bab ii tinjauan pustaka
advertisement
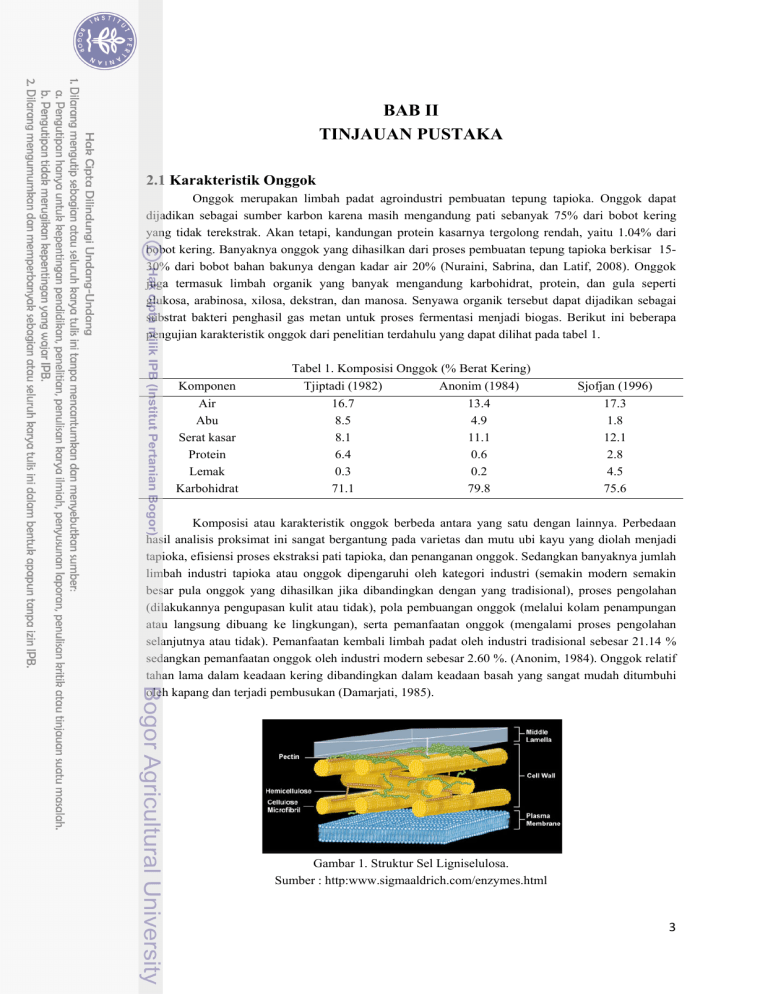
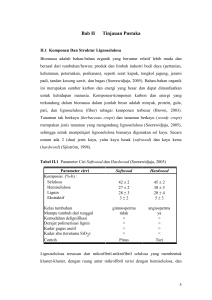
BAB II TINJAUAN PUSTAKA 2.1 Karakteristik Onggok Onggok merupakan limbah padat agroindustri pembuatan tepung tapioka. Onggok dapat dijadikan sebagai sumber karbon karena masih mengandung pati sebanyak 75% dari bobot kering yang tidak terekstrak. Akan tetapi, kandungan protein kasarnya tergolong rendah, yaitu 1.04% dari bobot kering. Banyaknya onggok yang dihasilkan dari proses pembuatan tepung tapioka berkisar 1530% dari bobot bahan bakunya dengan kadar air 20% (Nuraini, Sabrina, dan Latif, 2008). Onggok juga termasuk limbah organik yang banyak mengandung karbohidrat, protein, dan gula seperti glukosa, arabinosa, xilosa, dekstran, dan manosa. Senyawa organik tersebut dapat dijadikan sebagai substrat bakteri penghasil gas metan untuk proses fermentasi menjadi biogas. Berikut ini beberapa pengujian karakteristik onggok dari penelitian terdahulu yang dapat dilihat pada tabel 1. Komponen Air Abu Serat kasar Protein Lemak Karbohidrat Tabel 1. Komposisi Onggok (% Berat Kering) Tjiptadi (1982) Anonim (1984) 16.7 13.4 8.5 4.9 8.1 11.1 6.4 0.6 0.3 0.2 71.1 79.8 Sjofjan (1996) 17.3 1.8 12.1 2.8 4.5 75.6 Komposisi atau karakteristik onggok berbeda antara yang satu dengan lainnya. Perbedaan hasil analisis proksimat ini sangat bergantung pada varietas dan mutu ubi kayu yang diolah menjadi tapioka, efisiensi proses ekstraksi pati tapioka, dan penanganan onggok. Sedangkan banyaknya jumlah limbah industri tapioka atau onggok dipengaruhi oleh kategori industri (semakin modern semakin besar pula onggok yang dihasilkan jika dibandingkan dengan yang tradisional), proses pengolahan (dilakukannya pengupasan kulit atau tidak), pola pembuangan onggok (melalui kolam penampungan atau langsung dibuang ke lingkungan), serta pemanfaatan onggok (mengalami proses pengolahan selanjutnya atau tidak). Pemanfaatan kembali limbah padat oleh industri tradisional sebesar 21.14 % sedangkan pemanfaatan onggok oleh industri modern sebesar 2.60 %. (Anonim, 1984). Onggok relatif tahan lama dalam keadaan kering dibandingkan dalam keadaan basah yang sangat mudah ditumbuhi oleh kapang dan terjadi pembusukan (Damarjati, 1985). Gambar 1. Struktur Sel Ligniselulosa. Sumber : http:www.sigmaaldrich.com/enzymes.html 3 Sifat fisik onggok hasil samping tepung tapioka diantaranya adalah sukar larut dalam air dan sulit dicerna oleh pencernaan manusia. Hal itu dikarenakan onggok mengandung senyawa partikel yang disebut ligniselulosa. Ligniselulosa merupakan senyawa polimer sakarida kompleks semi kristal yang tersusun atas lignin, hemiselulosa, dan selulosa. Senyawa tersebut membentuk satu kesatuan yang kuat dan menjadi bahan dasar dinding sel suatu tumbuhan. Lignin merupakan senyawa yang menyelimuti dan mengeraskan dinding sel, sedangkan hemiselulosa bagian senyawa matriks yang berada diantara mikrofibril-mikrofibril selulosa, dan selulosa merupakan senyawa kerangka yang menyusun hingga 50% bagian kayu. Peran ketiga komponen ini saling bersinergi sebagai bahan penguat yang saling memperbaiki ikatan satu sama lainnya. Kandungan komponen senyawa ligniselulosa berbeda-beda bergantung pada sumber biomassanya seperti pada tabel 2 yang menunjukkan kandungan senyawa ligniselulosa pada limbah pertanian. Tabel 2. Kandungan Ligniselulosa Pada Beberapa Biomassa Limbah Pertanian (% Berat kering). Jenis Limbah Bagasse Tongkol Jagung Jerami Tandan Kosong Kelapa Sawit Onggok Sumber : Sun dan Cheng (2002) Lignin 25.0 15.0 15.0 32.5 25.0 Hemiselulosa 25.0 35.0 50.0 33.8 25.0 Selulosa 50.0 45.0 30.0 46.5 45.0 Lignin memiliki struktur molekul yang sangat berbeda dengan polisakarida karena tersusun atas senyawa aromatik dari unit monomer fenil propana yang diantaranya terdapat monolignol sinapil, koniferil alkohol, dan p-komaril alkohol dengan ikatan yang berbeda pula antar karbonnya. Gugus Arylgycerol-B-aryl ether sebagai ikatan utama, sedangkan gugus phenolic-hydroxyl, methoxyl, hydroxyl, dan benzyl alcohol sebagai ikatan tambahan yang mempengaruhi reaktifitas lignin dalam berinteraksi dengan mikrofibril selulosa sehingga lignin memiliki bobot molekul yang tinggi, struktur bercabang membentuk tiga dimensi, dan bersifat hidrofobik atau tidak larut dalam air (Ermawar, Yanto, Fitria, dan Hermiati, 2006). Konsentrasi lignin terbesar terdapat pada lamela tengah dan akan semakin mengecil pada lapisan dinding sekunder atau membran plasma. Gambar 2. Gugus Struktur dan Fungsional Polimer Lignin (Del Campo, 2006) 4 Polimerisasi lignin terjadi karena bergabungnya satu monomer dengan monomer lainnya yang sedang tumbuh atau disebut polimerisasi ekor. Radikal penoksi yang bermacam-macam menyebabkan lignin bercabang dan membentuk struktur tiga dimensi. Polimerisasi lignin diawali oleh dehidrogenasi enzimatik monolignol. Monolignol dioksidasi oleh peroksida lakase menjadi radikal penoksi yang sangat reaktif tetapi dapat distabilkan dengan penambahan air atau gugus hidroksil. Reaksi tersebut menghasilkan banyak tipe ikatan dengan ikatan yang paling dominan adalah gugus Arylgycerol-B-aryl ether (Gullichcen dan Paulapuro, 2004). Monolignol tersebut disintesis melalui jalur fenil-propanoid yang diinisiasi dari deaminasi fenilalanin oleh enzim fenilalanin ammonia-liase. (1) (2) (3) Gambar 3. Unit Fenil Propana Penyusun Lignin. (1) p-komaril alkohol, (2) koniferil alkohol, (3) sinapil alkohol (Gullichcen dan Paulapuro, 2004) Enzim-enzim yang berkaitan dengan biosintesis lignin diantaranya phenylalanine ammonia– lyase (PAL),CoA-o-methyltransferase (CoAoMT), 4-coumarate CoA ligase (4CL), cinnamoyl-CoA reductase (CCR), dan cinnamyl alcohol dehydrogenase (CAD) (Hambali, 2007). Enzim-enzim tersebut terlibat di dalam jalur biosintesis lignin yang dimulai dari konversi fenilalanin hingga pembentukan monolignol seperti pada gambar 4. Phenyilalanine Thyrosine Gambar 4. Jalur Biosintesis Monolignol Lignin (Fengel dan Wegener, 1995) 5 Hemiselulosa merupakan istilah yang umum bagi senyawa polisakarida yang larut dalam alkali. Empat gula utama, yaitu glukosa, mannosa, xilosa, dan arabinosa merupakan komponen utama penyusun senyawa hemiselulosa. Rantai utamanya terdiri atas satu jenis homopolimer, yaitu xilan. Xilan merupakan polimer dari xilosa yang diikat oleh ikatan β-1,4-glikosidik. Rantai xilan dapat bercabang dan berbentuk amorf sehingga mudah dimasuki pelarut. Dengan demikian, molekul hemiselulosa memiliki karakteristik senyawa yang lebih mudah menyerap air, tidak tahan panas, bersifat plastis, mempunyai permukaan kontak antar molekul yang lebih luas dari selulosa, dan ikatannya lemah sehingga mudah dihidrolisis (Oshima, 1965). (2) (1) Gambar 5. (1) Monomer Penyusun Hemiselulosa, (2) Struktur Hemiselulosa (Sjostrom, 1995) Reaksi yang terjadi untuk mendegradasi xilan, dibutuhkan kerja sama dari beberapa enzim hidrolitik. Dua enzim yang berperan penting untuk memecah xilan menjadi xilosa adalah endo-1,4-βxylanase dan xylan 1,4-β-xylosidase. Endo-1,4-β-xylanase bekerja dalam merusak ikatan non kovalen pada struktur polimer hemiselulosa sehingga diperoleh xilan individu kemudian xilan tersebut kembali dipecah menjadi monosakarida dengan bantuan enzim xylan 1,4-β-xylosidase sehingga menghasilkan xilosa dan arabinosa. Jika reaksi masih terjadi maka akan dihasilkan turunan dari xilosa, yaitu furfural seperti pada gambar 6. Furfural merupakan produk yang tidak diharapkan karena dapat menghambat proses degradasi senyawa lainnya. Hal itu dapat terjadi jika proses degradasi dilakukan melalui hidrolisis asam (Fengel dan Wegener, 1995). . Gambar 6. Struktur Hemiselulosa dan Turunannya (Fengel dan Wegener, 1995) 6 Selulosa merupakan polimer linear glukan dengan struktur rantai yang seragam karena setiap glukosanya diikat oleh β-1,4-glikosidik dengan gugus hidroksil. Keteraturan ini menyebabkan adanya ikatan hidrogen yang kuat antar molekulnya sehingga selulosa memiliki kekuatan tarik yang tinggi serta tidak larut dalam kebanyakan pelarut. Proses polimerisasi yang terjadi pada senyawa ini adalah selobiosa atau dua molekul glukosa menyatu dengan mengeliminasi satu molekul air diantara gugus hidroksil pada atom karbon 1 dan 4 yang memiliki sifat pereduksi. Beberapa molekul selobiosa tersebut bergabung menjadi mikrofibril berbentuk kristal kemudian mikrofibril bersatu menjadi fibril yang akhirnya menjadi serat selulosa. Gambar 7. Struktur Selulosa. Sumber : http:www.sigmaaldrich.com/enzymes.html Gugus hidroksil yang membentuk selulosa dapat berinteraksi dengan gugus -O, -S, dan -N membentuk ikatan hidrogen sehingga senyawa ini bersifat hidrofilik. Hal ini lah yang dapat menjelaskan bahwa walaupun strukturnya keras dan kuat, selulosa dapat dipecah menjadi senyawa sederhana melalui proses selulolitik. Selulolitik adalah proses pemecahan selulosa menjadi senyawa atau unit-unit glukosa yang lebih kecil. Karena molekul selulosa terikat kuat antar satu molekul dengan molekul lainnya, selulolitik relatif sulit bila dibandingkan dengan pemecahan polisakarida lainnya. Proses selulolitik terjadi pada sistem pencernaan sebagian hewan memamah biak ruminansia untuk mencerna makanan mereka yang mengandung selulosa. Proses selulolitik dapat terjadi dengan bantuan enzim selulase. Reaksi yang terjadi dalam pemecahan selulosa melibatkan tiga tahap, yaitu pemotongan ikatan non-kovalen struktur kristal selulosa menjadi selulosa individu, penghidrolisisan selulosa individu menjadi selobiosa, dan penghidrolisisan selobiosa menjadi glukosa (Astuti, 2003). 7 2.2 Perlakuan Pendahuluan (Pretreatment) Pretreatment bertujuan untuk menghilangkan lignin dan hemiselulosa, serta mengurangi kritalinitas selulosa. Pretreatment dapat dilakukan secara fisik, fisiko-kimia, kimia, biologis, maupun kombinasi diantaranya (Sun dan Cheng, 2002). 1. Perlakuan pendahuluan secara fisik dapat dilakukan dengan pencacahan mekanik, penggilingan, serta penepungan untuk mengurangi kritalinitas dan memperkecil ukuran. 2. Perlakuan pendahuluan secara fisiko-kimia, antara lain dengan melakukan steam explosion, ammonia fiber explosion, dan CO2 exlposion. Pada metode ini partikel biomassa dipaparkan pada suhu dan tekanan tinggi, kemudian tekanannya diturunkan secara cepat sehingga bahan mengalami dekompresi eksplosif. 3. Perlakuan pendahuluan secara kimia, diantaranya adalah ozonolisis, hidrolisis asam, hidrolisis alkali, delignifikasi oksidatif, dan proses organosolv 4. Perlakuan secara biologi. Pada metode ini digunakan mikroorganisme, seperti khamir pelapuk cokelat, khamir pelapuk putih, khamir pelunak untuk degradasi ligniselulosa, serta bakteri maupun kapang penghasil enzim yang dapat memutus ikatan ligniselulosa. Perlakuan pendahuluan biomassa ligniselulosa yang telah banyak digunakan adalah hidrolisis asam encer karena sudah dalam tahap komersialisasi. Akan tetapi, metode ini memiliki kekurangan diantaranya berpotensi menghasilkan produk samping seperti furfural atau hidroksi metal furfural (gipsum) yang dapat menghambat proses degradasi. Sedangkan metode lainnya baik secara fisik maupun biologis sudah banyak dilakukan dan beberapa masih dalam tahap pengembangan. Beragamnya bahan ligniselulosa membuat tidak ada satupun metode perlakuan pendahuluan yang berlaku secara umum karena berbeda bahan baku akan memerlukan perlakuan pendahuluan yang berbeda pula (Samsuri, 2007). Pada penelitian yang dilakukan oleh zam tahun 2010 mengenai pretreatment pada biomassa limbah pertanian ditambahkan campuran inokulum yang terdiri atas 8.5 x 105 sel (CFU/ml) Saccharomyces sp, 8.7 x 106 sel (CFU/ml) Lactobacillus sp, Actynomycetes (+), Pseudomonas sp (+), dan 7.5 x 105 sel (CFU/ml) Aspergillus sp pada kisaran konsentrasi 10-20 gram dalam 100 gram total padatan atau 10-20%. Hal tersebut dilakukan untuk mengetahui optimasi konsentrasi inokulum yang ditambahkan dalam mendegradasi limbah atau biomassa yang mengandung ligniselulosa dari suatu proses produksi (Zam, 2010). Tabel 3. Total Plate Count Optimasi Konsentrasi Inokulum Jumlah sel (CFU/ml) Konsentrasi Hari ke10% 15% 0 1 2 3 4 5 6 7 Laju pertumbuhan (sel/jam) Sumber : Zam, 2010 3.34 x 10 1.77 x 1010 2.03 x 1011 1.00 x 1011 2.07 x 1011 2.24 x 1011 2.24 x 1011 2.48 x 1011 4.80 x 10 5.43 x 1010 1.05 x 1011 9.25 x 1010 1.31 x 1011 1.79 x 1011 1.82 x 1011 1.79 x 1011 20% 6.46 x 107 1.16 x 1011 1.18 x 1011 9.01 x 1010 1.64 x 1011 1.04 x 1011 1.08 x 1011 9.95 x 1010 0,098 0,096 0,095 7 7 8 Konsentrasi inokulum yang mencukupi merupakan salah satu syarat agar proses degradasi dapat berlangsung dengan optimum. Kesesuaian antara rasio inokulum dan komposisi substrat juga dapat mempengaruhi proses degradasi limbah ligniselulosa (Mishra, 2001). Kurang baiknya pertumbuhan dan degradasi limbah pada konsentrasi inokulum 15% dan 20% diduga karena konsentrasi tersebut terlalu banyak sehingga medium kurang memadai untuk pertumbuhan bakteri tersebut. Hal ini mengakibatkan terjadinya kompetisi antar bakteri, sehingga pertumbuhan dan proses degradasi menjadi rendah. Persaingan dalam penggunaan substrat mengakibatkan pertumbuhan kultur menjadi kurang baik karena pertambahan jumlah sel atau biomassa menjadi rendah (Astuti, 2003). Optimasi lanjutan dari penelitian tersebut, seperti yang ditunjukkan pada tabel 4 penurunan COD pada konsentrasi inokulum 20% dan 30% tidak jauh berbeda dengan konsentrasi inokulum 10%. Menurut zam (2010), hal itu karena terjadinya kompetisi antar populasi pada perlakuan sehingga bakteri-bakteri beradaptasi menggunakan substrat selain karbon, seperti asam lemak dan senyawa lainnya yang terdapat dalam limbah tersebut. Penggunaan senyawa-senyawa lain mengakibatkan kenaikan COD yang cukup tinggi, sedangkan degradasi biomassanya menjadi rendah. Jika terdapat lebih dari satu pengguna substrat dalam satu kultur, maka kemungkinan mikroorganisme untuk termutasi akan lebih besar. Akibat dari mutasi ini, mikroorganisme akan memiliki kemampuan untuk memanfaatkan substrat lainnya untuk pertumbuhan (Black, 1999). Konsentarsi inokulum yang ditambahkan juga berpengaruh terhadap waktu yang dibutuhkan untuk proses pretreatment. Data pada tabel 3, laju pertumbuhan untuk konsentrasi inokulum 10% sebesar 0.098 dengan perhitungan kinetik laju pertumbuhan mikroorganisme maka diperoleh waktu generasi yang dibutuhkan adalah 10 jam. Dengan kata lain, pada waktu tersebut mikroorganisme akan tumbuh lebih banyak lagi dengan syarat substrat pada media masih mencukupi. Tabel 4. Penurunan COD Hasil Optimasi Inokulum Konsentrasi Inokulum COD awal (g/100ml) COD akhir (g/100ml) 10% 91.437 34.975 20% 91.437 35.960 30% 91.437 36.945 Sumber : Zam, 2010 2.3 Penguraian Senyawa Ligniselulosa Lignin merupakan bagian terkeras dari ligniselulosa karena sifatnya sebagai pelindung memiliki konsentrasi yang tinggi pada bagian lamela tengah, artinya senyawa ligniselulosa tidak akan terurai sebelum merusak ikatan ligninnya. Ikatan antar molekul lignin yang utama adalah ArylgycerolB-aryl ether, termasuk senyawa eter yang memiliki gugus fungsi mengandung oksigen pada posisi benziliknya. Gugus tersebut sensitif terhadap media asam sehingga lignin akan mengalami kondensasi dan mengendap. Akan tetapi sebagain lignin akan larut pada tahap penguraian selanjutnya (Munir, 2005). Bakteri yang dapat menghasilkan asam pada penelitian ini adalah Lactobacillus sp sebagai penghasil asam laktat. Asam laktat merupakan asam karboksilat yang dapat ditemukan hampir pada seluruh jenis organisme sebagai agen utama dalam degradasi ligniselulosa. 9 Pada saat tahap awal penguraian, enzim-enzim yang dikeluarkan oleh bakteri maupun khamir seperti selulase terlalu besar untuk melewati pori-pori dinding sel yang ukurannya lebih kecil. Kalsium yang merupakan unsur penyusun pada lamela tengah dalam bentuk kalsium pektat, diikat oleh asam sehingga merusak integritas dinding sel yang menyebabkan terbukanya pori untuk memberikan kesempatan pada enzim lignolitik bereaksi. Sedangkan enzim spesifik yang dapat mengurai senyawa lignin diantaranya adalah lignin peroksidase (LiP), mangan peroksidase (MnP), dan lakase (Munir, 2005). Lignin peroksidase pertama kali ditemukan pada khamir Phanerochaete chrysosporium. Umumnya merupakan khamir basidiomiset dan dikelompokkan menjadi khamir busuk cokelat dan busuk putih. Enzim yang dihasilkan dari organisme tersebut dimulai saat LiP mengkatalis senyawa aromatik fenolik, mengoksidasi senyawa amina, aromatik eter dan aromatik posiklik menjadi gula. Mangan peroksidase (MnP) mengoksidasi senyawa fenolik menjadi radikal fenoksi oleh oksidasi Mn(II) menjadi Mn(III) dengan H2O2 sebagai oksidannya. Lakase mengoksidasi senyawa non-fenolik menjadi radikal fenoksil, diamin, dan senyawa inorganik (Agustina, 2009). Proses pemecahan lignin menghasilkan senyawa fenolik bukan monosakarida karena rantainya tersusun atas fenil-propana atau senyawa aromatik seperti pada gambar 8. Gambar 8. Penguraian Lignin Oleh Enzim Lignin Peroksidase Penguraian senyawa selulosa dapat dilakukan dengan bantuan mikroorganisme yang dapat mensekresikan kompleks enzim selulase. Enzim tersebut digolongkan menjadi tiga kelompok, yaitu endoglukanase, selobiohidrolase, dan β-glukosidase. Endoglukanase memiliki afinitas yang tinggi dan bereaksi secara acak pada serat selulosa berkristalinitas rendah atau amorf sehingga substrat dapat larut karena menurunnya viskositas. Selobiohidrolase merupakan istilah untuk enzim yang menghasilkan selobiosa. Enzim ini beraksi sebagai eksoenzim dan melepaskan selobiosa dari selulosa kristal. Enzim ini mengurai selulosa dari polimer yang tidak tereduksi dan memiliki aksi yang terbatas terhadap selulosa karena fokus pada pemecahan selulosa berbentuk kristal. Sedangkan β-glukosidase bereakasi terhadap berbagai senyawa berikatan β-1,4-glikosidik menjadi glukosa yang merupakan sumber karbon untuk proses pemanfaatan selanjutnya (Fikrinda, 2000). Mikroba selulolitik memecah selulosa secara intraselular saat terjadi kontak antara sel dengan permukaan selulosa sebagai substrat untuk melakukan metabolismenya. Aktivitas enzim selulase akan lebih tinggi bila medium pertumbuhannya mengandung selulosa dibandingkan glukosa sebagai sumber karbon. Derajat polimerisasi selulosa berkisar 15.000- 27.000. Hal itu menandakan bahwa glukosa yang terkandung didalamnya juga berada pada kisaran yang sama, artinya setiap selulosa yang terurai akan menghasilkan hingga 27.000 glukosa. Mekanisme penguraian selulosa secara intraselular pada bakteri selulolitik dimulai dari daerah amorf oleh endoglukanase secara acak sehingga membentuk rantai yang terbuka bagi aktivitas selobiohidrolase. Aktivitasnya mampu 10 membebaskan unit selobiosa dari ujung rantai selulosa. Endoglukanase selanjutnya memotong lapisan kedua dan seterusnya dari serat selulosa yang diikuti aktivitas selobiohidrolase. Kemudian, selobiosa yang terbentuk diurai kembali oleh enzim β-glukosidase membentuk glukosa melalui pemutusan ikatan β-1,4 glukosida. Mikroorganisme yang dapat menghasilkan enzim tersebut diantaranya dari genus Acetobacter, Clostridium, Psedomonas, dan Vibrio (Fikrinda, 2000). Sama halnya dengan selulosa, senyawa hemiselulosa dapat dipecah menjadi monomer xilosa dengan bantuan enzim β-glukosidase karena hemiselulosa memiliki ikatan yang sama dengan selulosa, yaitu β-1,4-glikosidik di setiap molekulnya. Xilan merupakan polimer dari xilosa atau gula pentosa (C5) yang memiliki rantai 150-200 unit. Xilan lebih cepat diurai oleh mikroba dibandingkan selulosa karena ikatanya yang cenderung lemah. Ikatan tersebut dapat diputus dengan bantuan enzim xilanase hasil metabolisme khamir seperti Aspergilus sp dan bakteri dari golongan Actinomycetes seperti Streptomyces sp. Kedua mikroorganisme tersebut mampu menghasilkan enzim didalam tubuh dari substrat berupa hemiselulosa yang kontak pada permukaan selnya. Xilanase diklasifikasikan berdasarkan substrat yang dicerna, terdiri atas β-xyloxidase, eksoxilanase, dan endoxilanase. Enzim βxyloxidase, yaitu xilanase yang mampu mengurai xilo-oligosakarida rantai pendek menjadi xilosa. Endoxilanase mampu memutus ikatan β-1,4 pada bagian dalam rantai xilan secara teratur. Ikatan yang diputus, ditentukan berdasarkan panjang rantai subtrat, derajat percabangan, dan pola pemutusan dari enzim tersebut. Xilase umumnya protein kecil dengan berat molekul antara 15.000-30.000 dalton dan stabil pada pH netral. Untuk Streptomyces sp tumbuh dengan baik pada pH 4.5-8, suhu 36oC sedangkan khamir karena termasuk khemoorganoheterotrof maka dapat tumbuh pada kondisi anaerob dan memperoleh energi dengan mengoksidasi bahan organik. Aspergillus sp tumbuh pada suhu 2430oC dan pH 4.5-6 (Saha, 2003). 2.4 Produk Utama Hasil Pretreatment Produk atau hasil pretreatment onggok menggunakan mikroorganisme jenisnya beragam namun memiliki kesamaan, yaitu menghasilkan senyawa gula sederhana dalam bentuk monosakarida, kecuali hasil degradasi senyawa lignin yang merupakan senyawa aromatik bukan karbohidrat sedangkan untuk hemiselulosa menghasilkan gula baik dalam bentuk heksosa (C6) seperti glukosa, mannosa, dan galaktosa, juga pentosa (C5) seperti arabinosa dan xilosa, sementara selulosa menghasilkan glukosa. Semua senyawa gula tersebut adalah yang paling sederhana yang dapat dicerna oleh mikroorganisme sebagai substrat untuk melakukan metabolismenya lebih lanjut agar menghasilkan produk yang diinginkan seperti substrat pembuatan biogas dalam kondisi anaerob menghasilkan gas metan dari bakteri metanogenisis. 11 2.4.1 Glukosa Glukosa(C6H12O6, berat molekul 180.18) adalah heksosa atau monosakarida yang mengandung enam atom karbon. Glukosa merupakan aldehida yang mengandung gugus -CHO. Lima karbon dan satu oksigennya membentuk cincin yang disebut cincin piranosa, Bentuk paling stabil untuk aldosa berkarbon enam. Dalam cincin ini, tiap karbon terikat pada gugus samping hidroksil dan hydrogen, kecuali atom kelimanya yang terikat pada atom karbon keenam di luar cincin membentuk suatu gugus CH2OH (Siagian, 2011) Gambar 9. Bentuk Rantai D-glukosa Banyaknya glukosa yang diperoleh bergantung pada seberapa panjang rantai pada polisakaridanya. Semakin panjang maka glukosa yang diperoleh akan semakin banyak. Akan tetapi, dalam suatu pendegradasian senyawa tidak semuanya dapat diurai secara sempurna. Glukosa memiliki keunggulan atau sifat fisik dan kimianya, yaitu tidak mudah bereaksi secara nonspesifik dengan gugus amino suatu protein dengan cara mereduksinya. Reaksi ini dikenal dengan glikosilasi yang dapat merusak fungsi berbagai enzim. Hal ini disebabkan karena glukosa berada dalam bentuk isomer siklik yang kurang reaktif. Glukosa juga larut dalam air karena mampu berikatan dengan ikatan hidrogen pada gugus hidroksinya. 2.4.2 Manosa Manosa adalah gula aldehida yang dihasilkan dari oksidasi manitol dan memiliki sifatsifat umum yang serupa dengan glukosa. Senyawa dengan rumus kimia C6H14O6 memiliki lima rantai karbon dan gugus eter sehingga membuat senyawa ini mempunyai sifat rasa manis, tidak berbau, berbentuk serbuk, mudah larut dalam air dan basa, serta sukar larut dalam etanol dan eter (Almatsier, 2004). (1) (2) (3) Gambar 10. (1) D-Mannosa, (2) L-Mannosa, (3) Siklik Mannosa Mannosa merupakan gula alkohol isomer optik dari sorbitol dan ,merupakan gula yang paling mahal yang digunakan sebagai pengisi tablet, terutama pada tablet hisap serta memberikan rasa dingin ketika dihisap. Senyawa ini biasa digunakan untuk formulasi tablet multivitamin, tidak higroskopis, rendah kalori karena manisnya mannosa 0,5-0,7 dari manisnya sukrosa (Pasaribu, 2006). 12 2.4.3 Xilosa Xilosa merupakan suatu gula pentosa, yaitu monosakarida dengan lima atom karbon dan memiliki gugus aldehida. Xilosa sering disebut gula kayu karena merupakan senyawa gula yang pertama kali diisolasi dari kayu. Xilosa memiliki rumus molekul (HOCH2(CH(OH))3CHO. Karakteristik xilosa yang mengandung lima atom karbon dan adanya gugus spesifik, yaitu karbonil bebas, memberikan sifat xilosa dapat dimanfaatkan sebagai reducing sugar (Almatsier, 2004). (1) (2) (3) Gambar 11. (1) D-Xilosa (2) L-Xilosa (3) Siklik D-Xilosa Gula yang diperoleh dari hidrogenasi xilan dengan bantuan mikroorganisme ini memiliki banyak kegunaan. Kegunaan yang paling sering dimanfaatkan dan dikembangkan secara industri adalah sebagai bahan sintesis xilitol. Xilitol merupakan gula alkohol golongan pentitol yang memiliki lima atom karbon dan lima gugus karbonil. Xilitol mengandung 9.6 kalori dalam takaran 5 ml untuk meningkatkan kesehatan tulang (Mattila, 2002). 2.4.4 Arabinosa Arabinosa merupakan salah satu senyawa karbohidrat golongan monosakarida aldopentosa dengan lima atom karbon yang mengandung satu gugus aldehid dan empat gugus alkohol. Formulanya adalah C5H10O5 dengan berat molekul 150. D-arabinosa mempunyai konfigurasi yang sama dengan D-gliseraldehid, perbedaannya pada rotasi optik spesifik [α]. Campuran kesetimbangan dari anomer D-arabinosa (α dan β) memiliki rotasi spesifik -105,0o. Darabinosa merupakan gula pereduksi yang dapat mereduksikan Fehling maupun Tollens karena mempunyai gugus –OH laktol bebas. Struktur arabinosa dapat dilihat dengan proyeksi Fischer sebagai berikut Gambar 12. Struktur Fischer Senyawa Arabinosa Dalam proyeksi ini arabinosa terdapat dalam dua enansiomer yaitu D-arabinosa dan Larabinosa, tetapi isomer yang umum terdapat di alam adalah D-arabinosa. Suatu monosakarida berisomer D atau L bergantung pada posisi gugus hidroksil pada atom karbon asimetris terjauh dari gugus aldehid atau keton. Pada arabinosa atom C asimetris terjauh terdapat pada atom C nomor 4. Jika gugus –OH berada di sebelah kanan maka penamaannya memiliki bentuk isomer D, tetapi jika mengarah ke kiri dikatakan berisomer L (Almatsier, 2004). 13