BAB 1 - Universitas Sumatera Utara
advertisement

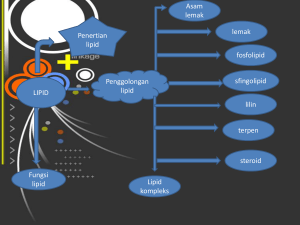
BAB 2 TINJAUAN PUSTAKA 2.1. Minyak dan Lemak Minyak dan lemak termasuk salah satu anggota dari golongan lipida yaitu merupakan lipida netral. Lipida itu sendiri dapat diklasifikasikan menjadi 4 kelas yaitu : lipid netral, fosfatida, spingolipid dan glikolipid. Semua jenis lipid ini banyak terdapat di alam. Minyak dan lemak yang telah dipisahkan dari jaringan asalnya mengandung sejumlah kecil komponen selain trigliserida yaitu : lipid kompleks ( lesitin, cephalin, fosfatida, lainnya serta glikolipid), sterol berada dalam keadaan bebas atau terikat dengan asam lemak, asam lemak bebas, lilin, pigmen yang larut dalam lemak dan hidrokarbon. Minyak merupakan trigliserida yang berwujud cairan pada suhu kamar dan umumnya diperoleh dari sumber nabati. Sedangkan lemak merupakan trigliserida yang pada suhu kamar berwujud padatan dan umumnya bersumber dari hewani . Minyak dan lemak adalah merupakan trigliserida yang merupakan bagian terbesar dari kelompok lipida. Pembentukan trigliserida dihasilkan dari proses esterifikasi satu molekul gliserol dengan tiga molekul asam lemak dapat sama atau bebeda (Gambar 2.1) membentuk satu molekul trigliserida dan tiga molekul air. O O OH H2C R1 OH + R2 HC OH C OH Gliserol R3 O C OH HC O O Asam Lemak OH C O H2C C R1 C O O H2C H2C C O R2 + R3 3 H2O Air Trigliserida Gambar 2.1. Reaksi Pembentukan Trigliserida dari Gliserol dan Asam Lemak. Jika R1 = R2 = R3 maka trigliserida yang terbentuk adalah trigliserida sederhana dan jika berbeda-beda disebut trigliserida campuran. Apabila satu molekul gliserol hanya mengikat satu molekul asam lemak, maka hasilnya disebut monogliserida dan bila dua molekul asam lemak disebut digliserida. Universitas Sumatera Utara Modifikasi dari lemak dapat dilakukan dengan mengubah komposisi dari pada asam lemak sebagai trigliserida untuk membentuk lemak baru misalnya lemak dengan titik lebur yang tinggi atau titik lebur rendah. Demikian juga transformasi dari lemak atau minyak adalah melakukan reaksi reaksi tertentu terhadap gliserida sehingga gugus ester, asam lemak baik jenuh maupun tidak jenuh mengalami perubahan menjadi turunan asam lemak ataupun gliserida (Meffert, 1984). Jenis asam lemak dari penyusun trigliserida dapat dikelompokkan berdasarkan : a. Panjang rantai yaitu : rantai pendek (kurang dari 8 karbon), rantai medium ( 8- 10 karbon) dan rantai panjang ( 12 karbon lebih). b. Tingkat kejenuhan, asam lemak jenuh (saturated fatty acid ) yang tidak mempunyai ikatan rangkap, asam lemak tak jenuh ( monoansaturated fatty acid ) yang mempunyai satu ikatan rangkap dan asam lemak tak jenuh ganda (polyunsaturated fatty acid, FUPA) yang mempunyai dua ikatan rangkap atau lebih. c. Isomer geometrik : asam lemak bentuk cis dan asam lemak bentuk tans dari asam lemak tak jenuh. Asam lemak alami umumnya ditemukan dalam bentuk cis. Isomer trans terbentuk selama reaksi kimia seperti hidrogenasi dan oksidasi terhadap asam lemak tidak jenuh Dalam hal ini secara umum suatu trigliserida dengan komposisi asam lemak rantai karbon pendek dan medium ( atom C≤ 12 ) atau komp osisi u taman ya asam lemak tidak jenuh akan berwujud cair pada suhu kamar, tetapi jika komposisi utamanya asam lemak jenuh dengan rantai atom karbon panjang ≥ 14 akan berwujud padat pada suhu kamar. Demikian juga asam lemak tidak jenuh dengan bentuk isomer geometri ikatan π-trans lebih padat dari bentuk ikatan π-cis (Silalahi, 2000). Minyak dan lemak dapat mengalami berbagai perubahan kimia seperti hidrolisis, oksidasi, hidrogenasi dan interesterifikasi. 2. 1.1. Hidrolisis Minyak dan Lemak Dalam reaksi hidrolisis minyak dan lemak akan dirubah menjadi asam lemak bebas dan gliserol (Gambar 2.2). Reaksi hidrolisis akan dapat mengakibatkan kerusakan minyak atau lemak dan dapat terjadi karena terdapatnya sejumlah air dalam minyak atau lemak tersebut (Ketaren, 2008). Reaksi ini akan mengakibatkan ketengikan hidrolisis yang menghasilkan flavor dan bau tengik pada minyak tersebut Universitas Sumatera Utara O O O C O C O O O R2 OH C O + 3 H2O R2 OH + OH C O Air R3 OH R3 C R1 OH R1 OH Asam Lemak Gliserol Minyak/Lemak C Gambar 2.2. Reaksi Hidrolisis Minyak dan Lemak. Proses hidrolisis seperti ini dapat terjadi secara alamiah terhadap minyak/lemak dan akan dapat dipercepat oleh mikroorganisme seperti lipase. Proses hidrolisis yang disengaja, biasanya dilakukan dengan penambahan basa, proses ini dikenal sebagai reaksi penyabunan ( Gambar 2.3). O O O C O C O C O O OH R1 ONa/K C O R2 + 3 NaOH R3 R1 Atau KOH Minyak/Lemak OH + R2 C ONa/K O OH Gliserol R3 C ONa/K Na/K-Asam Lemak (Sabun) Gambar 2.3. Reaksi Penyabuanan Lemak/ Minyak. Proses penyabunan ini banyak digunakan dalam industri.dimana minyak atau lemak pertama-tama dipanasi dalam ketel dan selanjutnya ditambah alkali (NaOH atau KOH) sehingga terjadi penyabunan. Sabun yang terbentuk dapat diambil dari lapisan teratas pada larutan yang merupakan campuran dari larutan alkali, sabun dan gliserol. Dari larutan ini dapat dihasilkan gliserol murni melalui penyulingan. 2.1.2. Oksidasi Minyak dan Lemak. Proses oksidasi dapat belangsung bila terjadi kontak antara sejumlah oksigen dengan minyak atau lemak. Terjadinya reaksi oksidasi ini akan mengakibatkan bau tengik pada minyak dan lemak. Oksidasi biasanya dimulai dengan pembentukan peroksida dan hidroperoksida. Tingkat selanjutnya ialah terurainya asam-asam lemak disertai dengan konversi hidroperoksida menjadi aldehida dan keton serta asam-asam lemak bebas. Ketengikan (rancidity) terbentuk oleh otooksidasi radikal asam lemak tidak jenuh atau aldehida bukan oleh peroksida. Jadi kenaikan bilangan peroksida ( Universitas Sumatera Utara Peroksida Value, PV) hanya indikator dan peringatan bahwa minyak sebentar lagi akan berbau tengik. R1 C H2 CH2 CH CH R2 energi o R1 UV C H Asam Lemak tidak jenuh O2 R1 CH CH O-Oo R1 CH CH O-Oo R1 CH CH CH2 CH CH2 CH CH R2 Radikal bebas R2 Peroksida aktif CH2 R2 + R1 C H2 CH CH2 CH R2 Peroksida aktif CH CH CH2 R2 + R1 o C H CH CH CH2 R2 Radikal bebas O-O-H Hidroperoksida Gambar 2.4. Reaksi Pembentukan Hidroperoksida Akibat Oksidasi Minyak/Lemak. Otooksidasi dimulai dengan pembentukan radikal-radikal bebas yang disebabkan oleh faktor yang dapat mempercepat reaksi seperti cahaya, panas, peroksida lemak atau hidroperoksida dan logam-logam berat. Mekanisme yang terjadi secara umum pada asam lemak tidak jenuh pembentukan hidroperoksida akibat oksidasi karena pemanasan (Gambar 2.4). Hidrperoksida dan radikal yang terbentuk merupan zat antara yang reaktif dan mengalami reaksi lanjut secara berantai menghasilkan berbagai jenis senyawa seperi polimer, aldehida, asam dengan rantai rendah, keton gliserida sehingga akhirnya menyebabkan kerusakan minyak seperti halnya bau tengik (Ketaren, 2008). 2.1.3. Hidrogenasi Minyak Hidrogenasi adalah suatu proses penambahan hidrogen dengan menggunakan katalis pada ikatan rangkap (Kent, 1992). Proses hidrogenasi sebagai suatu proses untuk menjenuhkan ikatan rangkap dari rantai karbon asam lemak tidak jenuh pada minyak atau lemak. Reaksi hidrogenasi ini dilakukan dengan menggunakan hidrogen murni dan ditambahkan serbuk nikel sebagai katalisator. Setelah proses hidrogenasi selesai minyak didinginkan dan katalisator dipisahkan dengan cara penyaringan. Hasil yang terjadi adalah minyak yang bersifat plastis atau keras yang tergantung kepada derajat kejenuhannya (Gambar. 2.5). Universitas Sumatera Utara O O O R C O C O C O 7 O 7 R 7 R O H2 Raney Ni (Hidrogenasi Partial) Trigliseriada (cair) R C O 7 O 7 R 7 Trigliserida ( padat) R O C O C Gambar 2.5. Reaksi Hidrogenasi Partial Minyak Trigliseriada yang dihasilkan biasanya digunakan sebagai bahan lemak margarin yang mana dalam proses ini mampu mengubah minyak menjadi setengah padat. Dengan cara tersebut dapat menghindari terjadinya proses oksidasi lemak yang mengakibatkan ketengikan (Hauman, 1997). Sebaliknya proses hidrogenasi dapat mengakibatkan terbentuknya asam lemak trans 60%. Kadar yang tinggi dari asam lemak bentuk trans dalam menu makanan dapat menimbulkan resiko penyakit jantung koroner. Pada umumnya asam lemak dari minyak nabati yang mengalami hidrogenasi adalah asam oleat (C18:1), linoleat(C18:2) maupun linolenat (C18:3). 2.2. Minyak Kelapa Sawit Tabel 2.1. Komposisi asam lemak minyak kelapa sawit dan minyak inti kelapa sawit Asam lemak Minyak kelapa sawit (%) Minya inti sawit (%) Asam kaprilat - 3–4 Asam kaproat - 3–7 Asam laurat - 46 – 52 Asam miristat 1,1 – 2.5 14 – 17 Asam palmitat 40 – 46 6,5 – 9 Asam stearat 3,6 – 4,7 1 – 2,5 Asam oleat 39 – 45 13 – 19 Asam linoleat 7 – 11 0,5 – 2 Sumber : (Eckey, 1955). Salah satu dari beberapa tanaman golongan palm yang dapat menghasilkan minyak adalah kelapa sawit. Kelapa sawit dengan nama kerajaan plantae, divisi magnoliophyta, kelas liliopsida, ordo arecales, famili arecaceae dan genus elaeis, Universitas Sumatera Utara mengandung kurang lebih 80 persen perikarp dan 20 persen buah yang dilapisi kulit yang tipis, kadar minyak dalam perikarp sekitar 34 – 40 persen. Minyak kelapa sawit adalah lemak semi padat yang mempunyai komposisi yang tetap. 2.2.1. Sifat fisio-kimia Minyak Kelapa Sawit Sifat fisio-kimia biasanya berada dalam suatu kisaran nilai, dan karena perbedaanya cukup kecil, nilai tersebut dinamakan konstanta. Konstanta fisik yang dianggap cukup penting adalah berat jenis, indeks bias, dan titik cair; sedangkan konstanta kimia yang penting adalah bilangan iod, bilangan penyabunan, bilangan asam, bilanagan reichert meisel, bilangan polenske, dan residu fraksi tak tersabunkan. Sifat lainnya dari asam lemak dicerminkan oleh sifat rantai hidrokarbon. Secara alamiah asam lemak jenuh yang mengandung atom karbon C1 – C8 berbentuk cair, sedangkan jika lebih besar dari C8 akan berwujud padat. Asam stearat (C18) o mempunyai titik cair 70 C, tetapi dengan adanya 1 ikatan rangkap maka titik cair turun mencapai 14 oC. Makin banyak jumlah ikatan rangkap pada suatu rantai karbon tertentu maka titik cairnya semakin rendah (Ketaren, 2008). Tabel 2.2. Sifat fisio-kimia minyak sawit dan minyak inti sawit Sifat minyak sawit minyak inti sawit Bobot jenis pada suhu kamar 0.900 0.900 – 0.913 Indeks bias D 40 oC 1.4565 – 1.4585 1.495 – 1.415 Bilangan iod 48 – 56 14 – 20 Bilangan penyabunan 196 – 205 244 – 254 Sumber : (krischenbauer, 1960). 2.2.2. RBDOlein dan RBDStearin Proses pengolahan minyak kelapa sawit atau CPO menjadi RBDOlein, RBDStearin dilakukan melalui dua tahapan proses yaitu tahap pemurnian (refinery) dan tahap fraksinasi kering (dry fractionation). Tahap Pemurnian (refinery) adalah proses penghilangan getah (gum), proses pemucatan (bleaching) dan proses penghilangan bau serta pengurangan kadar asam lemak bebas yang dikenal dengan proses deodorisasi. Sedangkan tahap fraksinasi kering adalah proses pemisahan antara Universitas Sumatera Utara fraksi cair (olein) dan fraksi padat (stearin) yang terbagi dalam dua bagian proses , yaitu kristalisasi dan filtrasi (penyaringan). Proses Penyulingan Minyak Kelapa Sawit CPO Degumming (penghilangan getah) Bleaching (pemucatan) Refining (pemurnian) Deodorizing (penghilangan bau) RBDPO Winterization (pendinginan) RBDPOleoin RBDPStearin Bleaching (pemucatan) Margarin, Shortening Industri sabun dan deterjen Gambar 2.6. Proses Penyulingan Minyak Kelapa Sawit Pemisahan fraksi olein dan fraksi stearin didasarkan atas perbedaan titik cairnya. Fraksi olein mempunyai titik cair yang lebih rendah dibandingkan dengan fraksi stearin karena rendahnyan kandungan asam lemak jenuh dan tingginya kandungan asam lemak tidak jenuhnya. Untuk menghasilkan super olein, minyak sawit mengalami dua kali penyaringan. RBDOlein hasil fraksinasi pertama dikristalisasi kembali sehingga menghasilkan fraksi cair berupa super olein dan fraksi padat berupa PMF (Palm Mid Fraction). Filtrasi merupakan proses pemisahan bahan Universitas Sumatera Utara secara mekanis berdasarkan pada perbedaan ukuran partikel yang dimiliki. Dalam proses dengan fraksinasi, filter yang digunakan adalah membran press filter (Alfian, 2005). 2.2.3. RBDPKO RBDPKO (Refined, Bleached and Deodorized Palm Kernel Oil) adalah minyak mentah dari inti kelapa sawit (CPKO) setelah dilakukan proses degumming (penghilangan getah), bleaching (pemucatan), dilanjutkan dengan deodorizing diperoleh minyak yang disebut RBDPKO (Refined, Bleached and Deodorized Palm Kernel Oil). Minyak inti sawit yang baik berkadar asam lemak bebas yang rendah dan berwarna kuning terang serta mudah dipucatkan. Bungkil inti sawit diinginkan berwarna relative terang dan nilai gizi serta kandungan asam aminonya tidak berubah. Tabel 2.3. Komposisi rata – rata inti sawit Komponen Jumlah Minyak 47 – 52 Air 6–8 Protein 7.5 – 9.0 Extractable non nitrogen 23 – 24 Selulosa 5 Abu 2 Sumber : (Bailey, 1950). 2.3. Asam Lemak Asam lemak − terdiri dari karbon, hidrogen, dan oksigen merupakan salah satu komponen penyusun lipid. Asam ini banyak terdapat dalam lemak sederhana dan lemak majemuk. Beberapa asam lemak yang penting adalah asam palmitat, stearat, linoleat dan oleat (Nursanyoto, 1993). Asam lemak terbagi dua yaitu asam lemak jenuh dan tak jenuh. Dalam bahan pangan, asam lemak jenuh yang paling banyak ditemukan adalah asam palmitat, yaitu 15% - 50% dari seluruh asam lemak yang ada, sedangkan asam stearat paling banyak pada lemak atau minyak dari biji-bijian. Asam lemak tak jenuh (unsaturated fatty acid ), didatangkan dari luar tubuh, umumnya tidak dapat disintesa sendiri oleh Universitas Sumatera Utara tubuh. Asam jenis ini biasa dikenal dengan asam lemak esensial, misalnya asam oleat, linoleat, dan arachidonat, yang banyak terdapat pada minyak sayur, minyak jagung, minyak kacang, kedelai, dan alpukat. Asam lemak esensial ini berfungsi untuk membantu proses pertumbuhan, selain itu dapat mempertahankan kesehatan kulit terutama mencegah terjadinya peradangan kulit (dermatitis) (Marsetyo, 1991). Tabel 2.4. Asam lemak yang penting terdapat dalam minyak dan lemak Jenis asam Rumus molekul Sumber(asal) Titik cair Asetat CH3COOH Minyak pohon spindle -16.66 n-Butirat CH3(CH2)2COOH lemak susu sapi, mentega -7.6 Isovalerat (CH3)2CHCH2COOH minyak ikan lumba-lumba -37.6 n-Kaproat CH3(CH2)4COOH -1.5 Asam lemak jenuh mentega,minyak kelapa, minyak kelapa sawit n-Kaprilat CH3(CH2)6COOH mentega,minyak kelapa 1.6 minyak kelapa sawit Kaprat CH3(CH2)8COOH susu sapi dan kambing, 31.5 Minyak kelapa, Minyak kelapa sawit Laurat CH3(CH2)10COOH 44 minyak laural, minyak Inti sawit,minyak kelapa Miristat CH3(CH2)12COOH minyak pala,susu ternak 58 Minyak ikan hiu Palmitat CH3(CH2)14COOH lemak hewani,minyak 64 nabati Stearat CH3(CH2)16COOH lemak hewani,minyak 69.4 nabati Arachidat CH3(CH2)18COOH minyak kacang 76.3 Behenat CH3(CH2)20COOH minyak behenat lemak 80.7 mentega Lignoserat CH3(CH2)22COOH minyak kacang,spingo 81 nyelin,minyak kacang tanah Universitas Sumatera Utara Tabel 2.4. (lanjutan) Jenis asam Rumus molekul Sumber(asal) Titik cair CH3(CH2)7 = CH – minyak dan lemak 14 Asam lemak tidak jenuh Oleat (CH2)7COOH Rapat gadoleat Erukat CH3(CH2)9 = CH – minyak kolza dan rape (CH2)7COOH minyak hering CH3(CH2)7 = CH – minyak raope seed, (CH2)11COOH mustard, minyak hati 31 - 32 Ikan hiu 2 ikatan rangkap atau lebih Linoleat CH3(CH2)4 = CH – minyak biji kapas CH2CH = CH – biji lin, biji poppy -11 (CH2)7COOH Linolenat CH3CH2CH = CH – minyak perilla CH2CH = CHCH2 – biji lin -11 CH = CH(CH2)7COOH Clupanodonat Arachidonat C22H34O2 C20H32O2 minyak ikan paus kurang Hati ikan hiu, herring dari -78 jaringan hati babi Sumber : (Krischenbeuer.1960). Asam oleat merupakan asam lemak tak jenuh yang paling banyak dijumpai pada makanan. Sepertiga lemak daging ayam adalah asam oleat. Margarin merupakan bahan makanan dengan kandungan asam oleat yang tinggi, sekitar 47% total kandungan lemaknya adalah asam oleat (Nursanyoto, 1993). Trigliserida adalah komponen lipid yang paling banyak terdapat di alam, dan karena sifatnya yang tidak menguap, trigliserida sukar sekali untuk dianalisis secara langsung dengan kromatografi gas. Meskipun demikian keterbatasan pemisahan ini diperbaiki dengan kemudahan pemisahan berbagai metal ester dari asam lemak dengan kromatografi gas. Karena itu, berbagai asam lemak trigliserida dapat dianalisis dengan kromatografi gas melalui pembentukan turunan seperti turunan metal Universitas Sumatera Utara ester. Berbagai asam lemak metil ester diperoleh dari reaksi esterifikasi. Pereaksi yang biasa digunakan untuk reaksi esterifikasi ini adalah boron trifluorida (BF3 ) dalam metanol (14%) (Fardiaz, 1989). 2.4. Oleokimia Oleokimia merupakan bahan kimia yang berasal dari minyak/lemak alami, baik tumbuhan maupun hewani. Bidang keahlian teknologi oleokimia merupakan salah satu bidang keahlian yang mempunyai prospek yang baik dan penting dalam teknik kimia. Pada saat ini dan pada waktu yang akan datang, produk oleokimia diperkirakan akan semakin banyak berperan menggantikan produk-produk turunan minyak bumi (petrokimia). Pada saat ini, permintaan akan produk oleokimia semakin meningkat. Hal ini dapat dimaklumi karena produk oleokimia mempunyai beberapa keunggulan dibandingkan produk petrokimia, seperti harga, sumber yang dapat diperbaharui dan produk yang ramah lingkungan (Spitz, 2004). Pada saat ini industri oleokimia masih berbasis kepada minyak/trigliserida sebagai bahan bakunya. Hal ini terjadi karena secara umum, para pengusaha masih ragu untuk terjun secara langsung ke industri oleokimia. Masih sangat jarang dijumpai sebuah industri yang mengolah bahan baku langsung menjadi bahan kimia tanpa melalui trigliserida. Padahal secara ekonomi dan teknik, banyak produk dari bahan alami yang bisa diolah langsung dari bahan nabati tanpa melalui trigliserida. Contohnya adalah pengolahan secara langsung buah kelapa sawit menjadi asam lemak. Selama ini asam lemak dari kelapa sawit selalu diolah dari minyak/trigliserida. Padahal dari segi teknik dan ekonomi akan lebih efisien untuk mengolah secara langsung buah sawit menjadi asam lemak melalui pengaktifan enzim lipase yang terkandung pada buah sawit. Hal ini juga bisa ditemukan pada bahan baku nabati lainnya (Spitz, 2004). Universitas Sumatera Utara Skema industri oleokimia dan turunannya dapat dilihat seperti pada gambar berikut. Gambar 2.7. Skema bahan baku oleokimia dan turunannya Universitas Sumatera Utara 2.5. Amida Suatu amida adalah senyawa yang mempunyai nitrogen trivalent yang terikat pada suatu gugus karbonil. Amida merupakan turunan asam karboksilat, dimana gugus –OH digan-ti dengan –NH2 atau amoniak, dimana 1 H diganti dengan asil. Sifat fisika : zat padat kecuali formamida yang berbentuk cair, tak berwarna, suku suku yang rendah larut dalam air, bereaksi kira – kira netral. Struktur Amida : R – CONH2 (Fessenden, 1999). Seperti asam karboksilat, amida memiliki titik cair dan titik didih yang tinggi karena adanya pembentukan ikatan hydrogen. Amida mampu membentuk ikatan hidrogen intermolekular selama masih terdapat hydrogen yang terikat pada nitrogen. Senya ini juga sangat istimewa karena nitrogennya mampu melepaskan electron dan mampu membentuk sebuah ikatan π dengan karbon karbonil. Pelepasan electron ini menstabilkan hibrida resonansi. (Bresnick, 1996). 2.5.1. Pembuatan Amida Reaksi asam karboksilat dengan amoniak atau amina O O R- C - OH + R" - NH2 Asam Karboksilat Amina O Amida O R- C - Cl + R" - NH2 Asil Klorida O R – C - NHR" + H2O Amina O R – C - NHR" + HCl Amida O O R - C – O – C – R + R" - NH2 R – C - NHR" + R – O – C - OH Anhidrida Asam Amida Amina O R- C - OR' Ester O + R" - NH2 Amina R – C - NHR" + R – OH Amida (Fessenden, 1999). Universitas Sumatera Utara Kemudian telah dilakukan pula pembuatan alkanolamida secara langsung dari minyak kacang kedelai : O R O O CH3 H–N O + OH O R R O CH3 CH3ONa 60 0C OH OH OH HO N R O ( Rawlins, 2008). 2.5.2. Penggunaan Amida Formamida berbentuk cair, sebagai pelarut, Untuk identifikasi asam yang berbentuk cair. Untuk sintesis nilon, dsb. Amida asam lemak seperti N-steroil asam amino dapat digunakan sebagai bahan surfaktan dan sebagai anti mikroba (Silvansany,et, al, 2001). Senyawa amida juga digunakan dalam bidang farmasi misalnya sulfonamide yang digunakan untuk mengobati bermacam – macam penyakit infeksi, antara lain disentri baksiler yang akut, radang usus dan untuk mengobati infeksi yang telah resisten terhadap antibiotik (Nuraini, 1988). Amida asam lemak yang berantai panjang bila direaksikan dengan epoksida membentuk senyawa bis ( 2-hidroksi etil) amina asam lemak yang banyak digunakan sebagai anti static. Bahan anti static ini berfungsi untuk mencegah pembentukan muatan statis pada permukaan resin yang disebabkan sifat plastic yang konduktif, sehingga dengan demikian amida dapat digunakan sebagai slip agent dalam pembuatan resin polietilena dan propilen (Richtler, 1984). 2.5.3. Amida Asam Lemak Amida asam lemak dibuat secara sintesis pada industri oleokimia`, dimana ammonia dan asam lemak bebas bereaksi pada suhu 200 oC dan tekanan 345 – 690 kpa selama 10 – 12 jam. Dengan proses tersebutlah dibuat seperti lauramida, stearamida serta lainnya. Amida juga dapat di buat dengan mereaksikan ammonia dengan metil ester asam lemak. Reaksi ini mengikuti konsep HSAB dimana H+ dari ammonia merupakan hard-acid yang mudah bereaksi dengan hard-base CH3O- untuk membentuk methanol. Sebaliknya NH2- lebih soft-base dibandingkan dengan CH3O- Universitas Sumatera Utara akan terikat dengan R – C+ O yang lebih soft-acid dibandingkan H+ membentuk amida. O R–C O + NH3 R–C OCH3 + CH3OH NH2 Amida sekunder merupakan turunan dari amoniak dimana 2 atom H diganti dengan 2 gugus asil ( Ismail, 1982). Pembuatan amida sekunder dilaksanakan dengan mereaksikan asam lemak dengan amina. O R–C O + R – CH2 - NH2 150-200 oC R–C OH + 2H2O NHR Senyawa amina yang digunaklan untuk reaksi tersebut antara lain ethanolamine dan diethanoamine, yang jika direaksikan dengan asam lemak pada suu tinggi, 150 – 200 oC, akan membentuk suatu amida dan melepaskan air. Reaksi amidasi antara alkyl klorida lebih mudah dengan gugus amina dibandingkan dengan terjadinya reaksi esterifikasi dengan gugus hidroksil, juga sebelumnya telah teruji denga adanya reaksi antara laurel anhidrida dengan propanolamine utuk membentuk senyawa N, N' – dilauril propanolamine ( Cho, 1985). 2.6. Dietanolamin Dietanolamin, sering disingkat sebagai DEA, adalah senyawa organik dengan rumus : HN(CH2CH2OH)2. Ini adalah cairan tak berwarna polyfunctional, menjadi amina sekunder dan diol.Seperti amina organik lainnya, dietanolamin bertindak sebagai basa lemah. Mencerminkan sifat hidrofilik kelompok alkohol, DEA dapat larut dalam air, dan bahkan higroskopik. Amida dibuat dari DEA sering juga hidrofilik Produksi dan menggunakan Reaksi etilen oksida dengan amonia berair pertama menghasilkan etanolamin: C2H4O + NH3 → H2NCH2CH2OH Universitas Sumatera Utara yang bereaksi dengan kedua dan ketiga setara dengan etilen oksida untuk memberikan DEA dan trietanolamin: C2H4O + H2NCH2CH2OH → HN (CH2CH2OH)2 C2H4O + HN(CH2CH2OH)2 → N(CH2CH2OH)3. DEA digunakan sebagai surfaktan dan inhibitor korosi. Hal ini digunakan untuk menghilangkan sulfid dan hidrogen karbon dioksida dari gas alam. DEA dalam larutan air biasanya digunakan untuk menghilangkan hidrogen sulfida dari berbagai proses gas. Ini memiliki keunggulan lebih dari etanolamin yang sama dalam konsentrasi yang lebih tinggi dapat digunakan untuk korosi yang sama potensial. Amida berasal dari DEA dan asam lemak, yang dikenal sebagai dietanolamida, adalah amphiphilic. Common Dietanolamida adalah bahan kosmetik dan shampoo yang ditambahkan untuk memberikan tekstur yang lembut dan berbusa. DEA derivatif yang relevan termasuk lauramida dietanolamin (Klein, 2001). 2.7. SURFAKTAN Surfaktan ( surface active agent ) merupakan bahan kimia yang berpengaruh pada aktifitas permukaan. Surfaktan memiliki kemampuan untuk larut dalam air dan minyak. Molekul surfaktan terdiri dari dua bagian yaitu gugus yang larut dalam minyak (hidrofob) dan gugus yang larut dalam air (hidrofil). Surfaktan yang memiliki kecenderungan untuk larut dalam minyak dikelompokkan dalam surfaktan oil soluble, sedangkan yang cenderung larut dalam air dikelompokkan sebagai surfaktan water soluble (Allen, 1993). Menurut Piispanen (2002), bagian polar surfaktan dipengaruhi oleh gaya elektrostatik (ikatan hidrogen, ikatan ionik, interaksi dipolar) sehingga dapat berikatan dengan molekul seperti air dan senyawa ion. Gugus non-polar surfaktan berikatan dengan struktur non-polar dengan dukungan gaya van der walls. Surfaktan dibagi menjadi empat kelompok penting dan digunakan secara meluas pada hampir semua sektor industri modern. Jenis-jenis surfaktan tersebut adalah surfaktan anionik, surfaktan kationik, surfaktan nonionik dan surfaktan amfoterik (Rieger, 1985). Surfaktan anionik adalah molekul yang bermuatan negatif pada bagian hidrofilik atau aktif permukaan (surface - active). Universitas Sumatera Utara Sifat hidrofilik disebabkan karena keberadaan gugus ionik yang sangat besar, seperti gugus sulfat atau sulfonat. Surfaktan kationik adalah senyawa yang bermuatan positif pada gugus hidrofiliknya atau bagian aktif permukaan (surface-active). Sifat hidrofilik umumnya disebabkan karena keberadaan garam amonium, seperti quaternery ammonium salt (QUAT). Surfaktan nonionik adalah surfaktan yang tidak bermuatan atau tidak terjadi ionisasi molekul. Sifat hidrofilik disebabkan karena keberadaan gugus oksigen eter atau hidroksil. Surfaktan amfoterik adalah surfaktan yang bermuatan positif dan negatif pada molekulnya, dimana muatannya bergantung kepada pH, pada pH rendah akan bermuatan negatif dan pada pH tinggi bermuatan positif (Matheson, 1996). Tabel 2.5. Harga HLB beberapa gugus fungsi Gugus Hidrofil Harga HLB -SO4Na+ 38,7 -COO-Na+ 19,1 -N (amina tersier) 9,4 Ester (cincin sorbitan) 6,8 Ester (bebas) 2,4 Hidroksil (bebas) 1,9 Hidroksil (cincin 0,5 sorbitan) Gugus Lipofil Harga HLB -CH3 0,475 -CH2- 0,475 =CH- 0,475 Untuk menentuklan kegunaan dari suatu surfaktan maka biasanya terlebih dahulu ditentukan harga HLB nya (Hidrofilik-Lipofilik- Balance). Harga HLB dapat ditentukan secara teoritis dan praktek. Harga HLB secara praktek dilakukan dengan Universitas Sumatera Utara menggunakan tensiometer cincin du Nuoy, dimana akan diperoleh harga tegangan permukaan yang setelah diplotkan dengan logaritma konsentrasi akan diperoleh harga konsentrasi kritik misel (CMC). HLB = 7 – 0.36 ln (Co/Cw) Dimana : Cw = CMC Co = 100 – Cw. Secara teori harga HLB suatu bahan dapat dihitung berdasarkan harga gugus fungsi hidrofil, lipofil dan derivatnya yang dapat dilihat pada tabel 2.4. (Belitz, 1986). Gambar 2.8. Skala keseimbangan Hydrophilic Lipophilic (HLB). Harga HLB dapat juga ditentukan berdasarkan harga bilangan penyabunan dan bilangan asam, yakni dengan menggunakan rumus berikut (Shinoda, 1986). HLB = 20 (1 – S/A) Dimana: S = bilangan penyabunan A = bilangan asam Hubungan antara nilai HLB dengan penggunaannya sebagai surfaktan dapat dilihat pada gambar 2.8. Surfaktan digunakan dalam volume besar pada berbagai produk kebutuhan rumah tangga, detergent dan produk – produk pembersih lainnya. Biasanya setelah digunakan, produk yang mengandung surfaktan tersebut di buang sebagai limbah yang mana pada akhirnya akan dibebaskan kepermukaan air, biodegradasi dan mekanisme penguraian lain sangat diperlukan untuk mengurangi jumlah dan konsentrasi surfaktan yang mencapai lingkungan (Brahmana, 1994). Universitas Sumatera Utara