eter
advertisement

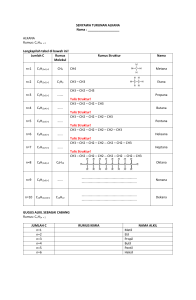
◦ Rumus umum R-OH ◦ Gugus fungsional: –OH (gugus hidroksil) Tata nama ◦ Diturunkan dari gugus alkil yang melekat pada –OH, kemudian ditambah kata alkohol. ◦ Dalam sistem IUPAC: akhiran –ol menunjukan adanya gugus hidroksil CH3OH (Metil alkohol = Metanol) CH3CH2OH (etil alkohol = etanol) CH3CH2CH2OH (1-propanol = n-propanol) Contoh Alkohol monovalen (bervalensi satu) Rumus Bangun CH I CH3 I I CH2 I CH3 I CH2OH CH2OH CH3 I I I I C CH3 1-propanol N-propanol 2-metil 1-propanol iso-butanol 2-metil 2-propanol tersier butil alhohol CH3 CH3 Nama OH Contoh Alkohol bivalen (bervalensi dua) Rumus Bangun CH2 OH OH I CH2 I Nama 1,2-etanadiol glikol I Contoh Alkohol trivalen (bervalensi tiga) Rumus Bangun I OH CH I OH I I CH2 CH2 I OH Nama 1,2,3-propanatriol gliserol Penggolongan alkohol (yang didasarkan pada derajat substitusi dari atom karbon yang langsung mengikat gugus hidroksil) o Alkohol primer (1º) Jika karbon yang mengikat gugus -OH juga mengikat satu atom karbon lain o Alkohol sekunder (2º) Jika karbon yang mengikat gugus -OH juga mengikat dua atom karbon lain o Alkohol tersier (3º) H mengikat gugus -OH juga mengikat Jika karbonO yang tiga atom karbon lain 5 Alkohol primer CH2OH H H C H C O H H H H Geraniol (aroma mawar) Etil alkohol CH2OH Benzil alkohol Alkohol sekunder CH3 H H H H H C C C H O H OH CH H3C CH3 Mentol (minyak peppermint) H Isopropil alkohol H Alkohol tersier H OH H C H H3C H H H H H C C C H H H O H O H Noretindron tert-Butil alkohol H C CH Alkohol bersifat : asam lemah Tetapan ionisasi : 10-15- 10-16 Dua molekul alkohol atau lebih dapat berasosiasi melalui ikatan hidrogen Ikatan O-H bersifat sangat polar, karena elektronegatifitas atom oksigen sangat tinggi Alkohol + logam 2 ROH + 2 Na 2 RO-Na + H2 Alkohol Na-alkosida RO-Na + HOH ROH + Na+OH- Dehidrasi : alkohol alkena H+ CH3CH2-OH CH2=CH2 180 C Alkohol berfungsi sebagai basa Kegunaan : sintesis alkena + H-OH R-OH + H-X Alkohol R-X + H-OH Alkil halida Kegunaan : untuk sintesa alkil halida Kecepatan reaksi dan mekanismenya tergantung struktur alkohol (30, 20 atau 10) Cara lain sintesa alkil halida dari alkohol ROH + Cl-S-Cl RCl + HCl + SO2 Atau 3ROH + PX3 3RX + H3PO3 Alkohol Primer O2 OH CH3-C-H aldehid O2 asam karboksilat O O2 CH3-C + H H H O O O2 CH3-C H CH3-C OH O2 Alkohol Sekunder O2 OH CH3-C-CH3 H keton O O2 CH3-C-CH + 3H O2 Oksidator : asam kromat H2CrO4 kromat anhidrida Dalam tubuh manusia: Oksidasi Alkohol aldehida + Keton Reduksi terjadi dalam proses sebaliknya Terjadi dalam proses metabolisme Oksidator : NAD (nikotinamida adenin dinukleotida) Dalam proses ini tereduksi menjadi NADH Reaksi terjadi didalam liver (hati) Etanol + NAD asetaal dehida + NADH + H+ Enzim alkohol dehidrogenase Glikolisis pemecahkan glukosa untuk menghasilkan energi glukosa piruvat NADH glukoneogenesis Laktat (dalam otot) NADH+ piruvat Diangkut keliver Masuk saluran dalam darah Rumus umum ( Ar – O – H ) Gugus fungsional: – OH Tata nama : Pada umumnya diberi nama menurut senyawa induknya Fenol p – klorofenol 2,4,6 - tribromofenol Contoh beberapa senyawa fenol O- kresol Titik Lebur 30,9o C Titik didih 191oC M- kresol t.l 11,5o C titik didih 202oC P-kresol t.l 35oC titik didih 202oC Ikatan hidrogen pada alkohol dan fenol Ikatan hidrogen Persamaan : ◦ Gugus fungsional sama: - OH ◦ Dapat membentuk ikatan hidrogen ◦ Keduanya bersifat asam lemah (fenol lebih asam) dan basa lemah Perbedaan: ◦ Ikatan C-OH pada alkohol relatif lebih mudah putus Fenol bersifat asam lemah (lebih kuat dari alkohol) Nama lain fenol : asam karbolat Fenol sangat mudah teroksidasi dalam udara terbuka cepat berubah warna larutan encer fenol bersifat antiseptik Antioksidan : dapat mencegah oksidasi Antioksidan fenolik BHA (butilated Hydroksy Anisole) BHT (Butilated Hydroxy Toulene) BHA : Digunakan dalam bahan makanan BHT : Digunakan dalam bahan makanan, Makanan ternak, Minyak tumbuhan, Minyak pelumas, Karet sintetik, Macam-macam plastik Vitamin E ( Totoferol), Vitamin C(asam askorbat), Gingerol Ketiganya merupakan antioksidan alami Penggunaan alkohol Etanol: pembuatan minuman keras (bir, wiski, dll) Metanol: pelarut pembuatan pernis pembersih karat pada logam Campuran metanol dan etanol: spiritus Gliserol: pelarut obat-obatan/ kosmetik Rumus umum R-O-R atau R-O-R’ Gugus fungsional: -OR= alkil atau aril Tatanama Gugus alkil atau aril menurut abjad diikuti dengan kata eter CH3-O-CH3 : dimetil eter (metoksi – metana) CH3-CH2-O-CH3 : metil etil eter (metoksi-etana) CH3CH2-O-CH2CH3 : dietil eter (etoksi-etana) = siklopentil metil eter = difenil eter CH3CHCH2CH2CH3 OCH3 = 2-metoksipentana = trans-2-metoksisikloheksana Senyawa tak berwarna, berbau khas Cair pada suhu kamar Tidak larut dalam air Mudah terbakar atau menguap Titik didih lebih rendah dengan jumlah atom C yang sama Tidak bereaksi dengan asam encer, basa encer, logam natrium, zat organik lain Sering dipakai sebagai pelarut untuk melakukan reaksi-reaksi organik Molekul-molekulnya tidak membentuk ikatan hidrogen satu sama lain Dapat membentuk ikatan hidrogen dengan senyawa-senyawa -OH Dibuat dengan memanfaatkan sifat eter sebagai pelarut Reaksi : R-X + Mg R- MgX Alkil aril halida pereaksi grignard eter Fenilmagnesium bromida PEMBUATAN RX + RONa ROR + NaX Contoh: CH3Cl m + C2H5ONa3 C2H5-O-CH3 + NaCl Epoksida eter siklik yaitu cincin beranggota tiga termasuk satu atom oksigen Etilena oksida Cis -2- butena oksida trans-2-2 butena oksida Pembuatan : CH2= CH2 + O2 Kegunaan etilena oksida o Fumigasi o Bahan baku pembuatan senyawa kimia lain reaksi –reaksi epoksida + H-OH Etilena oksida etilena glikol Tiol Dalam tabel berkala: S dibawah O S sering mengantikan O Gugus fungsional: -SH (sufihidril) Contoh : CH3SH: metanatiol (merkaptan) Tiofenol (fenil merkaptan) 2RSH + HgCl2 (RS)2Hg + 2 HCl Merkaptida Kegunaan etilena glikol: - Sebagai anti beku radiator mobil - Sebagai bahan baku poli ester ◦ ◦ Sulfida = tioeter Contoh: CH3-S-CH3 = dimetilsulfida CH3CH2-S-CH3= etilmetil sulfida CH3CHCH2CH3= 2-(metiltio)butana S CH3 * Dibuat dari : tiol dan alkilhalida dengan basa ◦ CH3SH + CH3Br CH3SCH3 + NaBr + H2O CH2= CHCH2-S-CH2CH=CH2 Dialilsulfida : terdapat pada bawang putih dan bawang merah ClCH2CH2-S-CH2CH2Cl di-2-kholroetilsulfida (gas mustard)