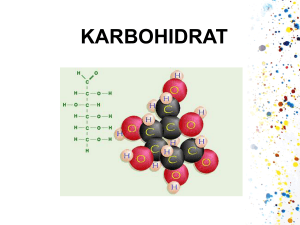
ANALISA HOPANOID PADA SINORHIZOBIUM
advertisement

ANALISA HOPANOID PADA SINORHIZOBIUM FREDII Ansori, Surya Rosa Putra ABSTRAK Analisis kandungan hopanoid dari beberapa bakteri merupakan langkah eksperimen untuk membuktikan dugaan bahwa hopanoid dapat dijadikan marker dalam kemotaksonomi. Keberadaan hopanoid dalam Sinosrizobium fredii yaitu suatu bakteri fiksasi nitrogen yang hidup dalam tanah perlu diteliti,untuk mencari hubungan kekerabatan antara bakteri penyubur tanah. Kandungan hopanoid kompleks dalam sel kering diekstrak dengan pelarut kloroform/methanol ( 2;1, v/v ). Oksidasi dan reduksi hopanoid menggunakan pelarut asam periodat dan natrium boro hidrida. Asetilasi hopanoid menggunakan pelarut piridin/ asetat anhidrat (1:1, v/v ). Langkah akhir hopanoid terasetilasi dideteksi menggunakan Kromatograf Gas- Spektroskopi Massa (KG-SM). Keberadaan fragmen-fragmen spesifik m/z = 73, 191, 295, dan 369 membuktikan bahwa Sinorhizobium fredii mengandung hopanoid bis- homohopan 31-ol-32- Ac. 285 Sintesis Selulosa Diasetat Dari Serat Daun Nanas (Ananas comusus) Siti Wafiroh, Setyo Dwi Santoso dan Bambang Kurniadi Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Airlangga Kampus C, Mulyorejo, Surabaya, 60115, Indonesia e-mail : [email protected] Abstract This purpose research is to synthesis of cellulose diacetate from pineapple leaf fiber (Ananas comosus). The first stage this research is to isolate cellulose use making of pulp method with enhancing NaOH 17,5 % (b/v) and anthraquinon 0,2% (b/v) later to reflux during 4 hour. Then the cellulose to synthesis become cellulose diacetate use acetylation method. In this method to use acetate anhydride, glacial acetate acid and sulphate acid as catalyze with acetylation time during 2 hour and the variation of hydrolysis time during 5, 10, 15, 20 and 25 hour at room temperature. The result of cellulose diacetate have chromatic is ashes white. Hydrolysis time influence to level of acetyl rate (KA) and mean molecule weight (Mv). With hydrolysis time during 15 hour obtained cellulose diacetate result from synthesis come near standard cellulose diacetate. This cellulose diacetate result from synthesis have characterization for example are 39,31% of acetyl rate (KA), 51.540,13 g/mole of mean molecule weight (Mv), 210,1 oC of glass transition temperature (Tg), 226,4 oC of melting point (Tm) and 77,0 mJ/mg of enthalpy (ΔH). Key word : cellulose diacetate, pineapple leave fiber, acetylation method, hydrolysis time Pendahuluan Teknologi membran berkembang sangat pesat karena efisiensi pemisahannya yang tinggi, tidak merusak struktur senyawa yang dipisahkan dan dapat dilakukan pada temperatur rendah, serta dapat memisahkan senyawa-senyawa yang peka terhadap suhu tinggi seperti pelarut organik dan biokimia. Selain itu teknologi membran termasuk clean technology karena ramah lingkungan dan tidak menimbulkan limbah (Mulder, 1996). Saat ini teknologi membran banyak diaplikasikan untuk proses sterilisasi obatobatan dan produksi minuman, industri logam, industri makanan dan biokimia, industri tekstil dan kulit, industri pulp, kesehatan dan pengolahan limbah, desalinasi air laut dan sebagainya (Wenten, IG., 2002). Sayangnya perkembangan teknologi membran di Indonesia tidak sepesat di negara lain karena kelangkaan bahan baku membran dan belum ada salah satu industripun yang memproduksi membran sehingga harganya mahal. Untuk itu perlu dilakukan upaya pemanfaatan kekayaan alam Indonesia sebagai bahan baku membran. Salah satu kekayaan alam Indonesia yang dapat dimanfaatkan sebagai bahan baku membran adalah serat daun nanas (Ananas comusus). Tujuan penelitian ini mensintesis selulosa diasetat dari serat daun nanas (Ananas comusus). Selulosa diasetat yang diperoleh dapat dimanfaatkan sebagai bahan baku membran 286 selulosa asetat. Penelitian dilakukan dalam tiga tahap yaitu : isolasi selulosa dari serat daun nanas, sintesis selulosa diasetat dan karakterisasi selulosa diasetat. Daun nanas dapat diperoleh dari pasar tradisional yang saat ini belum dimanfaatkan secara optimal. Daun nanas mengandung 81% selulosa. Kandungan selulosa yang cukup tinggi ini, dapat dibuat menjadi pulp , kemudian dilakukan reaksi asetilasi sehingga menghasilkan selulosa diasetat. Kondisi yang optimal selama sintesis selulosa diasetat terutama waktu hidrolisis akan sangat mempengaruhi kekuatan fisik dan kinerja membran selulosa asetat yang dihasilkan. Metode Penelitian Bahan yang digunakan Semua bahan yang digunakan mempunyai derajat kemurnian p.a kecuali yang disebutkan lain meliputi NaOH, etanol, aseton, Ca(OH)2 teknis, antrakuinon, akuades, KBr, asam asetat glasial, asetat anhidrida, H 2SO4 pekat, dry ice, HCl pekat, indikator fenolftalein, alumina, selulosa standar, selulosa diasetat standar, boraks dan asam oksalat. Alat yang digunakan Alat yang digunakan pada penelitian ini meliputi peralatan gelas, termometer, gelas beker, labu titrasi, buret, pengaduk, pengaduk magnetik, timbangan, erlenmeyer bertutup, pemanas, corong buchner, oven, alat cetak pulp, shaker, desikator, spektrofotometer IR Buck Scientific tipe 500, DSC 200 Seiko SSC tipe 5200H, Fresh Dryer Snijders dan kapillar viskometer. Prosedur Penelitian Preparasi serat daun nanas Daun nanas bagian pucuk buah yang diambil di Pasar Wonokromo dibersihkan kemudian direndam dengan air selama 1 minggu sampai kulit daun nanas tersebut lunak dan serat-seratnya terpisah. Serat daun nanas kemudian dicuci sampai bersih kemudian dikeringkan di udara terbuka. Isolasi selulosa dari serat daun nanas Serat daun nanas sebanyak 20 g ditambahkan Ca(OH) 2 2,5 % (b/v) dan direndam selama 3 hari. Setelah perendaman selesai, serat daun nanas dicuci dengan akuades. Serat daun nanas dimasukkan dalam labu alas bulat yang sebelumnya sudah diisi dengan 300 mL larutan NaOH 17,5 % (b/v), antrakuinon 0,2% (b/v) 20 mL dan di refluks selama 4 jam. Setelah dingin, serat dari limbah daun nanas dicuci sampai bebas NaOH dan diblender dan dicetak menjadi lembaran pulp dan dikeringkan dalam oven dengan suhu 60 0C. Sintesis selulosa diasetat dari serat daun nanas Ke dalam labu erlemeyer bertutup dicampurkan pulp serat daun nanas sebanyak 10 g dan asam asetat glasial 24 mL dan di-sheker pada suhu 400C selama 1 jam. Setelah 1 jam ditambahkan campuran asam asetat glasial 60 mL dan asam sulfat pekat 0,5 mL dan di-sheker lagi selama 45 menit pada suhu yang sama. Kemudian campuran didinginkan sampai mencapai suhu 180C dan ditambahkan asetat anhidrida sebanyak 27 mL yang sudah didinginkan sampai 17 0C. Selanjutnya campuran tadi ditambahkan asam sulfat pekat 0,5 mL dan asam asetat glasial 60 mL di-sheker selama 2 jam pada suhu 400 C. Setelah 2 jam diambil 30 mL dari campuran, kemudian diendapkan dengan menambahkan akuades tetes demi tetes dan diaduk. Endapan yang diperoleh berupa gel berwarna hijau muda. Gel tersebut kemudian di-fresh dryer. Campuran tersebut ditambahkan asam asetat 67% (v/v) sebanyak 30 mL tetes demi tetes selama 2 jam pada suhu 400C dan di-sheker. Selanjutnya diambil 35 mL dari 287 campuran pada tiap variasi waktu hidrolisis 5 jam, 10 jam, 15 jam, 20 jam dan 25 jam pada suhu kamar. Selanjutnya campuran diendapkan dengan menambahkan akuades tetes demi tetes dan diaduk sehingga diperoleh endapan yang berbentuk serbuk. Endapan disaring dan dicuci sampai netral. Endapan dikeringkan dalam oven pada suhu 60 – 700C dan disimpan dalam desikator. Karakterisasi selulosa diasetat dari serat daun nanas Analisa gugus fungsi selulosa diasetat hasil sintesis dari serat daun nanas dilakukan karakterisasi dengan menggunakan spektrofotometer IR dengan sampel pelet KBR dan kadar asetil ditentukan dengan titrasi asam-basa. Penentuan massa molekul relatif rata-rata viskositas (Mv) ditentukan dari pengukuran viskositas berbagai larutan selulosa diasetat dalam aseton dan persamaan Mark-Houwink [] KxM va dengan nilai K = 1,33x10-3 dan a = 0,616. Uji termalnya ditentukan dengan alat DSC (Differential Scanning Calorimetry). Hasil Penelitian Dan Pembahasan Hasil isolasi selulosa dari serat daun nanas Selulosa hasil isolasi dari serat daun nanas relatif berbeda dengan selulosa standar. Selulosa standar berwarna lebih putih daripada selulosa hasil isolasi. Hal ini disebabkan oleh adanya proses pemurnian lebih lanjut dari selulosa standar misalnya dilakukan proses pemutihan (bleaching). Pada selulosa hasil isolasi tidak dilakukan proses pemutihan karena hasilnya tidak jauh beda dengan sebelum dilakukan proses pemutihan. Rendemen selulosa hasil isolasi dari serat daun nanas ditunjukkan pada tabel 1. No. 1. 2. 3. Tabel 1. Data rendemen selulosa hasil isolasi dari serat daun nanas Serat daun nanas Selulosa hasil isolasi Rendemen Rendemen (g) (g) (%) rata-rata (%) 20,000 14,588 72,94 20,000 14,755 73,78 73,38 20,000 14,683 73,42 Analisis gugus fungsi selulosa hasil isolasi dari serat daun nanas dilakukan dengan menggunakan spektrofotometer infra merah (IR). Sebagai pembanding juga dilakukan analisis gugus fungsi selulosa standar. Spektrum IR selulosa standar dan selulosa hasil isolasi dari serat daun nanas dapat ditunjukkan pada gambar 1 dan 2. 288 Gambar 1. Spektrum IR selulosa standar Gambar 2. Spektrum IR selulosa hasil isolasi Dari perbandingan antara spektrum IR selulosa hasil isolasi dari serat daun nanas dan selulosa standar memiliki kesamaan gugus fungsinya. Pada selulosa hasil isolasi terdapat puncak gugus O-H yang melebar dan tajam pada bilangan gelombang 3351,5 cm-1, sedangkan pada selulosa standar pada bilangan gelombang 3342 cm-1. Pada selulosa hasil isolasi, terdapat puncak tajam pada bilangan gelombang 1058,7 cm1 , sedangkan pada selulosa standar pada bilangan gelombang 1058,9 cm -1 yang menunjukkan adanya gugus C-O. Gugus C-O ini menunjukkan adanya ikatan glikosida dan ikatan C-O pada cincin piranosa. Hasil Sintesis Selulosa Diasetat Dari Serat Daun Nanas Secara fisik, selulosa diasetat hasil sintesis dari serat daun nanas dengan selulosa diasetat standar terdapat perbedaan. Selulosa diasetat standar berwarna lebih putih dibandingkan dengan selulosa diasetat hasil sintesis dari serat daun nanas dengan variasi waktu hidrolisis dapat ditunjukkan pada Gambar 3. Hal ini disebabkan oleh kemurnian selulosa hasil isolasi yang masih kurang karena tidak dilakukan proses pemutihan. 289 Selulosa diasetat standar Selulosa diasetat hasil hidrolisis 5 jam Selulosa diasetat hasil hidrolisis 15 jam Selulosa diasetat hasil hidrolisis 10 jam Selulosa diasetat hasil hidrolisis 25 jam Selulosa diasetat hasil hidrolisis 20 jam Gambar 3. Selulosa diasetat standar hasil sintesis dari serat daun nanas dengan variasi waktu hidrolisis Hasil karakterisasi selulosa diasetat dari serat daun nanas Hasil Analisa IR Hasil analisis gugus fungsi spektrum IR dari selulosa diasetat standar dan selulosa diasetat hasil sintesis dengan variasi waktu hidrolisis ditunjukkan pada tabel 2. Tabel 2. Hasil perbandingan spektrum IR dari selulosa diasetat (SD) standar dan selulosa diasetat hasil sintesis tiap variasi waktu hidrolisis (WH) SD standar (cm-1) 3491,4 2956,3 1743,2 1381,3 Selulosa diasetat hasil sintesis ν(cm-1) WH 5 WH 10 WH15 WH 20 WH 25 3473,8 3493,3 3497,5 3493,9 3493,2 2948 2955,4 2958,4 2952.4 2931,6 1754,5 1752,9 1755,9 1757,2 1750,2 1379,8 1375,7 1374,8 1374,8 1374,6 290 Gugus fungsi O-H ulur C-H ulur C=O C-H tekuk 1242 1042,8 1241,8 1043,7 1240,1 1048,4 1243,7 1055,6 1243 1055,6 1237,6 1047,9 C-O asetil C-O ulur Dari perbandingan antara spektrum IR selulosa diasetat standar dan selulosa diasetat hasil sintesis dari serat daun nanas dengan variasi waktu hidrolisis memiliki kesamaan dalam gugus fungsinya. Pada selulosa diasetat hasil sintesis pada variasi waktu hidrolisis (WH) terdapat puncak gugus O-H yang melebar dan tajam pada bilangan gelombang sekitar 3497,5 cm-1 – 3473,8 cm -1. Sedangkan pada selulosa standar pada bilangan gelombang 3491,4 cm-1. Pada selulosa diasetat hasil sintesis terdapat puncak tajam pada bilangan gelombang sekitar 1757,2 cm-1 – 1750,2 cm-1 yang menunjukkan adanya karbonil (C=O), sedangkan pada selulosa standar pada bilangan gelombang 1743,2 cm-1. Pada selulosa diasetat hasil sintesis terdapat puncak pada bilangan gelombang sekitar 1243,7 cm -1 – 1237,6 cm-1 yang menunjukkan adanya ikatan C-O ester, sedangkan pada selulosa standar pada bilangan gelombang 1242 cm-1. Pada selulosa diasetat hasil sintesis, terdapat puncak tajam pada bilangan gelombang sekitar 1055,76 cm-1 – 1043,7 cm-1 yang menunjukkan adanya C-O ikatan glikosida dan C-O ikatan cincin piranosa, sedangkan pada selulosa standar pada bilangan gelombang 1042,8 cm-1. Hasil Penentuan Kadar Asetil Selulosa Diasetat kad ar asetil (%) Selulosa diasetat hasil sintesis dari serat daun nanas yang diperoleh ditentukan kadar asetilnya (KA) dengan titrasi asam basa. Penentuan kadar asetil bertujuan untuk menentukan banyaknya gugus asetil yang terdapat dalam selulosa asetat. Kadar asetil untuk selulosa monoasetat kurang dari 36,5%, selulosa diasetat 36,5%-42,2% dan selulosa triasetat 43,0%-44,8% (Fengel, D., 1995). Prinsip penentuan kadar asetil ini melalui reaksi penyabunan (saponifikasi) dengan metode titrasi asam-basa. Pada penelitian ini diperoleh kadar asetil selulosa diasetat hasil sintesis dari serat daun nanas dengan variasi waktu hidrolisis yang ditunjukkan pada gambar 4. 44 43 42 41 40 39 38 37 0 5 10 15 20 25 30 w aktu hidr olisis (jam ) Gambar 4. Kurva hubungan antara waktu hidrolisis dengan kadar asetil selulosa diasetat hasil sintesis Dari grafik tersebut terlihat bahwa waktu hidrolisis mempengaruhi nilai kadar asetil dari selulosa diasetat. Semakin lama waktu hidrolisis yang digunakan semakin banyak gugus asetil yang tersubtitusi gugus hidroksi (OH) maka kadar asetil selulosa diasetat hasil sintesis semakin menurun. Pada penelitian ini juga diperoleh kadar asetil selulosa diasetat standar sebesar 39,32 %. Dari perbandingan kadar asetil antara selulosa 291 Mv SD hasil sintesis (g/mol) diasetat dari variasi waktu hidrolisis dengan selulosa diasetat standar, besarnya kadar asetil dari selulosa diasetat hasil sintesis dengan waktu hidrolisis 15 jam mendekati selulosa diasetat standar. Hasil Penentuan Berat Molekul Rata-Rata (Mv) Selulosa Diasetat Selulosa diasetat hasil sintesis dari serat daun nanas yang diperoleh ditentukan berat molekul rata-rata dengan metode viskometri. Alat yang digunakan adalah kapillar viskometer dan yang diukur adalah waktu alir dari selulosa diasetat pada berbagai konsentrasi. Pada penelitian ini diperoleh berat molekul rata-rata selulosa diasetat pada variasi waktu hidrolisis (WH) yang dapat ditunjukkan pada gambar 5. 90000 80000 70000 60000 50000 40000 30000 0 5 10 15 20 25 30 waktu hidrolisis (jam) Gambar 5. Kurva hubungan antara waktu hidrolisis dengan berat molekul rata-rata (Mv) selulosa diasetat hasil sintesis Dari grafik tersebut terlihat bahwa waktu hidrolisis mempengaruhi nilai berat molekul rata-rata dari selulosa diasetat. Hal ini disebabkan dengan adanya hidrolisis maka gugus asetil yang pada awalnya terikat pada selulosa setelah reaksi asetilasi (selulosa triasetat) akan tersubtitusi oleh gugus -OH yang akan menurunkan berat molekul. Semakin lama waktu hidrolisis yang digunakan maka berat molekul rata-rata selulosa diasetat hasil sintesis semakin menurun. Pada penelitian ini juga diperoleh berat molekul rata-rata selulosa diasetat standar sebesar 52.725,97 g/mol. Dari perbandingan besarnya berat molekul rata-rata antara selulosa diasetat hasil sintesis dari variasi waktu hidrolisis dengan selulosa diasetat standar, besarnya berat molekul rata-rata dari selulosa diasetat hasil sintesis dengan waktu hidrolisis 15 jam mendekati selulosa diasetat standar. Hasil Uji Termal Pada penelitian ini digunakan Differential Scanning Calorimetry (DSC) untuk uji sifat termal polimer. DSC merupakan teknik analisa dengan mengukur perbedaan kalor yang masuk ke dalam sampel dan pembanding (referensi) sebagai fungsi temperatur. Dari termogram DSC yang diperoleh dapat digunakan untuk menentukan suhu transisi gelas (Tg), suhu titik leleh (Tm) dan perubahan entalpi (ΔH) selulosa diasetat hasil sintesis dari serat daun nanas. 292 Gambar 6. Termogram DSC selulosa diasetat hasil sintesis dari serat daun nanas Pada termogram diatas terdapat puncak pada suhu 79,0 oC dengan entalpi sebesar 124,6 mJ/mg yang menunjukkan adanya pengotor yaitu air yang dikarenakan sampel yang kurang kering. Pada termogram terdapat puncak pada suhu 220,8 oC yang menunjukkan adanya sebagian sampel yang belum meleleh. Dari termogram diperoleh suhu transisi gelas pada suhu 210,1 oC, titik leleh pada suhu 226,4 oC dan perubahan entalpi sebesar 77,0 mJ/mg. Kesimpulan Dari hasil penelitian ini dapat disimpulkan bahwa selulosa diasetat dapat disintesis dari serat daun nanas (Ananas comosus) dengan metode asetilasi. Waktu hidrolisis mempengaruhi terhadap selulosa diasetat hasil sintesis serat daun nanas (Ananas comosus) terutama besarnya kadar asetil (KA) dan berat molekul rata-rata (Mv). Pada penelitian ini dengan waktu hidrolisis 15 jam diperoleh hasil sintesis selulosa diasetat mendekati selulosa diasetat standar yang miliki karakterisasi antara lain KA sebesar 39,31%, Mv sebesar 51.540,13 g/mol, Tg pada suhu 210,1 oC, Tm pada suhu 226,4 oC dan ΔH sebesar 77,0 mJ/mg. Daftar Pustaka Basta, A.H., El-Saied H. and Elberry M., 2003, Cellulose Membranes for Reverse Osmosis, Part II, Improving RO membranes prepared from non-woody cellulose, Desalination, 159, 183-196 Carl, J.M., 1997, Preparation of Cellulose Acetate, Industrial and Engineering Chemistry, 75-79 Kulbe, K.C., Matsuura, T, Lamarche, A.M., Choi, C., Noh, S.H., 2001, Study of the structure of asymmetric cellulose acetate membranes for reverse ormosis using electron spin resonance (ESR) method, , Elvisier Science, Polymer 42, 6479-6484 293 Loske S., do Carmo Goncalves and Wolf B.S. (2003), Fractionation of cellulose acetate for the investigation of molecular weight influences on the morphology of membranes, J. Memb. Sci., 214, 223-228 Mulder, Marcel, 1996, Basic Principles of Membrane Technology, Kluwer Academic Publishers, Dordrecht Wenten,IG., 2002, Recent development in membrane science and its industrial applications, Review Article, Bandung . 294 PEMISAHAN DAN UJI ANTIMALARIA SENYAWA-SENYAWA TURUNAN FENOLAT DARI KAYU BATANG GARCINIA PICRORHIZA Miq Sudaryono, Taslim Ersam Pascasarjana Kimia ITS ABSTRAK Tumbuhan G. picrorhiza Miq (Clusiaceae) terdapat di daerah Asia tenggara endemik untuk daerah Ambon (Maluku). Famili Clusiaceae adalah sumber senyawa fenolat seperti turunan santon, benzofenon, flavonoid, depsidon dan antron. Beberapa senyawa tersebut memiliki efek farmakologis dan fisiologis, dapat dimanfaatkan dalam bidang kesehatan dan pertanian. Kajian ini ditujukan untuk mendapatkan senyawasenyawa aktif antimalaria dari tumbuhan yang terdapat di daerah endemik wabah malaria. Satu senyawa turunan biflavanon yaitu 5,7,3',3'',5'',7'',3''',4'''-oktahidroksi-4'metoksi-3,8''-biflavanon (1) telah dapat ditemukan menggunakan cara maserasi, fraksinasi dan pemurnian dilanjutkan dengan penentuan struktur dengan cara spektroskopi. Data fisik senyawa hasil isolasi adalah berupa padatan kuning dengan titik leleh 229-2300 C. Uji invitro antimalaria terhadap senyawa hasil isolasi menunjukkan bahwa senyawa tersebut kurang aktif sebagai antimalaria dengan nilai IC50 3,36 μg/ml jika dibandingkan dengan kloroquin. OH 3' 8 HO 4' OMe O 9 6' 3 6 OH OH 2''' OH O 8'' HO O 10 '' 4'' 6'' OH 6''' OH O (1) Kata Kunci : Clusiaceae, G. picrorhiza Miq, Fenolat, Spektroskopi, Antimalaria. 295 I. PENDAHULUAN 1.1 Latar Belakang Hutan tropika Indonesia dapat dipandang sebagai gudang, sumber, dan produsen senyawa-senyawa kimia khususnya yang dihasilkan oleh tumbuhtumbuhannya. Hutan tropika Indonesia memiliki beranekaragam spesies tumbuhan dan termasuk salah satu dari tujuh negara megabiodiversity bersama Australia, Brazilia, Kolombia, Madagaskar, Meksiko, dan Zaire. Tidak kurang dari 54 % spesies tumbuhan di dunia terdapat di hutan tropika, atau setara dengan 250.000 spesies tumbuhan tingkat tinggi, 30.000 spesies diantaranya terdapat di hutan tropika Indonesia. Keanekaragaman hayati Indonesia merupakan aset nasional yang sangat besar nilainya bagi kepentingan dan kesejahteraan manusia, sampai saat ini masih sangat sedikit yang sudah diketahui manfaatnya (Ersam, 2001). Salah satu tumbuhan tingkat tinggi Indonesia yang mempunyai potensi sebagai sumber bahan kimia hayati bioaktif adalah famili Clusiaceae. Di masyarakat dikenal sebagai tumbuhan keluarga manggis yang merupakan tanaman pangan dan sudah banyak dibudidayakan sebagai komoditas untuk buah-buahan. Selain itu, banyak pula dimanfaatkan sebagai obat tradisional, seperti kulit akarnya untuk obat infeksi kulit dan luka, kulit batangnya sebagai obat sakit perut, kulit buahnya sebagai obat diare, seduhan akar dan daunnya sebagai obat rematik, biji buahnya sebagai obat penyakit kulit dan bunganya untuk bahan jamu bersalin (Peres dan Nagem, 1997; Ersam, 2002 ). Salah satu spesies dari genus Garcinia yang belum pernah dilaporkan adalah Garcinia picrorhiza Miq yang berasal dari Ambon Maluku, dan di masyarakat dikenal dengan nama sesoot. Di Maluku tanaman ini tumbuh di pegunungan Hitu (pulau Ambon) dan pulau Laitimor (Rumphius, Heyne, 1987). Tumbuhan ini oleh masyarakat setempat dimanfaatkan sebagai obat saguer, yaitu sejenis minuman penambah stamina. Sebagai spesies tumbuhan langka dan endemik untuk wilayah Indonesia Timur khususnya Maluku dan Papua, G. Picrorhiza Miq diharapkan memiliki potensi menghasilkan senyawa-senyawa kimia bioaktif yang dapat menyelesaikan masalahmasalah penyakit khususnya penyakit malaria yang berada di wilayah itu. Oleh karena itu uji antimalaria terhadap senyawa hasil isolasi tumbuhan G.picrorhiza Miq dilakukan dengan memperhatikan hal tersebut. Berdasarkan kajian literatur, dapat diketahui bahwa afinitas kimia dari kayu batang tumbuhan G.picrorhiza Miq belum pernah dilaporkan, maka pada penelitian ini digunakan sebagai sampel yang akan diteliti kandungan kimia dan bioaktivitasnya sebagai antimalaria. 1.2 Perumusan Masalah Dari dua pendekatan yang dilaporkan di atas, tumbuh-tumbuhan yang mengandung senyawa fenolat yang terdapat di wilayah Indonesia Timur diharapkan dapat digunakan sebagai obat antimalaria. G.picrorhiza Miq merupakan tumbuhan asal Ambon Maluku yang dikenal sebagai sumber senyawa fenolat yang dijadikan obyek 296 pada penelitian ini diharapkan dapat menghasilkan senyawa fenolat yang bersifat sebagai antimalaria. 1.3 Tujuan dan Manfaat Penelitian 1. Dapat mengungkap senyawa-senyawa fenolat atau turunannya dari kayu batang G. picrorhiza Miq, menambah koleksi senyawa-senyawa fenolat atau turunannyadan menambah data bioaktivitas senyawa-senyawa dari genus Garcinia. 2. Mengetahui jenis-jenis senyawa yang dapat diisolasi dari kayu batang G. picrorhiza Miq dan sifat bioaktivitas senyawa - senyawa yang ditemukan tersebut sebagai antimalaria. 3. Dapat menyarankan jalur biogenesis pembentukan senyawa - senyawa tersebut dengan senyawa - senyawa yang sudah dilaporkan sebelumnya. II. TINJAUAN PUSTAKA 2.1 Tinjauan Umum Botani Genus Garcinia Tumbuhan Genus Garcinia yang terdiri dari kurang lebih 500 spesies ini tersebar luas di kawasan tropis serta memiliki fisiognomi yang beragam (Jones, 1980). Dari jumlah tersebut terdapat 91 spesies Garcinia terdapat di Indonesia dan 35 spesies dikoleksi di Kebun Raya Bogor (Hambali, 1986). Secara taksonomi tumbuhan genus Garcinia ini diklasifikasikan (Heyne, 1987) sebagai berikut : Divisio : Spermatophyta Sub Divisio : Angiospermae Kelas : Dicotyledoneae Sub Kelas : Archichlamydae Ordo : Parietales Famili : Clusiaceae (Guttiferae) Genus : Garcinia Spesies : Garcinia picrorhiza Miq Studi literatur mengenai kandungan kimia dari famili Clusiaceae khususnya dari genus Garcinia telah banyak dilaporkan, diantaranya senyawa-senyawa santon trioksigenasi sederhana, misalnya 1,2,5-trihidroksisanton (2) dan senyawa santon trioksigenasi dan terprenilasi, misalnya 1,3,5-trihidroksi-2-prenil santon (3) dari G. Vieillardii (Anne-Emanuelle Hay, dkk, 2004). Senyawa-senyawa santon dengan pola trioksigenasi atau tetraoksigenasi pada cincin utama dan terprenilasi bahkan sebagian di antaranya telah mengalami siklisasi dari beberapa spesies Garcinia, antara lain senyawa Subelliptenon F (4), dari G.Dulcis, dan 3-isomangostin (5) dari G. Mangostana (Deachathai, dkk.,2005). O OH O O OH OH O OH OH O OH O OH OH OH OH (2) (4) (3) 297 O O HO O OH (5) Senyawa - senyawa flavon turunan santon, juga ditemukan pada genus Garcinia di antaranya naringenin (6) dan taxifolin (7) yang diisolasi dari buah G. Kola Heckel (Cotterill dan Scheinmann, 1977), morelloflavon (8) yang diisolasi dari kayu batang G. Morella (Venkataraman, K; 1976); GB-1a (9) yang diisolasi dari kulit batang G. dulcis (Kosela, 2000), GB-1 (10), GB-2 (11), GB-3 (12) dan kolaflavon (13), yang diisolasi dari kulit batang G. k ola (Kabangu, dkk, 1986). OH OH OH HO HO O O OH OH OH O O (7) (6) R1 R2 OH HO OH O O R4 OH R5 OH OH O HO OH O O OH O R3 OH (8) OH (9-13) O OH O Gugus fungsi (R) untuk senyawa 9 sampai dengan 13. Senyawa R1 R2 R3 R4 R5 GB-1a (9) H OH H H OH GB-1 (10) H OH OH H OH GB-2 (11) H OH OH OH OCH3 GB-3 (12) OH OCH3 OH OH OH H OH OH OH OCH3 Kolaflavon (13) Dari banyak jurnal juga dilaporkan bahwa senyawa-senyawa kimia hasil isolasi dari tumbuhan Garcinia memiliki bioaktifitas sebagai: antimalaria (2) dan (3) (Anne-Emanuelle Hay, dkk, 2004); antibakteri, antimikrobial, sitotoksik, antioksidan dan anti-HIV (4 - 7), (Iinuma, dkk., 1996; Peres dan Nagem, 2000). Morellin (8) yang diisolasi dari G. morella sebagai antiprotozoa dan antibakteri (Perveen dan Khan, 1987). GB 1 (10) dan kolaflavon (13) yang diisolasi dari G.kola dilaporkan bioaktifitasnya sebagai antibakteri dan antimikroba (R.A. Hussain, dkk, 1982; Quan Bin Han, dkk, 2005). 298 Banyak manfaat yang dapat diperoleh dari genus Garcinia ini, maka dapat dikatakan bahwa genus Garcinia ini memiliki nilai ekonomi yang sangat penting dalam dunia perdagangan dan pengobatan. III. METODOLOGI PENELITIAN 3.1 Alat dan Bahan 3.1.1 Alat Peralatan yang digunakan terdiri dari corong pisah, erlenmeyer, gelas kimia, gelas ukur, pipa kapiler, pipet tetes, tabung reaksi, spatula, bejana pengembang (chamber), kontainer maserasi, alat ukur titik leleh, neraca analitik, destilator, rotary evaporator vakum, botol vial, oven, penggiling sampel mekanik, gunting, cutter, isolasi bening, peralatan kromatografi cair vakum (KCV), kromatografi lapis tipis (KLT), kromatotron, dan peralatan spektroskopi UV, IR, 13C-NMR dan 1H-NMR. 3.1.2 Bahan Bahan yang digunakan terdiri dari kayu batang G. picrorhiza Miq yang telah dihancurkan, pelarut-pelarut organik, yaitu: n-heksana, metilen klorida, kloroform, etil asetat, aseton dan metanol; plat KLT, plat KLT preparatif, silika gel untuk KLT, silika gel untuk kolom, pereaksi penampak noda serium sulfat[Ce(SO 4)2) ] dalam H2SO4 2N. 3.2 Penyiapan Bahan kayu batang dari tumbuhan G. picrorhiza Miq yang digunakan sebagai sampel pada penelitian ini adalah diperoleh dari Kebun Raya Bogor. Kayu batang yang sudah kering dipotong kecil-kecil kemudian digiling hingga menjadi serbuk yang siap untuk dimaserasi. 3.3 Prosedur Isolasi, Identifikasi dan Uji Bioaktifitas Serbuk kayu batang G.picrorhiza Miq sebanyak 5 kg dimaserasi menggunakan pelarut etil asetat sampai diperoleh ekstrak etil asetat, proses ini diakhiri berdasarkan hasil monitoring dengan KLT. Ekstrak tersebut diuapkan dengan menggunakan rotary evaporator vakum sampai dihasilkan ekstrak etil asetat padat. Ekstrak etil asetat yang diperoleh kemudian diKCV dengan eluen n-heksana etil asetat untuk memisahkan fraksi - fraksinya. Beberapa fraksi yang didapat masing-masing difraksinasi lagi dengan menggunakan berbagai cara kromatografi dan dielusi dengan eluen yang sesuai berdasarkan hasil monitoring KLT. Fraksi-fraksi yang dihasilkan yang mempunyai harga retensi (Rf) yang sama dikelompokkan menjadi beberapa fraksi gabungan. Kemudian dimonitor kembali dengan KLT untuk mengetahui fraksi yang lebih sederhana dan potensi untuk dilanjutkan proses isolasinya, sampai dihasilkan fraksi tunggal yang selanjutnya dimurnikan dengan cara rekristalisasi. Hasil rekristalisasi kemudian diuji kemurniannya dengan KLT menggunakan 3 macam pelarut tunggal atau campuran yang berbeda kepolarannya dan ditentukan titik lelehnya. Sedangkan untuk menentukan struktur molekul digunakan data fisika dan spektroskopi UV, IR, 1H-NMR dan 13C-NMR. Uji bioaktifitas senyawa hasil isolasi dilakukan dengan cara uji in vitro terhadap parasit malaria Plasmodium falciparum di laboratorium farmasi Universitas Airlangga Surabaya. 299 IV. HASIL DAN PEMBAHASAN Hasil kromatogram KLT senyawa hasil isolasi dengan 3 macam eluen campuran yang berbeda tingkat kepolaranya tetap menunjukkan noda tunggal seperti tampak di bawah ini : Keterangan eluen untuk senyawa A (1) : 1. kloroform : metanol 10 % ; 2. heksan : aseton 40 % ; 3. metilen klorida : metanol 10 % Ini berarti bahwa senyawa tersebut sudah murni. Selanjutnya dilakukan spektroskopi UV, IR, 1H-NMR dan 13C-NMR untuk menentukan struktur molekulnya. 4.1 Spektrum UV Senyawa Hasil Isolasi Spektrum UV senyawa hasil isolasi dengan λmaks nm dalam : (MeOH) adalah 223, 293 dan 334; (MeOH + NaOH) adalah 245 dan 332, dalam (MeOH + AlCl 3) adalah 315 dan 374; dan dalam (MeOH + AlCl3 + HCl) adalah 315 dan 373. Spektrum UV senyawa hasil isolasi dengan λmaks dalam MeOH adalah 293 nm dan 334 nm; adalah sesuai untuk senyawa flavanon (Mabry dkk, 1970). Dan ketika ditambahkan NaOH mengalami pergeseran λmaks dari 245 nm ke 332 nm, ini mengindikasikan bahwa senyawa flavanon yang ada tersebut mempunyai gugus OH pada posisi C-5 dan C-7 (Markham, 1998). Adapun spektrum UV senyawa hasil isolasi dalam (MeOH + AlCl 3) dengan λmaks 315 nm dan 374 nm; dan dalam (MeOH + AlCl 3 + HCl) adalah 315 nm dan 373 nm, dengan nilai pergeseran 59 nm dan 58 nm, ini mengindikasikan adanya gugus OH pada atom C-3 senyawa flavanon tersebut (Markham, 1998). 4.2 Spektrum IR (Infra Red) Senyawa Hasil Isolasi Spektrum IR V KBr maks cm-1 senyawa hasil isolasi adalah sebagai berikut : 3255; 2962; 2924; 1634; 1608; 1512; 1454; 1366; 1258; 1168; 1086; dan 830. Bilangan gelombang (V maks) 3255 cm -1 melebar menunjukkan adanya gugus fungsi OH; Dan V maks 1634 cm -1 adalah bilangan gelombang untuk gugus karbonil terkhelat. Sedangkan V maks 1608, 1512, 1454, dan 1366 cm -1 menunjukkan serapan yang khas untuk ikatan rangkap pada cincin aromatik. 4.3 Spektrum 13C – NMR Senyawa Hasil Isolasi Spektrum 13C – NMR senyawa hasil isolasi mempunyai nilai pergeseran kimia (δC) ppm sebagai berikut : 82,5; 48,7; 197,5; 163,7; 96,1; 161,5; 96,4; 163,5; 300 101,3; 129,2; 129,9; 115,6; 158,8; 115,7; 130,1; 49,0; 83,0; 73,3; 198,1; 163,9; 97,0; 164,1; 100,9; 167,0; 102,6; 129,7; 115,8; 158,5; 158,6; 115,5; dan 128,4; Nilai pergeseran kimia pada cincin C suatu flavaoid adalah khas dan dapat digunakan untuk mengidentifikasi kerangka dasar berbagai tipe senyawa flavonoid (Agrawal dan Rastogi, 1981). Nilai δC 197,5 ppm dan 198,1 ppm merupakan δC untuk atom C-4 (C karbonil) pada cincin piron pusat ( cincin C) untuk 5,7 dihidroksiflavanon dan flavanonol. Nilai δC untuk atom C-2nya adalah 83,0 ppm dan C-3nya 73,3 ppm. Untuk cincin A, nilai pergeseran kimia pada atom C-5=163,7; C-6=96,1; C-7=164,1; C8=96,4; C-9=163,5 dan C-10=101,3 ppm. Adapun nilai pergeseran kimia untuk cincin B dari atom C-1' – C-6' berturut-turut adalah 129,2; 129,9; 115,6; 158,8; 115,5; 128,4 ppm. Sedangkan δC 49,0 ppm adalah nilai pergeseran kimia untuk atom C metil pada gugus metoksi. 4.4 Spektrum 1H – NMR Senyawa Hasil Isolasi Nilai pergeseran kimia (δH) ppm spektrum 1H – NMR senyawa hasil isolasi adalah sebagai berikut : 5,51 d 12,2; 4,60 d 1,2; 12,27 s OH; 5,82 s; 11,59 s OH; 5,92 s; 7,20 d 5; 6,91 s OH; 1,36 s (3H); 6,71 d 9,9; 7,19 d 5; 5,01 d 1,6; 4,79 d 12,2; 5,95s OH; 12,40 s OH; 6,04 s 11,70 s OH; 7,29 d 5 6,83 d 10; 8,64 s OH; 6,83 d 7,3; dan 7,30 d 5; Dari data nilai pergeseran kimia (δH ppm) spektrum 1H – NMR senyawa hasil isolasi menunjukkan adanya beberapa kelompok proton yaitu δH 12,27 s dan 12,20 s adalah δH untuk OH khelat dengan C = O. Nilai δH ppm 11,59 s ; 6,91 s; 5,95 s; 11,70 s; dan 8,64 s; adalah nilai δH ppm untuk OH bebas dan δH ppm 4,60 d 11,2; 5,82 s; 5,92 s; 6,71 d 9,9; 7,19 d 5; 5,01 d 11,6; 4,79 d 12,2; 6,04 s; 7,29 d 5; 6,76 d 5; 6,75 d 5; 7,30 d 5; adalah nilai δH ppm untuk proton pada sistem aromatik. Sedangkan δH ppm 1,36 s (3H) adalah δH untuk 1 metil pada gugus metoksi yang diperkuat dengan adanya δC ppm 49,0 pada spektrum 13C-NMR senyawa tersebut. Proton pada atom C-2 untuk senyawa flavanon muncul sebagai kwartet (2 doblet) dengan J cis = 5 Hz dan J trans = 11 Hz dekat 5,2 ppm sebagai hasil kopling dengan 2 proton pada atom C-3. Proton pada atom C-3 berpasangan satu sama lain dengan J = 17 Hz akibat dari interaksi spin-spin pada atom C-2 sehingga memberikan puncak overlap kwartet di dekat 2,8 ppm. 2 dari masing-masing signal adalah lemah dan sering tidak teramati (Mabry dkk, 1970). Pada atom C-2 senyawa hasil isolasi, nilai δH ppm teramati pada 5,01 d J=11,2 Hz trans terhadap proton pada atom C-3. Sedangkan proton pada atom C-3 muncul 2 signal yaitu pada δH ppm 4,60 d J=11,2 Hz dalam posisi trans terhadap H pada atom C-2 dan 5,95 s. Signal ini adalah sesuai untuk senyawa dihidroflavonol atau flavanonol yangmana δH ppm 5,95 s adalah nilai δH ppm untuk gugus OH. Adapun proton pada atom C-6 dan C-8 muncul pada signal 5,82 s dan 5,92 s karena keduanya (atom C-6 dan C-8) tersebut mempunyai tetangga yaitu atom C-5 dan C-7 yang mengikat gugus OH, sedangkan atom C-9 sebagai tetangga atom C-8 tidak mengikat atom H. Nilai δH ppm pada atom C-2' 7,20 d J=5 Hz yang berarti bahwa proton ini mempunyai posisi meta terhadap atom C-6'. Adapun δH ppm 6,71 d J=9,9 Hz adalah nilai pergeseran proton yang terikat pada atom C-5' dalam posisi orto terhadap atom H pada C-6'. Signal 1,36 s (3H) adalah signal untuk 1 metil pada gugus metoksi yang diperkuat dengan adanya nilai δC ppm 49,0 untuk gugus metoksi. Signal-signal 11,59 s ; 6,91 s; 5,95 s; 11,70 s; dan 8,64 s; adalah signal-signal untuk H pada gugus OH bebas senyawa tersebut. 301 4.5 Penentuan Struktur Senyawa Hasil Isolasi Dari hasil analisa spektrum 1H-NMR senyawa hasil isolasi, nilai-nilai pergeseran kimia proton NMR untuk atom-atom C-2 dan C-3 pada cincin C dan C-5, C-6, C-7,C-8 pada cincin A serta C-2', C3', C4', C5', C6' pada cincin B, diketahui bahwa nilai-nilai pergeseran kimia yang ada adalah berulang dengan nilai pergeseran (δH ppm) yang mendekati satu sama lain dengan memunculkan 24 nilai signal proton. Hipotesa sementara senyawa hasil isolasi berdasarkan hasil analisa spektrum UV, IR, 13 dan C-NMR adalah suatu senyawa biflavanon dengan 2 cincin flavanoid yang identik yaitu flavanon dan flavanonol. Setelah dilengkapi dengan data hasil analisa spektrum 1H-NMR serta membandingkanya dengan hasil-hasil analisa spektrum beberapa senyawa flavanoid yang ada pada jurnal, maka dapat disarankan bahwa senyawa hasil isolasi adalah suatu senyawa biflavanon yang terbentuk dari senyawa flavanon (naringenin) dan senyawa flavanonol (taxifolin) yang terikat satu sama lain pada posisi C-3 (cincin C) dan C-8'' (Cincin A) dengan rumus struktur C31 H24O13 dan nama IUPAC 5,7,3',3'',5'',7'',3''',4''' – oktahidroksi - 4'- metoksi - 3,8''- biflavanon adalah mempunyai struktur molekul sebagai berikut ini : OH 3' 8 HO 4' OMe O 9 6' 3 6 OH OH 2''' OH O 8'' HO O 10 '' 4'' 6'' OH 6''' OH O (1) Berdasarkan uraian dan penjelasan data hasil analisa spektrum UV, IR, C-NMR dan 1H-NMR di atas dan setelah membandingkannya dengan data-data hasil spektrum senyawa GB3 maka dapat diambil kesimpulan bahwa senyawa hasil isolasi mempunyai struktur molekul yang sama dengan senyawa GB3 yang pernah dilaporkan pada jurnal oleh Kabangu dkk, (1986); Data fisika senyawa hasil isolasi adalah berupa padatan kuning (200 mg) dengan titik leleh 229 - 2300 C yang diuji dengan menggunakan alat uji titik leleh Fisher johns MP apparatus. 13 4.6 Hasil Uji Bioaktifitas Invitro Antimalaria Hasil uji bioaktifitas invitro antimalaria terhadap senyawa hasil isolasi menunjukkan bahwa senyawa tersebut kurang aktif sebagai antimalaria dengan nilai IC50 3,36 μg/ml jika dibandingkan dengan kloroquin. V. KESIMPULAN Senyawa Hasil isolasi dari tumbuhan Garcinia picrorhiza Miq pada penelitian ini setelah ditentukan struktur molekulnya dengan menggunakan data spektroskopi UV,IR, 13C-NMR dan 1H-NMR adalah suatu senyawa biflavanon dengan nama IUPAC 5,7,3',3'',5'',7'',3''',4'''-oktahidroksi-4'-metoksi-3,8''-biflavanon. Senyawa tersebut memiliki struktur molekul yang sama dengan senyawa GB3 yang pernah dilaporkan 302 pada jurnal oleh Kabangu, dkk (1986). Hasil uji invitro antimalaria terhadap senyawa hasil isolasi menunjukkan bahwa senyawa tersebut kurang aktif sebagai antimalaria dengan nilai IC50 3,36 μg/ml jika dibandingkan dengan kloroquin. VI. Ucapan Terima Kasih Penulis menyampaikan terima kasih yang mendalam kepada : 1. Dirjen Dikdasmen Dikmenjur Depdiknas, yang telah memberikan beasiswa terbatas untuk mengikuti Program Magister Kimia di ITS Surabaya ini. 2. Pemda Kabupaten Buru yang telah membantu biaya penelitian dan pembelian buku kuliah. 3. Dr. Tukiran, M.Si. dan staf dari UNESA Surabaya yang telah membantu dalam pembuatan data spektroskopi UV dan IR. 4. Ahmad Darmawan, S.Si dan Sofa Fajriati S.Si dari PUSPITEK LIPI Serpong Banten yang telah membantu pembuatan data spektroskopi 1H-NMR dan 13 C-NMR. 5. Dr. Aty Widyawaruyanti, M.Si dan Dra. Maria Nindatu, M. Kes dari Fakultas Farmasi UNAIR Surabaya yang telah membantu menguji bioaktifitas senyawa. 6. Kepala Laboratorium Taksonomi Tumbuhan Kebun Raya Bogor Jawa Barat yang telah membantu mengidentifikasi tumbuhan spesies Garcinia picrorhiza Miq. VII. DAFTAR PUSTAKA Agrawal, P.K., Rastogi, R.P. (1981) Heterocycles, 16 (12) 2181-2216. 13 C-NMR Spectroscopy of Flavonoids. Deachathai, S. (2005) Phenolic Compounds from the Fruit of Garcinia dulcis. Phytochemistry, 66 (19) 2368-75 Ersam, T. (2001) Senyawa Kimia Mikromolekul beberapa Tumbuhan Artocarpus Hutan Tropika Sumatera Barat, Disertasi, PPs. ITB, Bandung. Fidock DA, Rosenthal PJ, Croft SL, Brun R, Nwaka S, 2004. Antimalarial drug discovery : Efficacy models for compound screening, Review, Nature 3 (Juni) : 509-520. Iinuma, M., Tosa, H., Tanaka, T., Asai, F., Shinamo, R. (1996) Two Xanthones with 1,1 Dimethilallyl group in root bark of Garcinia subelliptica. Phytochemistry, 39 (4) 945-947 Jackson,B., Locksley, H.D., Scheinman, F., (1971) Extractives from Guttiferae, Part XXII. The isolation and structure of four novel Biflavanones from from the heartwood of Garcinia eugeniifolia Wall. J. Chem. Soc, 3791-3803. Mabry,T.J, Markham K.R, The Systematic Identification of Flavanoids, SpringerVerlag 1970 Markham ,K.R (1988) Cara Mengidentifikasi Flavonoid. Terjemahan ITB Bandung. 303 Peres, V., Nagem, T. J., Olivera F. (2000) “Tetraoxygenated Naturally Occuring Xanthones”, Phytochemistry, 55 683 – 710. Rismita Sari dan Abdul Hanan (2000) “Garcinia (Clusiaceae) di Kebun Raya Bogor : Fisiognomi, Keragaman dan Potensi “ 73 Rumphius dalam Heyne (1987) ”Tumbuhan Berguna Indonesia” jilid III Badan Penelitian dan Pengembangan Kehutanan,Departemen Kehutanan Jakarta 1387-1388 304 Senyawa Fenolik dari Ekstrak Kloroform Kulit Batang Tumbuhan Kedoya (Dysoxylum gaudichandianum A. Juss. Miq.) (Meliaceae) Tukiran, S. Hidayati Syarief, N. Hidayati, dan B. Eka Kelompok Penelitian Kimia Organik Bahan Alam Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Surabaya, Jl.Ketintang, Surabaya, 60231 Abstrak Suatu senyawa fenolik, p-hidroksiasetofenon telah berhasil diisolasi dari ekstrak kloroform kulit batang tumbuhan kedoya (Dysoxylum gaudichandianum A. Juss. Miq) (Meliaceae). Struktur senyawa ini ditetapkan berdasarkan data spektroskopi IR dan NMR. Kata kunci : Dysoxylum gaudichandianum A.Juss. Miq., Kedoya, Meliaceae, Phenolic Abstract A phenolic compound, p-hydroxyacetophenone had been isolated from chloroform extract of stem bark of kedoya (Dysoxylum gaudichandianum A. Juss. Miq.) (Meliaceae). This structure had been established based on spectroscopic data of IR and NMR. Key words : Dysoxylum gaudichandianum A. Juss. Miq., Kedoya, Meliaceae, Phenolic *) Makalah disampaikan pada Seminar Nasional Kimia di Jurusan Kimia – Unesa, Surabaya, tanggal 5 Desember 2007 305 1. PENDAHULUAN Genus Dysoxylum terdiri dari 200 spesies yang tumbuh secara alami di India dan Asia Tenggara, termasuk Indonesia. Menurut literatur, ekstrak dari beberapa spesies dari genus ini mempunyai sifat sitotoksik, anti-radang, dan antimalaria. Hingga sekarang ini, banyak senyawa seperti triterpena, triterpen glikosida, tetranortriterpenoid, diterpena, steroid, dan alkaloid, telah berhasil diisolasi dari tumbuhan genus ini. Suatu senyawa tetranortriterpenoid baru, yaitu lenticellatumin, tiga senyawa terpenoid yang sudah dikenal, dysoxylumin C, asam eichlerianat, dan dysoxylumin F, bersama-sama dengan tiga senyawa seramida yang sudah dikenal, 1-O- β-Dglucopiranosil- (2S,3S,4R,8Z)-2-N-(2’-hidroksitetrakosanoil) oktadekasphinga- 8ena, (2S,3S,4R,8E)-2-N-(2’-hidrokstetrakosanoil) oktadekasphinga-8-ena, (2S,3R,4E)-2-N-(2’-hidrokstetrakosanoil) oktadekasphinga- 4-ena, telah berhasil diisolasi dari ranting tumbuhan Dysoxylum lenticellatum. Dilaporkan pula bahwa senyawa 1-O- β-D-glucopiranosil- (2S,3S,4R,8Z)-2-N-(2’-hidroksitetrakosanoil) oktadekasphinga- 8-ena menunjukkan aktivitas antimakan yang kuat terhadap serangga Pieris brassicae L., sementara dua senyawa terakhir memperlihatkan aktivitas antimakan yang lemah [1]. Selanjutnya dilaporkan bahwa suatu senyawa triterpen baru, yaitu beddomei lacton telah diisolasi dari tumbuhan Dysoxyum beddomei, bersama-sama dengan enam senyawa triterpenoid yang sudah dikenal, 3-oksotirucalla-7,24-dien-23-ol, dipterocarpol, niloticin, melianone, melianodiol, dan 24-epi-melianodiol [2]. Di sisi lain dilaporkan pula, dua senyawa triterpen di atas, yaitu 3β,24,25- trihidroksisikloartana dan beddomei lacton menunjukkan sifat sitotoksik terhadap hama serangga beras Cnaphalocrocis medinalis (Guenée) [3]. Sebagai kelanjutan penelitian kami terhadap sejumlah tumbuhan Meliaceae, seperti Khaya senegalensis [4] dan Sandoricum koetjape [5], kini kami mulai menyelidiki kandungan kimia pada tumbuhan lain dalam famili tersebut, yaitu tumbuhan kedoya (Dysoxylum gaudichandianum A. Juss. Miq.) yang diperoleh dari Kebun Raya Purwodadi. Pada kesempatan ini, akan dilaporkan elusidasi struktur suatu senyawa fenolik hasil isolasi dari ekstrak kloroform kulit batang tumbuhan 306 Dysoxylum spp. Struktur molekul senyawa hasil isolasi ditetapkan berdasarkan data IR, 1H- dan 13C-NMR. 2. PERCOBAAN DAN HASIL Umum. Penentuan spektroskopi inframerah (IR) suatu senyawa hasil isolasi diukur dengan menggunakan alat spektrometer Buck Scientific M500. Spektrum 1H dan 13 C NMR diukur dengan menggunakan spektrometer JEOL JNM-ECA500 NMR, beroperasi pada 500 MHz ( 1H) dan 125 MHz (13C), menggunakan pelarut sebagai standar internal. Kromatografi cair vakum (KCV) dilakukan dengan menggunakan Si Gel Merck 60 GF254, kromatografi kolom gravitasi (KKG) dengan Si Gel Merck 60 (60 – 70 mesh), dan analisis kromatografi lapis tipis (KLT) menggunakan pelat berlapis Si Gel Merck Kieselgel 60 F254 , 0,25 mm. Pengumpulan Bahan Tumbuhan. Bahan tumbuhan berupa kulit batang dari kedoya (Dysoxylum gaudichandianum A. Juss. Miq.) dikumpulkan pada bulan Juni 2007 dari Kebun Raya Purwodadi. Tumbuhan ini telah diidentifikasi oleh staf Herbarium LIPI, Purwodadi, Pasuruan dan spesimennya disimpan di Herbarium tersebut. Ekstraksi dan Isolasi. Serbuk kering kulit batang tumbuhan kedoya (Dysoxylum gaudichandianum A. Juss., Miq) ini dimaserasi dalam pelarut metanol sebanyak 3 kali, kemudian dievaporasi pada tekanan rendah dan diperoleh ekstrak kental berwarna hijau tua (71,5 g). Selanjutnya, ekstrak kental metanol ini kembali dilarutkan dalam sedikit pelarut metanol, untuk selanjutnya dipartisi dengan kloroform sebanyak 3 kali pula. Setelah pelarut diuapkan dari porsi/bagian kloroform pada tekanan rendah, diperoleh ekstrak kloroform kental berupa residu berwarna hijau tua (30,7 g). Seluruh ekstrak kloroform ini difraksinasi sebanyak 3 kali dengan berat bagian masing-masing kurang lebih 10 g melalui KVC dengan menggunakan eluen yang sama, yaitu heksana, campuran heksana – kloroform, heksana – kloroform – metanol, dan metanol dengan tingkat kepolaran yang terus meningkat, masing-masing menghasilkan 22, 34, dan 18 fraksi. Penggabungan fraksi-fraksi tersebut atas dasar analisis KLT menghasilkan 4 fraksi utama, yaitu fraksi A (2,123 g), B (3,974 g), C (3,104 g), dan D. Pemisahan berikutnya dilakukan terhadap fraksi B (3,974 g) baik melalui cara/teknik KVC dan KKG 307 menggunakan berbagai macam eluen yang sesuai diikuti proses rekristalisasi, dihasilkan suatu kristal putih sebanyak 20 mg (dan selanjutnya senyawa hasil isolasi ini disebut isolat Bayu-Tuk-1). Uji karakterisasi berikutnya terhadap sampel kristal isolat tersebut meliputi uji spektroskopi IR dan NMR. Data spektroskopi senyawa hasil isolasi adalah sebagai berikut. Spektrum IR (KBr) senyawa hasil isolasi menunjukkan serapan νmaks. pada 3300,6 (-OH); 2936,0 (-CH); 1663,5 (-C=O); 1575,3; 1507,0; dan 1450,7 (-C=C); 1357,0 (-CH3); 1278,9 (=C-OH); 1216,7; 1160,4; dan 845,1 (1,4-disubstitusi benzena) cm-1. Spektrum 13 C-NMR (CDCl3, 125 MHz) senyawa hasil isolasi memperlihatkan sejumlah sinyal pada δC 26,5 (1 CH 3), 115,6 (2 -CH=), 131,3 (2 –CH=), 130,1 (1 – C=); 161,1 (1 –C-OH); dan 198,2 (-C=O) ppm. 3. PEMBAHASAN Pemisahan ekstrak kloroform dari kulit batang tumbuhan dysoxylum spp. dihasilkan suatu isolat Bayu-Tuk-1 yang diperoleh melalui beberapa tahap fraksinasi, diikuti oleh pemilihan fraksi utama berdasarkan analisis kromatogafi lapis tipis (KLT), pemurnian melalui kolom kromatografi dan rekristalisasi, serta pengukuran spektroskopi. Suatu isolat Bayu-Tuk-1 ini berupa kristal putih telah diperoleh dari kolom kromatografi dan rekristalisasi berulang-ulang dalam pelarut metanol panas dari fraksi gabungan V. Dengan pereaksi serium sulfat, senyawa ini memberikan warna ungu dan memberikan pendar ungun dibawah lampu UV pada panjang gelombang 254 nm, berarti menunjukkan suatu senyawa fenolik. Spektrum IR senyawa hasil isolasi ini memperlihatkan serapan pada daerah 3300,6; 2936,0; 1663,5; 1575,3; 1507,0; 1450,7; 1357,0; 1278,9; 1216,7; 1160,4; dan 845,1 cm -1. Data-data serapan IR ini masing-masing menunjukkan vibrasi ulur –OH (3300,6 cm -1), vibrasi ulur –CH (2936,0 cm-1), vibrasi ulur C=O (1663,5 cm1 ), vibrasi ulur ikatan rangkap terkonjugasi dari benzena (C=C-C=C) (1575,3; 1507,0; dan 1450,7 cm -1), vibrasi tekuk C-H (1357,0 cm-1 ), dan vibrasi ulur C – O (1278,9 cm -1) (Silverstein, 1981). 308 Berdasarkan spektrum 13 C-NMR senyawa hasil isolasi yang didukung oleh spektrum HMQC, senyawa hasil isolasi ini memiliki 8 karbon yang terdiri dari 1 gugus metil (-CH3 ), 4 gugus metin (-CH-), dan 3 atom karbon kuaterner (-C=) (lihat Table 2). Spektrum senyawa hasil isolasi ini memiliki 6 sinyal yang menggambarkan adanya 1 gugus metil, yang terletak pada daerah geseran kimia (δC ppm) 26,5, empat (4) gugus metin (-CH=) terletak pada daerah geseran kimia (δC ppm) 115,6 (2 C) dan 131,3 (2 C), dan tiga (3) gugus metun (-C=) pada daerah geseran kimia 130,1; 161,1; dan 198,2 (-C=O). Sementara itu, spektrum 1H-NMR senyawa hasil isolasi memperlihatkan sejumlah sinyal proton yang menggambarkan adanya 1 gugus metil (-CH3) pada daerah 1,88 ppm, 1 gugus –OH fenol pada 6,93 ppm, 4 gugus metin (-CH=) di daerah 6,91 (2 H) dan 7,90 (2 H) ppm yang menjadi ciri dari turunan 1,4disubstitusi benzena. Akhirnya, data spektroskopi ini mendukung bahwa senyawa hasil isolasi diduga sebagai senyawa p-hidroksiasetofenon, seperti digambarkan berikut. O 8 CH3 7 4 5 3 6 p-Hidroksiasetofenon 2 1 OH Tabel 1. Nilai geseran kimia dari spektrum H- dan C-NMR (δppm, CDCl3) dari senyawa hasil isolasi (isolat Bayu-Tuk-1) No. C 1 2(6) 3(5) 4 7 8 =C-OH 1 H- NMR (ppm) 6,91 (d, J = 8,0 Hz) 7,90 (d, J = 8,0 Hz) 1,88 (s) 6,93 (s) 13 C- NMR (ppm) 161,1 115,6 131,3 130,1 198,2 26,5 - 309 Jenis Karbon =C-OH -CH= -CH= -C= -C=O -CH3 4. KESIMPULAN Penelitian kimia pada tumbuhan kedoya (Dysoxylum gaudichandianum A.Juss. Miq.) telah dilakukan di laboratorium kami, dan dari penelitian ini telah ditemukan suatu senyawa fenolik, yaitu p-hidroksiasetofenon. Sejauh ini, studi fitokimia terhadap tumbuhan dalam genus Dysoxylum perlum pernah ditemukan senyawa fenolik tersebut. Untuk mengungkap lebih jauh senyawa-senyawa fenolik lainnya guna mencari keragaman dan pola kimia senyawa-senyawa pada tumbuhan tersebut, kami masih terus melanjutkan kegiatan penelitian ini. Ucapan terima kasih Penelitian ini dibiayai oleh DIPA Unesa, Jenis Payung Riset Unggulan Tahun 2007. Terima kasih disampaikan kepada staf LIPI, Kebun Raya Purwodadi, Pasuruan, yang telah membantu mengidentifikasi spesimen tumbuhan tersebut. Terima kasih pula disampaikan kepada staf LIPI ”Pusat Penelitian Kimia’, Serpong, atas bantuan pengukuran spektroskopi NMR. Referensi : 1. Qi, S.-H., Wu, D.-G., Zhang, S., dan Luo, X.-D., 2003, “A New Tetranortriterpenoid from Dysoxylum lenticellatum”, Z. Naturforsch., 58b, 1128 – 1132. 2. Hisham, A., Jayakumar, G., Ajitha Bai, M.D., Fujimoto, Y., 2004, “Beddomeilactone: A New Triterpene from Dysoxylum beddomei”, Natural Product Research, Vol. 18 (4), 329 – 334. 3. Nathan, S.S., Choi, M.-Y., Paik, C.-H., dan Seo, H.-Y., 2007, “Food consumption, utilization, and detoxification enzyme activity of the rice leaffolder larvae after treatment with Dysoxylum triterpenes”, Pesticide Biochemistry and Physiology, 88 (3), 260-267. 4. Tukiran, Sri Hidayati, S., dan Iid, F., Suatu Senyawa Steroid dari Ekstrak nHeksana Kulit Batang Tumbuhan Kaya (Khaya Senegalensis (Desr.) A. Juss) (Meliaceae)”, Presentasi oral, Kumpulan Abstrak, Seminar Nasional MIPA, 17 Desember 2005, UNESA Surabaya. 310 5. Tukiran, Saidah, Suyatno, Nurul Hidayati, and Shimizu, K., 2006, “Briononic acid from The Hexane Extracts Sandoricum koetjape Merr Stem Bark (Meliaceae)”, Indonesian Journal of Chemistry, Vol.2(1), . 311 PEMILIHAN PELARUT DAN OPTIMASI SUHU PADA ISOLASI SENYAWA ETIL PARA METOKSI SINAMAT (EPMS) DARI RIMPANG KENCUR SEBAGAI BAHAN TABIR SURYA PADA INDUSTRI KOSMETIK. Abstrak Titik Taufikurohmah, Rusmini, Nurhayati Etil p-metoksisinamat (EPMS) adalah salah satu senyawa hasil isolasi rimpang kencur (Kaempferia Galanga L) yang merupakan bahan dasar senyawa tabir surya yaitu pelindung kulit dari sengatan sinar matahari. Isolasi EPMS dapat dilakukan dengan berbagai pelarut karena struktur senyawa EPMS terdiri dari gugus polar dan nonpolar, untuk lebih efektifnya maka perlu dilakukan pemilihan pelarut untuk mengekstraknya. Dalam penelitian pemilihan pelarut yang digunakan adalah heksan, etil asetat, alkohol dan aquades. Selain pelarut suhu juga berpengaruh terhadap proses pelarutan karenanya dilakukan pula optimasi suhu pada proses isolasi dengan pelarut yang telah terpilih. Metode yang digunakan dalam penelitian ini adalah maeserasi yang diikuti dengan perkolasi. Setelah didapatkan perkolat selanjutnya dipekatkan dengan rotary vacuum evaporator, selanjutnya dikristalkan dan direkristalisasi. Hasil penelitian pada pemilihan pelarut pada suhu kamar didapat bahwa heksan adalah pelarut yang paling sesuai ditandai dengan % hasil isolasi tertinggi yaitu 2,111% yang diikuti etanol yaitu 1,434%, dan etil asetat 0,542% sedangkan dengan aquades tidak terdapat kristal. Pada optimasi suhu dengan pelarut heksan didapat % hasil isolasi tertinggi terjadi pada suhu 50oC yaitu 8,873%, diikuti suhu 60oC yaitu 8,765% dan suhu 40oC yaitu 7,236%, sedangkan suhu 70 oC memberikan prosentase terkecil yaitu 7,218%. Seluruh hasil isolasi selanjutnya dilakukan uji kemurnian dengan penentuan TL didapat sekitar 46,5oC mendekati TL EPMS standard, demikian pula pengujian dengan KLT memberikan Rf yang identik dengan EPMS standard pada berbagai pelarut pengembang. Analisa menggunakan IR menunjukkan pita serapan IR baik ulur maupun tekuk dengan kemiripan diatas 98%, hal ini menunjukkan adanya struktur senyawa yang identik antara EPMS standard dengan hasil isolasi. Bab I. PENDAHULUAN Indonesia merupakan negara dengan iklim tropik di mana sinar matahari menyinari wilayah Indonesia sepanjang tahun. Sinar matahari merupakan sumber kehidupan bagi makhluk yang tinggal di bumi ini. Banyak manfaat yang dapat diambil dari kehadiran matahari, namun ada juga yang kurang menguntungkan yaitu sengatan panasnya matahari yang dapat membakar kulit terutama sinar UV. Untuk mengurangi sengatan sinar UV ini dapat digunakan pelindung misalnya berteduh atau memakai payung, namun dalam beberapa hal keduanya tak mungkin dilakukan misalnya pada saat harus keluar rumah dan beraktivitas. Menggunakan lotion pelindung matahari adalah solusi yang tepat dan mudah dilakukan. 312 Tanaman kencur (Kaempferia Galanga L) telah lama digunakan oleh nenek moyang kita dalam campuran bedak yaitu bedak dingin beras kencur yang dapat mengurangi sengatan sinar matahari dan memberikan rasa sejuk pada permukaan kulit. Penelitian telah membuktikan kebenaran pengalaman nenek moyang kita bahwa dalam tanaman kencur memang mengandung senyawa tabir surya yaitu etil p-metoksisinamat. Etil p-metoksisinamat (EPMS) adalah salah satu senyawa hasil isolasi rimpang kencur (Kaempferia Galanga L) yang merupakan bahan dasar senyawa tabir surya yaitu pelindung kulit dari sengatan sinar matahari. Senyawa tabir surya terutama yang berasal dari alam dirasa sangat penting saat ini dimana tidak hanya wanita saja yang memerlukan perlindungan kulit akan tetapi pria pun memerlukan tabir surya untuk melindungi kulit agar tidak coklat atau hitam tersengat sinar matahari. Kulit dengan perlindungan akan tampak lebih baik dalam hal warna yaitu akan terlihat lebih bersih dan lebih putih. EPMS merupakan senyawa aktif yang ditambahkan pada lotion kulit ataupun pada bedak setelah mengalami sedikit modifikasi yaitu perpanjangan rantai dimana etil dari ester ini digantikan oleh oktil, etil heksil, atau heptil melalui transesterifikasi maupun esterifikasi bertahap. Modifikasi yang dilakukan diharapkan mengurangi kepolaran EPMS sehingga kelarutannya dalam air berkurang yang merupakan salah satu syarat senyawa sebagai tabir surya. Selain dari itu juga untuk mengurangi tingkat bahaya terhadap kulit, EPMS bila terhidrolisa akan melepaskan etanol yang bersifat karsinogenik terhadap kulit sedangkan hasil modifikasinya akan melepaskan alkohol dengan rantai lebih panjang yang tidak berbahaya. Mengingat kebutuhan akan senyawa tabir surya yang terus meningkat maka mengisolasi dari alam dengan bahan dasar yang murah adalah salah satu pilihan yang menguntungkan dipandang dari berbagai kepentingan. Industri kosmetik lebih diuntungkan dengan tersedianya bahan tabir surya yang lebih murah bila dibanding dengan import di satu sisi, sementara disisi lain petani kencur juga akan merasakan perbaikan harga dari hasil pertaniannya. Kenyataan inilah maka sangat perlu pengembangan bagaimana menyediakan EPMS ini di dalam negeri terutama karena Indonesia sangat potensi akan tanaman kencur. Saat ini yang terpenting adalah mengupayakan bagaimana mengoptimasi isolasi EPMS ini dari tanaman kencur agar didapatkan hasil dengan prosentase tertinggi. EPMS termasuk dalam golongan senyawa ester yang mengandung cincin benzena dan gugus metoksi yang bersifat nonpolar dan juga gugus karbonil yang mengikat etil yang bersifat sedikit polar sehingga dalam ekstraksinya dapat menggunakan pelarut-pelarut yang mempunyai variasi kepolaran yaitu etanol, etil asetat, metanol, air, dan heksan. Isolasi yang telah dilakukan sejauh ini adalah pada suhu kamar, sedangkan kelarutan suatu zat selalu meningkat dengan kenaikan suhu. Kelarutan suatu zat padat dan zat cair pada suatu pelarut meningkat dengan kenaikan suhu bila proses pelarutannya adalah endoterm, sedangkan untuk proses pelarutan yang bersifat eksoterm pemanasan justru menurunkan harga kelarutan zat. Fenomena yang kedua ini jarang dijumpai di alam yang umum 313 adalah proses pelarutan yang bersifat endoterm yaitu memerlukan kalor. Beberapa zat dalam larutan akan rusak atau terurai dam menguap dengan pemanasan sehingga suhu ekstraksi harus diperhatikan agar senyawa yang diharapkan tidak rusak. Dalam ekstraksi suatu senyawa yang harus diperhatikan adalah kepolaran antara pelarut dengan senyawa yang diekstrak, keduanya harus memiliki kepolaran yang sama atau mendekati sama. EPMS adalah suatu ester yang mengandung cincin bensen dan gugus metoksi yang bersifat non polar dan mengandung gugus karbonil yang mengikat etil yang bersifat agak polar menyebabkan senyawa ini mampu larut dalam beberapa pelarut dengan kepolaran bervariasi, dimana dalam eksperimen ini dicoba heksana, etil asetat, alkohol dan air dalam pencarian pelarut yang tepat. Selain pelarut, suhu juga ikut berpengaruh terhadap proses ekstraksi suatu bahan, dimana hampir semua zat padat dan zat cair kelarutannya dalam pelarut akan meningkat dengan kenaikan suhu. Beberapa senyawa akan rusak atau terurai dengan kenaikan suhu sehingga tidak mungkin suhu dinaikkan terus selama proses ekstraksi karena itu perlu diketahui suhu optimum untuk proses ekstraksi EPMS ini dengan pelarut yang sesuai yaitu pelarut yang diperoleh dari optimasi pelarut sebelumnya. Dengan asumsi-asumsi dari teori diatas maka rumusan masalah yang ingin di jawab dalam penelitian ini adalah ; 1. Pelarut apa yang sesuai untuk proses ekstraksi dalam isolasi EPMS dari rimpang kencur agar menghasilkan prosen isolat tertinggi. 2. Pada suhu berapa proses isolasi EPMS dengan pelarut terpilih yang menghasilkan prosen isolat tertinggi. Tujuan dari penelitian ini adalah mengetahui pelarut yang paling sesuai dan suhu optimum proses isolasi EPMS dari rimpang kencur. Pemilihan pelarut dan optimasi suhu bertujuan agar didapatkan prosen isolat yang tinggi, dan bisa diterapkan dalam skala yang lebih besar guna pemenuhan kebutuhan akan senyawa EPMS sebagai bahan dasar tabir surya di kalangan industri kosmetik Indonesia. Manfaat yang dapat diperoleh dari penelitian ini adalah dapat mengisolasi EPMS dari rimpang kencur dengan pelarut dan suhu yang tepat, manfaat yang lain yaitu dari kalangan industri kosmetik yang dapat membeli bahan kosmetik yang lebih murah dibanding dengan bila harus mengimport bahan kosmetik tersebut Bab II. KAJIAN PUSTAKA Tabir surya adalah suatu senyawa yang digunakan untuk menyerap secara efektif sinar matahari terutama daerah emisi gelombang UV sehingga dapat mencegah gangguan pada kulit akibat pancaran secara langsung sinar UV tersebut (Kreps,1972). Sinar matahari yang membahayakan kulit adalah radiasi ultraviolet dimana sinar ini dibedakan menjadi tiga, yaitu sinar ultraviolet A (UV-A), UVB dan UV-C yang ketiganya mempunyai panjang gelombang dan efek radiasi 314 yang berbeda. Sinar UV-A dengan panjang gelombang 320-400 nm mempunyai efek penyinaran, dimana timbul pigmentasi yang menyebabkan kulit berwarna coklat kemerahan. Sinar UV-B dengan panjang gelombang 290-320nm memiliki efek penyinaran, dimana dapat mengakibatkan kanker kulit bila terlalu lama terkena radiasi. Sedangkan Sinar UV-C dengan panjang gelombang 200290nm yang tertahan pada lapisan atmosfer paling atas dari bumi dan tidak sempat masuk ke bumi karena adanya lapisan ozon, efek penyinarannya paling kuat karena energi radiasinya paling tinggi diantara ketiganya yaitu dapat menyebabkan kanker kulit dengan penyinaran yang tidak lama (Harry, 1982). Secara alamiah kulit manusia telah mempunyai sistim perlindungan terhadap sinar UV yaitu penebalan stratum corneum, pembentukan melanin, dan juga pengeluaran keringat. Namun pada penyinaran yang berlebihan sistim pertahanan alamiah ini tidak mencukupi lagi sehingga menyebabkan beberapa gangguan pada kulit, karena itu diperlukanlah senyawa tabir surya untuk melindungi kulit dari radiasi UV secara langsung (Cumpelick, 1972). Senyawa tabir surya ada dua macam yaitu senyawa yang melindungi secara fisik dan senyawa yang menyerap secara kimia. Adapun senyawa yang melindungi secara fisik contohnya adalah senyawa titanium oksida, petroleum merah, dan seng oksida, sedangkan senyawa yang menyerap secara kimia contohnya adalah turunan asam p-aminobenzoat, turunan ester pmetoksisinamat, dan oksibenzena (Shaath, 1986). Ciri senyawa tabir surya yang menyerap secara kimia adalah mempunyai inti benzena yang tersubstitusi pada posisi orto maupun para yang terkonjugasi dengan gugus karbonil. Senyawa-senyawa demikian diantaranya adalah turunan asam para amino benzoat (PABA), turunan salisilat, turunan antranilat, turunan benzofenon, turunan kamfer dan senyawa-senyawa turunan sinamat. Senyawa turunan sinamat yang telah digunakan sebagai tabir surya antara lain adalah oktil sinamat, etil4-isopropil sinamat, dietanolamin pmetoksisinamat, dan isoamil p-metoksisinamat (Shaath, 1990). Selain itu sebagai senyawa tabir surya juga masih harus memenuhi persyaratan yaitu senyawa tersebut tidak atau sukar larut dalam air. Beberapa turunan sinamat yang memenuhi persyaratan ini diantaranya oktil p-metoksisinamat, isoamil pmetoksisinamat, sikloheksil p-metoksisinamat, 2-etoksi etil p-metoksisinamat, dietanolamin p-metoksisinamat dan turunan-turunan lain dari sinamat yang mempunyai rantai panjang dan sistem ikatan rangkap terkonjugasi yang akan mengalami resonansi selama terkena pancaran sinar UV. Berbagai jenis rempah-rempah diantaranya kencur (Kaempferia galanga) selain digunakan sebagai bumbu dapur juga dapat digunakan sebagai obat-obatan tradisional karena khasiatnya dapat juga digunakan menjaga kesehatan dan dapat menyembuhkan berbagai penyakit, antara lain sebagai penimbul rasa hangat, analgesik, penyembuh bengkak-bengkak, obat batuk, penambah nafsu makan dan lain-lain (Kusumaningati, 1994). Tanaman kencur mempunyai klasifikasi sebagai berikut: termasuk dalam divisi Spermatophyta, sub divisi Angiosperma, kelas Monocotyledoneae, bangsa Scitamineae, suku jahe-jahean (Zingiberaceae), marga Kaempferia, dan jenis Kaempferia galanga L, dengan nama lokal (Jawa) adalah kencur. Rimpang tanaman ini banyak digunakan sebagai bumbu masak, dan bahan bobok 315 tradisional, baik digunakan sendiri maupun bersama rempah yang lain. Campuran dari rempah kencur dengan tanaman lain dapat digunakan sebagai obat luar yang bersifat analgesik, antipiritik, anti inflamasi dan anti mikroba. Kencur juga digunakan sebagai bahan kosmetik yaitu dalam ramuan tradisional bedak dingin beras kencur (Kusumaningati, 1994). Kandungan senyawa kimia dari rimpang kencur (menurut J.J. Afriastini, 1990) antara lain minyak atsiri berupa sineol sebanyak 0.02%, asam metil kanil, pentadekana, ester etil sinamat, asam sinamat, borneol, kamfena, paraeumarina, asam anisat, alkaloid, gom mineral sebanyak 13.7% dan pati 4.14%. Kandungan minyak atsiri dalam rimpang kencur yaitu 2-4% yang terdiri dari etil sinamat, etil p-metoksisinamat, p-metoksi stirena, n-pentadekana, borneol, kamfen, 3,7,7-trimetil bisiklo [4,1,0] hept-3-ena (Didik, dkk, 1989). Larutan adalah campuran yang homogen, artinya setelah kedua zat dicampur, maka keduanya akan menghasilkan satu fasa (homogen) yang mempunyai sifat dan komposisi yang sama antara satu bagian dengan bagian lain dalam campuran tersebut. Larutan terdiri dari pelarut (komponen yang besar jumlahnya) yang biasa disebut solven dan zat terlarut (solut). Macam-macam larutan ========================================================== zat terlarut pelarut contoh gas gas udara gas cair oksigen dalam air gas padat hidrogen dalam serbuk Pt cair padat raksa dalam almagam padat cair cair alkohol dalam air padat padat emas dalam perak padat cair gula dalam air Jika kelarutan zat kurang dari 0,1 gram dalam 1000 gram pelarut disebut tidak larut (insoluble), misal kaca dan plastik dalam air. Konsentrasi larutan menyatakan komposisi larutan secara kuantitatif atau perbandingan jumlah zat terlarut dengan pelarut. Beberapa satuan konsentrasi: Fraksi mol (X) = mol zat terlarut/(mol zat terlarut+mol pelarut) Molaritas (M) = mol zat terlarut/ liter larutan Molal (m) = mol zat terlarut/ 1000 g pelarut Normal (N) = mol ekivalen zat terlarut/ liter larutan % massa = (gram zat terlarut/ gram larutan) x 100% 5 volume = (liter zat terlarut/ liter larutan) x 100% Ppm = mg zat terlarut/ kg larutan Walaupun suatu zat bisa larut dalam pelarut cair, tetapi jumlah yang dapat larut selalu terbatas dan batas itu disebut kelarutan. Suatu larutan lewat jenuh merupakan kesetimbangan dinamis. Kesetimbangan bergeser bila suhu dinaikkan. Pada umumnya kelarutan zat padat dalam larutan bertambah bila suhu 316 dinaikkan, karena umumnya proses pelarutan bersifat endotermik, tapi ada pula yang sebaliknya. Kelarutan dalam Zat padat cairan T Pengaruh kenaikan suhu pada kelarutan zat berbeda-beda. Hal ini merupakan dasar pemisahan secara kristalisasi bertingkat, misal memisahkan kristal KNO3 dan KBr yang bercampur. Dengan menaikkan suhu kristal KNO3 segera mencair sedang KBr tidak. Bila menggunakan pelarut air, maka KNO3 akan larut sedang KBr tidak, dengan menyaring keduanya terpisah (dalam keadaan panas). Bab III. METODE PENELITIAN Desain Penelitian. S-------------- P1-------------H1 P2-------------H2 P3-------------H3 P4-------------H4---------------H Opt / P Opt S--------------P Opt T1----------H5 P Opt T2----------H6 P Opt T3----------H7 P Opt T4----------H8------------T Opt Keterangan; S = sampel berupa rimpang kencur P1-P4 = Pelarut ( 1=Heksan, 2=Etil asetat, 3= Etanol dan 4 = air) H1-H4 = %isolat dengan Pelarut 1-4 H opt = %isolat paling besar P opt = Pelarut dengan %isolat paling besar T1-4 = Suhu (1=30oC, 2=50oC, 3=70oC dan 4= 90oC) H5-8 = %isolat dengan pelarut terpilih pada suhu (1=30oC, 2=50oC, 3=70oC, 4=90oC) Teknik pengumpulan data dimulai setelah prosedur berikut ini dilakukan yaitu: Isolasi etil p-metoksi sinamat ( EPMS ) dari rimpang kencur Rimpang kencur dicuci dengan air hingga bersih, ditiriskan lalu diiris-iris tipis agar mudah kering. Selanjutnya dikeringkan dengan sinar matahari tidak langsung, setelah kering dihaluskan menjadi serbuk dan direndam dalam perkolator dengan pelarut selama 24 jam. Cairan perkolat ditampung dalam erlenmeyer dan residu direndam lagi sampai beberapa kali hingga diperoleh perkolat yang warnanya kuning pucat dengan total perkolat 5 liter tiap kg serbuk. Perkolat selanjutnya dipekatkan dengan rotary vacuum evaporator hingga diperoleh larutan pekat yang selanjutnya didinginkan dalam penangas es hingga terbentuk kristal. Kristal yang didapat masih kotor dan dicuci dengan pelarut 317 sedikit saja lalu direkristalisasi dengan metanol hingga didapat kristal jarum yang tidak berwarna. Isolasi dengan proses ekstraksi di atas dilakukan menggunakan beberapa pelarut yaitu etanol, etil asetat, air dan hexana untuk mendapatkan pelarut paling sesuai yaitu pelarut yang mampu mengekstrak EPMS terbanyak dalam berat bahan yang sama dan volume pelarut sama. Setelah diperolah pelarut yang sesuai selanjutnya dilakukan Isolasi dengan ekstraksi menggunakan pelarut tersebut pada berbagai suhu yaitu suhu kamar (30 oC), 50 oC, 70 oC, dan 90 o C.Untuk mempertahankan suhu digunakan waterbath dan agar rendaman tidak kehilangan pelarut maka diusahakan tutup yang memungkinkan pelarut yang menguap akan masuk dalam rendaman kembali. Instrumen penelitian melipuli peralatan iolasi yaitu seperangkat alat perkolasi berupa peralatan gelas, alat pemekat berupa Rotary Vacum Evaporator, peralatan gelas untuk kristalisasi dan rekristalisasi, instrumen pengukur Titik leleh dan dilanjutkan dengan instrumen analisis yaitu UV-Vis, GC-MS, IR dan NMR. Data Instrumen senyawa hasil isolasi dibuat tabel dan dibandingkan dengan data instrumen senyawa EPMS murni sebagai pembanding. Data pada optimasi jenis pelarut berupa massa hasil isolasi yang diperoleh untuk tiap jenis pelarut dihitung prosentasenya dengan rumus. Hasil prosentase tertinggi menunjukkan proses ekstraksi untuk senyawa EPMS paling sesuai artinya pelarut tersebut mengekstrak EPMS paling sempurna karena mempunyai kepolaran yang paling mendekati kepolaran EPMS itu sendiri. Hasil dari optimasi ini didapatkan pelarut optimum dan selanjutnya digunakan untuk optimasi suhu. Data pada optimasi suhu dengan menggunakan pelarut terpilih berupa massa hasil isolasi juga dihitung prosentasenya dengan rumus. Hasil prosentase tertinggi menunjukkan bahwa pada suhu tersebut senyawa EPMS terekstrak dengan sempurna, senyawa tidak terurai dan tidak rusak pada suhu tersebut. Hasil dari optimasi ini diperoleh suhu optimum proses ekstraksi EPMS dengan pelarut terpilih. Untuk menafsirkan data instrumen EPMS senyawa hasil isolasi dibandingkan dengan senyawa EPMS murni. Data titik leleh senyawa dikatakan identik bila range titik leleh keduanya sama atau berbeda 0,5-1 oC. Data IR senyawa dikatakan identik bila serapan-serapan pada wilayah panjang gelombang yang sama terhadap sinar infra merah. Data NMR suatu senyawa dikatakan identik bila menghasilkan spektogram yang sama. Data MS suatu senyawa dikatakan identik bila pola fragmentasi keduanya sama. Data UV-Vis senyawa dikatakan identik bila keduanya mempunyai serapan pada wilayah panjang gelombang yang sama. Bab IV. HASIL DAN PEMBAHASAN 4.1. Hasil Penelitian Hasil Pemilihan Pelarut Pada Proses Isolasi EPMS Pada suhu Kamar Jenis Pelarut Heksana Etil Asetat Etanol Aquades Prosentase Hasil Isolasi 2,111% 0,542% 1,434% - 318 Hasil Optimasi Suhu Pada Proses Isolasi EPMS Dengan Pelarut Heksana Suhu Ekstraksi 40oC 50oC 60oC 70oC Prosentase Hasil Isolasi 7,236% 8,873% 8,765% 7,218% Harga Rf Etil p-metoksisinamat dari hasil pemilihan pelarut pada suhu kamar Harga Rf Jenis eluen Heksan : etil asetat = 4:1 Heksan: etil asetat : aseton = 13 : 3 : 1 Heksan : kloroform : As.Asetat Glasial = 5:4:1 Heksana E-Aset Etanol Aquades Stand. 0,65 0,73 0,66 0,72 0,66 0,72 - 0,65 0,73 0,92 0,93 0,93 - 0,93 Harga Rf Etil p-metoksisinamat dari hasil optimasi suhu dengan pelarut heksan Harga Rf 40oC Jenis eluen Heksan : etil asetat = 4:1 0,60 Heksan: etil asetat : aseton 0,63 = 13 : 3 : 1 Heksan : kloroform : As.Asetat 0,90 Glasial = 5:4:1 50oC 60oC 70oC 0,57 0,60 0,57 0,60 0,63 0,63 Stand. EPMS 0,63 0,63 0,85 0,87 0,87 0,87 Titik Leleh EPMS standard adalah 46,5oC Titik Leleh hasil isolasi dengan beberapa pelarut Jenis pelarut Heksan Etil asetat Etanol Air Titik leleh 46,5oC 46,0oC 46,5oC - Titik Leleh hasil isolasi dengan pelarut heksan pada berbagai suhu Suhu ekstraksi 40oC 50oC 60oC 70oC Titik leleh 46,0oC 46,5oC 46,0oC 46,5oC 319 4.2. Pembahasan Hasil Penelitian Hasil pemilihan pelarut dalam penelitian ini terlihat bahwa heksan lebih sesuai hal ini ditunjukkan oleh prosentase hasil yang lebih besar dibandingkan dengan pelarut lain pada suhu kamar. Kenyataan ini menunjukkan bahwa kepolaran EPMS lebih mendekati heksan karena dalam EPMS ada dua gugus yang mendukung sifat nonpolar yaitu gugus eter dan lingkar benzen, sedang gugus yang mendukung ke arah polar hanya satu yaitu adanya karbonil dalam gugus ester. Hasil optimasi suhu menunjukkan bahwa suhu optimum dalam isolasi menggunakan pelarut terpilih yaitu heksan adalah 50oC. Kenyataan ini memberikan gambaran jelas bahwa proses pelarutan EPMS dalam heksan tergolong endoterm yaitu memerlukan kalor dimana kenaikan kalor pada proses ekstraksi diikuti dengan kenaikan prosentase hasil isolasi. Pada suhu diatas 50oC terjadi penurunan hasil isolasi disebabkan karena EPMS yang telah terekstrak sebagian mengalami penguraian struktur karena pemanasan. Hasil Analisa kemurnian dengan penentuan titik leleh menunjukkan angka mendekati titik leleh EPMS standard yaitu 46,5oC, dengan demikian maka dapat dikatakan bahwa hasil isolasi telah murni dan senyawa yang diperoleh benar EPMS selanjutnya siap untuk dilakukan analisis lebih lanjut. Dari Uji KLT dengan berbagai komposisi dan jenis pelarut pengembang menunjukkan bahwa hasil RF tidak berbeda dengan senyawa EPMS standard pada pelarut pengembang yang sama, hal ini menunjukkan bahwa benar hasil yang kita dapat dalam isolasi ini adalah EPMS Analisa IR yang dilakukan terhadap senyawa hasil isolasi dibandingkan dengan EPMS standard ternyata terdapat kemiripan lebih dari 98%, hal ini memberikan informasi bahwa hasil isolasi identik dengan EPMS standard. Bab V. KESIMPULAN DAN SARAN 5.1. Kesimpulan 1. Pelarut yang paling sesuai dalam penelitian ini adalah Heksan 2. Suhu optimum proses pelarutan EPMS dalam heksan adalah 50oC 5.2. Saran Dari hasil isolasi EPMS dengan heksan ternyata lebih efektif pada suhu di atas suhu kamar berarti terdapat penambahan kalor selama proses ekstraksi. Heksan merupakan pelarut yang mudah terbakar maka sebaiknya melakukan pemanasan dengan pemanas yang sekaligus dapat mengontrol suhu yaitu hot plate jangan sekali-kali menggunakan kompor listrik yang pemanasannya tak terkendali. 320 DAFTAR PUSTAKA Afriastini. JJ., 1990, Bertanam Kencur, Cetakan V, Jakarta:PT. Penebar Swadaya , hal 3 Adams S. R, Jonhson J.R, Wilcox C.F, 1970, Laboratory Experimens Inorganic Chemistry, 6th edition, The Macmilam Company, London, p.76-78 Anonimus, 1987, Programme and Abstracts Handbook Unesco Sub-Regional Seminar/Workshoop on Trasnformation and synthesis Related to Natural Products, organized by Airlangga University and Sepuluh Nopember Institute of Technology with The Sponsorship of Unesco, p. 27-28 Crabtree, R H., 1992, The Organometallic Chemistry Of The Transition Metals, second edition, A Wiley-Interscience Publication, John Wiley & Sons, New York Cumpelik, B.M.,1972, Analitycal Procedures and Evaluation Of Sunscreen, J.Soc. Cosmet. Chemist, 2, 333-345. Fessenden, RJ., 1994, Kimia Organik, edisi ketiga, (alih bahasa oleh A. Hadyana Pudjaatmaka), Jakarta ; Penerbit Erlangga, Hal 86 Harrwood, Laurence M., Moody, Christoper S., 1989, Experimental Organic Chemistry, Principles and Practice, Blacwell Sciencetific Publication, London. Harry R.G., 1982, Harry’s Cosmeticology, 6 th edition, The Principle and Practice Of Modern Cosmetic, Leonard Hill Book, London Hidayati N., 1997, Sintesa Oktil p-metoksisinamat dan etil heksil pmetoksisinamat dari etil p-metoksisinamat Hasil Isolasi Rimpang Kencur (Kaempferia Galanga L), Tesis, Universitas Airlangga, Surabaya Hery Suwito, Mulyadi Tanjung, Sri Sumarsih, Nanik Siti Aminah, Sofiyan Hadi, 1994, Sintesis Beberapa Deret Homolog Turunan Ester pmetoksisinamat dengan bahan baku Kaempferia galanga OPF Lembaga Penelitian Unair. Kreps, S.I., Goldenberg, 1972, Suntan Preparation in Balsam MS, Cosmetic Sciense and Technology,2nd ed, John Wiley & Sons, Inc, 241-305. Kusumaningati S., 1994, Kaempferia Galanga L dalam Jamu, makalah pada seminar Nasional Tanaman Obat Indonesia VI , Bandung. 321 Norman R O C. 1978 Principles Of Organic Synthesis, second edition, A Halsted Press Book, John Wiley & Sons, New York. Shaath N.A., 1990, Sunscreens, Development, Evaluation, and Regulatory Aspects, Marcel Dekker, INC, New York. Sudjadi, 1986, Metode Pemisahan, cetakan I, Kanisius , Jogyakarta, halaman 167177. Dan halaman 74 Soeratri W., 1993, Studi Proteksi Radiasi UV sinar Matahari Tahap 1 : Studi Efektivitas Protektor Kimia , Lembaga Penelitian Universitas Airlangga. Tanjung M , 1997, Dari Isolasi Dan Rekayasa Senyawa Turunan Sinamat Kaempferia Galanga L Sebagai Tabir Surya, Lembaga Penelitian Universitas Airlangga. Vogel A.I, 1978 Vogel’s Text Book Of Practical Organic Chemistry, Ebflish Language Book Society Longman, London p-1078. Wahjo Dyatmiko, Mulya H.S, Achmad Fuad, Anik SB (1995) , Validasi Analisis etyl p-metoksisinamat secara densitometer dalam standarisasi produk jadi yang mengandung ekstrak etanol dari rimpang kencur (Kaempferia Galanga L), Laporan Penelitian SPP/DPP Lembaga Penelitian Unair. 322 SINTESIS ETIL P-METOKSISINAMIL P-METOKSISINAMAT HASIL ISOLASI RIMPANG KENCUR ( Kaempferia Galanga L.) Titik Taufikurohmah, Nita Kusumawati ABSTRAK Etil p-metoksisinamat (EPMS) adalah salah satu senyawa hasil isolasi rimpang kencur (Kaempferia Galanga L) yang merupakan bahan dasar senyawa tabir surya yaitu pelindung kulit dari sengatan sinar matahari.EPMS sebagai senyawa tabir surya dipandang masih kurang bagus karena saat terhidrolisa akan melepaskan etanol hal ini dapat menyebabkan karsinogenik, selain dari itu juga kelarutan senyawa ini dalam air cukup tinggi sehingga perlu perubahan senyawa EPMS menjadi ester dengan rantai yang lebih panjang yang lebih nonpolar dan tidak karsinogenik melalui sintesis. Metode yang digunakan dalam penelitian ini adalah sintesis bertahap dan transesterifikasi. Hasil sintesis secara bertahap dimana sebagian EPMS dirubah menjadi alkohol dan yang lain dirubah menjadi asam yaitu APMS. kedua senyawa direaksikan menghasilkan ester baru yaitu etil p-metoksisinamil p-metoksisinamat sebanyak 49,9%. Sintesis melalui transesterifikasi untuk mendapatkan ester yang sama maka persen hasil yaitu 70,23% Analisa kemurnian senyawa EPMS dengan penentuan titik leleh diperoleh harga 46,5oC, 46 oC dan 46,5oC ( tiga kali pengukuran) sedangkan ester hasil sintesis mempunyai titik leleh 187 oC dan 188oC ( dua kali pengukuran) Analisa kemurnian menggunakan KLT diperoleh beberapa data dengan fasa pengembang yang berbeda-beda sebagai berikut : Senyawa Pengembang-1 Pengembang-2 Pengembang-3 Pengembang-4 EPMS 0,86 0,65 0,67 0,56 Hasil sintesis 0,80 0,73 0,56 0,51 Bab 1. Pendahuluan Indonesia merupakan negara dengan iklim tropik di mana sinar matahari menyinari wilayah Indonesia sepanjang tahun. Sinar matahari merupakan sumber kehidupan bagi makhluk yang tinggal di bumi ini. Banyak manfaat yang dapat diambil dari kehadiran matahari, namun ada juga yang kurang menguntungkan yaitu sengatan panasnya matahari yang dapat membakar kulit terutama sinar UV. Untuk mengurangi sengatan sinar UV ini dapat digunakan pelindung misalnya berteduh atau memakai payung, namun dalam beberapa hal keduanya tak mungkin dilakukan misalnya pada saat harus keluar rumah dan beraktifitas. Menggunakan lotion pelindung matahari adalah solusi yang tepat dan mudah dilakukan. Tanaman kencur (Kaempferia Galanga L) telah lama digunakan oleh nenek moyang dalam campuran bedak yaitu bedak dingin beras kencur yang dapat mengurangi sengatan sinar matahari dan memberikan rasa sejuk pada permukaan kulit. Penelitian telah membuktikan kebenaran pengalaman nenek moyang bahwa dalam tanaman kencur memang mengandung senyawa tabir surya yaitu etil pmetoksisinamat.(Hidayati, 1997) 323 Etil p-metoksisinamat (EPMS) adalah salah satu senyawa hasil isolasi rimpang kencur (Kaempferia Galanga L) yang merupakan bahan dasar senyawa tabir surya yaitu pelindung kulit dari sengatan sinar matahari. Senyawa tabir surya terutama yang berasal dari alam dirasa sangat penting saat ini dimana tidak hanya wanita saja yang memerlukan perlindungan kulit akan tetapi priapun memerlukan tabir surya untuk melindungi kulit agar tidak coklat atau hitam tersengat sinar matahari. Kulit dengan perlindungan akan tampak lebih baik dalam hal warna yaitu akan terlihat lebih bersih dan lebih putih. EPMS merupakan senyawa aktif yang ditambahkan pada lotion kulit ataupun pada bedak setelah mengalami sedikit modifikasi yaitu perpanjangan rantai dimana etil dari ester ini digantikan oleh oktil, etil heksil atau heptil melalui transesterifikasi maupun esterifikasi bertahap. Modifikasi yang dilakukan diharapkan mengurangi kepolaran EPMS sehingga kelarutannya dalam air berkurang yang merupakan salah satu syarat senyawa sebagai tabir surya. Selain dari itu juga untuk mengurangi tingkat bahaya terhadap kulit, EPMS bila terhidrolisa akan melepaskan etanol yang bersifat karsinogenik terhadap kulit sedangkan hasil modifikasinya akan melepaskan alkohol dengan rantai lebih panjang yang tidak berbahaya. Berdasarkan sintesis yang telah dilakukan oleh para peneliti terdahulu terhadap hasil isolasi rimpang kencur yang berupa EPMS, telah dilakukan penggantian gugus etil pada EPMS dengan alkyl yang lebih panjang dengan harapan mengurangi kelarutannya dalam air, maka kemudian akan dicoba untuk melakukan pengembangan sintesis EPMS dimana etil dalam EPMS digantikan oleh alkyl yang terbentuk dari EPMS itu sendiri. Dengan menggunakan Litium Aluminium Hidrida (LAH), EPMS dapat dirubah menjadi alkohol, yaitu melalui reaksi reduksi. Esterifikasi bertahap telah dilakukan untuk ester yang meruang seperti di atas, yaitu dengan melalui tahap pembentukan asam dari EPMS yang diikuti pembentukan asil (senyawa intermediet yang reaktif) dengan tionil klorida sedangkan metode transesterifikasi belum pernah dicoba. Dengan melalui transesterifikasi maka penggunaan tionil klorida dapat dihindari karena bahan ini termasuk bahan yang sulit masuk ke dalam negeri saat ini. Transesterifikasi merupakan pilihan yang diharapkan dapat menyiasati keadaan, namun kendala yang mungkin timbul adalah sulitnya mempertemukan dua substituen yang sama-sama meruang yaitu alkohol dari EPMS dan EPMS itu sendiri. Metode yang digunakan dalam penelitian ini adalah transesterifikasi yang memiliki tahap reaksi yang lebih singkat. Langkah-langkah yang ditempuh meliputi: isolasi EPMS dari rimpang kencur, reduksi EPMS menjadi alkoholnya dan mensintesis menjadi ester yang lebih panjang. Metode ini lebih singkat dibanding esterifikasi bertahap yang perlu pembentukan asam dan asil dari EPMS. Dengan rantai dan sistim konjugasi yang lebih panjang diharapkan senyawa produk hasil reaksi ini dapat berfungsi lebih baik sebagai tabir surya karena kelarutan dalam air menurun dan dengan ikatan rangkap terkonjugasi yang lebih banyak kemampuan menyerap sinar UV juga makin besar. Berdasarkan latar belakang sintesis senyawa-senyawa turunan sinamat tersebut diatas maka dirumuskan permasalahan sebagai berikut: 1. Berapa rendemen Etil p-metoksisinamil p-metoksisinamat hasil sintesis EPMS melalui reaksi bertahap? 324 2. Berapa rendemen Etil p-metoksisinamil p-metoksisinamat hasil sintesis EPMS melalui transesterifikasi? Bab 2. Tinjauan Pustaka 2.1. Tinjauan Tentang Tabir Surya. Tabir surya adalah suatu senyawa yang digunakan untuk menyerap secara efektif sinar matahari terutama daerah emisi gelombang UV sehingga dapat mencegah gangguan pada kulit akibat pancaran secara langsung sinar UV tersebut (Kreps,1972). Sinar matahari yang membahayakan kulit adalah radiasi ultraviolet dimana sinar ini dibedakan menjadi tiga, yaitu sinar ultraviolet A (UV-A), UV-B dan UV-C yang ketiganya mempunyai panjang gelombang dan efek radiasi yang berbeda. Sinar UV-A dengan panjang gelombang 320-400 nm mempunyai efek penyinaran, dimana timbul pigmentasi yang menyebabkan kulit berwarna coklat kemerahan. Sinar UV-B dengan panjang gelombang 290-320 nm memiliki efek penyinaran, dapat mengakibatkan kanker kulit bila terlalu lama terkena radiasi. Sedangkan Sinar UV-C dengan panjang gelombang 200-290 nm yang tertahan pada lapisan atmosfer paling atas dari bumi dan tidak sempat masuk ke bumi karena adanya lapisan ozon, efek penyinarannya paling kuat karena energi radiasinya paling tinggi diantara ketiganya yaitu dapat menyebabkan kanker kulit dengan penyinaran yang tidak lama (Harry, 1982). Berbagai jenis rempah-rempah diantaranya kencur (Kaempferia galanga) selain digunakan sebagai bumbu dapur juga dapat digunakan sebagai obat-obatan tradisional karena khasiatnya dapat juga digunakan menjaga kesehatan dan dapat menyembuhkan berbagai penyakit, antara lain sebagai penimbul rasa hangat, analgesik, penyembuh bengkak-bengkak, obat batuk, penambah nafsu makan dan lain-lain (Kusumaningati, 1994). 2.2.Tinjauan Tentang Tanaman Kencur (Kaempferia galanga L) Tanaman kencur mempunyai klasifikasi sebagai berikut: termasuk dalam divisi Spermatophyta, sub divisi Angiosperma, kelas Monocotyledoneae, bangsa Scitamineae, suku jahe-jahean (Zingiberaceae), marga Kaempferia, dan jenis Kaempferia galanga L, dengan nama lokal (Jawa) adalah kencur. Rimpang tanaman ini banyak digunakan sebagai bumbu masak, dan bahan bobok tradisional, baik digunakan sendiri maupun bersama rempah yang lain. Campuran dari rempah kencur dengan tanaman lain dapat digunakan sebagai obat luar yang bersifat analgesik, antipiritik, anti inflamasi dan anti mikroba. Kencur juga digunakan sebagai bahan kosmetik yaitu dalam ramuan tradisional bedak dingin beras kencur (Kusumaningati, 1994). Kandungan senyawa kimia dari rimpang kencur (menurut J.J. Afriastini, 1990) antara lain minyak atsiri berupa sineol sebanyak 0.02%, asam metil kanil, pentadekana, ester etil sinamat, asam sinamat, borneol, kamfena, paraeumarina, asam anisat, alkaloid, gom mineral sebanyak 13.7% dan pati 4.14%. Kandungan minyak atsiri dalam rimpang kencur yaitu 2-4% yang terdiri dari etil sinamat, etil pmetoksisinamat, p-metoksi stirena, n-pentadekana, borneol, kamfen, 3,7,7-trimetil bisiklo [4,1,0] hept-3-ena (Didik, dkk, 1989). 325 2.3.Tinjauan Tentang EPMS Dan Isolasi Etil P-metoksisinamat Etil p-metoksisinamat merupakan kandungan terbesar dari rimpang kencur dengan rumus struktur sebagai berikut : CH3 O 4 CH3 H Gambar1. Rumus struktur EPMS Rumus molekul EPMS adalah C 12H13O3 , dengan berat molekul 205. Senyawa ini berbentuk kristal jarum tidak berwarna, dengan titik lebur antara 47-48 o C (Tanjung, 1997). Penelitian terdahulu terhadap EPMS memberikan data sebagai berikut: identifikasi EPMS dengan spektrofotometer UV-Vis memberikan puncak serapan maksimum dalam etanol pada panjang gelombang 225 dan 307 nm. Analisis spektrofotometer IR memberikan puncak serapan pada bilangan gelombang (cm-1) 3000 ; 2910 ;1635;1600 ;1570;1510 ;1185;1035 ; 835. Analisis spektrofotometer massa memberikan massa molekul (Mr = 206) dengan pola fragmentasi m/z: 191, 178, 161, 147, 134, 118, 103, 90, 81, 77, 63, 51 dan 39 (Tanjung, 1997). Isolasi etil p-metoksisinamat dari rimpang kencur dimulai dengan ekstraksi simplisia rimpang kencur dengan cara perkolasi pada suhu kamar, yaitu dengan cara merendam serbuk kering rimpang kencur dalam etanol 96% sebanyak 3-5 kali berat bahan selama 24 jam dalam perkolator dan diikuti perkolasi yang semuanya dilakukan 3 kali atau sampai didapat perkolat dengan warna kuning muda. Selanjutnya perkolat yang dihasilkan dikumpulkan dan diuapkan pelarutnya menggunakan rotary vacuum evaporator agar didapat perkolat yang kental. Setelah itu dengan penangas es perkolat kental tersebut didinginkan sampai terbentuk kristal yang masih kotor. Selanjutnya kristal yang terbentuk dicuci dengan etanol dan dilakukan rekristalisasi dengan metanol, atau etanol-air. 2.4.Tinjauan Tentang Esterifikasi Esterifikasi bertahap merupakan reaksi pembentukan ester dari suatu asam karboksilat dengan alkohol melalui suatu senyawa antara yaitu asil halida (Fessenden, 1990). Penelitian yang pernah dilakukan dengan metode ini adalah melalui tahapan sebagai berikut : hidrolisis etil p-metoksisinamat menjadi asam pmetoksisinamat, asam p-metoksisinamat yang terbentuk direaksikan dengan SOCl2 membentuk senyawa asil klorida. Selanjutnya senyawa asil klorida yang terbentuk direaksikan dengan n-oktanol membentuk oktil p-metoksisinamat. Mekanisme reaksi ini dapat dilihat pada gambar 2.6.2 ( Hidayati, 1997 ) 326 CH3 O CH3 O Hidrolisis OH APMS C2H 5 EPMS + SOC1 2 CH 3 CH3 O HC1 + SO OH CH3 CH3 C8H17OH + Gambar 2.6.2 Reaksi sintesis oktil p-metoksisinamat dengan pereaksi COCl2 Reaksi transesterifikasi merupakan salah satu mekanisme pembentukan ester dari suatu ester lain. Reaksi umum dari reaksi trasesterifikasi adalah sebagai berikut ( Fessenden, 1990 ; Morrison and Boyd, 1989 ). O R C O H’ atau OR’ + R”O - OH R OR’ C + R’ O H OR’ Reaksi transesterifikasi dikatalisis oleh suatu asam misalnya H2 SO4 atau HCl kering dan dapat pula dikatalisa oleh suatu basa yang biasanya berupa ion alkoksida. Mekanisme reaksi transesterifikasi yang dikatalisis oleh suatu asam adalah sebagai berikut ( Morrison and Boyd, 1989 ). R C OR’ Ester A OH R C OR’ + R”OH Alkohol B 327 OH R C OR’ OR ” OH OH R C OR’ H OR ” R + R’OH O RC OR” Ester B C OR ” O H+ Gambar 2.6.3a. Reaksi transesterifikasi dengan katalis asam Mekanisme reaksi transesterifikasi yang dikatalis oleh basa adalah sebagai berikut ( Morrison and Boyd, 1989 ). O OH RC OR” OR ” + OR” RC OR ” Ester A Alkoksida B OH + OR” RC OR ” Ester B Alkoksida A Gambar 2.6.3b. Reaksi transesterifikasi dengan katalis basa Transesterifikasi merupakan suatu reaksi kesetimbangan, agar kesetimbangan reaksi bergeser ke kanan maka dapat dilakukan dengan menggunakan alkohol berlebih atau dengan segera memisahkan hasil reaksi dari sistem. Cara yang lebih mudah untuk menggeser reaksi ke kanan adalah dengan alkohol berlebih ( Morrison and Boyd, 1989 ). Bab 3. Metode Penelitian 3.1. Prosedur Penelitian a. Isolasi etil p-metoksi sinamat ( EPMS ) dari rimpang kencur Rimpang kencur dicuci dengan air hingga bersih, ditiriskan lalu diiris-iris tipis agar mudah kering. Selanjutnya dikeringkan dengan sinar matahari tidak langsung, setelah kering dihaluskan menjadi serbuk dan direndam dalam perkolator dengan etanol 96 % selama 24 jam. Cairan perkolat ditampung dalam erlenmeyer dan residu direndam lagi sampai beberapa kali hingga diperoleh perkolat yang warnanya kuning pucat dengan total perkolat 5 liter tiap kg serbuk. Perkolat selanjutnya dipekatkan dengan rotary vacuum evaporator hingga diperoleh larutan pekat yang selanjutnya didinginkan dalam penangas es hingga terbentuk kristal. Kristal yang didapat masih kotor dan 328 dicuci dengan etanol sedikit saja lalu direkristalisasi dengan metanol hingga didapat kristal jarum EPMS yang tidak berwarna. b. Hidrolisis etil p-metoksi sinamat Hidrolisis dilakukan dengan mereaksikan EPMS dari hasil isolasi rimpang kencur dengan KOH dalam alkohol, selanjutnya garam yang terbentuk dilarutkan dalam air dan diasamkan dengan HCl pekat dengan prosedur sbb : Sebanyak 0,146 mol atau 30 g EPMS dilarutkan dalam 60 mL etanol dan dimasukkan ke dalam labu alas bulat. Ke dalam labu tersebut dimasukkan pula 300 ml larutan KOH dalam alkohol 5%. Campuran tersebut direfluks selama 2 jam di atas penangas air. Campuran didinginkan dan kristal Kalium p-metoksisinamat yang terbentuk disaring dengan corong Buchner. Garam ini selanjutnya dilarutkan dalam 150 ml air dan diasamkan dengan 30 ml HCl pekat. Endapan yang terbentuk disaring serta dicuci dengan air 3 kali. Asam p-metoksisinamat yang terbentuk ini direkristalisasi dengan menggunakan campuran etanol air 7 : 3 sehingga diperoleh kristal tidak berwarna. Selanjutnya dilakukan identifikasi terhadap asam p-metoksisinamat hasil transformasi ini. c. Pembentukan Asil klorida Ke dalam labu alas bulat berleher tiga yang bebas air pada masing-masing mulut tabung dipasang termometer, refluks pendingin, dan corong pisah. Selanjutnya dimasukkan 0,05 mol atau 9 g asam p-metoksisinamat dan 30 ml CHCl 3 sehingga terbentuk suspensi . Corong pisah dimasukkan perlahan-lahan 0,203 mol atau 18 ml tionil klorida yang sebelumnya telah dikeringkan dengan Na 2SO4 anhidrat. Campuran dibiarkan pada suhu kamar selama 15 menit agar campuran bereaksi. Selanjutnya labu dipanaskan selama 3 jam sambil diaduk dengan pengaduk magnet pada suhu 40-50 o C sampai cairan berwarna hijau muda. Kelebihan tionil klorida serta gas-gas yang terbentuk selama proses reaksi dihilangkan dengan mengalirkan ke dalam larutan KOH alkoholis 5%. Sisa gas yang terbentuk dihilangkan sekali lagi dengan menguapkan labu di atas penangas air. Senyawa yang terbentuk ini tanpa dilakukan identifikasi karena tidak stabil dan merupakan senyawa antara yang selanjutnya akan direaksikan dengan EPMS yang telah mengalami transformasi menjadi alkohol . d. Pembentukan Alkohol EPMS 0,05 mol (9g) dimasukkan ke dalam labu leher tiga yang sebelumnya dialiri gas nitrogen agar sistim bebas dari udara luar yang mengandung uap air. Tetrahidrofuran ditambahkan sebagai pelarut dari EPMS sebanyak 50 ml ke dalam labu tersebut dengan kedua lubang tertutup. Pereaksi LAH ditambahkan secara berlebih yaitu 0,15 mol dan dilakukan pengadukan berupa penggoyangan pada penangas es selama 18 jam agar reaksi berlangsung sempurna. Kemudian ditambahkan air tetes demi tetes sampai terbentuk masa endapan yang stabil, selanjutnya endapan disaring dan filtrate dipisahkan, dikeringkan dengan Na2SO 4 anhidrat. Pelarut diuapkan dengan evaporator dan residu dimurnikan dengan cara destilasisederhana menghasilhan hasil reaksi murni. Hasil reaksi selanjutnya diidentifikasi apakah benar alkohol. e. Reaksi Sintesis Bertahap Alkohol yang telah terbentuk dimasukkan ke dalam erlenmeyer untuk selanjutnya tetes demi tetes ke dalam erlenmeyer tersebut dimasukkan pula asil klorida 329 yang suhunya 50 oC. Campuran selanjutnya didinginkan di dalam penangas es sambil diaduk-aduk. Campuran ini dibiarkan selama satu malam pada suhu kamar. Sisa bahanbahan dan gas dihilangkan dengan cara penguapan dan kemudian didinginkan sampai diperoleh kristal. Kristal yang diperoleh dimurnikan dengan cara rekristalisasi dengan pelarut campuran metanol-air. Selanjutnya dilakukan identifikasi terhadap hasil reaksi. f. Reaksi Transesterifikasi Sebanyak 9 gram ( 0,5 mol) EPMS dimasukkan ke dalam beker glass 400 ml dilarutkan dengan 10 ml etanol selanjutnya diasamkan dengan H2SO4 pekat sebanyak 5 ml. Dalam beker glass yang lain disiapkan alkohol hasil reduksi EPMS sebanyak 8 g (0,5 mol), ditambahkan etanol sebanyak 10 ml sebagai pelarut dan KOH sebagai suasana basa kedua senyawa selanjutnya dimasukkan ke dalam labu bulat dan dibiarkan sejenak sambil pengaduk magnet dinyalakan. Reaksi dipanaskan pada suhu 70o selama 18 jam, sebelum reaksi berakhir suhu dinaikkan sampai 80 o C untuk menguapkan pelarut dan hasil samping yaitu etanol. 3.2. Analisis Hasil Penelitian Hasil isolasi maupun hasil sintesis dilakukan uji kemurnian dengan uji titik lebur dan uji Rf dengan berbagai komposisi dan jenis pelarut. Analisis senyawa hasil isolasi maupun hasil sintesis menggunakan peralatan sebagai berikut : 1. UV-Vis Spektrofotometer Simatzu Recording Spektrometer UV-260 2. Infra Red Spektrometer JASCO-FTIR-530 3. Spektrometer RMI (NMR) 1H NMR VARIAN INOVA 400 MHz Spektrometer Massa HP 6890. LC-MS Bab 4. Hasil Dan Pembahasan 4.1. Hasil Penelitian 4.1.1. Hasil Isolasi Rimpang Kencur (EPMS) Sebanyak 15 kg kencur segar yang dibuat simplisia dan dihaluskan menghasilkan 2605 g serbuk kering. Serbuk direndam dengan alcohol selama 24 jam kemudian diperkolasi menghasilkan perkolat berwarna coklat kekuningan sampai kuning muda diperlukan seluruhnya 22,5 liter alcohol. Selanjutnya dipekatkan dengan Rotary Vacuum evaporator sehingga didapat cairan pekat yang menghasilkan kristal kotor saat didinginkan dalam penangas es. Kristal kotor yang diperoleh sebanyak 210 g. Kristal kotor ini selanjtnya direkristalisasi dengan metanol yang menghasilkan 56,6 g kristal murni. Rendemen yang diperoleh adalah : 56,5/2605 x 100% = 2,2% 4.1.2. Hasil Sintesis Dengan Esterifikasi Bertahap Sebanyak 9 gr material awal yang berupa EPMS telah dilakukan perubahan bentuk dari ester menjadi alkohol dengan LAH. Dari reduksi ini didapat alkohol sebanyak 4,51 gr sehingga persen hasil dapat dihitung sebagai berikut : 4,51/9 x 100% = 50% Sebanyak 9 gr material awal yang berupa EPMS telah pula dilakukan perubahan bentuk dari ester menjadi asam yaitu A-PMS dengan KOH. Dari reaksi ini diperoleh asam sebanyak 8,10g sehingga diperoleh persen hasil : 330 8,10/9 x 100% = 90 % seluruh asam yang terbentuk selanjutnya dirubah menjadi asil klorida dengan tionil klorida, senyawa ini merupakan bentuk intermediet sehingga tidak mungkin mengisolasinya dan mengetahui persen hasilnya. Selanjutnya segera direaksikan antara asil dan alkohol di atas membentuk ester. Dari proses sintesis ini didapat 2,25 g ester sehingga rendemen sintesis dengan metode bertahap dapat dihitung sebagai berikut : 2,25/4,51 x 100% = 49,9% Material awal dalam sintesis ini sebanyak 4,51 yaitu pereaksi pembatasnya atau pereaksi yang paling kecil, dan asam sebagai pereaksi berlebih agar reaksi berjalan ke arah kanan yaitu kearah hasil reaksi. 4.1.3. Hasil Sintesis Dengan Metode Transesterifikasi Sebanyak 9 g EPMS dirubah bentuknya menjadi alkohol dengan pereaksi LAH. Dalam reaksi ini diperoleh alkohol sebanyak 5,98g, persen hasil dapat dihitung sebagai berikut : 5,98/9 x 100% = 66,44% Alkohol ini selanjutnya direaksikan dengan EPMS sebanyak 9 g, dalam hal ini alkohol adalah pereaksi pembatas dan dianggap sebagai material awal sintesis, sedangkan EPMS adalah pereaksi berlebihnya. Dalam reaksi ini diperoleh hasil sebanyak 4,2 g sehingga rendemen adalah : 4,2/5,98 x 100% = 70,23% 4.1.4 .Hasil Analisis Analisa kemurnian senyawa EPMS dengan penentuan titik leleh diperoleh harga 46,5oC, 46 oC dan 46,5oC ( tiga kali pengukuran) sedangkan ester hasil sintesis mempunyai titik leleh 187 oC dan 188oC ( dua kali pengukuran) Analisa kemurnian menggunakan KLT diperoleh beberapa data dengan fasa pengembang yang berbeda-beda sebagai berikut : Senyawa Pengembang-1 Pengembang-2 Pengembang-3 Pengembang-4 EPMS 0,86 0,65 0,67 0,56 Hasil sintesis 0,80 0,73 0,56 0,51 Hasil Analisa Instrumen UV-Vis, IR, NMR dan MS terlampir dalam lampiran. 4.2. Pembahasan Hasil Penelitian Dari hasil isolasi rimpang kencur dengan menggunakan etanol sebagai pelarut diperoleh rendemen sebanyak 2,2%, padahal EPMS termasuk senyawa dominan dari tanaman kencur seharusnya didapat lebih banyak lagi. Dengan melihat kepolaran EPMS dimana pendukung sifat nonpolarnya yaitu gugus eter dan gugus benzen, sedangkan penyumbang sifat polarnya hanya gugus karbonil, kemungkinan senyawa EPMS lebih maksimal diisolasi menggunakan pelarut yang lebih nonpolar misalnya heksan atau petroleum eter. Dengan memperhatikan hukum kelarutan, dimana kelarutan zat akan meningkat dengan kenaikan suhu. Rendemen EPMS dapat ditingkatkan dengan kenaikan suhu karena terbukti proses pengkristalannya terjadi dalam penangas es artinya pada suhu rendah. Jadi pada suhu rendah kelarutan turun, sehingga pada suhu tinggi kelarutan naik ini menunjukkan bahwa EPMS juga seperti senyawa pada umumnya yang proses pelarutannya bersifat endotermis yaitu memerlukan kalor. Dari hasil sintesis secara bertahap diperoleh rendemen sebanyak 49,9% sedangkan dengan metode transesterifikasi diperoleh rendemen sebanyak 70,23%, hal ini tidak sesuai dengan literatur dimana untuk ester rantai panjang biasanya lebih 331 dianjurkan dengan metode bertahap dimana melalui pembentukan asil yaitu senyawa antara yang reaktif. Namun perlu diingat bahwa hasil samping yaitu etanol dari EPMS dalam transesterifikasi adalah senyawa yang mudah menguap, dan pemanasan dalam hal ini ikut membantu proses penguapan etanol tersebut maka hal ini ikut mendorong arah reaksi terus berjalan ke kanan yaitu ke arah hasil reaksi. Transesterifikasi yang dilakukan dengan sistem terbuka juga ikut membantu proses penguapan hasil reaksi yang berupa etanol, sedangkan reaksi bertahap sistemnya tertutup sehingga ester yang telah terbentuk diserang lagi oleh etanol hasil reaksi yang tidak segera terpisah, sehingga reaksi bolak-balik ini terus berjalan sampai pada saat tabung terbuka untuk menguapka etanol hasil reaksi. Hasil Spektra UV-Vis menunjukkan adanya kenaikan serapan pada wilayah yang lebih tinggi energinya untuk senyawa hasil sintesis, hal ini memberikan informasi bahwa hasil sintesis lebih efektif sebagai senyawa tabir surya. Dari Spektra IR yang hampir mirip keduanya namun dibedakan dengan lebih tajam dan tingginya puncak menunjukkan terjadinya peningkatan jumlah ikatan yang ada tetapi masih identik karena dalam hal ini terjadi pengulangan karena ester yang baru merupakan penggabungan dua molekul EPMS dengan gugus fungsi yang sama tapi intensitas berbeda yaitu dua kali semula. Spektra H-NMR memberikan informasi tentang rangkaian proton-proton yang ada dimana untuk proton yang sejenis terjadi peningkatan intensitas ditandai dengan tingginya integral spektra. Spektra MS memberikan pola fragmentasi yang identik antara EPMS dan Ester hasil sintesis, hal ini menunjukkan bahwa keduanya tersusun dari fragmen masa yang sama dan ester baru mempunyai massa yang lebih tinggi yaitu hampir dua kali EPMS namun tidak nampak pada spektra, hal ini menandakan bahwa senyawa kurang stabil dalam bentuk gas atau senyawa sudah mengalami penguraian saat berubah fasa. Bab 5. Kesimpulan Dan Saran 5.1. Kesimpulan Kesimpulan yang dapat diambil dalam penelitian ini adalah sebagai berikut : 1. Rendemen Sintesis Etil p-metoksisinamil p-metoksisinamat dengan metode bertahap diperoleh rendemen sebanyak 49,9% 2. Rendemen Sintesis Etil p-metoksisinamil p-metoksisinamat dengan metode Transesterifikasi diperoleh rendemen sebanyak 70,23 % 5.2. Saran Saran untuk penelitian selanjutnya adalah sebagai berikut : 1. Perlu dilakukan pemilihan pelarut yang sesuai untuk proses ekstraksi pada isolasi EPMS dari rimpang kencur, disarankan untuk memilih pelarut yang lebih nonpolar misalnya heksan. 2. Perlu dilakukan optimasi suhu untuk proses isolasi, karena pada umumnya kenaikan suhu akan mempercepat proses pelarutan dan sekaligus meningkatkan jumlah kelarutan zat. 332 DAFTAR PUSTAKA Afriastini. JJ., 1990, Bertanam Kencur, Cetakan V, Jakarta:PT. Penebar Swadaya , hal 3 Adams S. R, Jonhson J.R, Wilcox C.F, 1970, Laboratory Experimens Inorganic Chemistry, 6th edition, The Macmilam Company, London, p.76-78 Anonimus, 1987, Programme and Abstracts Handbook Unesco Sub-Regional Seminar/Workshoop on Trasnformation and synthesis Related to Natural Products, organized by Airlangga University and Sepuluh Nopember Institute of Technology with The Sponsorship of Unesco, p. 27-28 Crabtree, R H., 1992, The Organometallic Chemistry Of The Transition Metals, second edition, A Wiley-Interscience Publication, John Wiley & Sons, New York Harry R.G., 1982, Harry’s Cosmeticology, 6 th edition, The Principle and Practice Of Modern Cosmetic, Leonard Hill Book, London Hidayati N., 1997, Sintesa Oktil p-metoksisinamat dan etil heksil p-metoksisinamat dari etil p-metoksisinamat Hasil Isolasi Rimpang Kencur (Kaempferia Galanga L), Tesis, Universitas Airlangga, Surabaya Fessenden, RJ., 1994, Kimia Organik, edisi ketiga, (alih bahasa oleh A. Hadyana Pudjaatmaka), Jakarta ; Penerbit Erlangga, Hal 86 Hery Suwito, Mulyadi Tanjung, Sri Sumarsih, Nanik Siti Aminah, Sofiyan Hadi, 1994, Sintesis Beberapa Deret Homolog Turunan Ester p-metoksisinamat dengan bahan baku Kaempferia galanga OPF Lembaga Penelitian Unair. Kusumaningati S., 1994, Kaempferia Galanga L dalam Jamu, makalah pada seminar Nasional Tanaman Obat Indonesia VI , Bandung. Norman R O C. 1978 Principles Of Organic Synthesis, second edition, A Halsted Press Book, John Wiley & Sons, New York. Shaath N.A., 1990, Sunscreens, Development, Evaluation, and Regulatory Aspects, Marcel Dekker, INC, New York. Sudjadi, 1986, Metode Pemisahan, cetakan I, Kanisius , Jogyakarta, halaman 167-177. Dan halaman 74 Soeratri W., 1993, Studi Proteksi Radiasi UV sinar Matahari Tahap 1 : Studi Efektivitas Protektor Kimia , Lembaga Penelitian Universitas Airlangga. 333 Tanjung M , 1997, Dari Isolasi Dan Rekayasa Senyawa Turunan Sinamat Kaempferia Galanga L Sebagai Tabir Surya, Lembaga Penelitian Universitas Airlangga. Vogel A.I, 1978 Vogel’s Text Book Of Practical Organic Chemistry, Ebflish Language Book Society Longman, London p-1078. Wahjo Dyatmiko, Mulya H.S, Achmad Fuad, Anik SB (1995) , Validasi Analisis etyl pmetoksisinamat secara densitometer dalam standarisasi produk jadi yang mengandung ekstrak etanol dari rimpang kencur (Kaempferia Galanga L), Laporan Penelitian SPP/DPP Lembaga Penelitian Unair. 334 Aktifitas Anti Jamur dan Antibakteri Minyak Atsiri pada Daun Sirih (Piper betle Linn) Oka Adi Parwata Kelompok Studi Bahan Alam Laboratorium Kimia Organik, Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana, Denpasar Bali. ABSTRAK Telah dilakukan penelitian tentang isolasi, uji aktifitas anti bakteri dan uji aktivitas anti jamur minyak atsiri pada daun sirih (Piper betle Linn). Sebanyak 10,0 kg daun sirih segar didestilasi uap menghasilkan 13,5 mL minyak atsiri berwarna kuning muda, dengan berat jenis 0,7148 g/mL. Uji fitokimia menunjukkan bahwa minyak atsiri daun sirih positif mengandung terpenoid dan senyawa fenol. Uji aktifitas antibakteri minyak atsiri 100 ppm menunjukkan zona hambatan 2,4 cm terhadap bakteri S. aureus dan 2,5 cm terhadap bakteri E. coli, sedangkan dalam uji aktivitas anti jamur zona hambatan terhadap pertumbuhan jamur Candida albicans sebesar 2,3 cm. Analisis GC-MS menunjukkan bahwa dalam minyak atsiri mengandung 15 puncak tapi setelah di analisa ternyata mengandung 9 komponen senyawa antara lain 4-metil(1-metiletil)-3-sikloheksen-1-ol, 1-metoksi-4(1-propenil) benzene, 4-(2propenil)fenol/kavicol, 4-alilfenilasetat, Eugenol, Karyofilen, 3-alil-6metoksifenilasetat, 4-alil-1,2-diasetoksibenzena dan dekahidro-4a-metil-1-metilen-7(1metiletenil) naftalena. Berdasarkan intensitas puncak kandungan minyak atsiri daun sirih didominasi oleh 4 komponen senyawa yaitu 4-allyl phenil acetate, 2 metoksi-4-(2 prophenil) fenol/eugenol, 3-allyl-6-methoksi phenil asetat, 4-(2-prophenyl)-phenol / kavikol. Keempat senyawa ini diduga berperan aktif/sangat besar dalam aktifitasnya sebagai senyawa yang menghambat pertumbuhan bakteri dan jamur karena merupakan senyawa fenol dan asetat. Kata Kunci : anti jamur, antibakteri, daun Piper betle (Linn), minyak atsiri, uji fitokimia, analisis GC-MS. 335 PENDAHULUAN Pemeliharaan dan pengembangan pengobatan tradisional sebagai warisan budaya bangsa terus ditingkatkan dan didorong pengembangnnya melalui penggalian, penelitian, pengujian dan pengembangan serta penemuan obat-obatan, termasuk budidaya tanaman obat tradisional yang secara medis dapat dipertanggungjawabkan (GBHN 1993). Berdasarkan amanah GBHN 1993 bidang kesehatan tersebut di atas maka secara umum dapat diformulasikan 5 masalah obat tradisional yaitu : etnomedisin, agroindustri tanaman obat, iptek kefarmasian dan kedokteran serta industri obat, teknologi kimia dan proses, pembinaan dan pengawasan produksi atau pemasaran bahan dan produk obat tradisional. (Noor C.Z. d.k.k., 1997).(1,2) Pengembangan potensi sumber bahan (tumbuhan/tanaman) obat tradisional untuk mendapatkan zat-zat kimia atau bahan baku obat baru (teknologi kimia dan proses) dapat dilakukan melalui eksplorasi keanekaragaman hayati hutan yang dimiliki Indonesia maupun budidaya tanaman obat (agroindustri tanaman obat). Tanaman sebagai bahan baku untuk obat mempunyai ciri-ciri yang khusus dan komplek. Hal ini disebabkan karena tumbuhan obat memiliki kandungan komponen aktif yang banyak jenisnya, dan berbeda kadarnya . Hal ini dipengaruhi oleh faktor iklim dan lingkungan. Setiap tanaman berinteraksi dengan organisme lain dan dalam proses evolusi telah terjadi adaptasi untuk mempertahankan keberadaan masing-masing species. Dalam interaksi ini tiap species dilengkapi dengan kemampuan untuk melakukan metabolisme sekunder dengan menggunakan metabolit primer sebagai prekursor. Dengan demikian keanekaragaman hayati merupakan keanekaragaman plasma nuftah dan genetika serta berfungsi sebagai pustaka kimia alam yang sangat besar artinya bila didayagunakan secara maksimal baik melalui proses isolasi (ekstraksi) maupun skrining bioaktivitasnya. Salah satu tanaman obat yang perlu dikembangkan adalah Tanaman Sirih (Piper betle Linn) (1,2,3) Sirih (Piper betle Linn) merupakan tanaman yang dikenal luas oleh masyarakat Indonesia, daerah Asia Selatan, dan Tenggara. Secara tradisional di Indonesia selain untuk upacara keagamaan, sirih juga digunakan sehari-hari untuk memelihara higienitas oral dengan mengunyah daunnya, mengatasi bau badan dan mulut, sariawan, mimisan, gatal-gatal, koreng dan untuk mengobati keputihan 1,2,3,4,5. Derivate fenol (eugenol dan chavicol) yang terkandung dalam daun sirih berkhasiat antiseptik dan khususnya Chavicol diketahui mempunyai daya pembunuh bakteri lima kali fenol2,3,5. Penggunaannya dalam pengobatan gigi diasumsikan selain sebagai antibakteri, juga sebagai analgesic dan anti oksidan, sedangkan sebagai obat untuk keputihan diasumsikan sebagai obat anti jamur.2,5,6 MATERI DAN METODA A. Isolasi Minyak Atsiri dengan Metoda Destilasi Uap Sepuluh kilogram daun sirih yang sudah dipotong kecil-kecil dimasukkan dalam alat destilasi uap. Destilat yang diperoleh merupakan campuran antara air dan minyak, selanjutnya minyak atsiri dipisahkan dengan menambahkan NaCl agar minyak atsiri yang teremulsi terpisah dengan air yang dibuktikan dengan terbentuknya dua lapisan yaitu fase air dan fase minyak.. Fase minyak yang diperoleh dipisahkan selanjutnya ditampung dan ditambahkan CaCl2 untuk menyerap air yang masih tersisa atau ikut dalam fase minyak selama lebih kurang 24 jam. Selanjutnya fase minyak dipisahkan 336 dengan CaCl 2 dengan cara dekantasi. Minyak atsiri yang diperoleh selanjutnya dipergunakan untuk uji fitokimia, uji aktivitas antibacteri dan anti jamur serta di analisis komponen-komponennya dengan GC-MS. 11,12 B. Uji aktivitas Antibacteri dan Anti Jamur Metoda yang dipergunakan dalam penelitian ini adalah metoda difusi agar. Cakram kertas saring yang telah dicelupkan dalam minyak atsiri / sample dimasukkan dalam cawan petridish yang telah berisi bacteri uji dan jamur yang telah dibiakkan dalam media agar. Bacteri yang dipergunakan dalam hal ini adalah bacteri gram positif (S. aureus) dan bacteri gram negative (E. coli ) sedangkan jamur yang dipergunakan adalah jamur jenis Candida albicans. Uji positif bila terbentuk daerah/zona bening disekitar cakram kertas saring yang merupakan zona hambatan pertumbuhan bacteri dan zona hambatan pertumbuhan jamur7,8,9,10 C. Uji Fitokimia Minyak Atsiri Minyak Atsiri diuji fitokimia terhadap golongan senyawa fenolat dan terpenoidnya. Uji golongan senyawa fenolat diuji dengan FeCl3 1%, uji positif bila terjadi perubahan warna dari kuning menjadi biru tua. Uji golongan senyawa terpenoid diuji dengan Pereaksi Leibermann –Burcard, uji positif bila terjadi perubahan warna dari kuning menjadi merah / ungu.11 D. Analisi / Identifikasi Minyak Atsiri dengan GC-MS Minyak Atsiri yang diperoleh di analisis komponen-komponen yang dikandungnya dengan GC-MS yang mana dalam hal ini akan diperoleh spectra GC yang merupakan total ion kromatogram atau puncak-puncak kromatogram dari komponen senyawa yang ada dalam minyak atsiri sedangkan spectra MS akan diperoleh Mr atau Massa Molekul Relatif dari komponen-komponen senyawa dalam minyak atsiri serta fragmentasi ion-ionnya.12 HASIL PENGAMATAN DAN PEMBAHASAN Minyak Atsiri yang diperoleh positif mengandung senyawa fenolat dan terpenoid. Hal ini ditunjukkan dengan uji positif untuk FeCl 3 yaitu terjadinya perubahan dari kuning menjadi biru tua dan dengan Pereaksi L-B terjadi perubahan dari kuning menjadi merah muda. Uji antibacteri dan anti jamur minyak atsiri, positif menghambat pertumbuhan bacteri bacteri gram positif (S. aureus) dan bacteri gram negative (E. coli ) serta positif menghambat pertumbuhan jamur jenis Candida albicans yang dibuktikan adanya zona bening disekitar cakram kertas saring pada biakan bacteri dan biakan jamur seperti yang ditunjukkan dalam tabel berikut ini : Tabel 1. Aktifitas antibacteri dari minyak atsiri. No. 1. 2. 3. Zona Hambatan terhadap bacteri Sampel S. aureus E. coli 0 0 2,4 cm 0 0 2,5 cm Control Control Metanol Minyak Atsiri 100 ppm Tabel 2. Aktifitas Anti Jamur Minyak Atsiri 337 No. 1. 2. 3. 4. 5. Sampel Zona Hambatan Pertumbuhan Jamur (cm) Candida albica 0 0 1,8 2,3 3,2 Control tanpa sample dan pelarut Control methanol Minyak Atsiri 10 ppm Minyak Atsiri 100 ppm Minyak Atsiri 1000 ppm Analisis Komponen Senyawa dalam Minyak Atsiri dengan Metode GC-MS Hasil analisis GS-MS menunjukkan bahwa minyak atsiri daun sirih, Piper betle (Linn) mengandung 15 komponen yang didominasi 4 komponen dengan intensitas (luas area) seperti yang ditunjukkan Tabel 3 dan Gambar 1 berikut : Tabel 3. Hasil Analisis Komponen Senyawa dalam Minyak Atsiri dengan Metode GC-MS No. 1. 2. Waktu retensi (tR ) 11,24 11,62 Intesitas/luas area 11,24 11,62 Mr 176 164 3. 4. 13,42 9,96 13,42 9,96 206 134 Senyawa 4-Allyl phenil Acetate 2-metoksi- 4-(2-prophenil) fenol/Eugenol 3- Allyl-6-methoxy phenil acetate 4-(2- prophenyl)-phenol/ kavikol Kromatogram pada gambar 1 memperlihatkan adanya 4 puncak dominan yaitu 2 puncak yang hampir sama tinggi dengan waktu retensi (t R) masing-masing 11,24; 11,62; 13,42 dan 9,96 menit. Intensitas (luas area) masing-masing puncak secara berturutan 27,99%; 21,20%; 20,08% dan 15,47%. Gambar 1. Kromatogram Gas Minyak Atsiri Piper betle Linn 338 Komponen senyawa yang diduga terkandung dalam Minyak Atsiri setelah di analisa dan dicocokkan dengan data base hanya 9 yang terdeteksi seperti yang ditunjukkan dalam tabel berikut ini 3,11,12 Tabel 4. Komponen Senyawa Yang terdeteksi dalam Minyak Atsiri Puncak Puncak 1 Puncak 2 Puncak 3,4 Puncak 5,6,7 Puncak 8,9 Puncak 10,11,12 Puncak 13 Puncak 14,15 Puncak 16 Waktu Retensi (t R ) 8,8 9,06 10,18 dan 10,33 11,32 ; 11,64 ; 11,97 12,62 ; 13,02 13,27 ; 13,47 ; 13,56 13,60 13,75 ; 13,83 14,85 Senyawa Yang diduga 4-metil(1-metiletil)-3-sikloheksen-1-ol 1-metoksi-4(1-propenil) benzene 4-(2-propenil)fenol/kavicol 4-alilfenilasetat Eugenol Karyofilen 3-alil-6-metoksifenilasetat 4-alil-1,2-diasetoksibenzena dekahidro-4a-metil-1-metilen-7(1-metiletenil) naftalena Sesuai dengan teori komponen senyawa yang diduga dominan dapat menghambat pertumbuhan bakteri dan jamur adalah Eugenol dan kavicol dimana derivate fenol (eugenol dan chavicol) yang terkandung dalam daun sirih berkhasiat antiseptik dan khususnya Chavicol diketahui mempunyai daya pembunuh bakteri lima kali fenol1,3 sedangkan yang lainnya yang lainnya bersifat sinergis/mendukung daya hambat pertumbuhan bacteri dan jamur. 8,9,10 SIMPULAN 1. Minyak atsiri daun sirih positif mengandung senyawa terpenoid dan senyawa fenol/derivatnya. 2. Minyak atsiri daun sirih positif menghambat pertumbuhan bacteri S. aureus dan bacteri E. coli serta positif menghambat pertumbuhan jamur Candida albicans 3. Hasil analisis GS-MS menunjukkan bahwa minyak atsiri daun sirih, Piper betle (Linn) mengandung 15 komponen yang didominasi 4 komponen yaitu 4-Allyl phenil acetat (tR =11,24); Eugenol (2-metoksi-4-(2-prophenil) fenol) tR = 11,62; 3- Allyl-6-methoxy phenil acetat tR = 13,42; 4-(2- prophenyl)-phenol atau kavikol t R =9,96. SARAN Perlu dilakukan penelitian lebih lanjut tentang pemisahan masing-masing komponen minyak atsiri dengan destilasi fraksi sehingga lebih jelas diketahui komponen mana yang mempunyai aktifitas yang paling tinggi dan apakah masingmasing komponen tersebut bersifat sinergis dalam menghambat pertumbuhan bacteri/jamur atau sebaliknya bersifat antagonis. 339 PUSTAKA 1. Noor C.Z., Wahjo D., Mulja H.S., 1997, Proses Bahan Tanaman Menjadi Obat di Indonesia, Surabaya. 2. Heyne K, 1987. Tumbuhan Obat berguna Indonesia Jilid II, Cetakan ke-1, Badan Litbang Kehutanan. Yayasan Sarana Wana Jaya, Jakarta.Hal: 622-627. 3. Hardjono Sastrohamidjojo, 2004, Kimia Minyak Atsiri, Cetakan ke-1, Gadjah Mada University Press, Yogyakarta. 4. Sastroamidjojo S, 1988. Obat Asli Indonesia. PT Dian Rakyat. Jakarta. Hal: 498501. 5. Dharmananda S, (2004) New Additions To The Chinese Materia Medica I. Kava: Piper methysticum, Available: http://www.itmonline.org/arts/kava.htm (diakses: 5/17/2004). 6. Lei D, Chan CP, Wang TM, et.al., 2003, Antioxidative and antiplatelet effects of aqueous inflorescence Piper betle extract, J Agric Food Chem, Mar 26;51(7):2083-8. Available: http//www.ncbi.nlm.nih.gov/entrez/query.fcgi? (diakses 2/2/ 2007). 7. Turner, R.A., 1965, Screening Method in Pharmacology Vol I, Academic Presss, New York and London, Hal. 100-117. 8. Jenie, BSL; Andarwulan, N; Puspitasari-Nienaber, NL; Nuraida L, 2001. Antimicrobial activity of Piper betle Linn extract towards foodborne pathogens and food spoilage microorganism. IFT Annual Meeting-New Orleans, Louisiana. Available: http://ift.confex.com/ift/2001/techprogram/paper_9068.htm (diakses tanggal 2/16/2007). 9. Bhattacharya S, et al., 2005. Radioprotective Property of the Ethanolic Extract of Piper betle Leaf, J. Radiat. Res., 46, 165-171 (2005); http://jrr.jstage.jst.go.jp 10. Urquiaga, I; Leighton, F, 2000. Plat Polyphenol Antioxidant and Oxidative Stress, Biol. Res.v.33n.2 Santiago 2000. Available: http://www.scielo.cl/scielo.php?pid=S071697602000000200004&script=sci_arttext 11. Paolo M., 1992, Biosintesis Produk Alami, diterjemahkan oleh Koensoemardiyah, IKIP Semarang Press, Semarang. 12. Silverstein, Bassler and Morrill, 1981, Spectrometric Identification of Organic Compounds, John Willey and Sons, New York. 340 PHENOLIC COMPOUNDS ISOLATED FROM THE FERN Chingia sakayensis (Zeiller) Holtt Suyatnoa, Noor Cholies Zaini b, Gunawan Indrayanto b, , Motoo TORIc, Kuniyoshi Shimizud a Department of Chemistry, Surabaya State University, Jl. Ketintang Surabaya, Indonesia E-mail : [email protected] b Faculty of Pharmacy, Airlangga University, Jl.Darmawangsa Dalam Surabaya,Indonesia c Faculty of Pharmaceutical Sciences, Tokushima Bunri University,Yamashiro-cho,Tokushima 770, Japan d Interior Design Institute, Fukuoka Industrial Technology Centre, Department of Forest and Forest Product Sciences, Faculty of Agriculture, Kyushu University, Fukuoka 812-8581, Japan ABSTRACT Four known phenolic compounds namely kaemferol, matteucinol, farrerol, and matteucinol-7-O--Dglucoside were isolated for the first time from the fern Chingia sakayensis (Zeiller) Holtt’s. Their structures were elucidated on the basis of spectroscopic evidence and by comparation with those reported data in literature. Keywords : Fern, Chingia sakayensis, kaemferol, matteucinol, farrerol, and matteucinol-7-O--Dglucoside INTRODUCTION Chingia sakayensis was one of the ferns belonging the Thelypteridaceae family distributed in Thailand, Malaysia, Serawak, Sumatra, and Java. It usually grew in the forest, often near streams, at altitude 150-1200 m. Because of the difference of environment condition, the specimens from Java and Sumatra were much ticker in texture, with very strongly raised veins and sinus membrane on the lower [1]. The young fronds of the plant can be eaten cooked or raw, an extract of mature fronds in water some times sprinkled on fever, and a decoction was used as tonic after childbirth [2]. In the course of our studies, several secondary metabolites had been isolated from the leaves and stem of C. sakayensis including wax ester, steroid, and flavonoid [3]. In this paper, we reported the isolation and structure determination of the four flavonoids, kaemferol, matteucinol, farrerol, and matteucinol-7-O--D-glucoside, isolated from C. sakayensis. 341 3' 3' OH 4' 2' HO 8 7 1 1' O 9 2 6 10 5 3 4 HO 5' 1' O 9 5' 2 6' 6' 6 H H3 C OH 10 5 OH O OH H 1 8 7 4' 2' CH3 3 4 H O (1) (2) 3' HO 1 8 7 OH 4' 2' CH3 1' O 9 5' 2 6' H 6 H3C 5 4 10 3 H OH O (3) H 4" OH 3' 6" 5" H O HO HO 2" 3" H H 1" O 8 7 4' 2' CH 3 1 9 H 1' O 5' OH 2 6' 6 H H3C OC H3 H 5 OH 10 4 3 H O (5) EXPERIMENTAL General Experimental Procedures Melting point was measured by Fisher John melting point apparatus and was uncorrected. Optical rotation was determined on polarimeter Perkin-Elmer 341. UV spectra were recorded on Shimadzu Pharmaspec UV-1700 spectrophotometer. IR spectrum in KBr film was determined by JASCO FT/IR-5300 spectrophotometer. 1H and 13C NMR spectra were measured by JEOL JNM-ECP 400 spectrometer [operating at 400 MHz (1H) and 100.5 MHz (13C)] and JEOL JNM-AL300/AL 400 spectrometer [operating at 400 MHz ( 1H) and 100.4 MHz (13 C)] using tetra methyl silane (TMS) as the internal standart. Mass spectrum (MS) was recorded on JEOL JMS-LX 1000 spectrometer using ion mode EI, CI+ , and FAB+ [3-nitro benzyl alcohol (m-NBA) as matrix]. Kieselgel 60 GF-254 (Merck) and silica gel G 60 63-200 m (Merck) were used for vacuum liquid chromatography (VLC) and flash chromatography (FC), respectively. Precoated silica gel 60 F-254 (Merck) 0.25 mm, 20 x 20 cm was used for thin layer chromatography (TLC) and spots were detected by spraying with the sulphuric acid solution 5% (v/v) in ethanol followed by heating. OCH3 Plant Material The leaves and stem of C. sakayensis was collected from Kletak forest, Nongkojajar, Pasuruan, East Java, Indonesia in January 2002. A voucher spesimen was deposited at the herbarium of the Purwodadi Botanical Garden, Indonesia. Isolation (1). The leaves of C. sakayensis. The dried powdered leaves of C. sakayensis (1.5 kg) was exhaustively extracted successively with n-hexane (6 L x 3), dichloromethane (6 L x 3), and methanol (6 L x 3) at room temperature. The methanol extract was evaporated in vacuo to obtain the concentrate methanol extract (104 g). Futhermore it was extracted with ethyl acetatewater mixture (1 : 1) (400 mL x 3). Removal of the solvent under reduced pressure of the ethyl acetate soluble fraction afforded a greenish brown residue (28 g). A portion of it (8 g) was chromatographed by VLC and eluted with solvents of increasing polarity (n-hexane, n-hexane-CHCl3, CHCl3, CHCl3-MeOH) yielded 200 fractions (15 mL each). Removal of the solvent under reduced pressure of the combined fractions of 125-180 gave the brownish yellow solid (271 mg). A part of it (203 mg) was rechromatographed by FC with CHCl3-acetone (4:1) as eluen, obtained 25 fractions (10 mL each). The fractions 6-9 were collected, recrystalized in CHCl3acetone yielded compound 1 (28 mg). (2). The stem of C. sakayensis. The dried powdered stem of C. sakayensis (677 g) was exhaustively extracted successively with n-hexane (4 L x 3), dichloromethane (4 L x 3), and methanol (4 L x 3) at room temperature. The methanol extract was evaporated in vacuo to afford the concentrate methanol extract (65 g). Futhermore it was extracted with ethyl acetatewater mixture (1 : 1) (400 mL x 3). Removal of the solvent under reduced pressure of the ethyl acetate soluble fraction yielded a brown residue (10 g). A portion of it (5 g) was chromatographed by VLC and eluted with solvents of increasing polarity (nhexane, n-hexane-CHCl3 , CHCl3, CHCl3-MeOH) yielded 225 fractions (15 mL each). The combined fractions of 34-50 (216 mg) was purified by FC with n-hexane-EtOAc (3:2) as eluen yielded compound 2 (30 mg). While purification of the combined fractions of 60-67 (160 mg) by FC with n-hexane-EtOAc (3:2) as eluen afforded compound 3 (18 mg). Recrystalization of the combined fractions of 128-135 (360 mg) in CHCl3-MeOH afforded compound 4 (58 mg). Compound 1 was obtained as yellow crystal (CHCl3-acetone), mp. 271-273oC, which gave positive test (green colour) with FeCl 3 and Shinoda test (Mg-HCl). UV (MeOH) max (log ) : 273 (2.87), 324 (sh) (2.63) and 375 (2.85) nm; (MeOH + NaOH): 285 (3.91) and 410 (3.69) nm; (MeOH+AlCl3): 276 (3.00), 312 (sh) (2.49), 355 (sh) (2.53) and 432 (2.93) nm; (MeOH+AlCl3+HCl): 276 (2.97), 311 (sh) (2.51), 355 (sh) (2.55) and 432 (2.89) nm; (MeOH+NaOAc): 282 (2.97) and 391 (2.81) nm; (MeOH+NaOAc+H3BO3): 274 (2.92) and 375 (2.87) nm. IR (KBr) max : 3333 (OH), 1659 (chelated C=O), 1617, 1570, 1509 (aromatic C=C) cm-1. 1H-NMR (400 MHz,CD3OH) (ppm) : 6.18 (1H, d, J = 2 Hz, H-6); 6.39 (1H, d, J = 2 Hz, H-8); 6.90 (2H, d, J = 9 Hz, H-3' and H-5') and 8.08 (2H, d, J = 9 Hz, H-2' and H-6'). 13C-NMR (100.5 MHz, CD3OH) (ppm) : 94.5 (C-8); 99.3 (C-6); 104.5 (C-10); 116.3 (C-3’ and C-5'); 123.7 (C-1'); 130.7 (C-2' and C-6'); 137.1 (C-3); 148.1 (C-2); 158.3 (C-5); 160.5 (C-4’); 162.5 (C-9); 165.6 (C-7) and 177.4 (C-4). FABMS, m/z (rel.int.): 287 (M+H+)(44), 176 (m-NBA + Na+)(34), 154 (m-NBA + H+ )(100), 136 (m-NBAOH)(84). Compound 2 was obtained as pale yellow crystal (benzene), mp. 167-168oC, []D20 = -26o (MeOH, c.0.1), gave positive test with FeCl3 (green) and shinoda test (Mg-HCl)(red). It showed a single spot by TLC on silica gel with Rf = 0.25 (n-hexane : CH2Cl2 = 1 : 4), Rf = 0.70 (CH2Cl2 : EtOAc = 95 :5) and Rf = 0.80 (CH2Cl2: EtOAc = 9:1). UV (MeOH) maks (log ) : 298 (4.13) dan 349 (sh) (3.40) nm; (MeOH + NaOH): 341 (4.37)nm; (MeOH+AlCl3): 299 (4.10), 354 (sh)(3.32) nm; (MeOH+AlCl3+HCl): 309 (4.05) nm; (MeOH+NaOAc): 341 (4.26) nm; (MeOH+NaOAc+H3BO3): 299 (4.07) dan 346 (sh)(3.72) nm. IR (KBr) maks : 3453 (OH), 3005 (aromatic C-H), 2922, 2840 (alkyl C-H), 1630 (chelated C=O), 1520 (aromatic C=C), 1454, 1397 cm-1. 1H-NMR (300 MHz,CDCl3) (ppm) : 2.03(3H, s, 6-CH3), 2.05 (3H, s, 8-CH3), 2.78 (1H, dd, J = 17 Hz, 3 Hz, H-3), 3.03 (1H, dd, J = 17 Hz, 13 Hz, H-3), 3.83 (3H, s, OCH3 ), 5.32 (1H, dd, J = 13 Hz, 3 Hz, H-2), 6.95 (2H, d, J = 9 Hz, H-3’,5’), 7.39 (2H, d, J = 9 Hz, H-2’,6’), 12.29 (1H, s, chelated 5OH). 13C-NMR (100.5 MHz,CDCl3) (ppm) : 6.9 (6-CH3), 7.6 (8-CH3), 43.1 (3,3), 55.2 (OCH3), 78.2 (C-1), 102.3 (C-8), 102.7 (C-10), 103.5 (C-6), 114.0 (C3’,5’), 127.4 (C-2’,6’), 131.0 (C-1’), 157.7 (C-9), 158.8 (C-5), 159.6 (C-4’), 162.1 (C7), 196.5 (C-4). EIMS, m/z (rel.int.): 314 (M+ )(100), 207 (M-C7H7 O)+ (9), 206 (MC7H7O-H)+(6), 180 (M-C9H10 O)+ (89), 152 (M-C9 H10O-CO)+(70), 134 (MC9H8O4)+(36), 121 (24), 91 (10), 77 (5), 69 (5), 55 (4). Compound 3 was obtained as pale yellow crystal (CHCl3-MeOH), mp. 224226oC, []D20 = -26o (MeOH, c.0.1), gave positive test with FeCl3 (green) and shinoda test (Mg-HCl)(red). It showed a single spot by TLC on silica gel with Rf = 0.38 (CHCl3 : EtOAc = 5 : 1), Rf = 0,36 (n-hexane : EtOAc = 3 : 2), and Rf = 0.07 (n-hexane : EtOAc = 4:1). UV (MeOH) maks (log ) : 297 (3.76) dan 348 (sh) (3.08) nm; (MeOH + NaOH): 339 (3.96)nm; (MeOH+AlCl 3): 297 (3.70), 357 (sh)(3.00) nm; (MeOH+AlCl 3+HCl): 299 (3.67), 358 (sh) (2.97) nm; (MeOH+NaOAc): 339 (3.83) nm; (MeOH+NaOAc+H 3BO3 ): 297 (3.75), 350 (sh)(3.37) nm. IR (KBr) maks : 3425 (OH), 2924 (alkyl C-H), 1636 (chelated C=O), 1520 (aromatic C=C), 1458, 1367, 1119, 833 cm-1. 1H-NMR (400 MHz, CD3OD) (ppm) : 1.98(3H, s, 6-CH3), 1.99 (3H, s, 8-CH3), 2.70 (1H, dd, J = 16.8 Hz, 2.8 Hz, H3), 3.05 (1H, dd, J = 16.8 Hz, 12.8 Hz, H-3), 5.29 (1H, dd, J = 12.8 Hz, 2.8 Hz, H2), 6.82 (2H, d, J = 8.4 Hz, H-3’,5’), 7.32 (2H, d, J = 8.4 Hz, H-2’,6’). 13C-NMR (100.6 MHz,CD3OD) (ppm) : 7.4 (6-CH3), 8.2 (8-CH3), 44.1 (3,3), 80.1 (C-1), 103.2 (C-8), 104.1 (C-10), 104.8 (C-6), 116.3 (C-3’,5’), 128.8 (C-2’,6’), 131.5 (C-1’), 158.9 (C-9), 159.3 (C-5), 160.3 (C-4’), 164.2 (C-7), 198.4 (C-4). EIMS, m/z (rel.int.): 300 (M+)(82), 282 (3), 271 (1), 257 (3), 207 (M-C6H5O)+ (6), 194 (12), 180 (MC8H8O)+ (65), 152 (M-C8H8O-CO)+(100), 154 (6), 120 (24), 107 (6), 91 (18), 77 (9), 65 (12), 55 (12). Compound 4 was obtained as pale yellow crystal (MeOH-CHCl3), mp. 135-136 o C, []D20 = +7o (MeOH, c.0.1), gave positive test with FeCl3 (green) and shinoda test (Mg-HCl)(pale red). It showed a single spot by TLC on silica gel with Rf = 0.14 (CHCl 3 - EtOAc = 1 : 4), Rf = 0.28 (CHCl3 -MeOH = 9 :1) and Rf = 0.38 (CHCl3MeOH = 5:1). UV (MeOH) maks (log ) : 282 (3.41), 361 (sh) (2.77) nm; (MeOH + NaOH): 284 (3.33), 372 (sh) (2.88)nm; (MeOH+AlCl3): 281 (3.37), 362 (sh)(2.73) nm; (MeOH+AlCl3+HCl): 283 (3.36), 363 (sh) (2.76) nm; (MeOH+NaOAc): 282 (3.41), 362 (sh) (2.77) nm; (MeOH+NaOAc+H 3BO3): 282 (3.41), 363 (sh) (2.74) nm. IR (KBr) maks : 3432 (OH), 2928 (alkyl C-H), 1636 (chelated C=O), 1516 (aromatic C=C), 1456, 1356, 1125, 1069, 835 cm-1. 1 H-NMR (400 MHz,DMSO-d6) (ppm) : 2.05(3H, s, 6-CH3), 2.07 (3H, s, 8-CH3), 2.84 (1H, dd, J = 17.2 Hz, 2.8 Hz, H-3), 3.05 (1H, dd, J = 18 Hz, 13.6 Hz, H-3), 3.10-3.62 (5H, m, H-2”-6”), 3.76 (3H, s, 4’OCH3), 4.58 (1H, d, J = 7.2 Hz, H-1”), 5.54 (1H, m, H-2), 6.98 (2H, d, J = 8.4 Hz, H3’,5’), 7.45 (2H, d, J = 8.8 Hz, H-2’,6’), 12.10 (1H, s, chelated 5-OH). 13C-NMR (100.4 MHz, DMSO-d6) (ppm) : 8.70 (6-CH3), 9.27 (8-CH3), 42.19 (3,3), 55.16 (OCH3), 61.05 (C-6”), 69.86 (C-4”), 74.06 (C-2”), 76.34 (C-3”), 77.03 (C-5”), 77.84 (C-2), 104.19 (C-1”), 109.96 (C-10), 110.13 (C-8), 111.21 (C-6), 113.94 (C-3’,5’), 127.99 (C-2’,6’), 130.82 (C-1’), 157.27 (C-9), 157.85 (C-5), 159.36 (C-4’), 161.40 (C-7), 198.46 (C-4). FABMS, m/z (rel.int.): 515 (M+K+)(2), 477 (M+H+ ) (1), 345 (2 m-NBA+K+)(22), 315 (aglycon+H+ ), 314 (aglycon) (3), 307 (2 m-NBA+H+ )(14), 192 (m-NBA+H+)(100), 136 (m-NBA-OH) (86). RESULTS AND DISCUSSION Compound 1 was isolated from ethyl acetate soluble fraction of methanol extract of the C. sakayensis’s leaves as a yellow needles (CHCl3-acetone), mp.271-273 oC, gave positive test with FeCl3 (green) and shinoda test (Mg-HCl) (orange). The FABMS spectrum of 1 showed a quasi molecular ion peak at m/z 287 [M+H+ ], corresponding to a molecular formula C15H10O6 . The absorbtion maxima at 273 (band II) and 375 nm (band I) in the UV spectrum supported that 1 was a flavonol with a free 3-hydroxyl group [4]. The batochromic shift of band I on adding NaOH reagent (35 nm) and AlCl3 + HCl reagent (57 nm) indicated the presence of a hydroxyl group at C-4' and C-5, respectively. The presence of a hydroxyl group at C-7 was exhibited by batochromic shift of band II (9 nm) on adding NaOAc reagent. No batochromic shift on adding NaOAc + H3BO3 reagent supported that 1 didn’t have ortho-di hydroxyl group at B-ring. The IR spectrum of 1 clearly disclosed absorbtion bands for OH group (3333 cm-1), chelated carbonyl group (1659 cm-1), and aromatic C=C (1617, 1570, 1509 cm-1 ). The 1H-NMR spectrum of 1 exhibited four doublet proton signals at H 6.18, 6.39, 6.90, and 8.08 (Table 1). Two doublet proton signals at H 6.18 (J =1.8 Hz) and 6.39 (J = 2.2 Hz) due to a pair of meta coupled protons H-6 and H-8 in the A-ring, respectively, supported the presence of a hydroxyl group at C-5 and C-7. While two doublet proton signals at H 6.90 (J = 8.8 Hz, H-3’,5’) and 8.08 (J = 8.8, H-2’,6’) due to two pairs of ortho-cop;ed protons in the B-ring, confirmed the presence of a hydroxyl group at C-4'. The 13C-NMR spectrum exhibited 15 carbon signals which corresponded to 1, containing five oxy aryl carbons [ C 148.1 (C-2), 158.3 (C-5), 160.5 (C-4'), 162.5 (C-9), and 165.6 (C-7)], one oxyolefine carbon [ [C 177.4 (C-4)] (Table 1). The C 137.1 (C-3)], and one carbonyl carbon 1 1 correlation spectroscopy ( H- H COSY, HMQC, and HMBC) spectral data supported complete assignment of all proton-bearing carbon signals of 1. Table 1. 1H, 13C, and 1 H-13C HMBC NMR data of 1 in CD3OH Position of Atom C 1 2 3 4 5 6 7 8 H (mult.,J in Hz) C H-13C HMBC 6.18 (d, 1.8) 6.39 (d, 2.2) 148.1 137.1 177.3 158.3 99.3 165.6 94.5 C-7,C-8,C-9, C-10 C-4,C-5,C-6,C-7,C-10 1 9 10 1’ 2’ 3’ 4’ 5’ 6’ 8.08 (d,8.8) 6.90 (d,8.8) 6.90 (d,8.8) 8.08 (d,8.8) 162.5 104.5 123.7 130.7 116.3 160.5 116.3 130.7 C-2,C-3’,C-4’,C-5’,C-6’ C-1’,C-4’,C-5’ C-1’, C-3’, C-4’ C-2,C-2’,C-3’,C-4’,C-5’ Futher supporting evidence of structure 1 for kaemferol came from comparison of the 1 H-NMR and 13C-NMR spectral data with those of reported data in literature [5,6]. From the above results, 1 was proposed for the structure of kaemferol (3,5,7,4’tetrahydroxy flavone). Compound 2 was isolated from ethyl acetate soluble fraction of methanol extract of the C. sakayensis’s stem as a pale yellow needles (benzene), mp.167-167 oC, []D20 = -26o (MeOH, c.0.1), gave positive test with FeCl3 (green) and shinoda test (MgHCl) (red). The EIMS spectrum of 2 showed a molecular ion peak at m/z 314, corresponding a molecular formula C18H18O5. The UV spectrum of 2 indicated absorbtion characteristic of flavanone-type compounds at 297 nm (band II) and 343 nm (sh) (band I) [4]. The absorbtion bands of alkyl C-H (2922, 2840 cm-1), chelated carbonyl group (1630 cm-1), and aromatic C=C (1520 cm -1) in the IR spectrum, together with the existence of the ABX-type proton signals at H 2.78 (dd, H-3), 3.05 (dd, H-3), and 5.35 (dd, H-2) in the 1 H-NMR spectrum (Table 2) also supported that 2 was a flavanone [8]. The batochromic shift of band II (42 nm) on adding NaOH and NaOAc reagent showed the presence of a hydroxyl group at C-7 [8]. The presence of OH group at C-5 was supported by the batochromic shift of band II (11 nm) on adding AlCl3 + HCl reagent. No batochromic shift on adding NaOAc + H3 BO3 reagent supported that 2 didn’t have ortho-dihydroxyl group at the A-ring. The chelated proton signal at H 12.29 (s) indicated the presence of a hydroxyl group at C-5. Futher the 1H-NMR spectrum of 2 showed the existence of two aromatic methyl groups [H 2.03 (s), 2.05 (s)] and a methoxyphenyl group [ H 3.85 (s)] in the flavanone skeleton (Table 2). In the HMBC spectrum of 2, the proton signal of the first aromatic methyl group (H 2.03) showed correlation with carbon signals of C-5 ( C 158.8), C-6 ( C 103.5), C-7 ( C 162.1), while the proton signal of the second aromatic methyl group (H 2.05) correlated with carbon signals of C-7 (C 162.1), C-8 ( C 102.3), C-9 ( C 157.7) (Table 2). These results indicated that the first and the second aromatic methyl groups should be located at C-6 and C-8, respectively. The correlation between proton signal of methoxyphenyl group (H 3.85) with carbon signal of C-4’ (C 159.6) in the HMBC spectrum, together with the appearance of two aromatic proton signals at H 6.95 (d, J = 9.0 Hz, H-3’,5’) and 7.39 (d, J = 8.7 Hz, H2’,6’) due to two pairs of ortho-copled aromatic protons in the B-ring indicated the presence of a methoxy group at C-4’. The other significant correlations of 2 can be seen in Table 2. Futher supporting evidence of structure 2 for matteucinol came from comparison of the 1H-NMR, 13 C-NMR, and EIMS spectral data with those of reported data in literature [7,8]. From the above results, compound 2 was identified as matteucinol (5,7-dihydroxy-4’-methoxy-6,8-dimethyl flavanone). Table 2. 1H, 13C, and 1 H-13C HMBC NMR data of 2 in CDCl3 Position of Atom C 1 2 3 3 4 5 6 7 8 9 10 1’ 2’ 3’ 4’ 5’ 6’ 6-CH3 8-CH3 4’-OCH3 5-OH 1 H-NMR (ppm, mult.,J) 5.32 (dd,J=13 Hz,3 Hz) 3.03 (dd,J=17 Hz,13 Hz) 2.78 (dd,J = 17 Hz,3 Hz) 7.39 (d,J=9 Hz) 6.95 (d,J= 9 Hz) 6.95 (d,J= 9 Hz) 7.39 (d,J=9 Hz) 2.03 (s) 2.05 (s) 3.83 (s) 12.29 (s) 13 1 13 C-NMR (ppm) H- C HMBC 78.2 43.1 43.1 196.5 158.8 103.5 162.1 102.3 157.7 102.7 131.0 127.4 114.0 159.6 114.0 127.4 6.9 7.6 55.2 - C-1’,C-2’,C-6’ C-4, C-10 C-2, C-4, C-1’ C-2, C-3’, C-4’, C-6’ C-1’,C-4’, C-5’ C-1’,C-4’, C-5’ C-2, C-2’, C-4’, C-5’ C-5, C-6, C-7 C-7, C-9 C-4’ - Compound 3 was isolated from ethyl acetate soluble fraction of methanol extract of the C. sakayensis’s stem as a pale yellow needles (CHCl3-MeOH), mp.224-226 oC, []D20 = -20o (MeOH, c.0.1), gave positive test with FeCl3 (green) and shinoda test (Mg-HCl) (red). The EIMS spectrum of 2 showed a molecular ion peak at m/z 300, suggesting a molecular formula C17 H16O5. The UV spectrum of 2 indicated absorbtion characteristic of flavanone-type compounds at 297 nm (band II) and 348 nm (sh) (band I) [4]. The absorbtion bands of alkyl C-H (2924 cm-1 ), chelated carbonyl group (1636 cm-1), and aromatic C=C (1520 cm-1) in the IR spectrum, together with the existence of the ABX-type proton signals at H 2.70 (dd, H-3), 3.05 (dd, H-3), and 5.29 (dd, H-2) in the 1H-NMR spectrum (Table 3) also supported that 2 was a flavanone [8]. The batochromic shift of band II (42 nm) on adding NaOH and NaOAc reagent showed the presence of a hydroxyl group at C-7. The presence of OH group at C-5 was supported by the batochromic shift of band II (2 nm) on adding AlCl3 + HCl reagent. No batochromic shift on adding NaOAc + H3 BO3 reagent supported that 3 didn’t have ortho-dihydroxyl group at the A-ring. Futher the 1HNMR spectrum of 3 showed the existence of two aromatic methyl groups [ H 1.98 (s), 1.99 (s)] in the flavanone skeleton (Table 3). The DEPT spectrum of 3 showed that it had five methine carbons, one methylene carbon, two methyl carbons, and nine quartenary carbons. Table 3. 1H-NMR, 13C-NMR, and DEPT spectral data of farrerol in CD3OD 1 Position H-NMR (ppm, mult.,J) 1 2 3 3 4 5 6 7 8 9 10 1’ 2’ 3’ 4’ 5’ 6’ 6-CH3 8-CH3 5.29 (dd,J=12.8 Hz, 2.8 Hz) 3.05 (dd,J=16.8 Hz, 12.8 Hz) 2.7 (dd,J = 16.8 Hz, 2.8 Hz) 7.32 (d,J=8.4 Hz) 6.82 (d,J=8.4 Hz) 6.82 (d,J=8.4 Hz) 7.32 (d,J=8.4 Hz) 1.98 (s) 1.99 (s) 13 C-NMR (ppm) DEPT 90 DEPT 135 80.1 44.1 44.1 198.4 159.3 104.8 164.2 103.2 158.9 104.1 131.5 128.8 116.3 160.3 116.3 128.8 7.4 8.2 CH CH CH CH CH - CH CH2 CH2 CH CH CH CH CH3 CH3 The 1H-NMR and 13C-NMR spectral data of 3 were similar to those of related compound, matteucinol, except a methoxy signal at H 3.83 (s) and C 55.2, respectively. Futher supporting evidence of structure 3 for matteucinol came from comparison of the EIMS data with those of the base data at the GCMS instrument. From the above results, compound 3 was identified as farrerol (5,7, 4’-trihydroxy6,8-dimethyl flavanone). Compound 4 was isolated from the ethyl acetate soluble fraction of methanol extract of the C. sakayensis’s stem as a pale yellow powder (CHCl3-MeOH), mp. 135136 oC, gave positive test with FeCl3 test (green) and Shinoda-test (Mg-HCl) (pale red). The FABMS spectrum of 4 a quasi molecular ion peak at m/z 477 [M+H+ ], suggesting a molecular formula C24H28O10. The absorption maxima at 282 nm (band II) and 361 nm (sh) (band I) in the UV spectrum supported that compound supported that compound 4 was a flavanone [4]. The presence of absorbtion bands for alkyl CH (2928 cm-1), chelated carbonyl group (1636 cm-1), and aromatic C=C (1516 cm-1 ) in the IR spectrum, together with the existence of the ABX-type signals at H 2.84 (dd, H-3), 3.05 (dd, H-3), and 5.35 (dd, H-2) in the 1H-NMR spectrum (Table 3) also supported that compound 4 had the flavanone skeleton. No batochromic shift of band II on adding NaOH and NaOAc reagent showed that 4 didn’t have a free hydroxyl group at C-7. No batochromic shift on adding NaOAc + H3BO3 reagent supported that 4 didn’t have ortho-dihydroxy group at A-ring. The chelated proton signal at H 12.10 (s) indicated the existence of a hydroxyl group at C-5. The 1H-NMR spectrum of 4 exhibited proton signals due to a 4’-methoxyphenyl group at H 3.76 (3H, s, 4’OCH3), 6.98 (2H, d, J=8.4 Hz), and 7.45 (2H, d, J=8.8 Hz), two aromatic methyl group at H 2.05 (3H, s) and 2.07 (3H, s) as well as a glycosyl group at H 4.58 (1H, d, J = 7.2 Hz, H-1”) and H 3.10-3.62 (6-H glycosyl, m)(Table 3). The glycosyl group of 4 could be identified as a glucosyl group because its carbon signals resembled those of reported data in literature [8]. In the HMBC spectrum of 4, proton signal of methoxyphenyl group (H 3.76) showed correlation with carbon signal of C-4’ ( C 159.36), proton signal of the first aromatic methyl group (H 2.05) correlated with carbon signals of C-5 (C 157.85), C-6 (C 111,21), C-7 (C 161.40), and the proton signal of the second aromatic methyl group (H 2.07) correlated with carbon signals of C-7 (C 161.40), C-8 (C 110.13), C-9 (C 157.27) (Table 3). These results suggested the presence of methoxyphenyl group at C-4’ and aromatic methyl group at C-6 and C-8, respectively. The correlation beetwen proton signal of anomeric proton of glucosyl group (H 4.58) with carbon signal of C-7 ( C 161.40) in the HMBC spectrum of 4 showed the presence of glucosyl group at C-7. Meanwhile the coupling constant value of the anomeric proton was 7.2 Hz, indicated the presence of a glycosydic linkage to a aglycon [11]. Futher supporting evidence of structure 4 for matteucinol-7-O--D-glucoside came from comparison of the 1H-NMR and 13C-NMR spectral data with those of reported data in literature [8]. From above results compound 4 was suggested to be a matteucinol-7-O--D-glucoside. Table 4. 1H, 13C, and 1H-13C HMBC NMR data of 4 in DMSO-d6 Position of Atom C 1 2 3 3 4 5 6 7 8 9 10 1’ 2’ 3’ 4’ 5’ 6’ 6-CH3 8-CH3 4’-OCH3 5-OH 1” 2” 3” 4” 5” 6” H (mult.,J in Hz) C H-13C HMBC 5.54 (m) 3.05 (dd,18.0,13.6) 2.84 (dd,17.2,2.8) 77.84 42.19 42.19 198.46 157.85 111.21 161.40 110.13 157.27 109.96 130.82 127.99 113.94 159.36 113.94 127.99 8.70 9.27 55.16 104.19 74.06 76.34 69.86 77.03 61.05 C-1’,C-2’,C-6’, C-4 C-4 C-4 C-2, C-3’, C-4’, C-6’ C-1’,C-2’,C-4’, C-5’ C-1’,C-3’,C-4’, C-6’ C-2, C-2’, C-4’, C-5’ C-5, C-6, C-7 C-7, C-8,C-9 C-4’ C-5,C-6,C-8 C-7 7.45 (d,8.8) 6.98 (d,8.4) 6.98 (d,8.4) 7.45 (d,8.8) 2.05 (s) 2.07 (s) 3.76 (s) 12.10 (s) 4.58 (d, 7.2) 3.10-3.62 (m) 1 ACKNOWLEDGMENTS We thanks the Directorate General of Higher Education, Ministry of National Education, Idonesia, for financial support and Mr. Wardaya from the Purwodadi Botanical Garden, Pasuruan, Indonesia, for help in collecting and identifying the plant material. REFERENCES [1] [2] [3] [4] [5] [6] [7] [8] Steenish V, Holttum RE. (1982). Flora Malesiana. Junk Publisher, London, 392. Piggott AG. (1988). Fern of Malaysia. Kualalumpur, 192. Sutoyo S, Indrayanto G, Zaini NC (2007). Studies on chemical constituents of Chingia sakayensis (Zeiller) Holtt. Natural Product Communications, 2 (5) 579-580. Markham, KR. (1982) Techniques of Flavonoid Identification. Academic Press, London, 38-50. Markham KR, Geiger H. (1994) 1H nuclear magnetic resonance spectroscopy of flavonoids and their glycosides in hexadeuterodimethylsulfoxide. In The Flavonoids. Advances in research since 1986. Harborne JB (Ed). Chapman & Hall, London, 452, 464. Li Bin, Luo Yongming. (2003) Studies on chemical constituents of Camellia oleifera Abel, http://www. chemistrymag.org//cji/2003/053020ne.htm, accesed at 5 June 2003. Tanaka N,Murakami T, Wada H, Gutierrez AB, Saiki Y, Chen CM. (1985) Chemical and chemotaxonomical studies of Filices.LXI.Chemical studies on the constituents of Proneprium triphyllum .Chemical and Pharmaceutical Bulletin, 33 (12) 5231-5238. Miraglia MDC, Padua APD, Mesquita, AAL, Gottlieb OR. (1985) Flavonoids from the fern Blechnum regnellianum and Pityrogramma ebenea . Phytochemistry, 24 (5) 1120. Suatu Senyawa Alkohol Rantai Panjang dan Dua Senyawa Sterol dari Ekstrak Heksana Kulit Batang Tumbuhan Pacar Cina (Aglaia odorata Lour)(Meliaceae) *) Tukiran a , P.Ardhiana a, Suyatno a, dan K.Shimizu b a Kelompok Penelitian Kimia Organik Bahan Alam Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Surabaya. Jl. Ketintang Surabaya, 60231 b Departement of Forest and Forest Products Sciences, Faculty of Agricuture, Kyushu University, Fukuoka 812-8581, Japan. Abstrak Suatu senyawa alkohol berantai panjang (long chain-alcohol), 1-eikosanol bersamasama dengan dua senyawa sterol,β-sitosterol dan stigmasterol telah berhasil diisolasi dari ekstrak heksana kulit batang tumbuhan pacar cina (Aglaia odorata Lour)(Meliaceae). Struktur ketiga senyawa ini telah ditetapkan berdasarkan data spektroskopi IR, NMR dan FABMS. Kata kunci : Aglaia odorata Lour, Alcohol, Meliaceae, Pacar Cina , Sterol Abstract A long chain alcohol, 1-eicosanol together with two sterols, β-sitosterol and stigmasterol had been isolated from hexane extract of stem bark of pacar cina (Aglaia odorata Lour)(Meliaceae). These structures had been established based on spectroscopic data (IR, NMR and FABMS). Keyword : Aglaia odorata Lour, Alcohol, Meliaceae, Pacar Cina, Sterol. * ) Makalah disanpaikan pada Seminar Nasional Kimia di Jurusan Kimia-Unesa Surabaya, Tanggal 5 Desember 2007 351 1. PENDAHULUAN Dari laporan yang berhasil dikumpulkan pada studi kimia tanaman genus Aglaia pada dasarnya dapat dikelompokan menurut kerangka dasarnya, yaitu kelompoksiklortan, liminoid, 14α-metilsterol (steroid), tirucllan, flavonoid, dan siklopenatetrahidrobenzofuran (rokaglamida). Kelompok- kelompok senyawa ini sekaligus menggambarkan keragaman molekul dan pola kimia dari senyawa-senyawa yang terkandung dalam tumbuhan Meliaceaea pada umumnya. Sebagai contoh, kelompok senyawa sikloartan, argenteanon A – E, argenteanol, argenteanol B – E telah berhasil diisolasi dari tumbuhan Aglaia argentea dan pula menunjukan efek sitotoksik terhadap sel KB [1,2]. Kemudian senyawa jenis sikloartan lainya, 29-nor-sikloartan-24,25-epoksi-3βol dan 29-nor-sikloartan-23-en-3β,25-diol telah diisolasi dari tumbuhan Aglaia roxburghiana [3]. Dari daun tumbuhan Aglaia harmsiana telah pula ditemukan empat senyawa jenis sikloartan, yaitu sikloartenol, sikloartan-3β,29-diol-24on, (24R)-sikloartan-3β,24,25-triol, dan (24R)-sikloartan-24,25-diol-3-on[4]. Sebagai kelanjutan penelitian kami terhadap sejumlah tumbuhan Meliaceae, seperti Khaya senegalensis [5] dan Sandoricum koetjape [6], kini kami mulai menyelidiki kandungan kimia pada tumbuhan lain dalam famili tersebut, yaitu Aglaia odorata Lour. [7] yang diperoleh dari Kebun Raya Purwodadi. Dari ekstrak heksana kulit batang tumbuhan A. odorata ini telah berhasil diisolasi suatu senyawa alkohol rantai panjang, 1-eikosanol bersamasama dengan β-sitosterol dan stigmasterol. Pada kesempatan ini, akan dilaporkan elusidasi struktur suatu senyawa hasil isolasi 1-eikosanol dari ekstrak heksana tersebut yang ditetapkan berdasarkan data IR dan NMR. 2. METODE DAN HASIL PENELITIAN Umum. Penentuan spektroskopi inframerah (IR) suatu senyawa hasil isolasi diukur dengan menggunakan alat spektrometer Buck Scientific M500. Spektrum 1H dan 13 C NMR diukur dengan menggunakan spektrometer JEOL JNM-AL300/AL400 FTNMR, beroperasi pada 399.65 MHz (1H) dan 100.40 MHz (13 C), menggunakan pelarut sebagai standar internal. Kromatografi cair 352 vakum (KVC) dilakukan dengan menggunakan Si Gel Merck 60 GF 254, Kromatografi kolom gravitasi (KKG) dengan Si Gel Merck 60 (60-70 mesh), dan analisis kromatografi lapis tipis (KLT) menggunakan pelat berlapis Si Gel Merck Kieselgel 60 F254 , 0,25 mm. Pengumpulan Bahan Tumbuhan. Bahan tumbuhan berupa kulit batang dari Aglaia odorata Lour (Pacar Cina) dikumpulkan pada bulan Maret 2007 dari kebun Raya Purwodadi. Tumbuhan ini telah diidentifikasi oleh staf Herbarium LIPI, Purwodadi, Pasuruan dan spesimenya disimpan di Herbarium tersebut. Ekstraksi dan Isolasi. Kulit batang tumbuhan pacar cina yang telah dikeringkan dan digiling halus (1,25 kg) diekstraksituntas (sebanyak 3 kali) dengan metanol. Setelah pelarut diuapkan dari ekstrak metanol paeda tekanan rendah, diperoleh residu berwarna coklat kekuningan (101,1 g). selanjutnya, terhadap total ekstrak metanol ini dipartisis oleh heksana sebanyak 3 kali, dan diperoleh total ekstrak heksana sebanyak 15,6 g. ekstrak heksana ini dibagi menjadi 2 bagian dengan berat masing – masing bagian kurang lebih 7,3 dan 8,3 g (selanjutnya disebut fraksi utama I dan II). Kemudian fraksi utama I difraksinasi melalui kromatografi vakum cair (KVC) berturut – turut menggunakan eluen campuran heksana/kloroform/metanol dengan tingkat kepolaran yang terus meningkat (H/K/M = 10/0/0 sampai dengan 0/0/10). Menghasilkan 20 fraksi. Penggabungan fraksi-fraksi tersebut atas dasar analisis KLT menghasilkan 5 fraksi utama yaitu fraksi IA (1-13)IB (14), IC(1517;2,003g),ID(18, 1,272 g), dan IE(19-20; 0,786 g). hal yang sama dilakukan pemisahan pula terhadap fraksi utama II dengan menggunakan cara dan eluen yang sama pula dihasilkan 24 fraksi dan digabung menjadi 5 fraksi, yaitu fraksi IIA (1-3), IIB (4-7), IIC(8-11), IID(12-19), dan IIE(20-24). Selanjutnya terhadap fraksi IC (15-17; 2,003 g) difraksinasi melalui KKG (eluen campuran heksana/kloroform/metanol (H/K/M = 15/1/0,5) dihasilkan 68 fraksi dan dilanjutkan dengan mengganti eluen (H/K/M = 10/3/0,5), dihasilkan fraksi 69-77 fraksi dan digabung berdasarkan analisis KLT diperoleh 8 fraksi gabungan yaitu fraksi ICI (1-3; 0,233 g), IC2)(4-5; 353 0,045 g), IC3 (6-9; 0,148g), IC4 (8-11, 0,547 g), IC5 (12-25; 0,649 g), IC6 (2633 ; 0,649 g), IC7 (34-41), dan IC8 (42-77). Berdasarkan analisis KLT dari sejumjah fraksi-fraksi hasil pemisahan fraksi utama I, II, dan IC di atas, selanjutnya digabung menjadi 6 fraksi kelompok, yaitu fraksi kelompok I (gabungan fraksi-fraksi IIB, IC1 dan IC2; 1,571 g), fraksi kelompol II (gabungan fraksi-fraksi IIC dan IC5; 1,681 g), fraksi kelompok III(gabungan fraksi-fraksi IID dan IC7, Fraksi kelompok IV (Fraksi IIA), fraksi kelompok V (gabungan fraksi-fraksi IIE dan IC8), dan fraksi kelompok VI (fraksi IC3). Pemisahan berikutnya difokuskan pada fraksi kelompok II (1,681 g) melalui KVC menggunakan eluen heksana, heksana/etil asetat, dan etil asetat menurut kenaikan tingkat kepolaran dihasilkan 80 fraksi. Berdasarkan analisis KLT terhadap semua fraksi yang diperoleh diatas, kemudian digabungmenjadi 6 fraksi, yaitu fraksi kelompok IIa (1-36), fraksi Kelompok IIb (37-46; 0,357 g), fraksi kelompok Iic(47-59; 0,385 g), fraksi kelompok Iid (60-63), fraksi kelompok Iie (64-74; 0,440 g), dan fraksi kelompok Iif (75-80). Penguapan terhadap fraksi kelompok Iib (0,357 g) diikuti terbentuknya kristal dan selanjutnya dilakukan rekristalisasi secara berulang-ulang dalam campuran kloroform dan metanol panas diperoleh kristal putihsebanyak 10 mg (disebut isolat Prima-tuk-1). Karakterisasi berikutnya dilakukan terhadap isolat ini melalui pengukuran IR dan NMR. Pemisahan selanjutnya dilakukan terhadap fraksi kelompok I melalui KVC menggunakan eluen yang sama dihasilkan 149 fraksi dan digabung menjadi fraksi gabungan, yaitu kelompok Ia (1-2), Ib (3-4), Ic (5-46), Id (4759), Ie (60-63), If (64-74), Ig (75-130), dan Ih (131-149). Hasil penguapan fraksi kelompok Id (47-59)dan If (64-74)diikuti terbentuknya kristal dan digabung selanjutnya dilakukan rekristalisasi dalam metanol panas secara berulang-ulang, masing-masing diperoleh kristal putih sebanyak 8mg (disebut isolat Prima-Tuk-2). Data spektroskopi senyawa hasil isolasi adalah sebagai berikut. Spektrum IR (KB r) senyawa hasil isolasi (isolat Prima-Tuk-1) menunjukan serapan v maks pada 3390,3 (-OH), 2921 dan 2853 (-CH alifatik), dan 1060,6 (- 354 C- OH)cm-1 . spektrum 13 C-NMR (CDCI3 , 125 MHz) senyawa hasil isolasi memperlihatkan sejumlah sinyal pada γc63,2 (C-OH), 32,97 (CH2-), 32,01 (CH2-), 29,42 (-CH2-); 25,87 (-CH2-), 22,75 (-CH2-), dan 14,11 (CH3 -) ppm. Spektrum 1H-NMR (CDCI3, 500 MHz)senyawa hasil isolasi menunjukan sejumlah sinyal pada δ c 0,88 (CH 3, t), 1,125 (CH 2-, m), dan 7,26 (-C-OH) ppm. Sementara itu, isolat Prima-Tuk-2 dilakukan karakterisasi dengan cara membandingkan dengan senyawa hasil isolasi standar yang diperoleh dari ekstrak kloroform (disebut Diah-Tuk-1), yaitu β-sitostero; dan stigmasterol dari tumbuhan yang sama, diatas pelat KLT dan dibawah lampu UV baik pada panjang gelombang 254 maupun 366 nm menunjukan kesamaan sifat dan pola serapanya, sehingga dapat disarankan bahwa isolat Prima-Tuk-2 adalah βsitosterol dan stigmasterol. 3. PEMBAHASAN Pemisahan ekstrak heksana kulit batang tumbuhan pacar cina (Aglaia odorata Lour) dihasilkan suatu senyawa hasil isolasi, yang diperoleh melalui beberapa tahap fraksinasi, diikuti oleh pemilihan fraksi utama berdasarkan analisis kromatografi lapis tipis (KLT), pemurnian melalui kolom kromatografi dan rekristalisasi, serta pengukuran spektroskopi. Suatu senyawa hasil isolasi berupa kristal putih telah diperoleh dari kolom kromatografi dan rekristalisasi berulang-ulang dalam pelarut metanol panas. Dengan pereaksi Lieberman-Burchard, senyawa ini memberikan warna ungu dan memberikan pendar dibawah lampu UV baik pada panjang gelombang 254 nm. Spektrum IR senyawa hasil isolasi menunjukan sejumlah serapan v maks pada 3390,3 yang menggambarkan adanya gugus –OH, pada 2921 dan 2853 cm-1 yang mengindikasikan adanya gugus –CH alifatik, dan pada 1060,6 cm-1 yang menunjukkan adanya gugus alkil alkohol (-C-OH) cm -1. Spektrum 13 C-NMR (CDCI3, 125 MHz) senyawa hasil isolasi memperlihatkan sejumlah sinyal pada δc 63,2 ppm berarti senyawa hasil isolasi mempunyai atom karbon alkohol sekunder (-CH2-OH), 32,97; 32,01; 29,42; 25,87 (-CH2-), 22,75 ppm (-CH2-), menyatakan adanya atom karbon jenis 355 metilen (CH2-). Spektrum 1H-NMR (CDCI3, 500MHz) senyawa hasil isolasi menunjukan sejumlah sinyal pada δc 0,88 ppm dengan multiplissitas triplet (t), yang menyatakan sebagai proton metil (CH3), 1,25 ppm dengan multiplisitas multiplet (m) dan dengan kelimpahan yang cukup tinggi menandakan dahwa senyawa hasil isolasi gugus metilen (CH2-) yang cukup banyak, dan 7,26 ppm yang berarti adanya gugus alkil alkohol. Data dan pola serapan spektruk IR ini serta data spektrum NMR, disarankan bahwa senyawa hasil isolasi adalah suatu 1-eikosanol. OH 1-Eikosanol (CH3-(CH2)19 OH) 21 18 22 22 20 23 23 17 11 19 1 9 10 14 3 OH OH 5 Β-Sitosterol Stigmasterol 4. KESIMPULAN Penelitian kimia tumbuhan Aglaia odorata Lour, telah dilakukan di laboratorium kami, dan dari penelitian ini telah ditemukan suatu senyawa alkohol rantai panjang, 1-eikosanol bersama-sama dengan dua senyawa sterol dalam bentuk isomernya yang sulit dipisahkan, yaitu β-sitosterol dan stigmasterol. Jika ditinjau dari segi biogenesis, dua senyawa terakhir terbentuk 356 melalui reaksi enzimatik dari 2,3-oksidoskualen sebagai precursor dalam konformasi kursi-perahu-kursi (chair-boat-chair conformation). Mempelajri terjadinya proses reaksi sekunder dari senyawa triterpenoid maupun steroid, diharapkan akan ditemukan banyak senyawa lain yang lebih komplek dari tumbuhan tersebut. Dengan demikian penelitian ini masih terus dilanjutkan. Ucapan Terima Kasih Penelitian ini dibiayai oleh Direktorat Penelitian dan Pengabdian Kepada Masyarakat (DP2M), Pendidikan Tinggi, Jenis Penelitian Fundamental Tahun 2007. Terima kasih disampaikan kepada staf LIPI, Kebun Raya Purwodadi, Pasuruan, yang telah membantu mengidentifikasi spessimen tumbuhan tersebut. Referensi 1. Omobuwajo, O.R., Martin, M.-T., Perromat, G.,Sevenet, T., Awang, K., dan Pais, M., 1995, “Cytotoxic cycloartanes from Aglaia argentea”, Phytochemistry, 41 (5), 1325-8. 2. Mohamad, K., Martin, M.-T., Leroy, E., Tempete, C., Sevenet, T., Awang, K., dan Pais, M., 1997, “Argenteanones C-E and argenteanols B-E, cytotoxic cycloartanes from Aglaia argentea”, Journal of Natural Products, 60 (2), 81-5. 3. Vishnoi, S.P., Shoeb, A., dan Kapil, R.s., 1988, “New cycloartenol derivatives from Aglaia roxburghania”, Planta Medica” , 54 (1), 40-1. 4. Inada, A., Murayta, H. Inatomi, Y., Nakanishi, T., dan Darnaedi, D., 1995, ”Cycloartane treterpenes from the leaves of Aglaia harmsiana”, Journal of Natural Products, 58, 1143-6. 5. Tukiran, Sri Hidayati, S., dan Iid, F., Suatu Senyawa Steroid dari Ekstrak n-Heksana Kulit Batang Tumbuhan Kaya (Khaya Senegalensis (Desr.)A. Juss)(Meliaceae)”, Presentasi oral, Kumpilan Abstrak, Seminar Nasional MIPA, 17 Desember 2005, UNESA Surabaya. 6. Tukiran, Saidah, Suyatno, Nurul Hidayati, and Shimizu, K.,2006, “A Briononic acid from the Hexane Exstracts of Sandoricum Koetjape Merr. 357 Stem Bark (Meliaceae)”, Indonesian Journal of Chemistry, Vol.13, No.2,2007, 133-137. 7. Tukiran dan Rikki H. A., “Isolation and Characteization a Roclamide from Ethil Achetate Extracts of The Stem Bark of Aglaia odorata Lour (Meliaceae)”, Presentasi oral, Kumpulan Abstrak, Seminar Nasional Kimia, 4 Februari 2006, UNESA Surabaya. 358