BAB II LANDASAN TEORI A. PNEUMONIA Pneumonia adalah
advertisement

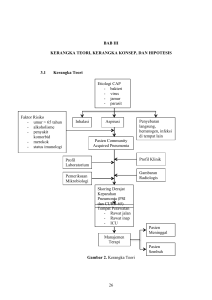
BAB II LANDASAN TEORI A. PNEUMONIA Pneumonia adalah inflamasi parenkim paru yang disebabkan oleh mikroba patogen (bakteri, jamur dan parasit) kecuali Mycobacterium tuberculosis. Pembagian pneumonia berdasarkan anatomi dan predileksi infeksi antara lain pneumonia lobaris, bronkopneumonia, dan pneumonia interstisial (PDPI, 2003; Marrie, 2008) Bronkopneumonia ditandai dengan bercak-bercak infiltrat pada lapang paru fokus dari infeksi dan respons inflamasi pada bronkus dan parenkim, dapat disebabkan oleh mikroba antara lain bakteri dan virus. Bronkopneumonia sering pada bayi dan orang tua. Pneumonia lobaris adalah pneumonia yang terjadi pada satu lobus sering disebabkan oleh karena infeksi bakteri dan disebabkan oleh obstruksi bronkus misalnya aspirasi benda asing dan jarang terjadi pada bayi dan orang tua. Pneumonia interstisial secara radiologi ditandai adanya infiltasi retikular atau retikulonoduler pada infiltrat peribronkovaskular (PDPI, 2003). 1. Imunopatogenesis Beberapa faktor menyebabkan risiko terjadinya pneumonia antara lain adalah adanya defek sistem imun tubuh, ukuran dan jumlah mikroba patogen, kemampuan kebertahanan hidup mikroba, dan kolonisasi mikroba. Pneumonia terjadi akibat invasi mikroba patogen melalui proses aspirasi, inhalasi, inokulasi langsung dan penyebaran hematogenik. Bahan aspirat dari orofaring yang mengandung mikroba menyebabkan invasi mikroba pada saluran napas bawah (Torres et al., 2010). Setelah terjadi aspirasi bahan-bahan faring yang mencapai saluran napas terminal dan alveoli, maka proses berlanjut secara progresif dengan penyebaran bronkogenik yang ditandai dengan terbentuknya infiltrat di paru atau konsolidasi, kerusakan parenkim paru yang terjadi akibat pengaruh satu faktor atau lebih seperti faktor virulensi intrinsik organisme, obstruksi bronkus, abnormalitas anatomis dan penurunan kekebalan individu (Fishman, 2008). Sel-sel imun paru akan berikatan dengan PRR mikroba melalui TLR atau NLR kemudian terjadi aktivasi faktor transkripsi, regulasi sitokin/ kemokin, molekul adhesi, infiltrasi sel fagosit. Sel-sel yang berperan penting pada imun bawaan adalah netrofil, makrofag, dan sel dendritik. (Balamayooran et al., 2010). Faktor transkripsi adalah protein yang menginduksi ekspresi gen. NF-κB adalah salah satu factor transkripsi yang paling banyak diteliti. Sinyal TLR yang bergantung pada MyD88 menyebabkan ekspresi gen proinflamasi melalui aktivasi NF-κB yang mengandung p65 dan p50 (Craig et al., 2009). 2. Imunitas bawaan Imunitas bawaan adalah respons tubuh secara awal terhadap mikroba untuk mengeliminasi infeksi mikroba. Respons imunitas bawaan terhadap mikroba akan merangsang respons imun adaptif dan dapat mempengaruhi imunitas adaptif agar respons terhadap berbagai jenis mikroba menjadi optimal dan efektif. Sistem imun bawaan mengenali mikroba melalui struktur molekul mikroba yang merupakan karakteristik dari mikroba patogen. Zat mikroba yang merangsang imunitas bawaan disebut pathogen associated molecular pattern Karakteristik imunitas bawaan dapat dilihat pada gambar 1 (PAMP) (Abbas,2012a). Gambar 1. Karakteristik imunitas bawaan (Abbas., 2012a). Replikasi mikroba patogen ekstraseluler dalam saluran napas dapat menimbulkan penyakit melalui dua mekanisme yaitu: (Abbas., 2012b) a. Inflamasi yang berlebihan yang mengakibatkan kerusakan jaringan. b. Toksin mikroba antara lain endotoksin bakteri gram negatif (lipopolisakarida) dapat mengaktivasi makrofag dan sel dendritik. Eksoktoksin bersifat sitotoksik merusak sel-sel melalui mekanisme biokimia atau mengganggu fungsi sel normal. Sel-sel imun bawaan antara lain adalah sel epitel saluran napas/ alveolar, makrofag, sel dendritik, dan polimorfonuklear (PMN). Sel-sel imun seluler berperan dalam merespons stimulasi dari sel-sel imun humoral (Balamayooran et al., 2010; Riches et al., 2010). Makrofag alveolar berperan dalam sistem imun bawaan dan adaptif. Makrofag alveolar adalah makrofag yang berada di dalam paru. Makrofag alveolar yang teraktivasi oleh antigen akan mengeluarkan berbagai sitokin (Abbas, 2012c). Makrofag teraktivasi mengenali dan berikatan dengan komponen mikroba melalui TLR-4 untuk LPS bakteri gram (-) dan TLR-2 untuk mengenali komponen dinding bakteri gram (+), antara lain: asam lipoteikoik dan peptidolikan (Amersfoort et al., 2003) TLR-2 berperan mengenali asam lipoteikoik dan peptidoglikan bakteri gram (+), TLR-4 mengenali endotoksin (LPS) bakteri gram (-), TLR-5 mengenali flagellin bakteri (Amersfoort et al., 2003; Bals & Hiemstra., 2004; Riches et al., 2010; Parker & Prince., 2011). Makrofag menghasilkan zat oksidatif dan enzim protease untuk mengeliminasi mikroba (Baratawidjaja dan Rengganis, 2012). Makrofag yang teraktivasi akan menghasilkan berbagai sitokin antara lain adalah IL-1, IL-6, IL-8, IL-12, dan tumor necrosis factor (TNF)-α (Gordon, 2008; Bordon et al., 2012). IL-8 yang dihasilkan oleh makrofag akan menarik neutrofil masuk ke alveoli dari pembuluh darah paru. Netrofil bertugas melawan infeksi mikroba. Neutrofil berasal dari sel progenitor yang terdapat dalam sumsum tulang. Pada keadaan infeksi netrofil terbentuk lebih banyak (Riches et al., 2010). Netrofil menghasilkan reactive oxygen species (ROS), enzim proteolitik, myeloperoxidase, dan defensins untuk mengeliminasi mikroba (Bordon et al., 2012). Sel dendritik berfungsi sebagai sel penyaji antigen yang banyak ditemukan di jaringan intraepitel dan subepitel saluran napas (Riches et al., 2010). Sel dendritik membawa antigen dan partikel yang berada pada saluran napas dan menyajikannya untuk sel T naïve melalui saluran kelenjar getah bening regional (Riches et al., 2010; Papadaki & Velegraki, 2005). Respons imunitas bawaan terhadap infeksi bakteri terjadi melalui dua mekanisme yaitu (Abbas., 2012b): a. Aktivasi komplemen. Aktivasi komplemen menyebabkan proses opsonisasi dan meningkatkan fagositosis. Unsur utama dinding sel bakteri gram positif antara lain peptidoglikan mengaktivasi jalur alternatif komplemen. Liposakarida bakteri gram (-) juga mengaktivasi komplemen melalui jalur alternatif. Permukaan dinding bakteri yang mengekspresikan manose yang dapat mengikat mannosebinding-lectin (MBL) mengaktivasi komplemen melalui jalur lectin. b. Aktivasi sel fagosit dan peradangan. Reseptor mannose dan reseptor scavenger yang berada pada sel fagosit dapat mengenali bakteri ekstraseluler. Sel fagosit menggunakan reseptor Fc dan reseptor komplemen untuk mengenali bakteri yang telah telah teropsonisasi dengan antibodi dan protein komplemen. Toll-like receptor (TLR) dan berbagai sitoplasma sensor produk mikroba turut berpartisipasi dalam aktivasi fagosit setelah bertemu dengan mikroba. Reseptor mannose dan reseptor scavenger berfungsi terutama untuk mempromosikan fagositosis mikroba. Respon imunitas bawaan terhadap infeksi virus terjadi melalui induksi interferon tipe I dan aktivasi sel natural killer (NK). Double stranded ribonucleic acid (dsRNA) yang dihasilkan selama siklus hidup virus dapat menginduksi ekspresi interferon (IFN)-α dan β. Sel-sel yang terinfeksi virus akan terinduksi dan melepaskan interferon tipe I terutama sel dendritik jenis plasmasitoid. Makrofag, monosit, dan fibroblas juga mampu mensintesis IFN tipe I tetapi mekanisme induksi pada sel-sel ini tidak sepenuhnya dipahami (Abbas., 2012b; Goldsby et al., 2003) Aktivasi protein kinase melalui jalur biokimia akan mengaktifkan faktor transkripsi interferon regulatory factors (IRF) yang kemudian merangsang transkripsi gen interferon. Interferon tipe I berfungsi untuk menghambat replikasi virus dalam sel yang terinfeksi dan tidak terinfeksi (Abbas, 2012b). Makrofag alveolar mengenali jamur melalui TLR yang berada di dipermukaan sel yaitu TLR-2, TLR-4, dan TLR-9, kemudian difagosit tetapi tidak semua jamur berhasil dihancurkan (Romani, 2004). Netrofil dan makrofag adalah mediator utama imunitas bawaan terhadap jamur. Pasien dengan neutropenia sangat rentan terhadap infeksi jamur oportunistik. Neutrofil melepaskan zat fungisida seperti reactive oxygen species (ROS) dan enzim lisosom. Sel fagosit dan sel dendritik mengenali organisme jamur melalui TLRs dan lectin-like receptors seperti disebut dectins (Abbas, 2012b). Sel dendritik yang berada pada jaringan yang terinfeksi jamur akan menjadi matur dan bermigrasi ke organ limfoid mengaktifkan sel Treg dan Th. Sel Treg berfungsi untuk meredam reaksi inflamasi yang berlebihan dan berkontribusi pada pengembangan memori kekebalan terhadap jamur (Romani, 2004). 2. Imunitas adaptif PAMP yang tidak dapat dieliminasi oleh sel fagosit akan dikenali oleh sistem imun spesifik. PAMP dikenali oleh PRR yang terdapat di permukaan sel dendritik sebagai sel penyaji antigen. Sel dendritik menjadi aktif dan matang, pada kondisi ini sel dendritik memiliki kemampuan untuk mengaktifkan sel limfosit T melalui major histocompatibility complex (MHC) yang terdiri dari MHC I dan MHC II. Sel T limfosit membutuhkan dua jalur rangsangan untuk aktif, pertama stimulasi dari kompleks antigen-MHC yang pada reseptor sel T (TCR) dan ko-stimulasi dari interaksi ligan sel dendritik dengan reseptor sel T. Reaksi pengenalan tersebut terjadi di limfonodi regional, memicu proliferasi sel T dan migrasi ke jaringan. Sel T yang belum berdiferensiasi dikenal sebagai sel T naïve kemudian teraktivasi menjadi sel Th1 dan sel Th2. Sel Th1 mensekresi IL-2, TNF-β, dan IFN-γ yang mengaktifkan fungsi fagositosis makrofag alveolar dan sel T sitotoksik. Sel Th2 mensekresi IL-4, IL-5 membantu mengaktifkan sel limfosit B memproduksi antibodi. Sel Th2 juga mensekresi IL-5 dan IL-9 yang mengaktifkan eosinofil dan sel mast. Respons imun yang diperantarai oleh sel limfosit T atau disebut dengan sistem imun seluler (Lambrecht, 2001; Abbas, 2012c). Sel dendritik dapat mengenali mikroba dan menyajikannya melalui major histocompatibility complex (MHC) yang berada pada permukaan sel dendritik. MHC membantu limfosit T untuk mengenali antigen yang disajikan oleh sel dendritik. MHC dibagi atas dua yaitu MHC I berperan dalam proses penyajian antigen endogen bakteri intraseluler dan virus ke limfosit T CD8+. Molekul MHC II menyajikan antigen eksogen ke sel T CD4+ (Abbas, 2012d; Curtis., 2005; Kiama, 2014). Sel T naive berdiferensiasi menjadi sel Th2 yang dikostimulasi oleh sitokin IL-4. Sitokin IL-4 dihasilkan oleh berbagai sel antara lain sel mast, basofil, dan eosinofil. Diferensiasi sel Limfosit T naive menjadi sel Th-17 dengan kostimulasi IL-6, IL-1, dan IL-23 yang dihasilkan oleh sel dendritik. (Abbas, 2012e; Friedman & Blumberg, 2015). Sel Th CD4+ menghasilkan IL-2 dan IFN-γ dan mengkostimulasi sel limfosit T CD8+ berdiferensiasi menjadi sel T sitotoksik (CTL) (Playfair & Chain, 2004; Abbas, 2012e). CTL berperan dalam merusak sel yang terinfeksi dengan menghasilkan granzim dan perforin (Abbas, 2012e). Imunitas adaptif terhadap infeksi virus diperantarai oleh antibodi dan cytotoxic T lymphocytes (CTLs) bertujuan untuk mengatasi infeksi dengan cara membunuh sel yang terinfeksi. Antibodi akan menghambat ikatan sel dengan virus. Antibodi efektif terhadap virus hanya selama tahap ekstraseluler dan diawal perjalanan infeksi (sebelum menginfeksi sel inang) virus hidup di ekstraseluler atau ketika virus dilepaskan dari sel yang terinfeksi oleh virus pemula atau jika sel-sel yang dibunuh. Antibodi mengikat kapsul virus atau antigen kapsid untuk mencegah masuk ke dalam sel inang. Antibodi yang disekresi dari isotipe IgA penting untuk menetralkan virus pada saluran pernapasan dan usus. Antibodi dapat melakukan opsonisasi pada partikel virus dan mempromosikan kepada fagosit. Aktivasi komplemen juga dapat berpartisipasi dalam kekebalan virus diperantarai antibodi. Kekebalan humoral memainkan peranan penting dalam pertahanan tubuh terhadap infeksi virus (Abbas, 2012b). Imunitas seluler atau cell-mediated immunity (CMI) adalah mekanisme utama kekebalan adaptif terhadap infeksi jamur. Histoplasma capsulatum adalah parasit intraseluler fakultatif yang hidup di dalam makrofag akan dihilangkan melalui mekanisme CMI. Sel CD4 dan CD8 bekerja sama untuk menghilangkan Cryptococcus neoformans yang cenderung berkolonisasi di paru dan otak manusia selama defisiensi imunitas. Aktivasi sel dendritik terjadi setelah reseptor dectin-1 berikatan dengan glucan jamur lalu sel dendritik melepaskan sitokin IL-6 dan IL-23 untuk merangsang TH17. Sel TH17 akan menstimulasi inflamasi, menarik netrofil dan monosit untuk menghancurkan jamur. Respons TH1 adalah pelindung pada infeksi jamur intraseluler seperti histoplasmosis tetapi respons ini dapat menimbulkan terjadinya peradangan granulomatosa (Abbas, 2012b). 3. Diagnosis Diagnosis pneumonia ditegakkan berdasarkan anamnesis, pemeriksaan fisis, pemeriksaan radiologis, dan laboratorium. Penderita yang dicurigai pneumonia harus dilakukan berbagai pemeriksaan radiografi dada untuk membantu penegakkan diagnosis dan untuk memastikan adakah komplikasi seperti efusi pleura atau penyakit multilobar. Penderita pneumonia dengan indikasi rawat inap harus menjalani pemeriksaan analisis gas darah (AGD)/ oksimetri, darah rutin/ kimia, dan kultur mikroba. Pemeriksaan serologi tidak dianjurkan pada pada pasien pneumonia komunitas (Niederman & Craven, 2005). Diagnosis pneumonia ditegakkan bila pada pemeriksaan radiografi dada ditemukan infiltrat baru atau infiltrat progresif ditambah dua atau lebih gejala berikut: gejala batuk yang bertambah, adanya purulensi sputum, suhu badan ≥ 38oC atau ada riwayat demam, pemeriksaan fisis paru didapatkan tanda-tanda konsolidasi , suara napas bronkial, dan ronki, atau lekosit ≥ 10.000 atau < 4500 (PDPI, 2003). 4. Terapi Terapi utama pneumonia adalah pemberian antibiotik yang sesuai dengan etiologinya. Terapi antibiotic empirik harus segera diberikan jika etiologinya belum diketahui. Tujuan utama pemberian terapi antibiotik adalah untuk tercapainya perbaikan klinis penderita pnumonia (Mandell et al., 2007). 5. Kriteria pemulangan dari rawat inap Kriteria pulang dari rawat inap penderita pneumonia berdasarkan Guideline BTS 2009 adalah penderita pneumonia diperbolehkan pulang bila sudah dilakukan evaluasi klinis selama 24 jam dan memenuhi semua variabel kriteria pulang. Kriteria pulang terpenuhi bila semua variabel berikut terpenuhi: suhu tubuh < 37,8 0C, frekuensi jantung < 100 kali per menit, frekuensi napas < 24 kali per menit, tekanan darah sistolik > 90 mmHg, saturasi oksigen > 90%, dapat makan dan minum, dan tidak ada gangguan kesadaran (Lim et al., 2009). B. INTERLEUKIN-6 Sitokin adalah protein yang dikeluarkan oleh berbagai sel imun, antara lain adalah sel dendritik dan makrofag yang dapat menyebabkan inflamasi. Sitokin berperan dalam memediasi (mediator) dan meregulasi imunitas bawaan dan adaptif (Abbas, 2012d). Produksi sitokin proinflamasi pada pneumonia akibat infeksi bakteri tidak terbatas pada paru yang terinfeksi saja, namun secara sistemik turut meningkat. Sitokin IL-6 adalah salah satu sitokin proinflamasi yang berperan penting pada pneumonia karena kadar IL-6 meningkat secara signifikan pada penderita pneumonia seiring dengan derajat keparahan (Endeman et al, 2011). Interleukin-6 pertama kali diidentifikasi pada pertengahan tahun 1980-an dan saat ini peran IL-6 dalam memodulasi respons imun semakin jelas diketahui dan produksi IL-6 yang berlebihan bertanggung jawab terhadap terjadinya inflamasi (Kishimoto., 2010; Rincon., 2012). 1. Struktur kimia dan fisiologi Interleukin-6 adalah anggota famili sitokin 4 helikal yang memberikan sinyal melalui IL-6 receptor (IL-6R) membran dan glicoprotein (gp) 130 (Krutgen & Jhon, 2011). Sitokin IL-6 berukuran 19-26 kD bertanggung jawab pada respons inflamasi akut yang memiliki efek lokal dan sistemik. Sitokin IL-6 merupakan homodimer dari polipeptida famili sitokin tipe I (Abbas, 2012a). Gen IL-6 manusia berada pada kromosom 7p21 dan 5. Interleukin 6 manusia terdiri dari 212 asam amino dan 27 yang diantaranya berperan sebagai peptida sinyal. Struktur tiga dimensi IL-6 manusia terdiri dari 4 bundel heliks (dua pasang heliks). Interleukin 6 memiliki beberapa peran dalam imunitas, inflamasi, sistem endokrin, sistem saraf, sistem hematopoietik, dan metabolisme tulang (Guzman et al., 2010). Interleukin-6 tidak dapat memberikan sinyal kepada gp130 sebelum berikatan dengan IL-6R membran. Hanya sel-sel tertentu saja yang mengeluarkan IL-6R yaitu sel hepatosit dan lekosit, sedangkan gp130 dihasilkan oleh banyak sel. Sel-sel yang hanya mengekspresi gp130 (tidak mengekspresi IL-6R) tidak respons terhadap IL-6 karena gp130 tidak dapat berikatan secara langsung dengan IL-6 tanpa IL-6R (Krutgen & John., 2011). Reseptor IL-6R terdiri dari sebuah rantai polipeptida yang dapat mengikat sitokin (cytokine-binding polypeptide chain). Glikoprotein 130 adalah sebuah unit transduksi yang dapat memberi sinyal kepada reseptor sitokin lain (Abbas, 2012a). Reseptor IL-6R berukuran 80 kDA dan gp130 berukuran 130 kDA (Kishimoto, 2010). Protein gp130 adalah protein transduser yang berperan pada jalur sinyal transmembran IL-6 (Heinrich et al., 2003; Kishimoto, 2010; Scheller et al., 2011). Protein gp130 tidak dapat berikatan secara langsung dengan IL-6 sebelum IL-6 berikatan dengan IL-6R atau sIL-6R. Apabila pembentukan sIL-6R terjadi secara berlebihan maka spektrum sel target IL-6 (jalur trans-signalling) akan meningkat. Reseptor sIL-6R dihasilkan dua mekanisme. Mekanisme pertama: sIL-6R berasal dari pembelahan proteolitik prekursor membran (IL-6R membran) oleh metalloprotease atau a-disintegrin and metalloprotease (ADAM) 17, dan mekanisme kedua: sIL-6R berasal dari transkripsi alternatif IL-6R-mRNA yang tidak memiliki transmembran dan sitosol domain (Scheller et al., 2011). Sitokin IL-6 memiliki aktivitas sebagai anttiinflamasi dan proinflamasi. Aktivitas IL-6 sebagai antiinflamasi dimediasi oleh jalur klasik dan aktivitas IL-6 sebagai proinflamasi dimediasi oleh jalur trans-sinyal (Scheller et al., 2011), Jalur klasik sinyal IL-6 (jalur antiinflamasi) terjadi bila IL-6 berikatan dengan IL-6R membran, kemudian ikatan kompleks antara IL-6 dan IL-6R berikatan dengan gp130 pada sel target (makrofag, netrofil, dan sel hepatosit), lalu terjadilah transduksi sinyal IL-6 (Heinrich et al., 2003; Scheller et al., 2011). Sinyal transduksi melibatkan aktivasi jalur janus kinase (JAK), aktivasi signal transducers and activators of transcription (STAT), dan mitogen-activated protein kinase (MAPK) (Heinrich et al., 2003). Jalur trans-sinyal IL-6 (jalur proinflamasi) terjadi bila sitokin IL-6 berikatan melalui soluble IL-6R (sIL-6R) dan memberi sinyal pada sel yang hanya mengekspresi gp130 (tidak mengekspresi reseptor IL-6R) (Krutgen & John., 2011; Rincon, 2012). Kadar IL-6 serum adalah rendah saat keadaan homeostatik, namun meningkat dengan cepat saat terjadi infeksi. Produksi IL-6 oleh monosit bergantung pada faktor transkripsi seperti NF-kβ, C/EPBb (CAAT/enhancer-binding protein beta, formerly NF-IL6), dan activating protein (AP)-1 (Naugler & Karin, 2007). Sitokin IL-6 disekresi oleh berbagai sel imun, antara lain: makrofag, sel epitel, dan sel imun lainnya setelah dirangsang oleh PAMP (Abbas, 2012a). IL-6 berperan dalam menentukan derajat berat infeksi karena memiliki waktu paruh yang lebih panjang dibandingkan sitokin proinflamasi lainnya (Andrijevic et al., 2014). Produksi IL-6 meningkat dengan cepat dan mencapai kadar puncak dalam waktu 3 jam setelah infeksi bakteri (Maruna et al.,, 2000). Peningkatan kadar IL-6 dapat merangsang peningkatan sitokin-sitokin lain saat berlangsungnya inflamasi. Waktu paruh IL-6 adalah 20-60 menit (Kishimoto., 2010; Zobel et al., 2012). 2. IL-6 sebagai penanda inflamasi pada pneumonia Antunes et al., 2002 melakukan penelitian tentang kadar sitokin proinflamasi pada penderita pneumonia yaitu IL-1β, TNF-α, dan IL-6. Kadar IL-6 meningkat pada awal masuk rumah sakit (admission) dan menurun secara signifikan saat perawatan hari ke-3 dan 5. Sitvokin IL-6 memiliki korelasi positif dengan skor stratifikasi keparahan berdasarkan Acute Physiology and Chronic Health Evaluation (APACHE) II dan skor BTS (terdiri dari 3 parameter yaitu frekuensi napas > 30/ menit, ureum > 7 mmol/ L, dan tekanan darah distolik < 60 mmHg). Penelitian Zobel et al., (2012) menemukan bahwa kadar IL-6 meningkat seiring dengan peningkatan stratifikasi keparahan penderita pneumonia. Peningkatan kadar IL-6 juga signifikan pada penderita pneumonia yang disebabkan oleh bakteri dibandingkan virus atau yang tidak diketahui etiologinya. Andrijevic et al.,, 2014, melakukan penelitian untuk mengetahui hubungan antara kadar IL-6 dengan risiko kematian dan sistim stratifikasi keparahan pneumonia komunitas salah satu diantaranya adalah PSI. Penelitian tersebut menemukan bahwa kadar IL-6 berkorelasi signifikan dengan skor PSI. Nilai sensitivitas IL-6 (cutt off 20,2 pg/ ml) dalam memprediksi mortalitas adalah 84% dan spesivisitas 87%. C. PRAVASTATIN Statin adalah obat pemghambat pembentukan kolesterol melalui penghambatan 3-hydroxy-3-methyl glutaryl coenzyme A reductase (HMG-CoA) (Mahley & Bersot, 2006). Kolesterol memiliki peran dalam tubuh antara lain adalah sebagai unsur penting pembentuk membran sel, sebagai prekursor lipoprotein, steroid, asam empedu, dan vitamin D (Liao & Laufs., 2005). Pravastatin adalah metabolit jamur dengan rantai methylbutirate ester dan rantai hydroxy acid analog atau menyerupai HMG-Coa reduktase (Mahley & Bersot., 2006).. Statin yang bersifat hidrofilik antara lain adalah pravastatin dan rosuvastatin, sedangkan yang bersifat lipofilik antara lain adalah simvastatin, atorvastatin, fluvastatin, dan lovastatin (Srinivasa et al., 2011). 1. Struktur sifat, dan sumber statin Statin dibagi atas tiga kelompok berdasarkan struktur kimianya yaitu: (Srinivasa et al., 2011). a. Kelompok analog substrat HMG-CoA. b. Kelompok cincin hidrofobik (hydrophobic rings) c. Kelompok cincin tepi (side rings group), seperti tampak pada gmbar 2. Gambar.2. struktur kimia statin (Stancu & Sima 2001) 2. Mekanisme keja Kebanyakan sintesis kolesterol terjadi di dalam hati. Kadar kolesterol berkurang bila sintesis kolesterol dihambat melalui penghambatan HMG-CoA reductase (Liao & Laufs., 2005). Penghambatan terhadap HMG-CoA reductase akan mereduksi kolesterol intrasel, menginduksi aktivasi protease yang mengikis sterol regulatory element binding proteins (SREBPs) dari retikulum endoplasma. Sterol regulatory element binding proteins mengalami translokasi pada tingkat nukleus dan meningkatkan ekspresi gen untuk reseptor LDL. Penurunan kolesterol dalam hepatosit menyebabkan peningkatan reseptor LDL di hati, yang menentukan pengurangan sirkulasi LDL dan prekursornya [intermediate density (IDL) dan very low densitylipoproteins (VLDL) (Stancu & Sima., 2001). 3. Efek Pleiotropik Statin Statin memiliki efek pleotropik yaitu sifat antiinflamasi, imunomodulator, dan antibakteri (Chalmers et al., 2010; Wunderink et al., 2012). Efek statin tampak pada tabel 1 Tabel 1. Efek pleiotropik statin Efek statin ( Viasus et al., 2010) 4. Antiinflamasi Efek antiinflamasi statin terhadap NF-kB dan aktivasi AP-1 telah menjadi topik besar dan menarik (Jain et al 2005). Penurunan penanda inflamasi seperti Creactive protein (CRP) selama pemberian statin menunjukkan bahwa statin dapat mempengaruhi kaskade inflamasi (Meij., 2013; Mahley & Bersot., 2006). Aktivasi pada permukaan sel dan jalur sinyal sitosol berujung pada tingkat nukleus yang mengatur ekspresi gen. Berbagai rangsangan proinflamasi berpusat pada jalur transkripsi utama seperti NF-kB dan AP-1 yang menginduksi ekspresi gen (Jain & Ridker., 2005). Penghambatan statin terhadap jalur mevalonat mengakibatkan pembentukan molekul isoprenoid yaitu farnesyl pyrophosphate (FPP) dan geranylgeranyl pyrophosphate (GPP) terhambat. Interaksi antara FPP dan GPP dengan protein sitoplasma seperti protein Rho, Rac, Ras, dan Rab berperan penting dalam regulasi sitokin, kemokin, molekul adhesi, protein fase akut, faktor koagulasi, dan enzim (Viasus et al., 2010). Protein Rho dan Rac menginduksi aktivitas NF-kB melalui beberapa mekanisme antara lain menyebabkan fosforilasi IκB dan membatasi akumulasi NF-kB dalam nukleus. Nuclear factor kappa B berada dalam sitoplasma berikatan dengan inhibitor NF-kB (IκB). Respons inflamasi menyebabkan IκB terfosforilasi dan terdegradasi sehingga NF-kB bebas bertranslokasi ke nukleus dan menginduksi ekspresi gen target. Statin terbukti membatasi akumulasi NF-kB nukleus dan mengikat DNA melalui peningkatan ekspresi IκB (Jain & Ridker, 2005). Nuclear factor-kappa B dibentuk oleh protein dimer (contoh heterodimer p50/ p65), mengatur ekspresi gen yang terlibat pada inflamasi, proliferasi, dan apoptosis. Ikatan secara langsung antara protein IkB dengan dimer NFKB di dalam sitoplasma akan menghambat translokasi NF-kB ke nukleus. Faktor NF-kB bebas bertranslokasi dan berikatan dengan DNA pada gen target pada saat IkB terfosforilasi oleh IkB kinase (IKK) kompleks (Riganti et al., 2008). Penghambatan HMG-CoA reductase mengakibatkan penurunan farnesylated dan geranylgeranylated small G - protein seperti protein Rho GTPase, sehingga terjadi penghambatan sinyal Rho (Iwata et al., 2012). Protein Rho/ Rac merupakan subkelompok (subfamili) dari superfamili Ras GTP hydrolase (GTPase). Famili Rho/ Rac yang terdapat pada manusia dibagi atas enam subfamili yaitu Rho, Rac, Cdc42, Rnd, RhoBTB, dan RhoT/ Miro. Protein RhoBTB dan RhoT protein juga disebut sebagai 'Rho/ Rac GTPases atipik karena mereka sangat berbeda dari subfamili GTPase lain berdasarkan struktur, regulatori dan fungsional (Bustelo et al., 2007). Rho/ Rac GTPase berperilaku sebagai '' molekul switch '' yang bersifat fluktuatif yaitu dalam keadaan “on” atau aktif bila berikatan dengan GTP dan keadaan “off” atau inaktif bila berikatan dengan GDP (Boureux et al., 2007; Bustelo et al., 2007). 5. Immunomodulator Statin menekan perkembangan Th1, hal tersebut terjadi kemungkinan karena statin secara langsung mempengaruhi jalur sinyal STAT4, sehingga menghambat pengembangan Th1 (Hakamada et al., 2003). Statin dapat menghambat perkembangan Th1 terjadi melalui penghambatan/ pelemahan sinyal NF-kB (Jasinska et al., 2007). Pengembangan sel T naive menjadi sel Th1 atau Th2 dipengaruhi oleh beberapa faktor diantaranya adalah APC dan molekul kostimulator (Hakamada et al., 2003). Molekul MHC-II diekspresikan pada permukaan sel APC dan secara langsung terlibat dalam pengendalian respons imun. Hanya sejumlah sel mengekspresikan MHC-II secara konstitutif, sel-sel lain mengekspresi MHC-II bila diinduksi oleh mediator inflamasi seperti IFN-γ. Statin dapat mengatur ekspresi MHC-II yang diinduksi oleh IFN-γ pada sel APC, dan mengakibatkan aktivasi sel T menjadi berkurang (Jasinska et a.,, 2007). Sifat imunomodulasi statin memberikan wawasan baru, termasuk dampaknya terhadap sinyal CD40, ekspresi MHC-II, dan respons imun sel Th2. Sinyal CD40 melalui aktivasi sel vaskular telah terbukti menginduksi respons inflamasi dengan ekspresi molekul adhesi, sitokin proinflamasi, kemokin, dan matriks metalloproteinase (MMP). Sel T CD4 + dan platelet teraktivasi mengekspresi CD40L. HMG-CoA reduktase dapat mengganggu sinyal CD40/ CD40L di beberapa tingkat. Statin mengurangi peningkatan kadar CD40L plasma yang terutama berasal dari platelet, serta mengurangi ekspresi CD40L permukaan sel dan CD40 pada sel-sel otot polos pembuluh darah (VSMC), monosit, makrofag, dan limfosit T. Statin mereduksi stimulator CD40/CD40L (lemak termodifikasi, sitokin, growth factor) melalui penurunan lemak dan oksidasi. Ligan PPARγ, seperti rosiglitazone dan troglitazone terbukti dapat menghambat ekspresi dan pelepasan CD40L pada permukaan platelet, sehingga jalur molekuler ini tampaknya berkontribusi terhadap efek antiinflamasi dan imunomodulator statin (Jasinska et al., 2007). Peran statin dalam mengatur respons imun mungkin terjadi melalui jalur sitokin sel Th, dan telah dilaporkan bahwa statin dapat mengatur keseimbangan Th1/ Th2, sehingga temuan jalur ini menunjukkan efek menguntungkan statin. Sel Th2 mensekresi sitokin seperti IL-4,5,10, dan TGF-B. Sel Th1 memperantarai imunitas seluler proinflamasi dengan mengeluarkan sitokin seperti IL-2, IL-12 dan TNF-α (Jasinka et al., 2007). Statin memiliki sifat aksi lain yaitu menghambat leucocyte function-associated antigen-1 (LFA-1) (Viasus et al., 2010). Leucocyte function-associated antigen-1 konstitutif disajikan dalam keadaan tidak aktif pada permukaan leukosit, dan memberikan respons terhadap beberapa stimulus (seperti ikatan silang antara reseptor sel T dengan MHC-II), dan LFA-1 akan berikatan dengan ICAM-1 lalu memberikan sinyal kostimulasi untuk pengaktivan sel T (Jasinska et al., 2007). Statin telah terbukti mengikat LFA-1 yang sangat penting untuk ikatan ICAM-1pengikatan, dan pemblokiran interaksi LFA-1 dan intercellular adhesion molecule (ICAM)-1 telah dibuktikan dapat mempromosikan penegembangan Th2, oleh karena itu, tidak tertutup kemungkinan bahwa penghambatan kostimulasi sel T yang diperantarai LFA-1 oleh statin dapat mempromosikan pengembangan Th2. Sel Th2 mediasi imunitas humoral dan menurunkan regulasi respons inflamasi (Hakamada et al., 2003). 6. Antibakterial Statin menginduksi antihiperlipidemia melalui penghambatan HMG-CoA reductase. Peranan HMG-CoA reduktase sangat penting dalam sel-sel bakteri yang diperlukan untuk biosintesis isoprene, namun HMG-CoA reductase bakteri memiliki struktural yang berbeda dan afinitasnya dengan statin yang 10 ribu kali lebih lemah dibandingkan pada eukariota. (Masadeh et al., 2012; Jerwood & Cohen, 2008). Efek antibakteri statin diteliti dalam satu penelitian dengan metode metaanalisis, yang menunjukkan bahwa hasil penggunaan statin bermanfaat dalam pengobatan dan pencegahan infeksi yang berbeda pada penerima transplantasi organ solid transplantasi (Masadeh et al., 2012). Aktivitas antimikroba statin secara langsung tidak terbukti, sepertinya aktivitas antimokroba berasal dari efek statin pada sel inang. Statin telah terbukti menurunkan kadar LDL dengan mengganggu sintesis mevalonat. Pengurangan kadar mevalonat berpotensi mempengaruhi inflamasi yang diinduksi patogen. Penghambatan mevalonat dapat mempengaruhi jalur sinyal sel sehingga dapat mengurangi penanda inflamasi plasma, sel T, aktivasi monosit, dan pembekuan darah (Kozarov et al., 2014). Penelitian Masadeh et al., 2012 tentang efek antibakteri statin dan membandingkan efek antibakteri diantara obat golongan statin yaitu atorvastatin, simvastatin, dan rosuvastatin. Penelitian tersebut menyimpulkan bahwa statin memiliki potensi sebagai antibakteri terutama atorvastatin dan simvastatin (Masadeh et al., 2012). Penelitan terbaru menyebutkan bahwa statin menurunkan kolesterol membran, terutama mevalonat-isoprenoid pada jalur sterol, mempromosikan maturasi fagosom (EEA-1/Lamp-3) dan autophagy M. tuberkulosis oleh makrofag. Hasil ini memperkirakan bahwa reduksi kolesterol dalam membran fagosom menghilangkan ”inhibisi maturasi fagosom” yang diinduksi bakteri dan mempromosikan autophagy yang diinduksi oleh inang, sehingga memperlihatkan aktivitas antimikroba dan melindung inang dari infeksi tuberkulosis. Inhibisi terjadinya reduksi sintesis mevalonat memperantarai isoprenoid (FPP dan GPP), sehingga menyebabkan modulasi prenylation pascatranslasi pada Ras, Rho, dan Rac (Kozarov et al., 2014). Penelitian Jerwood dan Cohen., 2008 membuktikan keuntungan penggunaan statin untuk mencegah infeksi melalui efek antimikroba statin (Jerwood & Cohen., 2008). Penelitian in vivo menunjukkan keuntungan penggunaan simvastatin dapat mereduksi kasus acute lung injury (ALI) pada inflamasi paru yang terinduksi oleh LPS. Pemberian simvastatin sebelum dan sesudah ALI dapat mengurangi influks netrofil kedalam paru dan menurunkan permeabilitas paru, sehingga mengindikasikan peran protektif simvastatin pada inflamasi paru (Grommes et al., 2012). Mekasnisme proteksi yang dimediasi simvastatin pada ALI yang terinduksi LPS sepertinya karena penurunan formasi reactive oxygen species (ROS), oksidasi LDL, dan adhesi netrofil, fagositosis bakteri dan bersihan bakteri masih belum jelas. Pengertian formasi ROS adalah ikatan Rac-1dengan p67phox yang mengaktivasi sistem oksidasi NADPH dan pembentukan ROS. Berdasarkan keterangan diatas berarti statin menghambat Rac, menekan pembentukan ROS yang bergantung pada oksidasi NADPH yang diperantarai oleh Rac (Kozarov et al., 2014). 7. Farmakokinetik Pravastatin tidak berikatan dengan protein plasma dan kadar pravastatin dalam darah lebih tinggi dibandingkan statin lainnya dan pravastatin dapat diabsorbsi secara pada saluran cerna.. Faktor jenis kelamin dan usia tidak mempengaruhi farmakokinetik pravastatin. Metabolisme pravastatin terjadi dalam hati dan saluran cerna. Ekskresi pravastatin melalui ginjal sebanyak 60 %. Dosis mempengaruhi efek terapi pravastatin Efek terapi pravastatin juga dapat dipengaruhi oleh obat-obat lain yang dapat menghambat metabolisme statin (Gazzero et al., 2012). 8. Dosis terapi Dosis terapi pravastatin adalah 40 mg perhari. Absorbsi pravastatin akan lebih baik bila pemberian pravastatin pada saat perut kosong (Gazzero et al., 2012). 9. Efek samping Efek samping pravastatin adalah mual, muntah, nyeri perut, diare, konstipasi, dan ruam kulit, namun efek samping ini jarang terjadi (Maji et al., 2013). Efek samping pravastatin terhadap otot paling kecil atau sedikit dibandingkan obat statin lain (Gazzero et al., 2012). Pemberian secara bersamaan statin dengan inhibitor sitokrom p450 atau obat penghambat metabolisme statin dapat menyebabkan miopati (Stancu & Sima., 2001; Malloy & Kane., 2012). Miopati atau miositis ditandai dengan adanya gejala otot difus yang dikaitkan dengan kenaikan kadar kreatinin kinase > 10 kali nilai tertinggi kadar normal (Maji et al., 2013). Bila muncul gejala seperti rasa nyeri, nyeri tekan, dan kelemahan otot, maka pemberian pravastatin harus segera dihentikan dan dianjurkan untuk dilakukan pemeriksaan kreatinin serum (Malloy & Kane., 2012). Penggunaan pravastatin 40 mg perhari dalam jangka waktu panjang tidak menimbulkan efek samping yang berarti (Pfeffer et al., 2002). 10. Kontraindikasi Ibu hamil belum terbukti aman menggunakan statin sehingga tidak dianjurkan menggunakan pravastatin. Pravastatin juga tidak dianjurkan pada ibu menyusui (Malloy & Kane., 2012, Mahley & Bersot., 2006). 11. Pengaruh pravastatin Penelitian Makris et al., (2011) menemukan bahwa frekuensi terjadinya kasus VAP menurun pada pasien-pasien yang dirawat di ruang intensif yamg menerima terapi statin dengan dosis 40 mg perhari. Pravastatin juga menurunkan angka kematian pada pasien yang dirawat di ruang intensif. Penelitian Iwata et al., (2012) menemukan penurunan kadar IL-6 setelah pemberian pravastatin lipopolisakarida bakteri. pada sel epitel Penghambatan bronkus yang HMG-CoA distimulasi reductase dengan menurunkan farnesylation dan geranylgeranylation terhadap protein Rho, sehingga jalur sinyal Rho terhambat. Proses terjadinya pneumonia dan peningkatan kadar IL-6 diringkas dalam kerangka teori seperti tampak pada gambar 3. Invasi Bakteri Parenkim Paru Bakteri gram (+) Bakteri gram (-) Asam Lipoteikoik Peptidoglikan Liposakarida TLR-4 TLR-4 Sel Epitel Bronkus TLR-2 Makrofag alveolar Sel Penyaji Antigen (Sel dendritik) MHC-II NF-қB TCR IL-12 IL-6 Sel Th CD4 IL-8 IL-4 IL-1α Sel Th1 Netrofil TNF-α IL1,IL-4, IL-6 Sel Th2 Sel Th17 MHC-I ROS Defensin IFN-γ IL-2 Sel T CD8 Eliminasi mikroba berhasil Inflamasi parenkim paru Sel T Sitolitik CD8 Eliminasi mikroba gagal Infiltrasi PMN dan eritrosit intraalveoli Sembuh dan Reaksi inflamasi menurun. Inflamasi menetap dan meningkat Infiltrasi PMN dan eritrosit Edema alveoli Infiltrasi PMN dan eritrosit intraalveoli Klinis pneumonia: Batuk Sesak napas Hipoksemia PNEUMONIA Keterangan: = mempengaruhi = meningkat Gambar 3. Kerangka teori Granzyme Perforine Merusak sel-sel yang terinfeksi mikroba D. KERANGKA KONSEPTUAL PENELITIAN Berdasarkan landasan teori yang sudah disampaikan sebelumnya yaitu pneumonia disebabkan antara lain infeksi bakteri gram (+) dan gram (-). Asam lipoteikoik dan peptidoglikan,bakteri gram (+) dan LPS bakteri gram (-) bersifat imunogenik. Inflamasi yang dihasilkan oleh respons imun berpern untuk mengeliminasi mikroba patogen, tetapi inflamasi yang berkepanjangan dan berlebihan berakibat kerusakan jaringan. TLR-2 yang terdapat pada permukaan sel dendritik mengenali dan berintraksi dengan asam lipoteikoik dan peptidoglikan bakteri gram (+) sedangkan TLR-4 yang terdapat pada permukaan makrofag dan sel epitel bronkus dan alveoli mengenali LPS bakteri gram negatip. Sel dendritik menyajikan asam lipoteikoik dan peptidoglikan ke sel Th CD4 melalui MHC-II yang berikatan dan berinteraksi dengan TCR (T cell receptor) dan sel penyaji antigen mengeluarkan sitokin IL-12 untuk mempromosikan diferensiasi sel Th CD4 menjadi sel Th1. Sel Th1 mengeluarkan IFN-γ untuk mengaktivasi dan merangsang makrofag untuk memproduksi IL-12. Interaksi sel epitel dan makrofag dengan LPS bakteri gram (-) melalui TLR-4 mengaktivasi NF-kβ dan menghasilkan sitokin proinflamasi IL-6, IL-1β, dan TNF-α. Efek pleiotropik pravastatin sebagai antiinflamasi akan mengendalikan inflamasi yang berlebihan yang ditandai dengan penurunan kadar IL-6 melalui penghambatan faktor transkripsi NF-kβ, sehingga lama rawat inap dapat dipercepat Kerangka konseptual penelitian tampak pada gambar 4. PNEUMONIA A ANTIMIKROBA Mikroba R E Aktivasi NF-қB PRAVASTATIN IL-6 A P Lokal dan sistemik E N Inflamasi berkepanjangan dan berlebihan E L I PRAVASTATIN Kerusakan struktur Patofisiologi Gangguan patologis paru dan sistemik Gangguan difusi Gejala dan tanda klinis Hipoksemia Sesak napas, batuk,demam. T I Pemeriksaan penunjang : Radiologi: foto toraks Patologi klinik: darah lengkap, kimia darah, IL-6, Mikrobiologi: kultur gram Takikardi, hipotensi, gangguan kesadaran Keterangan: = mempengaruhi/ induksi = meningkat = menghambat/ inhibisi = menurun Gambar 4. Kerangka konseptual penelitian. A N E. HIPOTESIS 1. Adakah pengaruh pemberian pravastatin terhadap kadar IL-6 pada penderita pneumonia? Terdapat pengaruh pemberian pravastatin terhadap penurunan kadar IL-6 pada penderita pneumonia. 1. Adakah pengaruh pemberian pravastatin terhadap percepatan lama rawat inap penderita pneumonia? Terdapat pengaruh pemberian pravastatin terhadap percepatan lama rawat inap penderita pneumonia.