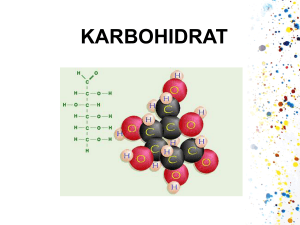
pemanfaatan selulosa bakteri - polivinil alkohol (pva)
advertisement

PEMANFAATAN SELULOSA BAKTERI - POLIVINIL ALKOHOL (PVA) HASIL IRADIASI (HIDROGEL) SEBAGAI MATRIKS TOPENG MASKER WAJAH SKRIPSI Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi Oleh : ELI FELASIH 106102003400 PROGRAM STUDI FARMASI FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA 2010 M/1431 H i LEMBAR PERNYATAAN DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI BENARBENAR HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA PENDIDIKAN MANAPUN. Jakarta, September 2010 Eli Felasih 106102003400 ii ABSTRAK PEMANFAATAN SELULOSA BAKTERI – POLIVINIL ALKOHOL (PVA) HASIL IRADIASI (HIDROGEL ) SEBAGAI MATRIKS TOPENG MASKER WAJAH Salah satu pemanfaatan air kelapa adalah untuk pembuatan nata de coco atau selulosa bakteri. Dengan modifikasi penambahan polivinil alkohol (PVA) akan diperoleh selulosa bakteri – polivinil alkohol (PVA) yang dapat digunakan untuk keperluan medis khususnya dalam bidang kosmetik. Penelitian dilakukan dengan menggunakan vitamin C yang digunakan sebagai model. Hasil radiasi antara selulosa bakteri – polivinil alkohol (PVA) menghasilkan hidrogel yang diperoleh dari proses pembentukan ikatan silang (crosslinking). Polivinil alkohol (PVA) yang berupa polimer hidrofilik yang banyak digunakan karena bersifat tidak toksik, kemampuan menyerap yang tinggi, dan tidak karsinogenik. Hasil uji dari ketebalan selulosa kering 0,028 mm, absorpsi 238,773 %, kekuatan tarik 1137 kg/cm2, elongasi 86,666 %, 89,655 % setelah diradiasi dengan berkas elektron sedangkan selulosa bakteri basah mempunyai ketebalan 0,090 mm. Laju pelepasan vitamin C ditentukan dengan alat uji difusi dalam medium aquabidest pH 7 pada suhu 37 ± 0,5 0C, kecepatan 50 rpm selama 1 jam. Hasil uji difusi menunjukkan bahwa profil pelepasan matriks selulosa bakteri – pva + vitamin C mengikuti kinetika orde nol dengan mekanisme difusi. Kata kunci : iradiasi, selulosa bakteri, gel fraksi, kekuatan tarik, elongasi, difusi v ABSTRACT UTILIZATION OF BACTERIAL CELLULOSE – PVA AFTER IRRADIATION (HYDROGEL) AS A FACE MASK MATRIX One of the utilization of coconut water is produce nata de coco or bacterial cellulose. Modification by addition of polyvinyl alcohol will collected cellulose bacteria - PVA which it can be used for medical purposes, especially in the cosmetics. Using the vitamin c as a model was choosen this research. The results collect form of a matrix obtained from the process of forming crosslinking (crosslinking) between bacterial cellulose and PVA in the form of hydrophilic polymer that is widely used because harmless, the high ability to absorb, and not carcinogenic. So it can be applied as a face mask matrix. Pva used with various concentration are 2%, 4%, and 6%. The test results characteristics of hydrogels include thickness of dry cellulose 0.028 mm, strengthent of PVA 6% about 238,773 %, strengthen is 1137 kg/cm2, elongation 86.666%, gel fraction after irradiated with electron beam is 89.655% while the wet bacterial cellulose has a thickness of 0.090 mm. Rate of vitamin c release is determined by test equipment aquabidest diffusion in the medium pH 7 at 37 ± 0.5 0C, at 50 rpm for 1 hour. Diffusion test results showed that the release profile of bacterial cellulose matrix - PVA + vitamin C followed zero order kinetics with a diffusion mechanism rule. Keyword : irradiation, bacterial cellulose, fraction gel, strengthen, elongation, diffusion vi KATA PENGANTAR Puji dan syukur dipanjatkan kehadirat Allah SWT atas segala limpahan nikmat, rahmat dan ridho-Nya sehingga penyusunan skripsi ini dapat diselesaikan. Skripsi yang berjudul ‘‘Pemanfaatan Selulosa Bakteri – Polivinil alkohol (PVA) Hasil Iradiasi (Hidrogel) Sebagai Matriks Topeng Masker Wajah’’ ini disusun dalam rangka memenuhi persyaratan untuk memperoleh gelar Sarjana Sains pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan, UIN Syarif Hidayatullah Jakarta. Selama penelitian dan penyusunan skripsi ini tidak terlepas dari bimbingan, bantuan dan dukungan dari berbagai pihak. Oleh karena itu, ucapan terima kasih dengan seikhlas hati dihanturkan kepada Bapak Dr. Darmawan Darwis, M. Sc,. Apt., selaku Pembimbing BATAN dan Ibu Yuni Anggraeni, S. Si, Apt., selaku pembimbing UIN Syarif Hidayatullah yang telah meluangkan waktu, perhatian dan tenaganya untuk memberikan bimbingan dan pengarahan selama penelitian dan penyusunan skripsi. Ucapan terima kasih juga disampaikan kepada: 1. Bapak Prof. Dr. dr. M.K Tadjudin, Sp. And, selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta. 2. Bapak Drs. Muhammad Yanis Musdja, M. Sc,. Apt, selaku Ketua Program studi Farmasi FKIK UIN Syarif Hidayatullah Jakarta dan dosen penguji I yang telah meluangkan waktu untuk memberikan arahan dan bimbingannya selama menyusun skripsi ini. 3. Dosen-dosen Farmasi UIN dan Staff yang telah membimbing dan memberikan ilmu pengetahuannya selama ini. vii 4. Ibu Lely Hardaningsih, Ibu Ilin, Ibu Yessi, Ibu Ayu, Ibu Farah, Bapak Erizal, Bapak Basril, Bapak Nikam, Bapak Mursalih dan seluruh staff peneliti dan pegawai Laboratorium Sterilisasi Bidang Proses Industri BATAN, Jakarta yang telah memberikan dukungan dan bantuan selama penelitian berlangsung. 5. Untuk kedua orang tua tercinta, ibunda Hj. Muhibah dan ayahanda H. Puryanto, kakak, saudara – saudara ku tersayang atas doa, cinta dan kasih sayang, kesabaran, dan dukungan baik moril maupun materil. Semoga Allah SWT selalu melindungi. 6. Teman-teman farmasi 2006 dan teman terdekat ku (pipit, acit, gita, alfi, hana, icha, yunita, nindi, reni, eka w, syifa) atas dukungan selama kuliah. 7. Teman-teman 11 pejuang (Irma, rico, landing, amal, Sheila, lisna, yayah, tiwi, ardian, hilda). 8. Semua pihak yang tidak dapat disebutkan satu persatu yang turut membantu menyelesaikan skripsi ini. Akhirnya penulis sebagai manusia biasa menyadari dan merasa bahwa skripsi ini masih jauh dari sempurna, karena itu penulis pun terbuka terhadap kritik dan saran yang sifatnya membangun. Meskipun demikian penulis berharap semoga hasil penelitian ini dapat berguna untuk pihakpihak lain yang memerlukan. Jakarta, September 2010 Penulis viii DAFTAR ISI Halaman COVER...........................................................................................................i LEMBAR PERNYATAAN...........................................................................ii LEMBAR PERSETUJUAN..........................................................................iii LEMBAR PENGESAHAN SKRIPSI...........................................................iv ABSTRAK.....................................................................................................v ABSTRACT..................................................................................................vi KATA PENGANTAR..................................................................................vii DAFTAR ISI.................................................................................................ix DAFTAR TABEL........................................................................................xii DAFTAR GAMBAR..................................................................................xiii DAFTAR LAMPIRAN................................................................................xv BAB I PENDAHULUAN 1.1 Latar Belakang...........................................................................1 1.2 Perumusan Masalah.................................................................. 4 1.3 Hipotesis....................................................................................4 1.4 Tujuan Penelitian.......................................................................5 1.5 Manfaat Penelitian.....................................................................5 BAB II TINJAUAN PUSTAKA 2.1 Kelapa........................................................................................6 2.1.1 Deskripsi Kelapa.................................................................6 2.1.2 Penyebaran Kelapa............................................................. 7 2.1.3 Kandungan Nutrisi dan Manfaat Kelapa.............................8 2.2 Sukrosa....................................................................................12 2.3 Amonium Sulfat .....................................................................12 2.4 Selulosa Bakteri.............................................................. ........13 2.4.1 Struktur Selulosa Bakteri..................................................14 2.4.2 Aplikasi Selulosa Bakteri..................................................15 2.4.3 Sumber Selulosa................................................................20 2.4.4 Pelikel Selulosa Bakteri.....................................................21 2.4.5 Pembuatan Pelikel Selulosa...............................................22 2.5 Acetobacter Xylinum.............................................. ................24 2.5.1 Deskripsi A.Xylinum..........................................................24 2.5.2 Tingkat Bahaya A.Xylinum................................................25 2.5.3 Pertumbuhan Bakteri A.Xylinum............................. .........26 2.6 Hidrogel...................................................................................27 2.6.1 Sintesis Hidrogel...............................................................29 2.6.2 Sifat Fisika – Kimia Hidrogel ...........................................32 2.7 Masker.....................................................................................35 ix 2.7.1 Jenis-Jenis Masker.............................................................35 2.7.2 Mekanisme Kerja Masker..................................................36 2.8 Antioksidan........................................................................ .....37 2.9 Polivinil Alkohol.....................................................................38 3.0 Asam Askorbat........................................................................39 3.1 Radiasi.....................................................................................39 3.1.1 Sumber Radiasi..................................................................40 3.1.2 Dosis Radiasi................................................................. ...43 3.1.3 Efek Radiasi pada Polimer............................................... 44 3.1.4 Keunggulan menggunakan Mesin Berkas Elektron.. .......45 3.2 Radiofarmasi............................................................................46 B III KERANGKA KONSEP 3.1 Alur Penelitian..................................................................... ...51 BAB IV METODOLOGI PENELITIAN 4.1 Tempat dan Waktu Penelitian.................................................52 4.2 Alat dan Bahan Penelitian.......................................................52 4.2.1 Alat Penelitian........................................................... ...... 52 4.2.2 Bahan Penelitian................................................................52 4.3 Prosedur Penelitian................................................................. 53 4.3.1 Pengumpulan Tanaman.............................................. .....53 4.3.2 Pembuatan Starter....................................................... ......53 4.3.3 Pengembangan Starter A.Xylinum.....................................53 4.3.4 Pembuatan Membran Selulosa Bakteri.............................55 4.3.5 Pembuatan Larutan Polivinil alkohol.......................... .....60 4.3.6 Optimasi Waktu Perendaman Membran Selulosa – PVA.60 4.3.7 Pembuatan Membran Selulosa Bakteri – PVA.................61 4.3.8 Pembuatan Membran Selulosa Bakteri – PVA + Vit.C....61 4.3.9 Karakterisasi Membran Selulosa – PVA Sebelum dan Sesudah Radiasi………………………………………….61 4.4 Analisa Data……………………………………………...…67 BAB V HASIL PENELITIAN DAN PEMBAHASAN 5.1 Hasil Penelitian........................................................................68 5.1.1 Pengumpulan.....................................................................68 5.1.2 Hasil Uji Tebal Membran Selulosa Basah dan Kering Sebelum Radiasi ...............................................................68 5.1.3 Hasil Optimasi Waktu Perendaman Membran Selulosa Bakteri – PVA.................. ................................................68 5.1.4 Hasil Uji Sifat Mekanik Membran Selulosa Bakteri – PVA Sebelum dan Sesudah Radiasi...........................................69 5.1.5 Hasil Uji Gel Fraksi Membran Selulosa Bakteri – PVA Sesudah Radiasi.................................................................72 5.1.6 Penentuan Panjang Gelombang Maksimum Vitamin C..........................................................................73 5.1.7 Pembuatan Kurva Kalibrasi Vitamin C.............................73 5.1.8 Profil Difusi Vitamin C.....................................................74 x 5.2 Pembahasan.............................................................................75 5.2.1 Pembuatan Membran Selulosa Bakteri...................... ......75 5.2.2 Hasil Uji Ketebalan Membran Selulosa Bakteri............... 75 5.2.3 Hasil Uji Daya Absorpsi Membran Selulosa Bakteri – PVA...................................................................................78 5.2.4 Hasil Uji Kekuatan Tarik Hidrogel (Selulosa Bakteri – PVA Hasil Iradiasi)......................................................... .78 5.2.5 Hasil Uji Gel Fraksi (Selulosa Bakteri – PVA Hasil Iradiasi)............................................................................. 80 5.2.6 Uji Penetrasi Vitamin C (Selulosa Bakteri – PVA 2 %, 4 %, 6 %)................................... ..........................................80 5.2.7 Data Hasil ANNOVA.................................................... ...82 BAB VI KESIMPULAN DAN SARAN 6.1 Kesimpulan............................................................................. 84 6.2 Saran........................................................................................85 DAFTAR PUSTAKA...................................................................................86 LAMPIRAN.................................................................................................90 xi DAFTAR TABEL Halaman Tabel 1 Hasil Uji Tebal Membran Selulosa Basah dan Kering Sebelum Radiasi...........................................................................................11 Tabel 2 Hasil Optimasi Waktu Perendaman Membran Selulosa Bakteri – PVA ..............................................................................................19 Tabel 3 Hasil Uji Sifat Mekanik Membran Selulosa Bakteri – PVA ........44 Tabel 4 Hasil Uji Gel Fraksi Membran Selulosa Bakteri – PVA Sesudah Radiasi...........................................................................................68 Tabel 5 Penentuan Panjang Gelombang Maksimum Vitamin C................69 Tabel 6 Pembuatan Kurva Kalibrasi Vitamin C.........................................70 Tabel 7 Profil Difusi Vitamin C.................................................................70 xii DAFTAR GAMBAR Halaman Gambar 1 Polivinil alkohol........................................................................7 Gambar 2 Air Kelapa...............................................................................12 Gambar 3 Biakan Acetobacter xylinum....................................................14 Gambar 4 Amonium.................................................................................15 Gambar 5 Nata de coco............................................................................17 Gambar 6 Asam Askorbat........................................................................25 Gambar 7 Alat Mikrometer......................................................................38 Gambar 8 Alat Pemotong Sampel............................................................39 Gambar 9 Alat Difusi...............................................................................43 Gambar 10 Alat Tensiometer.....................................................................45 Gambar 11 Stainles steel net......................................................................55 xiii DAFTAR LAMPIRAN Lampiran 1 Lampiran 2 Lampiran 3 Lampiran 4 Lampiran 5 Lampiran 6 Lampiran 7 Lampiran 8 Lampiran 9 Lampiran 10 Lampiran 11 Lampiran 12 Lampiran 13 Lampiran 14 Lampiran 15 Lampiran 16 Lampiran 17 Lampiran 18 Lampiran 19 Lampiran 20 Lampiran 21 Lampiran 22 Halaman Gambar Bahan, alat Penelitian, SEM Selulosa Bakteri…....90 Hasil Tebal Membran Selulosa Bakteri ...............................93 Tabel Hasil Optimasi Waktu Perendaman Membran Selulosa Bakteri dengan PVA 2 %, 4 %, 6 %......................95 Hasil Elongasi Membran Selulosa Bakteri – PVA 2 % Tanpa Radiasi…………………………………....... …………..…95 Hasil Elongasi Membran Selulosa Bakteri – PVA 4 % Tanpa Radiasi...............…….................................... …………..…95 Hasil Elongasi Membran Selulosa Bakteri – PVA 6 % Tanpa Radiasi..................................................................................95 Hasil Elongasi Membran Selulosa Bakteri – PVA 2 % Setelah Radiasi.....................................................................95 Hasil Elongasi Membran Selulosa Bakteri – PVA 4 % Setelah Radiasi.......... ..........................................................96 Hasil Elongasi Membran Selulosa Bakteri – PVA 6 % Setelah Radiasi................ …………………………...….....96 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 2 % Tanpa Radiasi.......................................................................96 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 4 % Tanpa Radiasi.......................................................................96 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 6 % Tanpa Radiasi.......................................................................97 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 2 % Setelah Radiasi....................................................................97 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 4 % Setelah Radiasi....................................................................97 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 6 % Setelah Radiasi....................................................................97 Hasil Elongasi Membran Selulosa Bakteri – PVA 2 % + Vit.C Tanpa Radiasi.............................................................98 Hasil Elongasi Membran Selulosa Bakteri – PVA 4 % + Vit.C Tanpa Radiasi.............................................................98 Hasil Elongasi Membran Selulosa Bakteri – PVA 6 % + Vit.C Tanpa Radiasi.............................................................98 Hasil Elongasi Membran Selulosa Bakteri – PVA 2 % + Vit.C Setelah Radiasi............................................................98 Hasil Elongasi Membran Selulosa Bakteri – PVA 4 % + Vit.C Setelah Radiasi.......... .................................................99 Hasil Elongasi Membran Selulosa Bakteri – PVA 6 % + Vit.C Setelah Radiasi.............. …………………………….99 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 2 % + Vit.C Tanpa Radiasi..........................................................99 xiv Lampiran 23 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 4 % + Vit.C Tanpa Radiasi..........................................................99 Lampiran 24 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 6 % + Vit.C Tanpa Radiasi........................................................100 Lampiran 25 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 2 % + Vit.C Setelah Radiasi.....................................................100 Lampiran 26 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 4 % + Vit.C Setelah Radiasi.....................................................100 Lampiran 27 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 6 % + Vit.C Setelah Radiasi.....................................................100 Lampiran 28 Hasil Gel Fraksi Membran Selulosa Bakteri – PVA 2 %, 4 %, 6 %................................................................................101 Lampiran 29 Hasil Gel Fraksi Membran Selulosa Bakteri – PVA 2 %, 4 %, 6 % + Vit.C ..................................................................101 Lampiran 30 Penentuan Panjang Gelombang Vit.C................................102 Lampiran 31 Kurva Kalibrasi Vit.C........................................ ................104 Lampiran 32 Pelepasan Difusi Vit.C............................................. .........105 Lampiran 33 Hasil Statistik Elongasi PVA dan PVA +Vit C Sebelum dan Sesudah Radiasi…………………………………………..106 Lampiran 34. Hasil Statistik Daya Tarik PVA dan PVA +Vit C Sebelum dan Sesudah Radiasi……………………………………...114 Lampiran 35. Hasil Statistik Uji Fraksi Gel……………………………..118 xv xvi BAB I PENDAHULUAN 1.1 LATAR BELAKANG Selulosa merupakan bahan/materi yang sangat berlimpah di bumi ini. Diperkirakan 1 triliun ton selulosa telah diproduksi tiap tahunnya. Selulosa yang dihasilkan digunakan untuk membuat perabot kayu, tekstil, kertas, kapas serap/bahan penyerap pada popok ataupun pembalut wanita, dan juga dalam berbagai bidang seperti pertambangan, kedokteran, obatobatan, kosmetik dan lain-lain (Soetrisno T, 1996). Sumber utama selulosa terdapat dalam tumbuh-tumbuhan terutama pada kayu dan kapas. Saat ini selulosa dapat juga dihasilkan dari proses fermentasi Acetobacter xylinum menggunakan media air kelapa sebagai sumber mikronutrien yang disebut selulosa bakteri. Acetobacter xylinum merupakan bakteri golongan asam asetat yang berbentuk batang pendek, bersifat non motil, obligat aerobik dan dengan pewarnaan gram menunjukkan gram negatif. Bakteri ini akan membentuk nata de coco (pelikel selulosa bakteri) jika ditumbuhkan dalam air kelapa yang kaya akan sumber karbon dan nitrogen melalui proses yang terkontrol. Bakteri tersebut akan menghasilkan enzim ekstraselular yang dapat menyusun zat gula menjadi ribuan rantai serat atau selulosa (Siahaan,dkk, 2003). Penggunaan selulosa sebagai bahan baku dalam berbagai bidang cukup banyak dibutuhkan, sehingga selulosa bakteri dapat dimanfaatkan sebagai 1 2 alternatif bahan baku yang mudah diperoleh. Selulosa bakteri juga mempunyai potensi yang cukup besar untuk dikembangkan menjadi suatu produk yang berkualitas serta dapat diaplikasikan secara luas, seperti dalam industri pembuatan kertas, biomaterial, bahan penyerap (pembalut dan popok), dan juga membran penyaring (Taufan,dkk, 1996). Penggunaan selulosa bakteri juga dapat memberikan nilai tambah karena memanfaatkan air kelapa yang selama ini menjadi limbah. Air kelapa merupakan limbah yang biasanya berasal dari industri pengolahan kelapa seperti industri kelapa kopra, pembuatan minyak goreng, santan, ataupun kelapa yang dijual di pasar. Air kelapa yang digunakan dalam pembuatan nata de coco harus berasal dari kelapa yang masak optimal tidak terlalu tua atau terlalu muda (berumur ±6 bulan). Air kelapa mengandung beberapa vitamin seperti vitamin C 0,7 – 1,7 mg/100 mg dan vitamin B kompleks yang terdiri dari asam nikotinat 0,4 g/ml, asam pantotenat 0,52 g/ml, biotin 0,02 g/ml, riboflavin 0,01 g/ml, asam folat 0,03 g/ml, thiamin dan juga piridoksin, yang berperan sebagai sumber mikronutrien yang mendukung proses fermentasi selain dari bahan utama yaitu sukrosa sebagai sumber karbon dan ammonium sulfat sebagai sumber nitrogen (Warisno, 2004). Pemanfaatan selulosa sebagai bahan baku biomaterial haruslah bersifat steril, salah satu cara sterilisasi paling praktis adalah dengan iradiasi EBM (mesin berkas elektron). Akan tetapi iradiasi EBM (mesin berkas elektron) dapat menyebabkan perubahan sifat mekanik dan kemampuan daya serap selulosa bakteri yang diiradiasi pada dosis 25 kGy. Adapun keuntungan 3 dari iradiasi EBM (mesin berkas elektron) yaitu terjadinya crosslinking (pembentukan ikatan silang) yang mengakibatkan suatu polimer mempunyai sifat viskositas bertambah, berat molekul bertambah dan sifat mekanik bertambah. Sedangkan kerugian dari iradiasi EBM (mesin berkas elektron) yaitu terjadinya degradasi (pemutusan rantai polimer) yang mengakibatkan suatu polimer mempunyai sifat viskositas berkurang, bobot molekul berkurang, dan sifat mekanik berkurang. Dosis iradiasi untuk sterilisasi biomaterial umumnya 25-50 kGy (Darmawan, 2008). Dalam Farmakope Indonesia Edisi IV disebutkan bahwa dosis sterilisasi yang digunakan untuk produk kesehatan adalah 25 kGy (Darmawan, 2002). Selama bertahun-tahun pemilihan dosis 25 kGy ini sangatlah aman, sederhana dan mudah. Beberapa peneliti melaporkan bahwa pada bahanbahan yang sebagian besar mengandung selulosa bila diiradiasi akan terjadi reaksi degradasi atau perubahan ikatan silang. Reaksi degradasi dan ikatan silang saling berkompetisi dan umumnya ikatan silang terjadi pada dosis rendah yaitu 10-30 kGy, sedang degradasi terjadi pada dosis di atas 30 kGy (Erizal,dkk, 2008). Energi radiasi pengion dapat menginduksi reaksi kimia pada bahan yang diiradiasi. Selain terjadi perubahan kimia ternyata reaksi kimia dapat juga menimbulkan perubahan sifat fisika dan biologi (Mirzan,dkk, 1993). Sifat mekanik dan kemampuan daya serap merupakan sifat-sifat fisika yang dimiliki selulosa. Pemanfaatan pada bidang kosmetik, khususnya untuk matriks topeng wajah, sifat dan karakteristik selulosa bakteri masih memiliki keterbatasan sehingga perlu dikombinasikan dengan material lain 4 seperti polivinil alkohol (PVA) yang mempunyai sifat fisik yang baik, tidak toksik, dan mempunyai kemampuan menyerap air yang relatif tinggi. Sifat fisik hidrogel yang terpenting adalah kemampuan hidrogel dalam menyerap dan menyimpan air dalam jumlah besar. Hal inilah yang melatarbelakangi dilakukannya pemanfaatan selulosa bakteri – polivinil alkohol (pva) hasil iradiasi (hidrogel) sebagai matriks topeng masker wajah yang menggunakan model asam askorbat (vitamin C) sebagai antioksidan. I.2 Perumusan Masalah 1. Bagaimana sifat dan karakteristik dari selulosa bakteri – polivinil alkohol (PVA) hasil iradiasi (hidrogel) yang digunakan sebagai matriks topeng masker wajah? 2. Berapakah konsentrasi polivinil alkohol (PVA) yang optimal untuk memperbaiki karakteristik dan sifat mekanik selulosa bakteri – polivinil alkohol (PVA) hasil iradiasi (hidrogel) sebagai matriks topeng masker wajah? 3. Apakah selulosa bakteri – polivinil alkohol (PVA) hasil iradiasi (hidrogel) dapat digunakan sebagai matriks topeng masker wajah? I.3 Hipotesis Selulosa bakteri – polivinil alkohol (PVA) hasil iradiasi (hidrogel) dapat dibuat menjadi matriks topeng masker wajah yang mempunyai karakteristik dan sifat mekanik yang baik. 5 I.4 Tujuan Penelitian 1. Menghasilkan selulosa bakteri – polivinil alkohol (PVA) hasil iradiasi (hidrogel) yang dapat digunakan sebagai matriks topeng masker wajah dari bahan alam Indonesis yang mudah diperoleh. 2. Menentukan konsentrasi polivinil alkohol (PVA) yang memberikan karakteristik dan sifat mekanik sebagai matriks topeng masker wajah. I.5 Manfaat Penelitian Adapun manfaat penelitian ini adalah dapat memberikan informasi tentang pemanfaatan selulosa bakteri – polivinil alkohol (PVA) hasil iradiasi (hidrogel) sebagai matriks topeng masker wajah. 6 BAB II TINJAUAN PUSTAKA 2.1 Kelapa (Cocos nucifera) 2.1.1 Deskripsi Kelapa Kelapa lahir dengan batang yang tidak bercabang, dengan lingkar tumbuh tunggal. Tinggi tanaman ini dapat mencapai 20 sampai 22 m pada umur 40 tahun dan pada umur 80 tahun tinggi tanaman dapat mencapai 3540 m. Bunga dari kelapa merupakan polygamomonoecious, dimana bunga diproduksi secara terus menerus dan bunga ini kemudian memproduksi biji. Daunnya memiliki panjang 4 - 6 m, pada pohon yang tinggi bisa menghasilkan 12 - 18 daun tiap tahunnya, sedangkan pada pohon yang pendek bisa menghasilkan 20 - 22 daun (Chan, et al, 2006). Buah dari kelapa berserabut, dimana bagian terluar hingga kedalam berturut-turut adalah kulit terluar keras dan tipis disebut dengan eksokarp, bagian tengah yang berserat disebut dengan mesokarp, bagian dalam yang keras disebut endocarp, bagian dalam yang melekat dengan endocarp disebut dengan testa dengan bagian dalam yang putih (daging) disebut dengan endosperm ( Slusarska, et al, 2008). Dan rongga yang dipenuhi dengan cairan (air) (Chan, et al, 2006). Air kelapa yang berasal dari kelapa muda dapat diminum. Rasa air ini manis dan jumlahnya tergantung ukuran kelapa, dimana rata-rata volume air kelapa antara 300 - 1000 ml. daging buah kelapa yang masih muda lebih lembut dibandingkan daging buah kelapa yang sudah tua. Kelapa yang sudah matang kulit luarnya akan berubah menjadi warna coklat, dan 6 7 saat yang bersamaan endosperm menjadi tebal dan keras dan air kelapa menjadi agak pahit. (a) (b) Gambar 1. Bagian buah kelapa Keterangan : (a) Bagian buah kelapa (b) Buah kelapa yang sudah matang 2.1.2 Penyebaran kelapa (Chan, et al, 2006) Pada awalnya penyebaran kelapa diketahui merupakan tanaman asli di daerah pantai asia tenggara (Malaysia, Indonesia dan Filipina) serta Melanesia. Perkembangan saat ini ternyata kelapa banyak ditemukan di daerah tropis dan daerah subtropics (23 o lintang utara dan selatan daerah ekuatorial). Manfaatnya yang banyak bagi perekonomian dan kehidupan manusia, sekarang kelapa memiliki penyebaran yang cukup luas dengan varietas yang berbeda-beda. Adapun beberapa daerah penyebarannya adalah sebagai berikut : - Asia tenggara : Burma, Indonesia, Malaysia, Filipina, Singapura, Thailand, Vietnam. - Afrika : Kamerun, Ghana, Kenya, Nigeria, Tanzania. - Amerika : Brazil, Ekuador, Jamaika, Mexico, Trinidad dan Tobago, Venezuela. Pohon kelapa tumbuh baik pada daerah berpasir dengan curah hujan yang teratur dan sinar matahari yang cukup. Pertumbuhan optimum ratarata pada suhu 27 oC. Pohon kelapa juga membutuhkan kelembapan yang 8 tinggi untuk pertumbuhan optimumnya yaitu 70% - 80% sehingga tanaman ini jarang ditemukan pada daerah dengan kelembapan yang rendah seperti daerah mediterania, meskipun memiliki temperatur yang cukup tinggi (umumnya 24oC). Selain itu tanaman ini memiliki toleransi terhadap salinitas yang tinggi. Berikut adalah klasifikasi dari kelapa : Kingdom : Plantae Divisi : Magnoliophyta Kelas : Liliopsida Ordo : Arecales Famili : Arecaceae Subfamili : Arecoideae Genus : Cocos Spesies : Cocos nucifera 2.1.3 Kandungan nutrisi dan manfaat kelapa Kelapa memiliki nutrisi yang tinggi dan kaya akan serat, vitamin serta mineral. Kelapa digolongkan sebagai makanan fungsional yang berperan dalam kesehatan karena kandungan nutrisinya. Hampir semua bagian kelapa dapat dimanfaatkan, dan memiliki kandungan nutrisi yang berbeda beda. Akar kelapa menginspirasi penemuan teknologi penyangga bangunan. Batangnya, yang disebut glugu dipakai sebagai kayu dengan mutu menengah, dan dapat dipakai sebagai papan untuk rumah. Daunnya dipakai sebagai atap rumah setelah dikeringkan. Daun muda kelapa, disebut janur, dipakai sebagai bahan anyaman dalam pembuatan ketupat 9 atau berbagai bentuk hiasan yang sangat menarik. Cairan manis yang keluar dari tangkai bunga, disebut (air) nira atau legèn (bhs. Jawa), dapat diminum sebagai penyegar atau difermentasi menjadi tuak (Wahyudi, 2003). Buah kelapa adalah bagian paling bernilai ekonomi. Buah kelapa tua terdiri dari empat komponen utama, yaitu: 35 persen sabut, 12 persen tempurung, 28 persen daging buah, dan 25 persen air kelapa. Daging buah tua merupakan bahan sumber minyak nabati (kandungan minyak 30 persen) (Astawan, 2009). Sabut, bagian mesokarp yang berupa serat-serat kasar, diperdagangkan sebagai bahan bakar, pengisi jok kursi, anyaman tali, keset, serta media tanam bagi anggrek. Tempurung atau batok, yang sebetulnya adalah bagian endokarp, dipakai sebagai bahan bakar, pengganti gayung, wadah minuman. Daging buah muda berwarna putih dan lunak serta biasa disajikan sebagai es kelapa muda atau es degan. Cairan ini mengandung beraneka enzim dan memiliki khasiat penetral racun dan efek penyegar/penenang. Daging buah tua kelapa berwarna putih dan mengeras sarinya diperas dan cairannya dinamakan santan. Daging buah tua ini juga dapat diambil dan dikeringkan serta menjadi komoditi perdagangan bernilai, disebut kopra. Kopra adalah bahan baku pembuatan minyak kelapa dan turunannya. Cairan buah tua kelapa biasanya tidak menjadi bahan minuman penyegar dan merupakan limbah industri kopra. Namun demikian dapat dimanfaatkan lagi untuk dibuat menjadi bahan semacam jelly yang disebut nata de coco dan merupakan bahan campuran minuman penyegar (Wahyudi, 2003). 10 Kelapa selain bermanfaat sebagai kuliner dan berbagai kerajinan, juga dapat dimanfaatkan dalam bidang pengobatan. Kelapa dalam pengobatan tradisional telah digunakan untuk mengobati berbagai masalah kesehatan seperti abses, asma, demam, flu, sakit pra menstruasi, konstipasi, luka bakar malnutrisi dan sebagainya. Pada pengobatan modern kelapa juga telah dimanfaatkan diantaranya: - Memberikan sumber energi - Membantu mengurangi osteoporosis - Mengurangi inflamasi - Membantu memberikan perlindungan penyakit periodontal dan kebusukan gigi - Membantu melindungi kulit dari kerutan wajah - Diaplikasikan secara topical sebagai kimia barrier pada kulit untuk mencegah infeksi Salah satu bagian kelapa yaitu air kelapa diketahui memiliki manfaat untuk pengobatan diare dan minuman penambah energi untuk orang yang sakit dan orang tua. Selain itu dalam bidang biomaterial air kelapa dimanfaatkan untuk menghasilkan selulosa bakteri (bacterial cellulose) dengan bantuan bakteri Acetobacter xylinum. Air kelapa mengandung sejumlah zat gizi, yaitu protein, lemak, gula, berbagai vitamin, asam amino, dan hormon pertumbuhan. Kandungan gula maksimal, yaitu 3 gram per 100 ml air kelapa, tercapai pada bulan keenam umur buah, kemudian menurun dengan semakin tuanya kelapa. Jenis gula yang terkandung adalah glukosa, fruktosa, sukrosa, dan sorbitol. Gula-gula 11 inilah yang menyebabkan air kelapa muda terasa lebih manis dibandingkan air kelapa tua. Kandungan zat gizinya yang kaya dan relatif lengkap, sehingga sesuai untuk pertumbuhan mikroba. Komposisi air kelapa antara lain karbohidrat (sukrosa, glukosa, fruktosa dan sorbitol) mineral (K, Na, Mg, P, Cl, Fe dan Cu), protein (asam–asam amino essencial) dan vitamin B dan C. Komposisi gizi air kelapa tergantung pada umur kelapa dan varietasnya. Berikut adalah komposisi gizi air kelapa (Wahyudi, 2003). Tabel 1. Komposisi nutrisi air kelapa Komposisi nutrisi air kelapa % Air 95.5 Nitrogen 0.05 Asam fosfat 0.56 Potasium 0.25 Kalsium oksida 0.69 Magnesium oksida 0.59 mg/100g Besi 0.5 Total padatan 4.71 Gula pereduksi 0.80 Gula total 2.08 Abu 0.62 Sumber : Pandalai, K. M. (1958). Coconut water and its uses. Coconut Bull. 12, No. 5, 167-173. Air kelapa dapat dimanfaatkan untuk pembuatan nata de coco atau pelikel selulosa bakteri, yaitu jenis makanan berbentuk seperti gelatin yang dihasilkan oleh bakteri Acetobacter xylinum. Komposisi nata de coco sebagian besar terdiri dari polisakarida, kemungkinan dekstrosa atau selulosa, tetapi struktur sebenarnya belum diketahui (Wahyudi, 2003). 12 2.2 Sukrosa Sukrosa atau sakarosa atau yang dikenal dengan sebutan gula pasir dibuat dari gula tebu atau gula bit melalui proses penyulingan dan kristalisasi. Sukrosa juga terdapat dalam buah, sayuran dan madu (Almaitser, 2001). Struktur kimia dari sukrosa adalah Gambar 2. Struktur sukrosa Sukrosa memberikan rasa manis yang baik. Sukrosa merupakan kristal yang tidak berwarna atau berwarna putih, berbentuk kotak-kotak, tidak berbau, dan memiliki rasa yang manis. Sukrosa pada pembuatan pelikel selulosa bakteri berfungsi sebagai media yang membantu pertumbuhan bakteri Acetobacter xylinum. Penggunaan sukrosa yang berwarna agak gelap menyebabkan warna kocoklatan yang tidak disukai pada pelikel selulosa yang dihasilkan (Collado, 1986). Oleh karena itu, pada pembuatan pelikel selulosa bakteri sebaiknya digunakan sukrosa berwarna putih. 2.3 Amonium Sulfat Amonium sulfat merupakan senyawa kimia dengan rumus (NH4)2SO4 yang berbentuk kristal, berwarna putih, abu-abu, kebiru-biruan atau kuning tetapi yang paling banyak berwarna putih seperti gula pasir. Senyawa ini mengandung nitrogen sebanyak 20,4%-21%, bersifat higroskopis dan baru 13 akan menyerap air bila kelembaban nisbi 80% pada 300C (Hardjowigono, 1987). Menurut Considine (1984) ammonium sulfat dapat dihasilkan melalui dua proses reaksi kimia. Pertama adalah mencampur ammonia dengan asam sulfat. Reaksi yang terjadi adalah sebagai berikut : 2NH3 + H2SO4 (NH4)2SO4 ammonia ammonium sulfat asam sulfat Kedua adalah dengan mencampur ammonium karbonat dengan gypsum (CaSO4) sehingga terjadi reaksi sebagai berikut : (NH4)2CO3 + CaSO4 (NH4)2SO4 + CaCO3 ammonium karbonat kalsium sulfat ammonium sulfat kalsium karbonat Ammonium sulfat merupakan sumber nitrogen bagi tanaman yang paling banyak digunakan di Indonesia sebagai pupuk. Amonium sulfat dapat pula digunakan sebagai sumber nitrogen untuk membantu pertumbuhan Acetobacter xylinum pada proses pembuatan pelikel selulosa bakteri (Steinkraus et al, 1983). 2.4 Selulosa Bakteri Selulosa merupakan biopolimer terbesar, yang diketahui sebagai komponen utama biomassa tanaman, dan juga diwakili oleh polimer ektraseluler mikrobial. Selulosa bakteri termasuk produk spesifik dari metabolisme primer yang sebagian besar sebagai lapisan pelindung sedangkan selulosa tanaman sebagai pembentuk struktur tumbuhan. Selulosa yang disintesis oleh bakteri termasuk dalam genus Acetobacter, Rhizobium, Agrobacterium dan Sarcina. Bakteri yang paling 14 banyak menghasilkan selulosa adalah bakteri Gram negatif, bakteri asam asetat dan Acetobacter xylinum. diantara berbagai jenis bakteri tersebut A. xylinum adalah jenis bakteri yang paling banyak digunakan sebagai model untuk studi megenai selulosa. Studi biasanya difokuskan pada mekanisme sintesis biopolimer, strukturnya dan karakteristiknya. Karakteristik penting dari selulosa bakteri adalah kemurniannya. Hal ini yang membedakan dengan selulosa dari tumbuhan, dimana selulosa tumbuhan mengandung hemiselulosa dan lignin yang sangat sulit untuk dihilangkan. Karakteristik dari selulosa bakteri yang unik, banyak diaplikasikan secara luas pada industri kertas, tekstil makanan dan sebagai biomaterial untuk kosmetik dan alat kesehatan. 2.4.1 Struktur selulosa bakteri (Bielecki, et al, 2005) Selulosa bakteri adalah polimer tidak bercabang, yang dihubungkan dengan β-1,4 glukosida. Penelitian selulosa bakteri menunjukkan bahwa secara kimia identik dengan selulosa tanaman, tetapi secara struktur makromolekular karakteristiknya berbeda dengan selulosa tanaman. Gambar 3. Struktur kimia selulosa Rangkaian struktur selulosa bakteri dimulai dengan terbentuknya subfibril (berupa benang), dengan lebar sekitar 1,5 nm. Subfiril ini kemudian terkristalisasi menjadi mikrofibril (Jonas, et al, 1998). 15 Membentuk suatu bundles dan akhirnya terbentuk seperti pita (ribbon). Berikut adalah gambar struktur dari selulosa bakteri (Bielecki, et al, 2005). (a) (b) Gambar 4. Perbedaan struktur antara selulosa bakteri dengan tumbuhan Keterangan : (a). selulosa tumbuhan (b). selulosa bakteri Selulosa bakteri juga berbeda dengan selulosa tumbuhan dari segi index kristalinnya dan derajat polimerisasi. Derajat polimerisasi selulosa baktei dapat mencapai 2000 dan 6000 dan dalam suatu kasus dapat mencapai 16000 atau 20000, sedangkan selulosa tumbuhan memiliki ratarata derajat polimerisasi 13000 sampai 14000 (Bielecki, et al., 2005). Beberapa kelebihan dari selulosa bakteri adalah memiliki struktur yang teratur, tidak mengandung lignin dan hemiselulosa, memiliki serat yang panjang (lebih kuat), dapat ditumbuhkan pada berbagai wadah. Sedangkan beberapa kelemahan bakteri selulosa untuk pengembangan komersil adalah, biaya cukup tinggi dibandingkan selulosa tumbuhan karena harga yang mahal subtrat yang digunakan (gula), hasil akhir yang sedikit, keterbatasan kapasitas untuk produksi dalam skala besar. 2.4.2 Aplikasi selulosa bakteri Selulosa bakteri diketahui merupakan polisakarida yang aman sehingga banyak digunakan dalam bebagai bidang. Aplikasi dari selulosa bakteri karena karakteristiknya yang unik, seperti selulosa yang dihasilkan 16 murni, elastik, mampu mempertahankan air, dan memiliki kristalin index yang tinggi. Berikut beberapa aplikasi dari selulosa bakteri adalah : a. Aplikasi teknik Dibandingkan dengan selulosa tanaman, selulosa bakteri memiliki kekuatan tarik (Tensile strength) yang lebih tinggi, sehingga selulosa bakteri merupakan komponen yang baik untuk kertas karena memiliki karakteristik mekanik yang baik. Selulosa bakteri untuk diaplikasikan sebagai kertas akan memberikan elastisitas, permeabel terhadap udara, tahan terhadap air dan tekanan berat dan mampu mengikat air (Iguch, 2000). Selulosa bakteri juga digunakan sebagai pelindung permukaan untuk beberapa kertas. Coating terhadap kertas akan memberikan karakteristik seperti permukaan yang mengkilap, cerah, halus, memiliki porositas, daya penerimaan terhadap tinta dan memiliki kekuatan tarik yang tinggi. Selain itu penambahan selulosa bakteri pada kertas akan meningkatkan masa simpan kertas. Selulosa bakteri juga merupakan komponen yang berharga pada kertas, karena meningkatkan ketahanan terhadap panas dan tidak mudah terbakar. Penggunaan selulosa bakteri dapat mengurangi bahan tambahan pada pembuatan kertas tanpa menimbulkan efek pada karakteristik kertas. b. Aplikasi dalam bidang medik Aplikasi seluosa bateri dalam bidang medik didasarkan atas keunikan struktur dan karakteristik mekaniknya seperti mampu menahan air, dan bersifat biokompatibel. Hasil studi pada tikus menunjukkan bahwa 17 selulosa bakteri terintegrasi dengan baik pada host-nya dan tidak menimbulkan reaksi inflamasi sehingga potensial dikembangkan sebagai scaffold (Suwannapinunt, 2007). Selulosa bakteri mempunyai sifat-sifat seperti berpori, elastis, mudah untuk disimpan, mampu mengabsorbsi, memiliki kelembapan dapat diaplikasikan untuk pembalut luka. Dengan kelebihannya tersebut dapat mempercepat proses penyembuhan luka dan melindungi luka dari infeksi sekunder. Gambar berikut adalah aplikasi selulosa bakteri sebagai pembalut luka. Gambar 5. Pelikel bakteri sebagai pembalut luka BioFill® diperoleh dari produk selulosa mikroba yang telah digunakan sebagai pengobatan beberapa luka bakar, grafting kulit, dan ulser kulit kronik. Pengobatan dengan menggunakan BioFill® menutupi rasa sakit, dan mempunyai keuntungan adhesi yang baik, barrier yang efektif untuk infeksi, penyembuhan cepat, retensi cairan yang baik (air dan elektrolit), biaya murah, dan waktu penyembuhan pendek dibandingkan secara normal. Produk lainnya yaitu Gengiflex®, diaplikasikan untuk proses penyembuhan dalam kasus periodontal. Aplikasi lainnya dalam bidang medis adalah sebagai membran tambahan untuk melindungi glukosa oksidase termobilisasi dalam biosensor yang digunakan untuk uji kadar gula darah. Sifat selulosa 18 bakteri yang elastis, permeabel terhadap udara dan cairan, memiliki kekuatan tarik yang tinggi dapat dimanfaatkan untuk aplikasi tersebut (Bielecki, 2005). c. Aplikasi dalam bidang makanan selulosa bakteri memiliki kemurnian secara kimia dan tidak menimbulkan reaksi metabolit sehingga banyak diaplikasikan sebagai stabilizer dalam makanan, emulsifier pada minuman dan sup, dan modifikasi tekstur dan meningkatkan serat makanan. Aplikasi pertama kali dalam bidang makanan adalah dihasilkannya nata de coco komersial. Konsumsi nata diyakini dapat melindungi dari kanker usus, atherosklerosis dan thrombosis pada jantung dan mencegah peningkatan glukosa pada urin. Salah satu produk makanan popular yang mengandung selulosa bakteri adalah kombucha dari Cina. Makanan ini diperoleh dengan cara menumbuhkan kapang dan bakteri asam asetat pada teh dan ekstrak gula. Pelikel akan terbentuk pada permukaan dimana banyak mengandung selulosa dan enzim yang baik untuk kesehatan. Aktivitas abiotiknya adalah memperluas permukaan usus besar dan saluran pencernaan, selain itu kombucha diyakini dapat melindungi terhadap kanker (Iguchi, 2000). Aplikasi lainnya adalah untuk filtrasi pada pembuatan anggur dan bir. Pada industri kue, selulosa bakteri dimanfaatkan untuk memperpanjang umur simpan kue karena sifatnya yang tidak berbau, tidak berasa dan banyak mengandung serat. 19 d. Aplikasi lainnya (Bielecki, 2005) Besarnya luas permukaan, daya tahan yang tinggi dan memiliki daya absorpsi yang tinggi dapat digunakan dalam modifikasi proses kimia maupun fisika, seperti selulosa bakteri dapat dimanfaatkan imobilisasi biokatalis. Gel selulosa yang mengandung sel hewan imobilisasi digunakan untuk produksi interferon, interleukin dan antibodi monoklonal. Selulosa bakteri juga dimanfaatkan sebagai absorpsi sel Gluconobacter oxydans, Acetobacter methanolyticus, Saccharomyces cerevisiae. Imobilisasi strain bakteri ini efektif untuk produksi glukonat, dihidroksi aseton dan etanol. Selulosa bakteri murni dapat dimanfaatkan sebagai bahan mentah sintesis selulosa asetat, nitroselulosa, CM-selulosa, hidroksimetilselulosa, metilselulosa dan hidroksiselulosa. Tabel berikut menunjukkan beberapa aplikasi selulosa bakteri pada beberapa bidang. Tabel 2. Aplikasi selulosa bakteri pada berbagai bidang Sektor Kosmetik Industri tekstil Olahraga Pertambangan danpengolahan limbah Pemurnian Broadcasting Kehutanan Industri kertas Aplikasi Penstabil dan pengemulsi pada krim, tonik dan pelembab kuku, sebagai bahan pengkilap dan sebagai bahan kuku buatan Bahan kulit buatan dan tekstil, Bahan pengabsorsi Untuk baju olahraga, tenda, dan perlengkapan kemah Untuk pengambilan batu karang, Absorbsi senyawa toksik, Daur ulang mineral dan minyak Untuk pemurnian air dan pemurnian udara kota Produksi diafragma untuk mikrofon dan headphone Multilapis untuk plywood Pembuatan kertas, dokumen menjadi tahan lama, pembuatan popok dan serbet dari kertas 20 Industri mesin Laboratorium/penelitian Kesehatan Untuk badan mobil, elemen pesawat, penutup retakan pada pelindung roket, Imobilisasi protein, kromatografi dan komponen media untuk kultur jaringan Kulit buatan sementara untuk terapi luka bakar, dan penyakit periodontal 2.4.3 Sumber selulosa 1. Kayu Kayu digunakan secara luas sebagai bahan selulosa. Komponen kimia dari kayu berbeda antar spesies dan juga dengan bagian tanaman, tetapi sebagian besar mengandung 40 - 50% selulosa, 20 - 30% lignin, dan 10 30% hemiselulosa dan polisakarida lainnya. Komponen lain juga ditemukan dalam jumlah yang kecil, seperti resin, gums, protein, dan mineral. Sebagai sumber serat selulosa, kayu merupakan bahan baku utama untuk menghasilkan pulp di mana dapat diproses untuk pembuatan kertas dan turunan selulosa seperti rayon, nitroselulosa, CMC, dan lainnya. 2. Serat bibit Seluruh tanaman kapas juga terdiri dari bahan-bahan selulosa dan dapat dimanfaatkan sebagai pulp. Serat kapuk juga merupakan bahan selulosa yang mengandung 55 - 65% selulosa tetapi tidak digunakan sebagai sumber selulosa untuk pulp. Bahan ini biasanya digunakan untuk bahan pengisi. 3. Serat bast Serat yang paling penting dalam kelompok ini meliputi serat rami dan goni. Tanaman rami adalah sumber dari industri tekstil linen yang terdiri dari 80 - 90% selulosa. Serat rami juga digunakan sebagai sumber pulp kertas untuk memproduksi kertas rokok dan tujuan khusus lainnya. 21 Serat goni juga mengandung selulosa yang tinggi. Goni biasanya digunakan untuk tali dan karung. Tanaman yang menghasilkan goni antara lain dikenal dengan nama kenaf (Hibiscus cannabinus) dan roselle (Hibiscus sabdariffa) . Kenaf dan roselle mengandung 70 - 90% selulosa yang sesuai untuk memproduksi pulp dan kertas untuk kebutuhan khusus. 4. Serat daun Ada banyak jumlah serat daun tetapi kegunaannya sangat terbatas. Beberapa di antaranya digunakan untuk tali-temali, tekstil, dan kertas. Yang termasuk dalam kelompok ini antara lain rami abaca dan manila, pisang, nanas, dan lainnya. 5. Selulosa non- tanaman Selulosa juga ditemukan dalam mineral dari sumber tanaman, seperti fossil kayu, dan beberapa tipe batu bara muda. 2.4.4 Pelikel selulosa bakteri Studi pertama tentang formasi dari selulosa dalam bakteri dilaporkan oleh Adrian Brown pada tahun 1886. Dalam eksperimen diketahui bahwa Acetobacter xylinum adalah organisme yang bertanggung jawab untuk membentuk lapisan selulosa. Pelikel selulosa bakteri dibuat menggunakan Acetobacter xylinum dan menghasilkan selulosa yang murni tanpa ada lignin. Acetobacter xylinum mensintesis benang-benang ekstraselular hingga membentuk membran selulosa hidrofilik yang dikenal sebagai pelikel. Pelikel selulosa bakteri mempunyai kandungan air 90 - 95% dari bobot total. Pelikel selulosa 22 bakteri yang dibuat dengan kultur statik mengandung 1% selulosa dari bobot kering (Brown, 1961). Kekuatan mekanik yang baik dari pelikel selulosa bakteri dihasilkan dari ikatan hidrogen intermolekular yang ekstensif. Hal ini diinvestigasi pertama kali oleh Yamanaka (1989). Sumber karbon yang biasa digunakan oleh Acetobacter xylinum untuk memproduksi pelikel selulosa bakteri adalah dekstrosa, glukosa, sukrosa, fruktosa, gula invert (Embuscado, 1994). Ide untuk memodifikasi selulosa sejak disintesis dideskripsikan oleh Brown, Acetobacter xylinum tidak hanya menjadi faktor penting dalam elusidasi sintesis selulosa tetapi juga dalam fermentasi asam cuka. Produk pelikel selulosa bakteri secara lambat ditegaskan sebagai biopolimer industri yang penting untuk berbagai aplikasi mulai dari makanan sampai material bahan yang mempunyai kekuatan besar (Brown, 1961). 2.4.5 Pembuatan pelikel selulosa bakteri Terdapat dua faktor utama yang mempengaruhi produksi pelikel selulosa bakteri oleh Acetobacter xylinum yaitu komponen dari fermentasi dan kondisi operasional. Komponen dari fermentasi meliputi strain atau tipe organisme yang digunakan, komposisi media, sumber karbon, dan sumber nitrogen. Kondisi operasional yang mempengaruhi antara lain pH, oksigen, temperatur, konsentrasi relatif dari substrat dan tipe metode kultur yang digunakan. Menurut Departemen Riset dan Teknologi (2008), ada lima tahap pembuatan pelikel selulosa bakteri yaitu : Pemeliharaan, biakan murni 23 Acetobacter xylinum meliputi (1) Proses penyimpanan sehingga dalam jangka waktu yang cukup lama viabilitas (kemampuan hidup) bakteri tetap dapat dipertahankan;dan (2) Penyegaran kembali bakteri yang telah disimpan sehingga terjadi pemulihan viabilitas dan bakteri dapat dipersiapkan sebagai inokulum fermentasi. Penyimpanan, A. xylinum biasanya disimpan pada agar miring yang terbuat dari media Hassid dan Barker yang dimodifikasi dengan komposisi sebagai berikut : glukosa, ekstrak khamir, K2 HPO4, (NH4)2SO4, MGSO4, agar, dan air kelapa. Pada agar miring dengan suhu penyimpanan 4 - 7 0C, bakteri ini disimpan selama 3 - 4 minggu. Penyegaran, setiap 3 atau 4 minggu, biakan A. xylinum harus dipindahkan kembali pada agar miring baru. Setelah 3 kali penyegaran, kemurnian biakan harus diuji dengan melakukan isolasi biakan pada agar cawan. Adanya koloni asing pada permukaan cawan menunjukkan bahwa kontaminasi telah terjadi. Biakan pada agar miring yang telah terkontaminasi, harus diisolasi dan dimurnikan kembali sebelum disegarkan. Pembuatan Starter, Starter adalah populasi bakteri dalam jumlah dan kondisi fisiologis yang siap diinokulasikan pada media fermentasi. Mikroba pada starter tumbuh dengan cepat dan fermentasi segera terjadi. Starter baru dapat digunakan 6 hari setelah diinokulasi dengan biakan murni. Pada permukaan starter akan tumbuh bakteri membentuk lapisan tipis berwarna putih. Lapisan ini disebut nata atau pelikel. Semakin lama lapisan ini akan semakin tebal sehingga ketebalannya dapat mencapai 1,5 cm. Di anjurkan volume starter tidak kurang dari 5 % volume media yang akan difermentasi menjadi pelikel 24 selulosa. Fermentasi, fermentasi dilakukan pada media cair yang telah diinokulasi dengan starter. Fermentasi berlangsung pada kondisi aerob (membutuhkan oksigen). Mikroba tumbuh terutama pada permukaan media. Fermentasi dilangsungkan sampai pelikel yang terbentuk cukup tebal (1 - 1,5 cm). 2.5 Acetobacter xylinum (A. xylinum) 2.5.1 Deskripsi A. xylinum A. xylinum adalah bakteri Gram negatif yang dapat memproduksi selulosa dan asam asetat dengan bantuan udara selama pertumbuhannya dan melepaskannya ke lingkungan. Selulosa yang dihasilkan dikenal dengan selulosa bakteri. Selulosa yang dihasilkan murni dan dihasilkan secara ekstraseluler yang akan membentuk kumpulan fibril dan kemudian dibentuk menjadi satu kesatuan selulosa yang padat yang disebut dengan pelikel atau yang lebih dikenal dengan nata (Suwannapinunt, 2007). Sintesa polisakarida oleh bakteri sangat dipengaruhi oleh tersedianya nutrisi dan ion-ion tertentu yang dapat mengkatalisasi aktivitas bakteri. Peningkatan konsentrasi nitrogen dalam subtrat dapat meningkatkan jumlah polisakarida yang terbentuk, sedangkan ion-ion bivalen seperti Mg2+ dan Ca2+ diperlukan untuk mengontrol kerja enzim ektraselluler. Aktivitas pembentukan pelikel (nata) hanya terjadi pada kisaran pH antara 3,5 - 7,5. Sedangkan pH optimum untuk pembentukan nata adalah 4. Suhu yang memungkinkan untuk pembentukan nata adalah pada suhu kamar antara 28 - 320C (Multazam, 2009). 25 A. xylinum mempunyai aktivitas oksidasi lanjutan atau over oxidizer, yaitu mampu mengoksidasi lebih lanjut asam asetat menjadi CO2 dan H2O. Bakteri pembentuk nata termasuk golongan Acetobacter mempunyai ciriciri antara lain : Obligat aerobik, bersifat non motil dan tidak membentuk spora, tidak memproduksi H2S, tidak mereduksi nitrat, termal death point pada suhu 65 - 70 o C. Berikut adalah klasifikasi dari Acetobacter xylinum : Kingdom : Bakteria Filum : Proteobakteria Kelas : Alphaproteobakteria Order : Rhodospirillales Family : Acetobacteraceae Genus : Acetobacter Subspecies : xylinum Gambar 6. Acetobacter xylinum 2.5.2 Tingkat bahaya A. xylinum A. xylinum dilaporkan bukan merupakan bakteri patogen bagi manusia. Suhu pertumbuhan optimumnya jauh dibawah suhu tubuh manusia dan pH optimum pertumbuhannya jauh dibawah normal pH kulit manusia. Sehingga tidak mungkin bakteri ini dapat ditemukan sebagai flora pada manusia. 26 A.xylinum diketahui tidak dapat menghasilkan toksin dan infeksi yang berbahaya bagi manusia maupun hewan. Bakteri ini tidak menghasilkan enzim atau agen ekstraseluler lainnya yang bersifat virulen. Bakteri ini memiliki plasmid yang berguna untuk menghasilkan enzim untuk produksi asam asetat. Berdasarkan hal tersebut A. xylinum tidak menunjukkan adanya faktor virulensi. Bakteri ini bukan bagian dari flora tubuh manusia dan kulit manusia dan diduga tidak dapat bertahan dalam tubuh manusia sehingga tidak dapat menginfeksi manusia. 2.5.3 Pertumbuhan bakteri Acetobacter xylinum Bakteri A. xylinum adalah bakteri gram negatif aerobik yang mengalami pertumbuhan sel. Pertumbuhan sel didefinisikan sebagai pertumbuhan secara teratur semua komponen di dalam sel hidup. Berikut adalah fase pertumbuhan sel bakteri Acetobacter xylinum : 1. Fase Adaptasi Apabila bakteri dipindahkan ke media baru maka bakteri tidak langsung tumbuh melainkan beradaptasi terlebih dahulu. Pada fase ini terjadi aktivitas metabolisme dan pembesaran sel, meskipun belum mengalami pertumbuhan. Adapatasi dicapai pada 0 - 24 jam sejak inokulasi. 2. Fase Pertumbuhan Awal Fase pertumbuhan awal dimulai dengan pembelahan sel dengan kecepatan rendah. Fase ini berlangsung beberapa jam saja. 3. Fase Pertumbuhan Eksponensial 27 Fase eksponensial dicapai antara 1 - 5 hari. Pada fase ini bakteri mengeluarkan enzim ekstraselulerpolimerase sebanyak-banyaknya untuk menyusun polimer glukosa menjadi selulosa (matriks nata). 4. Fase Pertumbuhan Lambat Fase pertumbuhan lambat terjadi karena nutrisi bakteri telah berkurang, terdapat metabolik yang bersifat racun yang menghambat pertumbuhan bakteri dan umur sel sudah tua. Pada fase ini pertumbuhan tidak stabil, tetapi jumlah sel yang tumbuh masih lebih banyak dibandingkan jumlah sel yang mati. 5. Fase Pertumbuhan Tetap Pada fase pertumbuhan tetap terjadi keseimbangan antara sel yang tumbuh dan yang mati. Matriks nata lebih banyak diproduksi pada fase ini. 6. Fase Menuju Kematian Fase menuju kematian terjadi akibat nutrisi di dalam media sudah hampir habis. Setelah nutisi habis, maka bakteri akan mengalami fase kematian. 7. Fase Kematian Sel Pada fase ini bakteri dengan cepat mengalami kematian. Bakteri hasil fase ini tidak baik untuk strain nata. 2.6 Hidrogel Suatu polimer atau kopolimer ikatan silang (crosslinking) yang memiliki kemampuan untuk menyerap sejumlah cairan (swelling) sehingga mencapai kesetimbangan dikenal sebagai xerogel. Bilamana 28 digunakan air sebagai bahan ˝swelling˝ maka hasilnya disebut hidrogel (Huglin, 1986). Hidrogel adalah bahan polimer hidrofilik yang mempunyai kemampuan untuk mengembang di air atau cairan biologi dan menunjukkan fraksi air yang berarti pada strukturnya, tetapi matriks tersebut tidak larut dalam air. Ketika mengembang di air, hidrogel tetap mempertahankan bentuk asalnya. Sifat hidrofilik dari hidrogel ini dipengaruhi oleh adanya gugus-gugus –OH, -COOH, -CONH2, dan – SO3H. Sedang sifat ketidaklarutannya dalam air dan kemampuannya mempertahankan bentuk dipengaruhi oleh struktur tiga dimensi dari hidrogel. Kemampuan dari hidrogel untuk mengembang di air adalah kesetimbangan antara kekuatan disperse pada rantai hidrat dengan kekuatan kohesi yang tidak mencegah penetrasi air ke dalam hidrogel. Selain itu, derajat dan sifat ikatan silang serta kekristalan dari polimer turut menentukan sifat mengembang dari hidrogel (Kroschwitz, 1992). Hidrogel pertama kali diperkenalkan sebagai biomaterial adalah polihidroksi metakrilat (PHEMA) yang digunakan untuk lensa kontak. Sejak itu pengembangan hidrogel yang digunakan sebagai biomaterial semakin menarik perhatian para peneliti karena hidrogel mempunyai biokompatibilitas yang baik bila kontak dengan darah, cairan tubuh, dan jaringan hidup. Biokompatibilitas dari hidrogel ditunjukan dengan kemampuannya menstimulasi jaringan, karena mempunyai sifat permukaan khusus. Tegangan antar mukanya rendah dan permeabilitasnya 29 yang tinggi, lunak dan elastis menjadikan hidrogel suatu biomaterial yang baik (Ramarajaj, 1994). Hidrogel merupakan bahan yang dapat mengabsorbsi dan menahan air dalam jumlah besar, tapi tidak larut dalam air. Umumnya hidrogel dibuat dari polimer hidrofilik baik dalam bentuk tunggal atau kombinasi dengan polimer lainnya dengan teknik kimia atau radiasi sehingga membentuk ikatan silang (crosslinking). Polimer yang digunakan dapat berupa polimer sintetis seperti PVP (polivinil pirolidon) dan PVA (polivinil alkohol) atau polimer alam. Tujuan utama pengembangan hidrogel sebagai bahan biomaterial adalah untuk perbaikan kesehatan manusia melalui penggunaan biomaterial tersebut sebagai alat kedokteran (Darwis, 1995). Biomaterial adalah material yang digunakan untuk menggantikan/memperbaiki kerusakan jaringan atau sebagai interface dengan lingkungan fisiologis. Biomaterial dapat berupa bahan alam seperti kolagen, serat protein (silk, wool, dan rambut), polisakarida (starch, selulosa dan kitosan) atau bahan sintetis seperti polimer, metal dan keramik (Rosiak, et al., dkk, 1999). 2.6.1 Sintesis hidrogel Secara umum ada dua metode umum yang dapat digunakan untuk membuat hidrogel yaitu teknik konvensional dan teknik radiasi. Pada metode pertama, hidrogel dibuat melalui polimerisasi dan pembentukan ikatan silang (crosslinking) monomer hidrofilik dengan bantuan agensia pengikatan silang bi- atau multifungsi (bi-or multifunctional crosslinking agent) atau melalui pembentukan ikatan silang polimer larut dalam air 30 menggunakan reaksi organik khusus yang melibatkan gugus fungsi polimer tersebut. Pada metode radiasi, hidrogel dapat dibuat melalui polimerisasi dan pembentukan ikatan silang dari monomer atau polimer larut dalam air dengan menggunakan sinar gamma atau elektron cepat. Dengan teknik ini tidak diperlukan adanya inisiator kimia atau agensia pengikatan silang, proses lebih mudah dan sekaligus dapat digunakan untuk mensterilkan produk (Chapiro, et al, 1995). Pemakaian radiasi ionisasi untuk membuat hidrogel didasarkan pada reaksi pembentukan ikatan silang. Dua jenis radiasi ionisasi yang banyak digunakan untuk pembuatan hidrogel adalah sinar gamma yang berasal dari sumber radioisotop cobalt-60 dan elektron cepat yang dihasilkan oleh akselerator elektron. Dengan teknik radiasi ini, hidrogel dapat dibuat dengan meradiasi monomer atau polimer baik dalam bentuk larutan dalam air atau dalam bentuk padat. Namun demikian, pembentukan ikatan silang memerlukan dosis yang lebih tinggi pada iradiasi dalam bentuk padat. Reaksi pembentukan ikatan silang polimer dalam larutan air akibat iradiasi sinar gamma atau elektron cepat dapat terjadi melalui dua cara yaitu efek langsung (direct effect) dan efek tidak langsung (indirect effect). Efek langsung terjadi bila suatu polimer diradiasi dalam kondisi bulk (padat). Jika suatu larutan polimer diradiasi maka akan terjadi efek langsung dan efek tidak langsung. Efek langsung terjadi akibat dari interaksi antara molekul polimer dengan energi radiasi sehingga menghasilkan radikal polimer. Efek tidak langsung terjadi melalui reaksi 31 antara molekul air dan radiasi gamma (radiolisis) menghasilkan spesiesspesies seperti OH, H3O+ H, H2,H+, H2O2. Diantara spesies ini yang paling realtif adalah radikal hidroksil (OH). Radikal selanjutnya akan bereaksi dengan molekul polimer membentuk radikal polimer. Radikal polimer yang terbentuk akan bereaksi satu dengan yang lainnya membentuk ikatan silang (crosslinking) (Darmawan, 2000). Secara garis besar, mekanisme terjadinya ikatan silang (crosslinking) pada radiasi polimer dengan adanya air adalah sebagai berikut (Darmawan, 1999). PH*, PH+ + e- (exitaded dan ionitated PH (polimer) state) Rekombinasi PH+ + e- PH* Penguraian (dekomposisi) PH* Po + H Radiolisis air H2O H3O+ aq, OH0, e- aq, H, H2O2, H2 Pemisahan hidrogen PH + OH0 P0 + H2O Rekombinasi radikal polimer P0 + P0 P – P (crosslinking polimer) Secara skematis mekanisme pembentukan ikatan silang suatu larutan polimer a. Ikatan silang langsung (direct crosslinking) 32 Pembentukan radikal polimer P P (radikal polimer) Rekombinasi polimer radikal P+P P – P (ikatan silang) P adalah molekul polimer b. Ikatan silang tidak langsung (indirect crosslinking) Radiolisis air H2O H+, OH, e- aq H3O+, H2O2 Abstraksi atom hidrogen P + OH P + H2O Rekombinasi radikal polimer P+P P – P (ikatan silang) 2.6.2 Sifat fisika – kimia hidrogel a. Daya serap air (water absorption) Jika hidrogel kering mulai menyerap air, molekul air akan menghidrasi gugus yang paling polar, gugus hidrofilik, gugus hidrofilik, gugus ionik dan gugus yang dapat membentuk ikatan hidrogen. Selanjutnya rantai dalam hidrogel mulai mengembang, gugus hidrofilik mulai terkena molekul air dan berinteraksi melalui interaksi hidrofilik membentuk sistem dengan entropi yang relatif rendah melapisi gugus hidrofobik. Jika interaksi antara air dan hidrogel lebih jenuh, jaringan hidrogel akan menghambat air dan membentuk keadaan keseimbangan. Air ini disebut ‘’air bebas’’ (free water) yang mengisi pori-pori hidrogel. Proses pengembangan hidrogel berlangsung kontinyu disebabkan oleh adanya 33 tekanan osmosis. Keadaan keseimbangan hidrogel disebut sebagai kondisi swelling. Untuk menguji jumlah air yang terserap (daya serap air) pada hidrogel dengan menggunakan rumus sebagai berikut (Erizal, 1999): Daya serap air = (Wa-Wb)/Wb x 100% Keterangan : Wa = bobot hidrogel setelah pengembangan Wb = bobot awal hidrogel b. Sifat biologis hidrogel Hidrogel dapat dibedakan menjadi hidrogel alami dan hidrogel sintetik. Hidrogel yang terbentuk secara alami umumnya berasal dari proses biologis baik terjadi di dalam tanaman maupun hewan misalnya : agar, gel lidah buaya, dextran, gelatin, dan alginat. Sedangkan hidrogel sintetik terbentuk berdasarkan reaksi kimia atau fisika. Ditinjau dari sifat biologisnya hidrogel yang diperoleh dari hasil sintetik maupun yang diperoleh dari alam dapat bersifat biodegradable (mudah terdegradasi), non-biodegradable (sukar terdegradasi) dan bioerodible. Hidrogel biodegradable umumnya berasal dari senyawasenyawa alami, misalnya asam amino dan derivatnya yang mudah terdegradasi oleh enzim. Sedangkan hidrogel non-biodegradable terbentuk dari senyawa-senyawa sintetik (Erizal, 1999). c. Sifat permukaan hidrogel Berdasarkan sifat fisika-kimia hidrogel, permukaan hidrogel mempunyai beberapa sifat yang khas untuk setiap jenis hidrogel. Pada aplikasinya diperlukan suatu kondisi standar sifat permukaan hidrogel. 34 Sifat permukaan hidrogel dipengaruhi oleh sifat komponen utamanya yang terdiri atas gugus hidrofilik dan hidrofobik. Jika hidrofilisitas relatif dominan dalam hidrogel, maka hidrogel dengan mudah dibasahi oleh air (sudut kontak=0), sukar dibasahi oleh cairan non polar dan relatif sukar mengabsorpsi protein. Pada hidrogel yang sifat permukaannya relatif hidrofob sukar dibasahi oleh air dan mudah dibasahi oleh minyak. Sedangkan pada hidrogel yang terdiri dari gugus hidrofilik dan hidrofobik yang terdistribusi secara heterogen, maka permukaan hidrogel dapat dibasahi oleh air maupun minyak (Rosiak JM, 1995). d. Fraksi gel Fraksi gel merupakan sifat kimia yang terdapat pada hidrogel. Derajat ikatan silang hidrogel dapat diketahui oleh adanya fraksi gel dalam struktur hidrogel tersebut. Semakin besar fraksi gel berarti semakin banyak ikatan silang yang terjadi antar rantai molekul polimer sehingga kekuatan mekanik semakin besar. Fraksi gel ini juga secara tidak langsung mencerminkan besar-kecilnya tingkat kerapatan ikatan silang yang terjadi antar polimer. Fraksi gel dapat diukur dengan cara mengekstraksi hidrogel menggunakan pelarut air pada suhu 90 - 1100C. Fraksi gel dapat dihitung dengan persamaan berikut (Erizal, 1999) : Fraksi gel (%) = (W1/W0) x 100% Keterangan ; W1 = bobot kering hidrogel setelah perendaman W0 = bobot awal hidrogel sebelum perendaman 35 2.7 Masker (Dwikarya, M, 2002) Masker adalah salah satu pembersih kulit wajah yang efektif. Selain itu masker juga bermanfaat untuk memperlancar peredaran darah, merangsang kembali kegiatan sel-sel kulit dan mengangkat sel-sel tanduk yang telah mati. Hal ini disebabkan karena pada saat pemakaian masker, kulit muka tertutup secara sempurna oleh masker dan menyebabkan suhu kulit meningkat sehingga peredaran darah menjadi lancar dan penghantaran zat-zat gizi ke lapisan permukaan kulit dipercepat sehingga kulit muka terlihat lebih segar. Adanya peningkatan suhu menyebabkan fungsi kelenjar kulit meningkat sehingga kotoran dan sisa-sisa metabolisme dikeluarkan ke permukaan kulit yang kemudian dapat diserap oleh lapisan masker. 2.7.1 Jenis-jenis masker 1. Masker gel, membentuk lapisan kulit tipis saat mengering. Masker gel sangat ideal untuk kulit wajah usia belasan tahun sampai dua puluh tahun. 2. Masker peel off, langsung membentuk lapisan begitu terpasang di seluruh wajah. Masker ini menambah kelembaban kulit untuk sementara. 3. Masker lumpur, masker dari lumpur ini dapat digunakan untuk membersihkan kulit wajah secara total, karena mengandung bahan aktif yang menyerap kotoran. 36 4. Masker exfoliate, biasanya berbentuk scrub (mengangkat sel kulit mati, gunanya mengembalikan vitalitas kulit yang pudar dan kusam. 5. Masker sulfur, masker yang berbahan dari belerang ini, ideal untuk kulit yang banyak noda flek, dan berjerawat. 6. Masker hidrating, masker ini banyak mengandung air dan digunakan untuk mengatasi kulit-kulit yang kering dan halus. 7. Masker topeng (facial mask), dimaksudkan untuk pengelupasan kulit, melembabkan kulit kering, mengisi kulit kusam, menyerap minyak, mengencangkan kulit, menyembuhkan jerawat bekas luka, mencerahkan kulit wajah, menyegarkan. 2.7.2 Mekanisme kerja masker Peredaran darah menjadi lebih lancar dan pengantaran zat-zat gizi ke lapisan permukaan kulit di percepat, sehingga kulit muka terlihat lebih segar. Karena terjadinya peningkatan suhu dan peredaran darah yang lebih lancar, maka fungsi kelenjar kulit meningkat, kotoran dan sisa metabolisme dikeluarkan ke permukaan kulit untuk kemudian diserap oleh lapisan masker yang mengering dengan diangkatnya masker, zat-zat tersebut turut terbuang dan kulit mengalami pembersihan secara sempurna. Cairan yang berasal dari keringat dan sebagian cairan masker diserap oleh lapisan tanduk, meskipun masker mengering, lapisan tanduk tetap kenyal, bahkan sifat ini menjadi lebih baik setelah masker diangkat, terlihat keriput kulit berkurang, sehingga kulit muka tidak saja halus tetapi juga kencang. Setelah masker diangkat, bagian cairan yang telah diserap oleh lapisan tanduk akan menguap akibatnya terjadi penurunan suhu kulit, yang 37 alami sehingga menyegarkan kulit. Jadi secara singkat dapat diambil kesimpulan bahwa masker kecantikan pada kulit fungsinya ialah menyehatkan, membersihkan, mengencangkan dan menyegarkan kulit. 2.8 Antioksidan Antioksidan adalah substansi yang diperlukan tubuh menetralisir radikal bebas dan mencegah kerusakan yang ditimbulkan oleh radikal bebas dengan melengkapi kekurangan elektrolit yang dimiliki radikal bebas dan menghambat terjadinya reaksi berantai dari pembentukan radikal bebas yg dpt menimbulkan stres oksidatif. Radikal bebas Radikal bebas merupakan jenis oksigen yg memiliki tingkat reaktif yg tinggi dan secara alami ada didalam tubuh sebagai hasil dari reaksi biokimia tubuh. Radikal bebas juga terdapat di lingkungan sekitar kita yg berasal dari polusi udara, asap tembakau, penguapan alkohol yg berlebihan, bahan pengawet dan pupuk, sinar ultr violet, x-rays dan ozon. Radikal bebas dapat merusak sel tubuh apabila tubuh kekurangan zat anti oksidan atau saat tubuh kelebihan radikal bebas. Hal ini menyebabkan berkembangnya sel kanker,penyakit hati, arthritis, katarak, dan penyakit degeneratif lainnya, bahkan mempercepat proses penuaan. Radikal bebas dapat merusak membran sel serta merusak dan merubah DNA. Merubah zat kimia dlm tubuh dpt meningkatkan resiko terkena kanker serta merusak dan menonaktifkan protein. Antioksidan : Vit A, Vit C, Vit E, Karotenoid, Selenium 38 2.9 PVA (polivinil alkohol) Gambar 7. Struktur Polivinil alkohol PVA (polivinil alkohol) (DepKes RI, 1969, The United States Pharmacopeia, 2007). Sinonim : Airvol, Alcotex, Celvol, Elvanol, Gelvanol, Lemol, Mowiol, Polyviol, PVA, Vinyl alcohol, polimer. Nama Kimia: Ethenol, homopolimer. Rumus Molekul : (C2H4O)n. Pemerian : Serbuk putih. Kelarutan: Larut dalam air panas maupun air dingin, kelarutannya dalam air meningkat dengan menurunnya bobot molekul, sangat mudah larut dalam beberapa amina dan amida, praktis tidak larut dalam senyawa alifatik, aromatic, dan hidrokarbon terklorinasi, ester, keton, dan minyak. pH: 5,0 - 8,0 . Stabilitas : Polivinil alkohol didegradasi lambat pada suhu 1100C dan didegradasi cepat pada 2000C, tahan terhadap cahaya. Kegunaan : PVA dapat digunakan sebagai penyalut pada tablet, surfaktan anionik, peningkat viskositas, dan lain-lain. Penerapannya dalam bidang farmasi adalah untuk pemakaian topical, terkadang juga digunakan dalam produk untuk mata karena fungsinya yang dapat meningkatkan viskositas sehingga banyak dimanfaatkan dalam pembuatan lensa kontak. PVA ditambahkan pada pembuatan gel yang cepat kering ketika dioleskan pada kulit, selain itu PVA juga dapat digunakan dalam pembuatan tablet lepas lambat, produk transdermal, dan kosmetik. 39 3.0 Asam Askorbat (vitamin C) (Farmakope Indonesia edisi IV, 1995) Gambar 8. Struktur Asam Askorbat (Vitamin C) Mengandung tidak kurang dari 99,0% dan tidak lebih dari 100,5% C6H8O6 Rumus Molekul : C6H8O6. Nama Kimia : L-(+)-asam askorbat, asam 1,3 keto-threo heksuronat lakton, 3-okso L-gulofuranolakton (bentuk enol). Bobot Molekul : 176,13. Pemerian : Hablur/serbuk putih/agak kuning, praktis tidak berbau, rasa asam tajam. Oleh pengaruh cahaya lambat laun menjadi berwarna gelap dalam keadaan kering stabil di udara, dalam larutan cepat teroksidasi. Kelarutan : Mudah larut dalam air (1:3 sampai 1:3,5), larut dalam methanol (1:10) dan dalam aceton, agak sukar larut dalam etanol 95% P (1:25), propilenglikol (1:20), dalam gliserol (1:100), praktis tidak larut dalam kloroform, eter, benzene, eter, minyak, lemak, minyak tanah, pelarut lemak. 3.1 Radiasi Teknologi radiasi (proses radiasi) merupakan bagian dari teknologi nuklir yang berkembang cukup pesat. Beberapa proses radiasi telah banyak dimanfaatkan dalam berbagai bidang industri bahkan produkproduk hasil teknologi radiasi telah banyak dipasarkan. Iradiasi yang banyak digunakan pada bidang industri adalah iradiasi ionisasi seperti iradiasi sinar gamma dan berkas elektron. Radiasi ionisasi dapat 40 didefinisikan sebagai iradiasi yang mempunyai energi cukup tinggi (lebih dari 50eV) yang dapat melepaskan elektron dari atom atau molekulnya (ionisasi) dan merubahnya menjadi partikel-partikel yang bermuatan listrik yang disebut ion. Reaksi selanjutnya dari ion dan elektron ini yang menyebabkan terbentuknya radikal bebas yang sangat reaktif yang pada akhirnya menyebabkan reaksi kimia. Studi perubahan kimia yang terjadi dalam suatu sistem akibat absorbsi radiasi ionisasi dikenal dengan kimia radiasi. Secara umum ada dua jenis radiasi ionisasi yang banyak digunakan dalam industri (Darmawan, 2002) : 1). Radiasi elektromagnetik Radiasi elektromagnetik terdiri dari gelombang radio, gelombang mikro, cahaya tampak, ultraviolet, sinar gamma, dan sinar X. Namun hanya sinar X dan sinar gamma yang mempunyai panjang gelombang rendah dan energi lebih besar dari 50eV yang mampu untuk mengionisasi atom dan molekul. 2). Partikel berenergi tinggi Partikel ini dihasilkan dari mesin seperti elektron dari akselerator elektron dan H, He, Ar, dan positron dari akselerator ion beam. Namun demikian, partikel ini dapat juga diperoleh dari radioisotop seperti beta partikel dan alfa partikel. 3.1.1 Sumber iradiasi ionisasi Iradiasi ionisasi dapat diperoleh melalui dua sumber yang berbeda seperti radioisotop dan mesin. Radioisotop yang paling umum digunakan 41 secara komersil adalah Co-60 dan Cs-137. Kedua radioisotop ini merupakan pengemisi gamma. Sumber radiasi ionisasi yang lain adalah akselerator elektron dan mesin sinar-X dan akselerator partikel bermuatan positif atau akselerator ion beam. a. Radioisotop Radioisotop yang dikenal juga dengan radioaktif isotop atau radionuklida terjadi secara alami, namun dapat juga diproduksi secara buatan dalam suatu reaktor nuklir. Radioisotop adalah suatu elemen tidak stabil yang mempunyai kelebihan neutron atau proton dalam intinya dan mengemisikan radiasi dapat berupa α, β, γ dan secara spontan akan meluruh ke keadaan stabil. Di antara sumber iradiasi gamma, Co-60 paling banyak digunakan dalam industri karena mempunyai energi radiasi yang lebih tinggi (2,506 MeV) dibandingkan dengan Cs-137 (0,662 MeV). b. Akselerator elektron Elektron beam mempunyai daya tembus yang terbatas maka elektron beam hanya dapat digunakan untuk produk-produk yang mempunyai ketebalan tertentu (<5 cm). Berkas elektron dapat juga digunakan untuk pengawetan makanan (menghambat pertunasan, membunuh mikroba patogen) dan sterilisasi produk kesehatan yang mempunyai ukuran kecil. Akselerator elektron yang digunakan secara komersial dapat menghasilkan berkas elektron beam dengan rentang energi 80 KeV-10 MeV. Elektron mempunyai penetrasi yang lebih rendah dibandingkan dengan iradiasi gamma (Darwis, 2002). 42 Berdasarkan energi yang dihasilkan, akselerator elektron dapat dibagi menjadi tiga bagian : 1). Elektron beam energi rendah (80-500 KeV) 2). Elektron beam energi sedang (500 KeV-5 MeV) 3). Elektron beam energi tinggi (5-10MeV) Radiasi berkas elektron yang banyak digunakan untuk tujuan sterilisasi adalah yang mempunyai energi 2 hingga 10 MeV (MBE energi sedang hingga tinggi). Mesin berkas elektron (MBE) dengan energi 5 MeV mempunyai kemampuan penetrasi elektron sekitar 2 cm pada produk dengan densitas 1 gr/cm3 pada satu sisi permukaan produk dan 4 cm pada dua sisi permukaan produk. Sedangkan MBE dengan energi 10 MeV dapat meradiasi produk dengan densitas 0,15 g/cm3 setebal 60 cm dengan teknik radiasi dari dua sisi. MBE energi yang tinggi sehingga dapat mensterilkan produk dalam kemasan akhir, fleksibilitas perlakuan produk dan kecepatan dosis yang tinggi (Darmawan, 2006). Menurut Supandi (2007), mesin berkas elektron pada umumnya terdiri dari beberapa komponen utama, yaitu : pembangkit tegangan tinggi, sumber elektron, pemfokus berkas elektron, pengarah berkas elektron, tabung akselerator, sistem pemayaran, sistem vakum, dan sistem pengendali. 43 Gambar 9. Skema mesin berkas elektron (EBM) 3.1.2 Dosis radiasi Dosis Radiasi sangat menentukan efektivitas hasil yang diperoleh. Dalam proses iradiasi dikenal dua macam dosis, yaitu dosis terpancar dan dosis serap. Dosis terpancar adalah besarnya energi yang dipancarkan oleh sumber radiasi selama proses berlangsung. Sedangkan dosis serap adalah besarnya energi yang diserap oleh sample selama iradiasi. Biasanya jika hanya disebutkan dosis (radiasi), maka yang dimaksud adalah dosis serap, dengan satuan lamanya adalah rad, dan satuan standarnya adalah Gray (Darmawan, 2002). Rata-rata dosis yang diserap adalah dosis yang diserap per satuan waktu, contohnya Gy/detik atau Kgy/jam. Satuan dan besaran dosis radiasi dinyatakan melalui energi dan massa bahan, yaitu joule/kg bahan. Satuan dosis menurut S.I dinamakan Gray dan disingkat Gy. Secara numerik 1 Gy = 1 joule/kg bahan. Dulu satuan dosis radiasi menggunakan Rad (Radiation Absorbed Dose). 1 Rad = 10-2 Gy 44 Tabel 3. Berdasarkan tingkat dosis radiasi, aplikasi teknik radiasi yaitu: No. 1 2 3 4 Dosis rendah (0 - 1 kGy) Mencegah pertunasan (0,05 - 0,15 kGy) Menunda pematangan buah (0,1 - 1,15 kGy) Membunuh serangga (0,2 - 1 kGy) Membunuh parasit daging (0,1 - 0,3 kGy) Dosis sedang Dosis tinggi (1 - 10 kGy) Menurunkan kandungan Sterilisasi mikroba (pasteurisasi) (10 - 50 kGy) (0,5 - 10 kGy) Membunuh bakteri patogen (3 - 10 kGy) - - - 3.1.3 Efek radiasi pada polimer Apabila suatu radiasi ionisasi mengenai molekul polimer maka akan terjadi reaksi kimia yang pada akhirnya akan menentukan sifat polimer tersebut. Secara garis besar reaksi yang terjadi dapat diklasifikasikan menjadi dua yaitu reaksi pembentukan ikatan silang (crosslinking) dan reaksi pemutusan rantai polimer (degradasi) (Woods, et al, 1994). Crosslinking suatu polimer terjadi melalui ikatan dua rantai polimer yang berdekatan yang pada akhirnya membentuk suatu network tiga dimensi. Crosslinking dapat mengakibatkan suatu polimer mempunyai sifat viskositas bertambah, berat molekul bertambah, sifat mekanik bertambah (Woods, et al, 1994). Sebaliknya degradasi merupakan suatu reaksi pemutusan rantai polimer sehingga menyebabkan berkurangnya berat molekul, viskositas, dan menurunnya sifat mekanik. 45 Beberapa polimer dalam larutan mengalami reaksi crosslinking dan degradasi secara simultan jika diradiasi dengan sinar gamma atau elektron beam. Jika ikatan silang yang terjadi lebih banyak dibandingkan dengan pemutusan ikatan maka polimer disebut sebagai tipe crosslinking, sebaliknya jika degradasi lebih banyak terjadi dibandingkan ikatan silang maka polimer tersebut dikategorikan sebagai polimer bertipe degradasi (Darmawan, 2002). Tergantung dari reaksi mana yang lebih dominan akan menentukan sifat akhir dari polimer tersebut (Darmawan, 2002). Reaksi ikatan silang Gambar 10. Reaksi ikatan silang 3.1.4 Keunggulan menggunakan EBM (Woods, et al, 1994) a. Dalam pelaksanaan iradiasi lebih cepat. b. Pemilihan bahan pengemas menjadi lebih leluasa karena tidak harus bahan yang tahan panas. c. Iradiasi merupakan teknologi yang ramah lingkungan karena tidak ada limbah proses yang dibuang ke lingkungan. d. Teknik ini dapat dilakukan pada bahan/produk yang sudah dikemas (kemasan akhir). e. Iradiasi berkas elektron bukan merupakan radioisotop sehingga tidak berbahaya. 46 f. Dapat digunakan untuk produk-produk yang tipis karena daya tembusnya yang terbatas. 3.2 Radiofarmasi Penggunaan radioaktif melalui aliran darah disebut radiofarmasi. Dalam terapi ini, obat dimasukkan ke dalam sirkulasi darah. Obat itu menggunakan molekul atom radioaktif. Atom yang membentuknya adalah radioaktif. Radioaktif gamma dalam teknologi radiofarmasi adalah untuk diagnosis. Ada dua sinar gamma yang digunakan untuk diagnosis. Yakni, single photon emisien computerized tomography (emisi dari photon tunggal yang dapat ditelusuri komputer). Yang terbaru disebut PETpositron emission tomography (radioaktif yang memancarkan positron). Teknologi ini digunakan agar sinar gamma yang masuk ke dalam aliran darah bisa menembus sasaran. Setelah mencapai sasaran, dalam kurun waktu tertentu bisa ditelusuri dengan kamera gama atau komputer. Radiofarmasi adalah penggunaan senyawa radioaktif dalam pengobatan penyakit. Salah satu aplikasi radiofarmasi adalah sebagai radioimunoterapi. Radioimunoterapi adalah metode penanganan kanker dengan memanfaatkan reaksi spesifik antigen dan antibodi. Radioisotop dengan jenis radiasi yang mematikan sel “ditumpangkan” ke antibodi yang bereaksi secara spesifik dengan tumor-associated antigen. Setelah dimasukkan ke dalam tubuh, antibodi akan terikat ke dalam antigen yang ada di sel kanker dan sel tersebut akan dimatikan oleh radiasi yang dipancarkan radioisotop. Sampai saat ini, radioimunoterapi telah 47 digunakan untuk pengobatan beberapa jenis kanker, antara lain pengobatan limfoma, kanker prostat, dan melanoma. Radio Farmasi atau Farmasi Nuklir adalah penggunaan prinsip dan cara-cara farmasi dan radiokimia untuk membuat obat yang mengandung zat radioaktif (radiofarmaka) bagi keperluan zat radioaktif (radiofarmaka) bagi keperluan diagnosa dan penyembuhan (terapi) penyakit yang diidap pasien. Sediaan farmasi Nuklir adalah sediaan radio isotop yang digunakan reaktor nuklir, telah mengalami suatu pengolahan kimia (destruksi, destilasi, ekstraksi dll)an oleh manusia baik untuk diagnosa maupun terapi serta mnegalami metabolisme di dalam tubuh. Kedokteran Nuklir menurut Society of Nuclear Medicine (SNM), kedokteran nuklir adalah bidang keahlian dalam kedokteran yang menggunakan isotop radioaktif secara aman, tanpa sakit, dan murah, baik untuk pencitraan maupun untuk pencegahan dan pengobatan penyakit . Jadi ada 2 fokus utama dalam kedokteran nuklir. Yang pertama adalah pencitraan organ tubuh. Pencitraan disini unik karena bisa menggambarkan fungsi dan struktur organ tubuh sekaligus. Dengan cara ini dapat diperoleh informasi medis tanpa melalui operasi, yang dengan cara lain mungkin tidak bisa dilakukan,membutuhkan operasi atau biaya diagnosa yang lebih mahal. Karena kemampuan untuk menggambarkan fungsi dan struktur organ (bukan struktur saja), maka banyak penyakit yang bisa dideteksi lebih dini, dengan demikian pengobatannya pun menjadi lebih efektif. 48 BAB III KERANGKA KONSEP 3.1 Alur Penelitian Persiapan Pembuatan Starter Pembuatan Membran Selulosa Bakteri Pengeringan Pengukuran Tebal Membran Selulosa Bakteri Basah Pengukuran Tebal Membran Selulosa Bakteri Kering Pembuatan Membran (Selulosa bakteri – PVA) dan Pembuatan Membran (Selulosa bakteri – PVA) + Vitamin C Karakterisasi Selulosa Bakteri - PVA Karakterisasi Selulosa Bakteri- PVA + Vitamin C 1. Uji sifat mekanik 2. Uji fraksi gel 1. Uji sifat mekanik 2. Uji fraksi gel 3. Uji pH 4. Uji analisis pelepasan vitamin c dengan spektrofotometer UVVis 48 BAB IV METODOLOGI PENELITIAN 4.1 Waktu Penelitian Penelitian ini dilakukan di Laboratorium Kelompok Bahan Kesehatan Bidang Proses Radiasi, Pusat Aplikasi Teknologi Isotop dan Radiasi, Badan Tenaga Nuklir Nasional (BATAN) Pasar Jumat, Jakarta Selatan selama ±5 bulan dari April sampai dengan Agustus 2010. 4.2 Alat dan Bahan 4.2.1 Alat Alat-alat yang digunakan pada penelitian ini antara lain erlenmeyer, gelas ukur, gelas piala (Pyrex), alumunium foil, pipet tetes, pH meter, autoklaf (Hirayama HA - 3D, Japan), inkubator (Heraeus), oven (Heraeus), timbangan analitik (Sartorius-West Germany), tangas air, tali rapia, wadah kotak plastik, Mikrometer Thickness Gage (Mitutoyo) Laminar Air Flow (Envair-Australia), tabung reaksi (Pyrex), alat Tensile-Strength (Toyoseiki-Japan), Sealing plastik, spatel, kapas, pembakar spiritus, Hand-press, cawan petri, pinset, pipet ukur, mesin berkas elektron, Spektrofotometer UV - Vis (Spectrofotometer UV - Vis Lambda 25 Perkin Elmer). 4.2.2 Bahan Bahan-bahan yang digunakan dalam penelitian ini adalah air kelapa berasal dari Pasar Jumat, biakan Acetobacter xylinum, amonium sulfat 49 50 (Merck), asam asetat glasial p.a (Merck), sukrosa (Gulaku), NaOH 4% (Merck), H2O2 0,25% p.a (Merck), air suling, PVA (polivinil alkohol), Vitamin C. 4.3 Prosedur Kerja 4.3.1 Pengumpulan bahan Bahan yang digunakan untuk penelitian adalah air kelapa (Cocos nucifera) yang diperoleh dari pasar di daerah Pasar Jumat. Kelapa yang digunakan adalah kelapa tua atau tidak lebih dari satu minggu. 4.3.2 Pembuatan starter Sebanyak lebih kurang 400 ml air kelapa yang telah disaring dengan kain penyaring, ditambahkan dengan 1 gr ammonium sulfat kemudian diaduk sampai homogen. Cek pH, apabila larutan belum mencapai pH 4 maka ditambahkan asam asetat glacial (p.a) sampai pH 4. Larutan media tersebut disterilkan dalam otoklaf pada suhu 121 0C selama 10 menit. Sebanyak 80 gr gula pasir ditambahkan ke dalam larutan media steril dan didinginkan. Sebanyak 80 ml biakan Acetobacter xylinum ditambahkan ke dalam larutan media steril yang sudah dingin, aduk sampai homogen. Larutan dipindahkan ke dalam botol steril, ditutup dengan aluminium foil dan disimpan pada suhu 30±20C 4.3.3 Pengembangan stater A. xylinum Pengembangan bibit A. xylinum perlu dilakukan sebelum melakukan sintesis selulosa bakteri. Bibit tersebut yang akan digunakan sebagai stater untuk produksi selulosa bakteri (pelikel). Pengembangan bibit A. xylinum 51 penting dilakukan untuk memperoleh kondisi stater yang optimum, karena stok A. xylinum biasanya berada pada kondisi dorman sehingga perlu disegarkan kembali. Hal ini dilakukan agar bakteri A. xylinum tidak membutuhkan waktu yang lama untuk adaptasi ketika dipindahkan pada medium baru. Stater yang baik adalah stater yang berada pada fase pertumbuhan, karena pada fase ini mikroba sedang aktif berkembang sehingga tidak memerlukan waktu adaptasi yang lama ketika dipindahkan ke dalam medium yang baru, jumlah sel meningkat dengan pesat dan kepadatan populasi meningkat beberapa kali lipat. Bakteri A. xylinum memiliki fase pertumbuhan pada hari ke 6 - 7 (Slusarska, dkk, 2008). Pada penelitian ini stater ditumbuhkan selama 7 hari. Umur kultur yang akan digunakan sebaiknya jangan lebih dari 10 hari, karena volume akan berkurang akibat makin menebalnya lapisan nata, nutrisi dalam cairan stater berkurang dan jumlah koloni makin berkurang. Pengkulturan dapat dilakukan beberapa kali jika kondisi stater belum siap untuk produksi pelikel hingga diperoleh kondisi yang optimum. Hal ini diduga bakteri masih memerlukan waktu untuk adaptasi karena beberapa waktu berada dalam kondisi dorman. Dengan penggantian ke dalam medium yang baru untuk beberapa kali diharapkan nutrisi tetap terjaga untuk bakteri melakukan pertumbuhan. Parameter stater yang baik adalah tidak ditumbuhi jamur, tebal nata sekitar 1 - 1,5 cm dan pertumbuhannya cepat (nata sudah mulai terbentuk pada hari ke 3). 52 Berikut adalah gambar perbedaan kondisi stater yang baik dan kurang baik. (a) (b) Gambar 11. Perbedaan kondisi starter Keterangan : (a). Kondisi stater tidak optimum (b). Kondisi stater optimum 4.3.4 Pembuatan membran selulosa bakteri Stater yang diperoleh dalam kondisi optimum selanjutnya diperbanyak sesuai kebutuhan untuk produksi selulosa bakteri. Sintesis selulosa bakteri dilakukan dengan menumbuhkan stater bakteri Acetobacter xylinum pada medium pertumbuhan dengan air kelapa sebagai mikronutrien. Campuran media, air kelapa dan biakan bakteri dikembangkan dalam wadah steril dan kemudian diinkubasi selama 8 hari pada suhu 30±2 oC. Air kelapa diketahui memiliki mikronutrien yang cukup baik untuk pertumbuhan mikroba, Komponen yang terpenting yang terdapat di dalam air kelapa adalah karbohidrat (gula). Air kelapa dari buah yang sudah tua mengandung sukrosa, vitamin dan mineral penting untuk pertumbuhan mikroba. Kelapa yang baik adalah kelapa yang telah berumur 6 bulan, 53 karena pada umur ini kandungan nutrisinya paling maksimum (Piluharto, dkk, 2003). Selain kelapa juga digunakan ammonium sulfat dan gula. Ammonium sulfat digunakan sebagai sumber nitrogen. Nitrogen merupakan senyawa penting karena merupakan komponen dasar penyusun protein. Sedangkan gula adalah sumber karbon/karbohidrat yang akan dimanfaatkan A. xylinum untuk sintesis selulosa ekstraseluler. Gambar 12. Pemeraman dalam inkubator Hasil fermentasi bakteri Acetobacter xylinum dalam media air kelapa sebagai mikronutrien akan dihasilkan pelikel atau yang disebut dengan nata de coco. Proses terbentuknya pelikel merupakan rangkaian aktifitas bakteri Acetobacter xylinum dengan nutrien yang ada pada media cair. Karena Acetobacter xylinum adalah bakteri yang memproduksi selulosa, maka nutrien yang berperan adalah nutrien yang mengandung glukosa. Dalam penelitian ini nutrien yang mengandung glukosa adalah air kelapa dan gula pasir. 54 Gambar 13. Polimerisasi Glukosa yang berperan dalam pembentukan selulosa adalah glukosa dalam bentuk β sehingga semua glukosa yang ada dalam bentuk α akan diubah dalam bentuk β melalui enzim isomerase yang berada pada bakteri Acetobacter xylinum (Piluharto, dkk, 2003). Tahap berikutnya glukosa berikatan dengan glukosa yang lain melalui ikatan 1,4 β-glikosida. Tahap terakhir adalah tahap polimerisasi yaitu pembentukan selulosa. Polimerisasi ini terjadi melalui enzim polimerisasi yang ada pada bakteri Acetobacter xylinum. Secara fisik pembentukan selulosa adalah terbentuknya pelikel. Produksi lempeng nata (pelikel) dikatakan berhasil jika ketebalan rata, pelikel tidak berlapis, warna putih kekuningan, tidak terdapat jamur dan ketebalan berkisar 1 - 1,5 cm pada masa inkubasi 8 hari. Pelikel yang terbentuk pada penelitian ini memiliki warna putih kekuningan, tidak berjamur dan memiliki ketebalan antara 0,8 - 1 cm pada masa inkubasi 8 hari sehingga dapat dikatakan berhasil. Pelikel yang terbentuk kemudian dicuci dengan air mengalir, larutan NaOH 4% dan H2O2 0,25%. Gambar 11 menunjukkan tahapan proses pencucian tersebut. 55 A B C D Gambar 14. Proses pencucian pelikel yang dihasilkan Keterangan : A= pelikel setelah fermentasi 8 hari, B = pelikel dicuci dengan air mengalir, C = pelikel dicuci dengan NaOH pada suhu 90oC-95 oC, D = Pelikel yang dicuci dengan H2O2 pada suhu 40oC-45 oC Pencucian dengan air mengalir bertujuan menghilangkan sisa asam dan gula. Selain itu untuk menghindari reaksi browning ketika dipanaskan dengan NaOH, karena reaksi browning akan menyebabkan warna membran yang dihasilkan berwarna coklat. Pencucian dengan larutan NaOH 4% bertujuan untuk menghilangkan sisa sel-sel bakteri yang terperangkap dalam jaringan pelikel selulosa serta sisa-sisa substrat (Slusarska, 2008). Komponen-komponen non-selulosa ini diduga akan menghalangi ikatan yang terjadi antar rantai molekul selulosa yang mengakibatkan terhadap menurunnya kekuatan sifat mekanis selulosa (Piluharto, 2003). Pelikel selanjutnya dicuci dan direndam dalam air suling untuk menghilangkan sisa NaOH hingga diperoleh pH netral. Proses 56 kemudian dilanjutkan dengan pencucian menggunakan larutan H2O2 0,25% untuk proses pemutihan sekaligus sebagai efek bakterisidal. B A Gambar 15. Reaksi browning Keterangan : A= pelikel setelah pencucian dengan NaOH, B = membran yang dihasilkan (berwarna kecoklatan) Pelikel yang telah dimurnikan kemudian dihilangkan kadar airnya dengan hand press selanjutnya dikeringkan pada suhu 27oC - 29oC hingga diperoleh ketebalan 0,02 mm. Membran yang dihasilkan kemudian diradiasi pada dosis dan laju dosis yang berbeda dan kemudian dilakukan karakterisasi membran. Berikut adalah gambar membran yang dihasilkan dari proses fermentasi dari A.xylinum dalam air kelapa sebagai mikronutrien. A B C Gambar 16. Membran selulosa bakteri yang dihasilkan dari fermentasi A. xylinum dalam media yang mengandung air kelapa. Keterangan : A= pelikel setelah pemurnian, B = pengeringan, C = membran selulosa bakteri 57 4.3.5 Pembuatan larutan PVA (polivinil alkohol) Dibuat larutan PVA dengan konsentrasi 2%. 4%, dan 6%. Untuk larutan PVA 2% ditimbang sebanyak 10 gr serbuk PVA dan dilarutkan dalam 500 ml aquadest, untuk larutan PVA 4% ditimbang sebanyak 20 gr serbuk PVA dan dilarutkan dalam 500 ml aquadest, untuk larutan PVA 6% ditimbang sebanyak 30 gr serbuk PVA dan dilarutkan dalam 500 ml aquadest. Larutan PVA tersebut di otoklaf pada suhu 1210C selama 20 menit kemudian diangkat dan didinginkan. 4.3.6 Optimasi waktu perendaman selulosa bakteri – PVA Sebanyak 9 buah membran selulosa bakteri kering dengan ukuran 14 x 8 cm, ditimbang dan dicatat sebagai bobot awal (W0), lalu direndam dalam larutan polivinil alkohol (PVA) pada suhu 370C. Pada saat waktu perendaman 1 jam, 2 jam, 4 jam, 24 jam, 30 jam membran selulosa bakteri diambil dan cairan yang terdapat pada bagian permukaan membran dihilangkan dengan cara diblotting dengan menggunakan tissue. Membran selulosa bakteri tersebut ditimbang kembali dan dicatat sebagai bobot akhit membran setelah perendaman (Wt). Dibuat kurva hubungan antara waktu perendaman dengan berat hasil perendaman. Daya absorpsi (%) = Keterangan: Wo = berat sebelum perendaman Wt = berat setelah perendaman Wt W 0 x 100 W0 58 4.3.7 Pembuatan selulosa bakteri – pva Sebanyak 9 buah membran selulosa bakteri kering dengan ukuran 14 x 8 cm, ditimbang dan dicatat sebagai bobot awal (W0), lalu direndam dalam larutan polivinil alkohol (PVA) pada suhu 370C selama 24 jam. Membran selulosa bakteri diambil dan cairan yang terdapat pada bagian permukaan membran dihilangkan dengan cara diblotting dengan menggunakan tissue. Membran selulosa bakteri tersebut ditimbang kembali dan dicatat sebagai bobot akhit membran setelah perendaman (Wt). Kemudian diiradiasi dengan mesin berkas elektron (EBM) dengan energi 1,5 MeV dan arus 2 mA (miliampere) pada dosis 25 kGy. Daya absorpsi (%) = Wt W 0 x 100 W0 Keterangan: Wo = berat sebelum perendaman Wt = berat setelah perendaman 4.3.8 Pembuatan membran selulosa bakteri kering – pva + vitamin C Membran selulosa bakteri yang telah direndam dengan larutan polivinil alkohol selanjutnya di semprotkan dengan larutan vitamin C sebanyak 1 ml pada masing-masing membran selulosa bakteri. Kemudian diradiasi dengan mesin berkas elektron (EBM) dengan energi 1,5 MeV dan arus 2 mA (miliamper) pada dosis 25 kGy. 4.3.9 Karakterisasi membran selulosa bakteri – pva sebelum dan sesudah radiasi 1. Uji Tebal Membran Membran selulosa bakteri dalam keadaan basah dan kering yang telah disterilkan diukur ketebalannya pada beberapa bagian yang berbeda 59 dengan menggunakan alat mikrometer. Pengukuran dilakukan disetiap tempat atau sisi secara acak sebanyak 10 kali. Membran tersebut lalu dihitung ketebalan rata-ratanya. 2. Uji Sifat Mekanik (kekuatan tarik dan perpanjangan putus ) membran selulosa bakteri - pva Alat tensiometer dinyalakan selama 15 menit sebelum digunakan, diatur beban dan kecepatan alat yang diinginkan untuk memutuskan sampel. Beban yang digunakan sebesar 100 kg, chart speed diatur pada kecepatan 100 mm/menit, dan cross head speed diatur pada kecepatan 25 cm/menit. Setelah alat dipanaskan selama 15 menit membran kemudian diuji kekuatan tariknya. Kekuatan tarik (tensile strength) didefinisikan sebagai kemampuan atau ketahanan suatu materi terhadap gaya yang akan merobeknya. Sebelum di uji kekuatan tarik membran dipotong dengan pisau khusus sehingga berbentuk seperti dummbel, seperti yang ditunjukkan pada Gambar 14. Membran yang telah dipotong kemudian diuji kekuatan tarik seperti yang ditunjukkan pada Gambar 15. Tebal area pengukuran diukur dengan menggunakan alat micrometer pada lima daerah yang berbeda, lalu dihitung rata-rata tebal membran. Gambar 17. Membran dalam bentuk dummbel 60 Pegangan untuk menahan sampel Gambar 18. Cara pengujian kekuatan tarik Kekuatan tarik merupakan sifat yang penting untuk polimer yang akan mengalami perlakuan fisik dalam aplikasinya. Seperti halnya membran selulosa bakteri, parameter ini perlu di uji untuk mengetahui ukuran kekuatan membran selulosa bakteri. Berikut adalah gambar diagram karakteristik kekuatan tarik dan perpanjangan putus dari beberapa jenis material. Gambar 19. Diagram karakteristik kekuatan tarik dan perpanjangan putus beberapa jenis material. Perpanjangan putus (elongation) adalah persentasi peningkatan panjang materi sebelum mengalami putus. Perpanjangan putus dihitung pada sampel yang mengalami perputusan pada bagian tengah sampel yang telah diberi tanda sepanjang 1 cm, seperti yang ditunjukkan pada ilustrasi 61 berikut. Persentasi perpanjangan putus merupakan hasil pengurangan panjang akhir dengan panjang awal dibagi dengan panjang awal dan dikalikan 100 persen. Gambar 20. Ilustrasi penetapan perpanjangn putus Rumus Kekuatan Tarik : r= F A = F x 100 % txl Keterangan: r = kekuatan tarik (kg/cm2) F = beban untuk memutuskan sampel (kg) A = luas sampel yang mengalami tarikan (cm2) t = tebal sampel (cm) l = lebar sampel (cm) Rumus Perpanjangan Putus : E= La - Lo Lo x 100 % Keterangan : E = perpanjangan putus (%) La = panjang sampel pada saat putus (cm) Lo = Panjang sampel awal (cm) 3. Fraksi gel Selulosa bakteri – pva hasil iradiasi (hidrogel) dipotong dengan ukuran 4 x 5 cm2 kemudian ditimbang (WO). Hidrogel dimasukkan kedalam stainless steel net. Untuk menghilangkan fraksi yang larut, hidrogel di ekstraksi di waterbath pada suhu 80 – 900C selama 8 jam. Setelah itu hidrogel di otoklaf pada suhu 1210C selama 15 menit dikeringkan pada 62 suhu 600C, 800C, 1000C sampai bobot konstan. Fraksi gel dihitung dengan persamaan : Wt Fraksi gel = Wo x 100 % Keterangan : Wo = bobot hidrogel sebelum fraksi gel (%) Wt = bobot hidrogel kering/setelah diekstraksi 4. Uji keasaman dan kebasaan/pH Cara : pH masker ditentukan dengan menggunakan pH meter, yang sebelumnya telah dikalibrasi dengan dapar standar pH 4 dan pH 7. 5. Uji pelepasan vitamin C 1) Pembuatan membran difusi Membran yang digunakan adalah kertas Whatman no. 1 yang diimpregnasikan dengan cairan Spangler yang dimodifikasi. Komposisi cairan Spangler adalah sebagai berikut : Asam Palmitat 10 Asam Oleat 15 Asam Stearat 5 Minyak Kelapa 15 Paraffin 10 Kolesterol 5 Lilin Putih 15 Bahan untuk Spangler dilebur dan diaduk homogen. Dimasukkan ke dalamnya kertas Whatman no.1 dengan diameter 2,5 cm selama 15 menit. Segera diangkat dan dikeringkan selama 3 hari, kemudian 63 tentukan jumlah cairan yang diserap oleh kertas saring. Bobot kertas Whatman sebelum dan sesudah impregnasi ditimbang untuk mendapatkan kondisi yang sama pada setiap kertas Whatman. Persentase impregnasi membran dihitung berdasarkan rumus : Persentase impregnasi : Bt - Bo Bo X 100 % Keterangan : Bt = berat kertas Whatman sesudah impregnasi Bo = berat kertas Whatman sebelum impregnasi Kertas Whatman yang digunakan untuk percobaan difusi adalah yang memiliki bobot yang hampir sama. 2) Pengukuran difusi masker Siapkan seperangkat alat difusi yang telah dihubungkan dengan pompa peristaltik. Kompartemen reseptor dikondisikan pada suhu 370C ±10C dengan cara mengalirkan air yang bersuhu 370C ±10C pada water jacket yang menyelimuti kompartemen reseptor. Kompartemen donor diisi dengan 100 ml air suling. Secara perlahan letakkan kertas Whatman yang telah diimpregnasi di antara kompartemen donor dan kompartemen reseptor. Sediaan membran selulosa bakteri - pva ukuran lingkaran pada pelat sel difusi kemudian kertas Whatman di letakkan diatasnya sambil dihindarkan masuknya udara antara kertas Whatman dan membran selulosa bakteri - pva. Cincin penjepit diletakkan dan kemudian ditutup. Alat disimpan dalam bak air bersuhu 370C dan pompa peristaltik dijalankan. Pengambilan cuplikan sebanyak 5 ml dilakukan selama 1 jam pada menit 5, 10, 15, 20, 30, 40, 50, 60. Setiap 64 kali pengambilan 5 ml cuplikan, volume medium diganti dengan 5 ml larutan medium yang baru dengan volume yang sama. Sampel disaring dengan kertas Whatman. Setiap cuplikan dianalisis dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang maksimum vitamin c yang telah diperoleh (Kumar, et al, 2009; Jaimini, et al, 2007). 6. Pembuatan kurva kalibrasi vitamin C Larutan induk vitamin C dibuat dengan konsentrasi 10 ppm, dengan melarutkan 1 mg vitamin C dalam 100 ml aquadest. Dari larutan induk dibuat deret standar dengan konsentrasi 1 ppm, 5 ppm, 10 ppm, 15 ppm, dan 20 ppm. Setiap konsentrasi larutan diukur serapannya dengan spektrofotometer UV-Vis pada panjang gelombang maksimum vitamin c. Kemudian dibuat persamaan kurva kalibrasi y = a + bx (USP 30 – NF 25, 2007). 4.4 Analisa Data Data hasil pengamatan yang diperoleh dianalisis menggunakan uji analisa varian (ANOVA) satu arah terhadap konsentrasi variasi PVA 2 %, 4 %, 6 %. 65 BAB VI KESIMPULAN DAN SARAN 6.1 Kesimpulan 1. Sifat dan karakteristik dari selulosa bakteri – PVA hasil iradiasi (hidrogel) yang digunakan sebagai matriks topeng masker wajah yaitu uji tebal membran, uji absorpsi, uji sifat mekanik (kekuatan tarik dan elongasi), uji fraksi gel. 2. Konsentrasi PVA yang optimal untuk memperbaiki karakteristik dan sifat mekanik selulosa bakteri – PVA hasil iradiasi (hidrogel) sebagai matriks topeng masker wajah yaitu pva konsentrasi 6 % karena memberikan absorpsi 238,773 %, kekuatan tarik 1137 kg/cm2, elongasi 86,666 %, 89,655 %. 3. Selulosa bakteri – PVA hasil iradiasi (hidrogel) dapat digunakan sebagai matriks topeng masker wajah karena selulosa bakteri mempunyai daya absorpsi yang tinggi dan menahan air dalam jumlah besar. 4. Data statistik dari kekuatan tarik, elongasi, dan gel fraksi PVA dan PVA+vit C tiap konsentrasi sebelum dan sesudah radiasi berbeda. 6.2 Saran Perlu dilakukan pengujian lebih lanjut membran selulosa bakteri – pva sebagai matriks topeng masker wajah secara mikrobiologi dan kemampuan 84 85 membran selulosa bakteri – pva sebagai matriks topeng masker wajah secara klinis. 65 BAB V HASIL DAN PEMBAHASAN 5.1 Hasil Penelitian 5.1.1 Pengumpulan Bahan yang digunakan untuk penelitian ini adalah air kelapa yang diperoleh dari pasar di daerah Pasar Jumat, Jakarta Selatan . Dan biakan bakteri Acetobacter xylinum diperoleh dari Laboratorium Mikrobiologi Kelompok Bahan Kesehatan Bidang Proses Radiasi, Pusat Aplikasi Teknologi Isotop dan Radiasi, Badan Tenaga Nuklir Nasional (BATAN) Pasar Jumat, Jakarta Selatan 5.1.2 Hasil uji tebal membran selulosa bakteri kering dan basah sebelum diradiasi Hasil pengujian terhadap ketebalan membran selulosa bakteri dapat dilihat pada tabel dibawah ini. Sedangkan hasil perhitungan dapat dilihat pada lampiran 2. Tabel 4: Hasil uji pengukuran tebal membran selulosa bakteri kering dan basah sebelum diradiasi Sampel Membran selulosa bakteri Tebal Rata-rata Standar deviasi Kering Basah 0,028 0,006 0,094 0,008 5.1.3 Hasil optimasi waktu perendaman membran selulosa bakteri – pva Hasil uji optimasi waktu perendaman membran selulosa bakteri – pva yang dihasilkan dari penelitian dapat dilihat pada tabel dan grafik dibawah ini. Sedangkan data hasil uji optimasi waktu perendaman dan contoh perhitungan dapat dilihat pada lampiran 3. 66 Tabel 5 : Tabel hasil optimasi waktu perendaman membran selulosa bakteri dengan PVA 2 %, 4 %, 6 % Waktu perendaman Absorpsi (%) 1 jam 2 jam 4 jam 24 jam 30 jam 54 jam Berat (membran selulosa bakteri) Selulosa bakteri – pva 2 % 113,396 106,464 135,552 144,981 179,877 158,721 Selulosa bakteri – pva 4 % 112,437 124,432 165,014 195,149 217,068 192,205 Selulosa bakteri – pva 6 % 121,563 117,268 145,806 201,882 238,773 220,053 700 600 500 400 300 200 100 0 pva 6 % pva 4 % pva 2 % 1 2 4 24 30 54 Waktu perendaman (jam) Gambar 21.Hasil uji optimasi waktu perendaman membran selulosa bakteri dengan larutan pva 2 %, 4 %, 6 % 5.1.4 Hasil uji sifat mekanik membran selulosa bakteri – pva sebelum dan sesudah diradiasi Hasil pengujian sifat mekanik membran selulosa bakteri – pva yang meliputi pengujian kekuatan tarik dan perpanjangan putus membran dapat dilihat pada tabel 3 – tabel 6 dan grafik 4 – grafik 7 dibawah ini. Sedangkan contoh hasil dan perhitungan dapat dilihat pada lampiran 4 – 27. 67 Tabel 6 : Hasil uji perpanjangan putus hidrogel (selulosa bakteri + PVA 2 %, 4 %, 6 %) sebelum dan sesudah diradiasi Sampel Perpanjangan putus (%) Selulosa bakteri – pva 2 % Selulosa bakteri – pva 4 % Selulosa bakteri – pva 6 % Perpanjangan Putus (%) Sebelum Setelah Rata-rata 23,333±0,058 46,666±0,058 Rata-rata 26,666±0,058 60,000±0,173 Rata-rata 43,333±0,115 86,666±0,115 100 80 60 PVA 2 % 40 PVA 4 % 20 PVA 6 % 0 sebelum Sesudah Radiasi dengan elektron berkas mesin (EBM) dosis 25 kGy Gambar 22 . Grafik hasil uji perpanjangan putus hidrogel (selulosa bakteri – PVA 2 %, 4 %, 6 %) sebelum dan sesudah diradiasi Tabel 7: Hasil uji kekuatan tarik hidrogel (selulosa bakteri – PVA 2 %, 4 %, 6 %) sebelum dan sesudah diradiasi Sampel Selulosa bakterri – pva 2 % Selulosa bakteri – pva 4 % Selulosa bakteri – pva 6 % Kekuatan tarik (kg/cm2) Sebelum radiasi Setelah radiasi Rata-rata 1016,666±97,341 1027,777±100,154 Rata-rata 1055,555±254,587 1111,111±192,450 Rata-rata 1074,074±64,410 1148,148±128,210 68 Kekuatan tarik (MPa) 1200 1150 1100 PVA 2 % 1050 PVA 4 % 1000 PVA 6 % 950 sebelum radiasi sesudah radiasi Radiasi hidrogel dengan EBM dosis 25 kGy Gambar 23. Grafik hasil uji kekuatan tarik hidrogel (selulosa bakteri – PVA 2 %, 4 %, 6 %) sebelum dan sesudah diradiasi Tabel 8: Hasil uji perpanjangan putus hidrogel (selulosa bakteri + PVA 2 %, 4 %, 6 % + vitamin c) sebelum dan sesudah diradiasi Sampel Perpanjangan putus (%) Selulosa bakteri – pva 2 % Selulosa bakteri – pva 4 % Selulosa bakteri – pva 6 % Perpanjangan Putus (%) Sebelum radiasi Setelah radiasi Rata-rata 33,333±0,057 60,000±0,173 Rata-rata 46,666±0,057 63,333±0,152 Rata-rata 60,000±0 86,666±0,115 100 90 80 70 60 50 40 30 20 10 0 PVA 2 % PVA 4 % PVA 6 % sebelum radiasi sesudah radiasi Radiasi hidrogel dengan EBM dosis 25 kGy Gambar 24. Grafik hasil uji perpanjangan putus hidrogel (selulosa bakteri – PVA 2 %, 4 %, 6 % + Vitamin C) sebelum dan sesudah diradiasi 69 Tabel 9: Hasil uji kekuatan tarik hidrogel (selulosa bakteri – PVA 2 %, 4 %, 6 % + vitamin c) sebelum dan sesudah diradiasi Sampel Kekuatan tarik (MPa) Selulosa bakteri – pva 2 % Selulosa bakteri – pva 4 % Selulosa bakteri – pva 6 % Kekuatan tarik (kg/cm2) Sebelum radiasi Setelah radiasi Rata-rata 986,110±139,928 1037,036±195,108 Rata-rata 1083,333±220,485 1129,629±262,547 Rata-rata 1111,111±111,111 1137,037±174,383 1150 1100 1050 PVA 2 % 1000 950 PVA 4 % 900 PVA 6 % sebelum radiasi sesudah radiasi Radiasi hidrogel dengan EBM dosis 25 kGy Gambar 25. Grafik hasil uji kekuatan tarik hidrogel (selulosa bakteri – PVA 2 %, 4 %, 6 % + vitamin c) sebelum dan sesudah diradiasi 5.1.5 Hasil uji gel fraksi membran selulosa bakteri – pva sesudah diradiasi Hasil pengujian gel fraksi membran selulosa bakteri – pva dapat dilihat pada tabel 7 dan tabel 8 dan grafik 8 dan grafik 9 dibawah ini. Sedangkan contoh hasil dan perhitungan dapat dilihat pada lampiran 28 - 29. Tabel 10:Hasil uji gel fraksi hidrogel (selulosa bakteri - PVA 2 %, 4 %, dan 6 %), hidrogel (selulosa bakteri - PVA 2 %, 4 %, dan 6 % + vitamin c) setelah diradiasi Elongasi (%) Sampel Selulosa Selulosa bakteri - pva bakteri – pva + vitamin c 2% Rata-rata 60,432±8,973 71,724±16,119 4% Rata-rata 72,831±4,660 83,663±4,573 6% Rata-rata 87,793±8,477 89,655±0,788 70 100 Gel fraksi (%) 80 60 pva 2 % 40 pva 4 % 20 pva 6 % 0 pva pva + vitamin c Radiasi hidrogel dengan EBM dosis 25 kGy Gambar 26. Grafik hasil uji gel fraksi hidrogel (selulosa bakteri PVA 2 %, 4 %, dan 6 %), hidrogel (selulosa bakteri PVA 2 %, 4 %, dan 6 % + vitamin c) setelah diradiasi 5.1.6 Penentuan panjang gelombang maksimum vitamin c Hasil penentuan panjang gelombang maksimum vitamin c dalam larutan air aquadest menggunakan spektrofotometer UV-Vis adalah pada 264 nm (lampiran 30), (USP 30 – NF 25, 2007). 5.1.7 Pembuatan kurva kalibrasi vitamin c Berdasarkan hasil pengukuran hubungan konsentrasi dengan serapan vitamin c dalam air aquadest diperoleh persamaan kurva kalibrasi y = 0,040 x + 0,116 dengan nilai r = 0,9999 dapat dilihat pada gambar 9 dibawah ini. Dan data selengkapnya dapat dilihat pada lampiran 31. 71 Absorbansi 1 0.8 0.6 0.4 Y-Values 0.2 Linear (Y-Values) 0 0 5 10 15 20 25 y = 0.040x + 0.116 R² = 0.999 Konsentrasi (ppm) Gambar 27. Kurva kalibrasi vitamin c dalam air aquadest 5.1.8 Profil difusi vitamin c Hasil uji difusi selama 60 menit menunjukkan bahwa ketiga fomula (selulosa bakteri – pva 2 %, 4 %, 6 %) yang diuji memiliki kinetika pelepasan mengikuti orde nol dapat dilihat pada tabel 8 dan gambar 10 dibawah ini. Hasil selengkapnya mengenai uji disolusi dapat dilihat pada lampiran 32. Tabel 11. Hasil perhitungan kadar pelepasan vitamin c pada uji difusi Waktu Pelepasan vitamin c (% b/b) (menit ke-) Formula Masker Topeng Selulosa Selulosa Selulosa bakteri – pva bakteri – pva bakteri – pva 2% 4% 6% 5 8,69 10,29 4,16 10 17,71 14,62 13,14 15 34,70 26,76 18,29 20 41,87 46,33 23,06 30 55,61 49,67 29,39 40 64,00 53,85 30,66 50 76,31 61,66 32,97 60 80,62 64,26 39,28 % vitamin C terdifusi 72 90 80 70 60 50 40 30 20 10 0 pva 2% pva 4% pva 6% 0 20 40 60 80 waktu (menit) Gambar 28. Kurva pelepasan vitamin C 5.2 Pembahasan 5.2.1 Pembuatan membran selulosa bakteri Pada penelitian ini selulosa bakteri dihasilkan melalui suatu proses fermentasi bakteri A.xyinum dalam media air kelapa sebagai sumber mikronutrien bakteri. Fermentasi dilakukan pada suhu kamar (30±2 0C). Pelikel yang dihasilkan dikenal dengan sebutan nata de coco. Pelikel selulosa bakteri lalu dicuci dengan larutan NaOH 4 % dan H2O2 0,25 %. Pencucian dengan larutan NaOH 4 % bertujuan untuk menghilangkan sisa sel-sel bakteri A.xylinum yang terperangkap dalam jaringan pelikel selulosa, adanya kontaminasi bakteri dan kemungkinan adanya endotoksin yang terjadi selama produksi pelikel selulosa bakteri. Pelikel selanjutnya dicuci dan direndam dalam air suling untuk menetralkan sifat alkali dari larutan NaOH. Proses kemudian dilanjutkan dengan pencucian menggunakan H2O2 0,25 % untuk memutihkan pelikel sehingga diperoleh pelikel selulosa bakteri yang berwarna putih seperti yang dapat dilihat pada foto hasil penelitian. 5.2.2 Hasil uji ketebalan membran selulosa bakteri 73 Berdasarkan hasil penelitian (tabel 1), terlihat bahwa ketebalan membran selulosa bakteri basah yang dihasilkan berkisar 0,090 – 0,1 mm dan tebal rata-rata 0,094 mm. Hal ini menunjukkan masih banyaknya air yang terkandung dalam membran selulosa bakteri basah. Membran selulosa bakteri juga mengalami proses pengeringan pada suhu kamar, setelah proses pengepresan. Pengeringan tersebut menyebabkan sebagian air yang tersisa di dalam membran juga keluar. Proses pengeringan membran yang dilakukan pada suhu kamar dimaksudkan agar proses keluarnya air dari dalam membran perlahan-lahan (tidak dalam kondisi yang dipaksakan) sehingga tidak mengubah struktur pori-pori membran seperti yang terjadi jika dikeringkan dalam oven. Data hasil uji tebal membran selulosa bakteri kering dapat dilihat pada tabel 1. Berdasarkan hasil penelitian (tabel 1) terlihat bahwa ketebalan membran selulosa bakteri kering berkisar 0,02 – 0,037 mm dan ketebalan rata-rata sebesar 0,028 mm. Hal ini menunjukkan pengepresan pelikel selulosa bakteri menyebabkan ketebalan membran semakin berkurang. Trade dan Evironment Database (2004) menyatakan bahwa pelikel selulosa bakteri mengandung air sekitar 98 %. Perbedaan ketebalan membran yang terjadi pada membran selulosa kering dan membran selulosa basah disebabkan oleh adanya sifat hidrofilisitas dari membran selulosa bakteri. Adanya sifat hidrofilik ini menyebabkan membran selulosa bakteri menjadi elastis dan mudah menyesuaikan dengan kontur tubuh serta tidak menimbulkan rasa sakit selama digunakan. Menurut Cerrai (1999), produk yang ada dipasaran mempunyai ketebalan bervariasi mulai dari 0,1 mm sampai 1 74 mm, dengan demikian membran selulosa bakteri dapat digunakan sebagai matriks topeng masker wajah. Dengan meningkatnya teknologi dan kebutuhan akan bahan baru yang dapat diaplikasikan di bidang kesehatan, maka hidrogel yang telah digunakan sebagai matriks topeng masker wajah. Hidrogel mempunyai kandungan air berkisar 70 – 95 % ((Darwis, dkk., 1993). Selain itu, hidrogel yang kaya air sangat cocok digunakan sebagai sediaan tidak berlemak untuk pemakaian kulit. Penggunaan hidrogel sebagai matriks topeng masker wajah mempunyai keunggulan dibandingkan yang ada dipasaran karena selain nyaman pada pemakaiannya juga bersifat alami karena tidak mengandung zat aktif attau obat yang dapat menimbulkan efek samping. Hidrogel dibuat dari polimer hidrofilik dan kopolimernya dengan cara konvensional atau teknik radiasi sehingga terbentuk struktur berikatan silang (crosslinking) yang sukar larut. Salah satu bahan dasar yang digunakan dalam pembuatan hidrogel adalah polimer sintetis seperti polivinil alkohol (PVA) atau polimer lain. PVA adalah salah satu jenis polimer hidrofilik yang banyak digunakan dalam berbagai bidang kimia, farmasi dan kesehatan. produk yang dihasilkan umumnya mempunyai sifat fisik yang baik, tidak toksik, dan mempunyai kemampuan meyerap air yang relatif tinggi. Oleh karena itu pada penelitian ini akan dilakukan formulasi hidrogel sebagai matriks topeng masker wajah dengan konsentrasi PVA 2 %, 4 %, dan 6 %, untuk meningkatkan elastisitas serta kekuatan hidrogel. 75 Pembentukan ikatan silang dari polimer tersebut dilakukan dengan proses radiasi. Penggunaan radiasi untuk pembentukkan dan modifikasi hidrogel untuk tujuan biomedis dalam bidang kosmetik memiliki beberapa keuntungan, antara lain untuk mensterilkan produk yang diiradiasi, tidak menimbulkan residu kimia, proses lebih mudah dikendalikan dengan mengatur dosis serap, dan iradiasi ini aman bagi manusia dan lingkungan (Rosiak et al., 1995). 5.2.3 Hasil uji daya absorpsi membran selulosa bakteri - pva Kemampuan menyerap (absorpsi) membran selulosa bakteri dalam larutan PVA ditunjukkan dalam tabel 2 dan gambar 3. Dari tabel terlihat bahwa kemampuan absorpsi membran selulosa bakteri – pva meningkat cukup tajam dalam waktu 24 jam kemudian dilanjutkan dengan kecepatan absorpsi yang relatif lebih lambat hingga 30 jam perendaman. Pada perendaman selanjutnya hingga 54 jam terjadi penurunan dan tidak menunjukkan nilai absorpsi yang signifikan. Sehingga dapat dikatakan pada waktu perendaman selama 24 jam telah terjadi kondisi ˝equilibrium swelling state˝ . Hal ini karena membran selulosa bakteri belum jenuh dengan cairan sehingga larutan pva tersebut dapat dengan bebas masuk ke pori-pori membran dan mengisi ruang dalam pori tersebut sehingga daya serap atau absorpsi membran selulosa bakteri pva menjadi relatif besar dapat dilihat pada tabel 1 dan gambar 2. Dimana paling tinggi adalah daya serap selulosa bakteri – pva 6 % yaitu 201,882 %. 76 Melihat kemampuan daya serap selulosa bakteri – pva yang cukup tinggi, selulosa bakteri – pva dapat diaplikasikan sebagai bahan baku pada matriks topeng masker wajah. 5.2.4 Hasil uji kekuatan tarik hidrogel (selulosa bakteri – pva hasil iradiasi) Hasil uji kekuatan tarik selulosa bakteri – pva yang telah diradiasi pada dosis 25 kGy dapat dilihat pada tabel 3 – tabel 6 dan grafik 4 – grafik 7. Tabel dan kurva menunjukkan bahwa nilai kekuatan tarik membran selulosa bakteri – pva diradiasi dengan dosis 25 kGy menyebabkan kekuatan tarik membran selulosa bakteri – pva 6 % meningkat menjadi yaitu sebesar 1148,148 kg/cm2, sedangkan paling rendah adalah pada selulosa bakteri dengan konsentrasi pva 2 % yang diradiasi yaitu sebesar 981,482 kg/cm2. Hal ini disebabkan karena energi radiasi berkas elektron dapat menginduksi terjadinya proses radiasi dapat menginduksi reaksi kimia pada bahan yang diiradiasi, seperti pembentukan ikatan silang (crosslinking). Efek ikatan silang molekul polimer akan meningkatkan sifat kekuatan tarik. Pengujian sifat mekanik membran selulosa bakteri – pva yang meliputi kekuatan tarik dan elongasi (perpanjangan putus) dilakukan untuk mengetahui mudah atau tidaknya membran selulosa bakteri – pva mengalami robek pada saat membran diaplikasikan sebagai matriks topeng masker wajah. Hal ini sesuai dengan persyaratan dari beberapa produk dipasaran yang mempunyai standar kekuatan tarik 3000 – 5000 kg/cm2 (British Journal of Oral and Maxilofacial Surgery, 2005). Penambahan vitamin c akan terbentuk suatu struktur gabungan antara ikatan silang 77 polimer pertama dengan ikatan silang polimer kedua yang dikenal dengan IPN (interpenetrating polymer network) (Xuequan, et al., 2000). Adanya struktur kompleks ini dapat meningkatkan sifat mekanik hidrogel yang terbentuk. Membran selulosa bakteri – pva 6 % memiliki elongasi yang paling tinggi yaitu sebesar 86,666 % dibandingkan dengan selulosa bakteri – pva 2 % dan 4 % mempunyai elongasi yang lebih rendah. Berdasarkan hasil tersebut menunjukkan bahwa membran yang diradiasi memiliki sifat kekuatan yang elastis dan tidak mudah rapuh. Karena matriks topeng masker wajah yang diaplikasikan harus memiliki sifat elastisitas untuk menempel pada wajah. 5.2.5 Hasil uji gel fraksi hidrogel (selulosa bakteri – pva hasil iradiasi) Polivinil alkohol (PVA) adalah polimer hidrofilik yang bila diradiasi dengan berkas elektron akan membentuk hidrogel yang mempunyai ikatan silang (crosslinking) antar rantai molekulnya, bersifat tidak larut dan menyimpan air dalam strukturnya (Laili, dkk., 2006). Gel fraksi adalah bagian yang tidak terlarut dari suatu hidrogel hasil iradiasi. Yang dinyatakan dalam persen (%). Data gel fraksi dapat dilihat pada tabel 7 dan gambar 8 yang menggambarkan hubunngan antara polimer pva dengan penambahan vitamin c yang akan membentuk interpenetrating polymer network (IPN). Dari data terlihat selulosa bakteri – pva mempunyai nilai gel fraksi tertinggi yaitu sebesar 87,793 % dan dengan penambahan vitamin c menjadi 89,655 %. 5.2.6 Uji penetrasi vitamin c dari selulosa bakteri – pva 2 %, 4 %, 6 % 78 Pembuatan kurva kalibrasi pada penelitian ini mengunakan vitamin c, hal ini karena vitamin c merupakan obat yang bekerja menangkap radikal bebas serta mencegah terjadi reaksi berantai sehingga tidak terjadi kerusakan yang lebih besar. Vitamin c digunakan karena dalam matriks topeng masker wajah akan di radiasi, sehingga diperlukan bahan yang bersifat polimer hidrofilik dan dosis lazimnya yang cukup kecil yaitu 0,01 – 0,1 % (Handbook of pharmaceutical excipients, hal. 15). Hasil selengkapnya mengenai uji difusi dapat dilihat pada lampiran 32. Uji penetrasi in vitro dilakukan menggunakan alat pelepasan zat aktif (difusi). Pengujian dilakukan untuk mengetahui jumlah vitamin c yang dapat berpenetrasi melalui kulit selama interval waktu tertentu. Membran yang digunakan pada pengujian adalah membran dari kertas Whatman no. 1 yang telah diisi oleh cairan Spangler dengan berat kertas whatman sebelum impregnasi 50,452 gr dan sesudah impregnasi 58,975 gr digunakan kertas Whatman no.1 karena membran ini mempunyai permeabilitas yang sama dengan kulit wajah manusia. Dari profil difusi terlihat bahwa penetrasi vitamin c per menit meningkat dari menit ke-5 kemudian mencapai nilai optimum pada menit ke-15 terus meningkat sampai menit ke-60. Hal ini berarti pada kurva menaik, gradient konsentrasi antara kompartemen donor dan reseptor besar. Kurva hubungan antara waktu dengan konsentrasi dari data yang diperoleh lebih linear dari pada kurva hubungan antara waktu dengan ln konsentrasi. Ini berarti laju pelepasan vitamin c konstan dari waktu ke 79 waktu tidak dipengaruhi oleh konsentrasi obat dalam sediaan. Jenis matriks yang digunakan pada penelitian ini adalah jenis matriks hidrofilik. Matriks hidrofilik akan membentuk lapisan gel hidrofilik saat mengalami kontak dengan medium. Adanya lapisan gel dapat menahan pelepasan obat lebih lama. Lapisan gel berfungsi sebagai penghalang disekeliling matriks yang mengontrol pelepasan obat dari dalam matriks dan penetrasi cairan ke dalam matriks. Semakin kuat dan tebal lapisan gel maka penetrasi cairan semakin sulit dan jumlah obat yang berdifusi keluar matriks menjadi semakin sedikit. Dari penelitian ini diketahui bahwa matriks selulosa bakteri – pva 6 % mampu menahan pelepasan vitamin c lebih lama dari pada matriks selulosa bakteri – pva 2 %. Setelah dilakukan uji difusi selama 1 jam diperoleh persentase pelepasan vitamin c untuk selulosa bakteri – pva 2 % adalah 80,62 %, selulosa bakteri – pva 4 % adalah 64,26 %, selulosa bakteri – pva 6 % adalah 39,28 %. Semakin tinggi konsentrasi PVA sebagai matriks dalam formula maka akan semakin lama menahan pelepasan obat. Uji derajat keasaman atau kebasaan (pH) merupakan parameter fisikokimia yang harus dilakukan pada pengujian sediaan topikal, karena pH mempengaruhi efektivitas, stabilitas, dan kenyamanan penggunaan pada kulit. Apabila bersifat basah (tidak masuk pada rentang pH kulit 4,5 – 6,5) akan mengakibatkan kulit terasa licin, cepat kering, dan dikhawatirkan akan mempengaruhi elastisitas kulit, namun apabila bersifat 80 asam dengan rentang pH di bawah rentang pH kulit akan mengakibatkan kulit mudah teriritasi (iswari, dkk, 2007). Dari hasil pengamatan pH dengan menggunakan alat uji pH meter hidrogel (selulosa bakteri – PVA + Vit.C ) mempunyai pH 6,19. 5.2.7 Data hasil ANOVA Selanjutnya data yang diperoleh dari pengamatan dilanjutkan dengan pengolahan data menggunakan uji analisis varian (ANOVA) satu arah menggunakan program SPSS. Terlebih dahulu dilakukan uji normalitas dan uji homogenitas. Metode yang digunakan pada uji normalitas adalah uji kolmogorov-Smirnov, dan homogenitasnya menggunakan uji Levene. Berdasarkan uji normalitas, data elongasi, kekuatan tarik, dan gel fraksi PVA dan PVA – vitamin c tiap konsentrasi sebelum dan sesudah radiasi uji terdistribusi normal, yaitu hasil data signifikasi lebih besar dari 0,05. Uji homogenitas PVA dan PVA – vitamin c tiap konsentrasi sebelum dan sesudah radiasi bervariasi homogen kecuali data PVA – vitamin c sebelum radiasi tidak bervariasi homogen karena signifikansi ≤ 0,05 (p = 0,02) sehingga dilanjutkan dengan uji Kruskal Wallis, yaitu data PVA dan PVA – vitamin c tiap konsentrasi sebelum dan sesudah radiasi berbeda secara bermakna maka dilanjutkan dengan uji BNT menggunakan metode LSD. DAFTAR PUSTAKA Almaitser, S. Prinsip Dasar Ilmu Gizi. Jakarta. 2001, hal 97-98. Astawan, M. Kelapa Muda Pulihkan Stamina. 2010. Diakses : 27 Juli 2010. Diambil dari : www.kompas.com. Astawan M. Kelapa Muda Pulihkan Stamina. 2009. Diakses : 27 April 2009. Diambil dari : www.kompas.com. Teknologi Pengolahan Pangan Nabati Tepat guna., edisi pertama, 1991, hal. 158-163. Bielecki S, Alina K, Marianna T, Halina K. Bacterial Cellulose. 2005. Diakses : 3 April 2009. Diambil dari : www.wiley InterScience.com. Brown, Malcom, Jr, ˝Advances in Cellulose Biosynthesis˝, Polimer from Biobased Material, New Jersey, hal 122-127. Cerrai, P., 1999, Periodontal Membrane From Composite of Hydroxyapatited and Bioresorable Block Copolymers, Journal of Materials Science : Material in Medicine, Vol 10, No. 10-11. Chan E dan Craig R. Elevitch. Cocos nucifera (coconut). 2010. Diakses : 25 Juli 2010. Diambil dari : www.traditionaltree.org. Collado. Nata: Processing and Problems of The Industry In The Phillipines, Tokyo. 1986, Hal 13-15. Czaja, W., ˝Microbial Cellulose-The Natural Power To Heal Wounds˝, Journal Biomaterial, No. 27, Vol. 2, hal. 145-151. Darwis, D., ˝Aplikasi Mesin Berkas Elektron dalam Bidang Biomedical Polymer dan Farmasi˝, P3TIR-BATAN, Jakarta, 2004, hal. 16-17. Darwis D. Aplikasi Teknologi Nuklir dalam Bidang Proses Radiasi dan Aspek Keselamatannya. Jakarta : Pusat Aplikasi Isotop dan Radiasi, Badan Tenaga Nuklir Nasional; 2002.hal. 3, 5-8. Darwis, D., ˝Aplikasi Hidrogel dalam Bidang Kedokteran dan Farmasi˝, P3TIR BATAN, Jakarta, 1999, hal. 1-11. Darwis, D., Hardiningsih, L., Erizal dan Chosdu, R., ˝Daya Absorpsi Hidrogel Polivinilpirolidon (PVP) Hasil Iradiasi Gamma Terhadap Air dan Pelarut Organik˝, Risalah Pertemuan Ilmiah Aplikasi Isotop dan Radiasi, Jakarta, 1995, hal. 129-136. 86 Darwis, Darmawan, ˝Aplikasi radiasi di bidang kesehatan˝ Coaching Aplikasi Kimia Radiasi, PATIR-Pusdiklat BATAN, Jakarta, 2008. Departemen Kesehatan Republik Indonesia. Farmakope Indonesia Edisi IV. Jakarta : Direktorat Jenderal Pengawasan Obat dan Makanan; 1995.hal. 69, 554, 584, 688, 1125, 1193. Departemen Kesehatan RI. Farmakope Indonesia edisi. IV. Jakarta : Direktorat Jendral Pengawetan Obat dan Makanan; 1995. Hal. 529. Departemen Kesehatan RI. Farmakope Indonesia edisi. IV. Jakarta : Direktorat Jendral Pengawetan Obat dan Makanan; 1995. Hal. 39, 107, 584, 750. Dwikarya, M. Merawat kulit dan Wajah. Jakarta:Kawan Pustaka: 2002. hal. 47, 62-3. Erizal dan Lely Hardiningsih, ˝Pengaruh Iradiasi Gamma pada Sifat Fisika-Kimia Plastik Film Nata de Coco˝, Dalam Risalah Pertemuan Ilmiah Penelitian dan Pengembangan Aplikasi Isotop dan Radiasi, 2003, Aplikasi Teknik Nuklir Menunjang Pembangunan Industri dan Pertanian Nasional. Jakarta, 2008 hal 265-270. Gennaro AR, Remington. The Science and Practise of Pharmacy. 20th ed. Vol. 1. Philadelphia: Lippincott Williams and Wilkins. 2000. hal. 86-92. Hidayat, Taufan, Tri Priyadi Basuki dan Nina Elyani, ˝Application of Bacterial Cellulose in Papermaking˝, Proceeding of the International Workshop Green Polymer, Bandung-Bogor, Indonesia. 1996, hal 43-46. Ighuci, M., Yamanaka, S., ˝Industrial Use of Bacterial Cellulose-A Review˝., Proceedings of The International Workshop on Green Polymer., Bandung, 1996, hal 47-54. Iguchi, M., Yamanaka, S., Budhioko, A. Bacterial Cellulose. a masterpiece of nature's arts, J. Mater. Sci. 2000 : 35, 261–270. Indriati, Lies, Nina Elyani dan Taufan Hidayat, ˝Pemanfaatan limbah Nata de Coco sebagai aditif pada pembuatan kertas˝, Prosiding Seminar Teknologi Selulosa, Bandung. 2001, hal 24-32. Jing R. and Hongfe H.study on interpenetrating polymer network hidrogel of diallyldimethylammonium chloride with kappa-carragenan by UV irradiation. European Polymer Journal 2001; 37 (12): p.2413-7. Jonas, R., Farah, L. F. Production and Application of Microbial Cellulose. Polym.Degrad. Stabil. 1998 : 59, 101–106 87 Kawata, T., Miho, Y., Miyamoto, Y., “Guided Bone Regeneration to Repair an Alveolar Bone Defect in a irl Whose Cleft Lip and Palate had been Repaired’’, British Journal of Oral and Maxilofacial Surgery, Vol. 43, 2005, p. 420-422. Lachman L, Lieberman HA, Teori dan Praktek Farmasi Industri edisi 3 vol II. Diterjemahkan oleh Suyatmi S. Jakarta: UI Press; 1994. hal. 1092-5, 10338. Peppas NA. Hydrogel of PVA and its Copolymer. In : Hydrogel in Medicine and Pharmacy Vol. II. Bocaraton: CRC Press, Inc; 1987. hal. 1-36. Peppas N. Hydrogel in Medicine and Pharmacy. Vol I. CRC press. Inc; 1986.p.32. Piluharto, Bambang, ˝Kajian Sifat Fisik Tipis Film Tipis Nata de Coco sebagai Membran Ultrafiltrasi˝, Jurnal Ilmu Dasar, Volume 4 no. 1, Universitas Jember FMIPA, Januari 2003, hal 52-57. Retnoningtyas, E.S., et al., ˝Pengaruh Jenis Substrat pada Produksi Bacterial Cellulose oleh Acetobacter xylinum˝., Prosiding Seminar Nasional Teknik Kimia ˝Kejuangan˝, 2004. Slusarska SB, Presler S, Danielewicz D. Characteristics of Bacterial Cellulose Obtained from Acetobacter xylinum Culture for Application in Papermaking. Fibre & Textiles in Eastern Europe. 2008 : Vol. 16, No. 4 (69) pp. 108-111. Qinn, K.J. et al., ˝Principle of Burn Dressing˝, in Biomaterial, 6th ed., BATAN, Jakarta, 1985, hal. 369-377. Rosiak, J.M. and Yoshii, F., ˝Hydrogels and Their Medical Applications˝, Nuclear Instruments and Methods in Physics Research B 151, Lodz, 1999, hal 5664. Rostamailis. Penggunaan Kosmetik, Dasar Kecantikan dan Berbusana yang Serasi. Jakarta:Rineka Cipta; 2005. Hal. 16-9, 40-3. Sanchez, P.C., Yoshida, T., ˝Microbial Cellulose Production and Utilization˝., ASIAN Network on Microbial Researches, UGM, Yogya, 1998, hal. 115130. Siahaan, Parsaroan, Dwi Hidiyanti, dan Tri Windarti, Laporan penelitian ˝Profil spektra IR. NMR, dan BM bioselulosa nata de coco pada berbagai waktu polimerisasi˝, FMIPA UNDIP, Semarang, 2003. Soedirjo, Soetrisno T., ˝Selulosa Bakteri sebagai Alternatif Sumber Serat˝, Berita Selulosa vol.37 No.3, 1996, hal 20-25. 88 United States Pharmacopeia Convention. The United States Pharmacopeia 30-The National Formulary 25. Rockville: United States Pharmacopeia Convention Inc; 2007.p. 2971, 2994-5. Wade A, Weller PJ, editors. Handbook of pharmaceuticalexcipients. Second edition. London: The Pharmaceutical Press; 1994.p. 383-4, 392-9, 433-5. Wade A, Weller PJ, editors. Handbook of pharmaceuticalexcipients. Second edition. London: The Pharmaceutical Press; 1994. hal. 367-8. Wahyudi.. Memproduksi Nata de Coco. Direktorat Pendidikan Menengah Kejuruan Direktorat Jendral Pendidikan Dasar dan Menengah Departemen Pendidikan Nasional. 2003. Woods RJ, Pikaev AK. Apllied Radiation Chemistry : Radiation Proceeding. John Wiley dan Sons. 1994.p. 165-71. Yunasfi, dan Mirzan T. Razzak, ˝Aplikasi Kimia Radiasi dalam Industri˝, Akta Kimia vol. 3 No. 1, 1993, hal. 38-44. Xuequan L. Maolin Z., Jiuqiang L ang Hongfei H. Radiation preparation and thero-response swelling of interpenetrating polymer network hydrogel composed of PNIPAAm and PMMA, Radiation Physics and chemistry 2000; 57 (3-6):p.477-80. 89 90 90 Lampiran 1. Gambar bahan-bahan dan alat-alat penelitan Gambar 29. PVA Gambar 30. Air Kelapa Gambar 31. Biakan Acetobacter Xylinum Gambar 32. Ammonium Sulfat Gambar 33. Nata de coco Gambar 34. Asam Askorbat Gambar 35. Alat Mikrometer Gambar 36. Alat Pemotong Sampel (Dumbbel) Gambar 37. Alat Difusi Gambar 38. Alat Tensiometer Gambar 39. Stainles steel net 91 Lampiran 1. (lanjutan) Alur Penelitian Pembuatan membran selulosa bakter air kelapa Gula, ammonium sulfat, as.asetat Inkubasi biakan bakteri Pencucian H2O2 Nata de coco Pengepresan Foto SEM Selulosa Bakteri tanpa radiasi Autoklaf Laminar Air Flow Pencucian dengan NaOH Pencucian dengan air Pengeringan Suhu Kamar Membran Selulosa Bakteri 92 Foto SEM Selulosa Bakteri setelah radiasi dengan dosis 50 kGy 93 Lampiran 2. Hasil uji tebal membran selulosa bakteri Sampel/ulangan 1 2 3 4 5 6 7 8 9 10 Tebal rata-rata Standar deviasi (SD) Tebal (mm) Membran kering (selulosa Membran basah (selulosa bakteri – polivinil alkohol) bakteri – polivinil alkohol) sebelum diiradiasi sebelum diiradiasi 0,0200 0,100 0,0225 0,080 0,0330 0,090 0,0280 0,100 0,0240 0,100 0,0260 0,100 0,0225 0,080 0,0375 0,100 0,0290 0,090 0,0370 0,100 0,0279 0,094 0,006161935 0,00843274 Lampiran 3. Tabel hasil optimasi waktu perendaman membran selulosa bakteri dengan polivinil alkohol 2 %, 4 %, 6 % Kode nata / Ulangan PVA 2 %.1 PVA 2 % .2 PVA 2 %.3 Rata-rata SD PVA 4 %.1 PVA 4 %.2 PVA 4 %.3 Rata-rata SD PVA 6 %.1 PVA 6 %.2 PVA 6 %.3 Rata-rata SD 1 jam 2 jam 4 jam 24 jam 30 jam 54 jam Berat awal membran selulosa kering 0,0277 0,0571 0,0580 0,0648 0,0657 0,0707 0,0680 0,0301 0,0637 0,0623 0,0716 0,0764 0,0846 0,0773 0,0264 0,0574 0,0536 0,0620 0,0644 0,0814 0,0723 0,0281 0,0594 0,0580 0,0661 0,0688 0,0789 0,0725 0,001877054 0,003726929 0,004350096 0,004936936 0,006585084 0,007279423 0,004654389 0,0259 0,0551 0,0562 0,0656 0,0685 0,0749 0,0764 0,0275 0,0570 0,0618 0,0743 0,0846 0,0873 0,0788 0,0285 0,0618 0,0660 0,0774 0,0893 0,0982 0,0841 0,0273 0,0580 0,0613 0,0724 0,0808 0,0868 0,0798 0,001311488 0,003453018 0,004916638 0,006117461 0,010908254 0,011658044 0,003939966 0,0258 0,0542 0,0550 0,0634 0,0761 0,0868 0,0826 0,0276 0,0625 0,0582 0,0680 0,0773 0,0875 0,0819 0,0245 0,0559 0,0558 0,0601 0,0810 0,0889 0,0841 0,0260 0,0575 0,0563 0,0638 0,0781 0,0877 0,0829 0,001556706 0,004384442 0,001665333 0,003967787 0,002554082 0,001069268 0,001123981 94 % Absorpsi = x 100 % Perhitungan : Hasil absorpsi (%) polivinil alkohol 2 % dengan waktu perendaman 1 jam : = , , , x 100 = 106,1371 % Kode Nata 2-1 2-2 2-3 Rata-rata 4-1 4-2 4-3 Rata-rata 6-1 6-2 6-3 Rata-rata 1 jam 106,1371 % 116,6279 % 117,4242 % 113,3964 % 112,7413 % 107,7272 % 116,8421 % 112,4368 % 110,0775 % 126,4492 % 128,1632 % 121,5633 % 2 jam 109,3862 % 106,9767 % 103,0303 % 106,4644 % 116,9884 % 124,7272 % 131,5789 % 124,4315 % 113,1782 % 110,8695 % 127,7551 % 117,2676 % 4 jam 133,9350 % 137,8737 % 134,8484 % 135,5523 % 153,2818 % 170,1818 % 171,5789 % 165,0141 % 145,7364 % 146,3768 % 145,3061 % 145,8064 % 24 jam 137,1841 % 153,8205 % 143,9393 % 144,9813 % 164,4787 % 207,6363 % 213,3333 % 195,1494 % 194,9612 % 180,0724 % 230,6122 % 201,8819 % 30 jam 150,2346 % 181,0631 % 208,3333 % 179,877 % 189,1891 % 217,4545 % 244,5614 % 217,0683 % 236,4341 % 217,0289 % 262,8571 % 238,7733 % 54 jam 145,4873 % 156,8106 % 173,8636 % 158,7205 % 194,9806 % 186,5454 % 195,0877 % 192,2045 % 220,1550 % 196,7391 % 243,2653 % 220,0531 % 95 Lampiran 4. Hasil uji elongasi membran (selulosa bakteri + polivinil alkohol 2 %) tanpa diiradiasi Ulangan Lo (cm) La (cm) 1 1 1,3 2 1 1,2 3 1 1,2 Perpanjangan putus rata-rata SD E (%) 30 % 20 % 20 % 23,333 % 0,057735027 Lampiran 5. Hasil uji elongasi membran (selulosa bakteri + polivinil alkohol 4 %) tanpa diiradiasi Ulangan Lo (cm) La (cm) 1 1 1,2 2 1 1,3 3 1 1,3 Perpanjangan putus rata-rata SD E (%) 20 % 30 % 30 % 26,666 % 0,057735027 Lampiran 6. Hasil uji elongasi membran (selulosa bakteri + polivinil alkohol 6 %) tanpa diiradiasi Ulangan Lo (cm) La (cm) 1 1 1,5 2 1 1,5 3 1 1,3 Perpanjangan putus rata-rata SD E (%) 50 % 50 % 30 % 43,333 % 0,115470054 Lampiran 7. Hasil uji elongasi hidrogel (selulosa bakteri + polivinil alkohol 2 %) setelah diiradiasi Ulangan Lo (cm) La (cm) 1 1 1,5 2 1 1,4 3 1 1,5 Perpanjangan putus rata-rata SD E (%) 50 % 40 % 50 % 46,666 % 0,057735027 96 Lampiran 8. Hasil uji elongasi hidrogel (selulosa bakteri + polivinil alkohol 4 %) setelah diiradiasi Ulangan Lo (cm) La (cm) 1 1 1,5 2 1 1,5 3 1 1,8 Perpanjangan putus rata-rata SD E (%) 50 % 50 % 80 % 60 % 0,173205081 Lampiran 9. Hasil uji elongasi hidrogel (selulosa bakteri + polivinil alkohol 6 %) setelah diiradiasi Ulangan Lo (cm) La (cm) 1 1 2,0 2 1 1,8 3 1 1,8 Perpanjangan putus rata-rata SD E (%) 100 % 80 % 80 % 86,666 % 0,115470054 Lampiran 10. Hasil uji kekuatan tarik membran (selulosa bakteri + polivinil alkohol 2 %) tanpa iradiasi Ulangan Tebal (cm) Lebar (cm) 1 3x10-3 0,3 2 4x10-3 0,3 3 3x10-3 0,3 Kekuatan tarik rata-rata Mpa (Mega Paskal) SD F (Kg) 1,0 1,1 0,92 r (Kg/cm2) 1111,111 916,666 1022,222 1016,666 101,666 97,36941683 Lampiran 11. Hasil uji kekuatan tarik membran (selulosa bakteri + polivinil alkohol 4 %) tanpa iradiasi Ulangan Tebal (cm) Lebar (cm) 1 3x10-3 0,3 -3 2 4x10 0,3 3 3x10-3 0,3 Kekuatan tarik rata-rata Mpa SD F (Kg) 0,90 1,0 1,2 r (Kg/cm2) 1000 833,333 1333,333 1055,555 105,555 254,5839023 97 Lampiran 12. Hasil uji kekuatan tarik membran (selulosa bakteri + polivinil alkohol 6 %) tanpa iradiasi Ulangan Tebal (cm) Lebar (cm) 1 3x10-3 0,3 -3 2 4x10 0,3 3 3x10-3 0,3 Kekuatan tarik rata-rata Mpa SD F (Kg) 1,0 1,2 1,0 r (Kg/cm2) 1111,111 1000 1111,111 1074,074 107,407 64,14361491 Lampiran 13. Hasil uji kekuatan tarik hidrogel (selulosa bakteri + polivinil alkohol 2 %) setelah diiradiasi Ulangan 1 2 3 Tebal (cm) Lebar (cm) 3x10-3 0,3 4x10-3 0,3 -3 3x10 0,3 Kekuatan tarik rata-rata Mpa SD F (Kg) 1,0 1,1 0,95 R (Kg/cm2) 1111,111 916,666 1055,555 1027,777 102,777 100,1788567 Lampiran 14. Hasil uji kekuatan tarik hidrogel (selulosa bakteri + polivinil alkohol 4 %) setelah diiradiasi Ulangan Tebal (cm) Lebar (cm) 1 3x10-3 0,3 -3 2 4x10 0,3 3 3x10-3 0,3 Kekuatan tarik rata-rata Mpa SD F (Kg) 1,2 1,2 0,90 R (Kg/cm2) 1333,333 1000 1000 1111,111 111,111 192,4308447 Lampiran 15. Hasil uji kekuatan tarik hidrogel (selulosa bakteri + polivinil alkohol 6 %) setelah diiradiasi Ulangan Tebal (cm) 1 2 3 Lebar (cm) 3x10-3 0,3 -3 4x10 0,3 3x10-3 0,3 Kekuatan tarik rata-rata Mpa SD F (Kg) R (Kg/cm2) 1,1 1,2 1,1 1222,222 1000 1222,222 1148,148 114,814 128,2872298 98 Lampiran 16. Hasil uji elongasi hidrogel (selulosa bakteri + polivinil alkohol 2 % + Vit. C) tanpa diiradiasi Ulangan Lo (cm) La (cm) 1 1 1,4 2 1 1,3 3 1 1,3 Perpanjangan putus rata-rata SD E (%) 40 % 30 % 30 % 33,333 % 0,057735027 Lampiran 17. Hasil uji elongasi hidrogel (selulosa bakteri + polivinil alkohol 4 % + Vit. C) tanpa diiradiasi Ulangan Lo (cm) La (cm) 1 1 1,5 2 1 1,5 3 1 1,5 Perpanjangan putus rata-rata SD E (%) 50 % 50 % 40 % 46,666 % 0,057735027 Lampiran 18. Hasil uji elongasi hidrogel (selulosa bakteri + polivinil alkohol 6 % + Vit. C) tanpa diiradiasi Ulangan Lo (cm) La (cm) 1 1 1,5 2 1 1,5 3 1 1,5 Perpanjangan putus rata-rata SD E (%) 60 % 60 % 60 % 60 % 0 Lampiran 19. Hasil uji elongasi membran (selulosa bakteri + polivinil alkohol 2 % + Vit. C) setelah diradiasi Ulangan Lo (cm) La (cm) 1 1 1,5 2 1 1,5 3 1 1,8 Perpanjangan putus rata-rata SD E (%) 50 % 50 % 80 % 60 % 0,173205081 99 Lampiran 20. Hasil uji elongasi membran (selulosa bakteri + polivinil alkohol 4 % + Vit. C) setelah diiradiasi Ulangan Lo (cm) La (cm) 1 1 1,5 2 1 1,5 3 1 1,6 Perpanjangan putus rata-rata SD E (%) 60 % 80 % 50 % 63,333 % 0,152752523 Lampiran 21. Hasil uji elongasi membran (selulosa bakteri + polivinil alkohol 6 % + Vit. C) setelah diiradiasi Ulangan Lo (cm) La (cm) 1 1 1,8 2 1 1,8 3 1 2,0 Perpanjangan putus rata-rata SD E (%) 80 % 80 % 100 % 86,666 % 0,115470054 Lampiran 22. Hasil uji kekuatan tarik hidrogel (selulosa bakteri + polivinil alkohol 2 % + Vit. C) tanpa diiradiasi Ulangan Tebal (cm) Lebar (cm) 1 3x10-3 0,3 -3 2 3x10 0,3 3 4x10-3 0,3 Kekuatan tarik rata-rata Mpa SD F (Kg) 0,97 0,95 0,99 R (Kg/cm2) 1077,777 1055,555 825 986,110 98,601 139,9287795 Lampiran 23. Hasil uji kekuatan tarik hidrogel (selulosa bakteri + polivinil alkohol 4 % + Vit. C) tanpa diiradiasi Ulangan Tebal (cm) Lebar (cm) 1 3x10-3 0,3 -3 2 4x10 0,3 3 3x10-3 0,3 Kekuatan tarik rata-rata Mpa SD F (Kg) 1,2 1,1 0,90 R (Kg/cm2) 1333,333 916,666 1000 1083,333 108,333 220,4855778 100 Lampiran 24. Hasil uji kekuatan tarik hidrogel (selulosa bakteri + polivinil alkohol 6% + Vit. C) tanpa diiradiasi Ulangan Tebal (cm) Lebar (cm) 1 3x10-3 0,3 -3 2 4x10 0,3 3 3x10-3 0,3 Kekuatan tarik rata-rata Mpa SD F (Kg) 1,1 1,2 1,0 R (Kg/cm2) 1222,222 1000 1111,111 1111,111 111,11 111,1 Lampiran 25. Hasil uji kekuatan tarik membran (selulosa bakteri + polivinil alkohol 2 % + Vit. C) setelah iradiasi Ulangan Tebal (cm) Lebar (cm) F (Kg) -3 1 3x10 0,3 1,1 2 3x10-3 0,3 0,95 3 4x10-3 0,3 1,0 Kekuatan tarik rata-rata Mpa SD r (Kg/cm2) 1222,222 1055,555 833,333 1037,036 103,703 195,1089183 Lampiran 26. Hasil uji kekuatan tarik membran (selulosa bakteri + polivinil alkohol 4 % + Vit. C) setelah iradiasi Ulangan Tebal (cm) Lebar (cm) 1 3x10-3 0,3 -3 2 4x10 0,3 3 3x10-3 0,3 Kekuatan tarik rata-rata Mpa SD F (Kg) 1,2 1,0 1,1 r (Kg/cm2) 1333,333 833,333 1222,222 1129,629 112,962 262,5472719 Lampiran 27. Hasil uji kekuatan tarik membran (selulosa bakteri + polivinil alkohol 6 % + Vit. C) setelah iradiasi Ulangan Tebal (cm) Lebar (cm) 1 3x10-3 0,3 2 4x10-3 0,3 -3 3 3x10 0,3 Kekuatan tarik rata-rata Mpa SD F (Kg) 0,97 1,2 1,2 r (Kg/cm2) 1077,777 1000 1333,333 1137,036 113,703 174,3834568 101 Lampiran 28. Hasil uji gel fraksi hidrogel (selulosa bakteri – polivinil alkohol 2 %, 4 %, dan 6 % yang diiradiasi) Kode nata 2.1 2.2 2.3 Rata-rata SD 4.1 4.2 4.3 Rata-rata SD 6.1 6.2 6.3 Rata-rata SD Berat kassa Kassa + gel Kassa + gel Gel basah Gel kering basah kering 4,9877 5,3421 5,3011 0,3544 0,3134 5,4143 5,6938 5,6101 0,2795 0,1958 5,1533 5,4257 5,3065 0,2724 0,1532 5,1851 5,4872 5,4059 0,3021 0,2208 0,2150705 0,1837387 0,176862998 0,045432037 0,082974454 4,5778 6,4162 6,2411 1,8384 1,6633 5,3906 6,5716 6,4400 1,181 1,0494 5,1897 6,2067 6,1011 1,017 0,9114 5,0527 6,3982 6,2607 1,3454 1,2080 0,423364748 0,183117185 0,17030092 0,434696967 0,400264667 5,4411 6,7846 6,5012 1,3435 1,0601 5,0522 6,6983 6,5011 1,6461 1,4489 5,2475 6,8743 6,6162 1,6268 1,3687 5,2470 6,7858 6,5395 1,5388 1,2926 0,194450619 0,088005473 0,066424167 0,169409829 0,205276821 Fraksi gel (%) 61,435 % 52 % 68,862 % 60,432% 8,973 78,193 % 70,548 % 69,753 % 72,833 % 4,660 86,301 % 80,161 % 96,917 % 87,793 % 8,477 Lampiran 29. Hasil uji gel fraksi hidrogel (selulosa bakteri- polivinil alkohol 2%, 4%, dan 6% + vit C yang diiradiasi) Kode nata 2.1 2.2 2.3 Rata-rata SD 4.1 4.2 4.3 Rata-rata SD 6.1 6.2 6.3 Rata-rata SD Berat kassa Kassa + gel Kassa + gel Gel basah Gel kering basah kering 3,3308 4,1605 3,9800 0,8297 0,6492 3,6184 3,7643 3,7211 0,1459 0,1027 3,4178 3,5802 3,5312 0,1624 0,1134 3,4557 3,835 3,7441 0,3793 0,2884 0,147491875 0,296539862 0,22528229 0,390116218 0,312478901 2,8747 3,0975 3,0110 0,2228 0,1363 2,8381 3,0385 2,9400 0,2004 0,1019 2,5947 2,7616 2,7100 0,1669 0,1153 2,7692 2,9659 2,887 0,1967 0,1178 0,152196759 0,179342977 0,157343573 0,028133077 0,017339358 2,8685 3,7315 3,5611 0,863 0,6926 3,0040 3,7503 3,6016 0,7463 0,5976 3,1120 4,4412 4,4010 1,3292 1,289 2,9949 3,9743 3,8546 0,9795 0,8598 0,122008538 0,404427649 0,473658214 0,308419017 0,374778139 Fraksi gel (%) 88,418 % 70 % 56,25 % 71,724 % 16,119 78,869 % 88,032 % 84,143 % 83,663 % 4,577 90,479 % 88,908 % 89,577 % 89,655 % 0,788 102 106 Lampiran 33. Hasil Statistik Elongasi PVA dan PVA +Vit C Sebelum dan Sesudah Radiasi 1. Uji Normalitas Kolmogorof-Smirnov dan Uji Homogenitas Levene Terhadap Data elongasi PVA dan PVA+vit C tiap konsentrasi sebelum dan sesudah radiasi a. Uji Normalitas Kolmogorof-Smirnov Tujuan : untuk mengetahui kenormalan data sebagai syarat uji ANOVA Hipotesis Ho : Data elongasi PVA dan PVA+vit C tiap konsentrasi sebelum dan sesudah radiasi yang terdistribusi normal Ha : Data elongasi PVA dan PVA+vit C tiap konsentrasi sebelum dan sesudah radiasi yang tidak terdistribusi normal Pengambilan keputusan Jika nilai signifikansi ≥ 0,05 maka Ho diterima Jika nilai signifikansi ≤ 0,05 maka Ho ditolak One-Sample Kolmogorov-Smirnov Test Elongasi pva – Elongasi pva – Vit C sebelum Vit C sesudah N Normal Parametersa,,b Mean Std. Deviation Most Extreme Differences Absolute Positive Negative Kolmogorov-Smirnov Z Asymp. Sig. (2-tailed) a. Test distribution is Normal. b. Calculated from data. Keputusan : 9 46.6667 12.24745 .195 .151 -.195 .586 .883 9 70.0000 18.02776 .266 .200 -.266 .798 .547 Elongasi pva sebelum 9 31.1111 11.66667 .316 .316 -.170 .947 .331 Elongasi pva sesudah 9 64.4444 20.68279 .313 .313 -.218 .939 .341 Ho diterima artinya uji normalitas Data elongasi PVA dan PVA+vit C tiap konsentrasi sebelum dan sesudah radiasi uji terdistribusi normal Kesimpulan : Hasil data signifikansi lebih besar dari 0,05. Hal ini menunjukkan distribusi data normal. 107 a. Uji Homogenitas Levene Tujuan : Untuk melihat data elongasi PVA dan PVA+vit C tiap konsentrasi sebelum dan sesudah radiasi homogen atau tidak Hipotesis Ho : Data elongasi PVA dan PVA+vit C tiap konsentrasi sebelum dan sesudah radiasi bervariasi homogen Ha : Data elongasi PVA dan PVA+vit C tiap konsentrasi sebelum dan sesudah radiasi bervariasi tidak homogen Pengambilan keputusan Jika nilai signifikansi ≥ 0,05 maka Ho doiterima Jika nilai signifikansi ≤ 0,05 maka Ho ditolak 108 Descriptives N Elongasi 2% Pva – Vit 4% C sebelum 6% Total Elongasi 2% Pva – Vit C sesudah 4% 6% Total Elongasi Pva sebelum 2% 4% 6% Total Elongasi Pva sesudah 2% 4% 6% Total Mean Std. Deviati on 95% Confidence Interval for Mean Std. Error Lower Bound Upper Bound Minimum Maximum 3 33.3333 5.77350 3.33333 18.9912 47.6755 30.00 40.00 3 46.6667 5.77350 3.33333 32.3245 61.0088 40.00 50.00 3 60.0000 .00000 .00000 60.0000 60.0000 60.00 60.00 9 46.6667 12.2474 5 3 60.0000 17.3205 1 3 63.3333 15.2752 5 3 86.6667 11.5470 1 9 70.0000 18.0277 6 3 23.3333 5.77350 3 26.6667 5.77350 3 43.3333 11.5470 1 9 31.1111 11.6666 7 3 46.6667 5.77350 3 60.0000 17.3205 1 3 86.6667 11.5470 1 9 64.4444 20.6827 9 4.08248 37.2524 56.0809 30.00 60.00 10.0000 0 8.81917 16.9735 103.0265 50.00 80.00 25.3875 101.2792 50.00 80.00 6.66667 57.9823 115.3510 80.00 100.00 6.00925 56.1426 83.8574 50.00 100.00 3.33333 3.33333 6.66667 8.9912 12.3245 14.6490 37.6755 41.0088 72.0177 20.00 20.00 30.00 30.00 30.00 50.00 3.88889 22.1433 40.0789 20.00 50.00 3.33333 10.0000 0 6.66667 32.3245 16.9735 61.0088 103.0265 40.00 50.00 50.00 80.00 57.9823 115.3510 80.00 100.00 6.89426 48.5462 80.3426 40.00 100.00 114 Lampiran 34. Hasil Statistik Daya Tarik PVA dan PVA +Vit C Sebelum dan Sesudah Radiasi 1. Uji Normalitas Kolmogorof-Smirnov dan Uji Homogenitas Levene Terhadap Daya Tarik PVA dan PVA +Vit C Tiap Konsentrasi Sebelum dan Sesudah Radiasi a. Uji Normalitas Kolmogorof-Smirnov Tujuan : untuk mengetahui kenormalan data sebagai syarat uji ANOVA Hipotesis Ho : Data daya tarik PVA dan PVA +Vit C tiap konsentrasi sebelum dan sesudah radiasi yang terdistribusi normal Ha : Data daya tarik PVA dan PVA +Vit C tiap konsentrasi sebelum dan sesudah radiasi yang tidak terdistribusi normal Pengambilan keputusan Jika nilai signifikansi ≥ 0,05 maka Ho diterima Jika nilai signifikansi ≤ 0,05 maka Ho ditolak One-Sample Kolmogorov-Smirnov Test Kekuatan tarik pva – Vit C sebelum N Normal Parametersa,,b Most Extreme Differences Mean Std. Deviation Absolute Positive Negative Kolmogorov-Smirnov Z Asymp. Sig. (2-tailed) 9 1060.1849 152.86610 .147 .147 -.125 .442 .990 Kekuatan tarik pva Kekuatan tarik – Vit C sesudah pva sebelum 9 1101.2334 191.52135 .181 .141 -.181 .542 .931 Kekuatan tarik pva sesudah 9 1048.7640 142.28507 .220 .220 -.144 .659 .779 Keputusan : Ho diterima artinya uji daya tarik PVA dan PVA +Vit C tiap konsentrasi sebelum dan sesudah radiasi terdistribusi normal Kesimpulan : Hasil data signifikansi lebih besar dari 0,05. Hal ini menunjukkan distribusi data normal. a. Uji Homogenitas Levene Tujuan : Untuk melihat daya tarik PVA dan PVA +Vit C tiap konsentrasi sebelum dan sesudah radiasi homogen atau tidak Hipotesis Ho : Data daya tarik PVA dan PVA +Vit C tiap konsentrasi sebelum dan sesudah radiasi bervariasi homogen Ha : Data daya tarik PVA dan PVA +Vit C tiap konsentrasi sebelum dan sesudah radiasi bervariasi tidak homogen 9 1095.6789 136.86790 .202 .202 -.156 .607 .855 115 Pengambilan keputusan Jika nilai signifikansi ≥ 0,05 maka Ho doiterima Jika nilai signifikansi ≤ 0,05 maka Ho ditolak 116 Descriptives 95% Confidence Interval for Mean N Kekuatan tarik pva – Vit C sebelum Kekuatan tarik pva – Vit C sesudah Kekuatan tarik pva sebelum Kekuatan tarik pva sesudh Mean Std. Deviation Std. Error Lower Bound Upper Bound Minimum Maximum 2% 3 986.1107 139.96764 80.81035 638.4118 1333.8096 825.00 1077.78 4% 3 1083.3330 220.47934 127.29381 535.6320 1631.0340 916.67 1333.33 6% 3 1111.1110 111.11100 64.14997 835.0960 1387.1260 1000.00 1222.22 Total 9 1060.1849 152.86610 50.95537 942.6816 1177.6882 825.00 1333.33 2% 3 1037.0367 195.10474 112.64377 552.3696 1521.7037 833.33 1222.22 4% 3 1129.6293 262.54533 151.58062 477.4306 1781.8281 833.33 1333.33 6% 3 1137.0343 174.39013 100.68419 703.8252 1570.2434 1000.00 1333.33 Total 9 1101.2334 191.52135 63.84045 954.0171 1248.4498 833.33 1333.33 2% 3 1016.6663 97.34148 56.20013 774.8567 1258.4760 916.67 1111.11 4% 3 1055.5553 254.58750 146.98616 423.1249 1687.9857 833.33 1333.33 6% 3 1074.0703 64.14679 37.03517 914.7209 1233.4198 1000.00 1111.11 Total 9 1048.7640 142.28507 47.42836 939.3940 1158.1340 833.33 1333.33 2% 3 1027.7777 100.15419 57.82405 778.9809 1276.5745 916.67 1111.11 4% 3 1111.1110 192.44990 111.11100 633.0390 1589.1830 1000.00 1333.33 6% 3 1148.1480 128.29993 74.07400 829.4333 1466.8627 1000.00 1222.22 Total 9 1095.6789 136.86790 45.62263 990.4729 1200.8849 916.67 1333.33 Test of Homogeneity of Variances Levene Statistic Kekuatan tarik pva – Vit C sebelum Kekuatan tarik pva - Vit C sesudah Kekuatan Tarik pva sebelum Kekuatan Tarik pva sesudah 1.483 .486 2.956 1.653 df1 df2 2 2 2 2 Sig. 6 6 6 6 .300 .637 .128 .268 Keputusan : Uji homogenitas daya tarik PVA dan PVA +Vit C tiap konsentrasi sebelum dan sesudah radiasi bervariasi homogen Kesimpulan : Data signifikansi lebih besar dari 0,05. Hal ini menunjukkan data bervariasi homogen. b. Uji Anava Satu Arah dan BNT (Beda Nyata Terkecil) terhadap data daya tarik PVA dan PVA +Vit C tiap konsentrasi sebelum dan sesudah radiasi Tujuan : Untuk melihat ada atau tidaknya perbedaan daya tarik PVA dan PVA +Vit C tiap konsentrasi sebelum dan sesudah radiasi 117 Hipotesis Ho : Data daya tarik PVA dan PVA +Vit C tiap konsentrasi sebelum dan sesudah radiasi tidak berbeda secara bermakna Ha : Data daya tarik PVA dan PVA +Vit C tiap konsentrasi sebelum dan sesudah radiasi berbeda secara bermakna Pengambilan Keputusan Jika nilai signifikansi ≥ 0,05 maka Ho diterima Jika nilai signifikansi ≤ 0,05 maka Ho ditolak ANOVA Sum of Squares Kekuatan tarik pva – Vit C sebelum Kekuatan tarik pva – Vit C sesudah Kekuatan tarik pva sebelum Kekuatan tarik pva sesudah Between Groups df Mean Square 25848.883 2 12924.441 Within Groups 161095.465 6 26849.244 Total 186944.348 8 18627.769 2 9313.885 Within Groups 274815.659 6 45802.610 Total 293443.429 8 5150.379 2 2575.189 Within Groups 156809.941 6 26134.990 Total 161960.320 8 22805.187 2 11402.594 Within Groups 127057.392 6 21176.232 Total 149862.580 8 Between Groups Between Groups Between Groups F Sig. .481 .640 .203 .821 .099 .908 .538 .609 Kesimpulan : Data daya tarik PVA dan PVA +Vit C tiap konsentrasi sebelum dan sesudah radiasi memiliki signifikansi (ρ ≥ 0,05) berarti Ho diterima atau data daya tarik PVA dan PVA +Vit C tiap konsentrasi sebelum dan sesudah radiasi tidak berbeda secara bermakna maka tidak perlu dilanjutkan dengan uji BNT menggunakan metode LSD. 118 Lampiran 35. Hasil Statistik Uji Fraksi Gel 1. Uji Normalitas Kolmogorof-Smirnov dan Uji Homogenitas Levene Terhadap Fraksi Gel Pada Tiap Konsentrasi a. Uji Normalitas Kolmogorof-Smirnov Tujuan : untuk mengetahui kenormalan data sebagai syarat uji ANOVA Hipotesis Ho : Data fraksi gel tiap konsentrasi yang terdistribusi normal Ha : Data fraksi gel tiap terdistribusi normal konsentrasi yang tidak Pengambilan keputusan Jika nilai signifikansi ≥ 0,05 maka Ho diterima Jika nilai signifikansi ≤ 0,05 maka Ho ditolak One-Sample Kolmogorov-Smirnov Test Pva N Normal Parametersa,,b Mean Std. Deviation Most Extreme Absolute Differences Positive Negative Kolmogorov-Smirnov Z Asymp. Sig. (2-tailed) a. Test distribution is Normal. b. Calculated from data. Keputusan : Pva Vitc - 9 9 73.6867 81.6311 13.57512 11.59152 .147 .147 -.139 .441 .990 .265 .223 -.265 .795 .552 Ho diterima artinya uji normalitas fraksi gel tiap konsentrasi uji terdistribusi normal Kesimpulan : Hasil data signifikansi lebih besar dari 0,05. Hal ini menunjukkan distribusi data normal. 119 b. Uji Homogenitas Levene Tujuan : Untuk melihat data fraksi gel tiap konsentrasi homogen atau tidak Hipotesis Ho : Data fraksi gel tiap konsentrasi bervariasi homogen Ha : Data fraksi gel tiap konsentrasi bervariasi tidak homogen Descriptives 95% Confidence Interval for Mean N Mean pva Std. Deviation Std. Error Lower Bound Upper Bound Minimu Maximu m m 2% 3 60.4367 8.97715 5.18296 38.1362 82.7371 51.00 68.87 4% 3 72.8300 4.65910 2.68993 61.2562 84.4038 69.75 78.19 6% 3 87.7933 8.47921 4.89547 66.7298 108.8568 80.16 96.92 9 73.6867 13.57512 4.52504 63.2519 84.1214 51.00 96.92 3 3 3 9 9.31924 2.65425 .45484 3.86384 111.6541 95.1003 91.6137 90.5411 56.25 78.87 88.91 56.25 88.42 88.03 90.48 90.48 Tota l Pva – 2% Vit c 4% 6% Tota l 71.5567 83.6800 89.6567 81.6311 16.14140 4.59729 .78780 11.59152 31.4592 72.2597 87.6997 72.7211 Pengambilan keputusan Jika nilai signifikansi ≥ 0,05 maka Ho doiterima jika nilai signifikansi ≤ 0,05 maka Ho ditolak 120 Test of Homogeneity of Variances Levene pva Statistic df1 df2 Sig. .513 2 6 .623 2 6 .093 pvaVitc 3.630 Keputusan : Uji homogenitas gel bervariasi homogen fraksi tiap konsentrasi Kesimpulan: Data signifikansi lebih besar dari 0,05. Hal ini menunjukkan data bervariasi homogen. c. Uji Anava Satu Arah dan BNT (Beda Nyata Terkecil) Terhadap Fraksi Gel Tiap Konsentrasi Tujuan : Untuk melihat ada atau tidaknya perbedaan data fraksi tiap konsentrasi Hipotesis Ho : Data fraksi gel tiap konsentrasi berbeda secara bermakna Ha : Data fraksi gel tiap konsentrasi berbeda secara bermakna Pengambilan Keputusan Jika nilai signifikansi ≥ 0,05 maka Ho diterima Jika nilai signifikansi ≤ 0,05 maka Ho ditolak ANOVA pva Pva - Vitc Sum of Squares Df Mean Square F Sig. Between Groups 1125.883 2 562.942 9.695 .013 Within Groups 348.387 6 58.064 Total Between Groups Within Groups Total 1474.270 510.306 564.601 1074.906 8 2 6 8 255.153 94.100 2.712 .145 121 Kesimpulan: Data fraksi gel PVA tiap konsentrasi memiliki signifikansi (ρ ≤ 0,05) berarti Ho ditolak dan Ha diterima atau data fraksi gel PVA tiap konsentrasi berbeda secara bermakna maka dilanjutkan dengan uji BNT menggunakan metode LSD, kecuali data fraksi PV+ vit C tiap konsentrasi tidak berbeda secara bermakna ρ ≥ 0,05 (ρ = 0,145). Uji BNT merupakan uji lanjutan yang dilakukan apabila hasil pengujian menunjukkan adanya perbedaan secara bermakna. Tujuannya adalah untuk menentukan kelompok mana yang memberikan nilai yang berbeda secara bermakna dengan kelompok lainnya. LSD Depend (I) (J) ent konsen konsen Mean Variable trasi trasi (I-J) Pva 2% 4% 6% 4% 95% Confidence Interval Difference Std. Error -12.39333 * Sig. Upper Lower Bound Bound 6.22171 .093 -27.6173 2.8306 6.22171 .005 -42.5806 -12.1327 6.22171 .093 -2.8306 27.6173 6% -27.35667 2% 12.39333 6% -14.96333 6.22171 .053 -30.1873 .2606 2% * 6.22171 .005 12.1327 42.5806 -.2606 -31.5040 -37.4806 -7.2573 -25.3573 -1.2806 -13.4040 30.1873 7.2573 1.2806 31.5040 13.4040 37.4806 25.3573 27.35667 4% 14.96333 6.22171 Pva - 2% 4% -12.12333 7.92044 Vitc 6% -18.10000 7.92044 4% 2% 12.12333 7.92044 6% -5.97667 7.92044 6% 2% 18.10000 7.92044 4% 5.97667 7.92044 *. The mean difference is significant at the 0.05 level. .053 .177 .062 .177 .479 .062 .479 122 Kesimpulan: 1. Data fraksi gel PVA pada konsentrasi 2% berbeda secara bermakna dengan fraksi gel PVA konsentrfasi 4% dilihar dari signifikansinya ≤ 0,05 tetapi tidak berbeda secara bermakna dengan fraksi gel PVA dengan konsentrasi 6% dilihat dari nilai signifikansinya ≥ 0,05. 2. Data fraksi gel PVA pada konsentrasi 4% tidak berbeda secara bermakna dengan fraksi gel PVA konsentrfasi 2% dan 6% dilihar dari signifikansinya ≥ 0,05. 3. Data fraksi gel PVA pada konsentrasi 6% berbeda secara bermakna dengan fraksi gel PVA konsentrfasi 2% dilihar dari signifikansinya ≤ 0,05 tetapi tidak berbeda secara bermakna dengan fraksi gel PVA dengan konsentrasi 4% dilihat dari nilai signifikansinya ≥ 0,05. 4. Data fraksi gel PVA pada konsentrasi 2% tidak berbeda secara bermakna dengan fraksi gel PVA konsentrfasi 4% dan 6% dilihar dari signifikansinya ≥ 0,05. Lampiran 30 Date: 1/1/2003 Time: 0:06:05 AM 1.50 1.4 1.3 1.2 1.1 1.0 0.9 0.8 A 265,0 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0.00 200.0 230 240 250 260 270 260 270 280 nm Description: Panjang gelombang maksimum vitamin c 10 ppm Spectrum Name: C:\UVWINLAB\DATA\VITAMIN C Date Created: Wed Jan 01 01:11:45 2003 Instrument Model: Lambda 25 Data Interval: 1.0000 nm Slit Width: 1.0000 nm Peak List Spectrum: vitamin c Comment: Panjang gelombang maksimum vitamin c 10 ppm Threshold: 0.1000 Abscissa units: nm Ordinate units: A No. Abscissa Ordinate Type ------------------------------------1 395.10 4.4792 Peak 2 363.07 5.4087 Peak 3 265.00 0.6907 Peak 1 389.88 -1.9912 Base 2 363.50 5.1650 Base 3 364.94 0.2505 Base 4 203.02 0.4284 Base 290 300 310.0 CALIBRATION ___________ Date: 12/8/2010 Time: 1:19:21 AM Instrument: PerkinElmer Lambda 25 Serial No: 101N4022502 Method:vitamin c Ordinate mode: Single wavelength Baseline: No correction ( 0.00 0.00 ) Analyst: pipit ___________________________________________________________________________ Wavelength(s) Sample ID Concentration Ord. value Comment ___________________________________________________________________________ 265.0 0.0 vitamin c 01 0.0000 ppm 0.0000 vitamin c 265.0 0.0 vitamin c 02 1.0000 ppm 0.1541 vitamin c 265.0 0.0 vitamin c 03 5.0000 ppm 0.3216 vitamin c 265.0 0.0 vitamin c 04 10.0000 ppm 0.5201 vitamin c 265.0 0.0 vitamin c 05 15.0000 ppm 0.7211 vitamin c 265.0 0.0 vitamin c 06 20.0000 ppm 0.9211 vitamin c ___________________________________________________________________________ Equation: y =0.116859965+0,04026863 Residual error: 0.004291 Correlation coefficient: 0.999970149 Lampiran 31 Date: 12/8/2010 Time: 0:06:05 AM 1.40 1.3 1.2 1.1 1.0 0.9 0.8 A 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0.00 0.0 5 10 15 20 Description: y = 0.06936307+0.02676919 Spectrum Name: vitamin c Date Created: Wed Jan 01 01:26:59 2003 25 ppm Lampiran 32 Tanggal 18 Agustus 2010 2% vitamin c 5'.Sample (A) 2% vitamin c 10'.Sample (A) 2% vitamin c 15'.Sample (A) 2% vitamin c 20'.Sample (A) 2% vitamin c 30'.Sample (A) 2% vitamin c 40'.Sample (A) 2% vitamin c 50'.Sample (A) 2% vitamin c 60'.Sample (A) 4% vitamin c 5'.Sample (A) 4% vitamin c 10'.Sample (A) 4% vitamin c 15'.Sample (A) 4% vitamin c 20'.Sample (A) 4% vitamin c 30'.Sample (A) 4% vitamin c 40'.Sample (A) 4% vitamin c 50'.Sample (A) 4% vitamin c 60'.Sample (A) 6% vitamin c 5'.Sample (A) 6% vitamin c 10'.Sample (A) 6% vitamin c 15'.Sample (A) 6% vitamin c 20'.Sample (A) 6% vitamin c 30'.Sample (A) 6% vitamin c 40'.Sample (A) 6% vitamin c 50'.Sample (A) 6% vitamin c 60'.Sample (A) 265.0 nm 0.0630 0,1421 0,2276 0,2680 0,3921 0,4567 0,4890 0,6071 0.1251 0,2413 0,4211 0,4819 0,5812 0,6577 0,7980 0,8791 0.1830 0,3437 0,5722 0,6210 0,7161 0,8121 0,9231 0,9948 Date: 1/1/2003 Time: 0:06:05 AM 1.50 1.4 1.3 1.2 1.1 1.0 0.9 0.8 265,0 A 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0.00 200.0 230 240 250 260 270 260 270 280 nm Description: Panjang gelombang maksimum vitamin c 10 ppm Spectrum Name: C:\UVWINLAB\DATA\VITAMIN C Date Created: Wed Jan 01 01:11:45 2003 Instrument Model: Lambda 25 Data Interval: 1.0000 nm Slit Width: 1.0000 nm Peak List Spectrum: vitamin c Comment: Panjang gelombang maksimum vitamin c 10 ppm Threshold: 0.1000 Abscissa units: nm Ordinate units: A No. Abscissa Ordinate Type ------------------------------------1 395.10 4.4792 Peak 2 363.07 5.4087 Peak 3 265.00 0.6907 Peak 1 389.88 -1.9912 Base 2 363.50 5.1650 Base 3 364.94 0.2505 Base 4 203.02 0.4284 Base 290 300 310.0