Hand-out Kuliah KIMIA ORGANIK
advertisement

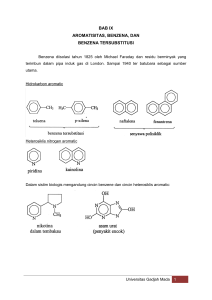
Guntur Nurcahyanto, ST., M.Pd. Fessenden, RJ And Fessenden JS.1997: Kimia Organik Alih Bahasa AH Pujaatmaja Jilid 1,Edisi Ketiga. Jakarta : Erlangga. Sabirin, Matsjeh 1997 : Kimia Organik 1. Yogyakarta : FMIPA- UGM Solomon, 2000: Organic Chemstry 6th Edition,New York:Wiley And Sons Benzene dan Turunannya Tatanama Benzene Sifat-sifat Benzene Reaksi Subtitusi Kegunaan Benzene dan derivat Aromatis pada awal abad ke 19 digunakan untuk menjelaskan beberapa senyawa parfum Sekarang dikelompokkan sebagai sifat kimia (senyawa takjenuh yang mengalami reaksi substitusi daripada adisi). Pereaksi Alkena Benzena Br2 Adisi Subtitusi HCl Adisi Subtitusi KMnO4 Teroksidasi Tak teroksidasi Persoalan pertama dalam membuat struktur benzene yang dapat diterapkan berdasarkan fakta bahwa struktur yang adekuat tak dapat digambarkan apabila memakai garis ikatan yang biasa. Enam karbon adalah sp2 yang hibrid dan disusun dalam bentuk cincin dengan 6 anggota. Tiap karbon mengandung sebuah elektron dalam orbit p. Dengan harapkan enam karbon eektron p ini ada dalam tiga ikatan. Tetapi rumus bangun ini tak menerangkan mengapa benzne tak mengalami rekasi seperti alkena. Lagipula semua ikatan C – C dalam benzne panjangnya sama, tak mengandung tiga ikatan rangkap yang pendek dan tiga ikatan tunggal yang lebih panjang. Semua ikatan C – C mempunyai panjang 1,40 A, ikatan antara ikatan tunggal C- C (1,54 A) dan antara ikatan rangkap C = C (1,34 A). Struktur benzene yang sebenarnya adalah suatu hibrid resonansi yang digambarkan oleh kedua struktur kekule. Benzene tak mengandung ikatan tunggal atau rangkap dari karbon-karbon, tetapi keenam elektron pi terbagi rata pada enam karbonnya sehingga panjang ikatan karbonkarbonnya sama. Gambarkan struktur resonansi untuk senyawa aromatik berikut seperti yang kita kerjkan untuk benzene. (U/ Jawaban Pakai garis panah). Benzena menurut teori orbital : Semua atom berada pada bidang datar. Semua atom C memiliki orbital hibrida sp2(sebanyak tiga). 2 orbital sp2 dari tiap C overlap dg orbital sp2dari dua C berdekatan membentuk ikatan σ(sp2-sp2) dan 1 orbital sp2 dari tiap C overlap dg orbital 1s dari atom H membentuk ikatan σ (sp2-1s) Tiap C memiliki orbital p terisi 1 elektron yang terletak ⊥terhadap bidang datar tsb. Memenuhi syarat ikatan delokal (meliputi lebih dari dari 2 atom) ∴benzena memiliki orb. delokal yang meliputike-6 atom karbon Struktur Resonansi Karena delokalisasi dari muatan elektron akan menstabilkan struktur, maka cincin benzene lebih stabil (Energi rendah)dari pada hipotasa dari suatu trienasiklik. Energi stabilitas u/ senyawa aromatik disebut energi resonansi, untuk benzne besarnya 36 kcal/mol. Sikloheksena melepaskan 28,6 kcal/mol bila di hidrogenasi. Sebab itu secara teoritis sikloheksatriena akan melepaskan 3 x 28,6 kcal/mol atau 85,8 kcal/mol. Ternyata benzene hanya melepaskan 49,8 kcal/mol. Beraarti perbedaannya sebesar 36 kcal/mol. Senyawa aromatis adalah senyawa siklis yg memiliki sistem ikatan ganda dua terkonjugasi dengan jumlah elektron π = (4 n + 2) • n = bilangan bulat = 0, 1, 2, 3, . . ., ∞ Benzena pada umumnya dipakai sebagai induk dan gugus yang terikat disebutkan lebih dulu kemudian diikuti dengan benzena. Nama Trivial dari beberapa Benzene yang Bersubtitusi Untuk dua subtituen posisinya dapat diberi awalan : orto (o) untuk posisi 1 dan 2, meta (m) untuk posisi 1 dan 3 dan para (p) untuk posisi 1 dan 4. Perhatikan contoh-contoh berikut: Dalam contoh kedua dan ketiga benzene yang sudah tersubtitusi dipakai sebagai nama induk. Dalam senyawa ini, subtitusi utama dari induk (- OH dalam fenol dan – NH2 dalam aniline) dianggap sebagai tempat 1 Beri nama senyawa berikut ini dengan sistem o,m,p. Gambarkan rumus bangun untuk senyawasenyawa berikut ini: a. P-dietilbenzene b. O-Xiline c. Asam p-aminobenzoat (gugus amino – NH2) Gugus bervalensi satu yang diturunkan dari benzena disebut fenil dan gugus yang diturunkan dari toluena disebut benzil. Untuk tiga substituen atau lebih, awalan orto, meta, dan para tidak diterapkan lagi, tetapi posisi substituen yang dinyatakan dengan angka, urutan prioritas penomoran adalah sebagai berikut. –– COOH, –– SO3H, –– CHO, –– CN, –– OH, –– NH2, –– R, –– NO2, –– X Bila cincin benzene terikat pada sebuah rantai yang terdiri dari enam karbon atau pada rantai induk yang lebih penting, cincin benzene tersebut dinamakan gugus fenil. Beri nama senyawa-senyawa berikut: Gambar rumus bangun dari nama-nama di bawah ini: a) 2,6-dibromfenol b) 2,4,6-trinitrofenol Benzena berupa zat cair kental seperti minyak dengan titik lebur 5,5°C. Benzena kurang reaktif dibanding alkena karena ikatan rangkap pada benzena mengalami resonansi. Dapat mengalami reaksi substitusi (penggantian) Benzene tidak memberikan reaksi seperti alkena, tetapi biasanya subtitusi. Reaksi subtitusi senyawa aromatik: addisi reaksi Mekanisme dari reaksi subtitusi aromatik dimulai dengan serangan oleh elektrofil pada elektron pi dari cincin benzene, maka disebut reaksi subtitusi elektrofil Langkah 1, sepasang elektron pi dari awan aromatik pi diberikan untuk membentuk ikatan sigma dengan E+. Langkah ini menyebabkan karbon atom yang berdekatan dikelilingi hanya oleh enam (6) elektron, karbon ini membawa muatan positif. Struktur yang sebenarnya dari suatu intermediate adalah bagian dari bentuk-bentuk berikut: Sigma kompleks Benzen telah tersubtitusi Langkah 2, dari reaksi karbokasi memberikan sebuah proton (H+) kepada suatu basa yang berada dalam campuran reaksi. Pasangan elektron ikatan sigma dari ikatan C – H diubah menjadi elektron pi, maka awan aromatik pi timbul kembali sehingga suatu hasil subtitusi terbentuk. Ion benzenonium tidak dapat beraddisi sebab ion ini akan merusak awan aromatik pi dan stabilitas resonansi dari cinci n benzen akan hilang Grafik energi menunjukkan mengapa benzene mengalami reaksi subtitusi bukan addisi Mereaksikan benzene dengan brom (Br2) atau khlor (Cl2) dengan katalisator besi (Fe III) halida akan menghasilkan halobenzena. Mekanisme reaksinya: Br Br + + Br FeBr 3 Br FeBr 3 H Proceeds through a -complex Br Br H Br H + Br 2 + CH FeBr 3 H HC + CH -complex with the positive charge, distributed only between ortho- and para-positions Br Br Br Br Addition - + -H Br Substitution (aromaticity is restored) Klorinasi serupa dengan brominasi. Katalis yang digunakan AlCl3. Iodinasi membutuhkan agen pengoksidasi asam, seperti asam nitrat, yang akan mengoksidasi iodin menjadi ion I+. + H + HNO3 + 1/2 I2 + I + NO2 + H2O Bila benzene direaksikan dengan asam nitrat pekat, dengan asam sulfat pekat sebagai katalisator akan terbentuk nitrobenzene. Nitronium-cation HNO3 + H2SO4 H NO2 + + HSO4- + H2O Proceeds through a -complex O2N + -H O2 N O2N H H + O2N + CH HC + CH H Mereaksikan benzena dengan asam sulfat berasap (campuran H2SO4 pekat dengan gas SO3 jenuh) menghasilkan asam benzenesulfonat). SO3 + H2SO4 H HSO 3 + + HSO4- Proceeds through a -complex HO 3S + -H HO 3S HO 3S H H + HO 3S + CH HC + CH H Bila benzena direaksikan dengan suatu Haloalkana (RX) dengan katalisator suatu asam Lewis (dalam reaksi ini AlX3), benzenenya diubah menjadi alkilbenzena. Reaksi ini disebut reaksi alkil Friedel – Crafts. Alkilasi berarti subtitusi oleh suatu gugus alkil. Langkah pertama dari alkilasi Friedel – Crafts adalah pembentukan Karbokation. Serangan oleh karbokasi elektrofil (atau haloalkana terpolarisasi) pada cincin benzena, menyebabkan hilangnya sebuah proton dan menghasilkan alkilbenzena. Dalam perubahan susunan kembali, karbokation sekunder memindahkan sebuah hibrida (H:-) ke karbon positif terdekat untuk menghasilkan kation tersier yang lebih stabil. Haloalkana primer yang terpolarisasi dapat mengadakan perubahan susunan serupa untuk menghasilkan karbokation sekunder atau tertier. Reaksi subtitusi ke dalam cincin benzennya adalah gugus asil bukan alkil. Reaksi ini juga disebut reaksi asilasi Friedel – Crafts. Reaksi asilasi tidak berlangsung dengan cara karbokasi dan tidak ada perubahan susunan. Dengan menggabungkan reaksi asilasi dengan suatu reaksi yang mereduksi gugus karbonil (C= O) menjadi CH2. seorang ahli kimia dapat mensitesa sebuah n-alkilbenzene tanpa takut ada perubahan susunan bentuk. Misalnya: n-propilbenzena dapat dibuat dengan reaksi bertingkat berikut ini: Benzena terutama digunakan sebagai bahan dasar pembuatan senyawa - senyawa turunannya, misalnya stirena, kumena, dan sikloheksana pada industri petrokimia. Selain itu benzena digunakan sebagai bahan dasar untuk membuat detergen, misalnya ABS (Alkil Benzena sulfonat), untuk bahan bakar dan pelarut dalam jumlah yang sedikit Alkil Benzena, Diperoleh menurut sintesis Friedel Crafts Halogen Benzena, Digunakan dalam industri cat, pembuatan zat-zat lain dan pembuatan insektisida (DDT). Nitro Benzena, Diperoleh dengan nitrasi benzena Nitro benzena digunakan untuk pembuatan anilin dan bahan peledak (TNT = 2,4, 6– trinitro toluena) Asam Benzena Sulfonat, Diperoleh dengan mereaksikan benzena dengan asam sulfat (sulfonasi). Asam benzena sulfonat digunakan untuk membuat zat-zat karena mudah larut dalam air, dan pembuatan obat-obat sulfa. Turunan asam benzena sulfonat yang terkenal adalah sakarin Anilin, Diperoleh dengan mereduksi nitro benzena atau dari halogen benzena. Fenol, Dibuat dengan memanaskan asam benzena sulfonat dalam alkali atau memanaskan halogen benzena dalam alkali. Fenol digunakan untuk desinfektan (larutan fenol dalam air disebut karbol), untuk pembuatan obat-obatan, bahan peledak, dan plastik. dll.