bab ix aromatisitas, benzena, dan benzena tersubstitusi
advertisement
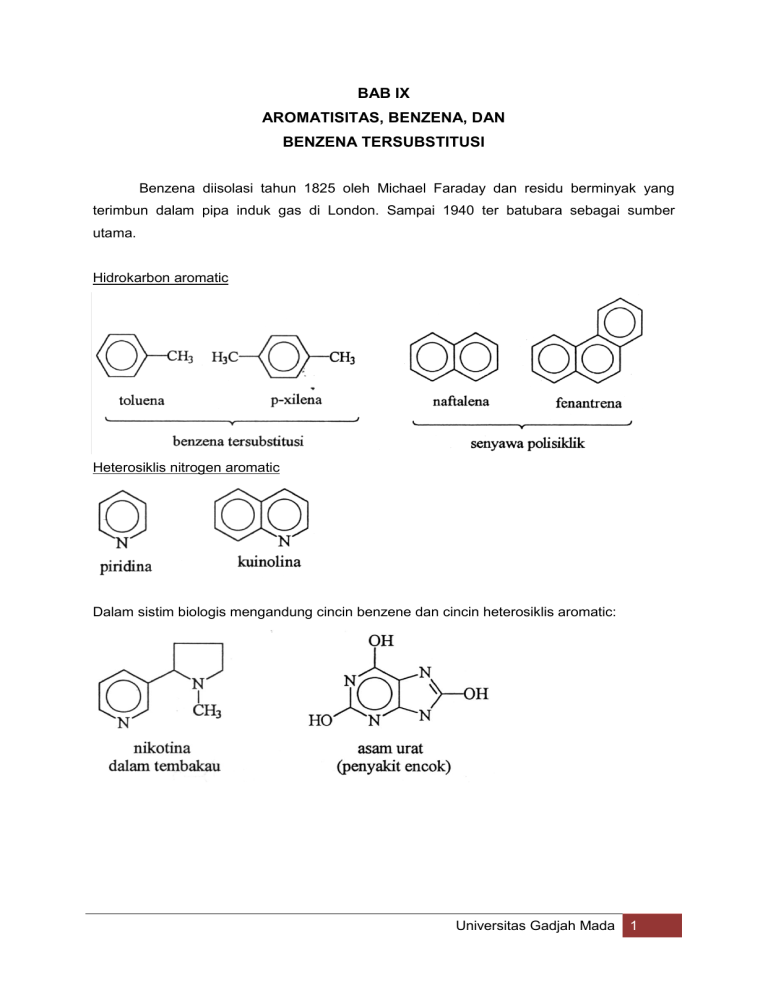
BAB IX AROMATISITAS, BENZENA, DAN BENZENA TERSUBSTITUSI Benzena diisolasi tahun 1825 oleh Michael Faraday dan residu berminyak yang terimbun dalam pipa induk gas di London. Sampai 1940 ter batubara sebagai sumber utama. Hidrokarbon aromatic Heterosiklis nitrogen aromatic Dalam sistim biologis mengandung cincin benzene dan cincin heterosiklis aromatic: Universitas Gadjah Mada 1 Tatanama benzene tersubstitusi Universitas Gadjah Mada 2 Distribstitusi Contoh: Bila ada 3 substitusi : Benzene sebagai substituent disebut gugus fenil. Kalu substitusi toluene tergantung pada titik lekatan : Sifat fisis hidrokarbon Bersifat non poiar sebagai pelarut Dengan air benzena membentuk senyawa azeotrop (91% benzena 29% air, mendidih 69,4%). Senyawa dengan 4 cincin terpadu hersifat karsinogen (penyebab kanker). Universitas Gadjah Mada 3 Benzena bersifat toksik agak karsinogenik (di laboratorium kalau bisa diganti toluena sebagai pelarut). Spektra benzena substitusi Karakteristik absorpsi IR senyawa benzena: Tipe vibrasi Posisi absorapsi C-H aril 3000-3300 cm-1 C-C aril 1450-1600 cm-1 Absorpsi tekukan C-H benzene tersubstitusi Substitusi Penampilan Monosubstitusi Posisi absorpsi 2 peak 730-770 690-710 o-disubstitusi 1 peak 735-770 680 kadang-kadang m-disubstitusi 3 peak 860-900 750-810 680-725 p-disubstitusi 1 peak 800-860 Gambar 10.1 Spektra klorobenzena (hal 456) Gambar halaman 457: o,m dan p-klorotolunea Spektra NMR Contoh spectrum toluene (halaman 458,459) Universitas Gadjah Mada 4 Panas dari hidrogenasi dan stabilitas : benzene Sikloheksadien dan sikloheksena Universitas Gadjah Mada 5 Syarat aromatis Molekul siklik Molekul datar Tiap atom cincin memiliki orbital p bidang cincin Aturan Hückel elektron pi sebanyak 4n+2 Tidak aromatis Universitas Gadjah Mada 6 Substitusi Aromatik Elektrofilik A. Substitusi Pertama Benzena tidak mengalami reaksi yang khas bagi alkena tetapi mengalami reaksi substitusi aromatik elektrofilik (Elektrofil disubstitusikan untuk satu atom hydrogen pada cincin aromatik). Contoh monosubstitusI cincin benzena. Halogenasi Mekanisme Pada kedua reaksi monosubstitusi di atas digunakan asam Lewis sebagai katatis. Asam Lewis bereaksi dengan reagensia (X2 ataupun HNO3) menghasilkan suatu elektrofiI yang merupakan pensubstitusi yang sebenarnya. Misal pada nitrasi: H2S04 (asarn kuat) dapat merebut gugus hidroksil dan asam nitrat dihasilkan NO (ion nitronium). Universitas Gadjah Mada 7 Elektrofil menyerang elektron pi satu benzena menghasilkan karbokation yang oleh resonansi yang disebut bereaksi lebih lanjut Ion benzenonium. Terstabilkan ion benzenonium. Alkilasi (alkilasi Friedel-Crafts) Alkilasi benzena berupa substitusi sebuah gugus alkil untuk sebuah hidrogen pada Cincin Mekanisme Tahap 1. Pembentukan elektrofil : suatu karbokation Tahap 2: serangan elektrofilik pada benzene, tahap 3 eliminasi sebuah ion hydrogen, hasilnya lkilbenzena. Masalah lain dalam alkilasi Friedel-Crafts ialah elektrofil yang menyerang dapat mengalami penataan ulang adanya geseran 1,2 dari H atau R. Contoh : Universitas Gadjah Mada 8 Diperkirakan kasus ini berlangsung lewat kompleks RX-AICI3 Tanpa penataan ulang Dengan penataan ulang Substitusi gugus asil pada cincin aromatic oleh suatu halide asam disebut reaksi asilasi aromatic (asilasi Friedel Craft) Universitas Gadjah Mada 9 Asilasi Friedel-Craft dapat direduksi menjadi alkil benzene tanpa penataan ulang. Mekanisme reaksi asilasi Friedel-Craft serupa dengan reaksi substitusi aromatic elektrofilik. Nukleofil menyerang ion asilium (RC=O) Universitas Gadjah Mada 10 B. Substitusi Kedua Benzene tersubstitusi dapat mengalami substitusi kedua. Universitas Gadjah Mada 11 Efek substituent pertama terhadap substitusi kedua C. Substitusi Ketiga Bagaimana bila sebuah cincin benzena telah mempunyai dua substituen? Ke mana subsstituen ketiga akan menuju ? Berapa aturan umum akan mencakup sebagian Besar kasus. 1. Jika dua substituen itu mengarahkan suatu gugus masuk ke satu posisi, maka posisi ini akan merupakan posisi utama (dan) substitusi ketiga. 2. Jika dua gugus bertentangan dalam efek-efek pengarahan mereka, maka activator yang lebih kuat akan lebih diturut pengarahannya. Universitas Gadjah Mada 12 3. Jika dua gugus deaktivasi berada pada cincin. terlepas dan di maria posisi mereka, dapat rnenyukarkan substitusi ketiga. 4. Jika dua gugus pada cincin berpoisi-meta satu sama lain, biasanya cincin itu tidak menjalani substitusi pada posisi yang mereka apit, meskipun mungkin cincin itu teraktifkan (pada posisi itu). Tidak reaktifnya posisi ini agaknya disebakan oleh rintangan sterik. Alkil benzene Karbon benzilik : karbon di dekat cincin benzene Misal : Gugus alkil dari benzene dapat dioksidasi: Universitas Gadjah Mada 13 Fenol C. Reaksi Reimer-Tieman D. Oksidasi fenol Yang dapat bereaksi adalah 1,2 dan 1,4 dihidroksi benzene (hidrokuionon) meliputi kuinon. Universitas Gadjah Mada 14 Garam benzenediazonium A. Pembuatan B. Reaksi garam benzenadiazonium Reaksi Sadmeyer Universitas Gadjah Mada 15 Universitas Gadjah Mada 16 Universitas Gadjah Mada 17 Universitas Gadjah Mada 18