SLE
advertisement

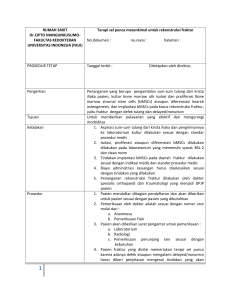
BAB I PENDAHULUAN A. Latar Belakang Systemic Lupus Erythematosus (SLE) adalah penyakit inflamasi autoimun kronis yang belum jelas penyebabnya dengan gambaran klinis yang luas serta tampilan perjalanan penyakit beragam (Perhimpunan Reumatologi Indonesia, 2011). Manifestasi klinis SLE sangat luas, meliputi keterlibatan kulit dan mukosa, sendi, darah, jantung, paru, ginjal, susunan saraf pusat dan sistem imun, sehingga diperlukan penegakan diagnosis yang memenuhi 4 kriteria dari 11 kriteria. Keterlibatan berbagai organ vital dan jaringan tersebut mayoritas terjadi pada wanita usia reproduksi. Hal ini menyebabkan pentingnya meneliti berbagai sarana diagnostik dan terapi yang semakin berkembang (Tsokos, 2011). Etiopatologi SLE melibatkan interaksi yang kompleks dan multifaktorial antara variasi genetik dan faktor lingkungan (Suarjana, 2014). Perkembangan SLE terjadi dalam beberapa tahapan. Predisposisi autoimunitas terjadi dalam jangka panjang karena kerentanan genetik, jenis kelamin dan paparan lingkungan. Pada sebagian kecil dari yang memiliki predisposisi tersebut akan terbentuk autoantibodi yang mendahului gejala klinis dalam waktu bulan sampai tahun (Hahn, 2013). Gangguan dalam mekanisme pengaturan imun seperti gangguan pembersihan sel-sel apoptosis dan kompleks imun berperan penting dalam perkembangan penyakit ini. Hilangnya toleransi imun, meningkatnya beban antigenik, bantuan sel T yang berlebihan, gangguan supresi sel B dan peralihan respons imun dari T helper 1 (Th1) ke Th2 menyebabkan hiperaktivitas sel B sehingga terbentuk autoantibodi patogenik. Respons imun akibat paparan faktor eksternal/lingkungan seperti radiasi ultraviolet dalam periode yang cukup lama dapat menyebabkan disregulasi sistem imun (Suarjana, 2014). Selain produksi autoantibodi dan deposit kompleks imun, sitokin juga berperan sebagai kunci utama dalam imunopatogenesis SLE. Sitokin merupakan faktor terlarut yang berperan penting dalam diferensiasi, maturasi dan aktivasi berbagai sel-sel imun serta menimbulkan respon inflamasi lokal yang menyebabkan kerusakan jaringan. Sitokin tertentu seperti IL-6, IL-10, IL-17, BLys, IFN type 1, dan TNFα sangat terkait dengan patogenesis SLE (Yap dan Lai, 2010). Angka kematian karena SLE bervariasi dari 6,8% sampai dengan 20% dengan survival rate pada tahun 5, 10 dan 15 berturut-turut sebesar 96%, 93%, dan 76%. Angka kematian pasien SLE 5 kali lipat dibandingkan populasi umum. Hal ini terkait dengan penyakit infeksi pada tahun-tahun awal dan dalam jangka panjang terkait penyakit vaskuler aterosklerosis (Perhimpunan Reumatologi Indonesia, 2011). Sel B adalah kunci untuk aktivasi sistem imun terutama melalui sitokin dan sebagai antigen presenting cell/APC (Postal et al., 2012). Identifikasi biomarker yang terkait erat dengan aktivitas penyakit SLE menjadi sebuah kebutuhan. Sitokin berperan penting dalam patogenesis SLE, keseimbangannya menentukan aktifitas penyakit. Perhatian utama ditujukan pada Th1/Th2. Sitokin diproduksi oleh sel limfosit Th1 dan Th2. Sitokin Th1 meliputi IL-2, IL-12 dan IFNγ (imunitas seluler), sedangkan sitokin Th2 meliputi IL-4, IL-5, IL-6 dan IL-10 yang memicu produksi antibodi (imunitas humoral). Produksi sitokin Th2 berlebihan menyebabkan hiperaktifitas sel B. Abnormalitas sel Th1 juga terlibat dalam patogenesis SLE. Pasien SLE memiliki kadar IL-6, IL-10, IL-12, dan IFNγ yang tinggi. Serum IL-6 signifikan meningkat pada pasien SLE aktif dan berkorelasi dengan indeks aktivitas SLE (SLEDAI), tingkat sedimentasi eritrosit (ESR), dan C-reactive protein (CRP). Serum IL-10 signifikan meningkat pada pasien SLE aktif dan berkorelasi positif dengan SLEDAI dan anti-dsDNA, sehingga IL-10 dapat menjadi biomarker aktivitas penyakit SLE (Chun et al., 2007). IL-10 merupakan sitokin multifungsional yang berperan penting dalam patogenesis SLE. IL-10 memicu proliferasi sel B dan menyebabkan peningkatan sekresi antibodi yang mampu memasuki kompartemen ekstravaskuler dan menimbulkan inflamasi (Yap dan Lai, 2010). C-Reactive Protein/CRP diproduksi oleh hepar dan adiposit sebagai respon terhadap berbagai proses inflamasi akut dan kronik sehingga disebut sebagai protein fase akut. Sintesis CRP di hepatosit distimulasi oleh peningkatan IL-6. CRP dapat mengaktifkan sistem komplemen dan berperan dalam pembersihan sel-sel apoptosis. Kadar CRP pada pasien SLE merupakan hal yang kontroversial. Beberapa penelitian terdahulu dengan metode konvensional menyatakan bahwa kadar CRP meningkat secara signifikan pada pasien SLE dengan infeksi dan terdapat peningkatan tidak terlalu tinggi pada pasien SLE aktif tanpa infeksi (Firooz et al., 2011). High sensitivity CRP (hsCRP) merupakan teknik untuk mendeteksi CRP dengan kadar lebih rendah daripada yang dapat dideteksi dengan metode konvensional (Rezaieyasdi et al., 2011). Kadar hsCRP signifikan lebih tinggi pada pasien SLE dengan kerusakan organ dibandingkan pasien SLE tanpa kerusakan organ, dimana nilai median hsCRP pada kedua kelompok < 0.5 mg/dl. Hal ini kontras dengan kadar hsCRP yang jauh lebih tinggi pada pasien SLE dengan infeksi (Firooz et al., 2011). Pristan atau tetramethylpentadecane (TMPD) merupakan alkalin isoprenoid (minyak hidrokarbon alami) yang didapatkan dari berbagai tanaman yang dapat memicu inflamasi kronik ketika dipaparkan ke dalam kavum peritoneal. Respon inflamasi tersebut menyebabkan SLE pada mencit (Reeves et al., 2009). Pemberian pristan pada mencit BALB/c memicu autoantibodi sebagai karakteristik lupus. Mencit yang terpapar pristan juga memiliki deposit komplek imun di ginjal yang menyebabkan proteiuria berat dan nefritis (Perry et al., 2010). Mencit BALB/c yang diberikan injeksi pristan mengalami glomerulonefritis yang tidak terlalu berat (proteinuria +3 sampai +4 dan perubahan proliferatif), artritis, ANA, dan bermacam-macam autoantibodi lupus termasuk anti dsDNA dan anti Sm (Reeves et al., 2009). Sel punca mesenkimal dewasa adalah sel multipoten yang dapat berdiferensiasi menjadi beberapa tipe sel mesenkimal khusus tahap akhir seperti osteoblas, kondrosit, adiposit, tenosit, dan lain-lain (Meirelles et al., 2009). Sel punca mesenkimal memiliki efek imunomodulasi yang terbukti berpengaruh pada sel limfosit T dan B, natural killer dan antigen precenting cells (APC). Sel punca mesenkimal bersifat hipoimmunogenik karena hanya sedikit mengekspresikan Major Histocompatibility (MHC) kelas I dan tidak mengekspresikan MHC kelas II atau molekul ko-stimulasi (CD40, CD40L, CD80 atau CD86), sehingga penggunaan sel punca mesenkimal alogenik tidak memerlukan pencocokan dengan Host Leukocyte Antigen/HLAs (Carrion dan Figueroa, 2011). Sel punca mesenkimal sangat potensial dalam regenerative medicine (Wang et al., 2012). Berbagai aktivitas sel punca mesenkimal terbukti berasal dari produk yang disekresikan oleh sel-sel tersebut (Madrigal et al, 2014). Penelitian mengenai sel punca mesenkimal menunjukkan efek secretome dilakukan pada tikus model spinal cord injury (Yang et al., 2008). Penelitian pada tikus model kandung kemih hiperaktif menunjukkan efek parakrin sel punca mesenkimal (Song et al., 2014). Pemberian sel punca mesenkimal menunjukkan perbaikan pada pasien SLE berat yang refrakter (Sun et al., 2010; Liang et al.,2010). Sel punca mensekresikan sejumlah protein (secretome) termasuk growth factor, kemokin, sitokin, metabolit dan lipid bioaktif yang mengatur secara autokrin atau parakrin sambil merekayasa interaksi dengan lingkungan mikro sekitarnya (Drago et al., 2013). Beberapa stimulan dapat ditambahkan pada medium kultur, yaitu prekondisi hipoksia, inflamasi, dan penumbuhan sel kultur dalam bidang 3 dimensi akan merangsang sekresi dari berbagai faktor terapeutik potensial (Madrigal et al, 2014). Terapi yang lebih efektif dengan efek samping lebih ringan dibandingkan dengan yang ditimbulkan oleh sitotoksik dan glukokortikoid hingga saat ini masih dibutuhkan. Penelitian terus dilakukan untuk mencari strategi terapi baru dengan efektivitas lebih tinggi dan komorbiditas lebih rendah (Musai M, 2010). Berdasarkan uraian di atas telah diketahui banyak manfaat dari secretome sel punca mesenkimal. Belum ada penelitian sebelumnya yang menggunakan secretome sel punca mesenkimal pada SLE sehingga peneliti ingin meneliti pengaruh secretome sel punca mesenkimal pada kultur medium terkondisi hipoksia terhadap ekspresi IL-10 dan kadar hsCRP pada mencit model lupus dengan induksi pristan. B. Rumusan masalah 1. Adakah pengaruh secretome sel punca mesenkimal terhadap ekspresi IL-10 pada mencit model lupus dengan induksi pristan 2. Adakah pengaruh secretome sel punca mesenkimal terhadap kadar hsCRP pada mencit model lupus dengan induksi pristan C. Tujuan Penelitian 1. Tujuan Umum Membuktikan pengaruh secretome sel punca mesenkimal terhadap ekspresi IL-10 dan kadar hsCRP pada mencit model lupus dengan induksi pristan. 2. Tujuan Khusus a. Membuktikan pengaruh secretome sel punca mesenkimal terhadap ekspresi IL-10 pada mencit model lupus dengan induksi pristan. b. Membuktikan pengaruh secretome sel punca mesenkimal terhadap kadar hsCRP pada mencit model lupus dengan induksi pristan. D. Manfaat Penelitian 1. Manfaat Teoritis a. Memberikan bukti ilmiah mengenai pengaruh secretome sel punca mesenkimal terhadap ekspresi IL-10 pada mencit model lupus dengan induksi pristan. b. Memberikan bukti ilmiah mengenai pengaruh secretome sel punca mesenkimal terhadap kadar hsCRP pada mencit model lupus dengan induksi pristan. c. Sebagai bahan informasi untuk melakukan penelitian lanjutan mengenai pengaruh secretome sel punca mesenkimal dalam penatalaksanaan SLE. 2. Manfaat Terapan Menjadikan secretome sel punca mesenkimal sebagai salah satu terapi dalam penatalaksanaan SLE.