BAB II TINJAUAN PUSTAKA 2.1 Limbah Pertanian Sebagai
advertisement

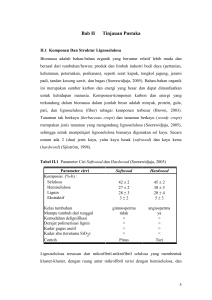
BAB II TINJAUAN PUSTAKA 2.1 Limbah Pertanian Sebagai Pakan Ternak Limbah tanaman pangan adalah bagian tanaman pangan yang tersedia dan dapat dimanfaatkan sebagai pakan setelah produk utama dipanen. Produksi limbah tanaman pangan di suatu wilayah dapat diperkirakan berdasarkan luas lahan panen dari tanaman pangan tersebut (Jayasurya, 2002). Djayanegara dan Sitorus (1983) menyatakan bahwa sebagian besar limbah pertanian dapat dimanfaatkan sebagai makanan ternak, namun sampai saat ini pemanfaatan limbah pertanian sebagai pakan ternak belum optimal. Hambatan yang sering dialami adalah kualitas yang rendah, serat kasar tinggi, kurang disukai ternak, konversinya tidak mudah dan produksinya berfluktuasi. Untuk mengatasi permasalahan tersebut, sentuhan teknologi sangat diperlukan sehingga limbah dapat diubah menjadi pakan bergizi dan sumber energi bagi ternak (Sarwono dan Arianto, 2006). Kandungan nutrien dari limbah dan gulma tanaman pangan untuk pakan ternak seperti batang pisang, eceng gondok, daun apu sangat baik diberikan kepada ternak. Namun di dalam penyusunan ransum untuk ternak nonruminansia khusunya itik belum dapat memenuhi kebutuhan yang optimal bagi ternak, dikarenakan limbah maupun gulma tanaman pangan mempunyai kualitas yang tidak seimbang bahkan rendah diakibatkan adanya kandungan serat kasar yang tinggi dan senyawa seperti lignin, silika, kutin, theobromine, tannin, kafein, asam sianida, keratin, dan lainlain. Serta kandungan mineral (terutama Ca, P, Mg, Cu, Zn, Co, Mn, Fe, dab S) dan vitamin (vitamin A dan E) rendah, dimana kesemuanya merupakan senyawa anti nutrisi sehingga harus diolah terlebih dahlu sebelum diberikan kepada ternak non ruminansia (Wijana, 2008) 2.2 Lignoselulosa Sebagai Faktor Pembatas Penggunaan Limbah Dan Gulma Tanaman Pangan Pemanfaatan sumber daya asal limbah dalam pengembangan usaha pertanian terintegrasi baik limbah pertanian sebagai pakan ternak, maupun limbah peternakan sebagai pupuk organik, biourine, biogas maupun biofestisida merupakan kunci keberhasilan program usaha pertanian terintegrasi. Pemanfaatan berbagai jenis limbah akan mengurangi biaya operasional usaha/produksi, mengurangi resiko terjadinya pencemaran lingkungan (Hegarty, 2001) serta meningkatkan penghasilan/laba usaha tani. Namun pemanfaatan limbah baik limbah pertanian sebagai pakan ternak, maupun limbah peternakan (feses dan urine) sebagai pupuk organik, biourine, biofestisida maupun biogas sering menghadapi kendala terkait terutama dalam proses degradasi bahan asal limbah tersebut. Tingginya kandungan serat kasar terutama senyawa lignoselulosa merupakan faktor pembatas utama pemanfaatan sumber daya alam asal limbah tersebut sebagai produk yang bermanfaat (Bidura, 2007). Dibawah disajikan kandungan lignoselulosa dari beberapa bahan asal limbah. Tabel 2.1 Kandungan senyawa lignoselulosa beberapa sumber daya alam No Bahan Limbah1 1 Jerami Padi 2 Jerami gandum 3 Tongkol jagung 4 Kulit Kacang Tanah 5 Biji Kapas 6 Baggas Tebu 7 Limbah kertas 8 Rumput-Rumputan 9 Dedaunan 10 Feses Sapi Sumber: 1)Howard et al., 2003, Komposisi Lignoselulosa (%) Selulosa Hemiselulosa Lignin 32,1 24 18 30 50 15 45 35 15 25-30 25-30 30-40 80-95 5-20 0 33,4 30 18,9 60-70 10-20 5-10 25-40 25-50 10-30 15-20 80-85 0 15 - 20 20-25 5-10 Lignoselulosa merupakan komponen utama tanaman (komponen dinding sel) yang menggambarkan jumlah sumber bahan organik yang dapat diperbaharui. Lignoselulosa terdiri dari polimer selulosa, hemiselulosa, lignin dan beberapa bahan ekstraktif lain yang berikatan secara kompak dan menjadi pembangun dinding sel tanaman. Susunan dinding sel tanaman terdiri dari lamela tengah (M), dinding primer (P) serta dinding sekunder (S) yang terbentuk selama pertumbuhan dan pendewasaan sel yang terdiri dari lamela transisi (S1), dinding sekunder utama (S2) dan dinding sekunder bagian dalam (S3) (Gambar 2.1). Gambar 2.1. Konfigurasi dinding sel tanaman (Perez et al., 2002) Dinding primer mempunyai ketebalam 0.1-0.2µm dan mengandung jaringan mikrofibril selulosa yang mengelilingi dinding sekunder yang relatif lebih tebal (Chahal dan Chahal 1998). Selulosa pada setiap lapisan dinding sekunder terbentuk sebagai lembaran tipis yang tersusun oleh rantai panjang residu ß-Dglukopiranosa yang berikatan melalui ikatan ß-1,4 glukosida yang disebut serat dasar (elementary fiber). Sejumlah serat dasar jika terjalin secara lateral akan membentuk mikrofibril. Mikrofibril mempunyai struktur dan orientasi yang berbeda pada setiap lapisan dinding sel (Perez et al. 2002). Lapisan dinding sekunder terluar (S1) mempunyai struktur serat menyilang, lapisan S2 mempunyai mikrofibril yang paralel terhadap poros lumen dan lapisan S3 mempunyai mikrofibril yang berbentuk heliks. Mikrofibril dikelilingi oleh hemiselulosa dan lignin. Bagian antara dua dinding sel disebut lamela tengan (M) dan diisi dengan hemiselulosa dan lignin. Hemiselulosa dihubungkan oleh ikatan kovalen dengan lignin. Selulosa secara alami terproteksi dari degradasi dengan adanya hemiselulosa dan lignin. Selulosa merupakan komponen utama penyusun dinding sel tanaman dan di alam hampir tidak pernah dijumpai dalam keadaan murni, tetapi berikatan dengan senyawa/komponen lain yaitu lignin dan hemiselulosa membentuk senyawa lignoselulosa (Howard, 2003). Dinding sel tanaman muda terdiri dari selulosa, hemiselulosa dan pektin. Seiring dengan perkembangan dan umur tanaman, lignin menjadi bagian dari dinding sel (Perez, 2002). Lignin secara fisik dan kimia merupakan penyebab utama ketidakmampuan ternak mendegradasi bahan pakan. Secara kimia, lignin berikatan dengan selulosa dan hemiselulosa membentuk ikatan kovalen yang kompak dan kuat (Gambar 2.2), sedangkan secara fisik, lignin bertindak sebagai penghalang proses perombakan dinding sel oleh mikroba rumen. Struktur berkristal serta adanya lignin dan hemiselulosa disekeliling selulosa merupakan hambatan utama dalam menghidrolisis selulosa. Kristalisasi selulosa dan pengerasan fibril selulosa oleh lignin membentuk suatu senyawa lignoselulosa yang keras (Gambar 2.3). Gambar 2.2. Hubungan antara lignin, selulosa dan hemiselulosa pada senyawa lignoselulosa Gambar 2.3. Tipe ikatan antara lignin dan polisakarida. A= Bensil ester, B=Bensil ether, C=Fenil Glikosida Efisiensi pemanfaatan selulosa sebagai sumber energi bagi ruminansia sangat tergantung pada kemampuan ternak untuk memutus ikatan yang memproteksi selulosa dari serangan enzim selulase. Selulosa dan hemiselulosa pada lignoselulosa tidak dapat dihidrolisis oleh enzim selulase dan hemiselulase kecuali lignin yang ada pada bahan pakan limbah tersebut dilarutkan, dihilangkan atau dikembangkan terlebih dahulu (Perez, 2002). 2.2.1 Selulosa sebagai faktor pembatas penggunaan limbah Selulosa adalah zat penyusun tanaman yang terdapat pada struktur sel. Kadar selulosa dan hemiselulosa pada tanaman pakan yang muda mencapai 40% dari bahan kering. Bila hijauan makin tua proporsi selulosa dan hemiselulosa makin bertambah (Tillman et al., 1998). Sellulosa merupakan suatu polisakarida yang mempunyai formula umum seperti pati (C6H1005)n. Sebagain besar sellulosa terdapat pada dinding sel dan bagian-bagian berkayu dari tumbuhan-tumbuhan. Selulosa tidak dapat dicerna oleh hewan non-ruminansia kecuali nonruminansia herbivora yang mempunyai mikroba pencerna sellulosa dalam sekumnya. Hewan ruminansia rnempunyai mikroba pencerna sellulosa didalam rumenretikulumnya sehingga sellulosa dapat dimanfaatkan dengan baik (Anggorodi, 1994). Komponen utama dari serat kasar yang merupakan penyusun dinding sel tanaman terdiri dari selulosa, hemiselulosa dan lignin (Church dan Pond, 1988). Selulosa merupakan substansi yang tidak larut dalam air yang terdapat di dalam dinding sel tanaman terutama dari bagian batang, tangkai dan semua bagian yang mengandung kayu. Selulosa merupakan homopolisakarida yang mempunyai molekul berbentuk linear, tidak bercabang dan tersusun atas 10.000 sampai 15.000 unit glukosa yang dihubungkan dengan ikatan â-1,4 glikosidik (Nelson dan Michael, 2000). Polisakarida (selulosa maupun hemiselulosa) agar dapat digunakan sebagai sumber energi harus dirombak terlebih dahulu menjadi senyawa sederhana. Selulosa sebagai fraksi serat kasar akan didegradasi oleh bakteri selulolitik selama proses fermentasi menjadi monomernya yang dapat digunakan sebagai sumber energi. Waktu yang diperlukan mikrobia beradaptasi dengan substrat memperlihatkan kecenderungan dengan urutan selulosa lebih rendah dan hemiselulosa (Prayitno, 1997). Smith dan Aidoo (1988), menyatakan bahwa selulosa terdapat hampir di semua material berkayu. Kandungan selulosa dalam bahan berkayu ini dapat mencapai 30-45% bahkan dapat mencapai 70-90% pada kapas. Kandungan selulosa tersebut bervariasi tergantung dari jenis dan bagian tanaman tersebut. Selulosa dan hemiselulosa juga merupakan penyusun jaringan tumbuhan yang tersusun dari gula yang berbeda. Selulosa adalah polimer liner yang tersusun dari D-glukosa yang diikat oleh β-1,4 glikosida membentuk celobiosa (Sanchez, 2009). Senyawa ini didegradasi oleh enzim mikroba menjadi oligosakarida kemudian menjadi glukosa. Pemecahan selulosa merupakan pemecahan polimer anhidrosa menjadi molekulmolekul yang lebih kecil. Melalui hidrolisis tersebut dihasilkan oligosakarida, trisakarida dan disakarida seperti selotriosa, selobiosa serta monomer-monomer glukosa atau pemecahan lainnya (alkohol, aldiehid, asam-asam dan keton) dan pada akhirnya menghasilkan CO2 dan air (Hardjo et al, 1989). 2.2.2 Hemiselulosa sebagai faktor pembatas penggunaan limbah Hemiselulosa merupakan kelompok polisakarida heterogen dengan berat molekul rendah. Komposisi hemiselulosa 15-30% dari berat kering bahan lignoselulosa (Perez et al., 2002). Hemiselulosa relatif lebih mudah dihidrolisis dengan asam menjadi monomer yang mengandung glukosa, mannosa, galaktosa, xilosa dan arabinosa (Gambar 2.4). Hemiselulosa mengikat lembaran serat selulosa membentuk mikrofibril yang meningkatkan stabilitas dinding sel. Hemiselulosa juga berikatan silang dengan lignin membentuk jaringan kompleks dan memberikan struktur yang kuat. Gambar 2.4. Bangun molekul hemiselulosa Morrison (1986) mendapatkan bahwa hemiselulosa lebih erat terikat dengan lignin dibandingkan dengan selulosa, sehingga selulosa lebih mudah dicerna dibandingkan dengan hemiselulosa. Jung (1989) melaporkan bahwa perubahan kecernaan selulosa dan hemiselulosa diakibatkan oleh keberadaan lignin yang berubah-ubah. Dikatakan pula bahwa kandungan lignin pada rumput lebih tinggi dibandingkan dengan legum. Hemiselulosa rantainya pendek dibandingkan selulosa dan merupakan polimer campuran dari berbagal senyawa gula, seperti xilosa, arabinosa, dan galaktosa. Selulosa alami umumnya kuat dan tidak mudah dihidrolisis karena rantai glukosanya dilapisi oleh hemiselulosa dan di dalam jaringan kayu selulosa terbenam dalam lignin membentuk bahan yang kita kenal sebagai lignoselulosa. 2.2.3 Lignin sebagai faktor pembatas penggunaan limbah Lignin adalah salah satu komponen penyusun tanaman yang bersama dengan sellulosa dan bahan-bahan serat Iainnya membentuk bagian struktural dan sel tumbuhan. Pada batang tanaman, lignin berfungsi sebagai bahan pengikat komponen penyusun Iainnya, sehingga suatu pohon bisa berdiri tegak. Kalau dianologikan dengan bangunan, lignin dan serat-serat tanaman itu mirip seperti beton dengan batang-batang besi penguat di dalamnya, yang memegang serat serat yang berfungsi seperti batang besi, sehingga membentuk struktur yang kuat. Berbeda dengan sellulosa yang terutama terbentuk dari gugus karbohidrat, lignin terbentuk dan gugus aromatik yang saling dihubungkan dengan rantai alifatik, yang terdiri dari 2-3 karbon. Pada proses pirolisa lignin, dihasilkan senyawa kimia aromatis yang berupa fenol, terutama kresol (Young, 1986). Lignin merupakan polimer dengan struktur aromatik yang terbentuk melalui unit-unit penilpropan yang berhubungan secara bersama oleh beberapa jenis ikatan yang berbeda (Perez et al. 2002). Lignin sulit didegradasi karena strukturnya yang kompleks dan heterogen yang berikatan dengan selulosa dan hemiselulosa dalam jaringan tanaman. Lebih dari 30 persen tanaman tersusun atas lignin yang memberikan bentuk yang kokoh dan memberikan proteksi terhadap serangga dan patogen. Disamping memberikan bentuk yang kokoh terhadap tanaman, lignin juga membentuk ikatan yang kuat dengan polisakarida yang melindungi polisakarida dari degradasi mikroba dan membentuk struktur lignoselulosa. Lignin terutama terkonsentrasi pada lamela tengah dan lapisan S2 dinding sel yang terbentuk selama proses lignifikasi jaringan tanaman. Lignin tidak hanya mengeraskan mikrofibril selulosa, juga berikatan secara fisik dan kimia dengan hemiselulosa. Lignin yang melindungi selulosa bersifat tahan terhadap hidrolisis karena adanya ikatan arilalkil dan ikatan eter (Gambar 2.6). Para Kumaril Alkohol Koniferil Alkohol Sinapil Alkohol Model Kerangka C Gambar 2.5 Satuan penyusun lignin (Steffen, 2003) Gambar 2.6. Bangun struktur lignin Pembentukan lignin terjadi secara intensif setelah proses penebalan dinding sel terhenti. Pembentukan dimulai dari dinding primer dan dilanjutkan ke dinding sekunder. Faktor lignin dalam membatasi fermeabilitas dinding sel tanaman dapat dibedakan menjadi efek kimia dan efek fisik. Efek kimia, yaitu hubungan lignin- karbohidrat dan asetilisasi hemiselulosa. Lignin secara fisik membungkus mikrofibril dalam suatu matriks hidrofobik dan terikat secara kovalen dengan hemiselulosa. Hubungan antara lignin karbohidrat tersebut berperan dalam mencegah hidrolisis polimer selulosa. Kadar lignin akan bertambah dengan bertambahnya umur tanaman. Tanaman pakan mengandung selulosa 20-30%, hemisellulosa 14-20% dan pektin kurang dari 10% serta lignin 2-12% (Young, 1986). 2.3 Degradasi Senyawa Ligoselulosa Lignoselulosa merupakan senyawa yang terdiri dari selulosa, hemiselosa dan lignin. Degradasi lignoselulosa secara sempurna dapat menyediakan nutrien yang optimal untuk ternak (Perez et al ,2002). Degradasi lignoselulosa terdiri dari degradasi senyawa selulosa, degradasi senyawa hemiselulosa, degradasi senyawa lignin. 2.3.1 Degradasi senyawa selulosa Degradasi selulosa merupakan proses pemecahan polimer hidroglukosa menjadi molekul yang lebih sederhana. Proses ini menghasilkan oligo, tri atau disakarida seperti selobiosa, selotriosa, monomer glukosa, CO2 dan H2O. Degradasi selulosa dapat dilakukan secara biologis (aktivitas enzim mikroba), fisik maupun kemis (Tillman, 1987). Sejumlah mikroba mampu menghidrolisis selulosa sampai taraf tertentu (Mudita et al.,2014). Selolusa merupakan komponen utama penyusun dinding sel tanaman, dibangun oleh unit-unit D-glukosa dengan ikatan 1,4. Ikatan-ikatan ini membentuk mikrofibril selulosa yang tidak larut dalam air. Bagian selulosa yang mudah dihidrolisis disebut bagian amorf selulosa. Selulosa merupakan subtansi yang utama dalam proses enzimatis Kecepatan degradasi enzimatis juga dipengaruhi oleh struktur selulosa. Degradasi selulosa berlangsung melalui hidrolisis rantai polisakarida menjadi molekul sederhana, yang menghasilkan oligosakarida maupun monomer glukosa atau produk degradasi sepe rti asam - asam organik maupun alkohol (Fadilah, 2012). Selulosa alami merupakan kristalin dan mempunyai struktur yang kompleks. molekul selulosa dibangun dari unit-unit β glukosa. Dua molekul β glukosa dikombinasikan melalui pertalian 1.4 yang menghasilkan β-cellobiose. Molekul selulosa merupakan polimer linier sederhana dari 1000 -10.000 unit sellobiose yang berikatan melalui ikatan 1,4-β glukosidik (Nurmayani, 2007) Aktivitas mikrobia selulolitik dalam mendegradasi selulosa dilakukan secara ekstraseluler melalui dua sistem, yaitu: 1) Sistem hidrolitik, melalui produksi enzim hidrolase yang merombak selulosa dan hemiselulosa, dan 2) Sistem oksidatif dan sekresi lignase ekstraseluler melalui depolimerisasi lignin (Peres et al., 2002). Lynd et al (2002) dan Beauchemin et al. (2003) disitasi oleh Mudita et al,(2014) menyebutkan perombakan secara enzimatis berlangsung karena adanya kompleks enzim selulase yang bersifat spesifik untuk menghidrolisis ikatan β -1,4-glikosidik, rantai selulosa dan derivatnya melalui beberapa tahapan. Tahap pertama adalah menguraikan polimer selulosa secara random oleh enzim carboxymethilcelulase/CMC-ase atau endo β-1,4 glukanase dengan cara memecah ikatan hidrogen yang ada di dalam struktur kristalin selulosa (ikatan internal α-1,4glukosida) sehingga terbentuk rantai-rantai individu selulosa (oligodekstrin). Tahap kedua adalah penguraian selulosa dari ujung pereduksi dan non pereduksi oleh eksoglukanase (selodektrinase dan selobiohydrolase) melalui pemotongan ujung- ujung rantai individu selulosa (ujung pereduksi dan non-pereduksi) sehingga menghasilkan disakarida dan tetrasakarida (misal selobiosa). Tahap ketiga (terakhir) adalah tahap penguraian selobiosa menjadi glukosa oleh enzim βglukosidase/glukohydrolase.. Reaksi degradasi selulosa menurunkan kadar karbon dan sebaliknya sintesa komponen-komponen sel akan meningkatkan kadar karbon (Djuarnani, 2004). Selulosa sebagai senyawa paling banyak di bumi tersusun atas 8 000 - 12 000 unit glukosa yang dihubungkan oleh ikatan 1,4-β-glukosida. Ikatan l,4-β- glukosida pada serat selulosa dapat dipecah menjadi monomer glukosa oleh selulase (Fikrinda, 2000) Gambar 2.7 Struktur kimia selulosa (Taylor, 1978) Gambar 2.8 Mekanisme degradari selulosa oleh enzim selulase Proses perombakan secara enzimatis terjadi dengan adanya enzim selulase sebagai agen perombak yang bersi fat spesifik untuk menghidrolisis ikatan 1,4-βglukosidik dan rantai selulosa dan derivatnya. Kompleks enzim selulase umumnya terdiri dari tiga unit enzim utama yaitu Endo β-(1,4)-glucanase (cx) yang berperan terutama pada bagian amorf pada rantai selulosa, membelah selulosa dan menghasilkan sedikit oligosakarida dengan ujung rantaiyang bebas, Ekso β-(1,4)glucanase (cl) atau cellobiosehydrolase yang ber peran pada pemecahan dibagian kristal rantai selulosa,membelah sellobiose dari ujung rantai yang tidak tereduksi dan β-glukosidase merupakan unit enzim yang penting untuk menghasilkan produk glukosa dari pemecahan selobiosa (Nurmayani, 2007) 2.3.2 Degradasi senyawa hemiselulosa Degradasi hemiselulosa merupakan hasil dari aktivitas komplek enzim hemiselulase terdiri dari endo-β-1,4-xylanase, ekso-β-1,4-xylosidase, endoarabinase, α-L-arabinofuranosidase, endo- β-1,4-mananase, dan ekso- β-1,4mannosidase. Komponen utama dari hemiselulosa adalah xilan dan mannan. Degradasi sempurna dari xilan membutuhkan enzim-enzim yang bekerja secara sinergis, seperti endo-1,4-β-xilanase, 1,4-β-xilosidase, α-glukuronidase, α-Larabinofuranosidase, asetil, furoloil, p-kumaril-esterase dan asetil-esterase (Coughlan and Hazlewood, 1993; Olempska-Beer, 2004). Enzim endo-1,4-βxilanase bertugas menghidrolisis ikatan β-1,4 dalam rantai silan menghasilkan silooligomer pendek yang selanjutnya akan dihidrolisis menjadi unit silosa tunggal oleh β-silosidase. Enzim α-D-glukorosidase menghidrolisis ikatan α-1,2-glikosidik dari asam 4-O-metil-D-glukoronik rantai samping silan. Asetil esterase menghidrolisis substitusi asetil pada silosa dan feruloil esterase yang menghidrolisis ikatan ester antara substitusi arabinosa dan asam ferulik. Feruloil esterase dapat melepaskan hemiselulosa dari lignin dan sehingga lebih mudah didegradasi oleh hemiselulase lain. Sedangkan degradasi sempurna dari mannan membutuhkan adanya kompleks enzim mananase yang terdiri dari; endo-β-Dmananase, ekso-β-D-mananase, α-D-manosidase, dan D-glukosidase (Howard, 2003). β-D-mananase menghidrolisis bagian tengah rantai manan, galaktomanan dan glukomanan, sedangkan β-D-glukosidase menghidrolisisi rantai sampingnya. Aktivitas hidrolisis dari kompleks enzim tergantung pada tipe enzim dan struktur manan sebagai substrat. Hemiselulase dihasilkan oleh berbagai mikrobia seperti Trichoderma, Aspergillus, Bacillus sp, Aeromonascaviae, Neurospora sitophila, Cryptococcus, Penicillium, Aureobasidium, Fusarium, Chaetomium, Phanerochaete, Rhizomucor, Humicola, Talaromyces, Clostridium sp, dan lain-lain yang dapat diisolasi dari berbagai sumber seperti sel tubuh hewan (seperti rayang, keong, siput), rumen, maupun sampah/limbah organik (Ohara et al., 1998; Chandel et al., 2007). Hasil penelitian Lee et al. (1985) menunjukkan Clostridium acetobutylicum strain ATCC 824 menghasilkan xylanase, xilopiranosidase, dan arabinofuranosidase, sedangkan strain NRRL B527 menghasilkan xilanase terbanyak. Bacillus sp dan B. pumilus PU 4-2 yang diisolasi dari perut rayap C. formosanus dan usus rayap Termitidae dapat menghasilkan enzim silanase. Hasil penelitian Purwadaria et al. (2004) menunjukkan B. pumilus PU 4-2 menghasilkan xilanase dengan aktivitas 3,0 U/ml dengan masa inkubasi optimum 36 jam dan aktivitas spesifik 67,5 U/mg. Beberapa jenis bakteri rumen, kolon dan caecum ruminansia (F. succinogenes, B. fibrisolvens, R. Albus) dan fungi rumen mampu menghasilkan enzim silanase. Akin dan Borneman (1990) menyebutkan jamur rumen mampu menghasilkan enzim silanase lebih tinggi daripada jamur anaerob lainnya, namun produksi silanase tersebut dipengaruhi oleh keberadaan gula, jika terdapat gula maka produksi silanase akan terhambat. Beberapa jenis jamur seperti Trichoderma reesei dan Penicillium chrysoporium menghasilkan β-xylosidase yang mempunyai ukuran lebih besar namun kurang populer dibandingkan endosilanase lainnya. Endosilanase dan endoglukanase dari jamur rumen Neocllimastix frontalis mempunyai aktivitas lebih tinggi dibandingkan endosilanase dan endoglukanase dari jamur anaerobik lainnya. Peres et al. (2002) juga mengungkapkan silanase bakteri pada umumnya lebih stabil pada pengaruh temperatur dari pada jamur. Enzim silanase termofilik dapat dihasilkan oleh kelompok bakteri Actinomycetes dan Thermonospora. Enzim silanase Actinobacteria bekerja aktif pada kisaran pH 6,0 – 7,0, sedangkan silanase jamur bekerja optimal pada pH 4,5 – 5,5. Jamur lain juga mampu menghasilkan silanase. Aspergillus niger yang ditumbuhkan pada media 50% dedak padi mampu menghasilkan enzim xylanase ekstraseluler (Riyanto et al., 2000). Penicillium oxalicum juga dapat menghasilkan silanase yang mampu aktif pada suhu tinggi dan pH basa (Muthezilan et al., 2007). 2.3.3 Degradasi senyawa lignin Ikatan lignin pada pinsipnya tidak berikatan linear tetapi merupakan senyawa kompleks. Lignin merupakan senyawa polimer yang sulit didegradasi dan hanya sedikit mikroorganisme yang mampu mendegradasi lignin secara efektif. Degradasi lignin membutuhkan enzim ekstraseluler yang tidak spesifik karena lignin mempunyai struktur acak dengan berat molekul tinggi. Degradasi lignin dari komplek lignoselulolitik merupakan respon dari aktivitas tiga (3) kelompok utama enzim ekstraseluler yaitu lignin-peroksidase/Li-P, mangan-peroksidase/Mn-P, dan lakase/Lac (Perez et al., 2002). Lignin Peroksidase (EC 1.11.1.14, Li-P, Ligninase) merupakan enzim lignolitik pertama yang berhasil ditemukan (Hammel, 1997) yang diisolasi dari beberapa kapang pelapuk putih (white rot fungus) dari kelas Basidiomycetes, seperti P. chrysosporium, Phlebia radiata, T. versicolor. Enzim Li-P bertugas mengkatalisis oksidasi sebuah elektron dari cincin aromatik lignin dan akhirnya membentuk kation-kation radikal. Senyawa radikal ini secara spontan atau bertahap melepaskan ikatan antar molekul dan beberapa diantaranya melepaskan inti pada cincin aromatik (Perez, 2002). Oksidasi substruktur lignin yang dikatalisis oleh LiP dimulai dengan pemisahan satu elektron cincin aromatik substrat donor dan menghasilkan radikal kation aril yang kemudian mengalami berbagai reaksi postenzymatic. Li-P memotong ikatan Cα-Cβ molekul lignin. Pemotongan ikatan pada Cα-Cβ merupakan jalur utama perombakan lignin (Hammel, 1997). Disamping itu, Li-P juga merupakan oksidan yang kuat yang mempunyai kemampuan mengoksidasi senyawa fenolik, amina, eter aromatik, dan senyawa aromatik polisiklik. Li-P adalah enzim peroksidase ekstraseluler yang mengandung heme yang aktivitasnya bergantung pada H2O2, yang mempunyai potensial redoks yang sangat besar dan pH optimum yang rendah (Gold dan Alic, 1993). Enzim Mangan-Peroksidase/Mn-P (EC. 1.11.1.13, Mn-P) ditemukan tidak lama setelah ditemukannya Li-P dari Phanerochaete chrysosporium oleh Kuwahara Tahun 1984 (Suparjo, 2008). Enzim Mn-P merupakan heme peroksidase ekstraseluler yang membutuhkan Mn2+ sebagai substrat pereduksinya (Steffen, 2003). Enzim Mn-P mengoksidasi Mn2+ menjadi Mn3+ dan H2O2 sebagai katalis untuk menghasilkan gugus peroksida (Camarero et al., 1994). Mn3+ yang dihasilkan dapat berdifusi ke dalam substrat dan mengaktifkan proses oksidasi. Hal ini didukung pula oleh aktivitas kation radikal dari veratril alkohol dan enzim penghasil H2O2. Proses ini diakhiri dengan bergabungnya O2 ke dalam struktur lignin (De Jong et al., 1994). Radikal fenoksil yang dihasilkan lebih lanjut bereaksi yang akhirnya melepaskan CO2 (Suparjo, 2008). Enzim Lakase/Lac berperanan mengoksidasi gugus fenol menjadi kuinon (Arora dan Sandhu, 1985). Ishihara (1980) menyatakan lakase adalah enzim pengoksidasi melalui proses demitilasi yang mengubah gugus metoksi menjadi methanol. Disamping itu terdapat kelompok enzim fenoloksidase (lakase dan tirosinase) yang mengoksidasi gugus δ dan p-fenol serta gugus amina menjadi kuinon dan memberi perubahan warna terhadap substansi fenolik 1-naftol dan pkresol (Crawford, 1981). Perez et al., 2002 menyatakan laccase mereduksi O2 menjadi H2O dalam substrat fenolik melalui reaksi satu elektron membentuk radikal bebas. Dengan adanya elektron seperti ABTS (2.2-azinobis/3-ethylbenzthiozoline- 6-sulphonate) atau HBT (Hydroxybenzotriazole), laccase mampu mengoksidasi senyawa nonfenolik tertentu dan veratryl alkohol. Berat molekul laccase basidiomycetes bervariasi antara 50 – 70 kDA (Suparjo, 2008). Lignin merupakan senyawa aromatik yang sulit didegradasi, hanya sedikit organisme yang telah diketahui mampu mendegradasi lignin secara baik. Mikrobia eukariotik seperti jamur di alam merupakan perombak lignin paling efisien dan berperanan penting dalam siklus karbon. Beberapa mikrobia prokariotik seperti bakteri mempunyai kemampuan mendegradasi lignin. Bakteri dari genus Aeromonas, Bacillus, Flavobacterium, Pseudomonas maupun Streptomyces memiliki kemampuan enzimatis dalam menggunakan senyawa aromatik cincin (aromatic ring) dan rantai samping yang ada pada lignin (Hernandes et al., 1994). Disamping itu bakteri berperanan dalam perombakan lebih lanjut senyawa intermediet hasil degradasi jamur (Ruttiman et al., 1991). Marti ni et al. (2003) mengungkapkan bakteri dari genus Micrococcus (isolat SPH-9) dan Bacillus (isolat SPH-10) yang diisolasi dari sampah domestik mampu mendegradasi lignin (lindi hitam) masing-masing sebesar 75% dan 78%. Prihantini et al. (2011) mengungkapkan isolat bakteri TLiD dan BOpR mampu mendegradasi lignin dan organochlorin (lignolitik) jerami padi sampai 100% pada fermentasi hari ke-7. 2.4 Cacing Tanah Sebagai Sumber Inokulan Pendegradasi Lignoselulosa Cacing Tanah adalah hewan tingkat rendah karena tidak mempunyai tulang belakang (invertebrata) dan digolongkan kedalam filum Annelida karena seluruh tubuhnya tersusun atas beberapa segmen (ruas) yang berbentuk seperti cincin (Khairuman & Khairul, 2009). Cacing tanah mengandung yaitu lemak, kalsium, fosfor, serat kasar dan kandungan protein yang ada di tubuhnya sangat tinggi dan banyak, setidaknya terdiri atas 9 macam asam amino esensial yaitu arginin, fenilalanin, histidin, isoleusin, leusin, lisin, methionin, threonin, valin dan 4 macam asam amino nonesensial yang terdiri dari sistin, glisin, serin, tirosin. Banyaknya asam amino esensial yang terkandung memberikan indikasi bahwa cacing tanah juga mengandung berbagai jenis enzim yang sangat berguna (Palungkun, 2010). Fuji et al. (2012) menambahkan bahwa bakteri selulolitik yang dominan pada cacing tanah Amynthun heteropoda dan Eisenia fetida adalah Burkholderia spp, Enterobacter Herbaspiririllum dan Pseidomonas, sedangkan fungi selulolitik yang dominan adalah Penicillium, Fusarium dan Staphylotrichum. Owa et al. (2013) juga melaporkan bahwa saluran pencernaan cacing tanah Libyodrilus violaceus berhasil diisolasi bakteri Acinobacter sp., Alcaligans faecalis, Bacillus sp., B. brevis, B.cereus, B lalerosporus, B. lichenoform, Corynebacterium sp., E. cloacae, Erwinia salicie, Flavobacterium sp., F, aquartile, Kiebsiella sp., Micrococcus inteus, M. varians, Proteus rennvi, P. vulgaris, dan Pseudomonas sp. Peranan inokulan dalam upaya menurunkan kandungan serat kasar dan senyawa anti nutrisi pada bahan pakan penyususn ransum komplit, pemanfaatan teknologi biofermentasi merupakan salah satu strategi yang dapat dilakukan (Suharto,2004). Fermentasi merupakan proses perubahan kimia pada substrat sebagai hasil mikroorganisme dengan menghasilkan produk tertentu. Selama proses fermentasi terjadi perubahan pH, kelembaban, aroma dan perubahan kompisisi zat makanan seperti protein, lemak, serat kasar, karbohidrat, vitamin dan mineral (Bidura, 2007). Terjadinya fermentasi tergantung pada jenis substrat, mikroba yang bekerja dalam proses fermentasi dan kondisi lingkungan yang mempengaruhi pertumbuhan dan metabolisme mikroba yang bersangkutan. Mikroba yang berperan dalam proses fermentasi umumnya dari kapang, khamir dan bakteri (Wardani, 2014). Pemanfaatan cacing tanah dalam produksi inokulan telah menunjukkan bahwa penggunaan 0,1–0,4% cacing tanah (Lubricus rubellus) mampu menghasilkan inokulan dengan kandungan nutrien dan populasi mikroba yang cukup tinggi (Putra, 2015). Hasil penelitian menunjukkan bahwa bioinokulan yang diproduksi dengan memanfaatkan cacing tanah dengan level 1-4% mampu menghasilkan bioinokulan dengan kandungan Fosfor/P, Kalsium/Ca, Zinc/Zn, Belerang/S, dan Protein terlarut yang berbeda tidak nyata (P>0,05) yaitu masingmasing sebesar 132,21 – 151,29 mg/l, 1155,83 – 1281 mg/l, 7,29 – 7,76 mg/l, 227,33 – 236,00 mg/l, 4,03 – 4,39% dan 0,77 – 0,84% (Tabel 2.2) Tabel 2.2 Kandungan nutrien bioinokulan konsorsium mikroba cacing tanah Bioinokulan1 Kandungan Nutrien Bioinokulan Ca Zn S P mg/l 2 132,21a 149,95ab 151,29b 132,47ab BC 4 3 4,60 SEM Sumber : Putra, 2015 BC 1 BC 2 BC 3 mg/l mg/l mg/l Protein terlarut % 1275,00a 1281,25a 1242,50a 1155,83a 96,97 7,29a 7,51a 7,76a 7,57a 0,22 227,33a 232,67a 232,67a 236,00a 6,30 4,03a 4,34a 4,39a 4,17a 0,14 Keterangan: Hasil analisis Lab. Analitik UNUD 1) Perlakuan yang diberikan BC1 = Bioinokulan yang diproduksi dengan level cacing tangan 0,1 mg/l BC2 = Bioinokulan yang diproduksi dengan level cacing tangan 0,2 mg/l BC3 =Bioinokulan yang diproduksi dengan level cacing tangan 0,3 mg/l BC4 = Bioinokulan yang diproduksi dengan level cacing tangan 0,4 mg/l 2) Hurup yang sama pada kolom sama, berbeda tidak nyata (P>0,05) 3) SEM = Standard Error of The Treatment Means Dihasilkannya kandungan mineral seperti Ca, P, S dan Zn yang tinggi serta protein terlarut yang juga tinggi dari keempat bioinokulan (Tabel 2.2), selain disebabkan oleh bahan penyusun medium juga merupakan sumbangan dari mikroba inokulan. Hal ini mengingat sel tubuh mikroba tersusun atas berbagai protein/asam amino terutama asam amino mengandung sulfur (metionin, sistein dan sistin) serta berbagai mineral pembangun tubuh (Ca, P, dan S) serta mineral fungsional seperti Zn sehingga kandungan nutrien bioinokulan menjadi tinggi. Tabel 2.3 Populasi mikroba dan derajat keasaman bioinokulan konsorsium mikroba cacing tanah POPULASI MIKROBA PERLAKUAN / JENIS BIOINOKULAN Total bakteri Bakteri Bakteri Bakteri Selulolitik Amilolitik Proteolitik Total Fungi pH x109sel/ml x108sel/ml x108sel/ml x108sel/ml x104sel/ml BC 1 7,77a 1,18a 6,60a 4,03a 2,92a 3,81a BC 2 8,85a 1,35a 6,87a 4,67a 2,99a 3,64a BC 3 8,88a 1,73a 7,37a 4,83a 3,23a 3,53a BC 4 9,40a 1,76a 6,73a 4,97a 3,52a 3,64a SEM 0,66 0,17 0,92 1,29 0,61 00,09 Sumber : Putra, 2015 Keterangan: Hasil analisis Lab. Nutrisi dan Makanan ternak Fakultas Peternakan UNUD 1) Perlakuan yang diberikan (Jenis Bioinokulan yang diproduksi) BC1 = Bioinokulan yang diproduksi dengan level cacing tangan 0,1 mg/l BC2 = Bioinokulan yang diproduksi dengan level cacing tangan 0,2 mg/l BC3 =Bioinokulan yang diproduksi dengan level cacing tangan 0,3 mg/l BC4 = Bioinokulan yang diproduksi dengan level cacing tangan 0,4 mg/l 2) Hurup yang sama pada kolom sama, berbeda tidak nyata (P>0,05) 3) SEM = Standard Error of The Treatment Means Pemanfaatan cacing tanah sebagai sumber konsorsium mikroba mampu menghasilkan bioinokulan dengan populasi mikroba baik bakteri maupun fungi yang cukup tinggi dan dengan derajat keasaman yang cukup rendah (Tabel 2.3). Penggunaan cacing tanah sebanyak 0,1–0,4% (10 – 40 ml larutan cacing tanah 10% dalam 1 liter bioinokulan) mampu menghasilkan bioinokulan dengan kandungan total bakteri 7,77 – 9,40 x 109 koloni/ml, bakteri selulolitik 1,18 – 1,76 x 108 koloni/ml, bakteri amilolitik 6,60 – 7,37 x 108 koloni/ml, bakteri proteolitik 4,03 – 4,97 x 108 koloni/ml dan total fungi 2,92 – 3,52 x 108 koloni/ml serta dengan derajat keasaman (pH) 3,53 – 3,81 (Tabel 2.3). Berbagai hasil penelitian telah menunjukkan bahwa semakin tinggi populasi mikroba akan meningkatkan kemampuan degradasi lignoselulosa dari inokulan bersangkutan (Mudita et al., “Unpublished”;). Mudita et al. (2012) menunjukkan bahwa inokulan yang diproduksi dari 2% cairan rumen dan 0,2% rayap dengan populasi bakteri selulolitik tertinggi yaitu 6,33 – 8,00 x 109 kol/ml mempunyai kemampuan degradasi substrat kaya selulosa yang lebih tinggi dibandingkan dengan inokulan yang mempunyai populasi mikroba yang lebih rendah. Tabel 2.4 Pengaruh perlakuan terhadap populasi bakteri bioinokulan Populasi Bakteri (...x 109 koloni/ml)1 Perlakuan2 Total Bakteri Bakteri Selulolitik Bakteri Silanolitik (x 109 koloni/ml) (x 109 koloni/ml) (x 109 koloni/ml) 11,96a 6,33a 4,87a BR1E1 13,27bc 6,65a 6,01a BR2E1 12,94ab 6,43a 5,56a BR1E2 14,01bc 7,00a 6,39a BR2E2 13,70bc 7,03a 6,59a BR1E3 14,23c 8,00a 6,91a BR2E3 4 0,34 0,75 0,53 SEM Sumber : Mudita et al. (2012) Keterangan: 1) Hasil Analisis Lab. Biofarmaka Fakultas Farmasi Unhas 2) Perlakuan yang diberikan, yaitu: BR1E1 yaitu bioinokulan yang diproduksi dari 10% cairan rumen dan 0,1% rayap BR2E1 yaitu bioinokulan yang diproduksi dari 20% cairan rumen dan 0,1% rayap BR1E2 yaitu bioinokulan yang diproduksi dari 10% cairan rumen dan 0,2% rayap BR2E2 yaitu bioinokulan yang diproduksi dari 20% cairan rumen dan 0,2% rayap BR1E3 yaitu bioinokulan yang diproduksi dari 10% cairan rumen dan 0,3% rayap BR2E3 yaitu bioinokulan yang diproduksi dari 20% cairan rumen dan 0,3% rayap 3) Notasi berbeda pada kolom sama menunjukkan nilai berbeda nyata (P<0,05) 4) SEM = Standard Error of the Treatment Mean.