penurunan kadar lignin dari tandan kosong kelapa
advertisement

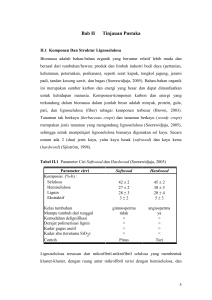
1 PENURUNAN KADAR LIGNIN DARI TANDAN KOSONG KELAPA SAWIT (TKKS) DAN PEMECAHAN MATERIAL SELULOSA UNTUK PEMBENTUKAN GLUKOSA DENGAN PROSES FUNGAL TREATMENT *1) Aldino J.G 1, Fanandy K 1, S.R. Juliastuti *1,Nuniek H 1, Sumarno 1 Jurusan Teknik Kimia, Fakultas Teknologi Industri, Institut Teknologi Sepuluh Nopember (ITS), Jl. Arief Rahman Hakim, Surabaya, 60111 Indonesia Phone : 031-5940374, Fax : 031-5999282 * Email : [email protected] Tandan Kosong Kelapa Sawit (TKKS) merupakan limbah padat terbesar dari pabrik minyak CPO. Komponen utama TKKS adalah lignin, selulosa, dan hemiselulosa yang umum disebut lignoselulosa. Kandungan lignin yang tinggi pada TKKS menyebabkan kendala dalam pemanfaatan selulosa murni bagi industri yang berbahan baku selulosa. Produksi glucose dari TKKS melalui cara konvensional mebutuhkan biaya yang tinggi. Oleh sebab itu penelitian ini bertujuan untuk mengkonversi TKKS menjadi glucose dengan menggunakan kombinasi fungi Tricodherma harzianum (TH) dan Phanerochaete chrysosporium (PC) pada proses degradasi lignin, kemudian dilanjutkan proses degradasi cellulose dan hemicellulose yang menggunakan penambahan fungi Aspergillus niger (AN) dan Tricodherma viride (TV). Metode penelitian ini menggunakan 2 tahap utama yaitu fungal treatment 1 dan fungal treatment 2. Bahan baku yang digunakan adalah TKKS, sedangkan jamur yang digunakan adalah jamur Phanaerochaete chrysosporium, Tricodherma harzianum, Aspergillus niger dan Tricodherma viride. Proses fungal treatment dilakukan pada suhu 37 oC dan pH 4 – 6 disertai dengan pengadukan sebesar 50 rpm. Dari hasil penelitian yang telah dilakukan didapatkan proses fungal treatment terbaik terdapat pada fungal treatment 2 dengan ratio PC:TH = 2:1, dengan penurunan lignin sebesar 84,72%, penurunan hemiselulosa sebesar 16,209%, penurunan selulosa sebesar 13,328% dan kenaikan glukosa sebesar 119,95%. Kata Kunci— Aspergillus niger, Phanaerocaete chrysosporium, Tandan Kosong Kelapa Sawit, Tricodherma harzianum, Tricodherma viride. I. PENDAHULUAN K elapa sawit (Elaeis guineensis) merupakan salah satu komoditas perkebunan andalan bagi perekonomian Indonesia. Kualitas dan tingkat produksi Crude Palm Oil (CPO) yang tinggi merupakan keunggulan dari komiditas ini. Data Ditjen Perkebunan menyebutkan pada tahun 2005 luas perkebunan kelapa sawit di Indonesia mencapai 5.358.423 hektar dengan total produksi minyak hingga 10.683.756 ton (Ditjenbun, 2008). Dalam proses produksi CPO dihasilkan banyak limbah yang masih belum dimanfaatkan secara maksimal sehingga berpotensi mencemari lingkungan. Tandan Kosong Kelapa Sawit (TKKS) merupakan limbah padat terbesar dari pabrik minyak CPO. Komponen utama TKKS adalah lignin, selulosa, dan hemiselulosa yang umum disebut lignoselulosa (Darnoko, 1992). Kandungan lignin yang tinggi pada TKKS dan bagas tebu menyebabkan kendala dalam pemanfaatan selulosa murni bagi industri yang berbahan baku selulosa seperti industri pulp dan kertas ataupun industri pembuatan papan serat. Salah satu cara untuk mengatasi masalah ini menggunakan mikroorganisme dalam rangka biodelignifikasi. Mikroorganisme yang berperan penting dalam biodelignifikasi adalah Fungi Pelapuk Putih (FPP) dari kelas Basidiomycetes. Kemampuan FPP melakukan biodelignifikasi disebabkan oleh enzim ligninolitik ekstraselular yang dihasilkannya (Kirk & Chang 1990). Enzim ligninolitik ekstraselular tersebut adalah lakase, lignin peroksidase (LiP), dan mangan peroksidase (MnP) (Gold & Alic 1993). Produksi enzim ligninolitik dari limbah lignoselulosa mempunyai arti penting karena selain dapat mengatasi masalah limbah organik lignoselulosa, juga dapat memberi nilai tambah dari limbah tersebut. TKKS mengandung Hemiselulosa sebanyak 28 persen. Dari 28 persen tersebut mengandung xilosa sebanyak 33 persen (Kwei Nam-Law, 2010). Dari data tersebut dapat disimpulkan bahwa limbah TKKS memilki potensi yang besar jika dimanfaatkan untuk industri glucose. Potensi ini ditunjang dengan fakta bahwa glucose memiliki manfaat di berbagai bidang industri seperti makanan, obat-obatan, alkohol, aseton – butanol atau biopolimer dan sudah dipakai secara luas di hampir seluruh negara di dunia, seperti Eropa, Amerika, serta Asia, sehingga glucose mempunyai peluang besar untuk komoditi ekspor yang unggul. (Darnoko, 1992) Produksi glucose dari TKKS melalui cara konvensional memang memerlukan biaya yang cukup tinggi karena selain diperlukan energi yang tinggi juga bahan baku utamanya adalah cellulose murni, serta glucose yang dihasilkan pun masih memerlukan proses pemurnian untuk memenuhi standar pada industri obat dan makanan yang menyebabkan meningkatnya biaya produksi . Maka diperlukan proses bioteknologi dengan memanfaatkan mikroorganisme untuk mengganti proses produksi kimia yang diharapkan lebih ekonomis. Oleh sebab itu penelitian ini bertujuan untuk mengkonversi TKKS menjadi glucose dengan menggunakan kombinasi fungi Tricodherma harzianum dan Phanerochaete chrysosporium 2 pada proses degradasi lignin, kemudian dilanjutkan proses degradasi cellulose dan hemicellulose dengan fungi Aspergillus niger dan Tricodherma viride II. METODOLOGI PENELITIAN A. Bahan Bahan – bahan yang digunakan yaitu Tandan kosong kelapa sawit (TKKS), Potatoes Dextrose Agar (PDA), Tricodherma harzianum, Phanerochaete chrysosporium, Tricodherma viride, Aspergillus niger, Asam/basa (H2SO4 dan CH3COOH / NaOH), glukosa, agar. B. Peralatan Peralatan yang digunakan yaitu waterbath, peralatan gelas, autoclave, incase, incubator. hingga beratnya konstan. Berat ditimbang (berat c). Residu kering ditambahkan 100 mL H2SO4 72% dan direndam pada suhu kamar selama 4 jam. Ditambahkan 150 mL H2SO4 1 N dan direfluk pada suhu 100 oC dengan water bath selama 1 jam pada pendingin balik. Residu disaring dan dicuci dengan H2O sampai netral (400 mL). Residu kemudian dipanaskan dengan oven dengan suhu 105oC sampai beratnya konstant dan ditimbang (berat d). Selanjutnya residu diabukan dan ditimbang (berat e) Kadar Air (% berat) = Kadar Hemiselulosa (%berat) = Kadar Selulosa (% berat) = Kadar Lignin (% berat) = Kadar Abu (% berat) = agitator, C. Cara Kerja Pretreatment Tandan Kosong Kelapa Sawit (TKKS) TKKS dicuci untuk menghilangkan debu dan pengotor lainnya. Lalu TKKS dipotong menjadi potongan-potongan kecil. Kemudian TKKS tersebut direbus / dimasak. Setelah dikeringkan, potongan TKKS tersebut digiling menjadi serbuk dan diayak sampai dengan ukuran 20 mesh. Setelah itu dilakukan analisa kadar selulosa, hemiselulosa, lignin, dan glukosa dalam TKKS. Fungal Treatment Tricodherma harzianum, Aspergillus niger, Tricodherma viride, dan Phanerochaete chrysosporium dibiakkan pada Potato Dextrose Agar (PDA). Jumlah jamur dihitung menggunakan mikroskop (counting chamber). Konsentrasi jamur yang diperlukan pada Tricodherma harzianum adalah 5 x 106 sel/mL, pada Aspergillus niger adalah 5 x 106 sel/mL, pada Tricodherma viride adalah 5 x 106 sel/mL, dan pada Phanerochaete chrysosporium adalah 5 x 106 sel/mL. (Pada kondisi log phase masing-masing jamur). Bubur TKKS dibuat dengan menambahkan air ke TKKS dengan rasio berat TKKS : Air = 3:5 (w/w). Delignifikasi dan proses hidrolisis pada TKKS dilakukan dengan menambahkan jamur Tricodherma harzianum, Phanerochaete chrysosporium, dan dibiakkan selama 5 hari sebagai proses fungal treatment 1. Aspergillus niger, dan Tricodherma viride dengan konsentrasi tertentu (sesuai variable), ditambahkan pada hari ke-5, dan fungal treatment dilanjutkan sampai hari ke-9 sebagai proses fungal treatment 2. Kondisi operasi proses fungal treatment dijaga 37oC pada pH 4-6 disertai pengadukan 50 rpm. Pengolahan Data Hasil Penelitian Metode Chesson (Datta 1981) Satu gram sampel kering (berat a) ditambahkan 150 mL H2O dan direfluk pada suhu 100 oC dengan water bath selama 1 jam. Hasilnya disaring, residu dicuci dengan air panas 300 mL. Residu kemudian dikeringkan dengan oven sampai beratnya konstan dan kemudian ditimbang (berat b). Residu ditambah 150 mL H2SO4 1 N, kemudian direfluk dengan water bath selama 1 jam pada suhu 100 oC. Hasilnya disaring dan dicuci sampai netral (300 mL) dan residunya dikeringkan Dengan : Massa A Massa B Massa C Massa D Massa E = Oven dry weight (ODW) awal sampel biomassa lignoselulosa = Oven dry weight (ODW) residu sampel direfluk dengan air panas = Oven dry weight (ODW) residu sampel setelah direfluk dengan 1 N H2SO4 = Oven dry weight (ODW) residu sampel setelah direndam H2SO4 72% dan ditambah H2SO4 1 N kemudian direfluk = Abu dari residu sampel Dinitrosalisilat (DNS) A. Prosedur Pembuatan Larutan Standar Glukosa Sebelum analisa DNS dilakukan perlu membuat larutan standar glukosa terlebih dahulu. Langkah yang pertama dilakukan ialah membuat larutan persediaan dengan cara mencampurkan 0,9 g glukosa dalam 100 mL aquadest. Membuat larutan standar glukosa dengan mengencerkan larutan persediaan (1) dengan pengenceran 1 : 1 (tanpa pengenceran), 1 : 2, 1 : 3, 1 : 4 dan 1 : 5. B. Prosedur Pembuatan Larutan DNS Selanjutnya untuk membuat larutan DNS yang pertama dilakukan ialah melarutkan 16 g NaOH dalam 200 mL aquades, kemudian ditambahkan 10 g larutan DNS dan diaduk menggunakan stirrer sampai benar-benar larut. Melarutkan 30 g NaK-tartrat dan 8 g Nametabisulfit kedalam 500 ml aquadest. Mencampurkan larutan (1) dengan (2) dan ditambahkan aquades sampai 1000 mL. C. Prosedur Pembuatan Kurva Standar Glukosa Setelah membuat larutan standar glukosa dan larutan DNS, selanjutnya membuat kurva standar glukosa yang nanti akan digunakan untuk menganalisa sampel proses fermentasi-ekstraktif. Langkahnya adalah mencampurkan 2 3 mL larutan persediaan yang mengandung glukosa dengan 3 mL larutan DNS. Memanaskan campuran dalam air mendidih selama 15 menit. Lalu mendinginkan campuran menggunakan es atau air mengalir. Mengulangi langkah sebelumnya untuk konsentrasi larutan glukosa berbeda. Mengukur dan mencatat absorbansi pada spektrophotometer dengan panjang gelombang 540 nm. Membuat grafik dengan memplot antara kadar glukosa sebagai gula reduksi dengan absorbansi. D. Prosedur Pembuatan Larutan Blanko Untuk menganalisa perlu larutan blanko. Pembuatan larutan blanko dilakukan dengan mencampurkan 2 mL aquades dengan 3 mL larutan DNS. Memanaskan campuran dalam air mendidih selama 5 menit. Mendinginkan campuran tersebut menggunakan es atau air mengalir. E. Prosedur Analisa Sampel Untuk menganalisa sampel hasil fermentasi-ekstraktif, prosedurnya ialah mencampurkan 2 mL larutan sampel yang telah diencerkan 50 kali menggunakan aquades dengan 3 mL larutan DNS. Memanaskan campuran dalam air mendidih selama 15 menit. Mendinginkan campuran tersebut menggunakan es atau air mengalir. Mengulangi langkah tersebut untuk sampel yang berbeda. Mengukur dan mencatat absorbansi pada spektrofotometer dengan panjang gelombang 540 nm. Mensubstitusi absorbansi yang diperoleh dengan persamaan dari kurva standar glukosa. Pada gambar 1 dapat dilihat bahwa Fungal treatment 2 pada setiap variabel run menunjukkan penurunan kadar lignin dalam TKKS lebih besar dari Fungal treatment 1. Hal ini disebabkan karena pada fungal treatment 2 terdapat penambahan jamur A.niger (AN) dan T.viride (TV) pada hari ke-5 dimana AN memiliki kemampuan mendegradasi lignin sebagai sumber karbonnya sedangkan TV tidak dapat menggunakan karbon pada lignin sebagai sumber karbonnya karena TV hanya bekerja secara spesifik terhadap karbon pada selulosa. Selain itu juga lama waktu 9 hari pada Fungal treatment 2 memungkinkan jamur PC, TH, AN, dan TV mencapai fasa pertumbuhan logaritmiknya yang menyebabkan PC secara optimal menghasilkan enzim pendegradasi lignin berupa lakase, LiP dan MnP sedangkan TH menghasilkan lakase dimana enzim tersebut merupakan enzim yang mampu mendegradasi lignin. LiP mengoksidasi unit non fenolik lignin melalui pelepasan satu elektron dan membentuk radikal kation yang kemudian terurai secara kimiawi. LiP dapat memutus ikatan Cα-Cβ molekul lignin dan mampu membuka cincin lignin dan reaksi lain (Kirk dan Farrell 1987; Hatakka 2001). MnP mengoksidasi Mn2+ menjadi Mn3+ (Hofrichter 2002). Sifat reaktif Mn3+ yang tinggi selanjutnya mengoksidasi cincin fenolik lignin menjadi radikal bebas tak stabil dan diikuti dengan dekomposisi lignin secara spontan (Hatakka 2001, Hofrichter 2002). Laccase mengoksidasi cincin fenolik lignin menjadi radikal fenoksil (Hatakka 2001) III. HASIL DAN PEMBAHASAN Proses fungal treatment dilakukan dengan dua tahapan, fungal treatment 1 dilakukan dari hari ke-0 hingga hari ke-5 dengan menggunakan jamur Phanaerochaete chrysosporium dan Tricodherma harzianum dengan variabel perbandingan 1:1, 2:1, dan 1:2 (%v/v), kemudian dilanjutkan fungal treatment 2 dari hari ke-5 hingga hari ke-9 dengan penambahan jamur Aspergillus niger dan Tricodherma viride sebesar 2:1 (%v/v). Besar perubahan kandungan lignin, selulosa dan glukosa ditampilkan pada gambar 1, 2, 3, 4 dan 5. Gambar. 1. treatment. Grafik kadar lignin yang hilang setelah proses Fungal Gambar. 2. treatment. Grafik kadar selulosa yang hilang setelah proses Fungal Gambar. 3. Grafik kadar hemiselulosa yang hilang setelah proses Fungal treatment. 4 Gambar 2 dan 3 dapat dilihat bahwa penurunan kadar hemiselulosa dan selulosa lebih efektif pada proses fungal treatment 2. Hal ini disebabkan dari struktur TKKS yang merupakan lignoselulotic material yang sebagian besar terdiri dari lignin. Keberadaan lignin disini adalah sebagai dinding yang melapisi selulosa, sehingga jika ingin mendapatkan selulosa maka lignin harus didegradasi terlebih dahulu seperti pada Fungal treatment 2 dimana proses ini merupakan lanjutan dari fungal treatment 1 yang bertujuan untuk mendegradasi lignin dengan menggunakan P.chrysosporium dan T.harzianum kemudian dilanjutkan dengan proses Fungal treatment 2 dengan penambahan A.niger dan T.viride guna menguraikan hemiselulosa dan selulosa yang terdapat didalam TKKS. Gambar. 4. Grafik kadar glukosa yang terbentuk setelah Fungal treatment. Gambar. 5. Grafik persen pembentukan glukosa setelah proses Fungal treatment pada FT 2 terhadap FT 1 Gambar 5 menunjukkan bahwa terdapat kenaikan pembentukan glukosa pada proses fungal treatment 2 terhadap proses fungal treatment 1 untuk masing – masing variabel. Persen pembentukan glukosa tertinggi sebesar 119,95% oleh Fungal treatment 2 dengan perbandingan PC:TH = 2:1 terhadap proses fungal treatment 1. Sedangkan pada treatment yang lain diperoleh % pembentukan glukosa sebesar 109,96% (pada Fungal treatment 2 dengan ration PC:TH = 1:1) dan 118,04% (pada Fungal treatment 2 dengan ration PC:TH = 1:2). Hal ini disebabkan karena adanya jamur P.chrysosporium dan T.harzianum yang mampu mendegradasi lignin pada saat proses fungal treatment 1 sehingga proses hidrolisa selulosa menjadi glukosa oleh A.niger dan T.viride pada fungal treatment 2 berjalan secara efektif dan glukosa yang dibentuk lebih banyak. Sedikitnya kenaikan glukosa pada fungal treatment 2 terhadap fungal treatment 1 disebabkan oleh sedikitnya waktu yang diberikan pada campiran AN dan TV pada saat proses fungal treatment yang hanya memakan waktu 4 hari dibandingkan dengan campuran fungi PC dan TH yang sudah ada selama 9 hari didalam reaktor. Pada gambar 2, 3 dan 4 dapat diketahui bahwa jumlah glukosa yang terbentuk tidak sama dengan jumlah selulosa dan hemiselulosa yang terurai, hal ini terjadi karena pada hidrolisa selulosa dan hemiselulosa menjadi glukosa melalui reaksi secara enzimatis selulosa tidak langsung terhidrolisa menjadi glukosa tetapi menjadi selubiosa terlebih dahulu dan dalam penelitian ini, jumlah selubiosa yang terbentuk tidak dianalisa (Chen ming dkk, 2007). Tidak hanya itu hidrolisa selulosa menjadi glukosa dimungkinkan berlanjut menjadi ethanol yang kemudian hilang karena terjadi penguapan pada saat proses fermentasi. Selain itu faktor kelembaban (moisture) juga berpengaruh terhadap jumlah karbon yang terkonsumsi. Fungi jenis Tricodherma harzianum dan Phanaerochaete chrysosporium umumnya baik hidup pada kelembaban 100 – 200%, sehingga pada kelembaban tersebut karbon yang dikonsumsi lebih banyak. (keller et al, 2003) Dari gambar 1, 2.3, 4 dan 5 dapat dilihat bahwa dari ketiga variabel Run 1 dengan perbandingan PC dan TH sebesar 1:1, Run 2 dengan 2:1, dan Run 3 dengan 1:2 dapat diketahui bahwa Fungal treatment 2 Run 2 dengan perbandingan PC dan TH sebesar 2:1 (%v/v) memiliki tingkat efektifitas yang paling baik. Hal ini ditunjukkan dengan besarnya kadar lignin, hemiselulosa dan selulosa yang hilang pada gambar 1 sebesar 84,72%, gambar 2 sebesar 13,328% dan gambar 3 sebesar 16,209% sedangkan besar kenaikan glukosa yang dihasilkan ditunjukkan pada gambar 5 yaitu sebanyak 119,95% untuk metode DNS dan 134,826% untuk metode HPLC. Hal ini disebabkan karena jamur P.chrysosporium lebih dominan daripada T.harzianum, dimana P.crysosporium ini tidak hanya mampu mendegradasi lignin dengan 3 enzim lignoselulotik seperti lakase, LiP, dan MnP yang mampu mendegradasi lignin secara optimal juga mampu menghasilkan enzim selulotik berupa xylanase dan selulase yang dapat menhidrolisa selulosa menjadi glukosa sedangkan T.harzianum hanya menghasilkan enzim lakase saja yang berfungsi untuk mendegradasi lignin. Adanya T.harzianum ini berfungsi sebagai biokontrol terhadap bakteri penganggu mengingat sifat dari jamur ini patogen terhadap mikroorganisme. Sehingga jalannya proses fungal treatment menjadi lebih optimal. Adanya penambahan A.niger dan T.viride menjadikan proses degradasi lignin dan hidrolisa selulosa menjadi glukosa semakin efektif. Karena jamur A.niger selain menghasilkan enzim yang dapat menghidrolisa selulosa menjadi glukosa juga mampu mendegradasi lignin. Sedangkan T.viride hanya menghasilkan selulotik termasuk endoglukanase, eksoselobiohidrolase, dan b-glikosidase. Ketiga enzim ini bekerja secara sinergis dalam mendegradasi selulosa menjadi glukosa. Sehingga glukosa yang terbentuk pada Fungal treatment 2 lebih tinggi dibandingkan dengan Fungal treatment 1. Lain halnya dengan Run 3 dengan perbandingan PC dan TH sebesar 1:2. Pada variabel ini baik penurunan lignin, selulosa dan hemiselulosa maupun kenaikan glukosa yang dihasilkan memiliki nilai yang paling rendah daripada variabel 5 yang lain yakni sebesar 45,91% untuk lignin, 7,905% untuk selulosa dan 8,581% untuk hemiselulosa sedangkan untuk kenaikan glukosa FT 2 terhadap FT 1 hanya sebesar 118,04%. Hal ini disebabkan karena sifat dari T.harzianum yang bersifat patogen terhadap mikroorganisme lain. Dengan komposisi yang dominan menyebabkan kinerja dari bakteri lain terhambat. Sehingga proses fermentasi degradasi lignin dan hidrolisa selulosa menjadi tidak berjalan dengan baik. IV. KESIMPULAN/RINGKASAN Proses fungal treatment terbaik terdapat pada fungal treatment 2 dengan ratio PC:TH = 2:1, dengan penurunan lignin sebesar 84,72%, penurunan hemiselulosa sebesar 16,209%, penurunan selulosa sebesar 13,328% dan kenaikan glukosa sebesar 119,95%. UCAPAN TERIMA KASIH [12]. Erickson K.E.L., Blanchette R.A., Ander P. 1990. Microbiol and Enzymatic Degradation of Wood and Wood Component. Berlin: Spinger-Verlag.. [13]. Fan, L. T., Y. H. Lee dan M. M. Gharpuray. 1982. The nature of lignocellulosics and their pretreatments for enzymatic hydrolysis. Adv. Biochem. Eng. 23: 158-187. [14]. Fengel, D. dan G. Wegener. 1995. Kayu : Kimia, Ultrastruktur, ReaksiReaksi. Diterjemaahkan oleh Sastrohamidjojo, H. Terjemahan dari : Wood : Chemical, Ultrastructure, Reactions. Gadjah Mada University Press, Yogyakarta. [15]. Gold M.H. and M. Alic. 1993. Molecular biology of the lignindegrading basidiomycete Phanerochaete chrysosporium. Microbiol. Rev. 57:605-622. [16]. Hammel K.E. 1996. Extracellular free radical biochemistry of ligninolytic fungi. New J Chem 20:195-198. [17]. Hammel K.E. 1997. Fungal Degradation of Lignin. Di Dalam: Cadisch G, Giller KE, Editor. Driven By Nature: Plantt Litter Quality And Decompostion. London: CAB International. hlm. 33-45. [18]. Hatakka A. 2001. Biodegradation of lignin. In: Steinbüchel A. [ed] Biopolymers. Vol 1: Lignin, Humic Substances and Coal. Germany: Wiley VCH. pp. 129-180. Penulis mengucapkan terima kasih kepada PT. Petrokimia Gresik yang telah membantu dalam menyediakan bahan baku berupa Tandan Kosong Kelapa Sawit dan fungi yang digunakan dalam penelitian ini. [19]. Hatakka A. 1994. Lignin-modifying enzymes from selected white-rot fungi: production and role in lignin degradation. FEMS Microbiol. Rev. 13: 125-135. DAFTAR PUSTAKA [21]. Highley T.I, T.K Kirk. 1979. Mechanisme of Wood Decay an The Unique Features of Heartrots. Symposium on Wood Decay J. 69 : 1151 – 1157. [1]. Adaskaveg, J.E., R.L. Gilbertson and M.R. Dunlap. 1995. Effects of incubation time and temperature on in vitro seceltive delignification of silver leaf oak by Ganoderma colossum. Appl. Environ. Microbiol. 61:138-144. [2]. Alexopoulos C.J., Mims C.W., Blackwell M. 1996. Introductory Mycology. Ed. Ke-4. New York: John Willey and Sons Inc. [3]. Arif W, Ferry, Musmuriadi. 2004. Jurnal : Pengaruh Berbagai Konsentrasi Mediator Pada Biodelignifikasi Menggunakan Enzim Kasar Lignin Peroksidase. Teknik Kimia ITS, Surabaya. [20]. Herliyana E.N. 1997. Studi Pertumbuhan Fungi White-Rot Phanerochaete chrysosporium Pada Berbagai Macam Suhu, pH Media dan Sumber N. Bogor: Institut Pertanian Bogor. [22]. Higley T.L, Dashek W.V. 1998. Biotechnology in the Study of Brown and White rot Decay. Di dalam : Bruce A, Palfreyman JW, editor. Forest Products Biotechnology. Taylor & Francis Ltd, London. hlm. 15 – 36. [23]. Hofrichter M. 2002. Review: Lignin conversion by manganese peroxidase (MnP). Enzyme Microbiol. Technol.30:454-466. [24]. Howard, R.T., Abotsi, E., Jansen van Rensburg, E.L and Howard, S., 2003, Lignocellulose Biotechnology : Issue of Bioconversion and Enzymes Production, African Journal of Biotech., 2. 602-619 [4]. Bajpai S.M and Anantharaman, N., 2006, Activity Enhancement of Ligninolytic Enzymes of Trametes versicolor with Bagasse Powder, African Journal of Biotech.,5, 189-194 [5]. Blanchette R.A. 1995. Degradation of lignocellulose complex in wood. Can. J. Bot. 73 (Suppl. 1):S999-S1010. [25]. Johjima T., N. Itoh, M. Kabuto, F. Tokimura, T.Nakagawa. H. Wariishi and H. Tnaka. 1999. Directinteraction of lignin and lignin peroxidase fromPhanerochaete chrysosporium. Proc. Natl. Acad. Sci. 96:19891994. [6]. Blanchette R.A., K.R. Cease and A.R. Abad. 1991. An evaluation of different forms of deterioration found in archaeological wood. Int. Biodeter. 28:3-22. [26]. Kirk KT, Chang HM. 1990. Biotechnology in Pulp and Paper Manufacture. New York: Butterworth-Heinemann. [7]. Chahal P.S. and D.S. Chahal. 1998. Lignocellulosic Waste: Biological Conversion. In: Martin, A.M. [eds]. Bioconversion of Waste Materials to Industrial Products. Ed ke-2. London: Blackie Academic & Professional. pp. 376-422. [8]. Darnoko, Z. Poeloengan & I. Anas 1992. Pembuatan pupuk organik dari tandan kosong kelapa sawit. Buletin Penelitian Kelapa Sawit, 2 , 89-99. [9]. Direktorat Jenderal Perkebunan. Perkebunan Kelapa Sawit www.ditjenbun.go.id.[26 July 2008] 2008. Pendataan Lengkap Indonesia Tahun 2008. [10]. Djumali Mangunwidjaja., Anas M.F., Sukardi., Wagiman. 2009. Rekayasa Produksi Bioetanol Dari Biomassa Lignoselulosa Tanaman Jagung Sebagai Energi Terbarukan. [11]. Dumanauw JF. 2001. Mengenal Kayu. Yogyakarta: Kanisius. [27]. Kirk T.K. and R.L. Farrell. 1987. Enzymatic “combustion”:the microbial degradation of lignin. Ann. Rev. Microbiol. 41,465-505. [28]. Kuhad, R.C., Singh, A. and Eriksson, K.E.L. (1997) Mi-croorganisms and enzymes involved in the degradation of plant fiber cell walls. Advances in Biochemical Engi-neering/Biotechnology, 57, 45-125. doi:10.1007/BFb0102072 [29]. Lynd L.R., P.J. Weimer, W.H. van Zyl WH and I.S. Pretorius. 2002. Microbial Cellulose Utilization: Fundamentals and Biotechnology. Microbiol. Mol. Biol. Rev. 66(3):506-577. [30]. Orth A.B., D.J. Royse, M. Tien. 1993. Ubiquity of lignindegrading peroxidases among various wood-degrading fungi. Appl Environ Microbiol 59:4017-4023. [31]. Perez J., J. Munoz-Dorado, T. de la Rubia and J. Martinez. 2002. Biodegradation and biological treatments of cellulose, hemicellulose and lignin: an overview. Int. Microbiol. 5:53-63. 6 [32]. Purwito dan Firmanti A. 2005. Pemanfaatan Limbah Sawit Untuk Bahan Pencegah Serangan Rayap Tanah. Pusat Penelitian dan Pengembangan Perkebunan. 89 hal. [33]. Pusat Penelitian Kelapa Sawit. 2008. Aplikasi Kompos TKS Pada Kelapa Sawit TM. Publikasi Pusat Penelitian Kelapa Sawit. Medan. [34]. Rayner A.D.M., Boddy L. 1988. Fungal decomposition of wood. Great Britain: John Wiley & Sons. [35]. Richana N, Prastowo B, Purwantana B, Nuralamsyah A. 2011. Diversifikasi Tandan Kosong Kelapa Sawit Untuk Biofuel Generasi 2 dan Reduksi 3 MCPD. Pusat Penelitian dan Pengembangan Perkebunan. 106 hal. [36]. Setyamidjaja D. 2006. Kelapa Sawit. Yogyakarta: Kanisius. [37]. Sjöberg, G. 2003. Lignin degradation: Long-term effects of nitrogen addition on decomposition of forest soil organic matter. [disertasi]. Uppsala: Dep. Soil Sci. Swedish University of Agricultural Sciences. [38]. Sjostrom, Eero.1995. Kimia Kayu, Dasar-dasar dan Penggunaan Edisi Kedua [39]. Steffen, K.T. 2003. Degradation of recalcitrant biopolymers and polycyclic aromatic hydrocarbons by litter-decomposing basidiomycetous fungi. [disertasi]. Helsinki: Division of Microbiology Department of Applied Chemistry and Microbiology Viikki Biocenter, University of Helsinki [40]. Sun, Y., dan Cheng, J. 2002. Hydrolysis of lignocellulosic materials for ethanol production: a review. Bioresour. Technol. 83, 1 – 11. [41]. Syafwina, Honda Y, Watanabe T, Kuwahara M. 2002. Pretreatment of Oil Palm Empty Fruit Bunch by White Rot Fungi for Enzymatic Saccharification. Wood Res. 89: 19-20. [42]. Vähätalo A.V., K. Salonen, M. Salkinoja-Salonen and A. Hatakka. 1999. Photochemical mineralization of synthetic lignin in lake water indicates rapid turnover of aromatic organic matter under solar radiation. Biodegradation 10:415-420. [43]. YSI Model 50B: Dissolver Oxygen Meter Instruction