File - Siti Suroyalmilah
advertisement

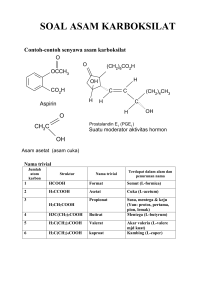
BAB I PENDAHULUAN 1.1 Latar Belakang Suatu asam karboksilat adalah suatu senyawa yang mengandung gugusan karboksil, suatu istilah yang berasal dari karbonil dan hidroksil. Gugusan yang terikat pada gugusan karboksil dalam asam karboksilat bisa gugus apa saja, bahkan bisa gugus karboksil lain. Dalam asam karboksilat gugus -COOH terikat pada gugus alkil (-R) atau gugus aril (-Ar). Meskipun yang mengikat gugus –COOH dapat berupa gugus alifatik atau aromatic, jenuh atau tidak jenuh, tersubstitusi atau tidak tersubstitusi sifat yang diperlihatkan oleh gugus –COOH tersebut pada dasarnya sama. Di samping terdapat asam yang mengandung satu gugus karboksil (asam monokarboksilat), diketahui juga terdapat asam yang memiliki dua gugus karboksil (asam dikarboksilat) dan tiga buah gugus karboksil (asam trikarboksilat). Perbedaan banyaknya gugus – COOH ini tidak mengakibatkan perubahan sifat kimia yang mendasar. Asam karboksilat tergolong asam lemah karena hanya sedikit terionisasi dalam air. Pada saat kesetimbangan, sebagian besar asam berada dalam bentuk molekul yang tidak terionisasi. Konstanta disosiasi, Ka, asam karboksilat, dimana R sebagai gugus alkil, adalah 10-5 atau kurang. Derivat asam karboksilat merupakan turunan asam karboksilat, dimana ditinjau dari strukturnya senyawa yang diperoleh dari hasil pergantian gugus – OH dalam rumus struktur RCOOH oleh gugus –NH2, -OR, atau –OOCR. Dalam derivat asam karboksilat ini lebih spesifik membahas halida asam, anhidrida asam, ester, amida, dan nitril. Semua turunan asam karboksilat 1 mempunyai gugus fungsi asil (RCO-) atau aril (ArCO-) dan bila dihidrolisis menghasilkan asam karboksilat. Adanya gugus karbonil menyebabkan turunan asam karboksilat bersifat polar, dan kepolaran ini yang berpengaruh terhadap sifat-sifat yang ada pada turunan asam karboksilat. Agar lebih memahami mengenai senyawa asam karboksilat dan turunannya serta pengujiannya maka disusunlah makalah ini. 1.2 Tujuan Penulisan Adapun tujuan dari penulisan makalah ini adalah agar mahasiswa memahami senyawa asam karboksilat dan turunannya serta pengujiannya. 2 BAB II PEMBAHASAN Suatu asam karboksilat adalah suatu senyawa organik yang mengandung gugus karboksil, –COOH. Gugus karboksil mengandung gugus karbonil dan sebuah gugus hidroksil; antar aksi dari kedua gugus ini mengakibatkan suatu kereaktifan kimia yang unik dan untuk asam karboksilat. Asam organik yang paling penting adalah asam-asam karboksilat. Gugus fungsinya adalah gugus karboksil, kependekan dari dua bagian yaitu gugus karbonil dan hidroksil. Rumus asam karboksilat dapat dipanjang dan atau dipendekkan seperti : Ciri-ciri asam karboksilat: - Mengandung gugus COOH yang terikat pada gugus alkil (R-COOH) maupun gugus aril (Ar-COOH). - Kelarutan sama dengan alkohol. - Asam dengan jumlah C 1 – 4 : larut dalam air. - Asam dengan jumlah C = 5 : sukar larut dalam air. - Asam dengan jumlah C > 6 : tidak larut dalam air. - Larut dalam pelarut organik seperti eter, alkohol, dan benzen. - TD asam karboksilat > TD alkohol dengan jumlah C sama. Suatu asam karboksilat adalah suatu senyawa organik yang mengandung gugus karboksil, –COOH. Gugus karboksil mengandung gugus karbonil dan sebuah gugus hidroksil; antar aksi dari kedua gugus ini mengakibatkan suatu kereaktifan kimia yang unik dan untuk asam karboksilat. 3 Asam format terdapat pada semut merah (asal dari nama), lebah, jelatang dan sebagainya (juga sedikit dalam urine dan peluh). Sifat fisika: cairan, tak berwarna, merusak kulit, berbau tajam, larut dalam H2O dengan sempurna. Sifat kimia: asam paling kuat dari asam-asam karboksilat, mempunyai gugus asam dan aldehida. Asam asetat (CH3COOH) sejauh ini merupakan asam karboksilat yang paling penting diperdagangan, industri dan laboratorium. Bentuk murninya disebut asam asetat glasial karena senyawa ini menjadi padat seperti es bila didinginkan. Asam asetat glasial tidak berwarna, cairan mudah terbakar (titik leleh 7ºC, titik didih 80ºC), dengan bau pedas menggigit. Dapat bercampur dengan air dan banyak pelarut organik. Adapun sifat-sifat yang dimiliki oleh asam karboksilat adalah: 1. Reaksi Pembentukan Garam Garam organik yang membentuk dan memiliki sifat fisik dari garam anorganik padatannya, NaCl dan KNO3 adalah garam organik yang meleleh pada temperatur tinggi, larut dalam air dan tidak berbau. Reaksi yang terjadi adalah: HCOOH + Na+ → HCOONa + H2O 2. Reaksi Esterifikasi Ester asam karboksilat ialah senyawa yang mengandung gugus –COOR dengan R dapat berbentuk alkil. Ester dapat dibentuk berkat reaksi langsung antara asam karboksilat dengan alkohol. Secara umum reaksinya adalah: RCOOH + R’OH → RCOOR + H2O 3. Reaksi Oksidasi Reaksi terjadi pada pembakaran atau oleh reagen yang sangat kokoh dan kuat seperti asam sulfat, CrO3, panas. Gugus asam karboksilat teroksidasi sangat lambat. 4. Pembentukan Asam Karboksilat 4 Beberapa cara pembentukan asam karboksilat dengan jalan sintesa dapat dikelompokkan dalam 3 cara yaitu: reaksi hidrolisis turunan asam karboksilat, reaksi oksidasi, reaksi Grignat (Fessenden, 1986). Asam karboksilat, dengan basa akan membentuk garam dan dengan alkohol menghasilkan eter. Banyak dijumpai dalam lemak dan minyak, sehingga sering juga disebut asam lemak. Pembuatannya antara lain melalui oksidasi alkohol primer, sekunder atau aldehida, oksidasi alkena, oksidasi alkuna hidrolisa alkil sianida (suatu nitril) dengan HCl encer, hidrolisa ester dengan asam, hidroilisa asil halida, dan reagen organolitium (Wilbraham, 1992). Derivat asam karboksilat ialah senyawa yang menghasilkan asam karboksilat apabila dihidrolisis. Tidak seperti aldehida dan keton, turunan dari asam karboksilat mengandung gugus yang tinggal, gugus elektronegatif yang dapat hilang sebagai anion (X- atau RCO2-) atau sebagai anion terprotonasi (ROH atau R2NH). Dan perlu diketahui bahwa semua derivat mengandung gugus asil, RCO-, kecuali nitril. Dalam derivat asam karboksilat mengandung gugus pergi yang terikat pada karbon asil, sedangkan aldehida dan keton tidak. Biasanya reagensia mengadisi pada gugus karbonil dari keton atau aldehida, tetapi mensubstitusi pergi tersebut dalam derivat asam. Spektra nomor dari derivat asam karboksilat memberikan sedikit informasi mengenai fungsionalitas dibandingkan dengan spektra inframerah yang memberikan lebih banyak informasi mengenai tipe gugus fungsional. 1. Halida asam Absorpsi inframerah karbonil dari klorida asam dijumpai pada frekuensi yang sedikit lebih tinggi daripada resapan untuk derivat asam lainnya. Klorida asam adalah turunan asam karboksilat yang paling reaktif. Reaktivitas turunan asam karboksilat ditentukan oleh kebasaan gugus perginya. Basa yang lemah bersifat lebih elektronegatif, selain itu kecil kemungkinannya menyumbangkan elektronnya pada karbon karbonil levat efek resonansi. Ion 5 halida adalah basa sangat lemah karena asam konjugasinya adalah asam kuat. Oleh karena itu, asam halida lebih reaktif dibandingkan turunan asam karboksilat lainnya (Usman, 2013). Fluorida, kloridaq, bromida dan iodida asam semuanya bereaksi serupa. Karena klorida asam yang paling populer dari halida asam, maka diskusi dibatasi hanya mengenai senyawa ini. a) Tatanama klorida asam Halida asam diberi nama menurut nama asam karboksilat induknya, dengan imbuhan asam-at diubah menjadi –il klorida. b) Pembuatan klorida asam Klorida asam dapat diperoleh langsung dari asam karboksilat induk melalui reaksi dengan tionil klorida (SOCl2) atau zat penghalogen lainnya, seperti PCl3. c) Reaksi kloridada asam Halida asam merupakan yang paling reaktif diantara semua derivat asam karboksilat. Oleh karena itu ketika terikat pada karbon positif dari gugus karbonil, ion ini lebih mudah ditukargantikan dari pada bila terikat pada karbon alkil. 1) Reaksi dengan alkohol Klorida asam bereaksi dengan alkohol untuk menghasilkan ester dan HCl dalam suatu reaksi yang beranologi langsung hidrolisis. Biasanya HCl segera dibuang dari dalam campuran reaksi setelah terbentuk, dan piridina ditambahkan sebagai penyapu HCl. 2) Reaksi dengan amonia dan amina Produk organik dari reaksi adalah suatuamida. 3) Reaksi dengan senyawa organologam Suatu halida asam bereaksi dengan keanekaragaman nukleofil, termasuk senyawa organologam. Seperti reagensia grignard (Fessenden, 1986). 6 2. Anhidrida Pada umumnya anhidrida menunjukkan peak karbonil rangkap dalam spektrum inframerahnya (Usman, 2013). Asam anhidrida mempunyai dua molekul asam karboksilat di mana sebuah molekul airnya dihilangkan. (Anhidrida berarti ”suatu senyawa tanpa air”). Misalnya dua molekul asam etanoat dan menghilangkan satu molekul air maka didapat anhidrida etanoat (nama lama: anhidrida asetat). a) Tata Nama Anhidrida Pemberian nama untuk anhidrida asam cukup mengambil nama asam induk, dan mengganti kata "asam" dengan "anhidrida". "Anhidrida" berarti "tanpa air". Dengan demikian, asam etanoat akan menjadi anhidrida etanoat; asam propanoat menjadi anhidrida propanoat, dan seterusnya. Untuk anhidrida asam yang tidak simetri penamaanya dilakukan secara alfabetik. b) Pembuatan Anhidrida Salah satu pengeculian, anhidrida asam tidak dapat dibentuk langsung dari asam karboksilat induknya, tapi harus dibuat dari derivat asam karboksilat yang lebih reaktif. Ada dua cara pembuatan anhidrida, yang pertama menggunakan klorida asam dan suatu karboksilat. Yang kedua dengan mengolah asam karboksilat dan anhidrida asam asetat, reaksinya reversibel. Letak kesetimbangan dapat di geser ke kanan dengan menyuling asam asetat segera setelah asam ini terbentuk. c) Reaksi Anhidrida Anhidrida asam tidak bereaksi dengan natrium klorida atau natrium bromida hal ini karena ion halida merupakan basa yang lebih lemah dari pada ion karboksilat. Karena dengan adanya ion halida sebagai basa yang lebih lemah, akan mengusir substituen dari intermediate tetrahedral. Anhidrida asam bereaksi dengan alkohol membentuk ester dan suatu asam karboksilat, dengan air membentuk dua karboksilat yang sama dan dengan amina membentuk suatu amida dan ion karboksiat. Dalam setiap reaksi, 7 adanya nukleofil akan dilepaskan proton karena merupkan basa yang lebih kuat dari pada ion karboksilat. Pada reaksi antara amina dengan anhidrida, dua senyawa ekuivalen dari amina atau satu amina ditambah dengan amina tersier seperti piridin harus digunakan untuk bereaksi dengan proton yang dihasilkan dari reaksi. 1) Reaksi Anhidrida Asam dengan Amonia dan Amina Primer Amonia dan amina primer masing-masing mengandung sebuah gugus NH2. Pada amonia, gugus ini terikat pada sebuah atom hidrogen sedangkan pada amina primer terikat pada sebuah gugus alkil (disimbolkan dengan "R" pada gambar berikut) atau pada sebuah cincin benzena (Fessenden, 1986). Sifat-sifat fisik anhidrida asam Untuk menjelaskan sifat-sifat anhidrida asam, dapat diambil contoh anhidrida etanoat sebagai anhidrida asam sederhana. Anhidrida etanoat merupakan cairan yang tidak berwarna dengan bau yang sangat mirip dengan asam cuka (asam etanoat). Bau ini timbul karena anhidrida etanoat bereaksi dengan uap air di udara (dan kelembaban dalam hidung) menghasilkan asam etanoat kembali. Kelarutan dalam air Anhidrida etanoat tidak bisa dikatakan larut dalam air karena dia bereaksi dengan air menghasilkan asam etanoat. Tidak ada larutan cair dari anhidrida etanoat yang terbentuk Titik didih Anhidrida etanoat mendidih pada suhu 140°C. Titik didih cukup tinggi karena memiliki molekul polar yang cukup besar sehingga memiliki gaya dispersi van der Waals sekaligus gaya tarik dipol-dipol. Akan tetapi, anhidrida etanoat tidak membentuk ikatan hidrogen. Ini berarti bahwa titik didihnya tidak sama tingginya dengan titik didih asam 8 karboksilat yang berukuran sama. Sebagai contoh, asam pentanoat (asam yang paling mirip besarnya dengan anhidrida etanoat) mendidih pada suhu 186°C (Ouelette, 1995). 3. Ester Absorpsi inframerah karbonil dari ester alifatik sekitar 1740 cm-1 (5,75 m), tetapi ester terkonjugasi menyerap pada frekuensi sedikit lebih rendah. Ester adalah salah satu senyawa organik yang sangat berguna, dapat diubah menjadi anekaragam senyawa lain. Ester adalah suatu senyawa organik yang terbentuk melalui penggantian satu atau lebih atom hidrogen pada gugus hidroksil dengan suatu gugus organik. Ester banyak dijumpai dalam alam misalnya lemak dan lilin. Ester atsiri menyebabkan dalam banyak buah dan parfum (Usman, 2013). Nama, bau, dan titik didih Nama trivial Struktur Bau T.d.˚C metil asetat CH3CO2CH3 Enak 57,5 propil asetat CH3CO2CH2CH2CH3 seperti buah 102 pear isobutil propionat CH3CH2CO2CH2CH(CH3) seperti rum 137 seperti 220 2 metil salisilat gandapura (wintergreen) Citarasa sintetik jarang dapat menyamai citarasa alamiah yang sesungguhnya. a) Tata Nama Ester Nama suatu ester terdiri dari dua kata yang pertama nama gugus alkil yang terikat pada oksigen ester, yang kedua berasal dari nama asam 9 karboksilatnya, dengan menghilangkan kata asam (inggris: -ic acid menjadi –ate). b) Pembuatan Ester Dalam hal ini terdapat beberapa metode untuk memenuhi perubahan bentuk tersebut, termasuk reaksi SN2 dari suatu anion karboksilat dengan suatu alkil halide primer. Ester dapat juga disintesis melalui reaksi substitusi asil nukleofilik dari asam karboksilat dengan alkohol. Fischer and Speier menemukan (1895) bahwa ester secara sederhana dihasilkan dari pemanasan asam karboksilat dalam suatu larutan alkohol yang mengandung sejumlah kecil katalis asam kuat. Hasil yang baik pada reaksi esterifikasi Fischer, tetapi kebutuhan untuk penggunaan alkohol berlebih sebagai pelarut membatasi metode untuk sintesis ester metil, etil dan propel (Fessenden, 1986). c) Reaksi Ester Suatu ester bereaksi dengan air membentuk suatu asam karboksilat dan alkohol. Ini merupakan suatu contoh reaksi hidrolisis – suatu reaksi dengan air yang mengubah satu senyawa menjadi dua senyawa. Suatu ester bereaksi dengan alkohol membentuk ester baru dan alkohol baru. Ini merupakan contoh reaksi alkoholisis. Reaksi alkoholisis tertentu ini disebut juga reaksi transesterifikasi sebab satu ester dirubah menjadi ester lain.Hidrolisis dan alkoholisis dari suatu ester merupakan reaksi sangat lambat sebab air dan alkohol merupakan nukleofil lemah dan ester memiliki gugus pergi yang sangat basa. Hidrolisis dan alkoholisis ester dapat dikatalisis dengan asam. Kecepatan hidrolisis dapat ditingkatkan dengan ion hidroksida dan kecepatan alkoholisis dapat ditingkatkan dengan basa konjugasi (RO¯) dari alkohol reaktan. Ester juga bereaksi dengan amina membentuk amida. Reaksi dengan amina mengubah satu senyawa menjadi dua senyawa yang disebut aminolisis. Sebagai catatan bahwa aminolisis dari ester membutuhkan hanya satu ekuivalen amina, tidak seperti aminolisis dari suatu asil halida atau asam anhidrida, yang membutuhkan dua ekuivalen. Reaksi dari ester 10 dengan amina tidak selambat reaksi dari ester dengan air dan alkohol, sebab amina merupakan nukleofil yang lebih baik. Ini merupakan keuntungan sebab kecepatan reaksi dari reaksi ester dengan amina tidak ditingkatkan dengan asam atau HO¯ atau RO¯. Ester dapat disintesis dengan mereaksikan asam karboksilat dan alkohol menggunakan katalis asam yang disertai pemanasan. Pembuatan ester dengan cara demikian disebut esterifikasi Fischer. Reaksi esterifikasi Fischer merupakan reaksi kesetimbangan (reversibel), sehingga untuk mendapatkan hasil ester yang banyak dapat dilakukan dengan menggunakan alkohol berlebih (Matsjeh, 1993). Namun demikian, reaksi ini tidak berlaku untuk asam lemak tak jenuh rantai panjang karena katalis asam sulfat adalah zat pengoksidasi kuat sehingga asam lemak tersebut akan teroksidasi/pecah, oleh karena itu penangananya harus hati-hati. Sedangkan bila menggunakan asam klorida sebagai katalis, makaalkohol yang digunakan harus benar-benar kering dan asam kloridanya anhidrat Disamping itu, reaksi etserifikasi ini juga terbatas untuk asam karboksilat rantai panjang, dimana makin panjang rantai atau makin besar gugus karboksilat tersebut maka reaksi makin lambat dan sulit terbentuk (Morrison and Boyd, 1987). 4. Amida Posisi resapan gugus karbonil suatu amida beranekaragam dan tergantung pada sejauh mana pengikatan hidrogen antara molekul-molekul. Spektrum inframerah dari suatu amida cair murni menunjukkan suatu peak yang disebut pita amida I. Dalam amida ini dibedakan dengan amida primer, amida sekunder, dan amida tersier. Amida adalah senyawa yang sangat tidak reaktif, karena protein terdiri dari asam amino yang dihubungkan oleh ikatan amida. Amida tidak bereaksi dengan ion halida, ion karboksilat, alkohol, atau air karena dalam setiap kasus, nukleofil yang masuk adalah basa lemah dari 11 gugus pergi amida. Amida dapat digunakan untuk identifikasi asam yang berbentuk cair, untuk sintesis nilon, dan formamida berbentuk cair, sebagai pelarut (Usman, 2013). a) Tata nama Amida Suatu amida ialah suatu senyawa yang mempunyai suatu nitrogen trivalen yang terikat pada suatu gugus karbonil. Suatu amida diberi nama dari nama asam karboksilat induknya, dengan mengubah imbuhan asam ....-oat (atau -at) menjadi –amida. b) Pembuatan Amida Amida disintesis dari derivat asam karboksilat dan amonia tau amina yang sesuai. c) Reaksi Amida Seperti ester amida dapat dihidrolisis dalam larutan asam amupun basa. Dalam kedua hal ini, asam dan basa adalah pereaksi, bukan katalis, dan harus digunakan dengan angka banding molar 1:1, atau berlebih. Reduksi amida dengan litium alumunium hidrida mengubah gugus karbonil menjadi –CH2; produknya adalah amina. Natrium borohidrida tidak mereduksi amida (Fessenden, 1986). 5. Nitril Resapan CN dijumpai dalam daerah ikatan rangkap tiga dari spektrum inframerah dan dengan intensitas antara medium ke lemah. Nitril merupakan senyawa organik yang mengandung rangkap 3 antara atom karbon dan nitrogen. Gugus fungsional dalam nitril adalah gugus siano (Usman, 2013). a) Tata nama nitril Dalam sistem IUPAC, banyaknya atom karbon menentukan induk alkananya, nama alkana itu diberi akhiran –nitril. Pemberian nama dengan menggantikan imbuhan asam –at menjadi akhiran –nitril, atau –onitril. b) Pembuatan Nitril 12 Ion CN- merupakan nukleofil yang baik unruk menukarganti SN2 suatu ion halida dari suatu alkil halida. Reaksi ini merupakan jalur utama menuju nitril; akan tetapi karena adanya reaski eliminasi, rendemen tinggi hanya diperoleh dengan halida alkil primer dan dengan rendemen renda dengan halida alkil sekunder. c) Reaksi Nitril Nitril dikelompokkan dalam derivat asam karboksilat karena hidrolisisnya menghasilkan asam karboksilat. Nitril dapat dihidrolisis dengan memanaskannya dengan asam atau basa berair (Fessenden, 1986). Derivat asam karboksilat yang terdiri dari halida asam (klorida asam), anhidrida, ester, amida, dan nitril dapat dibedakan dari sifat hidrolisis dengan air. Anhidrida mudah terhidrolisis dalam larutan berair membentuk asam karboksilat. Klorida asam merupakan senyawa reaktif yang mudah terhidrolisis secara cepat dengan air. Hasil hidrolisis diperoleh asam karboksilat dan asam klorida. Senyawa ester dihidrolisis pada suasana netral. Tetapi pada kondisi asam atau basa mudah terhidrolisis menjadi asam karboksilat dan alkohol. Untuk amida tidak mengalami hidrolisis pada keadaan netral. Hidrolisis dapat terjadi pada sushu tinggi dan konsentrasi asam yang pekat. Hasil dari hidrolisis berupa asam karboksilat dan amina. Klorida asam, anhidrida, ester, dan amida dapat dideteksi dengan reaksi hidroksilamin. Hasil reaksi ini berupa asam hidroxamik yang bisa direaksikan dengan ferri klorida membentuk senyawa komplek berwarna merah kebiru-biruan. Klorida asam dan anhidrida bereaksi dengan hidroksil amin secra cepat dalam suasana asam sedang ester dalam kondisi asam tidak dapat bereaksi dengan hidroksil amin. Amida hanya dapat bereaksi dengan hidroksil amin apabila direfluks menggunakan pelarut titik didih tinggi. Untuk dapat membedakan kompleks FeCl3 dari asam hidroxamik dan fenol, maka sebelum dilakukan test ini perlu terlebih dahulu dideteksi adanya fenol. Keberadaan fenol dalam campuran ini dapat mengacaukan warna senyawa kompleks yang diperoleh apakah dari fenol atau dari asam hidroxamik. Jika terdapat fenol dalam senyawa ini, maka test ini tidak dapat dilakukan (Rosilawati, 2014) 13 BAB III PENUTUP 3.1 Kesimpulan Berdasarkan pembahasan yang dilakukan diperoleh kesimpulan sebagai berikut: 1. Asam karboksilat mengandung gugus karboksil (-COOH) yang terdiri dari sebuah gugus karbonil dan sebuah gugus hidroksil. 2. Derivat asam karboksilat menghasilkan asam karboksilat apabila dihidrolisis. 3. Derivat asam karboksilat terdiri dari halida asam, anhidrida, ester, amida, dan nitril. 4. Klorida asam, anhidrida, ester, amida, dan nitril dapat dibedakan dari sifat hidrolisis dengan air. 5. Klorida asam, anhidrida, ester, dan amida dapat dideteksi dengan reaksi hidroksilamin. 6. Hasil dari reaksi hidroksilamin berupa asam hidroxamik yang bila direaksikan dengan ferri klorida membentuk senyawa komplek berwarna merah kebiru-biruan. 14 15 16