GUGUS FUNGSI SENYAWA KARBON DILINGKUNGAN
advertisement

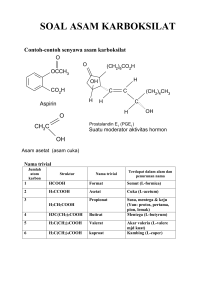
GUGUS FUNGSI SENYAWA KARBON DILINGKUNGAN : Halogen, oksigen, hidroksil karbonil, karboksilat Nitro, phospor, sulfur ALKOHOL (R-OH) Merupakan produk primer oksidasi hidrokarbon (namun reaksi ini tidak bisa secara alamiah dihentikan dengan alkohol sebagai produk akhir) R-H + ½ O2 R-OH Klasifikasi alkohol Alkohol primer ( R-OH) Alkohol Skunder ( R-CH(OH)-R) Alkohol Tersier (R-CR(OH)-R) Contoh Alkohol yang umum Methanol (CH3OH) atau methyl alcohol, biasanya digunakan dalam sintetis senyawaan organik, dihasilkan dari methana yang direaksikan dengan uap air dengan katalis dan tekanan tinggi atau dihasilkan dari hidrogenasi CO. Ethanol (CH3CH2OH) atau ethyl alcohol, untuk sintesis, produk minuman atau medis. Dihasilkan dari proses fermentasi starch (corn, wheat, rice, potatoes) menjadi (C12H22O11) dst Starch + water enzime of malt maltose Maltose + water enzime of yeast glucose Glucose fermentation CO2 + C2H5OH Isopropanol (isopropylalcohol), dihasilkan dari proses hidrasi propylen yang diperoleh dari cracking petroleum. n-Butanol (n-butylalcohol) digunakan sebagai bahan baku butyl asetat (pelarut organik) Methanol, ethanol, isopropanol larut dengan baik di air sedangkan n-buthanol sangat sedikit larut di air (karena adanya kemampuan membentuk ikatan hidrogen dan dominasi ke-tidakpolaran senyawaan alkohol) SIFAT FISIK ALKOHOL Alkohol rantai pendek larut di air karena dominasi kekuatan gugus hidroksil Makin besar jumlah atom C dalam deret homolog, titik leleh dan titik didih makin besar, kelarutan di air turun Sg, makin besar dengan bertambahnya berat molekul (methanol Sg = 0.791, ethanol = 0.789, propanol = 0.800, butanol = 0.810, Decanol = 0.830) POLIHIDROKSI ALKOHOL Alkohol yang mempunyai gugugs OH > 1 dalam satu molekul 2 gugus OH dalam 1 molekul = glycol contoh ethylen glycol, senyawaan yang digunakan dalam anti beku radiator 3 gugus OH dalam 1 molekul = glycerol atau glyserin atau trihidroxy alcohol (1,2,3trihydroxypropane)[CH2(OH)CH(OH)CH2(OH) ] merupakan hasil yang cukup besar dalam industri sabun hasil saponifikasi minyak dan lemak REAKSI KIMIA ALKOHOL Pembentukan ester Organik : ROH + RCOOH Anorganik : ROH + H2SO4 Oksidasi RCOOR ROSO3R Alkohol primer dioksidasi menjadi aldehid Alkohol skunder dioksidasi menjadi ketone Alkohol tersier tidak bisa dioksidasi biasa dalam larutan air. Ketika dioksidasi dengan oksidator sangat kuat akan dihasilkan CO2 dan H2O Mikroorganisme dalam kondisi aerobik akan mengoksidasi alkohol primer dan skunder menghasilkan CO2 dan H2O dengan aldehid atau ketone sebagai intermediate ALDEHID DAN KETONE Aldehid primer (RCHO) produk oksidasi alkohol Aldehid juga bisa dihasilkan dari proses ozonisasi hidrokarbon tak jenuh menjadi ozonida yang direaksikan dengan air dengan byproduct H2O2 biasanya dikatalis oleh oksida nitrogen Menyebabkan iritasi mata Contoh aldehid adalah formaldehid (hasil oksidasi methanol), sangat toksik bagi m.o. Acetaldehyde (hasil oksidasi ethanol) Ketone (RCOR) produk oksidasi alkohol sekunder, contoh aceton (hasil oksidasi isopropil alkohol) dan methyl ethyl ketone hasil oksidasi 2-butanol SIFAT KIMIA ALDEHID DAN KETON Aldehid lebih mudah dioksidasi menjadi asam karboksilat yang sesuai Ketone lebih sulit untuk dioksidasi. Hasil oksidasi dengan oksidator yang kuat, akan menghasilkan pemecahan gugus alkil dari keton sehingga akan dihasilkan dua asam atau lebih sebagai produk ASAM ORGANIK ATAU ASAM KARBOKSILAT Hasil oksidasi tertinggi dari senyawaan organik. Oksidasi lebih lanjut terhadap asam akan menghasilkan CO2 dan H2O CH4 ------CH3OH -------H2C=O------HCOOH HCOOH ------ H2O + CO2 COOH atau –C=O adalah gugus karboksil OH ASAM KARBOKSILAT JENUH ATAU TIDAK JENUH Asam karboksilat jenuh Banyak terdapat di konstituen alam seperti fats, oils, waxes Sifat fisik, C1 - C9 biasanya berfasa liquid pada suhu ruang, C lebih besar berbentuk grease Asam format, asam asetat, dan asam propionat berbau menyengat C1 – C5 cukup larut di air dan juga sangat volatil Penamaan (tata nama) Atom C setelah gugus karboksilat berturut turut disebut dengan C alfa, C betha, C gamma dst Nama nama lain menurut penamaan umum seperti asam :format, asetat: propionat, butirat, valerat, kaproat dsb Nama IUPAC untuk asam ini antara lain metanoat, etanoat, propanoat, butanoat, pentanoat dst tergantung jumlah atom C dalam asam tersebut Asam monokarboksilat tak jenuh (terdapat ikatan rangkap pada alkil-nya) Asam akrilat : digunakan sebagi bahan polimer, turunannya digunakan sebagai polimer plastik seperti lucite dan fleksiglass Asam oleat, linoleat, linolenat Merupakan konstituen normal dari gliserida minyak dan lemak Sifat kimia asam karboksilat Dapat bereaksi dengan logam membentuk metallic salts Asam lemak tak jenuh reaktifitasnya dipengaruhi jumlah ikatan tak jenuhnya Asam tak jenuh dapat dihidrogenasi membentuk asam jenuh Asam organik berfungsi sebagai food untuk m.o. dan mudah dioksidasi menjadi air dan carbon diokasida Laju oksidasi meningkat dengan adanya ikatan tak jenuh Proses biologis m.o. terhadap asam lemak sangat dibatasi kelarutan asam tsb di air Asam polikarboksilat (-(COOH)2) adalah asam karboksilat yang mempunyai 2 gugus karboksilat. Contoh asam oksalat, asam adipat (digunakan dalam industri fiber dan nilon) dan biasanya ada pada limbah industri tsb Asam hidroksi (HO – R – COOH) adalah asam karboksilat yang mempunyai gugus OH dalam senyawaannya. Sehingga mempunyai sifat kimia sebagai asam dan alkohol. Contoh asam laktat (asam α-hidroksipropionat) hasil fermentasi susu dan juga terdapat pada limbah industri makanan. Asam hidroksi polikarboksilat, contoh asam sitrat atau asam tartarat. Terdapat pada minuman anggur, jeruk dsb dan juga akan banyak pada limbah industri yang mengolah buah Ester hasil reaksi antara asam karboksilat dan alkohol RCO – OH + H – OR1 -------H2O + RCOOR1 Berbagai jenis ester digunakan dalam industri sebagai pemberi aroma atau parfum. Beberapa ester tidak larut di air dan menjadi masalah pada limbah Eter hasil pengolahan alkohol dengan dehydrating agent yang kuat ROH + HOR ----- R – O – R + H2O Digunakan sebagai pelarut organik, ketika terpapar ke udara dapat membentuk peroksida (eksplosive) Dietil-eter digunakan sebagai anastesic agent Resisten terhadap aktivitaf biological oksidasi, dan tidak larut di air Salah satu ether penting antara lain MTBE (methyl tertier-buthyl ether) digunakan sebagai peningkat bilangan octana sebelum TEL. MTBE sangat larut di air, volatile, non biodegradable, dapat ALKIL HALIDA Adalah senyawa alifatik yang mempunyai gugus halida melalui reaksi adisi ikatan tak jenuh. Beberapa sangat toksik pada manusia dan lingkungan Beberapa alkil halida penting Chloromethane dan chloroethane sebagai refrigerant dan sebagai bahan baku pembuatan TEL Vynil Chloride, bahan baku pembuatan PVC Senyawaan Polihalogen : EDB (ethylen dibromo ethane) sebagai pestisida; dikloromethane, kloroform, karbon tetraklorida, etana terhalogenasi, ethena terhalogenasi, dobromokloropropane (DBCP), klorofluorokarbon (CFC), asam haloasetat, senyawaan per-fluorinated SENYAWAAN ORGANIK SEDERHANA MENGANDUNG NITROGEN Amina Ada 3 jenis, amina p, s, t dilihat dari berapa jumlah alkil yang terikat pada N Amina tersier dapat mengikat satu alkil lagi membentuk quartenary ammonium salt (biasa digunakan sebagai disinfeksi makanan dan minuman atau disinfeksi untuk bayi) Amida Hasil reaksi antara asam organik dengan ammonia pada kondisi khusus. RCOOH + NH3 ----- RCOO- + NH4+ (kondisi biasa) RCOOH + NH3 ----- RCONH2 + H2O (kondisi khusus) Penting pada ikatan peptida atau poli peptida Contoh lain : urea (NH2 CO NH2), untuk soil fertilizer, pada tanah berair dengan bakteri, dihidrolisis menjadi CO2 dan NH3 yang akan berkombinasi membentuk ammonium karbonat Nitril Nitrosamin Adalah cyanida organik dengan formula R-CN dengan alkil yang jenuh atau tak jenuh. Kebanyakan nitril toksik pada m.o. dan bisa terdapat pada limbah industri fiber. atau senyawaan N-nitroso, mempunyai formula R2 – N – N = O, ditengarai dapat menyebabkan kanker, terdapat pada bir atau whiskey atau produk industri lain. Contoh nitrosoamin adalah NDMA (n-nitrosodimethylamine) (CH3)2N – NO, dipergunakan terutama untuk industri bahan bakar roket. Senyawaan ini juga bisa terbentuk secara alamiah di lingkungan. Beberapa penelitian menunjukkan NDMA dapat terbentuk sebagai by-product disinfeksi dengan adanya DMA (dimethylamin) dan adanya chloraminasi. Isocyanates Formula R – N = C = O Methyl isocyanate adalah salah satu bahan yang terdapat pada ledakan pabrik kimia di Bhopal, India yang menewaskan lebih dari 1000 org. Senyawa ini volatil. SENYAWA SIKLIK ALIFATIK Dikarakterisasikan oleh adanya maksimal 2 atom H pada setiap C pada ring, sehingga jenuh. Beberapa terdapat pada petroleum, dan disebut sebagai naftena, contoh siklopropana, siklopentana, sikloheksana Beberapa terbentuk sebagai siklik alkohol maupun keton, contoh sikloheksanol dan sikloheksanon MERCAPTAN ATAU TIO-ALKOHOL Adalah senyawa alifatik yang mengandung sulfur, struktur mirip alkohol dengan O digantikan oleh S (ROH [alkohol] dan RSH [tio-alkohol]) Beraroma tidak sedap, merupakan bau limbah terutama dari industri pembuatan pulp kayu dengan proses sulfat. Sangat toksik pada ikan Contoh buthyl-mercaptan SENYAWAAN AROMATIK Adalah senyawaan siklik dari aromatik alam dalam strukturnya. Senyawaan ini cukup distabilkan oleh delokallisasi elektron-pi Contoh senyawa aromatis sederhana adalah benzena Syarat aromatis Siklik dan datar Tiap atom cincin mempunyai orbital p tegak lurus pada bidang cincin Memiliki elektron pi sebanyak 4n+2 (aturan Huckel) SENYAWAAN HIDROKARBON AROMATIS Deret Benzen (BTEX) Adalah senyawa yang dibuat dengan reaksi substitusi alkil [metil dan etil] pada bensen Ad: Benzena, Toluena (metil benzen) Ethylbenzena, Xylene (o, m, p) Bersifat carsinogenic, penyebab leukimia Polyring HC [PAHs=polycyclic aromatic hydrocarbons] Naftalen (C10H8) Anthracene adan Phenantrene (C14H10) HC Aromatis terklorinasi Secara umum dengan adanya penambahan atom klorin pada ring benzena akan menurunkan kelarutan air, meningkatkan hidrophobisitas, dan menurunkan tekanan uap molekul. Benzena terklorinasi, biasanya sebagai solvent atau terdapat pada produk pestisida Polichlorinated biphenyls (PCBs) As coolant, plasticizer, solvent, hydraulic fluids. Tend to biocontretate (hidrophobic) PHENOLS Monohydroxy derivative of benzena As carbolic acids (Ka = 1,2 x 10 e -10) Toxic to bacteria ALKOHOL, ALDEHID, KETONE DAN ACIDS TURUNAN BENZENA SENYAWA SEDERHANA MENGANDUNG NITROGEN, TURUNAN BENZENA Senyawaan amina Anilin Diphenilamin benzylzmine Senyawaan Nitro Nitrobenzena Nitrotoluena dsb