Templat tesis dan disertasi
advertisement
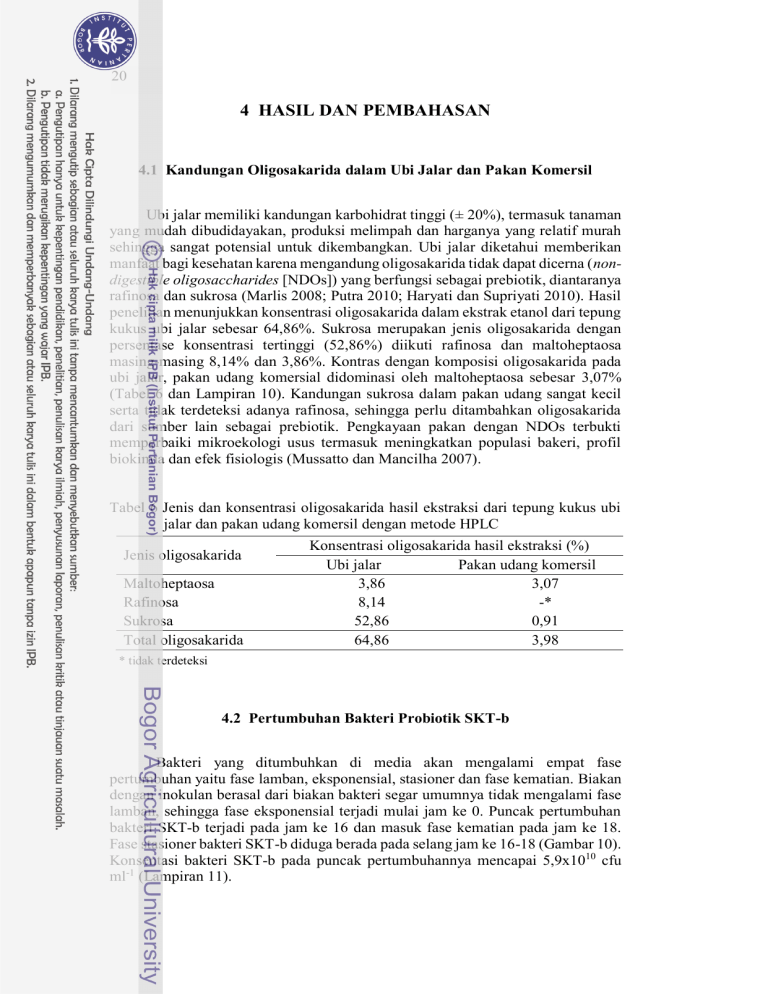
20 4 HASIL DAN PEMBAHASAN 4.1 Kandungan Oligosakarida dalam Ubi Jalar dan Pakan Komersil Ubi jalar memiliki kandungan karbohidrat tinggi (± 20%), termasuk tanaman yang mudah dibudidayakan, produksi melimpah dan harganya yang relatif murah sehingga sangat potensial untuk dikembangkan. Ubi jalar diketahui memberikan manfaat bagi kesehatan karena mengandung oligosakarida tidak dapat dicerna (nondigestible oligosaccharides [NDOs]) yang berfungsi sebagai prebiotik, diantaranya rafinosa dan sukrosa (Marlis 2008; Putra 2010; Haryati dan Supriyati 2010). Hasil penelitian menunjukkan konsentrasi oligosakarida dalam ekstrak etanol dari tepung kukus ubi jalar sebesar 64,86%. Sukrosa merupakan jenis oligosakarida dengan persentase konsentrasi tertinggi (52,86%) diikuti rafinosa dan maltoheptaosa masing-masing 8,14% dan 3,86%. Kontras dengan komposisi oligosakarida pada ubi jalar, pakan udang komersial didominasi oleh maltoheptaosa sebesar 3,07% (Tabel 6 dan Lampiran 10). Kandungan sukrosa dalam pakan udang sangat kecil serta tidak terdeteksi adanya rafinosa, sehingga perlu ditambahkan oligosakarida dari sumber lain sebagai prebiotik. Pengkayaan pakan dengan NDOs terbukti memperbaiki mikroekologi usus termasuk meningkatkan populasi bakeri, profil biokimia dan efek fisiologis (Mussatto dan Mancilha 2007). Tabel 6 Jenis dan konsentrasi oligosakarida hasil ekstraksi dari tepung kukus ubi jalar dan pakan udang komersil dengan metode HPLC Jenis oligosakarida Maltoheptaosa Rafinosa Sukrosa Total oligosakarida Konsentrasi oligosakarida hasil ekstraksi (%) Ubi jalar Pakan udang komersil 3,86 3,07 8,14 -* 52,86 0,91 64,86 3,98 * tidak terdeteksi 4.2 Pertumbuhan Bakteri Probiotik SKT-b Bakteri yang ditumbuhkan di media akan mengalami empat fase pertumbuhan yaitu fase lamban, eksponensial, stasioner dan fase kematian. Biakan dengan inokulan berasal dari biakan bakteri segar umumnya tidak mengalami fase lamban, sehingga fase eksponensial terjadi mulai jam ke 0. Puncak pertumbuhan bakteri SKT-b terjadi pada jam ke 16 dan masuk fase kematian pada jam ke 18. Fase stasioner bakteri SKT-b diduga berada pada selang jam ke 16-18 (Gambar 10). Konsentasi bakteri SKT-b pada puncak pertumbuhannya mencapai 5,9x1010 cfu ml-1 (Lampiran 11). Konsentrasi sel bakteri SKT-b (log cfu ml-1) 21 12 11 10.77 10 9 8.50 8 7 6 5.68 5 0 2 4 6 8 10 12 Jam ke 14 16 18 20 22 Gambar 10 Kurva pertumbuhan bakteri SKT-b yang dikultur di media SWC cair dan dihitung dengan metode total plate count 4.3 Kombinasi Sinbiotik Optimal Oligosakarida yang berasal dari ubi jalar dapat dimanfaatkan sebagai sumber makanan oleh bakteri probiotik SKT-b untuk menunjang pertumbuhan bakteri tersebut secara in vitro. Penambahan oligosakarida ke media kultur meningkatkan pertumbuhan bakteri SKT-b, yang berkorelasi positif terhadap peningkatan dosis prebiotik tersebut, pada semua perlakuan konsentrasi bakteri. Jumlah inokulan yang ditambahkan ke media kultur juga menentukan konsentrasi akhir dari biakan bakteri yang dikultur. Pengurangan jumlah inokulan bakteri SKT-b menyebabkan penurunan konsentrasi akhir biakan pada semua perlakuan dosis prebiotik. Kombinasi prebiotik dan probiotik yang optimal didapatkan pada penambahan prebiotik 3% dan inokulan bakteri SKT-b konsentrasi 1010 cfu ml-1 (Gambar 11). Li et al. (2009) menyebutkan bahwa ada hubungan yang erat antara efek dosis probiotik dan prebiotik terhadap efisiensinya. Oligosakarida dalam jumlah tertentu bersifat antinutrisi. Pemberian karbohidrat yang berasal dari bungkil kedelai (kandungan total karbohidrat terlarut 12-15%), dengan kandungan oligosakarida utama yaitu sukrosa (6-7%), rafinosa (1-2%) dan stakiosa (5-6%), menurunkan konsumsi pakan pada hybrid striped bass dan rainbow trout, serta menurunkan kecernaan pakan pada trout (Francis et al. 2001). Selain itu, dosis prebiotik yang diaplikasikan dalam kegiatan budidaya berkolerasi positif dengan biaya produksi. Oleh karena itu perlu dievaluasi efek dosis prebiotik tersebut secara in vivo. Diharapkan diperoleh dosis prebiotik terkecil yang memberikan dampak tidak berbeda dengan dosis yang lebih tinggi terhadap penanggulangan infeksi IMNV maupun performa pertumbuhan udang vaname. 22 0.6 Absorbansi (µm) 0.5 0.4 0.3 0.2 0.1 0 10^10 10^9 10^8 10^7 Konsentrasi inokulan bakteri SKT-b (cfu ml-1) Gambar 11 Nilai absorbansi biakan perlakuan kombinasi bakteri SKT-b konsentrasi 107, 108, 109 dan 1010 cfu ml-1 dengan prebiotik dosis 0% (kontrol) ( ), 1% ( ), 2% ( ) dan 3% ( ) 4.4 Uji In Vivo 4.4.1 Populasi Bakteri Usus Udang Secara in vivo, pemberian oligosakarida selama 30 hari terbukti meningkatkan populasi bakteri di dalam usus udang vaname. Peningkatan yang signifikan ditunjukkan oleh udang yang diberi perlakuan Pro+Pre 2% dan Pro+Pre 3% masing-masing sebesar 2,03 x 108 dan 1,25 x 108 cfu g usus-1 atau mencapai 10,9 dan 6,7 kali lebih tinggi dibandingkan Kontrol (Gambar 12). Rafinosa diketahui mampu meningkatkan jumlah mikroflora spesifik dalam usus (Mathious et al. 2006; Haryati dan Supriyati 2010). Namun efek dari peningkatan populasi mikroflora terhadap inang karena pemberian ekstrak oligosakarida dari ubi jalar, perlu dipelajari lebih lanjut. Mekanisme kerja dari berbagai jenis prebiotik tidak selalu sama. Beberapa prebiotik menyebabkan peningkatan mikroflora spesifik asli usus pencernaan yang menyebabkan menurunnya bakteri patogen di usus melalui kompetisi langsung terhadap nutrien atau binding site dengan memproduksi blocking factors. Beberapa prebiotik bekerja dengan cara menurunkan pH usus karena dihasilkannya short-cain fatty acid (SCFA), yang mengakibatkan persentase bakteri menguntungkan meningkat dan menurunkan persentase bakteri merugikan. Mannanoligosaccharides (MOS) sebagai prebiotik mempunyai mekanisme berbeda yang secara selektif tidak menyebabkan peningkatan populasi bakteri 23 menguntungkan, tetapi melalui kemampuannya yang dapat melekat pada lektin spesifik manosa dari patogen Gram negatif tipe 1 fimbriae seperti Salmonella dan E. coli yang kemudian akan dikeluarkan dari saluran pencernaan. Mekanisme MOS sebagai antiinfeksi pada fimbriae E. coli dan Salmonella dilakukan dengan berperan sebagai reseptor analog untuk fimbriae tipe 1 guna mencegah proses kolonisasi bakteri (Haryati 2011). Populasi bakteri usus 25.00 20.31 20.00 15.00 12.52 10.00 5.00 3.59 3.36 1.86 0.00 Awal Kontrol Pro+Pre 1% Pro+Pre 2% Pro+Pre 1% Perlakuan Gambar 12 Populasi bakteri dalam usus udang vaname (x107 cfu g usus-1) pada sebelum (awal) dan setelah 30 hari pemberian pakan perlakuan (n=5) Pada penelitian ini tidak diberikan penanda pada bakteri probiotik yang diberikan, sehingga tidak diketahui dominansi bakteri SKT-b di dalam usus udang vaname. Perhitungan populasi total bakteri di usus dilakukan sebagai pendekatan. Selain itu juga tidak dilakukan perhitungan keragaman bakteri di usus, sehingga tidak diketahui bagaimana pengaruh perbedaan dosis prebiotik, hasil ekstraksi dari ubi jalar, terhadap keragaman bakteri dalam usus udang. Keragaman bakteri dalam usus hewan akuatik sangat tergantung pada habitat dan sistem pencernannya. Bakteri yang masuk melalui air dan makanan akan mempengaruhi mikroflora dalam usus, sehingga kompleksitas bakteri dalam usus hewan akuatik dapat berubah-ubah selama hidupnya (Austin 2006). Kolonisasi bakteri patogen, yang umumnya banyak terdapat di perairan budidaya intensif maupun semiintensif, dalam usus sangat tidak diharapkan sehingga penggunaan prebiotik dan probiotik sangat dianjurkan untuk memanipulasi mikroflora usus yang menguntungkan terhadap inang. Keragaman mikroflora dalam usus udang vaname telah diamati oleh Li et al. (2007), U-taynapun et al. (2007) dan Pangastuti et al. (2010) dengan metode yang berbeda. Li et al. (2007) mengamati keragaman bakteri usus L. vannamei yang dipelihara di laboratorium menggunakan 16S rDNA clone library. Populasi usus udang didominasi oleh kelompok Firmicutes (75,4%) dan sisanya dari kelompok 24 Gamma-proteobacteria (24,6%) yang teridentifikasi sebagai Shewanella sp., Pantoea sp., Aranicola sp., Pseudomonas sp. and Vibrio sp. Hasil tersebut menunjukkan bahwa sebagian besar bakteri yang berasosiasi dengan usus udang adalah bakteri yang tidak dapat dikultur dan merupakan spesies baru. U-taynapun et al. (2007) menggunakan teknik Fluorescent in situ hybridization (FISH) untuk menganalisis keragaman udang vaname yang dikultur di tambak tanah. Eubacteria merupakan kelompok yang paling dominan mencapai 80%, terdiri dari low G+C gram positive bacteria (LGC) group, CFB group, High G+C gram positive bacteria (HGC) group, serta α, β, γ-Proteobacteria group. Kelompok bakteri dengan persentase paling besar adalah γ-Proteobacteria (Vibrio spp., Pseudomonas spp., dan kelompok lainnya) serta LGC (Bacillales, lactic acid bacteria, Streptococcaceae, Enterococcus spp., dan kelompok lainnya). Sedangkan Pangastuti et al. (2010) menggunakan Terminal Restriction Fragment Length Polymorphism (T-RFLP) untuk menganalisis larva udang vaname dan menemukan 9 phylotypes yang mempunyai kelimpahan tinggi yaitu Bacteroidetes (36 bp dan 529 bp), Pseudomonas (37 bp), Vibrio (149 bp dan 152 bp), α-protobacteria ( 213 bp dan 215 bp), serta 2 phylotypes (58 bp dan 357 bp) yang belum ada di Ribosomal Database Project. Hood dan Meyers (1974) mengisolasi bakteri dari saluran usus udang putih (P. setiferus) dan air yang berasal dari perairan payau di Barataria Bay, Louisiana. Hasil isolasi di media menunjukkan bahwa bakeri dalam saluran pencernaan terdiri dari genus yang lebih terbatas namun dalam jumlah yang lebih tinggi dibandingkan bakteri di lingkungan airnya. Terbatasnya tipe genus ini menggambarkan kemampuan bakteri tertentu untuk bertahan melewati saluran pencernaan udang dan hidup dalam lingkungan mikro usus udang. Spesies bakteri yang berhasil diisolasi dari usus meliputi Pseudomonas, Vibrio dan Beneckea. Berbeda dengan genus bakteri hasil isolasi dari air yang terdiri dari Bacillus, Pseudomonas, Flavobacterium, Chromobacterium, Micrococcus, Aeromonas, Alginomonas, Vibrio dan genus lainnya. Biomasa mikroba dalam saluran pencernaan lebih tinggi mencapai 2,9 x 107 cfu g-1 dibandingkan dengan di perairan sebesar 1,5 x 105 cfu ml-1. Bakteri hasil isolasi dari usus tersebut memiliki karakteristik aktif memperoduksi enzim protease, amilase, lipase, dan khitinase; tumbuh pada pH rendah (5); dan waktu generasi pendek (30 menit) pada suhu relatif rendah (22 oC). 4.4.2 Resistensi Udang Vaname terhadap Infeksi IMNV 4.4.2.1 Sintasan dan Gejala Klinis Infeksi IMNV melalui injeksi menyebabkan penurunan nilai sintasan udang vaname paling rendah pada Kontrol (+) sebesar 17,78% dibandingkan dengan Kontrol (-) sebesar 93,33% pada hari ke 10 setelah infeksi. Pemberian sinbiotik dapat meningkatkan sintasan udang vaname yang terinfeksi IMNV paling tinggi pada perlakuan Pro+Pre 3% mencapai 2,9 kali lebih besar dibandingkan Kontrol (+) (Gambar 13). Widanarni et al. (2008) menyebutkan bahwa aplikasi bakteri probiotik SKT-b mampu meningkatkan kelangsungan hidup larva udang windu yang diinfeksi V. harveyi melalui perendaman sebesar 83,33 % dibandingkan kontrol sebesar 41,67%. Hasil penelitian lain juga menunjukkan bahwa pemberian 25 bakteri SKT-b mampu meningkatkan sintasan hidup udang vaname yang diinfeksi V. harveyi sebesar 91,1% dibandingkan kontrol 46,7%. Peningkatan sintasan ini dimungkinkan karena terjadinya peningkatan beberapa parameter respons imunitas berupa nilai total hemosit, aktivitas fagositosis dan aktivitas phenoloxidase (PO) (Syahailatua 2009). 100 c 90 80 Sintasan (%) 70 b 60 50 b 93.33 40 a 30 a 42.22 20 10 17.78 51.11 26.67 0 Kontrol (-) Kontrol (+) Pro+Pre 1% Pro+Pre 2% Pro+Pre 3% Perlakuan Gambar 13 Sintasan udang vaname berbagai perlakuan pakan pada hari ke 10 setelah infeksi IMNV (n=15). Angka pada kolom merupakan nilai rataan dan huruf yang berbeda menunjukkan perbedaan nyata (Tukey; α=0,05) Udang vaname yang masih hidup hari ke 10 setelah infeksi pada perlakuan yang sama memperlihatkan gejala klinis yang berbeda-beda. Gejala klinis yang muncul menunjukkan tingkat infeksi IMNV terhadap udang uji. Infeksi IMNV dimulai dengan munculnya gejala klinis berupa lesi (nekrosis) keputih-putihan di otot bagian belakang. Nekrosis di otot pada stadia awal infeksi dapat sembuh yang ditandai dengan perubahan nekrosis dari coagulative ke liquefactive dan disertai dengan infiltrasi hemosit serta fibrosis. Pada tahap lanjut dari infeksi IMNV, nekrosis kemudian meluas ke seluruh bagian otot abdomen, yang menyebabkan warna otot menjadi putih (tidak transparan) dan kemudian berlanjut ke perubahan warna otot menjadi kemerahan. Pada tahap ini, udang tidak dapat pulih dan berujung pada kematian (Lightner et al. 2004; Tang et al. 2005; Costa et al. 2009). Berdasarkan hasil pengamatan gejala klinis pada hari ke 10 setelah infeksi, Kontrol (+) memperlihatkan tingkat infeksi paling berat yang diiringi dengan tingkat kematian yang tinggi. Pada perlakuan Sinbiotik masih ditemukan udang dengan tingkat infeksi ringan. Persentase udang dengan tingkat infeksi ringan dan sedang semakin tinggi seiring peningkatan dosis prebiotik. Udang perlakuan Pro+Pre 2% dan Pro+Pre 3% menunjukkan tingkat infeksi lebih ringan dan berbeda nyata dengan kontrol (+) (Gambar 14 dan Lampiran 12). Hal ini menandakan peningkatan imunitas pada udang yang diberi perlakuan sinbiotik, yang menyebabkan 26 penurunan tingkat infeksi dari INMV. Pengamatan gejala klinis hanya dilakukan pada hari ke 10 setelah infeksi, sehingga tidak diketahui apakah udang yang diamati sedang dalam tahap penyembuhan ataukah akan menuju ke stadia yang lebih lanjut. Perlakuan Kontrol (-) pada penelitian ini menunjukkan infeksi dari IMNV sampai tingkat sedang. Diduga udang yang digunakan telah membawa virus IMN namun dalam jumlah yang sangat kecil sehingga tidak terdeteksi dengan PCR. Dugaan lain, udang tertular selama pemeliharaan setelah infeksi IMNV melalui air dan peralatan. 100% c a ab ab b 7 90% 80% 27 58 Tingkat infeksi 70% 60% 82 49 73 50% 20 40% 30% 67 20 2 7 20 4 20% 10% 0% Kontrol (-) 7 7 4 13 7 2 13 2 9 Kontrol (+) Pro+Pre 1% Pro+Pre 2% Pro+Pre 3% Perlakuan Gambar 14 Tingkat infeksi udang vaname berbagai perlakuan sinbiotik pada hari ke 10 setelah infeksi IMNV (n=15). Simbol menunjukkan tingkat infeksi: mati ( ), sangat berat ( ), berat ( ), sedang ( ), ringan ( ). Angka pada kolom merupakan nilai rataan dan huruf yang berbeda menunjukkan perbedaan nyata (Tukey; α=0,05) 4.4.2.2 Total Hemosit (Total Haemocyte Count [THC]) dan Aktivitas Phenoloxidase (PO) Mekanisme pertahanan pada krustasea kurang berkembang dibandingkan dengan ikan dan vertebrata lainnya, dan hanya bergantung pada mekanisme pertahanan non spesifik. Hemosit memainkan peranan penting pada pertahanan tubuh krustasea yaitu dapat menghilangkan partikel asing yang masuk ke tubuh udang melalui fagositosis, enkapsulasi dan pembentukan nodul, serta produksi komponen-komponen humoral yang disimpan dalam granula hemosit diantaranya protein antikoagulan, aglutinin, enzim PO, peptida antimikrobial, dan inhibitor protease (Jiravanichpaisal et al. 2006). Pemberian sinbiotik pada perlakuan Pro+Pre 2% dan Pro+Pre 3% selama 30 hari mampu meningkatkan nilai THC udang vaname sampai dengan dua kali nilai THC udang Kontrol pada awal pengamatan. Jumlah hemosit yang tinggi dalam darah udang ini sangat menguntungkan dalam mekanisme pertahanan tubuh ketika udang terinfeksi IMNV, sehingga dapat 27 meminimalisir kerusakan akibat infeksi (menurunkan tingkat infeksi) dan meningkatkan sintasan. Selama periode pengamatan parameter imunitas, nilai THC udang perlakuan Pro+Pre 2% dan Pro+Pre 3% memperlihatkan pola yang berbeda dengan perlakuan lainnya. Setelah infeksi IMNV, nilai THC udang perlakuan Pro+Pre 2% dan Pro+Pre 3%, terus mengalami penurunan sampai dengan akhir pengamatan (hari ke 10). Sebaliknya nilai THC perlakuan Pro+pre 1% dan Kontrol (+) menunjukkan peningkatan pada hari ke lima dan menurun kembali di akhir pengamatan (Gambar 15). Penurunan nilai THC udang perlakuan Pro+Pre 2% dan Pro+Pre 3% mengindikasikan reaksi cepat terhadap infeksi yang diberikan. Penurunan jumlah hemosit ini merupakan efek dari berjalannya mekanisme pertahanan tubuh seperti infiltrasi hemosit pada jaringan yang terinfeksi, kematian sel hemosit akibat apoptosis (Costa et al. 2009), aktivitas fagositosis, enkapsulasi, pembentukan nodul, serta terjadinya proses degranulasi untuk aktivasi sistem prophenoloxidase (proPO) dan mekanisme pertahanan tubuh lainnya (Smith et al. 2003). Total hemosit (x106 ml-1) 12.00 a 10.00 a a a a a 8.00 a 6.00 4.00 a a a a 6.4 2.00 6.5 8.5 a a 6.4 4.6 3.0 3.0 3.1 a a 4.3 4.3 3.2 2.2 3.1 2.7 3.3 0.00 0 5 10 Waktu pengambilan sampel (hari ke) Gambar 15 Total hemosit udang vaname perlakuan: Kontrol (-) ( ), Kontrol (+)( ), Pro+Pre 1% ( ), Pro+Pre 2% ( ), Pro+Pre 3% ( ) pada hari ke-nol sebelum infeksi, hari ke 5 dan ke 10 setelah infeksi IMNV (n=3). Angka pada kolom merupakan nilai rataan dan huruf yang berbeda menunjukkan perbedaan nyata (Tukey; α=0,05) Tingginya proses degranulasi dapat dilihat dari meningkatnya aktivitas PO. Aktivitas PO digunakan untuk mengukur aktivasi sistem proPO. Parameter imunitas ini adalah bagian dominan pada sistem pertahanan krustasea yang berperan dalam perilaku sel, pelepasan dan atau aktivasi molekul-molekul fungsional penting serta netralisasi agen penginfeksi (Smith et al. 2003). Infeksi IMNV menyebabkan peningkatan aktivitas PO udang vaname sampai akhir pengamatan. Peningkatan aktivitas PO juga terjadi pada P. vannamei yang diinfeksi Taura Syndrome Virus (Song et al. 2003). Peningkatan aktivitas PO di hari ke lima 28 setelah infeksi pada udang yang diberi perlakuan sinbiotik lebih tinggi dibandingkan dengan Kontrol (+) (Gambar 16). Aktivitas PO tertinggi terjadi pada perlakuan Pro+Pre 3% sebesar 0,61 PO 100µl-1 (hari ke 10 pengamatan). Pola peningkatan aktivitas PO yang tajam pada udang perlakuan sinbiotik, sudah terjadi pada hari ke 5 dan semakin meningkat pada pengamatan hari ke 10. Sebaliknya pada udang perlakuan Kontrol (+) pola peningkatan tajam baru mulai terjadi setelah hari ke lima, menandakan respons imunitas yang lebih lambat. Respons imunitas yang lambat akan merugikan karena dapat memberikan kesempatan pada virus untuk memperbanyak diri dan menimbulkan kerusakan parah pada udang sehingga tidak memungkinkan lagi untuk memulihkan diri, yang akan berujung pada kematian udang. 1.00 a 0.90 a Aktivitas PO 100 ɥl-1 0.80 a 0.70 0.60 0.50 0.40 0.30 a a a a a a 0.20 0.10 a a a a 0.28 0.26 0.22 0.22 0.24 a 0.29 a 0.38 0.36 0.61 0.50 0.48 0.51 0.46 0.25 0.18 0.00 0 5 10 Waktu pengambilan sampel (hari ke) Gambar 16 Aktivitas PO udang vaname perlakuan: Kontrol (-) ( ), Kontrol (+)( ), Pro+Pre 1% ( ), Pro+Pre 2% ( ), Pro+Pre 3% ( ) pada hari ke 0 sebelum infeksi, hari ke 5 dan ke 10 setelah infeksi IMNV (n=3). Angka pada kolom merupakan nilai rataan dan huruf yang berbeda menunjukkan perbedaan nyata (Tukey; α=0,05) Hasil pengukuran parameter imunitas menunjukkan bahwa nilai THC dan aktivitas PO udang uji sangat bervariasi, bahkan pada udang dengan perlakuan dan ulangan yang sama. Hal ini dikarenakan setiap individu udang berada pada tingkat infeksi yang berbeda-beda (ditunjukkan dengan beragamnya gejala klinis yang muncul), sehingga menyebabkan perbedaan nilai parameter imunitasnya. Nilai dari parameter imunitas sangat tergantung pada kondisi fisiologis individu (Maggioni et al. 2004; Le Moullac et al. 1997) atau perubahan lingkungan (Le Moullac dan Haffner 2000). Keragaman nilai THC dan aktivitas PO individu udang ini menyebabkan standar deviasi antar perlakuan sangat tinggi sehingga hasil analisis statistik menunjukkan tidak berbeda nyata walaupun secara nominal memperlihatkan perbedaan yang sangat signifikan. Nilai parameter imunitas yang 29 bervariasi ini juga dilaporkan oleh Costa et al. (2009) setelah menganalisis imunitas udang vaname di salah satu tambak di utara timur Brazil yang secara alami terinfeksi IMNV, menunjukkan nilai standar deviasi yang tinggi antar perlakuannya. Mekanisme probiotik dalam merangsang respons imunitas di usus pada ikan dan udang belum banyak dipelajari, sebaliknya interaksi antara nonkomensal dan probiotik dengan sistem imunitas usus telah terdokumentasi dengan baik pada hewan tingkat lebih tinggi (Nayak 2010). Pada mamalia, probiotik (bagian atau komponennya) dapat secara langsung meningkatkan imunitas dengan cara melewati sel epitel usus dan berinteraksi langsung dengan limfosit yang kemudian mengaktivasi respons imunitas (imunostimulasi). Secara tidak langsung, melalui kontak antara probiotik dengan sel epitel usus (gut associated lymphoid tissue [GALT]) yang akan mengakifkan sitokin sehingga memungkinkan terjadinya komunikasi antar sel untuk mengaktifkan respons imunitas (imunoregulator). Pemberian probiotik mempengaruhi fungsi limfosit (proliferasi, sekresi sitokin, dan sitotoksisitas seluler), pertahanan nonspesifik (fagositosis, produksi radikal oksidatif, sekresi enzim lisosom), fungsi sitosidal alami dari makrofaga dan sel-sel pembunuh, serta respons antibodi (total level antibodi dan respons spesifik antigen) (Gill dan Cross 2002). Menurut Nayak (2010), berdasarkan sedikit penelitian yang terkait dengan sistem imunitas di usus, menunjukkan bahwa dalam usus ikan ditemukan banyak menyebar sel limfoid, makrofaga, granulosit dan IgM yang merupakan komponen imunitas. Pada ikan mas, segmen usus kedua sangat kuat menyerap antigen dan kemudian diproses oleh makrofaga intraepithelial. Probiotik mampu menstimulasi piscine gut immune system yang ditandai dengan meningkatnya jumlah sel Ig+ dan granulosit asidofilik (AGs). Probiotik juga dapat mengarah pada peningkatan jumlah sel-T pada GALT di ikan. Penelitian lain menunjukkan adanya peningkatan gut mucosal lysozyme oleh C. maltaromaticum dan C. divergens serta aktivitas fagositik dari mucosal leucocyte oleh probiotik kelompok bakteri asam laktat seperti L. lasctis ssp. lactis, L. mesenteroides dan L. sakei pada ikan seperti O. mykiss. 4.4.3 Performa Pertumbuhan Laju pertumbuhan spesifik udang vaname setelah pemberian pakan sinbiotik selama 30 hari menunjukkan tidak ada perbedaan antar perlakuan dengan kisaran 5,51-5,87% hari-1. Walaupun demikian, efisiensi pakan udang uji semakin meningkat seiring penambahan dosis prebiotik. Efisiensi pakan udang perlakuan Pro+Pre 2% dan Pro+Pre 3% lebih tinggi dan berbeda dibandingkan Kontrol. Pada jumlah konsumsi pakan yang relatif sama, penambahan bobot udang perlakuan Pro+Pre 3% lebih tinggi dibanding perlakuan lainnya (Tabel 7). Peningkatan efisiensi pakan ini dikarenakan meningkatnya aktivitas enzim-enzim pencernaan (amilase dan protease) sehingga memperbaki kecernaan pakan. Pemberian sinbiotik meningkatkan aktivitas enzim protease dan amilase udang dibandingkan dengan Kontrol (Gambar 17). Peningkatan aktivitas enzim paling tinggi terjadi pada udang perlakuan Pro+Pre 3% sebesar 1,85 unit protease menit-1 ml-1 dan 7,19 unit amilase menit-1 ml-1. Nilai aktivitas enzim tersebut masing-masing mencapai 1,7 kali lebih tinggi dibandingkan Kontrol. Protein merupakan komponen utama dalam pakan krustasea, oleh karena itu enzim protease memegang peran penting dalam proses hidrolisis dan asimilasi (Muhlia-Almazan dan Garcia-Carreno 2003). Pemberian 30 bakteri SKT-b melalui pakan pada udang vaname diduga berperan besar dalam peningkatan aktivitas enzim pencernaannya. Hasil uji karakterisasi sifat fisiologi dan biokimia menunjukkan bahwa bakteri probiotik SKT-b bersifat protease + dan amilase + (Tabel 3) (Widanarni et al. 2003). Nilai retensi nutrien udang, baik retensi protein maupun lemak, setelah diberi perlakuan pakan selama 30 hari memperlihatkan perbedaan antar perlakuan (Tabel 7). Retensi protein paling tinggi dicapai oleh udang pada perlakuan Pro+Pre 2% sebesar 46,18%. Hasil perhitungan retensi lemak menunjukkan perlakuan Pro+Pre 2% dan Pro+Pre 3% lebih tinggi dibandingkan Kontrol. Retensi lemak tertinggi dicapai oleh udang perlakuan Pro+Pre 3% sebesar 17,49%. Tingginya nilai retensi protein dan lemak udang vaname pada kedua perlakuan tersebut mengindikasikan penyerapan nutrien yang baik. Beberapa penelitian menemukan bahwa pemberian pakan prebiotik mampu meningkatkan panjang mikrofili usus (Yilmaz et al. 2007; Salze et al. 2008; Zhou et al. 2010). Panjang mikrofili usus berkorelasi positif dengan penyerapan nutrien sehingga memperbaiki performa pertumbuhan dan pemanfaatan pakan. Secara umum, performa pertumbuhan udang mengalami perbaikan setelah diberi pakan perlakuan Pro+Pre 2% dan Pro+Pre 3% selama 30 hari. Studi mengenai efek pemberian sinbiotik terhadap pertumbuhan pada hewan akuatik masih sangat terbatas. Rodriguez-Estrada et al. (2009) menyebutkan performa pertumbuhan (pertambahan bobot, SGR dan FCR) ikan salmon meningkat dibandingkan kontrol pada perlakuan pemberian sinbiotik (Enterococcus faecalis dan mannanoligosaccharide [MOS]) dan pemberian prebiotik (MOS), tetapi tidak pada perlakuan pemberian probiotik (E. faecalis). Penelitian mengenai efek probiotik dan prebiotik secara terpisah terhadap pertumbuhan berbagai jenis hewan akuatik telah banyak dilakukan dengan hasil yang beragam. Beberapa faktor yang mempengaruhi keragaman tersebut diantaranya dipengaruhi oleh jenis, dosis, dan lama pemberian bahan serta hewan uji (spesies, umur, kepadatan) (Helland et al. 2008). Pemberian pakan perlakuan selama 30 hari pada penelitian ini diduga belum optimal untuk melihat efektifitas perlakuan sinbiotik terhadap performa pertumbuhan, terutama laju pertumbuhan udang (SGR). Pemberian probiotik komersial dosis 20 g kg pakan-1 selama tujuh minggu pada hybrid striped bass secara signifikan meningkatkan efisiensi pakan tetapi tidak pertumbuhannya (Li dan Gatlin 2004). Helland et al. (2008) mengevaluasi efek pemberian berbagai jenis prebiotik (MOS, fructooligosaccharide [FOS] dan galactooligosaccharide [GOS]) pada kelompok ikan salmon (bobot rata-rata 200 g). Pengukuran performa pertumbuhan dilakukan setiap bulan selama empat bulan. Hasil penelitian menunjukkan bahwa performa pertumbuhan tidak berbeda antar perlakuan pada setiap bulannya, tetapi secara keseluruhan selama empat bulan menunjukkan hasil yang signifikan. Merrifield et al. (2010) menyebutkan bahwa lama waktu pemberian pakan probiotik pada berbagai penelitian yang telah dilakukan paling cepat enam hari dan paling lama lima bulan. Kepadatan udang sebesar 0,74 ekor l-1 (40 ekor dalam 54 liter; PL 55), diduga turut mempengaruhi laju pertumbuhan udang. Pada udang yang bersifat kanibal, kepadatan tinggi juga sangat menentukan nilai sintasan. Tabel 7 menunjukkan nilai sintasan udang pada semua perlakuan relatif rendah yaitu berkisar antara 67–74%. Perlakuan Kontrol menunjukkan nilai sintasan paling kecil dibandingkan perlakuan 31 pakan yang lain. Meskipun secara statistik tidak berbeda nyata, sintasan udang yang diberi pakan perlakuan Sinbiotik lebih tinggi dibandingkan dengan Kontrol. Tabel 7 Penambahan bobot tubuh (∆ biomasa), jumlah konsumsi pakan (JKP), laju pertumbuhan (SGR), efisiensi pakan (EP), retensi nutrien dan sintasan udang vaname yang diberi empat jenis pakan perlakuan (rerata±simpangan baku, n=40) selama 30 hari. Huruf yang berbeda menunjukkan perbedaan nyata (Tukey; α=0,05) Parameter Kontrol Pro+Pre 1% Pro+Pre 2% Pro+Pre 3% Biomasa awal (g) Biomasa akhir (g) ∆ Biomasa (g) JKP (g) SGR (% hari-1) EP (%) Retensi protein (%) Retensi lemak (%) Sintasan (%) 26,67±1,15 140,51±1,39 113,85±1,02a 121,16±1,14a 5,51±0,12a 93,97±0,77a 42,55±0,41b 13,07±0,10b 67,50±6,61a 23,33±3,21 135,93±2,66 112,60±0,98a 119,46±2,04a 5,87±0,39a 94,28±1,88a 37,80±0,66a 11,76±0,32a 70,83±6,29a 25,33±1,53 139,77±1,66 114,44±0,43a 116,80±1,88a 5,67±0,16a 98,00±1,82b 46,18±0,94c 15,00±0,27c 74,17±12,58a 26,67±1,53 146,21±0,45 119,54±1,90b 119,44±2,25a 5,65±0,21a 100,09±0,80b 43,91±1,18b 17,49±0,45d 71,67±2,89a 8.00 7.19 7.00 Unit menit-1 ml-1 6.00 4.86 5.00 4.16 4.47 4.00 3.00 2.00 1.85 1.10 1.19 1.28 1.00 0.00 Protease Amilase Enzim Pencernaan Gambar 17 Aktifitas enzim pencernaan (protease dan amilase) udang vaname (n=5) setelah 30 hari pemberian pakan perlakuan: Kontrol ( ), Pro+Pre 1% ( ), Pro+Pre 2% ( ), Pro+Pre 3% ( ) 32 4.4.4 Kualitas Air Media Pemeliharaan Kisaran kualitas air media pemeliharaan udang selama percobaan berlangsung (30 hari pemberian pakan perlakuan) disajikan pada Tabel 8 dan Lampiran 13. Pada semua perlakuan, salinitas media terus mengalami peningkatan selama masa pemeliharaan udang mencapai 35o/oo, sebaliknya oksigen terlarut terus mengalami penurunan mencapai nilai terendah 3,5 mg l-1. Hal ini berbeda dengan parameter suhu dan pH yang relatif stabil pada kisaran 28–29 oC dan 7,0-7,9 serta nilai TAN di bawah 0,14 mg l-1. Pada umumnya kualitas air media pemeliharaan udang pada semua perlakuan berada pada kisaran standar nilai menurut SNI 0127246-2006, kecuali salinitas dan pH pada akhir perlakuan. Salinitas media pemeliharaan sebesar 35o/oo berada di atas kisaran nilai yang dianjurkan. Meskipun demikian, udang vaname mampu hidup pada kisaran salinitas yang luas yaitu 050o/oo. Udang ini dapat tumbuh optimal dan normal pada salinitas di atas 40o/oo, namun dengan didukung parameter kualitas air yang lain seperti kandungan bahan organik (TOM) < 150 ppm, suhu 28-32 oC, fluktuasi pH < 0,4 dan oksigen terlarut lebih dari 3,5 mg l-1 (Adiwidjaya 2008). Nilai pH yang terlalu rendah dapat menyebabkan stress, pelunakan cangkang dan menurunkan sintasan. Selain itu, penurunan pH menyebabkan meningkatnya toksisitas nitrit dan hidrogen sulfida (H2S). Sebaliknya, peningkatan nilai pH akan meningkatkan persentase amonia tidak terionisasi (NH3) yang merupakan bentuk toksik dari amonia. Pada pH 6,45 tidak menyebabkan kematian Penaeus monodon, namun menurunkan pertumbuhan hingga 40%. Kematian P. Monodon terjadi pada pH di bawah 6,0 (Chien 1992). Hirono (1992) melaporkan bahwa kisaran nilai pH pada budidaya L. vannamei di Amerika Tengah 7,0-8,0; Ekuador 7,0-8,5; Polinesia 7,0-8,0; dan United States 8,09,0; dengan kisaran salinitas di Amerika Tengah 5-25 o/oo, Ekuador 0-25 o/oo, Polinesia 8-35 o/oo, dan United States < 40. Nilai salinitas 35 o/oo dan pH 7,0 pada media pemeliharaan udang di akhir perlakuan, diduga tidak mempengaruhi sintasan maupun pertumbuhan udang uji. Tabel 8 Kisaran kualitas air media pemeliharaan udang vaname selama 30 hari pemberian pakan perlakuan Parameter Suhu (oC) Salinitas (o/oo) DO (mg l-1) TAN (mg l-1) pH Kontrol 28 - 29 32 - 35 3,5 – 7,5 < 0,14 7 - 7,9 Perlakuan Pro+Pre Pro+Pre 1% 2% 29 28 – 28,5 32 - 35 31 - 34 3,9 – 7,9 4 – 7,2 < 0,14 < 0,14 7 - 7,8 7 - 7,9 Pro+Pre 3% 28,5 - 29 32 - 35 3,5 – 7,5 < 0,14 7 - 7,8 SNI 012-72462006 28,5 – 31,5 15 – 25 > 3,5 < 0,01 7,5 – 8,5