11 Analisa Protein -e-learning XI
advertisement

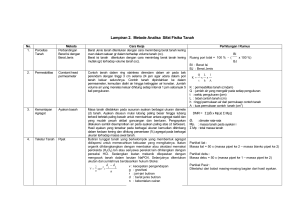
ANALISA PR O T E I N Tujuan Analisa protein Menera jumlah kandungan protein dalam bahan makanan Menentukan tingkat kualitas protein Menelaah protein sebagai salah satu bahan kimia secara biokimiawi, fisiologis, rheologis, enzimatis. Pemecahan protein profil asam amino Analisa Protein Uji Ninhidrin Analisa jumlah protein total: Kjeldahl Metode Lowry Metode Biuret Metode spektrofotometer UV Metode Turbidimetri Metode pengecatan Titrasi formol Analisa jumlah Protein total Protein N (total) Protein kasar (Crude protein) = Jumlah protein dihitung berdasarkan kandungan rata-rata unsur N dalam protein Tidak semua jenis protein mengandung N yang sama ada senyawa bukan protein yang mengandung N (misal: urea, asam nukleat, ammonia, nitrat, nitrit, asam amino, amida, purin, pirimidin) Analisa jumlah Protein total Umumnya dilakukan peneraan empiris (tidak langsung) yakni melalui penentuan kandungan N dalam bahan Dikembangkan oleh Kjeldahl Seharusnya hanya N dari protein saja yang ditentukan sulit dan kandungan senyawa lain dalam bahan sedikit. Hasilnya : protein kasar (crude protein). Dasar Protein alamiah N rata-rata 16% Jumlah protein = jumlah N X 100/16 = jumlah N X 6,25 Senyawa tertentu sudah diketahui komposisi fk (faktor perkalian): Protein gandum = 5,70 Protein susu = 6,38 Protein gelatin (kolagen yang terlarut) = 5,55 Faktor perkalian (fk) beberapa bahan Macam Bahan Faktor perkalian (fk) Bir, sirup, biji-bijian, ragi Buah-buahan, the, anggur, malt Makanan ternak 6,25 Beras 5,95 Roti, gandum, makaroni, mie 5,70 Kacang tanah 5,46 Kedele 5,75 Kenari 5,18 Susu 6,38 Gelatin 5,55 Analisa protein cara Kjeldahl 3 tahap: Proses destruksi Proses destilasi Proses titrasi Tahap destruksi Sampel dipanaskan dalam H2SO4 (p) terpecah menjadi unsur-unsurnya : C CO dan CO2 H H2O N (NH4)2SO4 Kebutuhan H2SO4 (p) minimum = 10 ml (18,4 g) 1 g protein 9 g H2SO4 1 g lemak 17,8 g H2SO2 1 g Karbohidrat 7,3 g H2SO4 lemak sebaiknya dihilangkan sebelum destruksi Sampel = 0,4 – 3,5 g Mikro Kjeldahl = 10 – 30 mg Destruksi selesai bila larutan jernih/tidak berwarna. Blanko koreksi adanya senyawa N dari reagensia Katalisator proses destruksi Katalisator menaikkan titik didih H2SO4 mempercepat destruksi Jenis: Na2SO4 dan HgO (20 : 1) K2SO4 CuSO4 Se Suhu destruksi: 370 – 410oC 1 g K2SO4 dapat menaikkan titik didih 3oC Reaksi selama destruksi (bila menggunakan HgO) HgO + H2SO4 HgSO4 + H2O 2HgSO4 Hg2SO4 + SO2 Hg2SO4 + 2H2SO4 2HgSO4 + 2H2O + SO2 [CHON] + On + H2SO4 CO2 + H2O+ [NH4]2SO4 + 2On Katalisator proses destruksi Penggunaan katalisator Hg o Amonium sulfat yang terbentuk dapat bereaksi dengan merkuri oksida membentuk senyawa kompleks merkuri-amonia o Sebelum destilasi, Hg harus diendapkan terlebih dahulu dg K2S atau tiosulfat agar senyawa kompleks merkuri-amonia pecah menjadi amonium sulfat Katalisator proses destruksi Penggunaan katalisator Se o Tidak perlu diberi perlakuan sebelum destilasi o Se lebih reaktif dibandingkan merkuri dan kuprisulfat o Kelemahan Se: oksidasi sangat cepat, sehingga nitrogennya kemungkinan ikut hilang o Solusi: penggunaan Se yang sangat sedikit (< 0,25 g) Destilasi Amonium sulfat dipecah menjadi amonia (NH3 ) dengan penambahan NaOH sampai alkalis dan dipanaskan NH3 yang dibebaskan ditangkap oleh larutan asam standar yaitu HCl/asam borat 4% berlebihan ( indikator BCG + MR atau PP) ujung tabung destilasi tercelup sedalam mungkin dalam asam, agar kontak antara asam dan amonia lebih baik superheating dicegah dengan Zn. Destilasi diakhiri bila semua NH3 sudah dibebaskan (destilat tidak bereaksi basis). Tahap titrasi Dengan penampung HC lSisa HCl dititrasi dengan NaOH 0,1 N; indikator PP sampai merah muda ml NaOH (blanko – S) %N = X N NaOH X 14,008 X 100% berat sampel (g) X 1000 Dengan penampung asam borat Titrasi dengan HCl 0,1N dengan indikator BCG + MR Akhir titrasi : biru merah muda ml HCl (S – Blanko) %N = X N NaOH X 14,008 X 100% berat sampel (g) X 1000 % Protein = % N X F/K (6,25) Cara lain penentuan N Cara Van Slyke Cara Dumas Cara Van Slyke Protein / asam amino direaksikan dengan asam nitrit Gas nitrogen yang terjadi diukur banyaknya secara volumetris RNH2 + HNO2 ROH + H2O + N2 1 grol N = 22,4 liter kadar protein dapat dihitung Protein Pirolisis Cara Dumas N Ukur Volume 1 ml Larutan Protein Ditambah 5 ml Lowry B Metode Lowry digojog, dibiarkan 10 menit Ditambah 0,5 ml Lowry A digojog, dibiarkan 20 menit Didiamati OD-nya pada λ = 600 nm Protein dengan asam fosfotungstat dalam suasana alakalis akan berwarna biru Intensitas warna biru berkorelasi dengan kadar protein Peneraan pada λ = 600 nm Kurva standar menggunakan protein standar (Bovine Serum Albumin = BSA) Metode Lowry 10 – 20 kali lebih sensitif dibandingkan cara UV atau Biuret Metode Biuret Menunjukkan adanya senyawa-senyawa yang mengandung gugus amida asam (- CONH2) yang berada bersama gugus amida asam yang lain atau gugus yang lain seperti : - CSNH2 - CHOHCH2NH2 - C(NH) NH2 - CHOHCH2 NH2 - CH2NH2 - CHNH2CH2OH - CRHNH2 - CHNH2CHOH Intensitas warna biru-violet tergantung konsentrasi protein Pengukuran: pada = 560 – 580 nm, perlu kurva standar Hanya protein/senyawa peptida yang bereaksi dengan biuret kecuali urea metode ini lebih baik dibandingkan Kjeldahl O H ll l HOOC-CH-NH-C-C-NH2 l l R R RH R l l l NH2-C-C-NH-C-COOH H l l O H l Cu l H OH l l l HOOC-C-NH-C-C-NH2 l l l R HR Senyawa berwarna biru violet + CuSO4 + NaOH + Na2SO4 + H2O Metode Spektrofotometer UV Protein (asam amino tirosin, triptofan, dan fenilalanin) mengabsorbsi sinar UV Pengukuran perlu kurva standar Metode ini: cepat, mudah dan tidak merusak bahan Metode Turbidimetri Penambahan bahan pengendap protein (misal: tri chloro acetic acid (TCA), kalium feri cyanida (K4Fe(CN)6), atau asam sulfosalisilat menyebabkan kekeruhan dalam larutan yang mengandung protein Perlu dibuat tabel atau kurva hubungan antara kekeruhan dengan kadar protein Untuk pentuan kadar protein bahan yang berupa larutan Hasil: biasanya kurang tepat Metode Pengecatan Bahan pewarna (misal: Orange G, Orange 12 dan amido black) dapat membentuk senyawa berwarna dengan protein dan menjadi tidak larut Sisa bahan pewarna yang tidak bereaksi dalam larutan diukur dengan colorimetrer kadar protein dapat ditentukan dengan cepat Perlu kurva standar Metode Titrasi Formol Metode ini hanya tepat untuk penentuan proses terjadinya pemecahan protein, dan kurang tepat untuk penentuan protein. Larutan protein dinetralkan dengan NaOH kemudian ditambah formalin, sehingga terbentuk dimetilol Indikator: PP Titik akhir titrasi: perubahan warna menjadi merah muda BAHAN DISKUSI Kenapa faktor konversi dari kadar N ke kadar protein tidak sama untuk semua bahan? Pada saat destilasi dan titrasi, kenapa larutan untuk menitrasi berbeda jika larutan penampung yang digunakan berbeda? Apa yang akan terjadi jika sampel yang dianalisa terlalu banyak? TUGAS Ditimbang 35 mg sampel dan dianalisa kadar proteinnya dengan mikro Kjeldahl, Volume HCl 0,02N untuk titrasi blanko 0,08 ml. titrasi sampel = 7,88 ml. Jelaskan tahap-tahap dalam analisa tsb dan apa tanda berakhirnya masing-masing tahapan Hitung kadar protein sampel tsb