Bab II 2007ala
advertisement

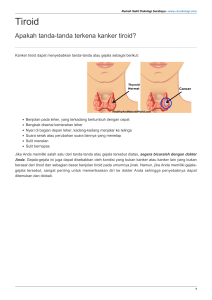
25 II. TINJAUAN PUSTAKA A. Gangguan Akibat Kekurangan Iodium (GAKI) 1. Besar, Luas Masalah GAKI, Penyebab dan Akibatnya Gangguan Akibat Kekurangan Iodium adalah sekumpulan gejala atau kelainan yang ditimbulkan karena tubuh mengalami kekurangan iodium secara terus menerus dalam waktu lama sehingga berdampak pada gangguan perkembangan fisik dan mental manusia (Depkes 1996). Gangguan Akibat Kekurangan Iodium merupakan masalah kesehatan masyarakat yang banyak diderita oleh berbagai kelompok umur termasuk ibu hamil. Prevalensi GAKI pada ibu hamil yang diukur dari Total Goitre Rate (TGR) adalah sekitar 16% (Depkes 1998). Total Goitre Rate merupakan pembesaran kelenjar gondok atau tiroid. Pada umumnya GAKI disebabkan masyarakat kurang mengkonsumsi zat iodium dari bahan makanan. Penderita GAKI yang ditemukan banyak tinggal di daerah pegunungan, karena tanah di daerah tersebut kurang mengandung iodium akibat pengikisan lapisan tanah atau erosi sehingga tanaman kurang mengandung iodium. Selain itu, kekurangan zat gizi mikro lainnya seperti selenium, zat besi dapat memperburuk keadaan GAKI tersebut (Arthur 1993; Hess 1998). Gangguan akibat kekurangan iodium terjadi pada setiap kelompok umur sejak janin sampai usia dewasa dan mulai dari tingkat ringan sampai dengan tingkat berat sesuai dengan tingkat kekurangan iodium. Ibu hamil dan janin yang mengalami kekurangan iodium tingkat berat berisiko ibu mengalami keguguran, bayi yang dilahirkan mati (stillbirth) dan apabila hidup akan menderita gangguan tumbuh kembang bahkan dapat menjadi cebol (kretin). Tabel 1 menunjukkan secara rinci gangguan akibat kekurangan iodium. Pada ibu hamil dengan berbagai tingkat kekurangan iodium akan mengalami gangguan pada fungsi tiroid yang berakibat berkurangnya sekresi hormon tiroid. Hal ini sangat mempengaruhi pertumbuhan dan perkembangan janin dan bayi yang dilahirkan. Anak yang lahir dari ibu yang mengalami defisiensi hormon tiroid akan mengalami keterbelakang perkembangan mental 26 dan menurunkan skor Intelegence Quotient (IQ) sebesar 10-15 poin dibandingkan dengan anak yang normal (Delange & Fisher 2006). Tabel 1 Gangguan Akibat Kekurangan Iodium pada Semua Kelompok Umur Tahap perkembangan Kelainan GAKI Janin - abortus dan lahir mati - angka kematian perinatal dan bayi meningkat - kretin neurologik: bisu tuli dan mata juling - kretin miksedematos: cebol dan keterlambatan mental dan psikomotor Neonatus - gondok neonatal - hipotiroid neonatal Anak dan - gondok, hipotoroid juvenil Remaja - gangguan fungsi mental - keterlambatan perkembangan fisik Dewasa - gondok dengan segala akibatnya - hipotiroid dan gangguan fungsi mental Sumber: Djokomoeljanto (1989). 2. Upaya Penanggulangan GAKI a. Penanggulangan GAKI Dahulu dan Sekarang Sejak jaman dahulu kala pengobatan terhadap penyakit gondok telah dilakukan. Penyakit gondok dilaporkan telah ada sejak jaman Yunani kuno dan pengobatannya menggunakan tumbuhan laut (sponge) (Wildman & Medeiros 2000). Tahun 1850 seorang dokter Perancis bernama Chatin menemukan bahwa kandungan iodium dalam tanah berhubungan dengan kejadian penyakit gondok. Kemudian pada awal abad 20, iodium dikenal menjadi pengobatan untuk penyakit gondok (Wildman & Medeiros 2000). Iodium pertama digunakan dalam larutan yang dikenal dengan larutan Lugol, kemudian berkembang menjadi larutan minyak iodium yang diberikan secara injeksi atau per oral (kapsul). Selain itu, iodinasi air minum dan irigasi, fortifikasi makanan dengan iodium dan iodisasi garam telah dilakukan untuk mencegah kekurangan iodium. Metoda injeksi minyak iodium atau secara intramuskular (IM) pertama kali dicoba di Papua Nugini (Buttfield & Hetzel 1967) dan sejak itu cakupannya telah mencapai jutaan penduduk di seluruh dunia (Dunn 1987). Dampak mencolok injeksi minyak iodium tampak empat tahun kemudian berupa pengecilan kelenjar 27 gondok dan menghilangnya kretin endemik (Buttfield & Hetzel 1967). Cara ini mendapat pengakuan dunia dan digunakan luas termasuk di Indonesia. Keuntungan iodium yang diberikan secara injeksi adalah efeknya cepat dan berlangsung lama sampai 3 tahun. Kelemahannya adalah harga lebih mahal karena harus menggunakan jarum suntik, memerlukan tenaga terlatih dan memungkinkan tertular penyakit infeksi melalui jarum suntik yang digunakan berulang (Dunn 1987). Dalam kemasan 1 ml minyak iodium yang diberikan secara IM mengandung 480 mg iodium. Kehilangan iodium dalam urin pada hari pertama setelah injeksi minyak iodium adalah 6% (Dunn 1987; Chastin 1992). Efek pemberian dengan minyak iodium tersebut dapat meningkatkan kadar EIU selama 3,5 tahun dan setelah itu kadar EIU kembali seperti kadar pada awal sebelum diberi injeksi minyak iodium (Burgi & Helbling 1996) Pemberian minyak iodium secara oral merupakan cara cepat dan singkat untuk mengatasi kekurangan iodium. Dibandingkan dengan pemberian IM, distribusinya tidak memerlukan tenaga terlatih, tidak menyebabkan bahaya transmisi penyakit infeksi dan murah karena tidak membutuhkan alat suntik. Kelemahannya terletak pada compliance dilapangan akibat transportasi atau kesulitan mencapai penderita Efek dari minyak iodium (Lipiodol) secara oral dengan dosis tunggal 200480 mg iodine meningkatkan status iodium dan dapat menurunkan prevalensi gondok (Eltom et al. 1985; Benmiloud et al. 1994; Elnagar et al. 1995). Efek proteksi minyak iodium secara oral lebih singkat yaitu hanya 1 tahun dibandingkan dengan injeksi yang mempunyai efek 3 tahun. Kehilangan iodium melalui urin pada hari pertama pemberian sekitar 48% (Dun 1987; Chastin 1992). Selain minyak iodium dengan merek dagang Lipiodol, dikenal juga merek lain Brassiodol dan Yodiol. Bahan baku Lipiodol dari minyak biji opium, Brassiodol dari minyak biji lobak dan Yodiol dari minyak kacang tanah. Kadar asam lemak tidak jenuh tunggal pada minyak biji opium lebih rendah dibandingkan minyak kacang tanah dan minyak biji lobak. Kemampuan retensi iodium lebih tinggi pada asam lemak tidak jenuh yang mempunyai lebih banyak ikatan rangkap tunggal (Sirajudin 2003). 28 Sejak tahun 1920 garam beriodium telah digunakan untuk penanggulangan masalah gondok di Swiss (Djokomoeljanto 1989). Sampai saat ini banyak negara menggunakan metoda ini dalam menanggulangi GAKI. Cara ini sangat murah dan mempunyai cakupan yang luas. b. Program Pemerintah dalam Menanggulangi GAKI Upaya Pemerintah yang dilakukan yaitu berupa program jangka pendek dan panjang. Jangka panjang dengan iodisasi garam dan jangka pendek dengan distribusi kapsul minyak beriodium. Selain itu penyuluhan tentang manfaat garam beriodium dan pembinaan terhadap produsen garam juga dilakukan oleh Pemerintah. Iodisasi dilakukan pada garam dengan alasan garam merupakan media yang paling baik untuk menyampaikan iodium, karena garam merupakan bahan makanan yang dikonsumsi semua orang setiap hari sehingga menjamin masukan iodium dalam menu sehari hari. Garam yang beredar di Indonesia untuk konsumsi rumah tangga sesuai Peraturan Pemerintah No 15 tahun 1991 dan SK Menteri Perindustrian No 29/M/SK/2/1995 harus mengandung iodium 30-80 ppm (Tim Penanggulangan GAKY Pusat 2005; BPS 2000). Garam iodium yang dikonsumsi sekitar 10 g diharapkan dapat memenuhi kebutuhan iodium masyarakat (WHO 2001). Target garam beriodium untuk semua atau Universal Salt Iodization(USI) dapat dicapai apabila 90% masyarakat mengkonsumsi garam mengandung cukup iodium (BPS 2000). Kapsul minyak beriodium ditujukan untuk penduduk dengan risiko tinggi di daerah endemik berat dan sedang. Pendistribusian kapsul beriodium sebanyak satu kapsul Yodiol selama kehamilan dengan metoda blanket approach. Melalui metoda ini semua ibu hamil di daerah endemik memperoleh kapsul yodiol dan diharapkan terhindar dari kekurangan iodium selama kehamilan. Sebelumnya tahun 1974-1991 suntikan lipiodol secara intramuscular merupakan satu-satunya metode penanggulangan GAKI secara crash program (Djokomoeljanto 1989). Suntikan lipiodol dihentikan karena biaya operasional yang mahal dan diganti dengan kapsul Lipiodol. Akhirnya kapsul lipiodol diganti 29 juga dengan kapsul Yodiol tahun 1993 yang harganya lebih murah dengan efektifitas yang sama dengan kapsul Lipiodol. Sampai saat ini kapsul minyak iodium (yodiol) sudah didistribusikan secara luas di daerah GAKI berat atau sedang di seluruh Indonesia, terutama pada penduduk dengan risiko tinggi yakni anak sekolah, wanita usia subur dan wanita hamil. Kapsul minyak beriodium merupakan larutan iodium dalam minyak berbentuk kapsul lunak, mengandung 200 mg iodium. Dosis pemberian kapsul minyak beriodium ditentukan sebagai berikut : (1) Wanita usia subur (15-49 th) : 2 kapsul/tahun (2) Ibu hamil : 1 kapsul pada masa hamil (3) Ibu menyusui: 1 kapsul masa menyusui (4) Anak SD kelas 1-6 : 1 kapsul/tahun (Depkes 2000a). Garam krosok tanpa iodium diakui masih ditemukan, diperdagangkan dan digunakan oleh ibu rumah tangga di beberapa daerah Indonesia (Lamid et al. 1992). Kurangnya informasi dan harga yang murah menyebabkan ibu rumah tangga masih memilih garam krosok tersebut. Oleh karena itu perlu di lakukan penyuluhan kepada masyarakat tentang manfaat garam beriodium terutama kepada ibu rumah tangga. Peran ibu rumah tangga sangat menentukan dalam memilih dan menggunakan garam yang beriodium sehari-hari di rumah tangga. Melalui penyuluhan kepada ibu rumah tangga diharapkan terjadi perubahan perilaku ibu agar lebih mengutamakan aspek kesehatan dalam memilih garam yang digunakan sehari-hari. Pembinaan terhadap produsen garam beriodium perlu dilakukan mengingat masih ditemukan garam yang beredar mengandung iodium tidak sesuai dengan ketentuan yang ditetapkan pemerintah. Kandungan iodium dalam garam lebih rendah dari kadar yang ditetapkan maupun kandungan iodium yang tinggi melebihi kadar yang ditentukan 3. Zat Goitrogenik Zat goitrogenik merupakan faktor lingkungan yang memperberat GAKI. Peran goitrogenik pada kelenjar tiroid tergantung pada macam senyawa goitrogenik dan senyawa antitiroid. Tiosianat merupakan salah satu zat goitrogenik. Kerja senyawa tiosianat atau senyawa mirip tiosianat menghambat ambilan iodium (iodida) oleh kelenjar tiroid. Molekul iodida dan tiosianat 30 berkompetisi untuk diangkut ke dalam sel folikular karena komposisi molekul tiosianat mirip dengan iodida. Sianogenik glikosida dalam beberapa makanan pokok merupakan prekursor tiosianat (Gaitan et al. 1986). Singkong atau ubi kayu mengandung sianogenik glikosida, linamarin, yang mengalami hidrolisis setelah kontak dengan ensim linamarinase yang ada dalam singkong. Perubahan linamarin menjadi sianida kemudian dikonversikan menjadi tiosianat dijelaskan pada Gambar 1 dibawah ini. Linamarin dihidrolisis oleh ensim glikosida menghasilkan acetone cyanohydrin dan hidrogen sianida (HCN) kedua senyawa ini dikenal dengan nama cyanogens. Hidrolisis linamarin oleh ensim glikosida sangat tergantung oleh ensim linamarase yang dibebaskan dari tanaman pada kelembapan tinggi dan temperatur rendah. Cyanogen dapat dihilangkan melalui proses pengolahan. Sebaliknya pemecahan cyanohydrin menjadi sianida difasilitasi oleh pH basa, kelembapan yang rendah dan temperatur yang tinggi. HCN yang dihasilkan segera hilang mungkin karena larut dalam air atau menguap atau hilang karena pembentukan cyanohydrin kedua. Sianida di konversikan menjadi tiosianat oleh ensim yang ada di hati dan ginjal. Dalam proses ini, atom sulfur ditambahkan kedalam reaksi disuplai oleh asam amino sistein (Rosling 1994 ). Gambar 1 Cyanogenesis pada Singkong dan Metabolisme Sianida pada Manusia (Rosling 1994 ). 31 Batas maksimum asupan sianida yang aman dikonsumsi manusia adalah 10 mg (0.4 mmol) dan dosis yang lebih tinggi meningkatkan kadar methaemoglobin pada jaringan dan menimbulkan gejala keracunan (Lundquist 1985). Adanya ensim rhodanese pada jaringan dan reaksi sulfan-sulfur (asam amino mengandung sulfur dari makanan) akan mengkonversi sianida yang berlebihan menjadi tiosianat yang kurang toksik dan diekskresi melalui urin (Rosling 1994). Penelitian epidemiologi di kepulauan Maluku menemukan ada keterkaitan daerah endemik goiter dengan konsumsi tinggi makanan yang mengandung tiosianat yang diiringi dengan rendahnya EIU (Thaha et al. 2002). Walaupun demikian penghambatan terhadap transpor aktif iodium ke dalam kelenjar tiroid hanya efektif bila kosentrasi iodium di dalam darah normal atau lebih rendah (Wilson & Foster 1992). Suplementasi iodium yang diberikan dalam jumlah yang cukup dan teratur dapat mengatasi masalah hambatan transpor aktif tersebut (Gaitan 1986). 4. Indikator GAKI WHO (2001) merekomendasikan pengukuran berat atau ringan GAKI dengan menggunakan dua indikator yaitu indikator klinis dan biokimia. Indikator klinis merupakan metoda non-invansive yaitu dengan mengukur pembesaran kelenjar tiroid dengan cara palpasi dan ultrasonografi. Indikator biokimia dengan mengukur ekskresi iodium urin dan spesimen darah untuk menentukan tiroglobulin serta hormon tirotropin (TSH) darah. Walaupun tidak direkomendasikan oleh WHO (2001), penentuan fungsi hormon tiroid sering dilakukan dalam diagnose GAKI. a. Pengukuran pembesaran kelenjar tiroid . Cara palpasi mempunyai kelayakan lebih tinggi dari pada dengan cara ultrasonografi. Pengukuran prevalensi gondok endemik dengan cara palpasi lebih mudah dan ekonomis serta hanya membutuhkan pelatihan yang khusus bagi tenaga kesehatan. Cara ultrasonografi lebih mahal karena membutuhkan 1 set peralatan khusus lengkap dengan komputer dan tenaga yang terlatih untuk mengoperasikan peralatan tersebut. Interpretasi hasil pengukuran pembesaran 32 kelenjar tiroid pada wanita hamil dilakukan secara hati-hati karena selama kehamilan terdapat pembesaran kelenjar tioid karena terjadi hiperplasia kelenjar tiroid dan bertambahnya daerah vaskularisasi (Cunningham et al. 1989). b.Tiroglobulin Tiroglobulin yang dirilis kedalam sirkulasi merupakan indikator ketidak cukupan asupan iodium. Asupan iodium yang rendah menyebabkan terjadi proliferasi sel tiroid yang menghasilkan hiperplasia dan hipertrofi. Keadaan ini meningkatkan kadar serum tiroglobulin (WHO 2001). c. Ekskresi Iodium Urin (EIU) EIU merupakan indikator biokimia yang non invasive. EIU merupakan marker yang baik untuk menentukan asupan iodium terkini (WHO/Unicef/ICCIDD 1993). Asupan iodium kemudian dicerna dan diabsorpsi serta masuk kedalam peredaran darah dengan cepat. Sisa iodium yang tidak diabsorpsi diekskresikan terbanyak melalui urin dan sebagian kecil melalui keringat, feses dan udara pernapasan yang dihembuskan (Pernnington 1988). Ekskresi Iodium Urin individu sangat bervariasi dari hari ke hari bahkan dalam sehari tergantung asupan iodium. Eksresi Iodium Urin yang dikumpulkan pagi hari cukup memadai untuk pengukuran iodium pada populasi, sehingga tidak memerlukan contoh urin selama 24 jam (WHO 2001). Nilai EIU biasanya tidak terdistribusi dengan normal sehingga untuk menginterpretasikan nilai EIU populasi sebaiknya menggunakan median dari pada angka rerata (WHO/UNICEF/ICCIDD 1994). Distribusi EIU dapat digunakan untuk menilai asupan iodium dan status iodium populasi. Indikator EIU juga dapat menilai tingkat endemik suatu daerah. Pada Tabel 2 diuraikan bahwa kekurangan iodium ringan apabila asupan iodium dengan EIU dibawah 100 μg/L, sedangkan kekurangan iodium sedang jika EIU dibawah 50 μg/L. Kekurangan iodium berat apabila EIU dibawah 20 μg/L. Status iodium optimal apabila median EIU 100-199 μg/L. Median EIU 200-299 μg/L dikategorikan status iodium berisiko menyebabkan iodine induced hyperthyroidisim atau disebut dengan IIH. Asupan iodium berlebihan apabila 33 median EIU > 300 μg/L dan status iodium pada keadaan ini dapat menimbulkan resiko yang buruk terhadap kesehatan dengan munculnya penyakit autoimun, penyakit tiroid atau iodine induced hyperthyroidism. Tabel 2 Kriteria Secara Epidemiologi untuk Menilai Status Iodium berdasarkan Median EIU pada Anak Sekolah Median UIE (μg/L) Asupan iodium Status iodium < 20 μg/L Tidak cukup Kekurangan iodium berat 20 -49 μg/L Tidak cukup Kekurangan iodium sedang 50-99 μg/L Tidak cukup Kekurangan iodium ringan 100-199 μg/L Cukup Optimal 200-299 μg/L Lebih dari cukup Berisiko hipertiroid atau iodine induced hyperthyroidism (IIH) dalam waktu 5-10 tahun setelah pemberian garam beriodium pada golongan rawan. ≥ 300 μg/L Berlebihan Berisiko terhadap kesehatan (IIH, autoimun, penyakit tiroid) Sumber : WHO(2001). d. Hormon TSH Hormon TSH merupakan indikator terbaik untuk mendeteksi gejala hipotiroid primer (Greenspan & Baxter 1995). Pemeriksaan GAKI dan monitoringnya pada masyarakat menggunakan pemeriksaan serum atau bercak darah kering TSH bayi neonatal dan serum TSH dapat menentukan ketersediaan dan kecukupan dari hormon tiroid (WHO/UNICEF/ICCIDD/1994). Kadar hormon tiroid yang rendah pada kelenjar pituitari karena sintesis hormon tiroid yang berkurang merangsang pelepasan hormon TSH yang dapat dideteksi dalam darah. Hormon TSH merangsang semua tahapan metabolisme iodida mulai dari peningkatan ambilan (uptake) iodida dari sirkulasi, transpor iodida hingga peningkatan iodinasi tiroglobulin dan peningkatan sekresi hormon tiroid (Greenspan & Baxter 1995). 34 e. Fungsi hormon tiroid. Penentuan konsentrasi serum hormon tiroid tiroksin (T4) dan triiodotironin (T3) biasanya tidak direkomendasikan untuk memonitor GAKI pada populasi karena kedua uji tersebut sangat mahal dan merupakan indikator yang kurang sensitif (WHO 2001). Selain itu pemeriksaan serum T4 dan T3 pada ibu hamil ditemukan meningkat (Harada 1979), sehingga interpretasi hasil uji T4 dan T3 menjadi bias dalam menentukan uji fungsi tiroid pada ibu hamil. Perubahan yang mencolok selama kehamilan terjadi karena peningkatan protein transpor iodium yaitu Tiroid Binding Globulin (TBG), namun kadar hormon tiroid bebas atau free tiroksin (FT4) dalam keadaan seimbang atau normal (Greenspan & Baxter 1995). B. Pencernaan, Penyerapan dan Metabolisme Iodium 1. Sejarah Penemuan Iodium Penemuan iodium dirintis oleh Bernard Courtois yang berasal dari Perancis pada tahun 1811. Profesinya sebagai pembuat bubuk mesiu yang digunakan dalam perang saat itu mengantarkannya menemukan uap yang berwarna ungu. Uap ungu tersebut merupakan hasil isolasi dari rumput laut (seaweed) yang ditambahkan asam sulfat yang berlebihan kemudian uap ungu tersebut dapat dikristalkan. Karena kekurangan dana maka temuannya lebih disempurnakan oleh koleganya Charles Bernard Desormes (1777-1862); Joseph Louis Gay-Lussac (1778-1850) dan Andre-Marie Ampere (1775-1836) (Wikipedia 2007). Iodium berasal dari kata Yunani: iodes artinya violet; yang merupakan elemen kimia dengan simbol I, nomor atom 53 dan berat atom 127. Iodium merupakan halogen seperti halogen lain (brom, fluor) dan iodium cenderung menerima elektron dan ada di alam sebagai ion negatif. Secara kimia iodium kurang reaktif dibandingkan halogen lainnya (Wikipedia 2007). Biasanya iodium berikatan dengan logam atau non logam yang membentuk iodida (Wildman & Medeiros 2000). 2. Sumber Iodium dan Guna Iodium Kadar iodium dari tanaman sangat tergantung kandungan iodida tanah dimana tanaman itu tumbuh atau tergantung pada pupuk yang digunakan. 35 Sebagian besar iodium tumbuhan dalam bentuk anorganik (Matovinovic 1988) Kadar iodium air minum tergantung pada kandungan iodium dari batu-batuan dan tanah sumber air berasal. Demikian juga kandungan iodium hewan tergantung pada tanaman yang dimakan dan pakan yang digunakan serta air minum. Makanan laut atau seafood merupakan sumber iodium yang baik dari pada ikan segar dari air tawar maupun tumbuhan dari darat. Gambaran kandungan iodium bahan makanan di daerah endemik berdasarkan hasil penelitian Purwaningsih (1997) disajikan pada Lampiran 22. Iodium digunakan untuk obat, fotografi, bahan cat (dyes), antiseptik dan food suplemen. Sebagai unsur kelumit (trace element), iodium dibutuhkan oleh manusia dalam jumlah yang kecil, sedangkan peranan iodium secara biologi sebagai pembentuk hormon tiroksin (T4) dan triiodotironin (T3) (Wikipedia 2007) 3. Kebutuhan dan Kecukupan Iodium Kebutuhan iodium sangat bervariasi sangat tergantung dari usia, jenis kelamin dan ekskresi urin (Karyadi 1984). Kebutuhan iodium per hari adalah 1-2 μg per kg BB per hari (Almatsier 2001). Angka kecukupan iodium di Indonesia untuk wanita usia 16-19 th: 150 μg/hari dan 20-59 th: 150 μg/hari untuk ibu hamil ada tambahan sebesar 25μg/hari iodium untuk kebutuhan janin dan laktasi (Kartono & Sukatri 2004). 4. Pencernaan dan Penyerapan Iodium Iodium (I) dalam bahan makanan terikat pada asam amino atau dalam bentuk bebas, terutama dalam bentuk iodat (IO3-) dan dalam bentuk iodida (I-). Selama dicerna iodat dari bahan makanan akan mengalami reduksi oleh glutathion menjadi iodida sedangkan iodida (I-) langsung diserap dari lambung dan usus halus. Kemudian iodida memasuki enterosit bersama sebagian kecil iodium yang terikat asam amino yang tidak seefisien ion iodida. Iodida bebas (I-) diserap dari enterosit memasuki sirkulasi darah didistribusikan diseluruh cairan ekstra sel yang kemudian menembus kesemua jaringan tubuh. Iodida yang muncul di dalam darah dalam bentuk bebas tidak terikat dengan protein (Groff & Grooper 2000; Berdanier 2000). 36 Adapun pencernaan dan penyerapan kapsul minyak beriodium dijelaskan sebagai berikut: kapsul minyak beriodium dikonsumsi per oral, kemudian dicerna dalam usus halus. Setelah itu minyak beriodium diabsorbsi dan masuk kedalam peredaran darah, diantaranya memasuki kelenjar tiroid, disimpan dalam jaringan lemak tubuh dan sisanya dibuang melalui urin (Dunn & Van Der Haar 1990). Seperti diketahui kapsul minyak iodium (Yodiol) mengandung asam oleat 43.3%; asam linoleat 29.9% dan asam linolenat 0.40% (Sirajuddin 2003). Iodium yang terikat pada asam lemak ikatan rangkap tunggal (etil oleat) akan tertahan lebih lama dalam tubuh dibandingkan yang terikat pada asam lemak ikatan rangkap ganda (etil linoleat atau etil linolenat) (Van der Heide et al. 1989). Iodium yang tidak terikat pada asam lemak memasuki sirkulasi darah dalam bentuk iodida (I-) (Groff & Grooper 2000). Iodida dalam sirkulasi, sepertiganya ditangkap kelenjar tiroid, sebagian kecil memasuki jaringan dan sebagian besar dibuang melalui urin (Djokomoeljanto 1994). Iodida dalam sirkulasi darah ada yang masuk kedalam kelenjar saliva tetap dalam bentuk inorganik iodida dan biasanya akan diabsoprsi kembali (Husaini 1992). Kelenjar tiroid mengandung 70-80% total iodida tubuh dan dapat menangkap 120 μg iodida per hari. (Groff & Gropper 2000). Kelenjar tiroid terbentuk dari banyak bola-bola kecil (folikel) dan berkembang menjadi 2 lobus lateral tiroid yang dihubungkan oleh suatu jembatan jaringan yang disebut ismus tiroid. Ismus tirod terletak dibawa kartilago tiroid di pertengahan antara apeks kartilago tiroid (”Adam’s apple”). Masing-masing folikel dikelilingi oleh lapisan sel yang disebut koloid. Sel-sel folikel mensitesa tiroglobulin yang dikeluarkan kedalam lumen folikel. Biosintesa hormon tiroksin (T4) dan hormon triiodotironin (T3) terjadi dalam tiroglobulin (Ganong 1995)(Greenspan & Baxter 1995). 5. Sintesa, Sekresi Hormon Tiroid dan Transpor Hormon Tiroid Iodida yang diserap kedalam peredaran darah sebanyak sepertiganya ditangkap oleh kelenjar tiroid sedangkan sisanya dikeluarkan melalui urin. Kurang lebih 95% simpanan iodium tubuh berada dalam kelenjar tiroid sedangkan sisanya berada dalam sirkulasi darah (0.04-0.57%) dan jaringan ( Djokomoeljanto 1996). 37 Kelenjar tiroid merupakan tempat mensintesa hormon tiroid dari bahan baku iodium (Gambar 2). Kemudian iodium disintesa dan disekresi oleh kelenjar tiroid melalui beberapa langkah: -Tahap ”trapping” dimana iodium dikonsentrasikan oleh kelenjar tiroid dan dibawa ke kelenjar tiroid. Penangkapan iodium oleh kelenjar tiroid dari darah melalui sebuah pompa ensim ATP yang memompa Na+ kedalam dan K+ keluar dari kelenjar tiroid. Penangkapan iodida oleh folikel kelenjar tirod dari darah dengan proses transpor aktif. Sedikitnya 60 μg iodida harus ditangkap oleh kelenjar tiroid per hari untuk memproduksi hormon tiroid yang cukup (Wildman & Medeiros 2000). Gambar 2 Model Metabolisme Iodida dalam Folikel Tiroid ( Martin et al. 1987) 38 -Tahap organifikasi iodium: dimana iodium dioksidasi dan bereaksi (iodinasi) dengan tirosil residu dalam tiroglobulin (Tg). Iodinasi pertama yaitu iodium diikat pada asam amino tirosil dari tiroglobulin yang diaktifkan oleh ensim peroksidase menjadi 3-monoiodotirosine (MIT). Iodinasi kedua yaitu iodium diikat dengan MIT menjadi 3,5 diiodotirosin (DIT). -Tahap penggabungan (coupling): dua molekul dari diiodotirosin bergabung menjadi hormon tiroksin (T4) dan satu DIT dan MIT bergabung menjadi T3. Kemudian disimpan dalam koloid dari lumen folikuler tiroid. -Tahap pelepasan dimana hormon tiroid dirilis kedalam sirkulasi darah dan MIT dan DIT mengalami deiodinasi (Djokomoeljanto 1996). Setiap hari kira-kira 80-90 μg hormon 3,5,3’,5’-tetraiodothyronine (T4) atau disebut hormon tiroksin dan 10-20 μg hormon 3,5,3’-triiodothyronine (T3) diproduksi dan disekresikan ke dalam darah. Kelenjar tiroid secara aktif mengabsorbsi iodium dari darah untuk membuat dan mensekresi hormon ini ke dalam darah. Penurunan hormon tiroid dalam darah akan meningkatkan sekresi TSH (tirotropin) oleh kelenjar hipofisa dan sebaliknya peningkatan hormon tiroid akan menurunkan sekresi hormon TSH. Mekanisme ini diatur melalui efek umpan balik negatif yang melibatkan kerja kelenjar tiroid, hipotalamus dan hipofisa (Guyton 1982). Hipofisis mensekresikan hormon TSH dan dihambat melalui umpan balik negatif oleh hormon T4 dan T3 dalam darah (Granner 1985). Kerja TSH melalui cyclic AMP dan fosfolipase C yang mempengaruhi 4 tahap sintesa dan sekresi hormon tiroid dalam kelenjar tiroid. Secara khusus hormon TSH merangsang semua tahapan metabolisme iodium dari meningkatnya ambilan iodium oleh kelenjar tiroid hingga peningkatan sekresi hormon tiroid (Greenspan & Baxter 1994). Kadar serum TSH normal adalah sekitar 0.5 -5 mU/L meningkat pada hipotiroid dan menurun pada hipertiroid. Waktu paruh TSH plasma adalah sekitar 30 menit dan kecepakatan produksi harian adalah sekitar 40-150 mU/ml/hari (Greenspan & Baxter1994). 39 Kelenjar tiroid memproduksi 100% hormon T4 yang disirkulasikan dalam darah tetapi 5% - 10% nya merupakan hormon T3. Walaupun kosentrasi plasma hormon T4 lebih besar dari hormon T3 tetapi hormon T3 lebih aktif dan lebih potensial (Groff & Gropperr 2000). Hormon tiroid yang disekresi kemudian berikatan dengan transpor protein darah kemudian didistribusikan ke target sel perifer. Tiga transpor protein pembawa hormon tiroid ialah: a)Thyroid Hormone Binding Globulin (TBG) ditemukan dalam plasma dengan kapasitas rendah tetapi dengan afinitas yang tinggi terhadap hormon T4 dan T3; b) Albumin dan c) Transthyretin (prealbumin). Umumnya hormon T4 terikat pada TBG. Ada sebagian kecil <0.1% dari hormon T4 dan hormon T3 tidak berikatan dengan protein transpor tetapi dalam bentuk bebas yang secara hormonal lebih aktif (Groff & Grooper 2000). 6. Metabolisme Iodium Metabolisme iodium setelah kelenjar tiroid mensekresi hormon tiroid dapat dilihat dalam Gambar 2. Dalam gambar ini diperkirakan dari asupan 500 μg iodida (I-) setelah dicerna menghasilkan kurang lebih 500 μg I- yang memasuki pool iodida ekstraselular. Sebanyak 40 μg iodida yang dibebaskan kelenjar tiroid dan 60 μg iodida yang dibebaskan dari jaringan juga memasuki pool ekstraselular. Kemudian dari pool iodida ekstraselular, sepertiga iodida pool memasuki kelenjar tiroid (115 μg I-) dan sisanya keluar melalui urin (485 μg I-). Konsentrasi iodida dalam pool tiroid sangat besar mencapai 8000 μg I- (8 mg) dan merupakan tempat cadangan hormon tiroid. Setiap hari dilepas 75 μg I- (hormon T3, T4) membentuk pool sirkulasi sekitar 600 μg I- sebagai T3 dan T4. Kemudian dari pool ini dilepas sekitar 75 μg I- sebagai hormon T3 dan T4 digunakan dalam jaringan hati, otot, jantung dan otak. Jumlah tersebut dikembalikan ke pool iodida sekitar 60 μg Idan 15 μg I- dikonyugasi dengan glukoronida atau sulfat dalam hati dan diekskresi melalui feses (Greenspan & Baxter 1995). 40 Gambar 3 Metabolisme Iodium (Greenspan & Baxter1995). Hormon T4 yang didistribusikan ke jaringan tepi akan mengalami konversi (monodeiodinase) menjadi hormon T3 oleh pengaruh ensim deiodinase-5’. Hampir semua tiroksin dalam darah dikonversikan (deiodinasi) menjadi T3 setelah memasuki jaringan tepi. Ada 3 tipe deiodinase yaitu deiodinase-5’ tipe 1, deiodinase-5’ tipe 2 dan deiodinase-5’ tipe 3. Deiodinase-5’ tipe 1 merupakan ensim yang mengkonversikan hormon T4 menjadi hormon T3 di dalam kelenjar tiroid, hepar, ginjal, otot jantung, otot rangka. Deiodinase-5’ tipe 2 berperan mengkonversi hormon T4 menjadi hormon T3 pada jaringan otak dan kelenjar hipofisa. Ensim deiodinase-5’ tipe mengkonversi hormon T4 menjadi hormon T3 pada jaringan plasenta, sel glia (Lazarus 1993; Brody 1999). Hormon T3 di jaringan akan mengalami proses metabolisme pada tingkat seluler. Hormon T3 merupakan hormon yang menjembatani kerja hormon pada 41 tingkat seluler. Kemudian hormon T3 berikatan dengan reseptor hormon tiroid nukleus untuk inisiasi transkripsi mRNA mengarah kepada produksi protein baru termasuk mempengaruhi aktifitas sejumlah ensim, sintesa koensim dan vitamin dan kemampuan metabolisme lainnya. Terdapat 3 macam reseptor hormon trioid yaitu : TR α1, TR ß2 dan TR ß2 (Lazarus 1999). 7. Keseimbangan Dinamis (Turnover) Iodida dan Waktu Paruh Iodida dan Hormon Tiroid. Turnover atau keseimbangan dinamis iodida dalam darah sangat singkat terutama diatur oleh ambilan kelenjar tiroid. Dalam keadaan normal, dalam plasma waktu paruh iodida sekitar 10 jam tetapi dapat lebih singkat apabila kelenjar tiroid aktif secara berlebihan dalam keadaan tirotoksikosis atau dalam keadaan defisiensi iodium. Turnover hormon tiroid relatif lambat/pelan. Waktu paruh hormon tiroid (T4) normal sekitar 7 hari. Waktu paruh untuk hormon tiroid lainnya yaitu T3 antara 1,5 sampai 3 hari (Stanbury 1996) 8. Efek Spesifik Hormon Tiroid terhadap Tubuh Molekul T4 dan T3 mempunyai 4 dan 3 atom iodium. T4 sebagian besar sebagai prekursor T3 yang secara biologis lebih aktif (Wikipedia 2007). T4 atau hormon tiroid mempengaruhi hampir setiap sel dalam tubuh manusia. Hormon tiroid juga meningkatkan aktifitas pemecahan glukosa sehingga meningkatkan metabolisme dalam tubuh (Wildman & Medeiros 2000). Kekurangan hormon tiroid dapat menurunkan basal metabolisme sampai 50% sedangkan produksi yang berlebih dari hormon tiroid dapat mengakibatkan laju metabolisme basal 100% (Wildman & Medeiros 2000). Dari banyak efek hormon tiroid pada tubuh manusia dapat disimpulkan 3 efek yang utama pada tubuh yaitu 1) mengatur metabolisme dan keseimbangan energi, 2) mengatur pertumbuhan dan perkembangan, dan 3) mengatur aktifitas sistem syaraf (Tortora & Anagnostakos 1990). Lebih rinci pada Tabel 3 di bawah diuraikan beberapa efek spesifik hormon tiroid (Wilman & Medeiros 2000). 42 Tabel 3 Pengaruh Hormon Tiroid dalam Mekanisme Tubuh Mekanisme Pengaruh hormon tiroid Metabolisme Karbohidrat merangsang absorpsi gula dan ambilan oleh sel, meningkatkan metabolisme karbohidrat, khususnya glikolisis dan glukoneogenesis, meningkatkan rilis hormon insulin Metabolisme Lemak meningkatkan mobilisasi lemak jaringan adipose, meningkatkan kandungan plasma asam lemak bebas (FFA) dan meningkatkan oksidasi asam lemak dalam sel, mengurangi plasma kolesterol dan trigliserida diduga dengan meningkatkan kandungan asam empedu-kolesterol dan membuang melalui feses. Sintesa Protein meningkatkan sintesa protein, tetapi dalam jumlah berlebih menyebabkan katabolisme protein Metabolisme Basal meningkatkan metabolisme pada semua sel, kekurangan hormon tiroid menyebabkan metabolisme basal turun 50% Sistem Kardiovaskuler meningkatkan denyut jantung; meningkatkan volume darah Respirasi Makanan/ Pencernaan meningkatkan respirasi karena metabolisme seluler meningkat meningkat nafsu makan dan konsumsi makanan, meningkat laju sekresi cairan lambung dan motilitas dari saluran pencernaan makanan dan kekurangan hormon tiroid menyebabkan konstipasi Skeletal Muscle meningkat kontraksi vigor Central Nervous System meningkat ”elation”, jumlah yang berlebih menyebabkan gugup dan cemas Kelenjar Endokrin meningkat laju sekresi endokrin Sumber: Wildman dan Medeiros (2000) C. Iodium dan Kehamilan Selama hamil terutama pada trimester pertama, terjadi adaptasi fisiologi yang ditandai peningkatan kadar Thyroid Binding Globulin (TBG) dan kenaikan ini sebagai respon terhadap meningkatnya hormon estrogen dan Human Chorionic Gonadotropin (hCG), sehingga merangsang kelenjar tiroid ibu membesar (Cunningham 1989). Kondisi tersebut menyebabkan goiter sementara pada masa kehamilan dan akan kembali normal setelah melahirkan. 43 Selama kehamilan, iodium dibutuhkan untuk ibu sendiri dan pertumbuhan janin sehingga kebutuhan iodium ibu hamil meningkat. Peningkatan kebutuhan jumlah iodium juga untuk menutupi kehilangan iodium melalui peningkatan renal clearance iodium. Gambar 4 Morfologi Embrio dan Janin (Rathus 1988) Iodium atau hormon T4 ditransfer melalui plasenta dan hal ini menunjukkan pentingnya peranan hormon tiroid pada pembentukan embrio dan janin. Sebelum usia kehamilan mencapai 12-18 minggu, hormon T4 dan reseptor hormon tiroid ditemukan pada jaringan janin. Namun produksi hormon tiroid janin dimulai pada trimester 2 (deViljder 1996). Gambaran morfologi embrio dan janin diuraikan secara lengkap pada Gambar 4. 1. Iodium untuk Perkembangan Otak Janin Manusia Iodium dalam bentuk hormon tiroid berperan pada perkembangan otak. Pada sel otak, T4 dan T3 mengalami monoiodinase dimana T4 dikonversi menjadi hormon rT3 dan T3 di konversi menjadi T2 dengan bantuan ensim deiodinase -5’ 44 tipe 3. Ensim ini ditemukan di plasenta dan mempunyai peran melindungi dan menghindari hormon tiroid yang berlebihan mencapai janin (Bernal 2005). Reseptor hormon T3 pada sel nukleus mengikat T3 dan jumlah T3 yang terikat pada reseptor tersebut meningkat 6-10 kali pada kehamilan 10-16 minggu (Vulsma et al. 1989). Pada janin, hormon tiroksin (T4) dapat ditemukan pada kehamilan trimester pertama (kehamilan 6 minggu) yaitu pada cairan coelomic, jauh sebelum dimulai sekresi hormon T4 oleh tiroid janin pada 24 minggu kehamilan. (Contempre et al. 1993). Walaupun pada usia 24 minggu janin dapat mensekresi T4 sendiri, transfer tiroid dari ibu ke janin masih tetap berlanjut sampai kehamilan trimester 3. Bahkan dalam darah ari-ari pada saat bayi lahir ditemukan 30% serum T4 berasal dari ibu (Delange et al.1989; Vulsma et al. 1989). Perkembangan otak dikategorikan dalam dua periode berdasarkan laju pertumbuhan maksimal (Dobbing & Sands 1973), terlihat pada Gambar 4. Gambar 5 Fungsi Tiroid Janin dan Postnatal pada Manusia dan Hubungannya dengan Laju Pertumbuhan Cepat Otak (Delange & Fisher 2006). 45 Periode pertama terjadi selama trimester 1 dan 2 atau antara umur kehamilan 3 dan 5 bulan. Pada periode ini terjadi multiplikasi, migrasi dan organisasi neuron. Kemudian periode kedua terjadi pada trimester 3 sampai 2 – 3 tahun post natal. Pada periode ini terjadi multiplikasi, migrasi dan myelinisasi sel glial. Periode pertama terjadi sebelum kelenjar tiroid janin berfungsi optimal dan suplai hormon tiroid pada tumbuh kembang janin hampir seluruhnya berasal dari ibu. Pada periode kedua, suplai hormon tiroid pada janin berasal dari sekresi janin sendiri dan suplai dari ibu melalui plasenta (Morreale de Escobar et. al. 2000). 2. Kelebihan dan Kekurangan Iodium pada Janin Dalam Kandungan Tiroid janin mulai mengakumulasi iodium pada kehamilan 10 minggu tetapi yang bebas dari efek Wolff-Chaikoff hanya selama 4 minggu kehamilan. Roti dan Braverman (1996) melaporkan bahwa janin yang terpapar oleh ibu hamil yang mengalami kelebihan iodium (obat), dapat menyebabkan gondok dan hipotirod khususnya di daerah defisiensi iodium. Ibu hamil yang mengalami kelebihan iodium berisiko meningkatnya transient kosentrasi TSH ari-ari bayi (Novaes et al. 1994; Roti & Braverman 1996). Janin yang defisiensi iodium karena ibu selama hamil kekurangan iodium, akan mengalami gangguan dalam produksi dan sintesa hormon tiroid janin dan ibu. Suplai hormon tiroid yang tidak cukup pada janin menyebabkan terjadi gangguan pertumbuhan dan perkembangan otak janin. Dampak negatifnya bayi yang dilahirkan mengalami hipotiroid. Hormon tiroid berfungsi dalam tumbuhkembang dengan cara diferensiasi sel dan ekspresi gene. Hormon tiroid T3 mengikat reseptor nukleus yang mengatur ekspresi gene spesifik dalam otak janin dan kehidupan postnatal. T3 terikat pada reseptor inti didapat dari konversi T4 melalui deiodinase-5’tipe 2, dan bukan dari sirkulasi T3 (Morreale de Escobar et al. 2004; Delange 2001) 3. Bukti-Bukti Pengaruh Kekurangan Iodium pada Tumbuh Kembang Janin Bukti kekurangan iodium pada tumbuh kembang janin dikumpulkan dari penelitian pada hewan yang bunting yang dibuat kekurangan iodium dan pada anak yang mengalami kekurangan iodium. 46 Penelitian telah dilakukan pada tikus, marmot, dan domba yang relevan dengan masalah kretin endemik dan kerusakan otak hasil akibat kekurangan iodium. Tikus diberi makanan yang biasa dikonsumsi oleh penduduk desa Jixian di China (Li et al. 1985; Zhong et al. 1983; Hetzel & Hay 1979). Desa tersebut termasuk desa endemik GAKI dengan prevalensi kretin endemik 11%. Diit terdiri dari jagung dan gandum, sayuran dan air diambil dari daerah ini dengan kadar iodium diit ini sebesar 4.5 ug/kg. Setelah 4 bulan diberi diit, tampak nyata timbul neonatal goiter, serum T4 janin lebih rendah dibandingkan dengan kontrol, dan berat otak tikus menurun. Marmot bunting dibuat defisiensi iodium tingkat berat dengan memberikan campuran diit jagung yang kurang iodium akan melahirkan bayi yang mengalami defisiensi iodium yang ditunjukkan dari pertumbuhan rambut yang jarang (Mano et al. 1987). Kelenjar gondok induk membesar diikuti dengan penurunan kadar plasma T4 pada trimester kedua dan kadar plasma T4 pada bayi juga menurun. Berat otak bayi marmot juga turun secara signifikan pada trimester kedua bila dibandingkan pada trimester pertama. Hal tersebut menunjukkan penurunan berat dan jumlah sel cerebellum akibat kurang iodium yang berat pada otak primata. Domba dibuat defisiensi iodium dengan memberikan diit rendah kandungan iodium. Pada usia 140 hari janin mengalami defisiensi iodium dan pertumbuhan fisik berbeda dengan janin kontrol (Potter et al. 1981). Pengamatan lain menemukan bahwa kekurangan iodium menyebabkan pertumbuhan wool kurang, kerusakan pembentukan otak dan keterlambatan maturasi tulang yang diindikasi keterlambatan munculnya epiphyses pada kerangka domba (Hetzel et al. 1988). Pada kehamilan umur 56 hari, hasil histologi jaringan tiroid ditemukan hyperplasia. Penurunan berat otak dan kandungan DNA dimulai sejak dini yaitu pada usia 70 hari. Indikasi penurunan jumlah sel otak terjadi dan hal ini dimungkinkan oleh adanya keterlambatan multiplikasi neuroblast secara normal yang terjadi pada hari ke 40-80 hari. Penemuan kejadian di cerebellum serupa dengan yang terjadi pada marmot (Potter et al. 1981). Hal ini disebabkan ada hubungan penurunan kandungan iodium pada kelenjar tiroid janin dengan penurunan plasma T4. Hal ini menunjukkan pentingnya hormon tiroid untuk ibu dan janin dalam perkembangan otak janin 47 Kekurangan iodium pada anak-anak di daerah yang kekurangan iodium tingkat sedang menyebabkan terjadi abnormalitas dalam perkembangan psikomotor dan intelektual anak-anak dan orang dewasa yang secara klinis eutiroid tetapi tidak ada tanda atau gejala kretin endemik. Hal ini dibuktikan dari 19 kajian meta analisis pada fungsi neuromotor dan kognitif pada kondisi kekurangan iodium sedang dan berat berakibat kehilangan 13,5 IQ poin (Bleichrodt 1994). Tabel 4 Defisit Perkembangan Mental pada Bayi dan Anak Sekolah pada Keadaan Kekurangan Iodium Berat dan Sedang Daerah Spanyol Sicily, Italia Tes/Uji Bayley McCarthy Cattell Bender-Gestalt Tuscany Wechsler Raven Tuscany WISC Reaksi waktu India Verbal, Tes pictorial Tes motivasi Bender-Gestallt Raven Tes psikomotor verbal Tes non verbal Tes intelektual Tes psikomotor Iran Malawi Benin Temuan Perkembangan psikomotor dan mental rendah dibanding kontrol Kemampuan motor persepsi rendah Neuromuscular abnormal Neurosensorial abnormal IQ verbal rendah Motor persepsi rendah Kecepatan respon motorik rendah Kemampuan belajar rendah Retardasi perkembangan psikomotor Defisit IQ 10 poin dibanding kontrol Defisit IQ 5 poin dibanding kontrol Sumber Bleichrodt et al. (1989) Vermiglio et al. (1990) Fenzi et al. (1990) Vitti et al.(1992) Aghini-Lombardi et. al.(1995) Tiwari et al. (1996) Azizi et al. (1993) Shrestha (1994) Van den Briel et al. (2000) 4. Perubahan Fungsi Tiroid Sejak Usia Dini dan Konsekuensi Terhadap Status Gizi Bayi dan Anak Sebanyak 10% bayi lahir mempunyai tanda biokimia kegagalan fungsi tiroid yang disebabkan kekurangan iodium tingkat berat dan asupan tiosianat yang berlebihan di daerah endemik GAKI di Ubangi, Zaire (Delange 1986). Individu yang hipotiroid tingkat berat juga mempunyai angka kematian yang tinggi 48 (Contempre 1993), walaupun dapat bertahan hidup sampai remaja tetap menjadi hipotiroid. Hal ini dapat dilihat pada individu yang menjadi endemik kretin miksodem pada usia dewasa. Skema di bawah ini dibuat oleh Delange (1986), tampak hipotiroid yang berat pada bayi mungkin masih dapat diperbaiki karena masih dalam periode perkembangan otak tetapi tidak dapat mengkoreksi kerusakan pada perkembangan mental. Fenomena ini sering terjadi dilaporkan pada anak-anak eutiroid yang mengalami keterlambatan mental karena anak tersebut dahulu hipotiroid yang telah mendapatkan pengobatan. Hipotiroid pada bayi yang berlanjut pada usia remaja atau dewasa berkembang menjadi kretin endemik. Serum T4 Euthyroid Range Hypothyroid Range Gambar 6 Skema Hubungan Fungsi Tiroid Sejak Usia Dini sampai Masa Anak-anak (Delange 1986). Kongenital hipotiroid dapat dicegah pada ibu hamil yang mengalami defisiensi iodium. Koreksi defisiensi iodium secara klinis dan biokimia pada bayi dapat memperbaiki normal fungsi hipotiroid, tetapi perbaikan hanya sebagian jika intervensi terjadi selama masa anak dan remaja. Kasus hipotiroid tidak dijumpai, 49 tetapi kemungkinan terjadi kerusakan otak minor jika koreksi terjadi pada permulaaan masa anak-anak, atau terjadi hipotiroid pada tingkat tertentu yang diikuti dengan defisiensi mental yang berat jika koreksi terlambat pada masa anak-anak dan remaja. Bayi lahir dengan fungsi tiroid yang normal dan fungsi tiroid ini selanjutnya tetap normal. Bayi akan tetap tidak hipotiroid dan tidak mengalami mental retardasi. Hipotiroid mungkin terjadi pada bayi umur diatas 3 tahun, akan menghasilkan hipotiroid dan retardasi mental yang dapat diperbaiki atau disebut ”late onset hipotiroidism”. Hal ini menunjukkan pentingnya uji saring (skrining) neonatal untuk mendeteksi hipotiroid kongenital yang disebabkan oleh pengaruh lingkungan. 5. Dosis Iodium Dalam Kapsul Minyak Iodium untuk Ibu Hamil Pemberian kapsul minyak beriodium untuk berbagai kelompok umur di daerah endemik GAKI sedang dan berat berbeda. Menurut Depkes (2000b), kapsul dibagikan untuk wanita usia subur (2 kapsul/tahun); ibu hamil (1 kapsul pada masa hamil); ibu menyusui (1 kapsul masa menyusui) dan anak SD kelas 1-6 (1 kapsul/tahun). Merujuk dari program Depkes, ibu selama hamil di daerah endemik GAKI mendapat 1 kapsul minyak iodium dengan dosis iodium 200 mg Tabel 5 Dosis Iodium dan Frekuensi Minyak Iodium per Oral/Intra Muskular (IM) per Kelompok Umur Durasi efek Kelompok umur 3 bln Oral 6 bln Oral 12 bln Oral >1 th IM WUS (wanita usia subur) 100-200 mg I 200-480 mg I 400-960 mg I 480 mg I Ibu hamil 50-100 mg I 100-300 mg I 300-480 mg I 480 mg I Bayi 20- 40 mg I Anak 1-5 th 40-100 mg I 100-300 mg I 300-480 mg I 480 mg I Anak 6-15 th 100-200 mg I 200-480 mg I 400-960 mg I 480 mg I Laki dewasa 100-200 mg I 200-480 mg I 400-960 mg I 480 mg I 50-100 mg I 100-300 mg I 240 mg I Sumber: WHO/UNICEF/ICCIDD (1992) 50 Dosis iodium dan frekuensi minyak iodium yang direkomendasikan oleh WHO/UNICEF/ICCIDD (1992) untuk target grup ditunjukkan pada Tabel 5. Secara oral, dosis yang direkomendasikan untuk ibu hamil selama 3, 6 dan 12 bulan adalah 50-100 mg Iodium (I); 100-300 mg I dan 300-480 mg I. Dosis iodium dalam kapsul minyak iodium dibagikan pada ibu hamil di Indonesia masih dalam batas dosis iodium yang direkomendasikan oleh WHO yaitu 100-300 mg I. 6. Penelitian di Berbagai Negara Menggunakan Minyak Iodium untuk Wanita Hamil Penelitian dari beberapa negara telah memberikan suplemen minyak iodium dengan dosis tinggi (iodium ≥ 200 mg) dan dosis rendah (iodium <200mg). Penelitian Cao et al. (1994) di China, Anwar et al. (1998) di Bangladesh, Zaleha et al. (2000) di Malaysia dan Hadisaputro et al. (2004) di Indonesia, memberi ibu hamil 1 kapsul minyak iodium dengan dosis 400 mg (Tabel 6). Ibu yang mendapat suplemen kapsul iodium menunjukkan EIU selama hamil meningkat. Bayi yang dilahirkan mempunyai berat badan lebih tinggi dari pada kontrol. Kasus bayi dengan TSH neonatal (blood spot) tinggi ditemukan lebih sedikit dibandingkan kontrol. Perkembangan mental bayi dan anak lebih baik apabila iodium diberikan lebih awal yaitu pada trimester 1 dan 2. Semua penelitian tersebut menggunakan kapsul Lipiodol kecuali penelitian di Indonesia menggunakan kapsul Yodiol. Penelitian yang dilakukan Chaouki dan Benmiloud (1994) di Aljazair memberikan ibu selama hamil kapsul Lipiodol dengan dosis iodium 200 mg. Dari penelitian tersebut ditemukan kadar EIU ibu nifas meningkat 2 kali lebih tinggi dibandingkan dengan keadaan awal penelitian ketika ibu hamil. Serum TSH ibu nifas menurun sekitar 50% dan free T4 meningkat dibandingkan pada awal penelitian. Tidak ditemukan bayi yang lahir dengan tanda-tanda neonatal hipotiroid. Dampak terhadap kesehatan bayi akibat pemberian minyak iodium secara oral diberikan pada ibu hamil trimester 1 di Aljazair yaitu dapat menurunkan angka keguguran dan bayi lahir mati (Chouki & Benmiloud 1994). 51 Tabel 6 Penelitian tentang Kapsul Minyak Iodium Dosis Tinggi pada Ibu Hamil Penelitian/ Lokasi Dosis iodium selama hamil Hasil 1. Zaleha et al. 2000 Malaysia 480 mg EIU meningkat selama hamil Setelah 6 & 12 bulan intervensi terjadi hipertiroid dari pemeriksaan serum FT4 2. Anwar et al.1998 Bangladesh 400 mg Rerata BB lahir lebih tinggi Proporsi serum T4 total bayi rendah (<16 nmol/L) kecil Proporsi serum TSH (>4,8mU/L) bayi kecil 3. Cao et al. 1994 China 400 mg Perbaikan neurologik: besar: iodium diberi trimester 1 & 2 kecil : iodium diberi pd trimester 3 4. Hadisaputro et al 2004, Ngawi 400 mg 200 mg Dosis 400 mg lebih baik pada perkembangan motorik kasar 5. Chaouki dan Benmiloud. 1994 Aljazair 240 mg Neonatal hipotiroid tidak ditemukan Ibu nifas : EIU naik 2 x TSH turun 50%, FT4 naik Kasus hiperiroid atau tirotoksikosis juga ditemukan di Sudan. Orang dewasa yang menderita GAKI dilaporkan mengalami tirotoksikosis setelah mendapat suplementasi iodium secara oral (Elnagar et al. 1995). Selain kapsul kapsul minyak iodium dosis tinggi, kapsul minyak iodium dosis rendah dilaporkan juga telah diberikan kepada orang dewasa yang berumur 20-30 tahun di Zaire. Kapsul minyak iodium dengan dosis 47 mg dan 118 mg diberikan selama setahun. Hasil penelitian tersebut tidak berbeda dengan penelitian yang memberikan kapsul minyak iodium dosis tinggi yaitu pembesaran kelenjar gondok berkurang, kadar EIU menjadi normal pada bulan ke 6 dan 9 dan tidak ditemukan efek samping seperti kasus hipertiroid. Pemberian kapsul minyak iodium dosis rendah lebih efektif, efisien dan dapat diterima dari pada pemberian melalui intra muskular dan tidak mempunyai efek samping seperti halnya minyak iodium dosis tinggi (Tonglet et al. 1992). 52 D. Uji Saring Hipotiroid Kongenital pada Bayi Baru Lahir dan Bayi Nenonatal Hipotiroid kongenital merupakan kekurangan hormon tiroid sejak lahir hal ini disebabkan kekurangan iodium yang terjadi sebelumnya yaitu sejak dalam kandungan. Bila terlambat diobati akan menyebabkan gangguan pertumbuhan dan perkembangan mental yang tidak bisa dipulihkan kembali atau irriversible (Rustama 2003). Upaya deteksi dini perlu dilakukan sehingga pengobatan dapat dilakukan dengan segera, agar bayi dapat tumbuh dan berkembang secara optimal. Upaya deteksi dini dengan uji saring (skrining) pada bayi baru lahir atau bayi neonatal sebagai berikut: a. Pada bayi baru lahir (umur 2-6 hari ) dilakukan pengambilan sampel darah dari tali pusar atau dari tumit. Kemudian darah diteteskan diatas kertas saring (filter paper) dan dikeringkan. Batasan (cut-off) untuk bayi yang dicurigai positif hipotiroid yang digunakan yaitu : cut-off 25 uU/ml: untuk sampel darah dari tali pusar cut-off 20 uU/ml: untuk sampel darah dari tumit Apabila sampel dicurigai positif dengan nilai diatas cut-off tersebut diatas maka dilakukan pemeriksaan ulang TSH dan T4 darah vena serta mencari gejala klinis hipotiroid kongenital (Rustama 2003). b. Pada bayi neonatal (umur 4 -14 hari) dilakukan pengambilan sampel darah dari tali pusar atau tumit bayi, kemudian tetesan darah ditampung diatas kertas saring (Sunartini 2006). Batasan (cut-off) untuk bayi yang diduga positif hipotiroid sama dengan pada bayi baru lahir E. Kekurangan dan Kelebihan Iodium (Iodine Excess) 1. Kekurangan Iodium Kekurangan iodium adalah suatu keadaan dimana asupan iodium kurang dari bahan makanan sehari-hari sehingga ambilan iodium oleh kelenjar tiroid berkurang. Akibatnya produksi dan sekresi hormon tiroid menurun. Dalam keadaan ini terjadi meningkatkan pelepasan TSH dari hipofisa. Kondisi ini menyebabkan kelenjar gondok bekerja keras untuk memproduksi lebih hormon tiroid. Peningkatan stimulasi TSH merupakan adaptasi normal tetapi dapat 53 menyebabkan gondok apabila defisiensi iodium terus berlanjut. Rendahnya kadar hormon tiroid dalam darah disebut hipotiroid (Dunn & Van Der Haar 1990). Gejala hipotiroid yang umum ditemukan seperti fatigue, gondok, depresi, berat badan kurang, temperatur tubuh basal turun dan perkembangan mental yang terlambat (Wikipedia 2007) 2. Kelebihan Iodium (Iodine Excess) Kelebihan iodium dapat menimbulkan beberapa efek samping. Batasan asupan iodium yang dianggap toksik masih beragam. Food and Drug Board dari Medicine Institute, US National Academy telah mengatur bahwa batas atas yang dapat ditolerir asupan iodium orang dewasa sebanyak 1100 μg per hari (Dunn 2002). WHO merekomendasikan bahwa intake sampai 1 mg/hari pada orang dewasa yang eutiroid masih aman (WHO 1994). Elemental iodium adalah toksik bila dikonsumsi dalam jumlah yang besar yaitu 2-3 gram (Wikipedia 2007). Berikut ini adalah contoh efek biokimia akibat pemberian iodium dosis tinggi. Penelitian distribusi iodium dosis tinggi dengan dosis 150 mg per hari menurunkan pelepasan hormon T4 dan T3 dalam sirkulasi sehingga hipotalamus (TRH) merangsang peningkatan kosentrasi TSH. Ketika pemberian tidak diteruskan pasien kembali eutiroid (Roti & Braverman 1996). Efek dari asupan iodium yang berlebihan secara terus menerus dapat menyebabkan iodine-induced hyperthyroidism (IIH) atau hipertiroid/tirotoksikosis, iodine-induced hypotiroidism atau hipotiroid, dan penyakit kanker tiroid (Dunn 2002). Oleh karena itu program iodisasi garam dan kapsul minyak beriodium di daerah defisiensi iodium memerlukan perhatian. Para ahli sependapat bahwa pemberian iodium pada daerah yang cukup atau daerah endemik secara terus menerus dapat menyebabkan pembesaran kelenjar gondok, atau produksi hormon tiroksin berlebihan (hipertiroid), atau terjadi hipotiroid, atau dapat memicu terjadi respon autoimun, serta penyakit kanker tiroid (Sutanegara 2004). Mekanisme terjadi hipotiroid akibat kelebihan iodium karena efek WolfChaikoff (Roti & Braverman 1996). Peningkatan pemberian iodida (I-) meningkatkan inhibisi organifikasi iodida sehingga hormogenesis hormon tiroid 54 menurun diduga disebabkan oleh inhibisi pembangkitan H2O2 oleh kandungan Iintratiroidal yang tinggi. Mekanisme terjadi hipertiroid atau Iodine Induced Hyperthyroidism (IIH) yang kadang-kadang disebut dengan Jodbasedow yaitu akibat kelebihan iodium karena beban iodida yang meningkat terus menerus pada pasien yang sebelumnya dengan kelenjar tirod yang normal, pasien dengan penyakit Graves atau pada pasien orang tua atau dewasa dengan goiter multinoduler (Greenspan & Baxter 1994). Data epidemiologi tentang kasus hipertiroid yang pernah terjadi akibat pemberian iodium secara terus menerus: 1. Iodisasi garam dengan dosis iodium tinggi - Di Tasmania fortifikasi roti (5-10th) dengan iodium ditingkatkan menjadi 150 μg. Komplikasi Jodbasedow ditemukan sekitar 0.4% dari populasi 3.319 orang (IDD Newsletter 1996). - Di Zaire iodisasi garam selama 2 th dengan dosis iodium 100 ppm. EIU naik menjadi 200-500 μg/hr; 14% serum TSH tidak terdeteksi ; serum T4 dan T3 naik ada gejala tirotoksikosis. - Di Zimbabwe garam iodisasi dengan dosis iodium sampai 148 ppm dilaporkan terjadi tirotoksikosis (Todd et al. 1995). 2. Suplementasi iodium - Di Sudan orang dewasa yang menderita GAKI mengalami tirotoksikosis setelah mendapat suplementasi iodium secara oral (Elnagar et al. 1995). - Pemberian suplemen iodium dosis tinggi pada daerah yang kekurangan iodium endemik seperti di Brazil dan Spanyol terjadi hipertiroid (Roti & Braverman 1996). - Pemberian minyak iodium dilaporkan terjadi tirotoksikosis pada orang dewasa dan anak sekolah : Malaysia (8 dari 240 orang orang dewasa) Maberly et al. (1982) Sudan (4 dari 117 orang orang dewasa) Elnagar et al. (1995) Sudan (1 dari 2393 anak sekolah) Eltom et al. (1985) 55 Gejala hipertiroid/tirotoksikosis yaitu degup jantung keras, sangat gugup, lemah, tak tahan panas dan kehilangan berat badan. Kadang-kadang hipertiroid menjadi berat dan mematikan. Peningkatan hipertiroid diasosiasikan dengan peningkatan ketersediaan iodium di daerah yang sebelumnya defisiensi iodium. F. Pencernaan, Penyerapan dan Metabolisme Vitamin A dan Beta Karoten Vitamin A merupakan salah satu dari vitamin yang larut dalam lemak. Penemuannya bermula dari pengamatan McCollum th 1913-1917 pada tikus yang diberi diit serelia yang mengandung lemak. Kemudian tikus yang diamati mengalami gangguan pertumbuhan. Ketika pakan tikus ditambah ekstrak kuning telur, ternyata kesehatannya pulih kembali. Akhirnya dari pengamatannya, ditemukan ’a fat soluble factor A’ yang terdapat dalam makanan tertentu yang penting untuk kelangsungan hidup dan untuk pertumbuhan (Underwood 1998; Day HG 1997). Istilah vitamin A merujuk kepada retinol (alkohol), retinal (aldehide), retinoic acid (metabolit retinal) dan vitamin A juga merujuk kepada prekursor vitamin A (Groff & Gropper 1995). Prekursor vitamin A adalah karotenoid yang umum adalah beta karoten. Karotenoid lain yang mempunyai aktifitas secara biologis seperti ß-karoten, adalah α-karoten, γ-karoten dan likopen. Diantara karoten tersebut, beta karoten yang paling potensial. Dari sekitar 600 karotenoid yang ada hanya sekitar 50 an dapat dikonversi dan mempunyai aktifitas vitamin (Berdanier 2000). Sifat fisik vitamin A dan beta karoten yaitu berwarna kuning, larut dalam lemak atau pelarut lemak. Selain itu vitamin A dan beta karoten masing-masing mempunyai bentuk konfigurasi cis dan trans dan masing masing mempunyai ikatan rangkap. Ikatan rangkap inilah mencirikan adanya sifat antioksidan (Berdanier 2000). Vitamin A berperan dalam berbagai fungsi faali tubuh yaitu berperan dalam sintesa protein, reproduksi, pertumbuhan dan penglihatan (Berdanier 2000). Beta karoten merupakan prekursor vitamin A di dalam tubuh dan secara in-vitro beta karoten mempunyai aktifitas sebagai antioksidan. 56 Gambar 7 Vitamin A dan Beta karoten (Brody 1999). 1. Sumber Vitamin A dan Beta Karoten Retinol bentuk aktif dari vitamin A jarang ditemukan dalam makanan. Dalam makanan vitamin A ditemukan dalam bentuk retinil ester (retinil palmitat) yang ditemukan umumnya pada makanan dari hewan seperti kuning telur, hati, minyak ikan susu dan mentega. (Groof & Grooper 2000). Dalam pangan nabati, vitamin A dalam bentuk prekursor vitamin A atau provitamin A. Provitamin A dalam tanaman berupa karotenoid. Makanan yang kaya karoten adalah buah yang berwarna, sayuran berwarna, wortel, sayuran daun hijau dan minyak sayuran. Kandungan beta karoten dari bahan makanan bervariasi tergantung kondisi pertumbuhan dan penanganan pasca panen dan juga pencernaan mempengaruhi ketersediaannya (Berdanier 2000). 2. Pencernaan Vitamin A dan Beta Karoten Bahan makanan yang dikonsumsi yang mengandung vitamin A (sebagai retinil ester seperti retinil palmitat) dari pangan hewani, provitamin A dalam 57 pangan nabati dan beta karoten elemental (suplemen) mengalami proses pencernaan dalam tubuh. Di lambung, protein dalam makanan yang dikonsumsi dihidrolisis oleh ensim pepsin. Pemisahan protein dari retinil ester dan karotenoid dari bahan makanan berlanjut di usus halus oleh ensim proteolitik dan di pankreas oleh ensim esterase. Pada saat bersamaan di pankreas, asam lemak (triasilgliserol, fosfolipid dan kolesterol ester) dihidrolisa juga oleh ensim pakreas. Di usus halus retinol dan karotenoid dilepas dan larut dalam cairan misel bersama dengan komponen makanan yang larut lemak. Kemudian cairan misel tersebut berdifusi melalui lapisan glikoprotein yang mengelilingi microvili dari duodenum dan jejunum masuk ke enterosit (Groff & Grooper 2000). Dalam sel mukosa usus dan juga terjadi sedikit di hati, beta-karoten dikonversi oleh ensim beta karoten 15,15’-dioxygenase menjadi retinal. Kemudian retinal berikatan dengan cellular retinoid binding protein (CRBP) II kemudian dikonversi menjadi retinol oleh retinal reductase yang merupakan ensim NADH/NADPH-dependen. Tidak seluruh beta karoten dikonversi menjadi retinal, diperkirakan sampai 30% beta karoten meninggalkan usus tanpa oksidasi. Walaupun retinal interkonversi menjadi retinol, beberapa retinal diperkirakan dioksidasi menjadi retinoic acid (Groff & Grooper 2000). Retinol mengalami proses reesterifikasi di enterosit dengan melalui dua cara yaitu: 1. Melibatkan cellular retinol binding protein (CRBP) II, sintesa tergantung kepada retinoic acid. CRBP II mengikat retinol dan retinal. Kemudian CRBP II mereduksi retinal menjadi retinol. CRBP II mengikat retinol diesterifikasi oleh ensim lechitin retinol acyl transferase (LRAT) untuk membentuk retinyl palmitat. 2. Cara kedua reesterifikasi melibatkan pengikatan retinol kepada protein sel yang non spesifik, kemudian reesterifikasi oleh ensim acyl CoA retinol acyl transferase (ARAT) (Groff & Grooper 2000). 58 Gambar 8 Absorpsi Vitamin A dan Karoten dalam Sel Usus Halus (Groff & Gropper 2000). 3. Penyerapan Vitamin A dan Karotenoid Asam retinoat langsung masuk vena porta dan diangkut dalam plasma berikatan dengan albumin. Retinil palmitat/ester yang terbentuk bersama sebagian kecil retinol yang tidak diesterfikasi dan karotenoid diserap bergabung dengan kilomikron yang mengandung kolesterol ester, fosfolipid, triasilgliserol dan apoprotein. Kemudian kilomikron ini langsung dibawa kedalam limfatik sistem yang akhirnya masuk kedalam sirkulasi darah (Groff & Gropper 2000). Kilomikron mengirim retinil ester, beberapa retinol yang tidak diesterifikasi, karotenoid ke jaringan ekstra hepatik seperti bone marrow, sel darah, ginjal, adipose tisue, otot, paru-paru, limpa. Kilomikron remnan mengirim retinil ester dan karotenoid yang tidak ditangkap oleh jaringan tepi ke hati. Karotenoid 59 mencapai hati kemudian mengalami berbagai proses antara lain dipecah menjadi retinol, bergabung dengan VLDL yang disintesa di hati dan didistribusikan ke jaringan tubuh atau disimpan di hati (Groff & Grooper 2000) 4. Metabolisme Vitamin A dan Karotenoid Di dalam sel parenkhim hati, retinil ester dari kilomikron remnan di hidrolisis menjadi retinol. Retinol mengikat CRBP dan mengalami esterifikasi menjadi retinil ester yang kemudian diangkut ke sel hati yang disebut sel stellate (Wake 1994). Retinol disimpan dalam bentuk retinil ester dalam sel stellate. Sekitar 50-80% vitamin A disimpan di hati (sel stellate) dalam bentuk retinil ester terutama palmitat. Jaringan adipose juga merupakan tempat penyimpanan untuk retinol dan beta karoten dari kilomikron (McLaren & Frigg 2001). Dalam keadaan normal penyimpanan ini cukup untuk beberapa bulan. Sel stellate hati tidak dapat menerima retinil ester lagi ketika terjadi hipervitaminosis (Groff & Grooper 2000). Mobilisasi retinol dari hati dan dikirim ke jaringan target dalam bentuk holo-retinol-binding-protein (holo-RBP). Holo-RBP dibentuk dari retinol dilepas oleh hidrolase dari bentuk penyimpanan ester dengan 1 molekul RBP. Pada plasma, holo-RBP juga berinteraksi dengan sebuah molekul transthyretin (TTR) atau dikenal dengan nama prealbumin yang juga mengikat hormon tiroxin (T4). Retinol-RBP-TTR komplek bersikulasi dalam plasma dengan masa paruh sekitar 11 jam yang tidak di filter oleh gromelurus. Beberapa jaringan menangkap retinol dari RBP-TTR komplek termasuk adipose, skeletal muscle, ginjal, sel darah putih dan bone marrow. Berbeda dengan retinol yang dimobilisasi di hati untuk diangkut ke jaringan lain, retinoic acid diproduksi dalam jumlah kecil tidak jelas dimana diproduksi retinoic acid apakah diusus halus atau dihati. Kosentrasi retinoic acid dalam plasma rendah. Dalam sitoplasma sel, retinoic acid mengikat kepada cellular retinoic acid-binding protein (CRABP). CRABP seperti CRBP, berfungsi untuk mengontrol kosentrasi retinoic acid yang bebas, mencegah katabolisme dan mengarahkan penggunaan retinoic acid Grooper 2000). intrasel. (Groff & 60 Gambar 9 Metabolisme Vitamin A dan RBP di dalam Hati (Groff & Grooper 2000). 5. Fungsi Gen dan Retinoid (Diferensiasi Sel) Pada sel retinoic acid bekerja sebagai hormon untuk mempengaruhi ekspresi gen dan mengontrol perkembangan sel (Groff & Grooper 2000). Retinoic acid bekerja dengan mengaktifkan reseptor vitamin A pada sel nukleus. Dikenal dua isomer dari retinoic acid adalah: all trans-retinoic acid dan 9-cis-retinoic acid. Peran reseptor vitamin A memediasi kerja vitamin A, mengatur ekspresi gen yang responsive terhadap vitamin A, mempertahankan kesehatan dan mencegah penyakit. Dua reseptor nukleus yang dikenal yaitu Retinoic acid reseptor : RARs (RAR-alpha, RAR-beta dan RAR-gamma) dan Retinoid X reseptor :RXRs (RXRalpha; TXR-beta; dan RXR-gamma). All trans retinoic acid mengaktifkan RARs dan 9-cis-retinoic acid mengaktifkan RXRs (Blaner 1998). Menurut Olson 1996, masing-masing reseptor mempunyai 6 domain antara lain yaitu 61 1. aktifasi amino-terminal domain (A/B) 2. pengikatan DNA domain (C) 3. daerah hinge (D) 4. ligand-binding domain (E) 5. carboxy-terminal tail terlibat dalam heterodimer Gambar 10 Aktifitas Vitamin A di dalam Sel (Blaner 1998). Aktifitas vitamin A dalam sel melalui kerja retinoic acid mengaktifkan vitamin A pada sel nukleus baik RARs atau RXRs. Retinoic acid hanya mengikat pada RAR reseptor sedangkan 9-cis retinoic acid hanya mengikat RXRs. Nuclear reseptor mengikat elemen yang respon dalam gen spesifik untuk meningkatkan atau menurunkan tingkat ekspresi gen. Elemen respon adalah nucleotide sequences (dalam DNA yang membangun gen). Disimpulkan bahwa vitamin A melalui aksi trans dan 9-cis-retinoic acid adalah regulator sangat penting dari transkripsi seperti ditunjukkan dalam gambar 10 (McLaren & Martin 2001; Blanner 1998). 6. Ekskresi Vitamin A dan Karotenoid Produk oksidasi vitamin A terkonyugasi dengan glucoronida dan dikeluarkan sebagai komponen dari asam empedu. Melalui proses tersebut, 62 sejumlah 70% vitamin A hilang. Metabolit karoten juga terbawa dalam asam empedu untuk diekskresikan. Sisa 30% vitamin A metabolites dikeluarkan melalui urin (Wildman & Medeiros 2000). 7. Kecukupan, Kebutuhan dan Toksisitas Vitamin A dan Beta Karoten Kecukupan vitamin A untuk wanita hamil 370 μg RE dan tingkat asupan yang aman vitamin A yang di rekomendasi 800 μg RE (retinol ekivalent) (Muhilal & Sulaeman 2004b). Kekurangan vitamin A terbanyak ditemukan pada balita di negara berkembang. Tanda-tanda kekurangan pada balita yaitu gangguan pertumbuhan, keratinisasi sel epitel, xeropthalmia dan bahkan penyebab kebutaan. Tanda sub klinis balita dinegara berkembang banyak mengalami kadar plasma vitamin A dibawah normal. Asupan vitamin A berlebihan terutama dari suplemen dapat menimbulkan keracunan tingkat akut, kronik maupun teratogenik. Keracunan tingkat akut bila asupan vitamin A dosis sangat tinggi, biasanya > 100 kali Angka Kecukupan Gizi (AKG) yang dianjurkan pada orang dewasa. Keracunan tingkat kronis yang lebih umum terjadi, karena asupan vitamin A dengan dosis ≤ 10 kali AKG dan berulang kali dikonsumsi dalam jangka waktu mingguan bahkan tahunan. Gejala awal keracunan yang muncul mual, muntah-muntah, pusing, vertigo dan pada tingkat kronik timbul kulit kering dan gatal, hepatomegali. Pada ibu hamil asupan vitamin A berlebihan dikhawatirkan menimbulkan keracunan teratogenik. Efek teratogenik yang ditimbulkan yaitu kelainan pertumbuhan janin, aborsi, lahir cacat dan melahirkan keturunan cacat mental yang permanen. Dosis yang aman disarankan IVACG pada ibu hamil agar tidak terjadi efek teratogenik adalah asupan vitamin A sampai dengan 10.000 IU (3000 μg RE) per hari atau sampai dengan 25.000 IU (8500 μg RE) per minggu (Olson 1996; IVACG 1999). Pada ibu hamil yang mengkonsumsi karotenoid baik dari makanan maupun suplemen dibuktikan tidak memberikan efek teratogenik (Hatcock et al. 1990; Bendich 1988). 63 8. Konversi Vitamin A dan Karotenoid Lainnya Istilah dari “retinol activity equivalent” (RAE) dikenalkan oleh Institute of Medicine (IOM) untuk mengganti “retinol equivalent” (RE) yang digunakan oleh FAO/WHO (1988). Penggantian didasarkan atas penelitian bioefikasi karotenoid. Bioefikasinya diperkirakan lebih rendah pada populasi di negara berkembang. Revisi konversi vitamin A dan karotenoid menurut International Vitamin A Consultative Group (IVACG 2002) adalah sebagai berikut : Tabel 7 Konversi Vitamin A dan Karotenoid Retinol Activity Equivalent (RAE) 1 μg RAE Commonly Used Units = 1 RE of retinol (vitamin A) 1 μg retinol (vitamin A) 2 μg β-carotene dalam minyak (suplemen) 12 μg β-carotene dari bahan makanan 24 μg provitamin A karotenoid lain dalam bahan makanan 3.33 IU vitamin A aktif dari retinol Sumber: IVACG (2002) 9. Beberapa Penelitian Tentang Suplemen Vitamin A dan Beta Karoten Penelitian tentang suplemen vitamin A dan beta karoten yang diberikan pada ibu hamil di Nepal dilaporkan oleh Katz (2000) dan West (1999). Hasil temuan kedua penelitian tersebut yaitu baik vitamin A maupun beta karoten efektif dalam menurunkan angka kematian ibu (maternal mortality). Vitamin A diketahui mempunyai efek teratogenik. Namun dalam dua penelitian tersebut dosis vitamin A yang diberikan sebesar 7000 μg retinol ekivalen setara dengan 23310 IU per minggu masih merupakan dosis aman yang disarankan oleh IVACG (IVACG 1999). Dosis beta karoten yang diberikan per minggu sebesar 42 mg dan beta karoten tidak mempunyai efek teratogenik. 64 Tabel 8 Penelitian tentang Suplemen Vitamin A dan Beta Karoten pada Ibu Hamil Penelitian / Lokasi Dosis dan Lama intervenís Desain penelitian/ Jumlah sampel Hasil penelitian dan kesimpulan Katz .2000 Nepal Retinol 7000 μg per minggu Randomized Cluster Trial Dari 43559 WUS; 17373 hamil; bayi lahir 15987. Beta karoten 42 mg per minggu Ada 3 grup (n=43559) - retinol 7000 μg per minggu ekivalen dengan retinyl palmitat (vitamin A) - all-trans β- karoten 42 mg per minggu - placebo Fetal loss dari : -grup placebo 92.0/1000 kehamilan -RR grup retinol RR 1.06 (95% CL:0.91,1.25) -grup beta karoten RR 1,03 (95% CL:0.87,1.19) West 1999 Nepal Vitamin A (7000 μg retinol ekivalen) per minggu β-karoten 42 mg (ekivalen dengan 7000 μg retinol) per minggu Lama intervensi: 3 ½ th Double blind, cluster randomized dari 44646 WUS 22189 ibu hamil Ada 3 grup: - plasebo - vitamin A (7000 μg retinol) -Beta karoten 42 mg Mortalitas bayi 6 bulan: grup placebo 70.8/1000 kelahiran grup retinol RR: 1.05 (95% CL:0.87,1.25) grup beta karoten RR 1.03 (95% CL:0.86,1.22) Kesimpulan: dosis retinol atau beta karoten untuk WUS pra konsepsi, hamil dan 6 bln postpartum tidak memperbaiki fetal/ infant survival Mortality selama hamil (per 100.000 kehamilan) - 704; 426; 361 untuk placebo; vitamin A; beta karoten - RR vit A 0,60 (95% CL; 0.37-0.97) - RR karoten 0,51 (95% CL; 0.30-0.86) - penurunan vitamin A 40% (p<0.04) - penurunan 49% (p<0.01) - vitamin A dan beta karoten dapat menurunkan mortalitas 44% dan ratio maternal mortality turun dari 645 menjadi 385 kematian per 100.000 kelahiran Kesimpulan: suplementasi WUS dengan vitamin A/ beta karoten menurunkan maternal mortalitas