Kesetimbangan Asam-Basa File
advertisement
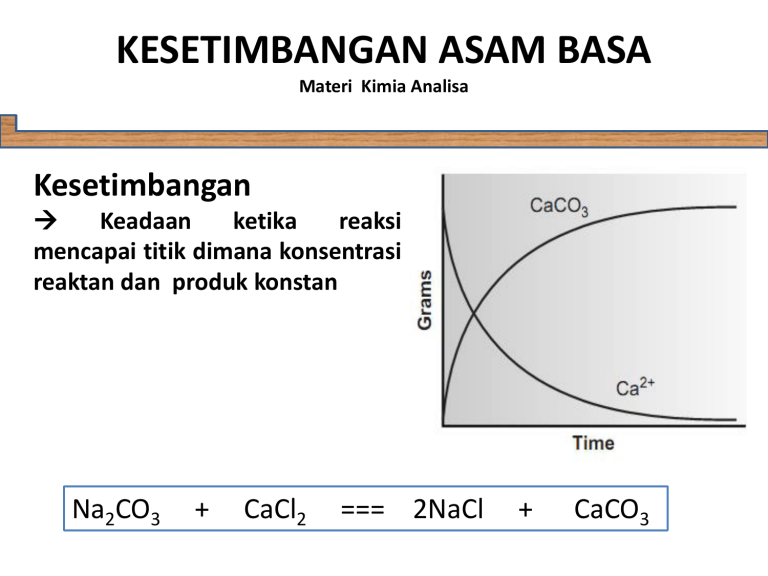
KESETIMBANGAN ASAM BASA Materi Kimia Analisa Kesetimbangan Keadaan ketika reaksi mencapai titik dimana konsentrasi reaktan dan produk konstan Na2CO3 + CaCl2 === 2NaCl + CaCO3 KESETIMBANGAN ASAM BASA Materi Kimia Analisa Persamaan umum kesetimbangan KESETIMBANGAN ASAM BASA Materi Kimia Analisa Hitung konstanta kesetimbangan untuk reaksi: 2A + B === C + 3D Diketahui: Rx 1: A Rx 2: A Rx3: C Rx4: F + + + + B E E C === === === === D C + D + F B D + B K1 = 0,4 K2 = 0,1 K3 = 2,0 K4 = 5,0 KESETIMBANGAN ASAM BASA Materi Kimia Analisa Persamaan keseluruhan: 2A + B === C + 3D Rx1 + Rx2 - Rx3 + Rx4 Rx3: C + E === B Reaksi 3 diubah arah menjadi: Rx5: B === C + E K3 = 2,0 K5 = 1/K3 = 0,5 K reaksi keseluruhan = K1.K2.K5.K4 = 0,1 KESETIMBANGAN ASAM BASA Materi Kimia Analisa Reaksi-reaksi yang umum digunakan dalam kimia analisa: 1. Reaksi pengendapan (presipitasi) 2. Reaksi asam-basa 3. Reaksi pembentukan senyawa kompleks 4. Reaksi oksidasi-reduksi KESETIMBANGAN ASAM BASA Materi Kimia Analisa Reaksi pengendapan Terjadi apabila dua atau lebih reaktan bergabung membentuk endapan atau produk yang sukar larut. Reaksi bisa terjadi karena pertukaran ion Ksp konstanta kesetimbangan untuk reaksi dimana padatan terdisosiasi menjadi ionionnya KESETIMBANGAN ASAM BASA Materi Kimia Analisa Reaksi asam-basa KESETIMBANGAN ASAM BASA Materi Kimia Analisa Asam dan Basa Asam (HA) dan Basa MOH) Arrhenius Asam (HA) Bronsted-Lowry Asam (HA) Bronsted-Lowry Disosiasi dalam air membentuk Disosiasi dalam donor air membentuk H+ (+ A-) OH(+ M+) acceptorDisosiasi dalam air membentuk H3O+ + A- H+ BH+ + OH- Konstanta terukur Reaksi yang terjadi Konstanta terukur Ka Transfer proton Kb Reaksi kombinasi netralisasi BH+ Garam MA(aq) Monoprotik HA Air H2O(l) poliprotik HxA Asam konjugasi B ABasa konjugasi HA Asam Lewis Basa Lewis donor acceptor Pasangan elektron KESETIMBANGAN ASAM BASA Materi Kimia Analisa Konsep asam basa Arrhenius -Asam - substansi yang berdisosiasi dalam air untuk menghasilkan ion H+ - asam kuat asam yang berdisosiasi ke dalam dengan jumlah besar (HCl, H2SO4) - asam lemah asam yang berdisosiasi hanya jumlah sedikit (CH3COOH, HF) -Basa substansi yang berdisosiasi dalam air untuk menghasilkan ion OHTeori Arrhenius ditujukan untuk larutan encer, tidak menghitung basa seperti NH3 yang tidak mengandung OH- KESETIMBANGAN ASAM BASA Materi Kimia Analisa Dr. Yeni Rahmawati, MT. Konsep asam basa Bronsted-Lowry -Asam substansi (molekul / ion) yang dapat memindahkan proton (ion H+) ke substansi lain (proton donors) -Basa substansi yang dapat menerima proton (proton acceptors) HA Asam donor H+ + B Basa acceptor H+ == BH+ Asam donor H+ Pasangan asam-basa konjugasi + ABasa acceptor H+ KESETIMBANGAN ASAM BASA Materi Kimia Analisa Dr. Yeni Rahmawati, MT. KESETIMBANGAN ASAM BASA Materi Kimia Analisa Dr. Yeni Rahmawati, MT. Asam kuat dan asam lemah Asam kuat molekul yang dapat mendonorkan semua proton ke molekul pelarut HCl(aq) + H2O(l) H3O+(aq) + Cl-(aq) Asam lemah molekul yang hanya mendonorkan sebagian proton ke molekul pelarut CH3COOH(aq) + H2O(l) === H3O+(aq) + CH3COO-(aq) Ka (konstanta disosiasi asam): Ka H O CH COO 1,75x10 3 - 3 CH3COOH -5 KESETIMBANGAN ASAM BASA Materi Kimia Analisa Asam lemah monoprotik asam yang hanya mendonorkan proton tunggal / konstanta disosiasi asam tunggal (misal: asam asetat) HCl(aq) + H2O(l) H3O+(aq) + Cl-(aq) poliprotik asam yang dapat mendonorkan proton lebih dari satu, umumnya dijelaskan dengan tahapan disosiasi asam (misal: asam phosphoric) KESETIMBANGAN ASAM BASA Materi Kimia Analisa Penurunan konstanta disosiasi asam dari Ka1 ke Ka3 menunjukkan proton berturutturut lebih sulit dipisahkan Berdasarkan kekuatan asam: H3PO4 > H2PO4- >HPO42- KESETIMBANGAN ASAM BASA Materi Kimia Analisa Basa kuat dan basa lemah Ke basa an larutan diukur dari konsentrasi ion hidroksida (OH-) Misal: basa kuat NaOH NaOH(aq) Na+(aq) + OH-(aq) Basa lemah molekul hanya menerima sebagian proton dari pelarut CH3COO-(aq) + H2O(l) === OH-(aq) + CH3COOH(aq) Ka (konstanta disosiasi basa): Kb CH3COOHOH- 5,71x10 -10 CH COO - 3 KESETIMBANGAN ASAM BASA Materi Kimia Analisa Amphiprotic Molekul yang bertindak sebagai asam atau basa (misal: reaksi kimia ion bikarbonat alam air) HCO3-(aq) + H2O(l) === H3O+(aq) + CO32-(aq) Ka = 4,69 x 10-11 HCO3-(aq) + H2O(l) === OH-(aq) + H2CO3(aq) Kb = 2,25 x 10-8 Jadi bikarbonat adalah basa lebih kuat dibanding sebagai asam KESETIMBANGAN ASAM BASA Materi Kimia Analisa KESETIMBANGAN ASAM BASA Materi Kimia Analisa Disosiasi air Air bisa menjadi molekul amphiprotik H2O(l) + H2O(l) === H3O+(aq) + OH-(aq) Kw = [H3O+] [OH-] Pada T: 24oC, Kw = 1 x 10-14 Persen disosiasi asam Konsentrasi asam yang terdisosiasi dibagi dengan konsentrasi awal asam dikali 100% KESETIMBANGAN ASAM BASA Materi Kimia Analisa Skala pH - Didefinisikan sebagai pH = - log [H3O+] - sebagai indikator keasaman suatu bahan [H3O+] = [OH-] kondisi netral Kw = [H3O+]2 = 1 x 10-14 [H3O+] = 1 x 10-7 KESETIMBANGAN ASAM BASA Materi Kimia Analisa Perhitungan Ka dan Kb CH3COOH(aq) + H2O(l) === H3O+(aq) + CH3COO-(aq) CH3COO-(aq) + H2O(l) === CH3COOH(aq) + OH-(aq) Kw = Ka x Kb Pada T: 24oC, Kw = 1 x 10-14 KESETIMBANGAN ASAM BASA Materi Kimia Analisa Misal: a) Hitung Kb untuk piridin (C5H5N) dengan Ka = 5,90 x 10-6 b) Hitung Kb untuk dihidrogen pospat (H2PO4-) dengan Ka = 7,11 x 10-3 KESETIMBANGAN ASAM BASA Materi Kimia Analisa Indikator asam basa pendekatan pH menggunakan substansi yang dapat berubah warna dalam rentang pH tertentu KESETIMBANGAN ASAM BASA Materi Kimia Analisa Perhitungan pH 1. Hitung pH dari 0,025 M HNO3 2. Berapa harga Ka untuk 0,25 HF dengan pH = 2,036 3. Hitung pH dan konsentrasi dari semua komponen yang ada dalam 0,05 M HF KESETIMBANGAN ASAM BASA Materi Kimia Analisa Jawab: 1. pH = - log [H3O+] = 1,6 2. Ka = 3,52 x 10-4 3. pH = 2,40 ; [H3O+] = [F-] = 4 x 10-3 M ; [HF] = 0,046 M ; [OH-] = 2,5 x 10-12 KESETIMBANGAN ASAM BASA Materi Kimia Analisa KESETIMBANGAN ASAM BASA Materi Kimia Analisa Jawaban no 3: Tahap 1: komponen yang ada HF (asam) dan H2O (basa) Tahap 2: reaksi transfer proton yang mungkin terjadi HF(aq) + H2O(l) === H3O+(aq) + F-(aq) Ka = 3,5 x 10-4 H2O(l) + H2O(l) === H3O+(aq) + OH-(aq) Kw = 1 x 10-14 Tahap 3: reaksi utama Ka >> Kw reaksi utama adalah disosiasi HF Tahap 4: Reaksi utama: HF(aq) + H2O(l) === H3O+(aq) + F-(aq) Konsentrasi awal 0,05 Reaksi -x x x Konsentrasi setimbang 0,05 – x x x Tahap 5: persamaan kesetimbangan H O F Ka 3 HF - x.x 3,5 x104 0,05 - x KESETIMBANGAN ASAM BASA Materi Kimia Analisa Tahap 6: konsentrasi yang besar [H3O+] = [F-] = x = 4 x 10-3 M [HF] = 0,05 – x = 0,046 M Tahap 7: konsentrasi yang kecil [OH-] = Kw/[H3O+] = 2,5 x 10-12 M Tahap 8: perhitungan pH pH = - log [H3O+] = 2,4 KESETIMBANGAN ASAM BASA Materi Kimia Analisa Tahapan untuk menghitung konsentrasi pada kesetimbangan KESETIMBANGAN ASAM BASA Materi Kimia Analisa Soal: 1. Diketahui reaksi antara bahan kimia A dan B menghasilkan C dan D, dimana konstanta kesetimbangan 0,3. Asumsi 0,2 mol A dan 0,5 mol B dilarutkan dalam 1 liter dan terjadi reaksi. Hitung konsentrasi reaktan dan produk dalam kesetimbangan! 2. Konstanta kesetimbangan untuk reaksi H2 dengan I2 adalah 37 pada 700K H2(g) + I2(g) === 2HI(g) K = 37 pada 700K Jika 1 mol H2 direaksikan dengan 1 mol I2 dalam 1 liter, berapa konsentrasi H2, I2 dan HI dalam kesetimbangan? KESETIMBANGAN ASAM BASA Materi Kimia Analisa 3. Hitung konsentrasi Pb2+ dan IO3- jika diketahui konstanta kesetimbangan Pb(IO3)2 dengan reaksi: Pb(IO3)2(s) === Pb2+(aq) + 2IO3-(aq) Ksp = 2,5 x 10-13 4. Hitung pH 0,1 M Na2HPO4 KESETIMBANGAN ASAM BASA Materi Kimia Analisa KESETIMBANGAN ASAM BASA Materi Kimia Analisa Reaksi Kompleks Teori Lewis menggunakan pemecahan dan pembentukan ikatan kovalen untuk menjelaskan karakteristik asam-basa (banyak digunakan untuk reaksi antara ion logam dan ligan) Asam : penerima (acceptor) pasangan elektron Basa : pemberi (donor) pasangan elektron Ligan : basa lewis yang berikatan dengan ion logam Cd2+(aq) + 4(:NH3)(aq) === Cd(:NH3)42+(aq) Produk reaksi: kompleks logam-ligan KESETIMBANGAN ASAM BASA Materi Kimia Analisa Konstanta pembentukan untuk reaksi Konstanta kesetimbangan untuk reaksi antara logam dan ligan yang berikatan membentuk kompleks logam-ligan (Kf) CdNH 5,5x10 2 Kf Cd NH 3 4 2 7 4 3 Konstanta disosiasi Konstanta kesetimbangan untuk reaksi dimana kompleks logam-ligan terdisosiasi membentuk ion logam tidak kompleks dan ligan (Kd) KESETIMBANGAN ASAM BASA Materi Kimia Analisa Reaksi bertahap: Cd2+(aq) Cd(NH3)2+(aq) Cd(NH3)22+(aq) Cd(NH3)32+(aq) + + + + NH3(aq) NH3(aq) NH3(aq) NH3(aq) === === === === Cd(NH3)2+(aq) Cd(NH3)22+(aq) Cd(NH3)32+(aq) Cd(NH3)42+(aq) Konstanta pembentukan bertahap konstanta pembentukan untuk kompleks logam-ligan yang mana hanya ligan yang ditambahkan ke ion logam / kompleks logam-ligan (misal: K1,K2,K3…dst) Konstanta pembentukan kumulatif konstanta pembentukan untuk kompleks logam-ligan yang mana dua atau lebih ligan ditambahkan secara simultan ke ion logam / kompleks logam-ligan (bi) KESETIMBANGAN ASAM BASA Materi Kimia Analisa Konstanta pembentukan kumulatif: bi = K1 x K2 x K3 x…x Ki Misal: Reaksi AgCl(s) + Cl-(aq) === AgCl2-(aq) Reaksi dapat dipisah menjadi reaksi kelarutan AgCl dan pembentukan bertahap: AgCl(s) === Ag+(aq) + Cl-(aq) Ag+(aq) + Cl-(aq) === AgCl(aq) AgCl(aq) + Cl-(aq) === AgCl2-(aq) , Ksp , K1 , K2 K reaksi keseluruhan = Ksp x K1 x K2 KESETIMBANGAN ASAM BASA Materi Kimia Analisa Larutan Buffer Larutan yang mengandung pasangan asam lemah / basa lemah konjugasi yang menghambat perubahan dalam pH ketika asam kuat / basa kuat ditambahkan (misal campuran asam asetat dan natrium asetat) CH3COOH(aq) + H2O(l) === H3O+(aq) + CH3COO-(aq) Ka = 1,75 x 10-5 Hubungan antara pH buffer asam-basa dan jumlah relatif CH3COOH dan CH3COO- diturunkan dengan persamaan: pH pK a CH COO CH COO log 4,76 log - 3 CH3COOH - 3 CH3COOH KESETIMBANGAN ASAM BASA Materi Kimia Analisa Persamaan umum Buffer Terdiri dari asam lemah (HA) dan garam dari basa konjugasi (NaA) NaA(aq) === Na+(aq) + A-(aq) HA(aq) + H2O(l) === H3O+(aq) + A-(aq) 2H2O(l) === H3O-(aq) + OH-(aq) Karena konsentrasi dari Na+, A-, HA, H3O+ dan OH- tidak diketahui maka diperlukan 5 persamaan untuk mendefinisikan konsentrasi Kw = [H3O+] [OH-] (1) H O A Ka - 3 HA (2) KESETIMBANGAN ASAM BASA Materi Kimia Analisa Neraca massa HA dan Na+ CHA + CNaA = [HA] + [A-] CNaA = [Na+] (3) (4) Neraca perubahan [H3O+] + [Na+] = [OH-] + [A-] (5) Subs pers. 5 ke 4 [A-] = CNaA - [OH-] + [H3O+] Subs pers. 63 ke 6 [HA] = CHA + [OH-] - [H3O+] (6) (7) KESETIMBANGAN ASAM BASA Materi Kimia Analisa Persamaan umum pH untuk larutan buffer Jika konsentrasi awal asam lemah dan basa lemah > [H3O+] dan [OH-], persamaan menjadi: C NaA OH- H 3O C NaA pH pK a log pK a log C HA OH H 3O C HA Persamaan Henderson-Hasselbalch Persamaan yang menunjukkan hubungan antara pH buffer dan jumlah relatif asam lemah dan basa lemah konjugasi buffer KESETIMBANGAN ASAM BASA Materi Kimia Analisa Soal: 1. Hitung pH buffer dari campuran 0,02 M NH3 dan 0,03 NH4Cl, selanjutnya berapa pH setelah ditambahkan 1 mL 0,1 M NaOH ke dalam 0,1 L larutan buffer tersebut? KESETIMBANGAN ASAM BASA Materi Kimia Analisa KESETIMBANGAN ASAM BASA Materi Kimia Analisa Aktivitas dan koefisien aktivitas Aktivitas konstanta kesetimbangan dihitung menggunakan besaran thermodinamika (untuk larutan pekat) ai = Ci x fi Ci = konsentrasi ion i fi = koefisien aktifitas c d c d c d a C xa D f C xf D C xD K a b a b a A xa B f A xf B Aa xB b KESETIMBANGAN ASAM BASA Materi Kimia Analisa Kekuatan ionik metode kuantitatif untuk melaporkan komposisi ionik dari larutan yang memberi pengaruh cukup besar terhadap ion bermuatan zi = muatan ion pada masing2 komponen KESETIMBANGAN ASAM BASA Materi Kimia Analisa KESETIMBANGAN ASAM BASA Materi Kimia Analisa Reaksi Oksidasi Reduksi Elektron tidak dibagi, tetapi dipindahkan dari satu reaktan ke lainnya Oksidasi kehilangan elektron Reduksi mendapat elektron Oksidator molekul yang menerima elektron dari molekul lain (oxidizing agent) Reduktor molekul yang memberi elektron ke molekul lain (reducing agent) reduktor oksidator











