hidrolss 2014 - WordPress.com
advertisement

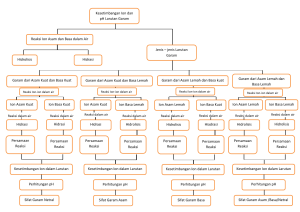
Garam terbentuk dari reaksi asam + basa 1. 2. 3. 4. Asam Kuat + Basa Kuat garam netral Asam Kuat + Basa lemah garam hidrolisis sifat asam Asam Lemah + Basa Kuat garam hidrolisis sifat basa Asam Lemah + Basa Lemah garam hidrolisis sempurna Garam hidrolisis = garam yang dapat terurai oleh air, berasal asam atau basanya berasal dari yang lemah. Garam netral tidak terhidrolisis karena kation dan anionnya berasal dari basa kuat dan asam kuat. Asam kuat dan basa kuat terionisasi sempurna. Garam netral dalam air tetap berupa ion-ion (yang tidak terhidrolisis) Ciri Asam Kuat : 1. Terionisasi sempurna dalam air 2. Reaksi ionisasi satu arah 3. Derajat ionisasi ( α ) = 1 atau mendekati 100% 4. Ka ≥ 1 atau pKa < 0 5. Contoh: HCl, HBr, HI, HSCN, HNO3, H2SO4, HClO4. No 1 2 3 4 5 6 7 Senyawa HClO4 HI HBr HCl H2SO4 HSCN (asam tiosianat) HNO3 Ka 1010 3 x 109 1 x 109 1 x 106 Ka1 = 1 x 103 Ka2 = 1,2 x 10-2 71 28 By Far Qim Iya pKa -10 -9,5 -9,5 -6 -3 2- log 1,2 -1,85 -1,45 2 Basa secara umum rumus kimianya memiliki anion OH- (ion hidroksida) Basa kuat kation logam gol + ion OHLogam IA + OH: LiOH, NaOH, KOH, RbOH, CsOH Logam IIA + (OH)- : Mg(OH)2 , Ca(OH)2, Sr(OH)2 , Ba(OH)2 Basa Lemah : NH3 = NH4OH , Zn(OH)2 , Fe(OH)2 dll Amfoter : Be(OH)2 Senyawa amfoter : senyawanya dapat bersifat sebagai asam dan dapat sebagai basa By Far Qim Iya 3 Garam netral: NaCl , K2SO4 , Ca(NO3)2 NaCl Na+ + ClNa+ + H2O tidak bereaksi Cl- + H2O tidak bereaksi