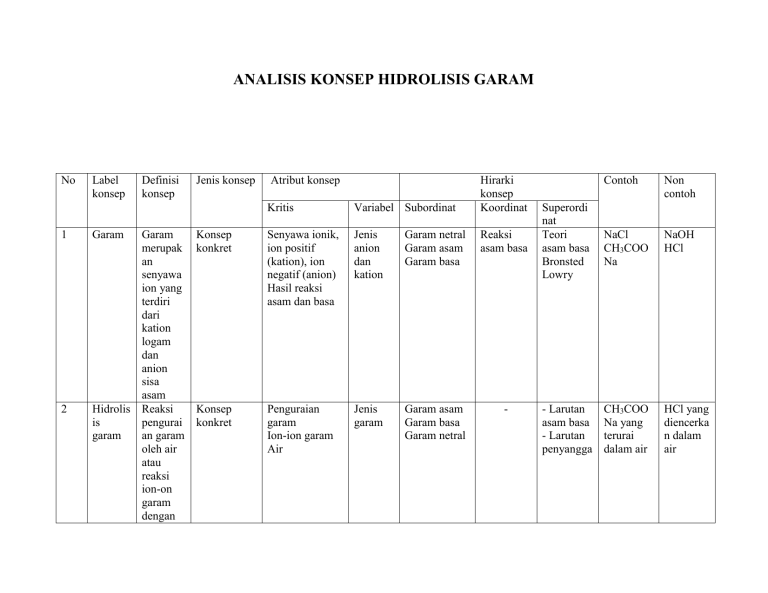
ANALISIS KONSEP HIDROLISIS GARAM No 1 2 Label konsep Garam Definisi konsep Garam merupak an senyawa ion yang terdiri dari kation logam dan anion sisa asam Hidrolis Reaksi is pengurai garam an garam oleh air atau reaksi ion-on garam dengan Jenis konsep Atribut konsep Hirarki konsep Koordinat Kritis Variabel Subordinat Konsep konkret Senyawa ionik, ion positif (kation), ion negatif (anion) Hasil reaksi asam dan basa Jenis anion dan kation Garam netral Garam asam Garam basa Reaksi asam basa Konsep konkret Penguraian garam Ion-ion garam Air Jenis garam Garam asam Garam basa Garam netral - Superordi nat Teori asam basa Bronsted Lowry - Larutan asam basa - Larutan penyangga Contoh Non contoh NaCl CH3COO Na NaOH HCl CH3COO Na yang terurai dalam air HCl yang diencerka n dalam air 3 Garam asam 4 Garam basa 5 Garam netral air merupak an hidrolisis garam Garam yang terbentuk dari reaksi asam kuat dan basa lemah merupak an garam asam Garam yang terbentuk dari reaksi asam lemah dan basa kuat merupak an garam basa Garam yang terbentuk dari Konsep konkret Garam Asam kuat Basa lemah Sifat Reaksi asam hidrolisis dan basa pembent uk garam Garam basa Garam netral Hidrolisis garam (NH4)2SO Konsep konkret Garam Asam lemah Basa kuat Sifat Reaksi asam hidrolisis dan basa pembent uk garam Garam asam Garam netral Hidrolisis garam CH3COO Na NaCl Konsep konkret Garam Asam kuat Basa kuat Sifat asam dan basa Garam asam Garam basa Hidrolisis garam NaCl Na2CO3 Reaksi hidrolisis CaCl2 4 6 7 8 asam kuat dan basa kuat merupak an garam netral Reaksi Reaksi hidrolisi yang s mengga mbarkan ion-ion garam dengan air merupak an reaksi hidrolisis Kesetim Tetapan bangan kesetimb hidrolisi angan s (Kh) dari reaksi hidrolisis pH Bilangan garam untuk yang menyata terhidro kan lisis tingkat keasama n larutan garam yang terhidroli pembent uk garam Konsep abstrak Ion-ion garam Air Konsep abstrak Tetapan kesetimbangan Reaksi hidrolisis Reaksi kesetimbangan Bilangan Tingkat keasaman Garam yang terhidrolisis Konsep konkret Sifat garam [H+] [OH-] Hidrolisis parsial Hidrolisis total Reaksi kesetimba ngan pH larutan garam Kw Ka Kb Garam asam, garam basa, garam netral CN-(aq) + H2O(l) ↔ HCN(aq) + OH-(aq) Kh = 𝐾𝑤 𝐾𝑎 ×𝐾𝑏 pH larutan pH larutan [H]+ = -log penyangga [H]+ [OH]- = log [OH]- Na(s) + H2O(l) → NaOH(aq) sis dinyatak an oleh pH









