SPEKTROFOTOMETRI ULTRAVIOLET DAN TAMPAK (VISIBLE) A
advertisement
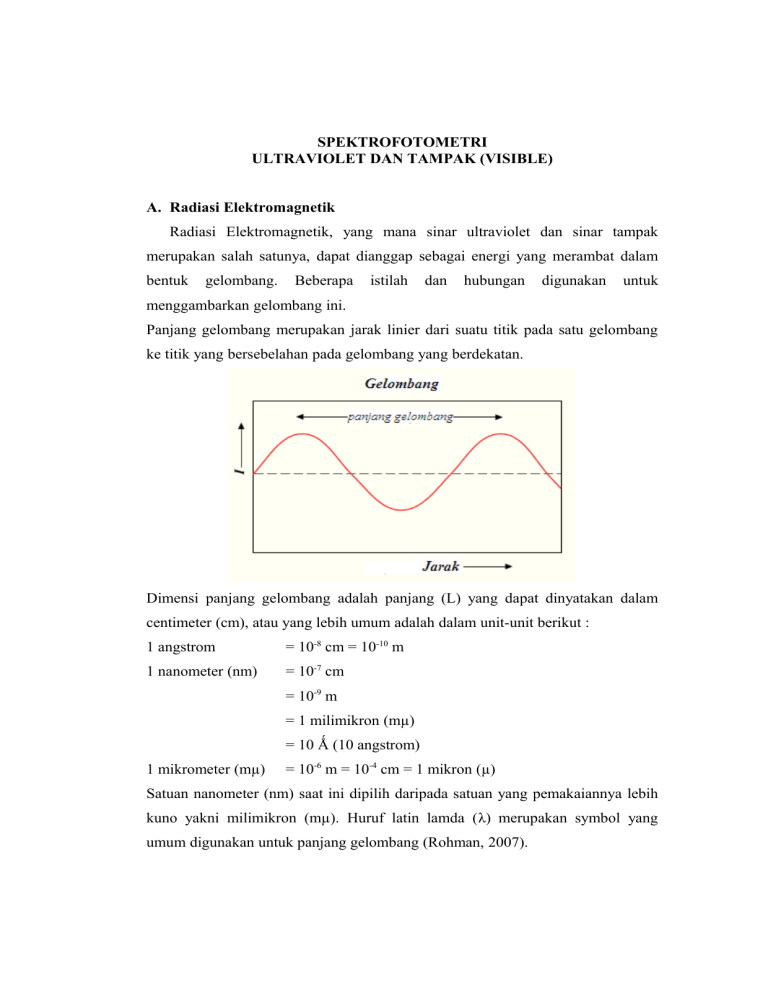
SPEKTROFOTOMETRI ULTRAVIOLET DAN TAMPAK (VISIBLE) A. Radiasi Elektromagnetik Radiasi Elektromagnetik, yang mana sinar ultraviolet dan sinar tampak merupakan salah satunya, dapat dianggap sebagai energi yang merambat dalam bentuk gelombang. Beberapa istilah dan hubungan digunakan untuk menggambarkan gelombang ini. Panjang gelombang merupakan jarak linier dari suatu titik pada satu gelombang ke titik yang bersebelahan pada gelombang yang berdekatan. Dimensi panjang gelombang adalah panjang (L) yang dapat dinyatakan dalam centimeter (cm), atau yang lebih umum adalah dalam unit-unit berikut : 1 angstrom = 10-8 cm = 10-10 m 1 nanometer (nm) = 10-7 cm = 10-9 m = 1 milimikron (mµ) = 10 Ǻ (10 angstrom) 1 mikrometer (mµ) = 10-6 m = 10-4 cm = 1 mikron (µ) Satuan nanometer (nm) saat ini dipilih daripada satuan yang pemakaiannya lebih kuno yakni milimikron (mµ). Huruf latin lamda (λ) merupakan symbol yang umum digunakan untuk panjang gelombang (Rohman, 2007). Frekuensi merupakan banyaknya gelombang yang melewati suatu titik tertentu dalam satuan waktu. Dimensi frekuensi adalah seper waktu (T -1) dan satuan yang digunakan biasanya detik-1. Satuan frekuensi juga dapat dinyatakan sebagai putaran perdetik atau Hertz (Hz). Frekuensi biasanya disimbolkan dengan huruf latin nu (υ). Bilangan gelombang merupakan seper panjang gelombang (1/λ) sehingga satuannya adalah 1/panjang. Jika panjang gelombang dinyatakan dengan cm-1 (Rohman, 2007). Ada hubungan antara energi yang dimiliki radiasi elektromagnetik, frekuensi, dan panjang gelombang yang bersangkutan : E = h υ .......................................................................(10-1) υ= c λ .........................................................................(10-2) Dengan menggabungkan persamaan (10-1) dan (10-2) maka akan diperoleh persamaan berikut : E= hc λ ........................................................................(10-3) Yang mana : E = Energi radiasi cahaya h = tetapan planck yang harganya 6,626 x 10-34 joule c = kecepatan cahaya yang harganya 2,998 x 1010 cms-1 λ = panjang gelombang (Rohman, 2007). Warna sinar tampak dapat dihubungkan dengan panjang gelombangnya. Sinar putih mengandung radiasi pada semua panjang gelombang di daerah sinar tampak. Sinar pada panjang gelombang tunggal (radiasi monokromatik) dapat dipilih dari sinar putih (sebagai contoh dengan alat prisma). Warna-warna yang dihubungkan dengan panjang gelombang diringkas pada tabel. Pada kolom ketiga dari tabel ini disebutkan juga warna komplementer, yang mempunyai makna sebagai berikut : jika salah satu komponen warna putih dihilangkan (biasanya dengan absorpsi) maka sinar yang dihasilkan akan nampak sebagai komplemen warna yang diserap tadi. Jadi jika warna biru (450 sampai 480 nm) dihilangkan dari sinar putih tersebut (atau warna biru diabsorbsi) maka radiasi yang dihasilkan adalah warna kuning (Rohman, 2007). Tabel 1. Hubungan antara warna dengan panjang gelombang sinar tampak Warna yang Panjang gelombang Warna yang diserap diamati/warna 400 – 435 nm 450 – 480 nm 480 – 490 nm 490 – 500 nm 500 – 560 nm 560 – 580 nm 580 – 595 nm 595 – 610 nm 610 – 750 nm Ungu (lembayung) Biru Biru kehijauan Hijau kebiruan Hijau Hijau kekuningan Kuning Orange Merah komplementer Hijau kekuningan Kuning Orange Merah Merah anggur Ungu (lembayung) Biru Biru kekuningan Hijau kebiruan B. Spektrum Absorpsi Spektrofotometer dapat digunakan untuk mengukur besarnya energi yang diabsorpsi /diteruskan. Jika radiasi yang monokromatik melewati larutan yang mengandung zat yang dapat menyerap, maka radiasi ini akan dipantulkan, diabsorpsi oleh zatnya dan sisanya ditransmisikan. I0 = I r + I a + I t Pengaruh Ir dapat dihilangkan dengan menggunakan blanko/kontrol sehingga : I0 = I a + I t (Harmita, 2006) Lambert dan Beer telah menurunkan secara empirik hubungan antara intensitas cahaya yang ditransmisikan dengan tebalnya larutan dan hubungan antara intensitas tadi dengan konsentrasi zat (Harmita, 2006) Hukum Lambert – Beer : A = log =γ.b.c=a.b.c Dimana : A : serapan I0 : intensitas sinar datang It : intensitas sinar yang diteruskan γ : absorbtivitas molekuler (mol.cm. It-1) a : daya serap (g.cm. It-1) b : tebal larutan / kuvet c : konsentrasi (g. It-1. mg. ml-1) (Harmita, 2006) Penyimpangan-penyimpangan Hukum Beer : Pada konsentrasi rendah, grafik hubungan dari serapan dengan konsentrasi biasanya merupakan garis lurus. Pada konsentrasi yang lebih tinggi kurva ini dapat membelok ke arah absis atau ordinat. Penyimpangan ini disebabkan oleh kondisi percobaan yang tidak dipenuhi lagi, yaitu : 1. Cahaya tidak cukup monokromatis 2. Cahaya sampingan (stay radiation) mengenai detektor 3. Kepekaan detektor berubah 4. Intensitas sumber cahaya dan amplifier dari detector berubah-ubah karena tegangan tidak stabil. 5. Pada desiasi-asosiasi keseimbangan kimia berubah, misalnya pada perubahan pH larutan 6. Larutan berfluoresensi 7. Suhu larutan berubah selama pengukuran. Seperti diketahui bahwa Beer hanya berlaku untuk cahaya monokromatis. Dalam praktek hal ini sukar dipenuhi karena derajat kemonokromatisan ditentukan oleh lebar celah yang digunakan. Makin kecil lebar celah, makin monokromatis cahaya yang diperoleh, akan tetapi intensitas cahaya yang mengenai detector juga makin kecil sehingga kepekaan berkurang (Harmita, 2006). C. Penyerapan Radiasi oleh Molekul Semua molekul mempunyai energi yang dapat digambarkan menjadi beberapa fenomena. (1) Molekul secara keseluruhan dapat bergerak yang kejadian ini disebut dengan translasi ; energi yang berhubungan dengan translasi disebut dengan energi translasional, Etrans (2) Bagian molekul (atom atau sekelompok atom) dapat bergerak karena berkenaan satu sama lain. Gerakan ini disebut dengan vibrasi dan energinya dinamakan dengan energy vibrasional, Evibr (3) Molekul dapat berotasi pada sumbunya dan rotasi ini dikarakterisasi dengan energy rotasional, Erot (4) Di samping bentuk gerakan-gerakan tersebut, suatu molekul memiliki konfigurasi elektronik, dan energinya (energi elektronik) tergantung pada keadaan elektronik molekul (Rohman, 2007). Energi suatu molekul merupakan jumlah dari komponen-komponen energi translasional, vibrasional, rotasional, dan elektronik : E = Etrans+ Evibr + Erot + Eelek (Rohman, 2007). Menurut teori mekanika kuantum, komponen-komponen energi translasional, vibrasional, rotasional, dan elektronik dapat dianggap hanya memiliki nilai tertentu pada suatu molekul tertentu ; dan energi-energi ini dikatakan terkuantisasi. Level energi Etrans, Evibr, Erot , dan Eelek berhubungan erat dengan struktur molekulnya. Kita dapat mengharapkan bahwa tidak ada 2 molekul yang mempunyai energi translasional, vibrasional, rotasional, dan elektronik yang identik (Rohman, 2007). Jika suatu molekul bergerak dari suatu tingkat energi yang lebih rendah maka beberapa energi akan dilepaskan. Energi ini dapat hilang sebagai radiasi dan dapat dikatakan telah terjadi emisi radiasi. Jika suatu molekul dikenai suatu radiasi elektromagnetik pada frekuensi yang sesuai sehingga energi molekul tersebut ditingkatkan ke level yang lebih tinggi, maka terjadi peristiwa penyerapan oleh molekul. Supaya terjadi absorpsi, perbedaan energi antara dua tingkat energi harus setara dengan energi foton yang diserap. Secara matematis, pernyataan ini dapat diekspresikan dengan : E2 – E1 = h . v E2 = energi pada tingkat yang lebih rendah E1 = energi pada tingkat yang lebih tinggi v = frekuensi foton yang diabsorpsi (Rohman, 2007). Sinar ultraviolet dan sinar tampak memberikan energi yang cukup untuk terjadinya transisi elektronik. Dengan demikian spektra UVdan spektra tampak dikatakan sebagai spektra elektronik. Keadaan energi yang lebih rendah disebut dengan keadaan dasar (ground state). Transisi-transisi elektronik akan meningkatkan energi molekuler dari keadaan dasar ke satu atau lebih tingkat energi tereksitasi (Rohman, 2007). Terbentuknya pita spectrum disebabkan oleh terjadinya eksitasi elektronik lebih dari satu macam pada gugus molekul yang sangat kompleks (Rohman, 2007). D. Penyerapan Sinar UV-Vis oleh Molekul Penyerapan radiasi sinar ultraviolet dan sinar tampak oleh spesies atom atau molekul (M) dapat dipertimbangkan sebagai proses dua langkah : Proses yang melibatkan eksitasi menjadi panas sesuai dengan persamaan berikut : M + hv M* (Rohman, 2007). Hasil reaksi antara M dengan foton (hv) merupakan partikel yang tereksitasi secara elektronik yang disimbolkan dengan M*. Waktu hidup M* sangat pendek (10-8 – 10-9 detik), dan keberadaannya dapat diakhiri dengan berbagai macam proses relaksasi. Kebanyakan tipe melibatkan konversi energi eksitasi menjadi energi panas, sesuai dengan persamaan berikut : M* M + panas (Rohman, 2007). Penyerapan sinar UV dan sinar tampak pada umumnya dihasilkan oleh eksitasi electron-elektron ikatan, akibatnya panjang gelombang pita yang mengabsorpsi dapat dihubungkan dengan ikatan yang mungkin ada dalam suatu molekul (Rohman, 2007). Ada tiga macam proses penyerapan energi UV dan sinara tampak yaitu : (1) Penyerapan oleh transisi elektron ikatan dan elektron anti ikatan (2) Penyerapan oleh transisi electron d dan f dari molekul kompleks (3) Penyerapan oleh perpindahan muatan (Rohman, 2007). (1) Penyerapan oleh transisi electron ikatan dan elktron anti ikatan (electron sigma, σ ; electron phi, π ; electron tidak berikatan atau non-bonding elektron, n) (a) Elektron sigma (σ) Orbital molekul ikatan yang menyebabkan terjadinya ikatan tunggal disebut ikatan sigma. Elektron yang menempatinya disebut elektron sigma. Distribusi rapat muatan dalam orbital sigma adalah simetris di sekeliling poros ikatan, sedangkan pada orbital sigma anti ikatan atau sigma star tidak simetris (Rohman, 2007). (b) Elektron phi (π) Orbital phi terjadi karena overlapping dua atom p. Distribusi rapat muatan dalam orbital phi adalah sedemikian rupa sehingga sepanjang poros ikatan antara kedua atom terdapat suatu daerha yang disebut dengan daerah nodal (nodal lane) yang dalam daerah ini rapat muatannya rendah (Rohman, 2007). (c) Elektron bukan ikatan (n = nonbonding elektron) Disebut non-bonding elektron karena elektron tersebut tidak ikut serta dalam pembentukan ikatan kimia dalam suatu molekul (Rohman, 2007). Diagram tingkat energi elektronik : Keterangan : garis pertama σ* , garis kedua π*, garis ketiga n, garis keempat π, dan garis kelima σ i. Transisi sigma-sigma star (σ σ*) Energi yang diperlukan untuk transisi ini besarnya sesuai dengan energi sinar yang frekuensinya terletak di antara UV vakum (kurang dari 180 nm). Jenis transisi ini terjadi pada daerah UV vakum sehingga kurang bermanfaat untuk analisis dengan cara spektrofotometri UV-Vis (Rohman, 2007). ii. Transisi non-bonding elektron – sigma star (n σ*) Jenis transisi ini terjadi pada senyawa organik jenuh yang mengandung atom-atom yang memiliki elektron bukan ikatan (elektron n). Energi yang diperlukan untuk transisi ini lebih kecil disbanding transisi σ σ* sehingga sinar yang diserappun mempunyai panjang gelombang lebih panjang, yakni sekitar 150-250 nm. Kebanyakan terjadi pada gelombang 200nm. Nilai ε = 100-3000 L.cm-1.mol-1 (Rohman, 2007). iii. Transisi n π* dan transisi π π* Untuk memungkinkan terjadinya transisi jenis ini, maka molekul organik harus mempunyai gugus fungsional yang tidak jenuh sehingga ikatan rangkap dalam gugus tersebut memberikan orbital phi yang diperlukan (Rohman, A. dan Ibnu G., 2008). Perbedaan antara transisi n π* dan transisi π π* adalah : n π* • π π* Absorptivitas molar (ε) antara 10- • 100 L.cm-1.mol-1 • Absorptivitas molar (ε) antara 1000-10.000 L.cm-1.mol-1 Biasanya, pelarut yang polar • Biasanya, pelarut yang polar menyebabkan pergeseran biru menyebabkan pergeseran merah atau hypersochromic shift atau bathochromic shift (pergeseran pita serapan ke arah (pergeseran pita serapan ke arah panjang gelombang yang lebih panjang gelombang yang lebih pendek) panjang) (Rohman, 2007). Kromofor-kromofor organik Kromofor merupakan semua gugus atau atom dalam senyawa organik yang mamapu menyerap sinar UV dan sinar tamapak. Pada molekul organik dikenal pula istilah ausokrom yang merupakan gugus fungsional yang mempunyai elektron bebas seperti : -OH, -O, -NH2, dan -OCH3 , yang memberikan transisi n π*. Terikatnya gugus ausokrom pada gugus kromofor akan mengakibatkan pergeseran pita absorpsi menuju ke panjang gelombang yang lebih besar (Rohman, 2007). (2) Penyerapan yang melibatkan elektron d dan f Kebanyakan ion-ion logam transisi menyerap di daerah UV dan sinar tampak. Untuk seri lantanida dan aktanida, proses absorpsi dihasilkan oleh transisi elektronik elektron-elektron 4f dan 5f; sementara itu untuk logam-logam golongan transisi pertama dan kedua, yang bertanggung jawab terhadap absorpsi adalah elektron-elektron 3d dan 4d (Rohman, 2007). (3) Penyerapan karena perpndahan muatan Untuk penyerapan tujuan karena analisis, perpindahan spesies-spesies muatan yang sangat menunjukkan penting karena absorptivitas molarnya sangat besar (ε > 10.000 L.cm-1.mol-1 ) (Rohman, 2007). Dengan demikian, senyawa-senyawa kompleks akan memberikan sensitifitas yang tinggi; dalam artian senyawa-senyawa kompleks mudah dideteksi dan ditentukan kadarnya. Beberapa ion anorganik menunjukkan penyerapan yang disebabkan oleh perpindahan muatan, karenanya kompleks-kompleks ini disebut dengan kompleks perpindahan muatan (charge-transfer complexes). Contoh kompleks ini yang umum adalah kompleks besi (III) dengan tiosinat atau senyawa fenolik, dan besi (II) dengan o-fenantrolin dan ferisianida (Rohman, 2007). E. Instrumentasi Spektrofotometri UV-Vis Spekrofotometer yang sesuai untuk pengukuran di daerah spektrum ultraviolet dan sinar tampak terdiri atas suatu sistem optik dengan kemampuan menghasilkan sinar monokromatis dalam jangkauan panjang gelombang 200-800 nm (Rohman, 2007). Suatu diagram sederhana spektrofotometer UV-Vis ditunjukkan oleh gambar berikut: Dengan komponen-komponennya meliputi sumber-sumber sinar, monokromator, dan sistem optik. a. Sumber-sumber lampu; lampu deudetrium digunakan untuk daerah UV pada panjang gelombang dari 190-350 nm, sementara lampu halogen kuarsa atau lampu tungsten digunakan untuk daerah visibel (pada panjang gelombang antara 350-900 nm) (Rohman, 2007). b. Monokromator; digunakan untuk mendispersikan sinar ke dalam komponenkomponen panjang gelombangnya yang selanjutnya akan dipilih oleh celah (slit). Monokromator berputar sedemikian rupa sehingga kisaran panjang gelombang dilewatkan pada sampel sebagai scan instrumen melewati spektrum (Rohman, 2007). c. Optik-optik ; dapat didesain untuk memecahkan sumber sinar sehingga sinar melewati 2 kompartemen, dan sebagaimana dalam spektrofotometer berkas ganda (double baem), suatu larutan blanko dapat digunakan dalam satu kompartemen untuk mengkoreksi pembacaan atau spektrum sampel. Yang paling sering digunakan sebagai blanko dalam spektrofotometri adalah semua pelarut yang digunakan untuk melarutkan sampel atau pereaksi (Rohman, 2007). F. Penggunaan Spektrofotometri UV-Vis Penggunaan spektrofotometri sebagai sarana penentuan struktur senyawa memiliki sejarah yang panjang. Reaksi nyala yang populer berdasarkan prinsip yang sama dengan spektrofotometri. Di pertengahan abad ke-19, kimiawan Jerman Robert Wilhelm Bunsen (1811-1899) dan fisikawan Jerman Gustav Robert Kirchhoff (1824-1887) berkerjasama mengembangkan spektrometer (Gambar 13.2). Dengan bantuan alat baru ini, mereka berhasil menemukan dua unsur baru, rubidium dan cesium. Kemudian alat ini digunakan banyak kimiawan untuk menemukan unsur baru semacam galium, indium dan unsur-unsur tanah jarang. Spektrofotometri ntelah memainkan peran penting dalam penemuan gasgas mulia (Takeuchi, 2009). Metoda penyelidikan dengan bantuan spektrometer disebut spektrometri. Dengan sumber cahaya apapun, spektrometer terdiri atas sumber sinar, prisma, sel sampel, detektor dan pencatat. Fungsi prisma adalah untuk memisahkan sinar polimkromatis di sumber cahaya menjadi sinar monokromatis, dan dengan demikian memainkan peran kunci dalam spectrometer (Takeuchi, 2009). Dalam spektrometer modern, sinar yang datang pada sampel diubah panjang gelombangnya secara kontinyu. Hasil percobaan diungkapkan dalam spektrum dengan absisnya menyatakan panjang gelombang (atau bilangan gelombang atau frekuensi) sinar datang dan ordinatnya menyatakan energi yang diserap sampel (Takeuchi, 2009). Salah satu contoh instrumentasi analisis yang lebih kompleks adalah spektrofotometer UV-Vis. Alat ini banyak bermanfaat untuk penentuan konsentrasi senyawa-senyawa yang dapat menyerap radiasi pada daerah ultraviolet (200 – 400 nm) atau daerah sinar tampak (400 – 800 nm). Analisis ini dapat digunakan yakni dengan penentuan absorbansi dari larutan sampel yang diukur (Sastrohamidjojo, 1991). Umumnya spektrofotometri dengan sinar ultraviolet (UV) dan sinar tampak (VIS) dibahas bersama karena sering kedua pengukuran dilakukan pada waktu yang sama. Karena spektrofotometri UV-VIS berkaitan dengan proses berenergi tinggi yakni transisi elektron dalam molekul, informasi yang didapat cenderung untuk molekul keseluruhan bukan bagian-bagian molekulnya. Metoda ini sangat sensitif dan dengan demikian sangat cocok untuk tujuan analisis. Lebih lanjut, spetroskopi UV-VIS sangat kuantitatif dan jumlah sinar yang diserap oleh sampel diberikan oleh ungkapan hukum Lambert-Beer. Menurut hukum ini, absorbansi larutan sampel sebanding dengan panjang lintasan cahaya d dan konsentrasi larutannya c (Beran, 1996). Prinsip penentuan spektrofotometer UV-Vis adalah aplikasi dari Hukum Lambert-Beer, yaitu: A = - log T = - log It / Io = ε . b . C Dimana : A = Absorbansi dari sampel yang akan diukur T = Transmitansi I0 = Intensitas sinar masuk It = Intensitas sinar yang diteruskan ε = Koefisien ekstingsi b = Tebal kuvet yang digunakan C = Konsentrasi dari sampel Penyebab kesalahan sistematik yang sering terjadi dalam analisis menggunakan spektrofotometer adalah: a) Serapan oleh pelarut Hal ini dapat diatasi dengan penggunaan blangko, yaitu larutan yang berisi matrik selain komponen yang akan dianalisis. b) Serapan oleh kuvet Kuvet yang biasa digunakan adalah dari bahan gelas atau kuarsa. Dibandingkan dengan kuvet dari bahan gelas, kuvet kuarsa memberikan kualitas yang lebih baik, namun tentu saja harganya jauh lebih mahal. Serapan oleh kuvet ini diatasi dengan penggunaan jenis, ukuran, dan bahan kuvet yang sama untuk tempat blangko dan sampel. c) Kesalahan fotometrik normal pada pengukuran dengan absorbansi sangat rendah atau sangat tinggi, hal ini dapat diatur dengan pengaturan konsentrasi, sesuai dengan kisaran sensitivitas dari alat yang digunakan. (melalui pengenceran atau pemekatan) (Sastrohamidjojo, 1991). Dengan mengukur transmitans larutan sampel, dimungkinkan untuk menentukan konsentrasinya dengan menggunakan hukum Lambert-Beer. Karena spektrofotometri UV-VIS sangat sensitif dan spektrometernya dapat dibuat dengan ukuran yang sangat kecil, metoda ini khususnya sangat bermanfaat untuk analisis lingkungan, dan khususnya cocok untuk pekerjaan di lapangan (Miller, 2000). Hukum Lambert-Beer dipenuhi berapapun panjang gelombang sinar yang diserap sampel. Panjang gelombang sinar yang diserap oleh sampel bergantung pada struktur molekulsampelnya. Jadi spektrometri UV-VIS dapat digunakan sebagai sarana penentuan struktur. Sejak 1876, kimiawan Swiss-Jerman Otto Nikolaus Witt (1853-1915) mengusulkan teori empiris warna zat (yang ditentukan oleh panjang gelombang sinar yang diserap) dan struktur bagian-bagiannya. Menurut teori ini, semua senyawa berwarna memiliki beberapa gugus tak jenuh. Gugus fungsi semacam ini disebut dengan kromofor. Semua senyawa pewarna dan pigmen memiliki kromofor (Miller, 2000). Terdapat beberapa faktor lain yang harus diperhatikan sehubungan dengan warna senyawa. Panjang konjugas linear adalah faktor yang penting. Misalnya, warna merah ß-karoten berasal dari sistem terkonjugasi, dan warna ini cocok dengan hasil perhitungan kimia kuantum. Terdapat beberapa gugus fungsi, seperti -NR2, -NHR, -NH2, -OH dan -OCH3, yang memiliki efek memekatkan warna kromofornya. Semua ini disebut auksokrom. Struktur ß-karoten. Warna merah wortel dan tomat adalah akibat sistem terkonjugasi yang panjang ini. Namun, tidak mungkin menyimpulkan struktur senyawa dari senyawa dari warnanya atau panjang gelombang sinar yang diserapnya (Takeuchi, 2009). Untuk mengatasi kesalahan pada pemakaian spektrofotometer UV-Vis maka perlu dilakukan kalibrasi. Kalibrasi dalam spektrofotometer UV-Vis dilakukan dengan menggunakan blangko: Setting nilai absorbansi = 0 Setting nilai transmitansi = 100 % Penentuan kalibrasi dilakukan denganikuti prosedur sebagai berikut: a. Dilakukan dengan larutan blangko (berisi pelarut murni yang digunakan dalam sampel) dengan kuvet yang sama. b. Setiap perubahan panjang gelombang diusahakan dilakukan proses kalibrasi. c. Proses kalibrasi pada pengukuran dalam waktu yang lama untuk satu macam panjang gelombang, dilakukan secara periodik selang waktu per 30 menit (Beran, 1996). Dengan adanya proses kalibrasi pada spektrofotometer UV-Vis ini maka akan membantu pemakai untuk memperoleh hasil yang kaurat dan presisi (Beran, 1996). G. Aspek Kualitatif dan Kuantitatif dalam Spektrofotometri UV-Vis Spektra uv-vis dapat digunakan untuk informasi kualitatif dan sekaligus dapat digunakan untuk analisis kuantitatif. 1. Aspek Kualitatif Data spectra UV-Vis secara tersendiri tidak dapat digunakan untuk identifikasi kualitatif obat atau metabolitnya. Akan tetapi jika digabung dengan cara lain seperti spektroskopi infra merah, resonansi magnet inti, dan spektroskopi massa, maka dapat digunakan untuk maksud identifikasi/ analisis kualitatif suatu senyawa tersebut. Data yang diperoleh dari spektroskopi UV dan Vis adalah panjang gelombang maksimal, intensitas, efek pH, dan pelarut; yang kesemuanya itu dapat diperbandingkan dengan data yang sudah dipublikasikan (Published data). Dari spectra yang diperoleh dapat dilihat, misalnya: a. Serapan (absorbansi) berubah atau tidak karena perubahan pH. Jika berubah, bagaimana perubahannya apakah dari batokromik ke hipsokromik dan sebaliknya atau dari hipokromik ke hiperkromik, dan sebaliknya (Ghalib dan Rohman, 2007). b. Obat-obat yang netral misalnya kafein, kloramfenikol; atau obat-obat yang berisi auksukrom yang tidak terkonjugasi seperti amfetamin, siklizin dan pensiklidin (Ghalib dan Rohman, 2007). 2. Aspek Kuantitatif Dalam aspek kuantitatif, suatu berkas radiasi dikenakan pada cuplikan (larutan sampel) dan intensitas sinar radiasi yang diteruskan diukur besarnya. Radiasi yang diserap oleh cuplikan ditentukan dengan membandingkan intensitas sinar yang diserap jika tidak ada spesies penyerap lainnya. Intesitas atau kekuatan radiasi cahaya sebanding dengan jumlah foton yang melalui satu satuan luas penampang per detik. Serapan dapat terjadi jika foton/ radiasi yang mengenai cuplikan memiliki energy yang sama dengan energy yang dibutuhkan untuk menyebabkan terjadinya perubahan tenaga. Kekuatan radiasi juga mengalami penurunan dengan adanya penghamburan dan pemantulan cahaya, akan tetapi penurunan karena hal ini sangat kecil jika dibandingkan dengan proses penyerapan Gholib dan Rohman, 2007). Penggunaan analisa kuantitatif didasarkan pada hukum LambertBeers yang menyatakan hubungan empiris antara intesitas cahaya yang ditransmisikan dengan tebalnya larutan (hukum Lambert/ Bouguer) dan hubungan antara intensitas tadi dengan konsentrasi zat (hokum Beers). Hukum Lambert-Beers: A Log = ε.b.c= a.b.c (Henry, 2009). Dimana : A = serapan Io = intensitas sinar yang datang It = intensitas sinar yang diteruskan (ditransmisikan) ε = absorbtivitas molekuler/ konstanta ekstingsi a = daya serap b = tebal larutan/ kuvet c = konsentrasi (Henry, 2009). Dalam hukum Lambert-Beers tersebut ada beberapa pembatasan yaitu: • Sinar yang digunakan dianggap monokromatis • Penyerapan terjadi dalam suatu volume yang mempunyai penampang luas yang sama • Senyawa yang menyerap dalam larutan tersebut tidak tergantung terhadap yang lain dalam larutan tersebut • Tidak terjadi peristiwa fluoresensi atau fosforisensi • Indeks bias tidak tergantung pada konsentrasi larutan (Ghalib dan Rohman, 2007). Analisis kuantitatif denga metode spektrofotometri UV-Vis dapat digolongkan atas tiga macam pekerjaan, yaitu: 1. Analisis zat tunggal atau analisis satu komponen 2. Analisis kuantitatif campuran dua macam zat atau analisis dua komponen 3. Analisis kuantitatif campuran tiga macam zat atau lebih (analisis multi komponen) (Ghalib dan Rohman, 2007). Dalam Farmakope, metode spektrofotometri UV-Vis digunakan untuk menetapkan kadar senyawa obat dalam jumlah yang cukup banyak. Metode ini biasanya mendasarkan pada penggunaan nilai suatu obat. Spektrofotometri yang digunakan harus telah terkalibrasi dengan benar. Nilai merupakan absorbansi suatu senyawa yang diukur pada konsentrasi 1% b/v (1 g/100 mL) dan dengan kuvet yang mempunyai ketebalan 1 cm pada panjang gelombang dan pelarut tertentu. Manfaat lain dari informasi nilai adalah terkait dengan apakah senyawa tersebut cukup sensitif diukur dengan spektrofotometer UV-Vis (Ghalib dan Rohman, 2007). Cara lain untuk menetapkan kadar sampel adalah dengan menggunakan perbandingan absorbansi sampel dengan absorbansi baku, atau dengan menggunakan persamaan regresi linier yang menyatakan hubungan antara konsentrasi baku dengan absorbansinya. Persamaan kurva baku selanjutnya digunakan untuk menghitung kadar dalam sampel (Ghalib dan Rohman, 2007). H. Spektra UV untuk Beberapa Molekul Obat Berikut akan diuraikan beberapa tipe spectra UV molekul obat : 1. Enon Steroid Kromofor-kromofor kebanyakan senyawa obat mendasarkan pada modifikasi kromofor pada cincin benzene. Salah satu kelompok senyawa yang tidak sesuai dengan kelompok ini adalah steroid (karena tidak memiliki cincin benzene) (Rohman, 2007). Jenis spectra ini umum untuk golongan steroid dan kesemuanya mempunyai absorbansi maksimal sekitar 240 nm dengan insentitas serapan yang mirip. Adanya tambahan ikatan rangkap pada betametason dibandingkan dengan hidrokortison tidak memberikan perbedaan yang cukup besar pada absorbansisnya di panjang gelombang maksimal. meskipun demikian, bentuk pita absorbsi betametason berbeda dengan bentuk pita pada hidrokortison (Rohman, 2007). Steroid BM λmaks Nilai E Hidrokortison 362,5 240 435 Betametason Klobetason 392,5 240 390 479,0 236 330 516,4 241 296 butirat Betametason natrium fosfat Tabel di atas meringakas data beberapa struktur steroid dan menggambarkan adanya efek berat molekul (BM) pada nilai E. Kekuatan kromofor enon adalah mirip untuk keseluruhan steroid karena nilai E berdasarkan pada absorbansi larutan 1% b/v. Nilai E akan turun jika BM steroid naik. Hal seperti ini berlaku untuk semua molekul (Rohman, 2007). 2. Efedrin : Suatu Kromofot Tipe Steroid (mengandung inti benzen) Efedrin mempunyai kromofor cincin benzene yang paling sederhana dan mempunyai spektum yang mirip benzene dengan pita simetri telarang yang lemah pada ± 260nm dengan nilai E=12. Sebagaimana benzene, efedrin juga mempunyai intensitas serapan maksimum di bawah 200nm. hal ini dapat dimengerti karena pada efedrin tidak ada gugus polar atau auksokrom yang berikatan secara langsung dengan gugus kromofor inti benzene. Obat-obat yang mempunyai kromofor seperti efedrin antara lain : difenil hidramin, ibuprofen, dan dekstro propoksifen. 3. Ketoprofen : Kromofor Benzen yang Diperpanjang Dalam kasus ini, kromofor inti benzene telah diperpanjang dengan 4 ikatan rangkap akibatnya simetri cincin benzene di ubah. Demikian juga, pita absorbs yang kuat pada benzene di 204 nm mengalami pergeseran batokromik dan memberikan λmaks di 262nm dan nilai E=647. Obat-obat lain yang mempunyai kromofor benzene yang diperpanjang antara lain : siproheptadin, dimentindin, protriptilin dan zimeldin (Rohman, 2007). 4. Prokain : Auksukrom gugus amino Pada prokain, kromofor benzene diperpanjang engan gugus C=O. di samping itu, prokain juga mempunyai auksokrom yang berupa gugus amino. Pada kondisi basa, prokain mempunyai E=1000, sedangkan pada kondisi asam nilai E prokain sebesar 100. Hal ini disebabkan karena pokain pada kondisi basa mempunyai sepasang electron pada gugus –NH2 yang dapat berinteraksi dengan kromofor untuk memberikan pergeseran hiperkromik. Dalam kondisi asam, gugus amino ini akan terprotonasi akibatnya gugus amino tidak lagi berfungsi sebagai auksokrom. Meskipun demikian, jika proton ini dihilangkan dari prokain dengan mengkondisikannya dalam lingkungan basa maka akan tetap memberikan pergeseran hiperkromik dan tetap memiliki nilai E sebesar 1000. Dari sini, dapat dimengerti bahwa prokain dan obat-obat lain yang mempunyai kromofor dan auksokrom sejenis dengan prokain lebih baik dilakukan analisis kuantitatif dalam kondisi basa, sebab pada kondisi basa prokain mempunyai sensitifitas yang lebih tinggi disbanding pada kondisi asam. Obat-obat yang mempunyai kromofor seperti prokain antara lain : prokainamid da peroksimetakain. Penting untuk dicatat bahwa obat-obat anestesi local seperti bupivakain dan lignokain tidak termasuk dalam kategori ini, disebabkan kelompok senyawa ini merupakan amida aromatic dan sepasang electron bebas pada nitrogen tidak tersedia sepenuhnya karena adanya gugus C=O yang bersifat gugus penarik electron (Rohman, 2007). 5. Fenileprin : Auksukron Gugus Hidroksil Kromofor fenileprin tidak diperpanjang akan tetapi struktur fenileprin mempunyai gugus hidroksi fenolik. Gugus hidroksi fenolik ini dapat berfungsi sebagai auksokrom baik pada kondisi asam ataupun basa. Dalam kondisi asam, fenileprin mempunyai 2 pasang electron bebas, sedangkan pada kondisi basa fenileprin mempunyai 3 pasang electron bebas yang dapat berinteraksi dengan kromofor cincin benzene. Fenileprin dan senyawa-senyawa yang mempunyai kromofor dan auksokrom sejenis lebih baik ditetapkan kadarnya dalam kondisi basa daripada dalam kondisi asam sebab pada kondisi basa fenileprin mempunyai sensitifitas yang tinggi disbanding pada kondisi asam (Rohman, 2007). DAFTAR PUSTAKA Beran, J.A. 1996. Chemistry in The Laboratory. John Willey & Sons. Harmita. 2006. Analisis Kuantitatif Bahan Baku dan Sediaan Farmasi. Cipta Kreasi Bersama. Jakarta. Henry, Arthur. 2009. Analisis Spektrofotometri UV-Vis Pada Obat Influenza Dengan Menggunakan Aplikasi Sistem Persamaan Linier. http: //repository. gunadarma.ac .id: 8000/ browse.php?nfile=177 (diakses tanggal 8 November 2009) Miller, J.N and Miller, J.C. 2000. Statistics and Chemometrics for Analytical Chemistry, 4th ed, Prentice Hall. Harlow. Rohman, A. 2007. Kimia Farmasi Analisis. Pustaka Pelajar. Yogyakarta. Sastrohamidjojo, H, 1991. Spektrofotometri. Liberty. Yogyakarta. Takeuchi, Yoshito. 2009. Metode Spektrofotometri. Available online on http//www.chem-is-try.org. [Diakses pada 07 Oktober 2009] SPEKTROFOTOMETRI ULTRAVIOLET DAN TAMPAK (VISIBLE) Kelompok 6 : 1. Sisca Seftiani Putri (260110070079) 2. Diatri Mariana H (260110070081) 3. Elis Ronasih (260110070083) 4. Annisa Nur Utami P. (260110070085) 5. Petrus Topaga (260110070087) 6. Dea Gilang Kancanawatie (260110070089) 7. Ayu Soffi Cholifati (260110070091) 8. Reynaldi Firmansyah (260110070093) 9. (D1E050002) Dhani Adriati K. KIMIA FARMASI ANALISIS I FAKULTAS FARMASI UNIVERSITAS PADJADJARAN 2009

![Modul Etik UMB [TM5] - Universitas Mercu Buana](http://s1.studylibid.com/store/data/000473648_1-9ef77b031bd4932c4f048a5947351be3-300x300.png)







