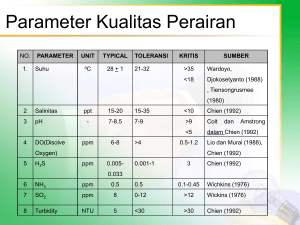
STUDI AKUMULASI LOGAM NIKEL PADA METODE
advertisement

i STUDI AKUMULASI LOGAM NIKEL PADA METODE FITOREMEDIASI MENGGUNAKAN TANAMAN SENGGANI (Melastoma malabathricum) TESIS OLEH SARLAN G2L113001 PROGRAM STUDI KIMIA PROGRAM PASCASARJANA UNIVERSITAS HALU OLEO KENDARI 2017 ii STUDI AKUMULASI LOGAM NIKEL PADA METODE FITOREMEDIASI MENGGUNAKAN TANAMAN SENGGANI (Melastoma malabathricum) TESIS Diajukan Sebagai Salah Satu Syarat Memperoleh Gelar Magister Sains Pada Program Studi Kimia Program Pascasarjana Universitas Halu Oleo OLEH SARLAN G2L113001 PROGRAM STUDI KIMIA PROGRAM PASCASARJANA UNIVERSITAS HALU OLEO KENDARI 2017 iii HALAMAN PENGESAHAN Judul : Studi Akumulasi Fitoremediasi Logam Nikel Menggunakan Pada Tanaman Metode Senggani (Melastoma malabathricum) Nama : Sarlan Nomor Induk Mahasiswa : G2L113001 Program Studi : Kimia Menyetujui: Komisi Pembimbing, Pembimbing I Pembimbing II Dr. rer. nat. H. Ahmad Zaeni, M.Si NIP. 19630208 199412 1 001 Armid, S.Si., M.Si., M.Sc., D.Sc. NIP. 19750618 200003 1 002 Mengetahui : Koordinator Program Studi Kimia Dr. rer. nat. H. Ahmad Zaeni, M.Si. NIP. 19630208 199412 1 001 iv PERNYATAAN KEASLIAN TULISAN Saya yang bertandatangan di bawah ini: Nama : Sarlan Nomor Pokok : G2L113001 Program Studi : Kimia Program Pendidikan : Pascasarjana Universitas : Halu Oleo Menyatakan dengan sebenar-benarnya bahwa tesis yang saya tulis ini benar-benar merupakan hasil karya sendiri, bukan merupakan pengambilalihan tulisan atau pikiran orang lain yang saya akui sebagai tulisan atau pikiran saya sendiri. Apabila di kemudian hari terbukti atau dapat dibuktikan tesis ini hasil juplakan, maka saya bersedia menerima sanksi atas perbuatan tersebut sesuai peraturan yang berlaku. Kendari, 4 Juli 2017 Yang membuat pernyataan Sarlan v KATA PENGANTAR Alhamdulillah, puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya sehingga penulisan hasil penelitian yang berjudul “Studi Akumulasi Logam Nikel Pada Metode Fitoremediasi Menggunakan Melastoma malabatricum” dalam rangka memenuhi salah satu syarat untuk mencapai gelar Magister di bidang Kimia dapat terselesaikan. Dalam kesempatan ini dengan segala bakti penulis haturkan terima kasih dan penghargaan yang tak terhingga kepada ibunda Sakti dan ayahanda La Pananta atas segala doa, restu, semangat, bimbingan, arahan, nasehat yang memberikan kedamaian hati serta ketabahan dalam mendidik, membesarkan dan menitipkan harapan besar kepada penulis. Terima kasih penulis haturkan kepada bapak Dr. rer. nat. H. Ahmad Zaeni, M.Si. selaku pembimbing pertama dan bapak Armid, S.Si., M.Si., M.Sc., D.Sc. selaku pembimbing kedua yang telah meluangkan waktu, tenaga dan pikiran dalam mengarahkan dan membimbing penulis selama mengikuti perkuliahan maupun dalam proses penyelesaian hasil penelitian ini. Semoga Allah SWT selalu melindungi dan melimpahkan rahmatNya. Penulis juga menyampaikan terima kasih kepada : 1. Bapak Rektor Universitas halu Oleo Kendari. 2. Bapak Prof. Dr. Ir. H. Sahta Ginting, M.Agr.Sc. Ph.D selaku direktur Program Pascasarjana Universitas Halu Oleo. 3. Bapak Dr. rer. nat. H. Ahmad Zaeni, M.Si. selaku Koordinator Program Studi Kimia. vi 4. Bapak Prof. Dr. H. Muhammad Nurdin, M.Sc., Prof. Dr. Sahidin, S.Pd. M.Si., dan Dr. La Ode Ahmad Nur Ramadhan, M.Si selaku dosen penguji yang telah memberikan kritikan dan arahan membangun kepada penulis dalam penyusunan tugas akhir ini. 5. Semua dosen Program Studi Kimia Program Pascasarjana Universitas Halu Oleo atas bimbingan, ilmu, serta bantuannya yang telah diberikan kepada penulis. 6. Rekan-rekan seangkatan kimia 13 : Ibu Tuty, Pak Syahrir, Ismaun, Bu Hafni, Gayuh. 7. Teman-teman penelitian : Alwahab, Sakinah, Kadir atas bantuannya selama penelitian. Akhir kata, penulis persembahkan kepada segenap pembaca semoga bermanfaat dan berguna demi kepentingan Ilmu pengetahuan dan Teknologi, Semoga Allah Subhanahu Wa Ta”ala memberkahi kita semua. Amin. Kendari, Juli 2017 Penulis vii Studi Akumulasi Logam Nikel Pada Metode Fitoremediasi Menggunakan Tanaman Senggani (Melastoma malabatricum) Sarlan, Ahmad Zaeni, Armid Program Pascasarjana Universitas Halu Oleo e-mail: [email protected] Abstrak Tanaman dapat beradaptasi dengan lingkungantempat tumbuhnya dengan berbagai cara. Beberapa tanaman ada yang bersifat hiperakumulator terhadap keberadaan ion logam berat, beberapa ada yang bersifat indikator dan ada yang bersifat eksluder. Penelitian ini menggunakan Melastoma malabatricum karena tanaman ini dapat hidup pada tanah dengan konsentrasi Nikel (Ni) yang tinggi. Penelitian ini bertujuan untuk mengkarakterisasi tanaman M. mmalabathricum terhadap kemampuannya mentranslokasikan ion logan Ni. Konsentrasi logam Ni pada tanah divariasikan dari 0 ppm sampai 400 ppm. Hasil peneltian menunjukkan bahwa M. malabathricum toleran terhadap Ni karena tanaman ini mampu hidup dengan adanya logam Ni pada tanah. Bertambahnya konsentrasi Logam Ni pada tanah menyebabkan laju pertumbuhan tanaman M. malabathricum menjadi berkurang. Hal ini dapat dilihat dari berkurangnya rata-rata pertambahan daun dan pertambahan tinggi. Selain toleran, M. malabathricum juga dapat mengakumulasi logam ke dalam jaringannya. Semakin tinggi konsentrasi Ni di dalam tanah, konsentrasi Ni di dalam jaringan tanaman juga semakin tinggi, sehingga tanaman ini dapat digunakan sebagai indikator pencemaran Ni pada tanah. Rata-rata konsentrasi logan Ni tertinggi pada jaringan akar, batang, dan daun berturut-turut : 2676,47 ppm, 1547,33 ppm, 1163,53 ppm. Secara umum, pada setiap konsentrasi Ni dalam tanah, konsentrasi Ni pada jaringan akar lebih tinggi dibandingkan dengan konsentrasi Ni pda jaringan batang dan daun. Berdasarkan nilai Bioaccumution Factor, tanaman M. malabathricum merupakan tanaman akumulator logam Ni. Tanaman ini memiliki kemampuan meremediasi logam Ni dari dalam tanah hingga 166,28 g/ha tiap tahun. Kata Kunci : Melastoma, Nikel, toleran, Logam berat. viii Study of Nickel Accumution Ability of Senggani (Melastoma malabatricum) on Phytoremediation Method Ahmad Zaeni, Armid, Sarlan Post-graduate Program of Halu Oleo University e-mail: [email protected] Abstract Plants have ability to adapt their growing environment with some way. Some of them are hyperaccumulator of heavy metal ion, indicator of heavy metal ion and excluder. This study used Melastoma malabatricum because it is one of the plant that tolerant with present of Nickel high concentration of soil. The aims of this study was to characterize Nickel ion translocation ability of M. malabathricum. Concentration level of Ni was variated from 0 ppm to 400 ppm. The study result showed that M. malabathricum was tolerant to present of high concentration of Ni base on it‟s ability to grow. Rate growing of Melastoma m. was decrease by increasing of concentration of Ni in media. It can be seen by decreased average of leaf and stem increasing. M. malabathricum also can absorb and accumulated Ni in it‟s tissues. Because of the Ni concentraton in plants tissue was increase with increasing of Ni concentration in soil, this plant can be used as indicator of Ni contamination in soil. The highest average on Ni concentration in root, stem, and leaf respectively : 2676.47 ppm, 1547.33 ppm, 1163.53 ppm. Generally, concentration of Ni in root higher than stem and leaf on each concentration of Nickel in soil. Base on the value of Bioaccumulation factor, M. malabathricum is accumulayor of Ni. This plant own Ni rmediation ability from contaminated soil up to 166,28 g/ha each year. Kata Kunci : Melastoma, Nickel, tolerant, heavy metal. ix DAFTAR ISI HALAMAN PENGESAHAN ................................................................................. ii PERNYATAAN KEASLIAN TULISAN ............................................................. iv KATA PENGANTAR ............................................................................................ v Abstrak ................................................................................................................. vii Abstract ............................................................................................................... viii DAFTAR TABEL ................................................................................................. xii DAFTAR GAMBAR ........................................................................................... xiii DAFTAR LAMPIRAN ........................................................................................ xiv DAFTAR ARTI LAMBANG DAN SINGKATAN ............................................. xv 1 2 PENDAHULUAN .......................................................................................... 1 1.1 Latar Belakang ......................................................................................... 1 1.2 Rumusan Masalah .................................................................................... 3 1.3 Tujuan ....................................................................................................... 3 1.4 Manfaat ..................................................................................................... 3 LANDASAN TEORI ...................................................................................... 4 2.1 Tanaman Melastoma sp. ........................................................................... 4 2.2 Nikel Pada Tanaman ................................................................................ 5 2.2.1 Kebutuhan Nikel ............................................................................... 5 2.2.2 Toksisitas Nikel................................................................................. 7 2.2.3 Konsentrasi Nikel (Ni) Dalam Jaringan ............................................ 8 2.3 3 Mekanisme Penyerapan Nikel (Ni) Oleh Tanaman................................ 10 2.3.1 Penyerapan Pada Akar .................................................................... 11 2.3.2 Pembawa Nikel ............................................................................... 13 2.3.3 Distribusi/Detoksifikasi .................................................................. 15 2.4 Pertumbuhan Tanaman dan Akumulasi Logam ..................................... 17 2.5 Metode Fitoremediasi ............................................................................. 18 2.5.1 Fitodegradasi ................................................................................... 19 2.5.2 Fitovolatilisasi ................................................................................. 20 2.5.3 Fitostabilisasi .................................................................................. 22 2.5.4 Rizofiltrasi ....................................................................................... 24 2.5.5 Rizodegradasi .................................................................................. 26 2.5.6 Fitoekstraksi .................................................................................... 27 KERANGKA BERPIKIR DAN HIPOTESIS .............................................. 29 x 4 3.1 Kerangka Berpikir .................................................................................. 29 3.2 Hipotesis ................................................................................................. 30 METODOLOGI PENELITIAN .................................................................... 31 4.1 Waktu dan Tempat Penelitian ................................................................ 31 4.2 Alat dan Bahan ....................................................................................... 31 4.2.1 Alat .................................................................................................. 31 4.2.2 Bahan............................................................................................... 31 4.3 Prosedur Penelitian ................................................................................. 32 4.3.1 Pembuatan Media Pembibitan......................................................... 32 4.3.2 Pembibitan ...................................................................................... 32 4.3.3 Penentuan kadar Nikel Tanah ........................................................ 32 4.3.4 Pembuatan Larutan Nikel 4000 ppm .............................................. 32 4.3.5 Pembuatan Tanah Terkontaminasi Nikel ........................................ 33 4.3.6 Penanaman Pada polybag eksperimen ............................................ 33 4.3.7 Pemanenan ...................................................................................... 33 4.3.8 Penentuan Konsentrasi Nikel Pada Jaringan ................................... 33 4.3.9 Penentuan Bioconcentration Factor ............................................... 34 4.3.10 Penentuan Translocation factor ...................................................... 34 4.3.11 Pengukuran Panjang Akar ............................................................... 34 4.3.12 Penentuan Luas Daun ...................................................................... 35 4.3.13 nalisis Kemampuan Remediasi Logam Ni Oleh M. malabathricum. ........................................................................................ 35 5 HASIL DAN PEMBAHASAN ..................................................................... 36 5.1 Pengaruh Logam Ni Terhadap Pertumbuhan Tanaman ......................... 36 5.1.1 Pertambahan Jumlah Daun.............................................................. 39 5.1.2 Pertambahan Tinggi ........................................................................ 44 5.1.3 Panjang Akar ................................................................................... 45 5.2 Pengaruh Konsentrasi Ni Pada Media Terhadap Penyerapan Logam Ni Oleh Tanaman ................................................................................................... 47 5.2.1 Akar ................................................................................................. 48 5.2.2 Batang ............................................................................................. 50 5.2.3 Daun ................................................................................................ 51 5.3 Kadar Abu dan Konsentrasi Ni Pada Abu Jaringan Tanaman ............... 53 5.4 Profil penyerapan Nikel Oleh Tanaman M. malabathricum. ................. 54 5.4.1 Bioconcentration Factor ................................................................. 54 xi 6 5.4.2 Translocation Factor ...................................................................... 56 5.4.3 Kemampuan Remediasi Melasoma malabathricum ....................... 57 KESIMPULAN ............................................................................................. 59 DAFTAR PUSTAKA ........................................................................................... 60 LAMPIRAN .......................................................................................................... 66 6.1 Pembuatan Media Pembibitan ................................................................ 66 6.2 Pembibitan .............................................................................................. 66 6.3 Pembuatan Larutan Ni 4000 ppm ........................................................... 67 6.4 Preparasi Sampel Untuk analisis AAS ................................................... 67 6.5 Pembuatan Tanah terkontaminasi Ni ..................................................... 69 6.6 Penenaman Pada Polibag Experimen ..................................................... 70 6.7 Pemanenan .............................................................................................. 70 6.8 Pengukuran Pertumbuhan Tanaman ....................................................... 71 6.9 Tabel Rata-rata Pertambahan Tinggi ...................................................... 78 6.10 Grafik Pertambahan Tinggi ................................................................ 78 6.11 Tabel Rata-rata Pertambahan Daun .................................................... 79 6.12 Grafik Pertambahan Jumlah daun ....................................................... 79 6.13 Tabel Biomassa Tanaman ................................................................... 80 6.14 Larutan Standar Ni .............................................................................. 81 6.15 Tabel Konsentrasi Ni Pada Batang ..................................................... 82 6.16 Tabel Pengukuran Konsentrasi Ni Akar ............................................. 82 6.17 Tabel Pengukuran Konsentrasi Ni Batang .......................................... 84 6.18 Tabel Pengukuran Konsentrasi Ni Daun ............................................ 85 6.19 Grafik Konsentrasi Ni Pada Batang .................................................... 88 6.20 Tabel Konsentrasi Ni Pada Daun ........................................................ 88 6.21 Grafik Konsentrasi Ni pada Daun ....................................................... 89 6.22 Tabel konsentrasi Ni Pada Akar ......................................................... 89 6.23 Grafik Konsentrasi Ni Pada Akar ....................................................... 90 6.24 Kemampuan Remediasi TanamanMelastoma malabathricum ........... 91 6.25 Kemampuan Translokasi Tanaman .................................................... 92 6.26 Analisis Statistik Pertambahan Daun .................................................. 92 6.27 Analisis Statistik Pertambahan Tinggi .............................................. 100 xii DAFTAR TABEL 1. Perbedaan Luas Daun M. malabathricum………………………………… 43 2. Rata-rata Kadar Abu dan Kadar Nikel Pada Abu tanaman M. malabathricum……………………………………………………………….. 53 3. Kemampuan akumulasi Logam Ni Tanaman M. malabathricum .……… 55 4. Kemampuan Translokasi Nikel Pada batang dan daun M. malabathricum. 57 5. Kemampuan Remediasi Logam Ni oleh Tanaman M. malabathricum……. 58 xiii DAFTAR GAMBAR 1. Tanaman Melastoma malabathricum ………………………………… 5 2. Penggolongan Tanaman Berdasarkan konsentrasi Logam …………… 10 3. Fitodegradasi …………………………………………………………. 20 4. Fitovolatilisasi ………………………………………………………… 21 5. Fitostabilisasi …………………………………………………………. 23 6. Rizofiltrasi ……………………………………………………………. 24 7. Rizodegradasi ………………………………………………………… 26 8. Fitoekstraksi ………………………………………………………….. 28 9. Kurva Sigmoid Pertumbuhan Tanaman ……………………………… 38 10. Grafik Pertambahan Jumlah Daun …………………………………… 39 11. Grafik Profil Jumlah Daun terhadap Konsentrasi Ni Dalam tanah ….. 41 12. Perbedaan Ukuran Daun Melastoma m. ……………………………… 42 13. Grafik Perbedaan Luas Daun Melastoma m. …………………………. 43 14. Grafik Pengaruh Ni dalam Tanah Terhadap Pertambahan Tinggi …… 44 15. Grafik Panjang Akar Terhadap Konsentrasi Ni Tanah ………………. 66 16. Akar Tanaman Melastoma m. ……………………………………….. 47 17. Senyawa Fitokelatin …………………………………………………. 48 18. Kompleks Ni ………………………………………………………… 49 19. Grafik Konsentrasi Ni dalam Akar tanaman ………………………... 49 20. Grafik Konsentrasi Ni dalam Batang Tanaman …………………….. 51 21. Grafik Konsentrasi Ni dalam Daun Tanaman ………………………. 52 22. Grafik Translocation Faktor Tanaman Melastoma m. ………………. 56 xiv DAFTAR LAMPIRAN 6.1 Pembuatan Media Pembibitan ................................................................ 66 6.2 Pembibitan .............................................................................................. 66 6.3 Pembuatan Larutan Ni 4000 ppm ........................................................... 67 6.4 Preparasi Sampel Untuk analisis AAS ................................................... 67 6.5 Pembuatan Tanah terkontaminasi Ni ..................................................... 69 6.6 Penenaman Pada Polibag Experimen ..................................................... 70 6.7 Pemanenan .............................................................................................. 70 6.8 Pengukuran Pertumbuhan Tanaman ....................................................... 71 6.9 Tabel Rata-rata Pertambahan Tinggi ...................................................... 78 6.10 Grafik Pertambahan Tinggi ................................................................ 78 6.11 Tabel Rata-rata Pertambahan Daun .................................................... 79 6.12 Grafik Pertambahan Jumlah daun ....................................................... 79 6.13 Tabel Biomassa Tanaman ................................................................... 80 6.14 Larutan Standar Ni .............................................................................. 81 6.15 Tabel Konsentrasi Ni Pada Batang ..................................................... 82 6.16 Tabel Pengukuran Konsentrasi Ni Akar ............................................. 82 6.17 Tabel Pengukuran Konsentrasi Ni Batang .......................................... 84 6.18 Tabel Pengukuran Konsentrasi Ni Daun ............................................ 85 6.19 Grafik Konsentrasi Ni Pada Batang .................................................... 88 6.20 Tabel Konsentrasi Ni Pada Daun ........................................................ 88 6.21 Grafik Konsentrasi Ni pada Daun ....................................................... 89 6.22 Tabel konsentrasi Ni Pada Akar ......................................................... 89 6.23 Grafik Konsentrasi Ni Pada Akar ....................................................... 90 6.24 Kemampuan Remediasi TanamanMelastoma malabathricum ........... 91 6.25 Kemampuan Translokasi Tanaman .................................................... 92 6.26 Analisis Statistik Pertambahan Daun .................................................. 92 6.27 Analisis Statistik Pertambahan Tinggi .............................................. 100 xv DAFTAR ARTI LAMBANG DAN SINGKATAN Lambang/Singkatan 0 C Arti Lambang/Singkatan Derajad Cescius G Gram Mg Mili gram L Liter mL Mili liter Ppm Part Permilion Ha Hektar AAS Athomic Absoption Spectroscopi Ni Nikel Nm Nano meter Panjang gelombang TF Translocation factor BCF Biological Concentration factor 1 BAB 1 I. PENDAHULUAN 1.1 Latar Belakang Sektor pertambangan merupakan salah satu industri yang berkembang di Propinsi Sulawesi Tenggara. Perkembangan tersebut disebabkan oleh cadangan mineral yang tinggi seperti Nikel (Ni), Emas (Au), Krom (Cr), dan Aspal. Kekayaan sumber daya alam tersebut menjadikan industri pertambangan menjadi salah satu industri andalan di Propinsi Sulawesi tenggara, khususnya pertambangan Ni. Hal itu dapat dilihat dengan berdirinya beberapa perusahaan yang bergerak di sektor pertambangan Ni. Kondisi ini membuat roda perekonomian di Sulawesi Tenggara menjadi lebih hidup. Ketersediaan lapangan pekerjaan terbuka lebar, sehingga masyarakat berpeluang untuk mendapatkan pekerjaan. Hal ini dapat meningkatkan taraf ekonomi masyarakat di wilayah tersebut, sehingga kesejahteraan bagi masyarakat yang dicita-citakan oleh pemerintah dapat tercapai. Selain itu, terdapat juga beberapa permasalahan terkait berkembangnya industri pertambangan, salah satunya adalah belum memadainya penanganan lahan bekas pertambangan. Menurut Mansur (2010), terdapat tiga kondisi yang dijumpai pada lahan bekas pertambangan, yaitu keasaman yang tinggi, kondisi fisik permukaan tanah yang rusak, dan kemampuan tanah mengikat air rendah. Selain itu bekas lahan pertambangan yang terbuka dan masih memiliki kandungan logam yang cukup tinggi dapat mengalami erosi oleh air hujan, sehingga logam dari lahan tersebut dapat mencemari lingkungan di daerah sekitarnya. Untuk itu, perlu dikembangkan suatu teknologi untuk mengatasi permasalahan pada lahan 2 bekas pertambangan, sehingga dapat mendukung perkembangan industri pertambangan yang ramah lingkungan di wilayah Sulawesi Tenggara. Salah satu metode yang dapat digunakan untuk mengatasi permasalahan tersebut adalah metode fitoremediasi, yaitu penggunaan tanaman untuk memperbaiki kondisi lingkungan. Tanaman yang digunakan adalah tanaman yang hipertoleran dan hiperakumulator terhadap logam. Metode ini dapat digunakan untuk mencegah erosi pada lahan bekas pertambangan dan meremediasi lingkungan yang tercemar logam. Penelitian ini akan menggunakan tanaman Melastoma malabathricum sebagai agen fitoremediasi logam Ni. Berdasarkan studi pendahuluan pada lahan pertambangan Nikel PT. Antam Pomalaa, diketahui bahwa tanaman Melastoma merupakan salah satu tanaman yang hidup pada tanah dengan konsentrasi Ni tinggi pada areal tersebut. Pada penelitian sebelumnya, telah diperoleh data bahwa Melastoma merupakan tanaman yang cukup toleran terhadap tingginya konsentrasi Ni dalam tanah dan mampu menyimpan Ni pada jaringannya dengan kadar yang cukup tinggi. Penelitian ini akan menyelidiki sejauh mana kemampuan kedua tanaman ini dalam toleransi dan akumulasi Ni. Selain itu, penelitian ini akan mempelajari kemampuan tanaman ini dalam menghilangkan kontaminan Ni pada tanah. Data yang akan diperoleh pada menelitian ini akan digunakan sebagai instrument penilaian terhadap kelayakan M. malabathricum untuk digunakan sebagai agen fitoremediasi pada lahan bekas pertambangan Nikel. 3 1.2 Rumusan Masalah Permasalahan yang diangkat pada penelitian ini adalah : 1. Bagaimanakah kemampuan toleransi Melastoma malabathricum terhadap kontaminasi nikel pada media tanam? 2. Bagaimanakah pengaruh konsentrasi nikel pada media tanam terhadap penyerapan nikel oleh tanaman Melastoma malabathricum ? 3. Bagaimanakan kemampuan remediasi logam nikel oleh tanaman Melastoma malabathricum ? 1.3 Tujuan Tujuan penelitian ini adalah 1. Untuk mengetahui pengaruh konsentrasi nikel pada media tanam terhadap pertumbuhan tanaman Melastoma malabathricum. 2. Untuk Mengetahui pengaruh konsentrasi nikel pada media tanam terhadap penyerapan nikel oleh tanaman Melastoma malabathricum 3. Untuk mengetahui kemampuan remediasi logam nikel oleh tanaman Melastoma malabathricum 1.4 Manfaat Manfaat penelitian ini adalah : 1. Peneliti dapat mengaplikasikan ilmu pengetahuan khususnya di bidang Kimia Lingkungan. 2. Hasil penelitian dapat memberikan informasi mengenai kemampuan toleransi dan akumulasi Ni oleh tanaman Melastoma sp. 3. Memberikan informasi tentang solusi bagi masalah lingkungan yang terjadi di sekitar kita. 4. Memberikan informasi tentang tanaman hipertoleran dan hiperakumulator terhadap Nikel. 4 BAB2II. LANDASAN TEORI 2.1 Tanaman Melastoma sp. Melastoma malabathricum termasuk famili/suku Melastomataceae, genus/marga Melastoma tumbuh liar pada tempat yang cukup sinar matahari, seperti lereng gunung, semak belukar, lapangan yang tidak terlalu gersang. Bia'sanya ditemukan sampai pada ketinggian 1650 m. Senggani telah digunakan dalam pengobatan untuk luka dan borok, diare, disentri dan juga penanggulangan hipertensi (digunakan selurah bagian tumbuhan), sakit gigi, kumur-kumur (akarnya). Daun muda dapat dimakan sebagai lalapan, atau direbus untuk pengobatan rematik, radang sendi (arthritis) dan untuk relaksasi pada kaki. Selain itu daun, buah, biji dan akar dapat digunakan untuk penetral racun, dengan direbus dan diminum airnya. Daunnya berguna dalam peternakan ulat sutera sebagai bahan makanan. Daging buah (pulp) sekeliling biji dapat dimakan, bijinya untuk pewarna hitam, dan akarnya untuk pewarna pink (Jawetz, dkk., 1996). Klasifikasi tanaman M. malabathricum : Kingdom : Plantae Subkingdom : Tracheobionta Superdivisi : Spermatophyta Divisi : Magnoliophyta Kelas : Magnoliopsida Subkelas : Rosidae Ordo : Myrtales Famili : Melastomataceae Genus : Melastoma Spesies : Melastoma malabathricum L. (Jawetz, dkk., 1996). 5 Gambar 1. Melastoma malabathricum (Gholib, D., 2009) Tanaman Melastoma sp. merupakan tanaman yang mengandung metabolit sekunder yang berpotensi dijadikan senyawa bahan obat. Balumugan, K., dkk (2014) telah menemukan bahwa ektrak etanol tanaman Melastoma malabathricum memiliki aktivitas antidiabetes dan antihiperlipidemia. Selain itu, ektrak metanol daun Melastoma memiliki aktivitas hepatoptrotekif (Kamisan, F.H., dkk., 2013). Roslen dkk (2014) telah melakukan screaning sitotoksisitas ektrak tanaman Melastoma, dan diketahui bahwa ektrak tanaman Melastoma tersebut memiliki aktivitas terhadap kanker payudara. Ektrak etanol tanaman Melastoma juga memiliki aktivitas antinosiseptik (Sulaiman, M.R., dkk., 2004). Ekstrak bunga Melastoma meiliki aktivitas antioksidan (Susanti, D., dkk., 2008). 2.2 2.2.1 Nikel Pada Tanaman Kebutuhan Nikel Nikel merupakan suatu mikronutrien yang dibutuhkan oleh tanaman, dan dapat ditemukan pada bagian-bagian tanaman. Secara alami, Ni dapat ditemukan pada jaringan tanaman sebesar 1-10 mg/Kg berat kering (Assuncao, dkk., 2003). 6 Konsentrasi Ni yang rendah pada jaringan tanaman menyebabkan pertumbuhan tanaman menjadi lebih baik. Hal ini disebabkan karena logam Ni merupakan aktivator beberapa enzim pada tanaman, seperti hidrogenase, urease, asetil-Skoenzim A sintase, peptide deformilase, karbon monoksida dehidrogenase, dan glioksalase I (Mulrooney and Hausinger, 2003). Kebutuhan Ni oleh tanaman telah diteliti oleh Gerendas dan Satlelmacher (1999) bahwa menambahan Ni berhubungan dengan peningkatan produksi urea pada tanaman, tetapi reduksi secara signifikan aktivitas urea pada daun dan akar tanaman akan terjadi apabila tanaman mengalami defisiensi logam Ni. Logam Ni juga dibutuhkan pada simbiosis tanaman dan mikroba pemfiksasi Nitrogen. Mikroba memerlukan Ni pada proses fiksasi nitrogen (N2) untuk menghasilkan senyawa nitrogen yang dibutuhkan oleh tanaman. Logam ini mempengaruhi secara langsung fiksasi nitrogen (Zobiole, dkk., 2010), sehingga defisiensi logam Ni dapat menyebabkan berkurangnya fiksasi nitrogen oleh mikroba. Tanaman mengakumulasi logam memiliki tujuan tertentu. Logam yang diakumulasi tersebut (misalnya Ni) dapat berfungsi sebagai elemen pertanahan, misalnya dari patogen dan herbivora (Boyd, 2004). Penelitian tentang pertahanan tanaman akibat akumulasi logam Ni telah dilakukan terhadap spesies Alyssum, seperti Alyssum murale dan Alyssum serpyllifolium sp. lusitanicum mudah terinfeksi oleh Phytium ultimum ketika ditumbuhkan pada media dengan konsentrasi Ni yang rendah (Ghaderian, dkk., 2000), tetapi spesies Alyssum yang ditanam pada media dengan konsentrasi Ni tinggi menyebabkan tanaman tidak terserang jamur. Hal ini bisa disebabkan karena Ni sendiri toksik terhadap hama, 7 atau menurut Graham dan Webb (1991) hal ini disebabkan karena senyawan Ni yang toksik terhadap hama. Sebagai contoh, garam-garam Ni sangat efektif sebagai fungisida. 2.2.2 Toksisitas Nikel Kehadiran logam berat, termasuk Ni, berakibat toksik bagi sebagian besar tanaman. Penelitian tentang toksisitas Ni pada tanaman telah banyak dilakukan, sebagai contoh kehadiran Ni mengakibatkan defisiensi beberapa mikronutrien, atau mikronutrien divalent yang dibutuhkan oleh tanaman berkompetisi dengan Ni. Tingginya konsentrasi Ni menyebabkan berkuarangnya biomassa akar dan daun. Konsentrasi Ni yang tinggi menyebabkan penurunan konsentrasi Ca, Mn, dan Fe, selain itu, N, K, Zn, dan Cu juga berkurang seiring bertambahnya konsentrasi Ni (Ahmad, dkk., 2011). Gejala toksisitas logam Ni ditunjukkan oleh jagung (Zea mays) berdasarkan pertumbuhannya. Kehadiran logam ini di dalam media tanam dapat mengurangi laju pertumbuhan tanamannya. Laju pertumbuhan terganggu secara signifikan pada konsentrasi Ni dalam tanah sebesar 100 mg/Kg (100 ppm). Dengan konsentrasi tersebut, biomassa tanaman ini, khususnya daun dan akar berkurang secara signifikan, yaitu masing-masing 41.9 % dan 29.3% (Wang, H., dkk., 2009). Toksisitas Ni juga ditunjukkan oleh Hordeum vulgare L. (Molas, J., 2004). Tanaman ini dapat hidup pada tanah yang terkontaminasi senyawaan logam Ni, baik bentuk Ni-organik maupun Ni-anorganik. Analisis toksisitas Ni diamati 8 dengan melihat struktur sel penyusun akar dan daun. Adanya logam Ni menyebabkan sel-sel penyusun akar dan daun mengalami kelainan. 2.2.3 Konsentrasi Nikel (Ni) Dalam Jaringan Berdasarkan konsentrasi logam di dalam jaringannya, tanaman dibedakan atas tiga jenis, yaitu Exluder, Indikator, dan Hiperakumulator. 2.2.3.1 Excluder Tanaman-tanaman yang termasuk dalam kategori ini adalah tanaman yang mampu mencegah logam masuk ke dalam jaringannya. Tanaman ini dapat mengeluarkan senyawa tertentu, yang disebut senyawa fitokelatin, yang akan bereaksi dengan logam di dalam tanah. Setelah bereaksi dengan senyawa tersebut, logam akan menjadi lebih stabil dan susah untuk masuk ke dalam jaringan tanaman. Mekanisme ini membuat konsentrasi logam di dalam tanah yang berada di sekitar akar akan relatif konstan (Cuningham, 1995). Selain itu, tanaman juga dapat beradaptasi dengan logam dalam tanah dengan cara mengubah permeabilitas membran sel akarnya sehingga logam akan sulit masuk. Adaptasi lain dari tanaman adalah dengan mengubah kapasitas dinding sel akar dalam mengikat logam (Cuningham, S., 1995). Proses ini akan menghalangi logam untuk naik ke jaringan tanaman yang berada di atas tanah, sehingga konsentrasi logam pada akar akan relatif jauh lebih tinggi dibandingkan pada batang dan daun. Tanaman jenis ini cocok digunakan pada metode fitostabilisasi. 9 2.2.3.2 Indikator Tanaman kategori ini adalah tanaman yang mengakumulasi logam pada jaringan tanaman yang terdapat di atas permukaan tanah. Konsentrasi logam pada jaringan tanaman ini dipengaruhi oleh konsentrasi logam di dalam tanah. Jika konsentrasi logam dalam tanah rendah, maka konsentrasi logam dalam jaringan tanaman juga rendah. Konsentrasi logam dalam jaringannya akan meningkat seiring dengan meningkatnya konsentrasi logam dalam tanaman. Perubahan konsentrasi ini menggambarkan konsentrasi logam dalam tanah (Cunningham, S., dan Ow, D.W., 1996). Untuk mencegah toksisitas logam dalam jaringan, tanaman memproduksi senyawa intraseluler untuk mengikat logam. Selain berfungsi untuk mengurangi toksisitas logam, senyawa ini berfungsi sebagai senyawa transport sehingga logam lebih mudah didistribusikan di dalam jaringan tanaman. Logam kemudian dilokalisasi pada bagian tertentu yang tidak atau kurang sensitif (Cunningham, S., dan Ow, D.W., 1996). 2.2.3.3 Hiperakumulator Tanaman hiperakumulator adalah tanaman yang dapat mengakumulasi logam dengan konsentrasi yang sangat tinggi. Tanaman ini mengakumulasi logam pada bagian tanaman yang terdapat di atas permukaan tanah jauh lebih tinggi dari pada di dalam akar. Chaney, dkk (1997) memberikan tiga persyaratan suatu tanaman dikatakan tanaman hiperakumulator, yaitu: Toleran terhadap konsentrasi logam yang tinggi pada tanah, sehingga pertumbuhan tanaman relatif tidak terganggu; mampu menyerap logam dari dalam tanah dengan sangat cepat, serta 10 mentranslokasikannya dengan cepat pula ke jaringannya; dan menghasilkan biomassa yang tinggi pada waktu yang relatif cepat (tumbuh dengan cepat). Terdapat batasan penyerapan logam oleh tumbuhan agar dikatakan sebagai tanaman hiperakumulator. Batasan tersebut berbeda-beda sesuai dengan jenis logam yang di absorbsinya (Baker dan Brooks 1999). Untuk Kadmium, konsentrasi setinggi 0,01% (100 mg/Kg BK) dianggap sebagai hiperakumulator. Kobalt, Tembaga, dan Timbal konsentrasi 0,1% (1.000 mg/Kg BK) dan 1% (10.000 mg/Kg BK) untuk Seng dan Mangan. Untuk logam Ni, tanaman dikatan hiperakumulator jika konsentrasi Ni dalam jaringannya 0,2% (2.000 mg/Kg BK) (Priyanto dan Priyanto, 2007). Gambar 2. Penggolongan tanaman berdasarkan konsentrasi logam dalam jaringan (Ghosh & Singh, 2005) 2.3 Mekanisme Penyerapan Nikel (Ni) Oleh Tanaman Pencemaran lingkungan oleh logam Ni disebabkan oleh beberapa faktor: (1) limbah pabrik pengolahan logam, dan pembakaran bahan bakar cair; (2) irigasi dengan air yang mengandung logam berat; (3) erosi lahan bekas pertambangan; 11 dan (4) penggunaan pestisida. Konsentrasi Ni dalam tanah akibat pencemaran berkisar antara 2 ppm sampai 750 ppm. Jalur utama extraksi Ni dari dalam tanah oleh tumbuhan adalah melalui penyerapan oleh akar. Namun sebagian dari logam di dalam tanah terikat dengan senyawa organik, sehingga tidak dapat diserap oleh tanaman. Logam Ni diserap oleh tanaman melalui transport aktif dan difusi pasif. Perbandingan antara logam yang ditransport aktif dan difusi pasif tergantung pada konsentrasi Ni di dalam tanah. Difusi pasif akan meningkat dengan meningkatnya konsentrasi Ni pada tanah. Ketika diserap oleh akar, Ni berkompetisi dengan dengan logam yang lain, sebagai contoh, logam Ni dan Zn (Seregin dan Kozhevnikova, 2006). 2.3.1 Penyerapan Pada Akar Tanaman dapat menyerap Ni2+, NiSO4, dan kompleks sederhana NiOH+. Ni dapat membentuk kompleks dengan senyawa organik, seperti asam organik yang dapat meningkatkan desorbsi atau disolusi Ni dalam tanah. Berdasarkan solubilitasnya, Ni dalam tanah dibedakan atas Ni tersedia, potensial tersedia, dan tidak tersedia. Ni tersedia adalah Ni yang terlarut di dalam air, potensial tersedia adalah Ni yang membentuk kompleks dengan senyawa organik, dan Ni tidak tersedia adalah Ni yang tidak terlarut, termasuk Ni oksida. Secara umum, terdapat dua proses pengambilan Ni oleh akar tanaman, yaitu bioaktivasi dan absorbsi pada akar (He, S., dkk., 2012). 2.3.1.1 Bioaktivasi Nikel Sebelum menyerap Ni ke dalam akar, tanaman terlebih dahulu melakukan treatment terhadap logam Ni di dalam tanah. Tanaman menegeluarkan senyawa 12 tertentu (exsudat) untuk mengkelat Ni. Senyawa-senyawa tersebut adalah asam organik seperti asam malonat dan asam oksalat, fotosiderosfor yang merupakan senyawa pengkelat logam, serta enzim. Senyawa-senyawa ini secara bersamasama merupakan faktor utama yang mempengaruhi penyerapan logam Ni ke dalam akar (He, S., dkk., 2012). Selain bioaktivasi dilakukan oleh tanaman itu sendiri, bioaktivasi dapat juga dibantu dengan mikroorganisme. Mikroorganisme yang digunakan adalah mikroorganisme yang resisten terhadap Ni. Sebagai contoh, konsentrasi Ni pada akar meningkat dari 2,2 mg/Kg menjadi 2,6 mg/Kg dengan menginokulasikan Microbacterium arabinogalactanolyticum ke dalam media tanah. Hal ini dapat terjadi karena mikroorganisme tersebut dapat merubah Ni tidak tersedia menjadi Ni potensial tersedia. Selain itu, Sychrobacter sp., Bacillus cereus, Pseudomonas sp., Bacillus megaterium, Phyllobacterium brassicacearum, R. leguminosarum bv. viciae, Mesorhizobium loti. Selain membantu dalam penyerapan Ni, mikroorganisme tersebut dapat membantu tanaman melawan toksisitas Ni, sehingga meningkatkan pertumbuhan tanaman (He, S., dkk., 2012). 2.3.1.2 Absorbsi Akar Membran plasma pada sel-sel penyusun akar merupakan pintu masuk bagi logam Ni pada tanaman. Senyawa yang berperan pada proses masuknya Ni ke dalam akan adalah enzim membran plasma, yaitu H+-ATPase. Aktivitas enzim ini menyebabkan terjadinya gradien proton elektrokimia (H+). Perbedaan gradien ini menyebabkan penyerapan nutrisi bagi tanaman dan mengasimilasikannya ke dalam xylem dan floem, termasuk di dalamya logam Ni. Aktivitas ATPase 13 membran plasma bergantung pada konsentrasi logam Ni di dalam tanah (He, S., dkk., 2012). Untuk masuk ke dalam xylem, Ni pertama-tama harus melewati membran, kemungkinan Ni masuk melewati kanel atau pompa membran, yang disebut Symplast transport. Plama permeabel mengontrol lalu-lintas Ni melalui kanel spesifik ion atau senyawa pembawa ion logam. Pada proses ini, Ni berkompetisi dengan mineral-mineral yang lain yang juga di serap oleh tanaman (He, S., dkk., 2012). 2.3.2 Pembawa Nikel Logam Ni tidak begitu saja ditransportasikan pada jaringan tanaman. Untuk mentransportasikan logam, diperlukan senyawa-senyawa pembawa. Senyawa-senyawa ini akan bereaksi dengan Ni, kemudian ditransportasikan di dalam jaringan. Secara umum terdapat dua kelompok besar senyawa pembawa Ni, yaitu asam organik dan protein. 2.3.2.1 Asam Organik Sampai saat ini, asam-asam organik dianggap sebagai salah satu transporter bagi logam Ni di dalam jaringan tumbuhan. Namun, dari semua asam organik yang dapat diproduksi oleh tanaman, asam sitrat merupakan pembawa Ni yang paling dominan. Pada tanaman Stackhousia tryoni (Celastraceae) yang merupakan tanaman hiperakumulator terhadap Ni, pada jaringan xilemnya ditemukan Ni dalam bentuk senyawa dengan sitrat. Selain itu, pada lateks tanaman S. acuminate, hampir semua Ni ditemukan dalam bentuk senyawaan dengan asam sitrat dan asam-asam organik yang lain. Sama halnya dengan Ni 14 yang ditemukan pada tanaman Alyssum bertolonii, Ni membentuk senyawa dengan asam sitrat (He, S., dkk., 2012). Asam-asam organik lain yang juga merupakan pembawa logam berat dalam jaringan tanaman adalah asam amino bebas, seperti histidin dan nikotinamin yang dapat membentuk kompleks yang stabil dengan ion logam. Namun khusus untuk Ni, histidin merupakan yang paling dominan sebagai pembawa. Senyawa Ni ditemukan dalam bentuk kompleks dengan histidin pada tanaman hiperakumulator Ni, seperti Alyssum montanum, A. lesbiacum, A. lesbiacum, A. montanum, Brassicaceae. Pada tanaman-tanaman tersebut, ditemukan trend bahwa aktivitas histidin meningkat seiring dengan meningkatnya konsentrasi Ni pada tanah (He, S., dkk., 2012). 2.3.2.2 Protein Transport Protein transport merupakan salah satu senyawa pembawa logam di dalam jaringan tanaman. Senyawa protein yang khusus untuk mentransport Ni sampai saat ini belum di ketahui, namun Ni dapat ditransport oleh protein-protein yang mentransport logam yang lain. Protein yang mempengaruhi transportasi Ni dalam jaringan tanaman, diantaranya ZIP, NRAMP yang diisolasi dari Thlaspi japonicum. Kedua protein ini berfungsi untuk melindungi tanaman dari toksisitas logam Ni (He, S., dkk., 2012). Selain itu, terdapat juga TjZNT1 and TjZNT2, yang merupkan rantai panjang yang mengandung banyak histidin. Histidin yang terdapat pada rantai tersebut merupakan bagian yang aktif terhadap Ni, di mana bagian tersebut dapat berikatan kuat dengan Ni (He, S., dkk., 2012). Aktifitas senyawa ini berbanding 15 lurus dengan konsentrasi Ni yang diberikan pada tanaman tersebut. Selain dapat mentransportasikan Ni, kedua transporter ini juga diketahui memiliki peranan penting dalam transportasi Mn, Zn, dan Cd (He, S., dkk., 2012). 2.3.3 Distribusi/Detoksifikasi 2.3.3.1 Distribusi Kemampuan suatu tanaman untuk mentolerasi dan mengakumulasi logam berat, misalnya Ni, memberikan keuntungan tersendiri secara ekologi bagi tanaman tersebut. Logam yang telah di akumulasi tersebut dapat digunakan sebagai alat pertahanan. Tanaman dengan konsentrasi Ni yang tinggi pada batang dan daunnya, merupakan pelindung yang efektif dari serangga. Olehnya itu, tanaman hiperakumulator mendistribusikan logam dengan konsentrasi yang lebih tinggi pada jaringannya yang berada di atas tanah (batang dan daun) daripada bagian yang berada di dalam tanah (akar) (He, S., dkk., 2012). Tanaman seperti Alyssum murale mendistribusikan logam pada akar sebesar 1260 mg/Kg, 1170 mg/Kg pada batang, dan 11.400 mg/Kg pada bijinya. Sedangkan konsentrasi Ni pada pada daun tanaman ini meningkat pada saat proses pembentukan bunga. Tanaman S. coronatus juga menunjukkan hal serupa, dengan konsentrasi Ni tertinggi berada pada daunnya. Salix viminalis juga menunjukkan hal yang sama, dan konsentrasi Ni di dalam jaringannya batangnya bertambah besar dengan bertambahnya ketinggian batang. Selain itu, Berkheya coddii, S. coronatus, Stackhousia tryonii, A. bertolonii Desv, L. emarginata, dan T. gosingense yang merupakan tanaman hiperakumulator terhadap Ni, menunjukkan 16 pola yang sama pada sebaran konsentrasi Ni dalam jaringannya (He, S., dkk., 2012). 2.3.3.2 Detoksifikasi Efisiensi tanaman dalam mendetoksifikasi logam merupakan kunci utama tanaman tersebut dapat menyimpan logam dalam jumlah yang besar. Mekanisme detoksifikasi logam pada tanaman yaitu mendistribusikan logam pada bagian tertentu di dalam sel yang kehadirannya tidak akan menggagngu proses selular seperti fotosintesis. Logam terlebih dahulu dikomplekskan, kemudian dipindahkan dari bagian aktif sitoplasma ke bagian sel yang tidak aktif pada proses seluler, seperti dinding sel dan vakuola. Pada daun, logam disimpan pada apoplas atau selsel epidermis, seperti yang terjadi pada tanaman hiperakumulator terhadap Ni, Hybanthus floribundus (He, S., dkk., 2012). Kemampuan detoksifikasi ini menyebabkan tanaman memiliki toleransi yang tinggi terhadap logam Ni. Sebagian besar tanaman hiperakumulator Ni, menyimpan Ni dengan konsentrasi paling besar berada di daun, kemudian batang, dan yang paling rendah pada akar. Besar kecilnya konsentrasi Ni pada daun, tergantung pada mekanisme transport xylem. Jika kapasitas tukar kation pada xylem baik, maka Ni akan mudah ditransportasikan menuju daun, akan tetapi kapasitas tukar kation pada xylem tanaman tertentu, seperti D. innoxia, menyebabkan konsentrasi Ni di daun jauh lebih kecil daripada di akar (He, S., dkk., 2012). 17 2.3.3.3 Penyimpanan Vakuolar Kapasitas penyimpanan vacuolar berperan penting dalam imobilisasi dan homeostatis logam pada tumbuhan. Vakuola merupakan tempat penyimpanan logam utama pada tumbuhan, senyawa-senyawa fitokelatin di mobilisasi ke vakuola untuk mentreatment logam. Dengan demikian, perbedaan antara tanaman hiperakumulator dan tanaman yang tidak hiperakumulator terletak pada kemampuan penyimpanan di vakuola, serta kemampuan detoksifikasi biokimia di vakuola (He, S., dkk., 2012). Penyimpanan logam di dalam vacuole melibatkan transport aktif pada tonoplas yang diaktivasi oleh ATP. Dalam rangka membawa logam ke vakuola, tonoplas melintasi sitosol melawan gradient elektrokimianya. Lintasan gradient elektrokimia tonoplas di tentukan oleh dua pompa proton, yaitu proton transport ATPase Vacuolar (V-ATPase) dan piropospatase translokasi proton vakuola (VPPase) (He, S., dkk., 2012). 2.4 Pertumbuhan Tanaman dan Akumulasi Logam Lambers dan Poorter (1992) merumuskan beberapa perhitungan untuk menganalisis pertumbuhan tanaman, yaitu sebagai berikut : Laju Pertumbuhan Relatif (LPR) diameter dan tinggi tanaman : (1) (D1 dan D2 adalah diameter awal dan akhir, T1 dan T2 adalah waktu awal dan akhir pengamatan.) Rasio Berat Daun (RBD): (2) 18 Rasio Berat Akar (RBA): (3) Panjang akar Spesifik (PAS): (4) Rasio Berat Batang (RBB): (5) Agoramoorthy, dkk (2005) juga mengajukan rumus untuk menghitung perbandingan konsentrasi logam yang terdapat dalam jaringan tanaman dengan konsentrasi logam yang terdapat dalam media, yang disebut Biological Concentration Factor (BCF). (6) (CB adalah konsentrasi total logam pada tanaman, dan CS adalah konsentrasi logam dalam tanah). dan Translocation Factor (TF) yang digunakan untuk menghitung potensi mobilitas logam dari akar ke batang dan dari akar ke daun. (7) (8) Cs adalah konsentrasi logam pada batang, Cl adalah konsentrasi logam pada daun, dan Cr adalah konsentrasi logam pada akar. 2.5 Metode Fitoremediasi Fitoremediasi merupakan penghilangan polutan baik yang terdapat pada tanah, maupun air menggunakan tanaman. Dengan metode ini, polutan di akumulasi, didegradasi, ditransformasi, atau diimobilisasi (Hdayati, 2005). Fitoremediasi merupakan solusi yang baik untuk mengatasi encemaran lingkukan, karena selain ramah lingkungan dan efektif, metode ini juga memerlukan biaya 19 yang sangat murah jika dibandingkan dengan pemulihan secara konvensional menggunakan bahan kimia (Ghosh, M., dan Singh, S.P., 2005). Metode fitoremediasi terdiri atas 6 jenis, yaitu Fitodegradasi, Fitovolatiliasi, Fitostabilisasi, Rizofiltrasi, Rizodegradasi, dan Fitoekstraksi. 2.5.1 Fitodegradasi Fitodegradasi adalah metabolisme kontaminan di dalam jaringan tumbuhan. Tanaman menyerap kontaminan kemudian diuraikan dengan proses biokimia pada tanaman. Organ tumbuhan menguraikan polutan yang diserap melalui proses metabolisme tumbuhan atau secara enzimatik. Spesies tumbuhan yang berpotensi digunakan adalah berbagai jenis rumput (Mangkoedihardjo, 2005). Seiring dengan perkembangannya, penggunaan selain jenis rumput telah banyak dilakukan. Tembakau transgenik dapat digunakan sebagai agen fitodegradasi untuk senyawa posporus. Tanaman ini dapat mengekstrak senyawa pospor dari media tanamnya, kemudian ditransformasi di dalam jaringannya. Hal ini tunjukkan dengan berkurangnya senyawa organopospor yang terdapat di dalam media, namun senyawa tersebut hanya sedikit terdapat di dalam jaringan tanaman (Wang, X., 2008). Selain itu, Kagalkar, A,N., dkk (2011) telah melakukan penelitian kemampuan fitodegradasi tanaman Phaseolous mungo dan Triticum aestivum yang diasosiasikan dengan sel inokulasi Bulmea malcolmii. Teknik tersebut meningkatkan kemampuan fitodegradasi terhadap zat warna Malactic Green, hal ini ditunjukkan dengan meningkatnya kecepatan decolorisasi. Selain itu, tanaman Scirpus grossus yang diasosiasikan dengan rizobakteri dapat mendegradasi petroleum hidrokarbon sampai 81,5% setelah 72 hari (Al- 20 Baldawi, IA., dkk., 2015). Tanaman Miskantus digunakan pada proses fitodegradasi senyawa organik yang diasosiasikan dengan rizobakteri. Tanaman ini menyediakan nutrisi dan oksigen untuk rizobakteri (Megharaj, dkk., 2011). F. arundinacea, B. campestris, dan H. anuus yang diasosiasikan dengan asam humat, dapat mendegradasi petroleum hidrokarbon masing-masing 45%, 54%, dan 66% (Park, S., dkk., 2011). Gambar 3. Fitodegradasi (Mangkudiharjo, 2005) 2.5.2 Fitovolatilisasi Fitovolatilisasi terjadi merupakan proses penyerapan kontaminan oleh tanaman, kemudian kontaminan tersebut di lepaskan ke udara. Penyerapan polutan oleh tumbuhan dan dikeluarkan dalam bentuk uap cair ke atmosfer. Metode ini cocok digunakan untuk mengatasi kontaminasi senyawa-senyawa organik maupun anorganik (Mangkoedihardjo, 2005). Kontaminan dapat mengalami transformasi sebelum lepas ke atmosfer, misalnya Hg(II) yang toksik direduksi menjadi Hg yang relatif tidak toksik (Alder, 1996). 21 Metode Fitovolatilisasi untuk senyawa anorganik digunakan untuk menghilangkan kontaminan logam yang volatil. Metode fitovolatilisasi senyawa anorganik umumnya dilakukan terhadap senyawa-senyawa Merkuri (Hg). Nicotiana tabacum dan Arabidopsis thaliana dapat mereduksi ion merkuri (Hg(II)) menjadi Hg, kemudian menguapkannya ke udara (Terry dan Bubuelos., 2000). Hal serupa juga terjadi pada tanaman Liriodendron tulipifera (Rugh, dkk., 1998) dan Brassica napus (Bañuelos, dkk., 1997) ketika di tanam pada media yang terkontaminasi ion merkuri. Gambar 4. Fitovolatilisasi (Mangkudiharjo, 2005) Fitovolatilisasi juga terjadi pada kontaminan senyawa organik. Burken dan Schnoor (1999) telah meneliti fitovolatilisasi kontaminan senyawa organik seperti trikloroetilwn (TEC), benzena, toluena, etilbenzena, dan ksilena pada media hidroponik. Kontaminan tersebut berkurang sebanyak 98% - 99% setelah memasuki tahun kedua pertumbuhan tanaman, dengan konsentrasi mula-mula 50 ppm. Fitovolatilisasi sangat sulit diamati untuk senyawa organik, karena proses 22 yang terjadi pada jaringan tanaman sangat mirip dengan rizodegradasi dan fitodegradasi. 2.5.3 Fitostabilisasi Fitostabilisasi adalah suatu proses imobilisasi kontaminan pada daerah akar oleh senyawa tertentu yang dikeluarkan tanaman. Akar tumbuhan melakukan imobilisasi polutan dengan cara mengakumulasi, mengadsorpsi pada permukaan akar dan mengendapkan presipitat polutan dalam zona akar. Proses ini secara tipikal digunakan untuk dekontaminasi zat-zat anorganik. Spesies tumbuhan yang biasa digunakan adalah berbagai jenis rumput, bunga matahari, dan kedelai (Mangkoedihardjo, 2005). Pada awalnya metode ini hanya menggunakan tanaman, namun saat ini fitostabilisasi dilakukan dengan menggabungkan antara tanaman dan mikroorganisme. Tanaman Juncus effusus L. dapat hidup baik pada media dengan konsentrasi Pb yang cukup tinggi. Pada konsentasi Pb 0,5 mM dalam media hidroponik, tanaman ini tidak menunjukkan gejala keracunan Pb. Sedangkan pada konsentrasi Pb 1 mM, walaupun bisa dikatakan hidup baik, terjadi penurunan biomassa akar dan daun. Namun dengan penambahan EDTA pada media tanamnya, menyebabkan tanaman ini dapat kembali normal jika dilihat pada biomassa akar dan daunnya. Logam Pb disimpan dalam akar lebih besar daripada bagian lain tanaman (Najeeb, U., 2014). Rajkumar, dkk (2013) telah meneliti potensial fitostabilisasi Ni terhadap tanaman B. juncea, L. cylindrica dan S. halepense yang diasosiasikan dengan Bacillus megaterium SR28C. Pada penelitian ini teramati tanaman mengeluarkan eksudat sebagai makanan B. megaterium, kemudian mikroba ini mengimobilisasi 23 logam Ni di dalam tanah. Psidium guajava dapat bertahan hidup pada media dengan konsentrasi Ni yang tinggi. Perubahan morfologi seperti penurunan biomassa akar dan daun terjadi pada konsentrasi 1000 M NiSO4. Tanaman ini cocok digunakan sebagai agen fitostabilisasi hanya mengakumulasi logam dalam jumlah sangat kecil dan dapat bertahan hidup pada konsentrasi Ni yang tinggi (Bazihizinaa, N., 2015). Gambar 5. Fitostabilisasi (Mangkudiharjo 2005) Potensial fitostabilisasi Solanum nigrum L. yang merupakan tanaman hiperakumulator terhadap Zn dan Cd telah dilakukan oleh Feras, P., dkk (2012). Tanaman ini tidak toleran terhadap logam Ni dilihat dari laju pertumbuhannya. Dengan adanya logam Ni dalam media tanam, tanaman ini mengalami pengurangan ukuran dan akar berturut-turut 33% dan 30%. Agropyron elongatum juga merupakan tanaman yang toleran terhadap Ni, toleransi terhadap Ni makin baik dengan penambahan CaO sebagai agen liming, sehingga asosasi tanaman ini 24 dengan liming cocok digunakan untuk meremediasi lahan terkontaminasi Ni melalui metode fitostabilisasi (Chen dan Wong., 2006). 2.5.4 Rizofiltrasi Rizofiltrasi adalah pemanfaatan kemampuan akar tumbuhan untuk mengendapkan, menyerap, dan mengakumulasi kontaminan dari linggkungan air. Akar tumbuhan mengadsorpsi atau presipitasi pada zona akar atau mengabsorpsi larutan polutan sekitar akar ke dalam akar spesies tumbuhan yang fungsional adalah rumput air seperti Cattail dan eceng gondok (Mangkoedihardjo, 2005). Metode ini digunakan untuk membersihkan lingkungan beair dari kontaminan larut air. Saat ini, berbagai tanaman telah diteliti kemampuannya untuk digunakan pada metode ini. Contamine Satbilized On or In root Tissue (C2) Plant Support Matrix Clarified Efluent Contaminated Groundwater Pump Contaminant (C) Hydroponic sistem Precipitated Contaminant (C1) Gambar 6. Rizofiltrasi Kultur serabut akar Brassica juncea dan Chenopodium aramanticolor telah digunakan oleh Eapen, S., dkk (2003) untuk menghilangkan kontaminasi uranium (U) pada lingkungan air. Pada air yang terkontaminasi U, pertumbuhan akar tidak terganggu sampai konsentrasi 500 M. Kultur serabut akar B. juncea dapat menghilangkan kontaminasi U pada air sebesar 20-23%, sedangkan C. 25 amaranticolor dapat menghilangkan U hingga 13%. Selain itu, Phaseolus vulgaris L. var. vulgaris merupakan tanaman potensial untuk rizofiltrasi (U) dan Cesium (Cs). Konsentrasi U dan Cs pada akar maupun daun tanaman ini berbanding lurus dengan konsentrasi logam-logam tersebut pada media (konsentrasi 100 g/L – 700 g/L). Tanaman ini dapat mengakumulasi U sampai 6,53 g/g pada daun dan 1019,01 g/g pada akar, sedangkan untuk Cs 60,38 g/g pada daun dan 1174,73 g/g berat kering. Tanaman ini dapat mereduksi konsentrasi U dalam air sampai 98,9% (Yang, M., 2015). Penelitian serupa dilakukan oleh Lee dan Yang (2010) terhadap potensial rizofiltrasi U Helianthus annuus L. dan Phaseolus vulgaris L. var. vulgaris. Selama 24 rizofiltrasi, Helianthus annuus L. dapat menurunkan konsentrasi U sampai 97% media dengan konsentrasi U yang sangat tinggi (543 g/L). Phaseolus vulgaris L., Var. vulgaris juga memiliki kapabilitas yang besar untuk meremediasi air terkontaminasi U. Hal ini ditunjukkan dengan berkurangnya konsentrasi U sampai 80% dari konsentrasi awal 116 g/L. Namun, kemampuan itu menurun ketika konsentrasi di atas 300 g/L, yang penurunannya hanya mencapai 60%. Tome, V., dkk (2008) juga melakukan penelitian tentang kemampuan Helianthus annuus L. menghilangkan kontaminasi U dan Radium 226 (226Ra). Tanaman ini hanya membutuhkan dua hari untuk menurunkan kadar kontaminasi U dan 226 Ra. Selama waktu itu, selama 50% U dan 70% 226 Ra, dan sisanya terpresipitasi, serta hanya sedikit sekali konsentrasi ditemukan pada daun dan larutan. 26 2.5.5 Rizodegradasi Polutan diuraikan oleh mikroba dalam tanah, yang diperkuat/sinergis oleh zat-zat keluaran akar tumbuhan (eksudat) yaitu gula, alkohol, asam. Eksudat yang dikeluarkan oleh tumbuhan merupakan makanan dari mikroorganisme tanah. Pada proses hidupnya, mikroorganisme tanah tersebut akan mendegradasi kontaminan dalam tanah. Proses ini sangat tepat digunakan pada proses dekontaminasi senyawa-senyawa organik di dalam tanah (Mangkoedihardjo, 2005). Gambar 7. Rizodegradasi (Mangkudiharjo, 2005) Salah satu tanaman yang dapat digunakan sebagai agen rizodegradasi adalah Sealavander (L. bicolor Kuntze). Tanaman ini dapat bekerja sama dengan mikroorganisme untuk mendegradasi Total Petroleum Hidrokarbon (TPH). Kerjasama tanaman ini dengan mikroorganisme dapat mendegradasi TPH sampai 40% selama 90 hari (Wang, Z., dkk., 2011). Selain itu, Lu dkk (2011) melakukan penelitian rizodegradasi penantren dan piren pada sedimen menggunakan tanaman mangrov (Kandelia candel (L.) Druce). Setelah 60 hari ditumbuhkan pada 27 sedimen terkontaminasi kedua senyawa tersebut dengan konsentrasi masingmasing 10 mg/Kg, tanaman ini telah mendegradasi sebanyak 47,7 % untuk penantren dan 36,7% untuk piren. Potensial rizodegradasi juga telah diamati pada tanaman Sesbania cannabina terhadap TPH. Hasil penelitian menunjukkan bahwa tanaman ini merupakan tanaman yang cepat mendegradasi TPH pada media tanamnya. Hanya dalam waktu 90 hari, tanaman ini dapat mereduksi konsentrasi TPH pada media dari 2.500 mg/Kg menjadi hanya 679 mg/Kg (Maqbool, F., dkk., 2012). 2.5.6 Fitoekstraksi Fitoekstraksi merupakan proses penyerapan kontaminan oleh tanaman melalui akar, kemudian ditranslokasikan ke seluruh bagian tanaman. Akar tumbuhan menyerap polutan dan selanjutnya ditranslokasi ke dalam organ tumbuhan. Proses ini adalah cocok digunakan untuk dekontaminasi zat-zat anorganik (Mangkoedihardjo, 2005). Pada metode ini, tumbuhan yang digunakan adalah tanaman hiperakumulator, yaitu tanaman yang mampu menyerap kontaminan dan menyimpannya dalam jaringan dengan konsentrasi yang sangat tinggi. Penelitian tentang kemampuan fitoektraksi terhadap Ni telah banyak di lakukan. Salah jenis tanaman yang merupakan tanaman hiperakumulator Ni adalah spesies-spesies Alyssum. Menurut Seregin dan Kozhevnikova (2006) 48 spesies Alyssum dapat mengakumulasi Ni maksimal sebesar 1.280–29.400 mg/Kg berat keringnya. Alyssum discolor dapat mengakumulasi Ni sebesar 34,7 mg/g berat keringnya (Bayramoglu, dkk., 2012). Alyssum murale dapat mengakumulasi Ni sebesar 1260 mg/Kg pada akar dan 1170 mg/Kg pada batang (Barbaroux, dkk., 28 2009). Ghaderian dkk (2007) melakukan penelitian terhadap spesies Alyssum yang hidup secara alami di Iran, mereka menemukan bahwa A. baumgartnerianum Bornm dapat mengakumulasi Ni 55-65 mg/Kg, A. bracteatum Boiss 245-1250 mg/Kg, A. bracteatum 710-2300, A. desertorum Stapf 76-83 mg/Kg, A. meniocoides Boiss 90 mg/Kg, A. simplex Rudolphi 80-90 mg/Kg, A. stapfii Vierh 60-70, dan A. strictum Willd 70-75 mg/Kg. Alyssum bertolonii dapat mengakumulasi Ni sampai 21.154,4 mg/Kg (Galardi, dkk., 2007), Alyssum serpyllifolium sp. dapat mengakumulasi Ni 187 mg/Kg (Kidd dan Monterroso, 2005). Impacted Soil Plant Uptake Soil Being Remediated Contaminant Gambar 8. Fitoekstraksi (Mangkudiharjo, 2005) 29 BAB 3V. KERANGKA BERPIKIR DAN HIPOTESIS 3.1 Kerangka Berpikir Nikel adalah salah satu logam yang paling penting dan memiliki banyak aplikasi dalam industri. Menurut data dari kementerian ESDM tahun 2013, Potensi Nikel di Sulawesi tenggara diperkirakan luas penyebarannya 480.000,12 Ha dengan cadangan deposit hipotetik sebesar 97.401.593.025,72 Ton yang tersebar di Kabupaten Kolaka, Kolaka Utara, Konawe Utara, Konawe Selatan, Bombana, Konawe, Buton dan Kota bau-bau. Oleh sebab itu, sektor pertambangan Nikel merupakan sektor yang berkembang di daerah Sulawesi Tenggara, hal ini dibuktikan dengan dibangunnya 11 smelter pengolahan Nikel di Sulawesi Tenggara. Proses penambangan nikel meninggalkan lahan gundul yang terbuka. Hal ini menyebabkan lahn tersebut kehilangan flora dan fauna serta fungsi hutan sebagai penyerap dan sumber persediaan air tanah menjadi hilang. Selain itu, lahan tersebut masih memiliki kandungan Ni yang tinggi sehingga jika terjadi erosi oleh air hujan, maka Ni akan mencemari daerah lain di sekitar areal tersebut. Tanah yang labil juga mengakibatkan areal tersebut menjadi rawan longsor. Dari uraian di atas, maka perlu dilakukan penanganan terhadap lahan bekas pertambangan. Salah satu metode yang dapat digunakan untuk mengangani hal tersebut adalah dengan metode fitoremediasi. Dimana metode ini menggunakan tanaman tanaman untuk mengembalikan atau memperbaiki kondisi suatu lahan tanah. 30 Penanganan lahan Terkontaminasi Ni Metode Fitoremediasi Tnaman Hipertoleran/Hiperakumulator Melastoma malabathricum 3.2 Hipotesis Berdasarkan rumusan masalah, maka dapat diambil hipotesis bahwa pertumbuhan tanaman Melastoma malabathricum akan dipengaruhi oleh konsentrasi Nikel didalam media tanam. Selain itu penyerapan Nikel oleh tanaman Melastoma malabathricum juga akan dipengaruhi oleh besarnya konsentrasi Nikel di dalam media tanam. 31 4 METODOLOGI PENELITIAN BAB IV. 4.1 Waktu dan Tempat Penelitian Penelitian ini dilaksanakan pada bulan Juli 2016 sampai Januari 2017 di Laboratorium Kimia Anorganik Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Halu Oleo Kendari, Sulawesi Tenggara. 4.2 Alat dan Bahan 4.2.1 Alat Alat yang digunakan pada penelitian ini yaitu oven, desikator, tanur, labu takar 500 mL, 250 mL, 100 mL, dan 10 mL, gelas kimia 500 mL, 250 mL, 100 mL, dan 50 mL, timbangan analitik, pipet ukur 25 mL, pipet volume 10 mL, 25 mL, 50 mL, dan 100 mL, Hot plate, lemari asam, filler, cawan porselin. 4.2.2 Bahan Bahan yang akan digunakan pada penelitian ini yaitu Nikel(II)Sulfat heksahidrat ((NiSO4).6H2O), Asan Nitrat (HNO3), Kalium dikromat (K2Cr2O7), aquadest. 32 4.3 Prosedur Penelitian 4.3.1 Pembuatan Media Pembibitan Sebanyak 5 Kg tanah yang akan digunakan sebagai media pembibitan dibersihkan dari batu dan akar-akar, kemudian dicampur dengan pupuk kandang dan daun-daun kering yang telah dihancurkan dengan perbandingan volume 1:1:1. 4.3.2 Pembibitan Untuk bunga, benih ditabur pada media pembibitan, kemudian disiram dengan air, Setelah tanaman agak besar kira-kira berumur 2 minggu, tanaman siap dipindahkan ke polybag eksperimen. Untuk pohon, tanaman yang terpilih ditumbuhkan pada polybag, kemudian disiram dengan air, setelah tanamannya sehat, maka tanaman telah siap dipindahkan ke polybag eksperimen. 4.3.3 Penentuan kadar Nikel Tanah Sebanyak 0,5 gram tanah di masukkan ke dalam gelas kimia dan ditambahkan berturut-turut 50 ml aquades, 10 ml HClO4 pekat, kemudian di tambahkan 3 ml H2SO4 lalu panaskan. Campuran kemudian akan disaring dengan kertas saring. Filtrat lalu diencerkan di dalam Labu takar 25 ml, kemudian ditentukan konsentrasi Nikelnya dengan AAS pada panjang gelombang 341,5 nm. 4.3.4 Pembuatan Larutan Nikel 4000 ppm Nikel(II)Sulfat Heksahidrat (NiSO4.6H2O) ditimbang sebanyak 18.8434 gram dengan timbangan analitik, kemudian dimasukkan kedalam labu takar 1000 mL dan diencerkan sampai tanda tera. 33 4.3.5 Pembuatan Tanah Terkontaminasi Nikel Tanah yang akan digunakan sebagai media ditimbang sebanyak 2 Kg, kemudian dicampurkan dengan larutan Nikel 4000 ppm sebanyak 50 mL untuk konsentrasi 100 ppm, 62,5 mL untuk konsentrasi 125 ppm, 75 mL untuk konsentrasi 150 ppm, 87,5 mL untuk konsentrasi 175 ppm, 100 mL untuk konsentrasi 200 ppm, 112,5 mL untuk konsentrasi 225 ppm, 125 mL untuk konsentrasi 250 ppm, 137,5 mL untuk konsentrasi 275 ppm, 150 mL untuk konsentrasi 300 ppm, 162,5 mL untuk konsentrasi 325, 175 mL untuk konsentrasi 350, 187,5 mL untuk konsentrasi 375, 200 mL untuk konsentrasi 400. 4.3.6 Penanaman Pada polybag eksperimen Tanaman yang telah siap kemudian dipindahkan ke dalam polybag eksperimen, tanaman ini kemudian disiram dengan air secukupnya, dan dilakukan pengukuran tinggi tanaman dan penghitungan jumlah daun setiap dua hari. 4.3.7 Pemanenan Tanaman dipanen setelah berumur 3 bulan, dan dipisahkan akar, batang, dan daunnya, kemudian dikeringkan di dalam oven pada suhu 105 0C selama 3 x 24 jam. 4.3.8 Penentuan Konsentrasi Nikel Pada Jaringan Sampel yang telah diabukan kemudian dilarutkan dengan 25 mL akuades, kemudian ditambahkan 5 mL larutan HNO3 pekat, larutan tersebut diuapkan sampai hampir kering, kemudian diencerkan sampai volumenya 25 mL dalam labu takar, kemudian ditentukan kadar Ni dengan menggunakan AAS pada 34 panjang gelombang 341,5 nm dan menggunakan sistem pembakar Nitrous oxideacetylene (The Perkin-Elmer Corporation, 1996). 4.3.9 Penentuan Bioconcentration Factor Tanaman yang telah tentukan konsentrasi Ni pada akar batang dan daunnya, kemudian dihitung konsentrasi total Ni dalam jaringan (gabungan konsentrasi Ni pada akar batang dan daun), kemudian dibagi dengan konsentrasi Ni pada media tanam. (CB konsentrasi total logam pada tanaman, CS konsentrasi logam dalam tanah). 4.3.10 Penentuan Translocation factor Potensi mobilitas logam Ni dari akar ke batang dan dari akar ke daun (Translocation Factor) dihitung dengan cara membagi konsentrasi Ni pada batang dan daun dengan konsentrasi Ni pada akar. dan (Cs konsentrasi logam pada batang, Cl konsentrasi logam pada daun, dan Cr konsentrasi logam pada akar). 4.3.11 Pengukuran Panjang Akar Panjang akar tanaman diukur menggunakan penggaris berskala cm, panjang akar diukur dari pangkal akar sampai ujung terpanjang dari akar tanaman. 35 4.3.12 Penentuan Luas Daun Daun melastoma dicetak pada kertas kingstrik (skala 200 GSM), kemudian kertasnya di timbang dan ditentukan luas daun dengan mengalikan berat kertas dengan skala kertas 4.3.13 nalisis Kemampuan Remediasi Logam Ni Oleh M. malabathricum. Konsentrasi Ni dalam jaringan tanaman tanaman dikalikan dengan biomassa yang tanaman sehingga diperoleh massa Ni yang terakumulasi pada setiap tanaman, kemudian dikali jumlah penanaman dalam satu tahun, dan dikali jumlah tanaman dalam satu hektar, asusmsi jarak tanam 0,5 m). 36 5 BAB V. 5.1 HASIL DAN PEMBAHASAN Pengaruh Logam Ni Terhadap Pertumbuhan Tanaman Secara umum, pertumbuhan didefinisikan sebagai proses pembelahan dan pemanjangan sel (Gardner, dkk., 1991). Pertumbuhan tanaman dalam arti terbatas menunjuk pada pertambahan ukuran yang tidak dapat balik yang dicerminkan oleh pertambahan bobot tanaman (Harjadi dan Setyati., 1988). Pertambahan bobot kering umumnya digunakan sebagai penunjuk ciri pertumbuhan karena pada umumnya hal tersebut mempunyai kepentingan ekonomi yang paling besar. Adapun parameter lain di antaranya adalah tinggi, volume, dan luas daun juga dapat digunakan untuk mendeteksi adanya pertumbuhan pada tanaman. Parameter lain yaitu bobot basah tidak banyak digunakan karena angkanya berfluktuasi (Gardner, 1991). Pertumbuhan tanaman dipengaruhi oleh faktor internal tanaman itu sendiri. Faktor-faktor tersebut adalah ketahanan tanaman terhadap ikim, kondisi tanah, laju fotosintesis, dan respirasi. Selain itu, kandungan pigmen seperti klorofil juga merupakan fator internal yang sangat penting dalam pertumbuhan tanaman. Kecepatan pertumbuhan tanaman tergantung juga pada kecepatan proses fotosintesis, dan kecepatan fotosintesis dipengaruhi oleh kandungan klorofil pada tanaman tersebut. Selain itu, pertumbuhan tanaman juga dipengaruhi oleh faktor eksternal, seperti iklim, cahaya, ketersediaan air, panjang hari, tektur tanah, pH, dan ketersediaan nutrisi berupa bahan organik. Selain itu, faktor biologis seperti mikroorganisme tanah dan hama merupakan bagian dari faktor ekternal (Tjitrosoepomo, G., 1999). Pada penelian ini, tanaman yang digunakan 37 merupakan tanaman yang sejenis dan memiliki umur yang relatif sama, sehingga diharapkan tidak ada perbedaan pada faktor internal yang mempengaruhi pertumbuhan tanaman. Selain itu, tanah yang digunakan diambil pada tempat yang sama, sehingga diharapkan memiliki struktur dan ketersediaan nutrisi yang sama. Volume air yang digunakan untuk penyiraman pada saat pengamatan relatif sama sehingga diharapkan faktor eksternal yang mempengaruhi pertumbuhan tanaman pada penelitian ini hanyalah perbedaan konsentrasi logan Ni pada tanah. Pengamatan pertumbuhan dilakukan selama 2 bulan menggunakan tanaman yang telah berumur 13 hari. Standar pertumbuhan tanaman yang diamati adalah pertambahan tinggi dan pertambahan daun yang dilakukan setiap 2 hari. Penyiraman dilakukan dua kali sehari yaitu pada pagi dan sore hari. Kemampuan bertahan hidup tanaman menggambarkan tingkat toleransi terhadap adanya lohgam Ni di dalam tanah. Selama siklus hidup, tumbuhan akan mengalami pertumbuhan dan perkembangan. Pertumbuhan merupakan penambahan bobot dan volume atau ukuran tumbuhan karena adanya penambahan unsur–unsur struktural yang baru. Pertumbuhan suatu organ atau tumbuhan secara keseluruhan dimulai dari perkecambahan biji dan dilanjutkan dengan memasuki fase pertumbuhan juvenile yang berakhir pada fase maturasi, selanjutnya diikuti dengan senesensi. Pola pertumbuhan suatu organ atau tumbuhan secara keseluruhan berupa pertumbuhan sigmoid, yaitu terjadinya pertumbuhan yang lambat pada fase inisiasi yang kemudian pada fase berikutnya pertumbuhan akan semakin cepat secara eksponensial.Selanjutnya pertumbuhan akan diperlambat dan akhirnya 38 akan mendekati konstan, sehingga akan membumbentuk kurva pertumbuhan yang menyerupai huruf “ S “ seperti gambar berikut : Gambar 9. Kurva sigmoid pertumbuhan tanaman Pertumbuhan pada tanaman mula-mula lambat, kemudian berangsurangsur lebih cepat sampai tercapai suatu maksimum, akhirnya laju tumbuh menurun. Apabila digambarkan dalam grafik, dalam waktu tertentu maka akan terbentuk kurva sigmoid. Menurut Franklin G.P. (1991), kurva sigmoid adalah pola pertumbuhan sepanjang suatu generasi secara khas dicirikan oleh suatu fungsi pertumbuhan. Bentuk kurva sigmoid untuk semua tanaman kurang lebih tetap, tetapi penyimpangan dapat terjadi sebagai akibat variasi-variasi di dalam lingkungan. Ukuran akhir, rupa dan bentuk tumbuhan ditentukan oleh kombinasi pengaruh faktor keturunan dan lingkungan (Tjitrosomo, 1999). Selain itu, umur daun juga dapat berpengaruh pada pertumbuhan tanaman karena terkait pada 39 tinggi rendahnya laju fotosintesis. Kemampuan daun untuk berfotosintesis meningkat pada awal perkembangan daun, tetapi kemudian mulai turun, terkadang sebelum daun tersebut berkembang penuh (Benyamin, L., 1995). Pada penelitian ini, pengamatan dilakukan pada fase pertumbuhan cepat tanaman M. malabathricum, sehingga pengaruh logam yang ditambahkan pada media dapat lebih mudah diamati. Pada penelitian ini, tanaman yang ditanam pada media terkontaminasi Ni adalah tanaman yang berumur 2 minggu (13 hari). 5.1.1 Pertambahan Jumlah Daun Pertambahan jumlah daun merupakan salah satu indikator yang dapat diamati dalam pengamatan pertumbuhan tanaman. Kecepatan pertambahan jumlah daun dapat digunakan untuk membedakan kesuburan tanaman. Semakin subur suatu tanaman, maka pertambahan jumlah daun akan semakin cepat. Pada penelitian ini telah dilakukan pengamatan terhadap pertambahan jumlah daun tanaman M. malabathricum seperti yang dapat dilihat pada gambar berikut : 10 Pertambahan Jumlah Daun 8 6 R² = 0,9336 4 2 0 0 25 50 75 100 125 150 175 200 225 250 275 300 325 350 375 400 -2 -4 Konsentrasi Ni (ppm) Gambar 10. Grafik pengaruh konsentrasi Ni pada media tanam terhadap rata-rataPertambahan jumlah daun 40 Berdasarkan data yang diperoleh, secara umum tanaman M. malabathricum dapat bertahan hidup pada tanah dengan konsentrasi Ni yang tinggi, hal ini dapat dilihat dengan adanya tanaman yang masih sanggup bertahan hidup sampai dengan konsentrasi Ni di dalam tanah sebesar 400 ppm. Berdasarkan grafik di atas, adanya logam Ni didalam tanah mempengaruhi laju pertumbuhan tanaman ini. Semakin tinggi konsentrasi Ni di dalam tanah, maka pertumbuhan tanaman makin terganggu yang dibuktikan dengan semakin berkurangnya pertambahan daun seiring bertambahnya konsentrasi Ni dalam tanah. Hal ini juga didukung oleh hasil analisis statistik Kruskal-Wallis dengan signifikansi 0,000. Nilai R2 yang mendekati 1 menunjukkan bahwa laju pertumbuhan tanaman sangat dipengaruhi oleh konsentrasi Ni yang ada pada media tanam. Dalam pertumbuhannya, tanaman memerlukan makronutrien dan mikronutrien. Pertumbuhan tanaman akan terganggu jika nutrient yang dibutuhkan kurang tersedia. Kurang tersedianya nutrien yang dibutuhkan oleh tanaman dapat disebabkan oleh kurangnya nutrient dalam tanah atau adanya competitor yang dapat mempegaruhi penyerapan makro dan mikro nutrien. Unsur yang dapat memainkan peran sebagai kompetitor penyerapan nutrien oleh tanaman adalah logam berat, dimana nikel adalah salah satunya (Ahmad, dkk., 2011) Toksisitas Ni mulai sangat terasa bagi tanaman M. malabathricum adalah pada konsentrasi Ni 300 ppm di dalam media tanam. Hal ini dapat dilihat dengan matinya tanaman pada 300 ppm ulangan ke-3 (300 ppm (3)), 325 ppm (1), 350 41 ppm (3), 375 ppm (1,2), dan 400 ppm (1,5). Namun demikian, tanaman yang masih hidup pada konsentrasi tersebut tetap mengalami pertambahan jumlah daun. Rata-rata pertambahan daun yang bernilai negatif pada konsentrasi Ni 300-400 ppm dalam tanah disebabkan karena rata-rata jumlah daun pada saat akhir pengukuran lebih sedikit dibandingkan pada saat awal pengukuran. Kecepatan jumlah total pertambahan daun dipengaruhi oleh 2 faktor, yaitu kecepatan pertambahan daun kecepatan gugur daun. Jumlah total pertambahan daun akan semakin meningkat jika kecepatan pertambahan daun lebih besar dari kecepatan gugur daun. Berikut adalah grafik yang menunjukkan hubungan antara jumlah total pertambahan daun, pertambahan daun, dan daun yang gugur. 10 Respon Daun Tanaman 8 Total Pertambahan daun Pertambahan daun Daun Gugur 6 4 2 0 0 25 50 75 100 125 150 175 200 225 250 275 300 325 350 375 400 -2 -4 [Ni] Tanah (ppm) Gambar 11. Grafik profil jumlah daun terhadap konsentrasi Ni pada media tanam Grafik di atas menunjukkan terganggunya pertumbuhan tanaman yang disebabkan adanya logam Ni pada media tanamnya. Grafik menunjukkan bahwa total pertambahan jumlah daun semakin berkurang dengan bertambahnya konsentrasi Ni dalam tanah karena dengan pertambahnya konsentrasi Ni dalam tanah, pertambahan daun semakin sedikit dan daun yang gugur semakin banyak. 42 Gangguan pertumbuhan tanaman yang disebabkan oleh adanya logam Ni pada media dapat dilihati dari daun yang terbentuk selama pengamatan. Perbedaan tersebut terletak pada luas daun. Secara kualitatif, perbedaan luas daun dapat dilihat pada gambar berikut: Gambar 12. Perbedaan ukuran daun M. malabathricum. Dari gambar di atas terlihat bahwa kehadiran logam Ni pada media tanam dapat mengganggu pertumbuhan tanaman jika dilihat dari besarnya daun pada tanaman. Dengan adanya Ni pada media tanam, menyebabkan ukuran daun berkurang secara drastis. Pada media-media dengan kontaminasi logam Ni, perbedaan ukuran akibat bertambahnya konsentrasi Ni tidak dapat lagi dibedakan secara kualitatif karena perbedaan ukuran yang kecil. Secara kuantitatif, pengaruh logam Ni pada media terhadap luas tanaman dapat dilihat pada grafik berikut: 43 50 45 Luas Daun (Cm2 ) 40 35 30 25 20 15 10 5 0 0 25 50 75 100 125 150 175 200 225 250 275 300 325 350 375 400 425 Konsentrasi Ni Tanah (ppm) Gambar 13. Grafik perbedaan luas daun M. malabathricum. Berdasarkan grafik di atas, dapat terlihat behwa semakin tinggi konsentrasi Ni pada media tanam, pertumbuhan tanaman semakin terganggu. Hal ini dapat dilihat dari semakin berkurangnya luas daun. Tabel 1. Tabel perbedaan luas daun terhadap konsentrasi Ni tanah. [Ni] Panjang Lebar Luas Daun ppm (cm2) 11,82 5,36 43,399 0 8,52 3,5 20,029 100 8,56 3,42 19,72 125 8,14 3,32 18,491 150 7,84 3,28 17,635 175 7,86 3,26 17,556 200 7,52 3,24 16,265 225 7,44 3,28 15,264 250 7,18 3,06 14,898 275 6,86 2,98 13,512 300 6,72 2,74 12,619 325 6,76 2,66 12,123 350 6,82 2,66 12,718 375 6,38 2,5 11,43 400 44 Luas daun yang dihitung secara kuantitatif merupakan daun terbesar yang terbentuk pada saat tanaman telah ditanam pada media terkontaminasi Ni. berdasarkan tabel di atas dapat terlihat bahwa panjang dan lebar daun, yang menentukan luas daun, semakin berkurang seiring bertambahnya konsentrasi Ni pada media. Hal ini membuktikan bahwa tanaman M. malabathricum terpengaruh oleh toksisitas logam Ni, meskipun tanaman ini dapat dikatan toleran toleran terhadap adanya Ni pada tanah karena masih sanggup bertahan hidup. 5.1.2 Pertambahan Tinggi Selain pertambahan daun, indikator lain yang dapat digunakan untuk mengamati kesuburan tanaman adalah pertambahan tinggi. Total pertambahan tinggi yang diamati pada periode tertentu dapat digunakan untuk menganalisis tingkat kesuburan tanaman. Semakin besar total pertambahan tinggi suatu tanaman makan dapat dikatakan tanaman tersebut semakin subur. Pertambahan tinggi tanaman M. malabathricum Dapat dilihat pada gambar berikut : 12 10 Pertambahan Tinggi (cm) 8 R² = 0,9609 6 4 2 0 0 -2 25 50 75 100 125 150 175 200 225 250 275 300 325 350 375 400 [Ni] Tanah (ppm) Gambar 14. Grafik pengaruh konsentrasi Ni dalam Tanah terhadap rata-rata pertambahan tinggi tanaman 45 Adanya logam Ni pada media tanam juga mempengaruhi pertambahan tinggi tanaman M. malabathricum Grafik menunjukkan bahwa semakin besar konsentrasi Ni pada media tanam, maka rata-rata pertambahan tinggi tananam semakin berkurang. Perbedaan tersebut juga ditunjukkan dengan analisis statistic Kruskal-Wallis dengan signifikansi 0,000. Berdasarkan rata-rata pertambahan tinggi, toksisitas logam Ni sangat berpengaruh terhadap kesuburan tanaman ini. Selain logam Ni dapat berperan sebagai kompetitor penyerapan nutrien dari dalam tanah (Ahmad, dkk., 2011), Ni juga dapat menganggu reaksi enzimatis di dalam jaringan tanaman (Priyanto dan Priyanto, 2007). Ion logam nikel merupakan golongan ion logam yang daya racunnya disebabkan oleh kemampuan dari ion ini untuk menggantikan ion logam yang telah ada secara alamiah pada suatu molekul. Ion nikel dapat menggeser ion Zn(II) yang merupakan kofaktor enzim karbonat anhidrase. Terbentuknya ikatan antara ion nikel dengan enzim menyebabkan tidak berfungsinya enzim sebagaimana mestinya. Akibatnya suatu bentuk reaksi metabolisme akan gagal terjadi (Palar, 1994). Dengan terganggunya proses metabolisme, maka kesuburan tanaman akan berkurang yang ditunjukkan dengan makin berkurangnya pertambahan tinggi seiring bertambahnya konsentrasi Ni di dalam media tanam. 5.1.3 Panjang Akar Pertumbuhan akar dalam hal ini pertambahan panjang akar selama periode pengamatan dapat menggambarkan respon tanaman terhadap perlakuan yang diberikan. Dalam pertumbuhannya, tumbuhan akan menyesuaikan fisiologi akar 46 yang bertujuan untuk menyesuaikan diri dengan lingkungan tempat tumbuhkan. Fisiologi yang dimaksud adalah bentuk dan panjang akar. Berikut adalah grafik panjang akar terhadap kontaminasi Ni pada media tanam : 50 45 40 Panjang Akar (cm) 35 30 25 20 15 10 5 0 0 25 50 75 100 125 150 175 200 225 250 275 300 325 350 375 400 Konsentrasi Ni dalam Tanah (ppm) Gambar 15. Grafik perbedaan panjang akar tergadap konsentrasi Ni Tanah Berdasarkan pengukuran panjang akar tanaman, dapat diketahui bahwa pertumbuhan tanaman terganggu dengan adanya Ni sebagai kontaminan pada media tanamnya. Perbedaan panjang akar yang sangat signifikan antara tanaman yang ditanaman pada media tanpa kontaminasi nikel terhadap media dengan kontaminasi Ni menunjukkan bahwa toksisitas logam Ni telah mempengaruhi pertumbuhan tanaman in. Selain itu, akar tanaman yang ditanam pada media tanpa kontaminasi Ni memiliki banyak serabut akar dan panjang, sedangkan aar tanaman pada media dengan kontaminasi Ni akarnya besar dan pendek dengan sedikit serabut akar, seperti ditunjukkan pada gambar berikut : 47 Gambar 16. Gambar akar tanaman M. malabathricum pada 0 ppm (1), 100 ppm (2), 125 ppm (3), 150 ppm (4) Ukuran akar yang besar dengan sedikit serabut akar pada tanaman yang ditanam pada media terkontaminasi Ni merupakan bentuk adaptasi fisiologi tanaman terhadap lingkungan tempat tumbuhnya. 5.2 Pengaruh Konsentrasi Ni Pada Media Terhadap Penyerapan Logam Ni Oleh Tanaman Selain dapat hidup pada tanah dengan konsentrasi Ni tinggi, M. malabathricum juga dapat mengakumulsai logam Ni pada jaringannya. Logam Ni di absorbsi melalui akar kemudian diangkut dengan senyawa-senyawa transport, kemudian mengalami detoksifikasi dan delokalisasi ke seluruh bagian tanaman (He, S., dkk., 2012). Besarnya konsentrasi Ni yang tersimpan pada akar, batang, dan daun berbeda-beda. Perbedaan konsentrasi pada jaringan tanaman tersebut menggambarkan kemampuan translokasi logam oleh tanaman. 48 5.2.1 Akar Telah diketahui, bahwa agar tumbuhan dapat menyerap logam maka logam harus dibawa ke dalam larutan di sekitar akar (rizosfer) dengan beberapa cara bergantung pada spesies tumbuhannya. Mekanisme penyerapan besi lewat pembentukan suatu zat khelat yang disebut fitosiderofor. Molekul fitosiderofor yang terbentuk ini akan mengikat (mengkhelat) logam dan membawanya ke dalam sel akar melalui peristiwa transport aktif. Di dalam meningkatkan penyerapan besi, tumbuhan membentuk suatu molekul reduktase di membran akarnya (Marschner dan Romheld, 1994). Reduktase ini berfungsi mereduksi logam yang selanjutnya diangkut melalui kanal khusus di dalam membran akar (Priyanto, B., 2006). Menurut Wendy (2008), logam diserap oleh akar setelah berikatan dengan senyawa yang dikeluarkan oleh tumbuhan, dimana yang berperan mengikat logam adalah senyawa yang mempunyai sistein, glutamine, dan glisin. O HO O HO O HO SH OH H2N H2N H2N O Sistein (Cys) HO Glutamin (Glu) Glisin (Gly) O O H N H N N H O OH O SH Gambar 17. Fitokelatin (PC) (Wendy, 2008) 49 Gambar 18. Kompleks Ni (Wendy, 2008) Berdasarkan hasil analisis konsentrasi logam Ni di dalam jaringan tanaman, diketahui bahwa tinggi rendahnya konsentrasi Ni di dalam jaringan tanaman ditentukan oleh konsentrasi Ni pada media tanamnya, seperti ditunjukkan oleh gambar berikut : 1600 Konsentrasi Ni Pada Akar (ppm) 1400 1200 1000 R² = 0,8267 800 600 400 200 0 0 -200 25 50 75 100 125 150 175 200 225 250 275 300 325 350 375 400 Konsentrasi Ni Tanah (ppm) Gambar 19. Grafik konsentrasi Ni dalam akar tanaman terhadap konsentrasi Ni pada media tanam Berdasarkan grafik di atas, terlihat bahwa penambahan konsentrasi Ni di dalam media tanam dapat mempengaruhi besarnya konsentrasi Ni di dalam jaringan tanaman. Tanpa penambahan Ni di dalam media tanam, konsentrasi Ni dalam akar hanya sebesar 15,97 ppm, dimana konsentrasi Ni tanah sebesar 4.2 ppm. Dengan penambahan logam Ni ke dalam media tanam mulai dari 100 ppm, menyebabkan konsentrasi Ni pada akar meningkat drastis di atas 200 ppm. 50 Pada grafik terlihat bahwa konsentrasi Ni didalam jaringan akar bertambah tinggi dengan bertambah ringginya konsentrasi Ni di dalam tanah. Hal ini sesuai dengan teori yang menyatakan bahwa konsentrasi Ni pada tanah dan jaringan tanaman akan mengalami kesetimbangan, sehingga peningkatan konsentrasi Ni pada media tanam akan diikuti oleh peningkatan konsentrasi Ni di dalam jaringan tanaman. Nilai R2 yang mendekati 1 (0,8267) menunjukkan bahwa konsentrasi Ni di dalam jaringan tanaman sangat bergantung pada besarnya konsentrasi Ni pada tanah. Berdasarkan pola penyerapan nikel oleh akar, tanaman M. malabathricum merupakan jenis tanaman indikator logam Ni. 5.2.2 Batang Setelah logam dibawa masuk ke dalam sel akar, selanjutnya logam harus diangkut melalui jaringan pengangkut, yaitu xilem dan floem, ke bagian tumbuhan lain. Untuk meningkatkan efisiensi pengangkutan, logam diikat oleh molekul khelat. Berbagai molekul khelat yang berfungsi mengikat logam dihasilkan oleh tumbuhan, khusus untuk logam Ni, histidin merupakan pengkelat utama untuk logam ini (Priyanto, B., 2006). Kemampuan memproduksi senyawa transport logam akan mempengaruhi kecepatan translokasi logam dalam jaringan tanaman. Semaik baik baik transportasi logam Ni, maka konsentrasi Ni pada jaringan tanaman yang berada di atas tanah akan semakin besar. Berikut adalah grafik konsentrasi Ni pada jaringan batang tanaman M. malabathricum. 51 900 800 Konsentrasi Ni Pada Batang (ppm) 700 600 500 R² = 0,8767 400 300 200 100 0 0 25 50 75 100 125 150 175 200 225 250 275 300 325 350 375 400 -100 -200 Konsentrasi Ni Tanah (ppm) Gambar 20. Grafik konsentrasi Ni dalam batang tanaman terhadap konsentrasi Ni pada media tanam Konsentrasi Ni pada batang tanaman M. malabathricum juga dipengaruhi oleh besarnya konsentrasi Ni pada tanah seperti halnya pada akar. Secara umum pertambahan konsentrasi Ni pada tanah menyebabkan meningkatnya konsentrasi Ni di dalam jaringan batang. Berdasarkan pola konsentrasi Ni pada jaringan batang yang meningkat menikuti peningkatan konsentrasi Ni dalam tanah, tanaman ini merupakan tanaman indikator terhadap kehadiran logam Ni pada tanah. Hubungan yang erat antara konsentrasi Ni pada tanah terhadap konsentrasi Ni pada jaringan batang ditunjukkan oleh nilai R yang mendekati 1 (0,8767) 5.2.3 Daun Pada daun terjadi peristiwa detoksifikasi logam Ni dengan terlebih dahulu dikomplekskan, kemudian dipindahkan dari bagian aktif sitoplasma ke bagian sel yang tidak aktif pada proses seluler, seperti dinding sel dan vakuola. Pada daun, logam disimpan pada apoplas atau sel-sel epidermis (He, S., dkk., 2012). 52 Kemampuan detoksifikasi ini menyebabkan tanaman memiliki toleransi yang tinggi terhadap logam Ni. Indikator kemampuan suatu tanaman mentranslokasika logam Ni adalah besar kecilnya tanaman menyimpan logam Ni di dalam jaringan yang berada di atas permukaan tanah, seperti batang dan daun. Seperti halnya konsentrasi Ni pada jaringan akar dan batang, konsentrasi Ni pada daun juga bergantung pada konsentrasi Ni pada media tanam. Berikut grafik konsentrasi Ni pada daun tanaman M. malabathricum. terhadap pertambahan konsentrasi Ni pada media tanam : 600 Konsentrasi Ni Pada Daun (ppm) 500 400 R² = 0,953 300 200 100 0 0 -100 25 50 75 100 125 150 175 200 225 250 275 300 325 350 375 400 Konsentrasi Ni Tanah (ppm) Gambar 21. Grafik konsentrasi Ni dalam daun tanaman terhadap konsentrasi Ni pada media tanam Berdasarkan gambar di atas, dapat diketahui bahwa penambahan logam Ni ke dalam media tanam menyebabkan peningkatan konsentrasi Ni di dalam jaringan daun M. malabathricum. Seperti halnya pada akar dan batang, peningkatan konsentrasi Ni pada jaringan daun mengikuti peningkatan konsentrasi Ni pada tanah. Nilai R2 = 0,953 menunjukkan bahwa besarnya konsentrasi Ni 53 pada jaringan daun sangat bergantung pada besarnya konsentrasi Ni pada tanah. Hal ini semakin menguatkan bahwa tanaman M. malabathricum merupakan tanaman indikator terhadap logam Ni dalam tanah. Kemampuan suatu tanaman untuk mentolerasi dan mengakumulasi logam berat, misalnya Ni, memberikan keuntungan tersendiri secara ekologi bagi tanaman tersebut. Logam yang telah di akumulasi tersebut dapat digunakan sebagai alat pertahanan. Tanaman dengan konsentrasi Ni yang tinggi pada batang dan daunnya, merupakan pelindung yang efektif dari serangga ) (He, S., dkk., 2012). Keuntungan ini dapat teramati dengan tidak adanya daun pada tanaman yang ditanaman pada media dengan kontaminasi logam Ni. 5.3 Kadar Abu dan Konsentrasi Ni Pada Abu Jaringan Tanaman Kadar abu dapat digunakan untuk menggambarkan besarnya kandungan logam yang terdapat pada suatu jaringan tanaman, karena abu merupakan senyawa oksida dari logam. Semakin tinggi kadar abu, maka semakin tinggi pula konsentrasi logam. Tabel 2. Rata-Rata Kadar Abu dan kadar Nikel pada abu Tanaman Melastoma malathricum Kadar Abu Pada Jaringan (%) [Ni] Pada Abu (%) [Ni] Tanah (ppm) Akar Batang Daun Akar Batang Daun 0 13,736 7,116 8,508 7,340 0,002 0,007 100 12,960 9,804 9,801 33,141 0,101 0,124 125 18,841 9,923 8,207 40,493 0,140 0,175 150 21,955 9,368 15,035 49,090 0,582 0,278 175 21,436 12,117 10,755 54,827 0,139 0,266 200 19,416 11,582 14,110 61,277 0,226 0,196 225 30,376 17,939 17,549 72,716 0,096 0,077 250 21,280 13,413 8,761 73,364 0,082 0,345 275 21,767 20,237 15,194 83,049 0,129 0,058 54 300 325 350 375 400 20,184 19,050 19,487 16,476 21,027 14,302 18,282 10,605 23,369 21,611 17,061 18,528 9,010 12,603 20,286 87,887 95,215 97,276 106,862 115,731 0,340 0,314 0,368 1,130 0,204 0,362 0,204 0,225 0,084 0,293 Pada Tabel di atas, dapat dilihat secara umum kadar abu pada jaringan tanaman yang ditanam pada tanah yang terkontaminasi Ni bertambah besar. Hal ini disebabkan tanaman mengakumulasi logam Ni ke dalam jaringannya. Pata tabel terlihat bahwa peningkatan persentase kenaikan kadar abu tidak terlalu besar, namun peningkatan kadar Ni pada abu meningkat dsartis pada tanaman yang ditanan pada tanah terkontaminasi Ni. Hal ini menunjukkan bahwa bertambahnya konsentrasi Ni di dalam jaringan diikuti oleh berkurangnya konsentrasi logam lain. Berdasarkan data tersebut dapat diketahui bahwa kehadiran logam Ni dapat mengganggu transportasi logam lain pada jaringan tanaman. 5.4 5.4.1 Profil penyerapan Nikel Oleh Tanaman M. malabathricum. Bioconcentration Factor Sebagai tanaman yang akan digunakan untuk meremediasi lahan terkontaminasi logam, tanaman harus memiliki kemampuan mengakumulasi logam. Setiap tanaman memiliki kemampuan mengakumulasi logam, dimana kemampuan itu dapat digunakan untuk mengklasifikasikan tanaman sebagai akumulator atau ekskluder. Kemampuan mengakumulasi logam oleh suatu tanaman dinyatakan dengan Bioconcrntration factor (BCF). Nilai BCF tanaman M. malabathricum. Dapat dilihat pada tabel berikut : 55 Tabel 3. Tabel kemampuan akumulasi logam Ni tanaman M. malabathricum No [Ni] Tanah (ppm) Massa Total tanaman (g) Massa Total Ni (mg) Rata-Rata [Ni] Pada Jaringan (ppm) Nilai BCF 1 2 3 4 5 6 7 8 9 10 11 12 13 100 125 150 175 200 225 250 275 300 325 350 375 400 1,77 1,02 1,29 0,75 0,62 0,81 0,49 0,74 0,63 0,72 0,91 0,38 1,04 0,28 0,17 0,24 0,17 0,16 0,22 0,18 0,23 0,24 0,32 0,50 0,31 0,69 160,65 167,31 188,55 223,49 250,47 266,96 362,54 309,76 373,02 440,63 555,22 811,27 663,42 1,61 1,34 1,26 1,28 1,25 1,19 1,45 1,13 1,24 1,36 1,59 2,16 1,66 Berdasarkan tabel di atasdapat dilihat bahwa nilai BCF lebih besar dari 1 yang berarti bahwa tanaman M. malabathricum merupakan tanaman akumulator terhadap logam Ni. Pada tabel diatas dapat dilihat bahwa umumnya nilai BCF tanaman M. malabathricum seragam berada disekitar 1. Hal ini bersesuaian dengan teori yang menyatakan bahwa nilai BCF suatu tanaman terhadap logam yang sama adalah identik meskipun ditanam pada tanah dengan konsentrasi logam yang berbeda. Secara teoritis, suatu tanaman dikatakan akumulator terhadap suatu logam jika nilai BCF > 1 dan ekskluder jika nilai BCF << 1. Tabel di atas menunjukkan bahwa umunya nilai BCF > 1. Berdasarkan tabel di atas, maka M. malabathricum merupakan tanaman akumulator logam Ni. 56 5.4.2 Translocation Factor Selain memiliki kemampuan mengakumulasi logam, tanaman yang baik untuk digunakan pada metode fitoremediasi adalah tanaman yang memiliki kemampuan mendistribusikan kontaminan logam ke seluruh bagian tanaman. Kemampuan distribusi logam oleh tanaman dinyatakan dengan nilai Translocation Factor (TF). Nilai TF terhadap perubahan konsentrasi Ni pada media ditunjukkan pada grafik berikut : 1.00 , 0.90 , Nilai Translocation Factor (TF) 0.80 , TF Batang 0.70 , TF daun , 0.60 0.50 , 0.40 , 0.30 , 0.20 , 0.10 , 0.00 , 0 25 50 75 100 125 150 175 200 225 250 275 300 325 350 375 400 Konsentrasi Ni Tanah (ppm) Gambar 22. Grafik Translocation factor tanaman M. malabathricum Nilai TF adalah perbandingan antara jaringan tanaman yang terdpat di atas tanah yaitu batang dan daun terhadap akar. Seperti halnya BAF, secara teoritis nilai TF seharusnya identik. Pada grafik diatas, dapat dilihat bahwa TF lebih kecil dari 1. Hal ini menunjukkan bahwa konsentrasi Ni pada akar lebih besar darpada konsentrasi Ni pada akar dan daun. Nilai TF batang dan daun M. malabathricum ditunjukkan pada tabel berikut : 57 Tabel 4. Tabel kemampuan Translokasi pada batang dan daun M. malabathricum [Ni] Tanah [Ni] akar [Ni] Batang [Ni] Daun TF TF (ppm) (ppm) (ppm) (ppm) Batang daun 15,97 1,47 5,81 0,09 0,36 0 227,87 73,32 87,47 0,32 0,38 100 273,67 205,90 101,69 0,75 0,37 125 400,26 161,56 125,17 0,40 0,31 150 450,61 212,82 140,87 0,47 0,31 175 477,06 258,38 218,34 0,54 0,46 200 516,01 293,64 214,36 0,57 0,42 225 526,45 326,97 282,11 0,62 0,54 250 544,32 358,90 296,00 0,66 0,54 275 694,81 364,07 315,77 0,52 0,45 300 700,78 405,39 430,74 0,58 0,61 325 706,87 613,58 435,75 0,87 0,62 350 1257,62 748,60 515,69 0,60 0,41 375 1392,02 802,71 541,08 0,58 0,39 400 Berdasarkan tabel di atas, dapat terlihat bahwa nilai TF batang ataupun daun lebih kecil dari 1. Hal ini menunjukkan bahwa translokasi logam Ni pada tanaman ini kurang baik. Kemmapuan transportasi logam ditentukan oleh kemampuan tanaman untuk meproduksi senyawa transport, seperti protein transport, asam amino dan asam organik. Jika kurang memiliki kemampuan untuk memproduksi senyawa transport, maka transport logam akan kurang baik pula, sehingga Ni tidak tersebar merata ke seluruh bagian tanaman. 5.4.3 Kemampuan Remediasi Melasoma malabathricum Kemampuan remediasi lahan oleh suatu tanaman pada teknik fitoremdiasi merukan kemampuan tanaman menghilangkan kontaminan dari dalam tanah untuk jangka waktu tertentu pada luas tanah tertentu. Kemampuan remediasi logam Ni oleh tanaman M. malabathricum dapat dilihat pada tebel berikut: 58 Tabel 4. Tabel kemampuan remediasi Ni tanaman M. malabathricum [Ni] Rata-Rata [Ni] Rata-Rata Massa Tanah Pada Jaringan Ni (g/Ha/Tahun) (ppm) (ppm) 160,65 68,16 100 167,31 40,94 125 188,55 58,37 150 223,49 39,99 175 250,47 37,31 200 266,96 51,63 225 362,54 42,21 250 309,76 55,13 275 373,02 56,58 300 440,63 76,64 325 555,22 120,59 350 811,27 74,90 375 663,42 166,28 400 Kemampuan remediasi logam oleh tanaman ditentukan oleh kemampuan absorpsi logam dan kemampuan menghasilkan biomassa. Kemampuan remediasi suatu tanaman akan semakin baik jika kemampuan mengabsorpsi logam diikuti dengan kemampuan biomassa yang tinggi, sehingga tanaman akan semakin baik digunakan sebagai agen fitoremediasi jika mampu menyerap logam dengan konsentrasi yang tinggi dan diikuti oleh produksi biomassa yang tidak menurun secara signifikan. Hal ini disebabkan karena sekuat apapun toleransi suatu tanaman terhadap toksisitas logam, akan tetap terjadi penurunan kesuburan dalam pertumbuhan tanaman tersebut. Rata-rata biomassa pada tabel di atas merupakan estimasi berdasarkan hasil perhitungan biomassa yang di hasilkan selama 2 bulan pengamatan. Dengan asumsi 6 kali penanaman pertahun dan jarak penanaman 0,5 m. Berdasarkan hal tersebut, maka dapat diketahui bahwa kemampuan menyerap logam oleh tanaman M. malabathricum mencapai 166,28 g Ni per hektar per tahun. 59 6 BAB VI. KESIMPULAN Berdasarkan data yang telah diperoleh, dapat di simpilkan sebagai berikut : 1. Tanaman Melastoma malabathricum merupakan tanaman yang cukup toleran terhadap kontaminasi logam nikel pada media tanam, hal ini dapat dilihat bahwa tanaman ini mampu bertahan hidup pada tanah dengan konsentrasi Nikel sampai 400 ppm. 2. Konsentrasi nikel pada tanah mempengaruhi penyerapan nikel oleh tanaman M. malabathricum. Semakin tinggi konsentrasi nikel pada media tanam meningkatkan akumulasi logam nikel pada jaringan tanaman, hal ini menunjukkan bahwa Melastoma malabathricum merupakan jenis tanaman indikator. 3. Berdasarkan nilai BCF Melastoma malabathricum merupakan tanaman akumulator terhadap logam nikel dengan kemampuan remediasi logam nikel mencapai 166,28 g/ha per tahun. 60 DAFTAR PUSTAKA Adler, T., 1996, Botanical cleanup crews, Sci, News, Vol 150, 42-43. Ahmad, M.S., Ashraf, M., and Hussain, M., 2011, Phytotoxic effects of nickel on yield and concentration of macro- and micro-nutrients in sunflower (Helianthus annuus L,) achenes, J, Hazard Mater, Vol 185, 1295-1303. Al-Baldawi, I.A., Abdullah, R.S., Anuar, N., Suja, F., Mushrifah, I., 2015, Phytodegradation of total petroleum hydrocarbon (TPH) in dieselcontaminated water using Scirpus grossus, Ecological Engineering, Vol 74, 463–473. Assuncao, A.G.L., Schat, H., dan Aarts, M.G.M., 2003, Thlaspi caerulescens, an attractive model species to study heavy metal hyperaccumulation in plants, New Phytol, Vol 159, 351-360. Balumugan, K., dkk., 2014, Antidiabetic and antihyperlipidaemic activity of ethanol extract of Melastoma malabathricum Linn. leaf in alloxan induced diabetic rats, Asian Pacific Journal of Tropical Biomedicine. Vol 4 : 442-448. Baker, A.J.M., dan Brooks, R.R., 1999, Terrestrial higher plants which hyperaccumulate metallic elements, A review of their distribution, ecology, and phytochemistry, Biorecovery, Vol 1, 81-126. Bañuelos, G.S., Ajwa, H.A., Mackey, B., Wu, L.L., Cook, C., Akohoue, S., dan Zambrzuski, S., 1997, Evaluation of different plant species used for phytoremediation of high soil selenium, J, Environ, Qual, Vol 26, 639646. Barbaroux, R., Meunier, N., Mercier, G., Taillard, V., Morel, J.L., Simonnot, M,O,, Blais, J,F,, 2009, Chemical leaching of nickel from the seeds of the metal hyperaccumulator plant Alyssum murale, Hydrometallurgy, Vol 100, 10–14. Bayramoglu, G., Arica, M.Y., Adiguzel, N., 2012, Removal of Ni(II) and Cu(II) ions using native and acid treated Ni-hyperaccumulator plant Alyssum discolor from Turkish serpentine soil, Chemosphere, Vol 89, 302–309. Bazihizinaa, N., Redwana, M., Taiti, C., Giordano, C., Monettia, E., Masia, E., Azzarelloa, E., Mancusoa, S., 2015, Root Based Responses Account for Psidium guajava Survival at High Nickel Concentration, Journal of Plant Physiology, Vol 174, 137–146. 61 Benyamin, L., 1995, Dasar-Dasar Fisiologi Tumbuhan, PT Raja Grafindo Persada, Jakarta. Boyd, R, S., 2004, Ecology of metal hyperaccumulation, New Phytol, Vol 162, 563-567, Burken, J.G., dan Schnoor, J,L., 1999, Distribution and volatilization of organic compounds following uptake by hybrid poplars, Int, J, Phytoremediation, Vol 1, 39-151. Chen Q., dan Wong, J.W.C., 2006, Growth of Agropyron elongatum in a Simulated Nickel Contaminated Soil With Lime Stabilization, Science of the Total Environment, Vol 366 ,448–455. Cunningham, S., 1995, Current topics in Plant Biochemistry, Physiology and Molecular Biology, Columbia, 47-53. Ferraz, P., Fidalgo, F., Almeida, A., Teixeira, J., 2012, Phytostabilization of Nickel by the Zinc and Cadmium Hyperaccumulator Solanum nigrum L, Are Metallothioneins Involved?,Plant Physiology and Biochemistry, Vol 57, 254-260. Franklin, G.P., 1991, Fisiologi Tanaman Budidaya, Universitas Indonsia press, Jakarta. Galardi, F., Mengoni, A., Pucci, S., Barletti, L., Massi, L., Barzanti, R., Gabbrielli, R,, Gonnelli, C,, 2007, Intra-specific differences in mineral element composition in the Ni-hyperaccumulator Alyssum bertolonii: A survey of populations in nature, Environmental and Experimental Botany, Vol 60, 50-56. Gardner, F.P., R.B. Pearce., dan R.L Mitchell., 1991, Physiology of Crop Plants, UI Press, Jakarta. Gerendás, J., dan Sattelmacher, B., 1999, Influence of Ni supply on growth and nitrogen metabolism of Brassica napus L, grown with NH4NO3 or urea as N source, Ann, Bot, Vol 83, 65-71. Ghaderian, S.M., Mohtadi, A., Rahiminejad, M.R., Baker, A.J.M., 2007, Nickel and other metal uptake and accumulation by species of Alyssum (Brassicaceae) from the ultramafics of Iran, Environmental Pollution, Vol 145, 293-298. Ghaderian, Y.S.M., Lyon, A.J.E., dan Baker, A.J.M., 2000, Seedling mortality of metal hyperaccumulator plants resulting from damping off by Pythium spp, New Phyto, Vol 146, 219-224. 62 Gholib, D., 2009, Uji Daya Hambat Daun Melastoma Malabathricum Terhadap Trichophyton mentagrophytees dan Candida albicans, Berita Biologi, Vol 9 : 9-13. Ghosh, M., dan Singh, S,P., 2005, A review on phytoremediation of heavy metals and utilization of its by product, Applied Ecology and Environmental Research, Vol 3, 1-18. Gouveia-Figueira, L.S.C., dan Castilho, P.C., 2015, Phenolic screening by HPLC– DAD–ESI/MSnand antioxidant capacityof leaves, flowers and berries of Rubus grandifolius LoweSandra, Industrial Crops and Products, Vol 73, 28–40. Graham, R.D., dan Webb, M.J., 1991, Micronutrients and disease resistance and tolerance in plants, dalam J.J. Mortvedt, F.R. Cox, L.M. Shuman, dan R.M. Welch (Eds,), Micronutrients in Agriculture (2nd ed,), (pp, 329370) Soil Science Society of America. Harjadi, M.M., Setyati, S., 1988, Pengantar Agronomi, Gramedia, Jakarta. He, S., He, Z., Yang, X., dan Baligar, V.C., 2012, Advances in Agronomy Volume 117, Science Direct. Hidayati, N., 2005, Fitoremediasi dan potensi tumbuhan hiperakumulator, Hayati, 35-40, ISSN 0854-8587. Jawetz, Z.E., Melnick J.L., dan Aderberg E.A., 1996, Mikrobiologi Kedokteran Edisi 20, EGC, Jakarta. Kagalkar, A.N., Jadhav, M.U., Bapat, V.A., Govindwar, S.P., 2011, Phytodegradation of the Triphenylmethane dye Malachite Green Mediated by Cell Suspension Cultures of Blumea malcolmii Hook, Bioresource Technology, Vol 102, 10312–10318. Kamisan, F.H., dkk., 2013, Hepatoprotective Activity of Methanol Extract of Melastoma malabathricum Leaf in Rats, Journal of Acupuncture and Meridian Studies, Vol 6 : 52-55. Kidd, P.S., Monterroso, C., 2005, Metal extraction by Alyssum serpyllifolium ssp, lusitanicum on mine-spoil soils from Spain, Science of the Total Environment, Vol 336, 1-11. Lambers, H., dan Poorter H., 1992, Inherent variation in growth rate between higher plants: a search for physiological causes and ecological consequences, Advanced Ecology, Vol 23, 187-261, 63 Lee, M., Yang, M., 2010, Rhizofiltration using sunflower (Helianthus annuus L,) and bean (Phaseolus vulgaris L, var, vulgaris) to remediate uranium contaminated groundwater, Journal of Hazardous Materials, Vol 173, 589–596. Mangkoedihardjo, 2005, Fitoteknologi dan Ekotoksikologi dalam Desain Operasi Pengomposan Sampah, ITS, Surabaya. Mansur, 2010, Teknik Silvikultur Untuk Reklamasi Lahan Bekas Tambang, Seamo Biotrop, Bogor, Indonesia. Maqbool, F., Wang, Z., Xu, Y., Zhao, J., Gao, D., Zhao, Y.G., Zulfiqar, A, Bhatti, A., Xinge, B., 2012, Rhizodegradation of petroleum hydrocarbons by Sesbania cannabina in bioaugmented soil with free and immobilized consortium, Journal of Hazardous Materials, Vol 237–238, 262-269. Megharaj, M., Ramakrishnan, B., Venkateswarlu, K., Sethunathan, N., Naidu, R., 2011, Bioremediation approaches for organic pollutants: a critical perspective, Environ, Int,, Vol 37, 1362-1375. Molas, J., dan Baran, S., Relationship Between the Chemical Form of Nickel Applied to the Soil and Its Uptake and Toxicity to Barley plants (Hordeum vulgare L,), Geoderma, Vol 122, 247-255. Mulrooney, S.B., dan Hausinger, R.P., 2003, Nickel uptake and utilization by microorganisms, FEMS Microbiol, Vol 27, 239-261, Najeeb, U., Ahmad, W., Zia, M.H., Malik, Z., Zhou, W., 2014, Enhancing the lead phytostabilization in wetland plant Juncus effusus L, through somaclonal manipulation and EDTA enrichment, Arabian Journal of Chemistry, Vol xxx, xxx–xxx. Park, S., Kim, K.S., Kim, J.T., Kang, D., Sung, K., 2011, Effects of humic acid on phytodegradation of petroleum hydrocarbons in soil simultaneously contaminated with heavy metals, Journal of Environmental Sciences, Vol 23, 2034–2041. Priyanto, B., dan Priyanto, J., 2007, Fitoremediasi sebagai Sebuah Teknologi Pemulihan Pencemaran, Khususnya Logam Berat, Lipi, Bogor. Rajkumar, M., Mab, Y., Freitas, H., 2013, Improvement of Ni phytostabilization by inoculation of Ni resistant Bacillus megaterium SR28C, Journal of Environmental Management, Vol 128, 973-980. Rivai, 1994, Asas Pemeriksaan Kimia, UI-Press, Jakarta. 64 Roslen, dkk., 2014, Cytotoxicity screening of Melastoma malabathricum extracts on human breast cancer cell lines in vitro, Asian Pacific Journal of Tropical Biomedicine, Vol 4 : 545-548. Rugh, C.L., Senecoff, J.F., Meagher, R.B., dan Merkle, S.A., 1998, Development of transgenic yellow poplar for mercury phytoremediation, Nat, Biotechnol,Vol 16, 925-928. Seregin, I.V., dan Kozhevnikova, A.D., 2006, Physiological Role of Nickel and Its Toxic Effects on Higher Plants, Russian Journal of Plant Physiology, Vol, 53, 257-277. Seregin, V.I., dan Kozhevnikova, A.D., 2006, Physiological Role of Nickel and Its Toxic Effects on Higher Plants, Russian Journal of Plant Physiology, Vol, 53, 257-277. Sulaiman, M.R., Somchita M.N., Israf D.A., Ahmad, Z., Moin S., 2004, Antinociceptive effect of Melastoma malabathricum ethanolic extract in mice, Fitoterapia, Vol 75 : 667– 672. Susan Eapen, S., Suseelan K.N., Tivarekar, S., Kotwal, S.A., dan Mitra, R., 2003, Potential for rhizofiltration of uranium using hairy root cultures of Brassica juncea and Chenopodium amaranticolor, Environmental Research, Vol 91, 127–133. Susanti, D., Sirat, H.M., Ahmad, F., Ali, R.M., Aimi, N., Kitajima, M., 2008, Erratum to „„Antioxidant and cytotoxic flavonoids from the flowers of Melastoma malabathricum L.”, Food Chemistry, Vol 107 : 1275. Terry, N., and Bañuelos, G., Phytoremediation of Contaminated Soil and Water, Lewis Publishers, Boca Raton. The Perkin-Elmer Corporation, 1996, Analytical Methods for Atomic Absorption Spectroscopy, The Perkin-Elmer Corporation, United States of America, 103. Tjitrosoepomo, G., 1999, Botani Umum Jilid 2, Penerbit Angkasa, Bandung. Tome, F.V., Rodríguez, P.B., Lozano, J.C., Elimination of natural Uranium and 226Ra from contaminated waters by rhizofiltration using Helianthus annuus L,, Science Of The Total Environment, Vol 393, 351–357. Wang, H., Feng, T., Peng, X., Yan, M., dan Tang, X., 2009, Up-regulation of chloroplastic antioxidant capacity is involved in alleviation of nickel 65 toxicity of Zea mays L, byexogenoussalicylicacid, Ecotoxicology and Environmental Safety, Vol 72, 1354-1362. Wang, X., Wu, N., Guo, J., Chu, X., Tian, J., Yao, B., dan Fan, Y., 2008, Phytodegradation of Organophosphorus Compounds by Transgenic Plants Expressing a Bacterial Organophosphorus Hydrolase, Biochemical and Biophysical Research Communications, Vol 365, 453–458. Wang, Z., Xu, Y., Zhao, J., Li, P., Gao, D., Xing, B., 2011, Remediation of petroleum contaminated soils through composting and rhizosphere degradation, Journal of Hazardous Materials, Vol 190, 677–685. Yang, M., Jawitz, J.W., Lee, M., 2015, Uranium and cesium accumulation in bean (Phaseolus vulgaris L, var, vulgaris) and its potential for uranium rhizofiltration, Journal of Environmental Radioactivity, Vol 140, 4249. Zobiole, L.H.S., Oliveira, R.S., Jr., Kremer, R,J., Constantin, J., Yamada, T., Castro, C., Oliveira, F.A., dan Oliveira, A., Jr., 2010, Effect of glyphosate on symbiotic N2 fixation and nickel concentration in glyphosate-resistant soybeans, App,, Soil, Ecol, Vol 44, 176-180. 66 LAMPIRAN 6.1 Pembuatan Media Pembibitan Tanah Ditimbang sebanyak 5 kg 5 kg tanah Ditambahkan 5 kg pupuk kandang Ditambahkan 5 kg daun kering Tanah : Pupuk kandang : Daun 1:1:1 Diaduk Media Pembibitan 6.2 Pembibitan Bijih Ditabur pada media pembibitan Bijih pada media pembibitan Media Pembibitan 67 6.3 Pembuatan Larutan Ni 4000 ppm NiSO4.6H2O Ditimbang sebanyak 18,8434 g Dimasukkan ke dalam labu takar 100 ml 18.8434 g NiSO4.6H2O dalam Labu Takar 1000 ml Diencerkan sampai tanda tera Larutan Ni 4000 ppm Perhitungan : Mr. NiSO4.6H2O=262,7 Massa Ni yang dibutuhkan=4 g 4 g Ni = 4 g Ni x 4 g Ni= 18,8434 g NiSO4.6H2O 6.4 Preparasi Sampel Untuk analisis AAS Biomassa Kering Tanaman Ditimbang 0,5 g Dimasukkan ke dalam Cawan Porselin Dibakar dalam tanur pada suhu 700 0C Selama 15 menit Abu dipindahkan ke gelas kimia 50 ml Abu dalam Gelas Kimia 50 ml Ditambahkan 25 ml aquadest Ditambahkan 5 ml Asam Nitrat Pekat Dipanaskan Dipindahkan ke dalam labu takar 25 ml dan diencerkan Larutan di analisis dengan menggunakan AAS Hasil Pengamatan 68 69 6.5 Pembuatan Tanah terkontaminasi Ni Tanah Ditimbang 5 kg 5 kg Tanah 5 kg Tanah 5 kg Tanah 5 kg Tanah 5 kg Tanah 5 kg Tanah 5 kg Tanah 5 kg Tanah Di+ 33,3 ml lar. Di+ 50 ml lar. Di+ 66,7 ml lar. Di+ 83,3 ml lar. Di+ 100 ml lar. Di+ 116, ml Ni 3000 ppm lar. Ni 3000 Ni 3000 ppm Ni 3000 ppm Ni 3000 ppm Ni 3000 ppm ppm Kontrol Tanah Terkont. Ni 50 ppm Tanah Terkont. Ni 75 ppm Tanah Terkont. Ni 100 ppm Tanah Terkont. Ni 125 ppm Tanah Terkont. Ni 150 ppm Tanah Terkont. Ni 175 ppm 5 kg Tanah Di+ 133,3 ml lar. Ni 3000 ppm Tanah Terkont. Ni 200 ppm 5 kg Tanah Di+ 150 ml lar. Di+ 166,7 ml lar. Ni 3000 Ni 3000 ppm ppm Tanah Terkont. Ni 225 ppm Tanah Terkont. Ni 250 ppm 70 6.6 Penenaman Pada Polibag Experimen Tanaman Hasil Pembibitan Dipindahkan ke dalam polibag eksperimen Tanaman dalam polibag eksperimen Disiram secukupnya setiap pagi dan sore Diukur pertambahan tinggi batangnya setiap 2 hari Dihitung pertambahan jumlah daunnya setiap 2 hari Pertambahan tinggi batang Pertambahan Jumlah daun 6.7 Pemanenan Tanaman berusia 2 bulan Dipanen Dipisahkan akar, batang, dan daunnya Akar Batang Daun Dikeringkan di dalam oven pada suhu 105 0C selama 3 x 24 jam Sampel kering 71 6.8 Pengukuran Pertumbuhan Tanaman 0 [Ni] (ppm) 1 Tanaman 2 100 3 4 5 A B C D A B C D A B C D A B C D 2016-08-31 7 0 0 22.5 6 0 0 28.5 2 0 0 26.5 6 0 0 2016-09-02 7 0 0 23 8 2 0 29 4 2 0 27.5 6 0 2016-09-04 9 2 0 24 8 0 0 30 4 0 0 28 6 2016-09-06 9 0 0 24.5 8 0 0 30 4 0 0 28 2016-09-08 9 0 0 24.5 8 0 0 30.5 4 0 0 2016-09-10 9 0 0 24.5 8 0 0 30.5 4 0 2016-09-12 9 0 0 24.5 9 2 1 32 4 0 2016-09-14 9 0 0 24.5 9 0 0 32 6 2016-09-16 11 2 0 25..5 9 0 0 32.5 2016-09-18 11 0 0 26 9 0 0 2016-09-20 11 0 0 27.5 9 0 2016-09-22 11 0 0 27.5 9 2016-09-24 11 0 0 29 2016-09-26 13 2 0 2016-09-28 13 0 0 2016-09-30 13 0 2016-10-02 13 2016-10-04 1 A B C D 22 9 0 0 0 22 9 0 0 0 22 9 8 2 0 23.5 28 8 0 0 0 28.5 8 0 0 28.5 8 0 2 0 30 8 6 0 0 30 33 6 0 0 0 33 6 0 0 0 33.5 6 9 0 0 33.5 29 11 2 0 29 11 0 0 0 29 11 0 0 0 0 30.5 11 0 13 0 0 30.3 11 2016-10-06 14 2 1 31 2016-10-08 14 0 0 2016-10-10 14 0 2016-10-12 14 2016-10-14 14 2016-10-16 2016-10-18 2 A B C D 26 6 0 0 0 26 8 2 0 0 26 8 11 2 0 27 23.5 11 0 0 0 24 11 0 0 24 11 0 0 0 24.5 11 8 0 0 24.5 30 10 2 0 0 31.5 10 0 0 0 32 10 6 0 0 32 35 8 2 0 35.5 8 0 0 35.5 8 0 0 0 36 8 0 0 0 36 10 13 2 0 37 32 13 0 0 0 32 13 0 0 0 32.5 13 0 0 32.5 13 14 0 0 33 15 2 1 33.5 3 A B C D 18 6 0 0 0 18 6 0 0 0 18.5 8 8 0 0 18.5 27.5 8 0 0 0 27.5 7 0 0 27.5 7 0 0 0 28 7 11 0 0 28 26 13 2 0 0 26 13 0 0 0 26.5 13 10 0 0 26.5 32 10 0 0 32.5 10 0 0 34 12 2 0 34 12 2 0 35.5 10 0 0 37.5 10 0 0 37.5 10 0 0 37.5 0 0 37.5 13 0 0 15 2 0 4 A B C D 16 4 0 0 0 16 4 0 2 0 16 4 8 0 0 16.5 18.5 8 0 0 1 19 8 0 0 19 8 0 0 0 19 8 7 0 0 19 28.5 9 2 0 0 28.5 9 0 0 0 28.5 9 13 0 0 29 27 13 0 0 27 13 0 0 0 27.5 14 2 0 0 28 14 12 0 0 28 36 12 0 0 0 36 12 0 0 0 37 12 10 0 0 37 10 0 0 37 37.5 12 2 0 38.5 12 0 0 5 A B C D A B C D 24 6 0 0 15 6 0 0 20 0 24.5 6 0 0 15.5 8 2 0 21 0 0 24.5 8 2 0 15.5 8 0 0 21.5 4 0 0 24.5 7 0 1 15.5 8 0 0 21.5 16.5 4 0 0 24.5 7 0 0 15.5 8 0 0 22 0 17 6 2 0 17 6 0 0 25 6 2 3 16 8 2 2 23 0 25 6 0 0 16 8 0 0 23 0 0 17 6 0 0 25 6 0 0 16 8 0 0 23 8 0 0 17 6 0 0 25 6 0 0 16 8 0 0 23 19.5 8 0 0 17 6 0 0 25 8 2 0 17.5 10 2 0 24 0 19.5 10 2 0 18 6 0 0 25 8 0 0 17.5 10 0 0 24.5 0 0 19.5 10 0 0 18 6 0 0 25 8 0 0 17.5 10 0 0 24.5 9 0 0 20.5 10 0 0 18 8 2 0 26.5 8 0 0 17.5 10 0 0 25 29 9 0 0 29 9 0 0 20.5 10 0 0 19.5 8 0 0 27 8 0 0 17.5 10 0 0 25 20.5 12 2 0 20 8 0 0 27.5 8 0 0 18 10 0 0 25 1 31 9 0 0 20.5 12 0 0 20 8 0 0 27.5 8 0 0 18.5 10 0 0 25 0 0 31.5 11 2 0 21 12 0 0 21 8 0 0 27.5 8 0 0 18.5 12 0 0 26.5 14 0 0 32 11 0 0 21 12 0 0 21 8 0 0 27.5 8 0 0 18.5 12 0 0 27 28.5 14 0 0 32 11 0 0 21.5 12 0 0 22 8 0 0 27.5 8 0 0 18.5 12 2 0 27 0 28.5 14 0 0 32.5 11 0 0 21.5 12 0 0 22 8 0 0 28 8 0 0 19 12 0 0 27 0 0 29 14 0 0 34 11 0 0 21.5 12 0 0 22 10 0 0 28.5 8 0 0 19 12 0 0 27 12 0 0 29 12 0 0 29 14 0 0 34 11 0 0 22 12 0 0 23.5 10 0 0 29 8 0 0 19 12 0 0 27 14 0 0 35 11 0 0 22 12 0 0 23.5 10 0 0 29 10 2 0 20.5 12 0 0 27 38.5 13 2 1 30.5 16 2 0 37 11 0 0 22 14 2 0 24.5 10 0 0 29 10 0 0 20.5 12 0 0 28.5 39 13 0 0 31 16 0 0 37.5 11 0 0 23 14 0 0 25 10 0 0 29 10 0 0 21 12 0 0 29 Tanggal 72 125 [Ni] (ppm) 1 Tanaman 2 150 3 4 5 1 2 3 A B C D A B C D A B C D A B C D A B C D A B C D A B C D 2016-08-31 6 0 0 22 6 0 0 22.5 6 0 0 16.7 6 0 0 13.5 4 0 0 19 4 0 0 17.5 5 0 0 2016-09-02 6 0 0 22 6 0 0 22.5 6 0 0 16.7 8 2 0 14 4 0 0 19 4 0 0 17.5 5 0 2016-09-04 6 0 0 22.5 8 2 0 22.5 8 2 0 16.7 8 0 0 14.5 4 0 0 19.5 4 0 0 17.5 7 2 2016-09-06 6 0 0 22.5 8 0 0 22.5 8 0 0 17.5 8 0 0 15 4 0 0 19.5 2 0 2 17.5 7 2016-09-08 6 0 0 22.5 8 0 0 23 8 0 0 18 8 0 0 15 4 0 0 19.5 2 0 0 17.5 2016-09-10 4 0 2 23 4 0 4 23.5 8 0 0 18.5 10 2 0 15.5 6 2 0 20 2 0 0 2016-09-12 4 0 0 23 4 0 0 23.5 8 0 0 18.5 10 0 0 15.5 6 0 0 20 2 0 2016-09-14 6 2 0 24.5 4 0 0 23.5 8 0 0 19 10 0 0 15.5 6 0 0 21 4 2016-09-16 6 0 0 25 4 0 0 23.5 8 0 0 19 10 0 0 16.5 6 0 0 21 2016-09-18 6 0 0 25 4 0 0 23.5 8 0 0 19.5 12 2 0 16.5 6 0 0 2016-09-20 6 0 0 25.5 6 2 0 24 10 0 0 21 11 0 1 17 6 0 0 2016-09-22 6 0 0 25.5 6 0 0 24 10 0 0 21 11 0 0 17 6 0 2016-09-24 6 0 0 25.5 6 0 0 24 10 0 0 21.5 11 0 0 17.5 6 2016-09-26 8 2 0 26 6 0 0 24 10 0 0 21.5 11 0 0 17.5 2016-09-28 8 0 0 26 6 0 0 24 10 0 0 21.5 11 0 0 2016-09-30 8 0 0 26 7 2 1 25 10 0 0 21.5 11 0 2016-10-02 8 0 0 26 7 0 0 25 10 0 0 22 11 2016-10-04 8 0 0 26 7 0 0 25 10 0 0 22 2016-10-06 8 0 0 26 7 0 0 25 10 0 0 22 2016-10-08 8 0 0 26 7 0 0 25 10 0 0 2016-10-10 10 0 0 27 9 0 0 26 11 2 2016-10-12 10 0 0 27 9 0 0 26.5 11 2016-10-14 10 0 0 27.5 9 0 0 26.5 2016-10-16 10 0 0 28 9 0 0 2016-10-18 10 0 0 28 9 0 0 4 5 A B C D A B C D A B C D 13 6 0 0 16.5 4 0 0 15.5 8 0 0 0 13 6 0 0 16.5 4 0 0 15.5 8 0 0 9 0 13.5 6 0 0 16.5 4 0 0 15.5 8 0 0 9.5 0 0 13.5 6 0 0 16.5 3 0 1 15.5 8 0 0 10 7 0 0 14 6 0 0 17 2 0 1 15.5 8 0 0 10 17.5 6 0 1 14.5 7 2 1 17.5 2 0 1 15.5 7 0 1 11 0 17.5 6 0 0 14.5 7 0 0 17.5 2 0 0 15.5 7 0 0 11 2 0 17.5 6 0 0 14.5 6 0 1 18 4 2 0 16.5 9 0 0 11.5 4 0 0 18 6 0 0 14.5 6 0 0 18.5 4 0 0 17 9 0 0 12 21.5 4 0 0 18 6 0 0 14.5 6 0 0 18.5 4 0 0 17 9 0 0 12 22 4 0 0 18 6 0 0 14.5 6 0 0 18.5 4 0 0 17.5 9 0 0 12 0 22 4 0 0 18.5 8 2 0 16 6 0 0 18.5 4 0 0 18 9 0 0 12 0 0 22 4 0 0 19 8 0 0 16.5 6 0 0 18.5 4 0 0 18 11 0 0 13 8 2 0 23 4 0 0 19 8 0 0 17 8 0 0 20 4 0 0 18 11 0 0 13 18 8 0 0 23.5 6 2 0 20 8 0 0 17.5 8 0 0 20.5 4 0 0 18.5 11 0 0 13.5 0 18.5 8 0 0 23.5 6 0 0 20 8 0 0 18 8 0 0 20.5 6 2 0 20 11 0 0 13.5 0 0 18.5 7 0 1 24 6 0 0 21 8 0 0 18.5 8 0 0 20.5 6 0 0 21.5 11 0 0 13.5 10 0 1 18.5 7 0 0 24.5 6 0 0 21 10 2 0 17 8 0 0 20.5 6 0 0 22 11 0 0 13.5 12 2 0 20 9 2 0 25 6 0 0 21 10 0 0 17 8 0 0 20.5 6 0 0 22 11 2 2 14.5 22 12 0 0 21 9 0 0 25.5 6 0 0 21 10 0 0 18 8 0 0 21 8 2 0 23 11 0 0 14.5 1 23 12 0 0 21.5 9 0 0 25.5 8 2 2 22 10 0 0 18 8 0 0 21 8 0 0 24 11 0 0 14.5 0 0 23.5 12 0 0 21.5 9 0 0 25.5 8 0 0 22.5 10 0 0 18.8 8 0 0 21 8 0 0 24 11 0 0 14.5 11 0 0 23.5 12 0 0 22 9 0 0 25.5 8 0 0 23 10 0 0 18.5 8 0 0 21 8 0 0 24 11 0 0 14.5 26.5 11 0 0 24 12 0 0 22 9 0 0 26 8 0 0 23 10 0 0 18.5 8 0 0 22 8 0 0 24 11 0 0 14.5 26.5 11 0 0 24 12 0 0 22 9 0 0 26 8 0 0 24 10 0 0 18.5 10 0 0 22 9 2 1 24 13 2 0 15 Tanggal 9 73 175 [Ni] (ppm) 1 Tanaman 2 200 3 A B C D A B C D 2016-08-31 12 0 0 20 5 0 0 2016-09-02 12 0 0 20 5 0 2016-09-04 12 0 0 20 5 0 2016-09-06 12 0 0 20.5 6 2016-09-08 12 0 0 20.5 2016-09-10 8 0 4 2016-09-12 8 0 2016-09-14 8 2016-09-16 4 A B C D 16 6 0 0 0 16 5 0 0 16 5 0 2 1 16 4 6 0 0 16 21 4 0 2 0 21 4 0 0 0 21.5 6 8 0 0 21.5 2016-09-18 8 0 0 2016-09-20 10 0 0 2016-09-22 10 0 2016-09-24 10 2016-09-26 5 A B C D 13 4 0 0 0 13 6 2 0 13 6 0 0 1 13 5 4 0 0 13 16 4 0 0 0 16 4 0 0 0 17 6 6 0 0 17 21.5 6 0 0 22.5 6 0 0 0 22.5 8 0 0 0 22.5 0 10 0 0 22.5 2016-09-28 10 0 0 2016-09-30 11 2 2016-10-02 11 2016-10-04 2016-10-06 1 A B C D 17 6 0 0 0 17.5 6 0 0 17.5 6 0 0 1 17.5 6 5 0 0 17.5 13.5 7 2 0 0 13.5 7 0 0 0 15 7 6 0 0 15.5 17 6 0 0 17 6 0 0 0 17.5 6 0 0 0 18 6 0 0 0 18 22.5 0 0 0 1 24 8 2 0 0 24 8 11 0 0 24 11 0 0 24 2016-10-08 11 0 0 2016-10-10 11 0 2016-10-12 11 2016-10-14 2 3 4 5 A B C D A B C D A B C D A B C D A B C D 13 4 0 0 16.5 4 0 0 12 2 0 0 23 6 0 0 10.5 5 0 0 15 0 13 4 0 0 16.5 4 0 0 12 2 0 0 23 6 0 0 11 5 0 0 15 0 13 4 0 0 16.5 4 0 0 12 2 0 0 23 6 0 0 11 5 0 0 15 0 0 13 4 0 0 17 4 0 0 12 2 0 0 23.5 6 0 0 11 7 2 0 15 8 2 0 13 4 0 0 17 4 0 0 12 2 0 0 23.5 6 0 0 11 7 0 0 15.5 18.5 7 0 1 13 4 0 0 18.5 2 0 2 12 4 2 0 24 5 0 1 11.5 6 0 1 17 0 18.5 7 0 0 13 4 0 0 19 2 0 0 12 4 0 0 24 5 0 0 11.5 6 0 0 17 0 0 19 7 0 0 13.5 6 2 0 20 2 2 2 13 4 0 0 24 5 0 0 11.5 6 0 0 17 7 0 0 19 7 0 0 13.5 6 0 0 20.5 2 0 0 13.5 4 0 0 24 5 0 0 11.5 6 0 0 17 15.5 7 0 0 19 7 0 0 13.5 6 0 0 20.5 2 0 0 13.5 4 0 0 24 7 2 0 13 6 0 0 17 16 7 0 0 19 7 0 0 13.5 6 0 0 20.5 2 0 0 13.5 6 2 0 25 7 0 0 13 6 0 0 17 0 16 7 0 0 19 7 0 0 13.5 6 0 0 20.5 2 0 0 13.5 6 0 0 25.5 7 0 0 13.5 6 0 0 17 0 0 16 7 0 0 19 7 0 0 13.5 6 0 0 20.5 4 2 0 15 6 0 0 25.5 7 0 0 13.5 6 0 0 17 6 0 0 16 9 0 0 20 9 0 0 14.5 8 0 0 21 4 0 0 15 6 0 0 26 7 0 0 13.5 8 2 0 18 18.5 6 0 0 16 9 0 0 20 9 0 0 15 8 0 0 21 4 0 0 15 6 0 0 26 7 0 0 13.5 8 0 0 18.5 2 19.5 6 0 0 16 9 0 0 20.5 9 0 0 15 8 0 0 21 4 0 0 15 6 0 0 26 7 0 0 13.5 8 0 0 19 0 0 20 8 0 0 16.5 9 0 0 20.5 9 0 0 15 8 0 0 21 4 0 0 15 6 0 0 26 7 0 0 13.5 8 0 0 19 8 0 0 20 8 0 0 16.5 9 0 0 20.5 9 0 0 15 8 0 0 21 4 0 0 15 6 0 0 26 7 0 0 13.5 8 0 0 19 7 0 1 21 8 0 0 17 9 0 0 20.5 9 0 0 15 9 2 1 21.5 4 0 0 15 6 0 0 26 7 0 0 13.5 8 0 0 19 24 9 1 0 22 8 0 0 17 9 0 0 20.5 9 0 0 15 9 0 0 21.5 4 0 0 15 6 0 0 26 7 0 0 13.5 8 0 0 19 0 24 8 0 1 22.5 8 0 0 17.5 9 0 0 20.5 9 0 0 15 9 0 0 21.5 4 0 0 15 6 0 0 26 7 0 0 13.5 8 0 0 19 0 0 24 8 0 0 23 8 0 0 17.5 9 0 0 20.5 10 2 1 16 9 0 0 21.5 4 0 0 15 8 2 0 27 7 0 0 13.5 8 0 0 19.5 11 0 0 24 8 0 0 23 8 0 0 17.5 11 0 0 21.5 10 0 0 17 9 0 0 21.5 6 2 0 15.5 8 0 0 27.5 7 0 0 13.5 8 0 0 19.5 2016-10-16 13 0 0 25 7 1 0 23 8 0 0 17.5 0 0 0 22 10 0 0 17 9 0 0 21.5 6 0 0 15.5 8 0 0 27.5 9 2 0 14.5 8 0 0 19.5 2016-10-18 13 0 0 25.5 7 0 0 23 10 0 0 18.5 11 0 0 22 10 0 0 17 11 2 0 22 6 0 0 16 8 0 0 27.5 9 0 0 15 8 0 0 19.5 Tanggal 74 225 [Ni] (ppm) 1 Tanaman 2 250 3 4 5 1 2 3 4 5 A B C D A B C D A B C D A B C D A B C D A B C D A B C D A B C D A B C D A B C D 2016-08-31 6 0 0 12 4 0 0 12.5 5 0 0 10.5 7 0 0 23 7 0 0 11 6 0 0 18 6 0 0 17.5 6 0 0 10.5 4 0 0 15 8 0 0 10.5 2016-09-02 4 0 2 12 4 0 0 12.5 5 0 0 10.7 9 2 0 23.5 7 0 0 11.5 8 2 0 18 6 0 0 17.5 6 0 0 10.5 4 0 2016-09-04 4 0 0 12.5 2 0 2 12.5 7 2 0 11 9 0 0 23.5 6 0 1 11.5 8 0 0 18.5 6 0 0 17.5 6 0 0 11 4 0 0 15 8 0 0 10.5 0 15 8 0 0 10.5 2016-09-06 4 0 0 13 2 0 0 12.5 7 0 0 11.5 9 0 0 23.5 5 0 1 11.5 8 0 0 18.5 6 0 0 17.5 8 2 0 11 4 0 0 15 8 0 0 11 2016-09-08 3 0 1 13 2 0 0 12.5 7 0 0 11.5 9 0 0 23.5 5 0 0 11.5 7 0 1 18.5 5 0 1 17.5 8 0 0 11 2 0 2 15 8 0 0 11 2016-09-10 4 2 1 13 2 0 0 12.5 9 2 0 13 8 0 1 24 6 2 1 12 4 0 3 18.5 4 0 1 17.5 8 0 0 12 4 2 0 15 6 0 2 12 2016-09-12 4 0 0 13 2 0 0 12.5 9 0 0 13 8 0 0 24 6 0 0 12 4 0 0 18.5 4 0 0 17.5 8 0 0 12 4 0 0 15 6 0 0 12 2016-09-14 4 0 0 13 4 0 0 14 7 0 2 13 8 0 0 24 6 0 0 12.5 4 0 0 18.5 6 2 0 18 8 0 0 12 4 0 0 16 6 0 0 12 2016-09-16 4 0 0 13 4 0 0 14 7 0 0 13 8 0 0 24 6 0 0 12.5 4 0 0 18.5 6 0 0 19 8 0 0 12.5 4 0 0 16 6 0 0 12 2016-09-18 4 0 0 13 4 0 0 14.5 7 0 0 13 8 0 0 24 6 0 0 12.5 4 0 0 18.5 6 0 0 2016-09-20 4 0 0 13 4 0 0 14.5 7 0 0 13 8 0 0 24 6 0 0 13 6 2 0 19.5 6 0 0 19 8 0 0 13 4 0 0 16 6 0 0 12 19 8 0 0 13 4 0 0 16 8 2 0 13 2016-09-22 6 0 0 14 4 0 0 14.5 9 2 0 14.5 10 2 0 25 6 0 0 13 6 0 0 19.5 6 0 0 19.5 8 0 0 13 4 0 0 16 8 0 0 13 2016-09-24 6 0 0 14.5 4 0 0 14.5 9 0 0 14.5 9 0 1 25.5 6 0 0 13 6 0 0 20 6 0 0 19.5 8 0 0 13 4 0 0 16 8 0 0 13 2016-09-26 6 0 0 14.5 4 0 0 14.5 9 0 0 15 9 0 0 25.5 6 0 0 13 6 0 0 20 6 0 0 19.5 8 0 0 13 4 0 0 16 8 0 0 13 2016-09-28 6 0 0 14.5 6 0 0 15.5 9 0 0 15 9 0 0 25.5 6 0 0 13 6 0 0 20 6 0 0 19.5 8 0 0 13 6 2 0 17.5 8 0 0 13 2016-09-30 6 0 0 14.5 6 0 0 16 9 0 0 15 9 0 0 25.5 6 0 0 13 6 0 0 20 6 0 0 19.5 8 0 0 13 6 0 0 17.5 8 0 0 13 2016-10-02 6 0 0 14.5 6 0 0 16 8 0 1 15 9 0 0 25.5 6 0 0 13 6 0 0 20 6 0 0 19.5 8 0 0 13 6 0 0 18 8 0 0 13 2016-10-04 6 0 0 14.5 6 0 0 16 8 0 0 15 9 0 0 26 8 2 0 15.5 2016-10-06 6 0 0 14.5 6 0 0 16 8 0 0 15 9 0 0 26 8 0 0 15 6 0 0 20 6 0 0 19.5 8 0 0 13 6 0 0 18 8 0 0 13 6 0 0 20 8 2 0 20 8 0 0 14 6 0 0 18 8 0 0 13 2016-10-08 8 2 0 14.5 6 0 0 16 8 0 0 15 8 0 1 26 8 0 0 15.5 6 0 0 20 8 0 0 21 8 0 0 14.5 6 0 0 18 8 0 0 13 2016-10-10 8 0 0 14.5 6 0 0 16 8 0 0 15 8 0 0 26 8 0 0 15.5 8 2 0 21.5 8 0 0 21 8 0 0 14.5 6 0 0 18 8 0 0 13 2016-10-12 8 0 0 14.5 8 2 0 16.5 9 2 1 15.5 8 0 0 26 8 0 0 15.5 6 0 2 22 8 0 0 21.5 8 0 0 14.5 6 0 0 18 8 0 0 13 2016-10-14 8 0 0 14.5 7 0 1 17 9 0 0 16 8 0 0 26 8 0 0 15.5 6 0 0 22 8 0 0 22 8 0 0 14.5 6 0 0 18 8 0 0 13 2016-10-16 8 0 0 14.5 7 0 0 17 9 0 0 16 8 0 0 26 8 0 0 15.5 6 0 0 22 8 0 0 22 8 0 0 14.5 6 0 0 19.5 10 2 0 13.5 2016-10-18 10 2 0 15 7 0 0 17 9 0 0 16 8 0 0 26.5 8 0 0 16 6 0 0 22 9 2 1 22.5 8 0 0 15 6 0 0 19.5 10 0 0 14 Tanggal 75 275 [Ni] (ppm) 1 Tanaman 2 A B C D 2016-08-31 6 0 0 2016-09-02 6 0 2016-09-04 6 0 2016-09-06 6 2016-09-08 300 3 4 5 1 2 3 4 5 A B C D A B C D A B C D A B C D A B C D A B C D A B C D A B C D A B C D 27 7 0 0 10.5 6 0 0 21 7 0 0 9.5 6 0 0 30.5 3 0 0 20 8 0 0 12 4 0 0 10.5 6 0 0 16 5 0 0 28 0 27.5 6 0 1 10.5 5 0 1 21 7 0 0 10 6 0 0 31 3 0 0 20 8 0 0 12 6 2 0 11 5 0 1 16 5 0 0 28 0 27.5 6 0 0 10.5 5 0 0 21 7 0 0 10 6 0 0 31 3 0 0 20.5 7 0 1 12 6 0 0 11 4 0 1 16 5 0 0 28 0 0 27.5 8 2 0 10.5 4 0 1 21 8 2 1 10 6 0 0 31 3 0 0 20.5 7 0 0 12 6 0 0 11 4 0 0 16.5 4 0 1 28 6 0 0 28 8 0 0 11 4 0 0 21 8 2 0 10 8 0 0 31 3 0 0 20.5 7 0 0 12 6 0 0 11 4 0 0 16.5 4 0 0 28.5 2016-09-10 8 2 0 28.5 8 0 0 11.5 4 0 0 21 7 0 1 10.5 6 0 2 31 4 2 1 20.5 4 0 3 12 0 0 6 0 2 0 2 17 6 2 0 29 2016-09-12 8 0 0 28.5 8 0 0 11.5 4 0 0 21 7 0 0 10.5 6 0 0 31 4 0 0 20.5 2 0 2 12 0 0 0 0 2 0 0 17 6 0 0 29 2016-09-14 8 0 0 29 8 0 0 12 6 0 0 22 7 0 0 10.5 6 0 0 31 4 0 0 21 2 0 0 12 0 0 0 0 2 0 0 17 6 0 0 29 2016-09-16 8 0 0 29 8 0 0 12 6 0 0 22.5 7 0 0 10.5 6 0 0 31 4 0 0 21 2 0 0 12 0 0 0 0 2 0 0 17 6 0 0 29 2016-09-18 8 0 0 29.5 8 0 0 12 6 0 0 22.5 7 0 0 10.5 6 0 0 31 4 0 0 22 2 0 0 12.5 0 0 0 0 2 0 0 17 6 0 0 29 2016-09-20 8 0 0 29.5 8 0 0 12 6 0 0 22.5 7 0 0 10.5 6 0 0 31 4 0 0 22 2 0 0 12.5 0 0 0 0 2 0 0 17 6 0 0 29 2016-09-22 8 0 0 30 8 0 0 12 6 0 0 22.5 7 0 0 10.5 6 0 0 31 4 0 0 22 4 2 0 13 0 0 0 0 3 2 1 17.5 6 0 0 29 2016-09-24 8 0 0 30 8 0 0 12 6 0 0 22.5 7 0 0 10.5 6 0 0 31 4 0 0 22 4 0 0 13 0 0 0 0 3 0 0 17.5 6 0 0 29 2016-09-26 8 0 0 30 8 0 0 12 6 0 0 22.5 7 0 0 10.5 6 0 0 31 4 0 0 22 4 0 0 13 0 0 0 0 3 0 0 18 6 0 0 29 2016-09-28 8 0 0 30 8 0 0 12.5 6 0 0 22.5 7 0 0 10.5 6 0 0 31 4 0 0 22 4 0 0 13 0 0 0 0 3 0 0 18 7 2 1 29.5 2016-09-30 8 0 0 30 8 0 0 12.5 6 0 0 22.5 7 0 0 10.5 8 2 0 32.5 4 0 0 22 4 0 0 13 0 0 0 0 3 0 0 18 7 0 0 29.5 2016-10-02 8 0 0 30.5 8 0 0 12.5 6 0 0 22.5 9 0 0 11 8 0 0 32.5 4 0 0 22 4 0 0 13 0 0 0 0 3 0 0 18 7 0 0 30 2016-10-04 8 0 0 30.5 10 2 0 13.5 8 0 0 23.5 9 0 0 11.5 8 0 0 33 3 0 1 22 4 0 0 13 0 0 0 0 3 0 0 18 7 0 0 30 2016-10-06 8 0 0 30.5 10 0 0 13.5 8 0 0 23.5 9 0 0 11.5 8 0 0 33 3 0 0 22 4 0 0 13 0 0 0 0 3 0 0 18.5 7 0 0 30 2016-10-08 10 2 0 31 10 0 0 13.5 8 0 0 23.5 9 0 0 11.5 8 0 0 34.5 3 0 0 22 4 0 0 13 0 0 0 0 3 0 0 18.5 7 0 0 30 2016-10-10 10 0 0 31.5 10 0 0 14 8 0 0 23.5 9 0 0 12 8 0 0 34.5 3 0 0 22 4 0 0 13 0 0 0 0 3 0 0 18.5 7 0 0 30 2016-10-12 10 0 0 32.5 10 0 0 14 8 0 0 23.5 9 0 0 12 8 0 0 35 3 0 0 22 4 0 0 13 0 0 0 0 3 0 0 18.5 7 0 0 30 2016-10-14 10 0 0 33 10 0 0 14 8 0 0 24 9 0 0 12 8 0 0 35 3 0 0 22 4 0 0 13 0 0 0 0 3 0 0 18.5 7 0 0 30 2016-10-16 10 0 0 33 9 0 1 14 8 0 0 24 9 0 0 12 8 0 0 35 3 0 0 22 4 0 0 13 0 0 0 0 3 0 0 18.5 7 0 0 30 2016-10-18 10 0 0 33 9 0 0 14 8 0 0 24 9 0 0 12 8 0 0 35 3 0 0 22 4 0 0 13 0 0 0 0 3 0 0 18.5 7 0 0 30 Tanggal 76 325 [Ni] (ppm) 1 Tanaman 2 350 3 4 5 1 2 3 4 5 A B C D A B C D A B C D A B C D A B C D A B C D A B C D A B C D A B C D A B C D 2016-08-31 2 0 0 16 5 0 0 9 9 0 0 8.5 4 0 0 8.5 4 0 0 21.5 6 0 0 18 6 0 0 10.5 8 0 0 17.5 5 0 0 15 6 0 0 11.5 2016-09-02 2 0 0 16.5 5 0 0 9 9 0 0 9 4 0 0 8.5 4 0 0 21.5 6 0 0 18 6 0 0 11 8 0 0 17.5 5 0 0 15 6 0 0 11.5 2016-09-04 2 0 0 16.5 5 0 0 9 9 0 0 9 4 0 0 8.5 4 0 0 21.5 6 0 0 18 6 0 0 11.5 8 0 0 17.5 5 0 0 15 6 0 0 12 2016-09-06 2 0 0 16.9 5 0 0 9 9 0 0 9.5 4 0 0 8.5 4 0 0 21.5 6 0 0 18 6 0 0 11.5 10 2 0 17.5 5 0 0 15 7 2 1 12 2016-09-08 4 0 0 10 4 0 1 9 9 0 0 9.5 4 0 0 8.5 4 0 0 21.5 6 0 0 18 6 0 0 12 10 0 0 17.5 5 0 0 15 7 0 0 12 2016-09-10 0 0 4 0 5 2 1 9 6 0 3 9.5 4 0 0 8.5 5 2 1 21.5 8 2 0 18.5 6 0 0 13 9 0 1 17.5 6 2 1 15.5 6 0 1 12 2016-09-12 0 0 0 0 5 0 0 9 6 0 0 9.5 4 0 0 8.5 5 0 0 21.5 8 0 0 18.5 6 0 0 13 9 0 0 17.5 6 0 0 15.5 6 0 0 12 2016-09-14 0 0 0 0 0 0 0 9 6 0 0 9.5 4 0 0 8.5 5 0 0 22.5 8 0 0 18.5 6 0 0 13 9 0 0 17.5 6 0 0 15.5 6 0 0 12 2016-09-16 0 0 0 0 0 0 0 9 6 2 2 10 6 2 0 9 5 0 0 22.5 8 0 0 18.5 6 0 0 13 9 0 0 17.5 6 0 0 15.5 6 0 0 12 2016-09-18 0 0 0 0 0 0 0 9 6 0 0 10 6 0 0 9.5 5 0 0 22.5 8 0 0 18.5 4 0 2 13 9 0 0 17.5 6 0 0 15.5 6 0 0 12 2016-09-20 0 0 0 0 0 0 0 9 6 0 0 10 6 0 0 9.5 5 0 0 22.5 8 0 0 18.5 4 0 0 13 9 0 0 17.5 6 0 0 15.5 5 0 1 12 2016-09-22 0 0 0 0 6 2 1 9.5 6 0 0 10 6 0 0 9.5 5 0 0 22.5 8 0 0 18.5 4 0 0 13 9 0 0 17.5 6 0 0 15.5 5 0 0 12 2016-09-24 0 0 0 0 6 0 0 9.5 6 0 0 10 6 0 0 9.5 5 0 0 22.5 8 0 0 18.5 4 0 0 13 9 0 0 17.5 6 0 0 15.5 5 0 0 12 2016-09-26 0 0 0 0 6 0 0 9.5 6 0 0 10 6 0 0 9.5 5 0 0 22.5 8 0 0 18.5 4 0 0 13 9 0 0 17.5 6 0 0 15.5 5 0 0 12 2016-09-28 0 0 0 0 6 0 0 10 6 0 0 10 6 0 0 9.5 5 0 0 22.5 8 0 0 18.5 4 0 0 13 8 0 1 17.5 6 0 0 15.5 5 0 0 12 2016-09-30 0 0 0 0 6 0 0 10 6 0 0 10 6 0 0 9.5 5 0 0 22.5 8 0 0 18.5 2 0 2 13 8 0 0 17.5 6 0 0 15.5 5 0 0 12 2016-10-02 0 0 0 0 6 0 0 10 6 0 0 10 6 0 0 9.5 5 0 0 22.5 8 0 0 18.5 2 0 0 13 8 0 0 17.5 6 0 0 15.5 5 0 0 12 2016-10-04 0 0 0 0 6 0 0 10 6 0 0 10 6 0 0 9.5 5 0 0 22.5 8 0 0 18.5 2 0 0 13 8 0 0 17.5 6 0 0 15.5 5 0 0 12 2016-10-06 0 0 0 0 6 0 0 10 6 0 0 10 6 0 0 9.5 5 0 0 22.5 8 0 0 18.5 2 0 0 13 8 0 0 17.5 6 0 0 15.5 5 0 0 12 2016-10-08 0 0 0 0 6 0 0 10 6 0 0 10 6 0 0 9.5 5 0 0 22.5 8 0 0 18.5 2 0 0 13 8 0 0 17.5 6 0 0 15.5 5 0 0 12 2016-10-10 0 0 0 0 6 0 0 10 6 0 0 10 6 0 0 9.5 5 0 0 22.5 8 0 0 18.5 2 0 0 13 8 0 0 17.5 6 0 0 15.5 5 0 0 12 2016-10-12 0 0 0 0 6 0 0 10 6 0 0 10 6 0 0 9.5 5 0 0 22.5 8 0 0 18.5 2 0 0 13 8 0 0 17.5 6 0 0 15.5 5 0 0 12 2016-10-14 0 0 0 0 6 0 0 10 6 0 0 10 6 0 0 9.5 5 0 0 22.5 8 0 0 18.5 2 0 0 13 8 0 0 17.5 6 0 0 15.5 5 0 0 12 2016-10-16 0 0 0 0 6 0 0 10 6 0 0 10 6 0 0 9.5 5 0 0 22.5 8 0 0 18.5 2 0 0 13 8 0 0 17.5 6 0 0 15.5 5 0 0 12 2016-10-18 0 0 0 0 6 0 0 10 6 0 10 10 6 0 0 9.5 5 0 0 22.5 8 0 0 18.5 2 0 0 13 8 0 0 17.5 6 0 0 15.5 5 0 0 12 Tanggal 77 375 [Ni] (ppm) 1 Tanaman 2 400 3 4 5 1 2 3 4 5 A B C D A B C D A B C D A B C D A B C D A B C D A B C D A B C D A B C D A B C D 2016-08-31 5 0 0 10 4 0 0 10.5 4 0 0 8.5 6 0 0 10 6 0 0 10.5 7 0 0 14 9 0 0 12 7 0 0 11 9 0 0 12 4 0 0 15.5 2016-09-02 5 0 0 16 4 0 0 10.5 4 0 0 9 6 0 0 10 6 0 0 10.5 6 0 1 14 9 0 0 12 7 0 0 11 8 0 1 12 4 0 0 15.5 2016-09-04 5 0 0 16 4 0 0 10.5 4 0 0 9 6 0 0 10.5 6 0 0 10.5 6 0 0 14 8 0 1 12 6 0 1 11 8 0 0 12 4 0 0 15.5 2016-09-06 7 2 0 16.5 4 0 0 10.4 4 0 0 9.5 5 0 1 10.5 6 0 0 10.5 6 0 0 14 8 0 0 12.5 8 2 0 11 8 0 0 12 4 0 0 15.5 2016-09-08 7 0 0 16.5 4 0 0 10.5 4 0 0 9.5 5 0 0 10.5 6 0 0 10.7 6 0 0 14 8 0 0 12.5 8 0 0 11.5 8 0 0 12.5 2 0 2 15.5 2016-09-10 0 0 7 0 0 0 4 0 6 2 0 10 7 2 0 10.5 4 0 2 10.7 0 0 6 0 9 2 1 13 8 0 0 12 8 0 0 13 0 0 2 0 2016-09-12 0 0 0 0 0 0 0 0 6 0 0 10 7 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-09-14 0 0 0 0 0 0 0 0 6 0 0 10 7 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-09-16 0 0 0 0 0 0 0 0 6 0 0 10 7 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-09-18 0 0 0 0 0 0 0 0 6 0 0 10 7 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-09-20 0 0 0 0 0 0 0 0 6 0 0 10 7 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-09-22 0 0 0 0 0 0 0 0 5 0 1 10 7 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-09-24 0 0 0 0 0 0 0 0 5 0 0 10 7 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-09-26 0 0 0 0 0 0 0 0 5 0 0 10 7 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-09-28 0 0 0 0 0 0 0 0 4 0 1 10 7 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-09-30 0 0 0 0 0 0 0 0 4 0 0 10 6 0 1 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-10-02 0 0 0 0 0 0 0 0 4 0 0 10 6 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-10-04 0 0 0 0 0 0 0 0 4 0 0 10 6 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-10-06 0 0 0 0 0 0 0 0 4 0 0 10 6 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-10-08 0 0 0 0 0 0 0 0 4 0 0 10 6 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-10-10 0 0 0 0 0 0 0 0 4 0 0 10 6 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-10-12 0 0 0 0 0 0 0 0 4 0 0 10 6 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-10-14 0 0 0 0 0 0 0 0 4 0 0 10 6 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-10-16 0 0 0 0 0 0 0 0 4 0 0 10 6 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 2016-10-18 0 0 0 0 0 0 0 0 4 0 0 10 6 0 0 10.5 4 0 0 10.7 0 0 0 0 9 0 0 13 8 0 0 12 8 0 0 13 0 0 0 0 Tanggal 78 6.9 Tabel Rata-rata Pertambahan Tinggi Rata-Rata Pertambahan Tinggi (cm) 10,8 6,8 6,56 6,4 5,4 4,6 4,3 4,3 3,9 1,5 0,9 0,8 0,44 0,6 [Ni] Tanah 0 100 125 150 175 200 225 250 275 300 325 350 375 400 6.10 Grafik Pertambahan Tinggi 12 10 Pertambahan Tinggi (cm) 8 R² = 0,9609 6 4 2 0 0 -2 25 50 75 100 125 150 175 200 225 250 275 300 325 350 375 400 [Ni] Tanah (ppm) 79 6.11 Tabel Rata-rata Pertambahan Daun [Ni] Tanah 0 100 125 150 175 200 225 250 275 300 325 350 375 400 Rata-Rata Jumlah daun 8,2 5,8 4,6 4,6 3,6 4,2 2,6 1,8 2,4 -1,8 -0,2 -0,4 -2,2 -2,2 6.12 Grafik Pertambahan Jumlah daun 10 Pertambahan Jumlah Daun 8 6 R² = 0,9336 4 2 0 0 25 50 75 100 125 150 175 200 225 250 -2 -4 Konsentrasi Ni (ppm) 275 300 325 350 375 400 80 6.13 Tabel Biomassa Tanaman [Ni] Tanah 1 2 3 4 5 0 8,3131 8,9795 6,5652 6,3734 14,3855 RataRata Biomassa 8,92334 100 2,089 3,0341 2,0486 3,1262 3,0627 2,67212 125 1,5349 1,4056 0,8013 0,7576 0,9658 1,09304 150 0,5587 0,6432 0,8348 0,4603 0,5247 0,60434 175 1,2995 2,9479 0,5265 0,8374 0,6875 1,25976 200 0,6217 0,6376 0,418 0,9331 1,4104 0,80416 225 0,4201 0,339 0,5665 1,2488 1,0996 0,7348 250 1,9996 1,1077 1,0647 0,3439 0,5026 1,0037 275 0,9568 0,4627 0,2889 0,7061 1,2581 0,73452 300 1,4305 0,8602 0 0,4833 1,1197 0,973425 325 0 0,3208 0,7157 0,2525 0,572 0,46525 350 1,8704 1,1734 0 0,845 0,1575 1,011575 375 0 0 0,4278 0,664 0,2723 0,4547 400 0 0,3793 0,3693 1,3997 0 0,7161 Biomassa Tanaman 81 6.14 Larutan Standar Ni Konsentrasi Absorbansi (ppm) 0 0 0.05 0.0045 0.1 0.0129 0.5 0.0561 1 0.0968 3 0.2881 5 0.4468 7 0.6885 10 1.0258 Kurva Standar Nikel 1.2 y = 0.1001x - 0.0054 R² = 0.9966 Absorbansi (A) 1 0.8 0.6 0.4 0.2 0 -0.2 0 2 4 6 8 Konsentrasi Ni (ppm) Konsentrasi Ni = ( ) ( ) 10 12 82 6.15 Tabel Konsentrasi Ni Pada Batang [Ni] Tanah 0 100 125 150 175 200 225 250 275 300 325 350 375 400 1 0,00 92,05 152,57 251,84 231,20 345,20 569,52 29,59 302,68 709,14 0,00 399,00 0,00 0,00 Konsentrasi Ni Batang Tanaman 2 3 4 1,56 1,61 1,23 75,85 48,59 47,92 93,85 236,42 228,72 941,53 249,75 78,28 127,91 71,91 82,39 59,36 335,70 69,01 57,21 79,47 126,14 31,12 499,50 109,38 2,44 260,50 7,51 123,09 0,00 1547,33 1984,99 221,92 201,24 346,15 0,00 115,38 0,00 244,51 4067,36 767,59 217,51 231,07 5 2,01 52,06 47,63 379,32 125,55 411,30 5,97 39,78 417,73 170,31 48,77 331,55 351,92 0,00 Rat-rata [Ni] Batang 1,28 63,30 151,84 380,15 127,79 244,11 167,66 141,87 198,17 509,97 491,38 238,42 932,76 243,24 6.16 Tabel Pengukuran Konsentrasi Ni Akar [Ni] Tanah Tanaman A 0 0 0 0 0 100 100 100 100 100 125 125 125 125 125 150 150 150 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 0,0276 0,0392 0,044 0,0338 0,0304 0,4872 0,3211 0,2657 0,1382 0,4538 0,2485 0,3967 0,237 0,5282 0,1359 0,1305 0,3211 0,4155 [Ni] Larutan Sampel 0,2218 0,3377 0,3856 0,2837 0,2498 4,8132 3,1538 2,6004 1,3267 4,4795 2,4286 3,9091 2,3137 5,2228 1,3037 1,2498 3,1538 4,0969 Massa Ni Massa Tanaman 0,0055 0,0084 0,0096 0,0071 0,0062 0,1203 0,0788 0,0650 0,0332 0,1120 0,0607 0,0977 0,0578 0,1306 0,0326 0,0312 0,0788 0,1024 0,5493 0,5080 0,5308 0,5397 0,5313 0,3972 0,3040 0,2990 0,5365 0,5415 0,1764 0,1928 0,2225 0,1661 0,1503 0,0330 0,0650 0,1126 [Ni] Akar (ppm) 10,0937 16,6172 18,1619 13,1423 11,7518 302,9448 259,3623 217,4247 61,8208 206,8107 344,1853 506,8842 259,9648 786,0893 216,8490 946,7805 1213,0178 909,6144 83 150 150 175 175 175 175 175 200 200 200 200 200 225 225 225 225 225 250 250 250 250 250 275 275 275 275 275 300 300 300 300 325 325 325 325 350 350 350 350 375 375 4 5 1 2 3 4 5 1 2 2 3 4 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 4 5 2 3 4 5 1 2 4 5 3 4 0,1031 0,3091 0,3391 0,3032 0,1802 0,1544 0,2719 0,3204 0,1159 0,2241 0,6796 0,1429 0,3785 0,1059 0,2936 0,2785 0,1527 0,3108 0,2314 0,1543 0,1191 0,3196 0,1428 0,1928 0,2263 0,0758 0,1793 0,7761 0,1804 0,3423 0,4616 0,3194 0,2125 0,0404 0,1497 0,4455 0,4086 0,3707 0,0248 0,1464 0,1855 0,9760 3,0340 3,3337 2,9750 1,7463 1,4885 2,6623 3,1469 1,1039 2,1848 6,7353 1,3736 3,7273 1,0040 2,8791 2,7283 1,4715 3,0509 2,2577 1,4875 1,1359 3,1389 1,3726 1,8721 2,2068 0,7033 1,7373 7,6993 1,7483 3,3656 4,5574 3,1369 2,0689 0,3497 1,4416 4,3966 4,0280 3,6494 0,1938 1,4086 1,7992 0,0244 0,0758 0,0833 0,0744 0,0437 0,0372 0,0666 0,0787 0,0276 0,0546 0,1684 0,0343 0,0932 0,0251 0,0720 0,0682 0,0368 0,0763 0,0564 0,0372 0,0284 0,0785 0,0343 0,0468 0,0552 0,0176 0,0434 0,1925 0,0437 0,0841 0,1139 0,0784 0,0517 0,0087 0,0360 0,1099 0,1007 0,0912 0,0048 0,0352 0,0450 0,1070 0,0800 0,2108 0,4622 0,1161 0,2146 0,1550 0,0810 0,1036 0,5826 0,0946 0,3007 0,1491 0,0347 0,0928 0,1711 0,0802 0,2184 0,5056 0,1923 0,0987 0,0988 0,3008 0,0611 0,1027 0,0977 0,1774 0,1674 0,0588 0,1317 0,3433 0,0734 0,0848 0,0235 0,0850 0,2747 0,2508 0,1401 0,0092 0,0559 0,0181 228,0430 948,1144 395,3589 160,9165 376,0236 173,4053 429,4093 971,2510 266,3842 93,7528 1779,9325 114,2024 624,9619 723,3401 775,6252 398,6370 458,7059 349,2387 111,6368 193,3844 287,7062 794,2462 114,0814 766,0098 537,1941 179,9633 244,8228 1149,8358 743,3043 638,8828 331,8848 1068,4139 609,9443 371,9685 423,9878 400,1277 401,5124 651,2046 526,6473 629,9604 2485,0840 84 375 400 400 400 5 2 3 4 0,1234 0,7352 0,1238 0,1054 1,1788 7,2907 1,1828 0,9990 0,0295 0,1823 0,0296 0,0250 0,0448 0,0681 0,0267 0,0637 657,8243 2676,4718 1107,5067 392,0726 6.17 Tabel Pengukuran Konsentrasi Ni Batang [Ni] Tanah Tanaman A 0 0 0 0 0 100 100 100 100 100 125 125 125 125 125 150 150 150 150 150 175 175 175 175 175 200 200 200 200 200 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 3 3 4 5 1 2 3 4 5 0 0,0088 0,0087 0,0079 0,0098 0,1295 0,0768 0,0726 0,03 0,0867 0,2026 0,1775 0,2625 0,212 0,0608 0,2827 0,5411 0,246 0,059 0,179 0,2323 0,077 0,0682 0,0499 0,0888 0,2101 0,0632 0,3323 0,119 0,2269 [Ni] Larutan Sampel 0 0,0340 0,0330 0,0250 0,0440 1,2398 0,7133 0,6713 0,2458 0,8122 1,9700 1,7193 2,5684 2,0639 0,5534 2,7702 5,3516 2,4036 0,5355 1,7343 2,2667 0,7153 0,6274 0,4446 0,8332 2,0450 0,5774 3,2657 1,1349 2,2128 Massa Ni 0 0,0008 0,0008 0,0006 0,0011 0,0310 0,0178 0,0168 0,0061 0,0203 0,0493 0,0430 0,0642 0,0516 0,0138 0,0693 0,1338 0,0601 0,0134 0,0434 0,0567 0,0179 0,0157 0,0111 0,0208 0,0511 0,0144 0,0816 0,0284 0,0553 Massa Tanaman 0,512 0,5426 0,5126 0,5091 0,5460 0,3367 0,2351 0,3454 0,1282 0,3900 0,3228 0,4580 0,2716 0,2256 0,2905 0,2750 0,1421 0,2406 0,1710 0,1143 0,2451 0,1398 0,2181 0,1349 0,1659 0,1481 0,2432 0,2432 0,4111 0,1345 [Ni] Batang (ppm) 0 1,5650 1,6078 1,2264 2,0126 92,0523 75,8493 48,5907 47,9240 52,0633 152,5736 93,8472 236,4167 228,7163 47,6288 251,8391 941,5286 249,7502 78,2843 379,3232 231,2049 127,9121 71,9134 82,3861 125,5526 345,1984 59,3568 335,7046 69,0139 411,2987 85 225 225 225 225 225 250 250 250 250 250 275 275 275 275 275 300 300 300 300 325 325 325 325 350 350 350 350 375 375 375 400 400 400 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 4 5 2 3 4 5 1 2 4 5 3 4 5 2 3 4 0,1518 0,0489 0,1162 0,1101 0,0143 0,0268 0,0361 0,2308 0,0608 0,0598 0,0929 0,0072 0,1508 0,016 0,5336 0,2865 0,1538 0,8579 0,0605 0,89 0,2956 0,0502 0,0742 0,4465 0,353 0,1542 0,1047 0,0987 0,4842 0,1046 0,4532 0,1255 0,1056 1,4625 0,4346 1,1069 1,0460 0,0889 0,2138 0,3067 2,2517 0,5534 0,5435 0,8741 0,0180 1,4525 0,1059 5,2767 2,8082 1,4825 8,5165 0,5504 8,8372 2,8991 0,4476 0,6873 4,4066 3,4725 1,4865 0,9920 0,9321 4,7832 0,9910 4,4735 1,1998 1,0010 0,0366 0,0109 0,0277 0,0261 0,0022 0,0053 0,0077 0,0563 0,0138 0,0136 0,0219 0,0004 0,0363 0,0026 0,1319 0,0702 0,0371 0,2129 0,0138 0,2209 0,0725 0,0112 0,0172 0,1102 0,0868 0,0372 0,0248 0,0233 0,1196 0,0248 0,1118 0,0300 0,0250 0,0642 0,1899 0,3482 0,2073 0,3722 0,1806 0,2464 0,1127 0,1265 0,3415 0,0722 0,1846 0,1394 0,3526 0,3158 0,0990 0,3011 0,1376 0,0808 0,1113 0,3266 0,0556 0,3523 0,2761 0,2508 0,3221 0,0748 0,0953 0,0294 0,0704 0,1457 0,1379 0,1083 569,5239 57,2098 79,4725 126,1401 5,9720 29,5939 31,1174 499,5005 109,3768 39,7845 302,6752 2,4353 260,4999 7,5081 417,7267 709,1393 123,0918 1547,3262 170,3124 1984,9872 221,9153 201,2376 48,7733 399,0034 346,1451 115,3767 331,5535 244,5089 4067,3612 351,9208 767,5921 217,5127 231,0709 6.18 Tabel Pengukuran Konsentrasi Ni Daun [Ni] Tanah Tanaman A 0 0 1 2 0,0151 0,0288 [Ni] Larutan Sampel 0,0969 0,2338 Massa Ni 0,0024 0,0058 Massa Tanaman 0,5798 0,5250 K Akhir (ppm) 4,1783 11,1317 86 0 0 0 100 100 100 100 100 125 125 125 125 125 150 150 150 150 150 175 175 175 175 175 200 200 200 200 200 225 225 225 225 225 250 250 250 250 250 275 275 275 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 0,0178 0,0203 0,0088 0,1366 0,2727 0,1704 0,1037 0,1040 0,0254 0,2337 0,1289 0,3805 0,1674 0,7750 0,4697 0,4534 0,0979 0,2563 0,1289 0,0752 0,6343 0,0803 0,1694 0,2430 0,6455 0,2900 0,0315 0,1780 0,1637 0,0873 0,0863 0,0818 0,0944 0,0808 0,0721 0,2602 0,2206 0,1063 0,0624 0,1126 0,0658 0,1239 0,1489 0,0340 1,3107 2,6703 1,6484 0,9820 0,9850 0,1998 2,2807 1,2338 3,7473 1,6184 7,6883 4,6384 4,4755 0,9241 2,5065 1,2338 0,6973 6,2827 0,7483 1,6384 2,3736 6,3946 2,8432 0,2607 1,7243 1,5814 0,8182 0,8082 0,7632 0,8891 0,7532 0,6663 2,5455 2,1499 1,0080 0,5694 1,0709 0,6034 0,0031 0,0037 0,0008 0,0328 0,0668 0,0412 0,0246 0,0246 0,0050 0,0570 0,0308 0,0937 0,0405 0,1922 0,1160 0,1119 0,0231 0,0627 0,0308 0,0174 0,1571 0,0187 0,0410 0,0593 0,1599 0,0711 0,0065 0,0431 0,0395 0,0205 0,0202 0,0191 0,0222 0,0188 0,0167 0,0636 0,0537 0,0252 0,0142 0,0268 0,0151 0,5146 6,0181 0,5146 7,2314 0,5365 1,5828 0,3859 84,9112 0,3706 180,1356 0,4547 90,6285 0,2344 104,7374 0,3461 71,1510 0,2704 18,4727 0,3444 165,5574 0,2595 118,8599 0,2612 358,6574 0,3401 118,9637 0,1832 1049,1692 0,2720 426,3200 0,3448 324,5015 0,1720 134,3134 0,3189 196,4953 0,3255 94,7593 0,2662 65,4867 0,1503 1045,0295 0,3512 53,2639 0,2687 152,4341 0,2278 260,4946 0,2192 729,3117 0,2239 317,4583 0,2206 29,5489 0,3804 113,3199 0,0881 448,7567 0,1610 127,0469 0,2551 79,2034 0,4257 44,8225 0,2942 75,5533 0,4769 39,4866 0,2045 81,4589 0,2898 219,5872 0,0979 548,9914 0,2110 119,4303 0,3638 39,1307 0,1280 209,1658 0,1096 137,6361 87 275 275 300 300 300 300 325 325 325 325 350 350 350 350 375 375 375 400 400 400 4 5 1 2 4 5 2 3 4 5 1 2 4 5 3 4 5 2 3 4 0,0345 0,0978 0,6553 0,2921 0,2746 0,2399 0,4193 0,3899 0,0959 0,0965 0,0317 0,1493 0,0731 0,2028 0,0893 0,0843 0,0415 0,5376 0,5115 0,2054 0,2907 0,9231 6,4925 2,8641 2,6893 2,3427 4,1349 3,8412 0,9041 0,9101 0,2627 1,4376 0,6763 1,9720 0,8382 0,7882 0,3606 5,3167 5,0559 1,9980 0,0073 0,0231 0,1623 0,0716 0,0672 0,0586 0,1034 0,0960 0,0226 0,0228 0,0066 0,0359 0,0169 0,0493 0,0210 0,0197 0,0090 0,1329 0,1264 0,0500 0,2984 24,3557 0,3044 75,8112 0,1395 1163,5318 0,2122 337,4335 0,1742 385,9516 0,4790 122,2681 0,3952 261,5679 0,2546 377,1758 0,1159 195,0164 0,1096 207,5935 0,3270 20,0869 0,2970 121,0069 0,3624 46,6559 0,3588 137,4044 0,1814 115,5129 0,3194 61,6947 0,1058 85,2172 0,1634 813,4460 0,2811 449,6571 0,1759 283,9684 88 6.19 Grafik Konsentrasi Ni Pada Batang 900 800 Konsentrasi Ni Pada Batang (ppm) 700 600 500 R² = 0,8767 400 300 200 100 0 0 25 50 75 100 125 150 175 200 225 250 275 300 325 350 -100 -200 Konsentrasi Ni Tanah (ppm) 6.20 Tabel Konsentrasi Ni Pada Daun [Ni] Tanah 0 100 125 150 175 200 225 250 275 300 325 350 375 400 Konsentrasi Ni pada Daun Tanaman 1 2 3 4 5 4,18 11,13 6,02 7,23 1,58 84,91 180,14 90,63 104,74 71,15 18,47 165,56 118,86 358,66 118,96 1049,17 426,32 324,50 134,31 196,50 94,76 65,49 1045,03 53,26 152,43 260,49 729,31 317,46 29,55 113,32 448,76 127,05 79,20 44,82 75,55 39,49 81,46 219,59 548,99 119,43 39,13 209,17 137,64 24,36 75,81 1163,53 337,43 385,95 122,27 261,57 377,18 195,02 207,59 20,09 121,01 46,66 137,40 115,51 61,69 85,22 813,45 449,66 283,97 Rata-rata [Ni] Daun (ppm) 6,03 106,31 156,10 426,16 282,19 290,03 155,08 201,79 97,22 502,30 260,34 81,29 87,47 515,69 375 400 89 6.21 Grafik Konsentrasi Ni pada Daun 600 Konsentrasi Ni Pada Daun (ppm) 500 400 R² = 0,953 300 200 100 0 0 25 50 75 100 125 -100 150 175 200 225 250 275 300 325 350 375 400 Konsentrasi Ni Tanah (ppm) 6.22 Tabel konsentrasi Ni Pada Akar Konsentrasi Ni Tanah 0 100 125 150 175 200 225 250 275 300 325 350 375 400 Konsentrasi Ni pada akar tanaman 1 2 3 4 10,09 16,62 18,16 13,14 302,94 259,36 217,42 61,82 344,19 506,88 259,96 786,09 946,78 1213,02 909,61 228,04 395,36 160,92 376,02 173,41 971,25 266,38 93,75 1779,93 624,96 723,34 775,63 398,64 349,24 111,64 193,38 287,71 114,08 766,01 537,19 179,96 1149,84 743,30 638,88 1068,41 609,94 371,97 400,13 401,51 651,20 629,96 2485,08 2676,47 1107,51 392,07 5 11,75 206,81 216,85 948,11 429,41 114,20 458,71 794,25 244,82 331,88 423,99 526,65 657,82 rata-rata [Ni] Akar (ppm) 13,95 209,67 422,79 849,11 307,02 645,10 596,25 347,24 368,41 715,98 618,58 494,87 1257,62 1392,02 90 6.23 Grafik Konsentrasi Ni Pada Akar 1600 Konsentrasi Ni Pada Akar (ppm) 1400 1200 1000 R² = 0,8267 800 600 400 200 0 0 -200 25 50 75 100 125 150 175 200 225 250 275 Konsentrasi Ni Tanah (ppm) 300 325 350 375 400 91 6.24 Kemampuan Remediasi TanamanMelastoma malabathricum No [Ni] Tanah 1 2 3 4 5 6 7 8 9 10 11 12 13 100 125 150 175 200 225 250 275 300 325 350 375 400 Rata-Rata Biomassa(g/2Bulan) 2,67212 1,09304 0,60434 1,25976 0,80416 0,7348 1,0037 0,73452 0,973425 0,46525 1,011575 0,4547 0,7161 Rata-rata [Ni] (ppm) 130,3053 209,585 432,6284 202,1763 258,5186 177,3228 162,1512 158,5252 485,2113 373,0046 229,0749 355,2395 608,9316 Rata-rata massa Ni (mg/2 bulan) 0,348191 0,229085 0,261455 0,254694 0,20789 0,130297 0,162751 0,11644 0,472317 0,17354 0,231726 0,161527 0,436056 Rata-rata massa Ni (mg/Tahun) Jarak Tanam (m) Jumlah Tanaman/Ha 2,089148 1,374508 1,568728 1,528162 1,247342 0,781781 0,976507 0,69864 2,833901 1,041242 1,390359 0,969165 2,616335 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 40000 40000 40000 40000 40000 40000 40000 40000 40000 40000 40000 40000 40000 Rata-Rata Massa Ni (g/Ha/Tahun) 83,56593 54,98034 62,74911 61,12648 49,89368 31,27124 39,06027 27,94558 113,356 41,64969 55,61434 38,76658 104,6534 92 6.25 Kemampuan Translokasi Tanaman [Ni] Pada Media 0 100 125 150 175 200 225 250 275 300 325 350 375 400 [Ni] Akar Tanaman (ppm) [Ni] Batang (ppm) [Ni] Daun (ppm) TF Batang TF Daun 13,95 1,130360917 6,03 0,08101 0,432042 209,67 65,8208072 106,31 0,313922 0,507042 422,79 138,2954093 156,10 0,327098 0,369215 849,11 246,938145 426,16 0,290819 0,501888 307,02 127,6831279 282,19 0,415875 0,919133 645,10 231,1067871 290,03 0,358247 0,449581 596,25 131,193952 155,08 0,22003 0,260085 347,24 135,258983 201,79 0,389523 0,581124 368,41 224,6009443 97,22 0,609642 0,263887 715,98 663,7765024 502,30 0,927092 0,701554 618,58 297,3097962 260,34 0,480634 0,420866 494,87 273,7374606 81,29 0,553147 0,164261 1257,62 1587,219747 87,47 1,262079 0,069556 1392,02 345,4875834 515,69 0,248192 0,370463 6.26 Analisis Statistik Pertambahan Daun One-Sample Kolmogorov-Smirnov Test Pertambahandau Konsetrasi N Normal Parameters a,b Most Extreme Differences 70 70 232,1429 2,2143 111,57168 3,57484 Mean Std. Deviation n Absolute ,086 ,105 Positive ,066 ,067 Negative -,086 -,105 Kolmogorov-Smirnov Z ,716 ,876 Asymp. Sig. (2-tailed) ,684 ,427 a. Test distribution is Normal. b. Calculated from data. 93 Test of Homogeneity of Variances Pertambahandaun Levene Statistic df1 df2 2,648 13 Sig. 56 ,006 Kruskal-Wallis Test Ranks Konsetrasi Pertambahandaun 5 67,10 P2 5 58,40 P3 5 52,10 P4 5 52,50 P5 5 43,20 P6 5 47,90 P7 5 36,60 P8 5 31,00 P9 5 35,60 P10 5 13,50 P11 5 19,50 P12 5 17,90 P13 5 10,10 P14 5 11,60 Total 70 a,b Pertambahandau n 55,974 Df Asymp. Sig. Mean Rank P1 Test Statistics Chi-Square N 13 ,000 a. Kruskal Wallis Test b. Grouping Variable: Konsetrasi 94 Mann-Whitney Test Ranks Konsetrasi Pertambahandaun N Mean Rank Sum of Ranks P1 5 7,50 37,50 P2 5 3,50 17,50 Total Test Statistics 10 b Pertambahandau n Mann-Whitney U 2,500 Wilcoxon W 17,500 Z -2,108 Asymp. Sig. (2-tailed) ,035 Exact Sig. [2*(1-tailed Sig.)] ,032 a a. Not corrected for ties. b. Grouping Variable: Konsetrasi Mann-Whitney Test Ranks Konsetrasi Pertambahandaun N Mean Rank Sum of Ranks P1 5 8,00 40,00 P3 5 3,00 15,00 Total Test Statistics 10 b Pertambahandau n Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,627 Asymp. Sig. (2-tailed) ,009 Exact Sig. [2*(1-tailed Sig.)] ,008 a. Not corrected for ties. b. Grouping Variable: Konsetrasi a 95 Mann-Whitney Test Ranks Konsetrasi Pertambahandaun N Mean Rank Sum of Ranks P1 5 8,00 40,00 P4 5 3,00 15,00 Total Test Statistics 10 b Pertambahandau n Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,660 Asymp. Sig. (2-tailed) ,008 Exact Sig. [2*(1-tailed Sig.)] ,008 a a. Not corrected for ties. b. Grouping Variable: Konsetrasi Mann-Whitney Test Ranks Konsetrasi Pertambahandaun N Mean Rank Sum of Ranks P1 5 7,80 39,00 P5 5 3,20 16,00 Total Test Statistics 10 b Pertambahandau n Mann-Whitney U 1,000 Wilcoxon W 16,000 Z -2,440 Asymp. Sig. (2-tailed) ,015 Exact Sig. [2*(1-tailed Sig.)] ,016 a. Not corrected for ties. b. Grouping Variable: Konsetrasi a 96 Mann-Whitney Test Ranks Konsetrasi Pertambahandaun N Mean Rank Sum of Ranks P1 5 7,80 39,00 P6 5 3,20 16,00 Total Test Statistics 10 b Pertambahandau n Mann-Whitney U 1,000 Wilcoxon W 16,000 Z -2,440 Asymp. Sig. (2-tailed) ,015 Exact Sig. [2*(1-tailed Sig.)] ,016 a a. Not corrected for ties. b. Grouping Variable: Konsetrasi Mann-Whitney Test Ranks Konsetrasi Pertambahandaun N Mean Rank Sum of Ranks P1 5 8,00 40,00 P7 5 3,00 15,00 Total Test Statistics 10 b Pertambahandau n Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,635 Asymp. Sig. (2-tailed) ,008 Exact Sig. [2*(1-tailed Sig.)] ,008 a. Not corrected for ties. b. Grouping Variable: Konsetrasi a 97 Mann-Whitney Test Ranks Konsetrasi Pertambahandaun N Mean Rank Sum of Ranks P1 5 8,00 40,00 P8 5 3,00 15,00 Total Test Statistics 10 b Pertambahandau n Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,652 Asymp. Sig. (2-tailed) ,008 Exact Sig. [2*(1-tailed Sig.)] ,008 a a. Not corrected for ties. b. Grouping Variable: Konsetrasi Mann-Whitney Test Ranks Konsetrasi Pertambahandaun N Mean Rank Sum of Ranks P1 5 8,00 40,00 P9 5 3,00 15,00 Total Test Statistics 10 b Pertambahandau n Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,703 Asymp. Sig. (2-tailed) ,007 Exact Sig. [2*(1-tailed Sig.)] ,008 a. Not corrected for ties. b. Grouping Variable: Konsetrasi a 98 Mann-Whitney Test Ranks Konsetrasi Pertambahandaun N Mean Rank Sum of Ranks P1 5 8,00 40,00 P10 5 3,00 15,00 Total 10 b Test Statistics Pertambahandau n Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,627 Asymp. Sig. (2-tailed) ,009 Exact Sig. [2*(1-tailed Sig.)] ,008 a a. Not corrected for ties. b. Grouping Variable: Konsetrasi Mann-Whitney Test Ranks Konsetrasi Pertambahandaun N Mean Rank Sum of Ranks P1 5 8,00 40,00 P11 5 3,00 15,00 Total 10 Test Statistics b Pertambahandau n Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,627 Asymp. Sig. (2-tailed) ,009 Exact Sig. [2*(1-tailed Sig.)] ,008 a. Not corrected for ties. b. Grouping Variable: Konsetrasi a 99 Mann-Whitney Test Ranks Konsetrasi Pertambahandaun N Mean Rank Sum of Ranks P1 5 8,00 40,00 P12 5 3,00 15,00 Total 10 Test Statistics b Pertambahandau n Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,619 Asymp. Sig. (2-tailed) ,009 Exact Sig. [2*(1-tailed Sig.)] ,008 a a. Not corrected for ties. b. Grouping Variable: Konsetrasi Mann-Whitney Test Ranks Konsetrasi Pertambahandaun N Mean Rank Sum of Ranks P1 5 8,00 40,00 P13 5 3,00 15,00 Total 10 Test Statistics b Pertambahandau n Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,627 Asymp. Sig. (2-tailed) ,009 Exact Sig. [2*(1-tailed Sig.)] ,008 a. Not corrected for ties. b. Grouping Variable: Konsetrasi a 100 Mann-Whitney Test Ranks Konsetrasi Pertambahandaun N Mean Rank Sum of Ranks P1 5 8,00 40,00 P14 5 3,00 15,00 Total 10 Test Statistics b Pertambahandau n Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,619 Asymp. Sig. (2-tailed) ,009 Exact Sig. [2*(1-tailed Sig.)] ,008 a a. Not corrected for ties. b. Grouping Variable: Konsetrasi 6.27 Analisis Statistik Pertambahan Tinggi One-Sample Kolmogorov-Smirnov Test Pertambahantingg Konsentrasi N Normal Parameters a,b Mean Std. Deviation Most Extreme Differences 70 70 232,1429 3,0000 111,57168 5,67678 Absolute ,086 ,216 Positive ,066 ,113 Negative -,086 Kolmogorov-Smirnov Z ,716 Asymp. Sig. (2-tailed) ,684 a. Test distribution is Normal. b. Calculated from data. Test of Homogeneity of Variances Pertambahantinggi i -,216 1,803 ,003 101 Levene Statistic df1 df2 9,116 13 Sig. 56 ,000 Kruskal-Wallis Test Ranks Konsentrasi Pertambahantinggi N P1 5 67,80 P2 5 55,10 P3 5 54,40 P4 5 55,40 P5 5 47,80 P6 5 40,20 P7 5 38,40 P8 5 37,30 P9 5 35,40 P10 5 18,10 P11 5 13,90 P12 5 12,70 P13 5 9,90 P14 5 10,60 Total 70 a,b Test Statistics Pertambahanting gi Chi-Square 59,745 Df Asymp. Sig. Mean Rank 13 ,000 a. Kruskal Wallis Test b. Grouping Variable: Konsentrasi Mann-Whitney Test Ranks 102 Konsentrasi Pertambahantinggi N Mean Rank Sum of Ranks P1 5 7,80 39,00 P2 5 3,20 16,00 Total Test Statistics 10 b Pertambahanting gi Mann-Whitney U 1,000 Wilcoxon W 16,000 Z -2,440 Asymp. Sig. (2-tailed) ,015 Exact Sig. [2*(1-tailed Sig.)] ,016 a a. Not corrected for ties. b. Grouping Variable: Konsentrasi Mann-Whitney Test Ranks Konsentrasi Pertambahantinggi N Mean Rank Sum of Ranks P1 5 8,00 40,00 P3 5 3,00 15,00 Total Test Statistics 10 b Pertambahanting gi Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,611 Asymp. Sig. (2-tailed) ,009 Exact Sig. [2*(1-tailed Sig.)] ,008 a. Not corrected for ties. b. Grouping Variable: Konsentrasi Mann-Whitney Test a 103 Ranks Konsentrasi Pertambahantinggi N Mean Rank Sum of Ranks P1 5 8,00 40,00 P4 5 3,00 15,00 Total Test Statistics 10 b Pertambahanting gi Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,619 Asymp. Sig. (2-tailed) ,009 Exact Sig. [2*(1-tailed Sig.)] ,008 a a. Not corrected for ties. b. Grouping Variable: Konsentrasi Mann-Whitney Test Ranks Konsentrasi Pertambahantinggi N Mean Rank Sum of Ranks P1 5 8,00 40,00 P5 5 3,00 15,00 Total Test Statistics 10 b Pertambahanting gi Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,619 Asymp. Sig. (2-tailed) ,009 Exact Sig. [2*(1-tailed Sig.)] ,008 a. Not corrected for ties. b. Grouping Variable: Konsentrasi a 104 Mann-Whitney Test Ranks Konsentrasi Pertambahantinggi N Mean Rank Sum of Ranks P1 5 8,00 40,00 P6 5 3,00 15,00 Total 10 b Test Statistics Pertambahanting gi Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,643 Asymp. Sig. (2-tailed) ,008 Exact Sig. [2*(1-tailed Sig.)] ,008 a a. Not corrected for ties. b. Grouping Variable: Konsentrasi Mann-Whitney Test Ranks Konsentrasi Pertambahantinggi N Mean Rank Sum of Ranks P1 5 8,00 40,00 P7 5 3,00 15,00 Total Test Statistics 10 b Pertambahanting gi Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,611 Asymp. Sig. (2-tailed) ,009 Exact Sig. [2*(1-tailed Sig.)] ,008 a 105 Mann-Whitney Test Ranks Konsentrasi Pertambahantinggi N Mean Rank Sum of Ranks P1 5 8,00 40,00 P8 5 3,00 15,00 Total Test Statistics 10 b Pertambahanting gi Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,619 Asymp. Sig. (2-tailed) ,009 Exact Sig. [2*(1-tailed Sig.)] ,008 a a. Not corrected for ties. b. Grouping Variable: Konsentrasi Mann-Whitney Test Ranks Konsentrasi Pertambahantinggi N Mean Rank Sum of Ranks P1 5 8,00 40,00 P9 5 3,00 15,00 Total Test Statistics 10 b Pertambahanting gi Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,611 Asymp. Sig. (2-tailed) ,009 Exact Sig. [2*(1-tailed Sig.)] ,008 a. Not corrected for ties. b. Grouping Variable: Konsentrasi a 106 Mann-Whitney Test Ranks Konsentrasi Pertambahantinggi N Mean Rank Sum of Ranks P1 5 8,00 40,00 P10 5 3,00 15,00 Total 10 Test Statistics b Pertambahanting gi Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,619 Asymp. Sig. (2-tailed) ,009 Exact Sig. [2*(1-tailed Sig.)] ,008 a a. Not corrected for ties. b. Grouping Variable: Konsentrasi Mann-Whitney Test Ranks Konsentrasi Pertambahantinggi N Mean Rank Sum of Ranks P1 5 8,00 40,00 P11 5 3,00 15,00 Total 10 Test Statistics b Pertambahanting gi Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,643 Asymp. Sig. (2-tailed) ,008 Exact Sig. [2*(1-tailed Sig.)] ,008 a 107 Test Statistics b Pertambahanting gi Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,643 Asymp. Sig. (2-tailed) ,008 Exact Sig. [2*(1-tailed Sig.)] ,008 a a. Not corrected for ties. b. Grouping Variable: Konsentrasi Mann-Whitney Test Ranks Konsentrasi Pertambahantinggi N Mean Rank Sum of Ranks P1 5 8,00 40,00 P12 5 3,00 15,00 Total 10 Test Statistics b Pertambahanting gi Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,643 Asymp. Sig. (2-tailed) ,008 Exact Sig. [2*(1-tailed Sig.)] ,008 a. Not corrected for ties. b. Grouping Variable: Konsentrasi a 108 Mann-Whitney Test Ranks Konsentrasi Pertambahantinggi N Mean Rank Sum of Ranks P1 5 8,00 40,00 P13 5 3,00 15,00 Total 10 Test Statistics b Pertambahanting gi Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,611 Asymp. Sig. (2-tailed) ,009 Exact Sig. [2*(1-tailed Sig.)] ,008 a a. Not corrected for ties. b. Grouping Variable: Konsentrasi Mann-Whitney Test Ranks Konsentrasi Pertambahantinggi N Mean Rank Sum of Ranks P1 5 8,00 40,00 P14 5 3,00 15,00 Total 10 Test Statistics b Pertambahanting gi Mann-Whitney U ,000 Wilcoxon W 15,000 Z -2,643 Asymp. Sig. (2-tailed) ,008 Exact Sig. [2*(1-tailed Sig.)] ,008 a. Not corrected for ties. b. Grouping Variable: Konsentrasi a