6 PROTEIN REKOMBINAN
advertisement

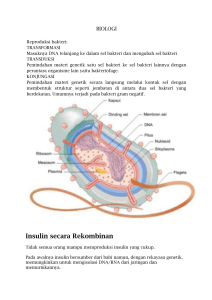
6 PROTEIN REKOMBINAN 6.1 PENDAHULUAN Protein adalah bahan yang paling penting dari semua bahan yang membentuk organisme hidup. Protein terkandung dalam setiap sel hidup pada semua organisme, tanpa pengecualian, dan di dalam sel, protein berada dalam jumlah yang sangat banyak dengan berbagai bentuk atau jenis. Semua karakteristik dari organisme ditentukan oleh aktivitas protein. 6.2 LATAR BELAKANG Dalam biologi molekuler, yang disebut “Central Dogma”, menyatakan bahwa informasi gen yang tersimpan di dalam DNA dipindahkan ke RNA dan kemudian dipindahkan ke protein. Proses transfer dari DNA ke RNA disebut proses transkripsi, sedangkan proses transfer dari RNA ke protein disebut proses translasi. Kode-kode gen dalam protein disebut gen struktural karena mereka bertanggung jawab untuk mengekspresikan informasi gen ke dalam unit struktural pada manusia, seperti warna mata, kulit dan rambut. 6.3 DEFINISI Rekombinan protein adalah suatu bentuk manipulasi dari protein, yang dihasilkan dalam berbagai cara untuk menghasilkan sejumlah besar protein, memodifikasi urutan gen dan memproduksi produk komersial yang bermanfaat. Pembentukan protein rekombinan dilakukan melalui perantara khusus yang dikenal sebagai vector. Teknologi rekombinan adalah proses yang terlibat dalam pembentukan protein rekombinan. 69 6.3.1 Rekombinasi Rekombinasi adalah suatu proses dimana suatu progeny (keturunan) dikembangkan menjadi kombinasi gen-gen yang berbeda dari gen-gen kedua orang tua nya, yang menghasilkan satu set DNA baru. Gambar 6.1. Penyilangan molekul DNA untuk menghasilkan protein rekombinan Ditunjukkan pada gambar 6.1 adalah proses dari rekombinasi protein, diadaptasi dari artikel dari Pusat Informasi Nasional Bioteknologi (NCBI). Istilah “protein” digunakan karena protein adalah struktur yang mendukung DNA dan merupakan blok bangunan materi hidup. Digunakan istilah “DNA rekombinan” untuk menggambarkan urutan DNA baru yang telah dihasilkan dari rekombinasi gen dari kedua orang tuanya. Proses rekombinan tersebut menjadi landasan terhadap kejadian evolusi dari makhluk hidup. 6.4 PROTEIN REKOMBINAN Teknologi DNA rekombinan adalah salah satu cara mempelajari fungsi dan interaksi dari protein. Hal ini dilakukan dengan mengisolasi urutan DNA target dan kemudian memindahkannya ke vektor kloning yang memiliki kemampuan untuk mereproduksi diri. Urutan DNA dari vektor kloning berinteraksi dengan DNA target dan menghasilkan cetak biru informasi gen baru yang disebut DNA rekombinan. DNA rekombinan tersebut ditransfer ke RNA, yang pada proses berikutnya menghasilkan protein rekombinan. 6.4.1 Produksi protein rekombinan Rekombinan DNA merupakan bidang ilmu pengetahuan yang hangat diperbincangkan yang berhubungan dengan pembuatan organisme – mulai dari bakteri hingga kambing -memproduksi protein yang biasanya tidak dihasilkan oleh suatu organisme. Penelitian di bidang ini telah menghasilkan berbagai macam aplikasi dimana pada beberapa tahun yang lalu masih belum memungkinkan. Penderita diabetes yang biasanya bergantung pada insulin 70 dari babi, dimana mirip dengan manusia tetapi tidak persis sama, sekarang dapat memiliki insulin dari manusia yang pada saat ini telah dapat diproduksi oleh bakteri. Penderita hemophilia dapat menggunakan faktor pembekuan yang telah diproduksi dalam susu kambing. Sementara ilmu pengetahuan yang kompleks, dapat diuraikan ke dalam konsep yang lebih sederhana. Gambar 6.2. Skema rekombinasi protein Dalam rangka untuk memahami bagaimana protein rekombinan dibuat, sebelumnya kita perlu memahami bagaimana semua protein dibentuk. DNA berada didalam inti sel, DNA memegang semua petunjuk yang diperlukan untuk membentuk suatu organisme. Seiring dengan itu rangkaian helai panjang dari DNA adalah suatu instruksi untuk terbentuknya berbagai protein. 6.4.2 Struktur DNA DNA adalah dasar genetik untuk semua makhluk hidup dan seluruh kehidupan pada dasarnya mempunyai struktur DNA yang sama. Untai panjang dari DNA pada dasarnya terdiri dari jutaan unit berulang yang disebut nukleotida. Setiap nukleotida memiliki tiga bagian: gula, gugus fosfat dan basa nitrogen. Struktur akhir DNA adalah dua helai yang terhubung di bagian tengah, mirip sebuah tangga atau tangga spiral. Masing-masing sisi terdiri dari fosfat dan gula yang berulang-ulang terus dan penghubung diantaranya terdiri dari dua basa nitrogen yang bergabung bersama-sama. Hanya ada empat basa nitrogen dan mereka direpresentasikan dengan kode-kode TCAG. Sebuah DNA dari organisme merupakan jutaan 71 basa-basa panjang tetapi urutan dari Ts, Cs, As dan Gs yang membuat kita mempunyai perbedaan satu dengan yang lainnya. 6.4.3 Struktur dan Fungsi protein DNA yang kita miliki menentukan dengan tepat bagaimana kita akan terlihat dan bagaimana setiap sifat yang kita miliki, tetapi semua DNA hanya merupakan kode-kode sederhana untuk protein-protein yang berbeda. Sebenarnya protein tersebut yang membuat kita menjadi bentuk seperti sekarang ini. Protein merupakan rangkaian rantai panjang dari asam amino sama seperti DNA yang juga merupakan rantai panjang dari nukleotida. Terdapat 20 asam amino pada keberadaan protein dan setiap organisme menggunakan 20 asam amino tersebut dalam kombinasi yang berbeda-beda untuk membentuk setiap protein . Urutan asam amino ini sangat penting karena urutan tersebut memberikan bentuk akhir dari protein. Bentuk dari protein sangat penting, hal tersebut memberikan karakteristik dari protein. Inilah sebabnya mengapa protein rekombinan sangat penting. Menggunakan insulin babi, yang memiliki struktur sedikit berbeda dengan insulin manusia, selalu berisiko karena beberapa orang akan menolaknya. Namun, insulin rekombinan mempunyai urutan asam amino yang persis sama seperti insulin manusia, kecuali yang dihasilkan oleh bakteri. Hanya karena bakteri memiliki kode genetik didalamnya tidak berarti bahwa bakteri akan segera memulai membuat suatu protein rekombinan. Para ilmuwan harus merekayasa bagian promotor untuk melampirkan kode yang diinginkan sebelumnya dan kemudian mereka dapat mengaktifkannya. Setelah semua ini ditambahkan ke dalam bakteri atau organisme lain, sel-sel mulai membuat protein baru, karena urutan dari asam amino yang sama maka produk protein akan 100% identik dengan sumbernya dank arena itu lebih aman untuk digunakan. 6.4.4 Pilihan host untuk amplifikasi protein Sistem host tersedia dalam beberapa bentuk termasuk fag, bakteri, ragi, tumbuhan, jamur berserabut, serangga atau sel mamalia yang tumbuh dalam kultur dan hewan transgenik. Pilihan terakhir dari host akan bergantung pada persyaratan yang spesifik dan aplikasi untuk protein rekombinan. Pemilihan host tidak hanya mempengaruhi amplifikasi dan isolasi dari protein, tetapi juga cara dimana produk kemudian dapat dimurnikan. Dalam rangka untuk memutuskan host mana yang paling cocok dalam jumlah dan tingkat kemurnian produk serta integritas biologis dan potensi toksisitas sebaiknya dipertimbangkan. Sebagai contoh, sistem 72 ekspresi bakteri tidak cocok jika modifikasi pasca-translasi diperlukan untuk menghasilkan produk rekombinan yang dapat berfungsi penuh. Lokasi produk dalam host akan mempengaruhi pilihan metode untuk isolasi dan pemurnian dari produk. Sebagai contoh, sebuah host bakteri dapat mensekresikan protein ke dalam media pertumbuhan, mentransportnya ke dalam ruang periplasmik atau menyimpannya sebagai badan inklusi yang tidak dapat larut dalam sitoplasma. Tabel 6.1. Keuntungan dan kerugian dalam pemilihan host Host Advantages Bacteria e.g.Escherichia coli Many references available Disadvantages and much experience No post-translational modification Wide choice of cloning vectors Gene expression easily controlled Biological activity and immunogenicity may differ from natural protein Easy to grow with high yields (product can form up to 50% of total cell protein) High endotoxin content in gram negative bacteria Product can be designed for secretion into the growth media Bacteria e.g. Staphylococcus aureus Secretes fusion proteins into the growth media Does not express such high levels as E. coli Pathogenic Mammalian cells Same biological activity as native proteins Cells can be difficult and expensive to grow Mammalian expression vectors available Cells grow slowly Can be grown in large scale cultures Manipulated cells can be genetically unstable Low productivity as compared to micro-organisms Yeasts Lacks detectable endotoxins Gene expression less easily controlled Generally Regarded As Safe (GRAS) Glycosylation not identical to mammalian systems Fermentation relatively inexpensive Facilitates glycosylation and formation of disulphide bonds Only 0.5% native proteins are secreted so isolation of secreted product is simplified Well established large scale production and downstream processing Cultured insect cells Baculovirus vector Many processing mechanisms similar to eukaryotic cells Lack of information on glycosylation mechanisms Safe, since few arthropods are adequate hosts for baculovirus Product not always fully functional Baculovirus vector received FDA approval for a clinical trial Few differences in functional and antigenic properties between product and native protein Virus stops host protein amplification. High level expression of product 73 Tabel 6.1. (Lanjutan) Keuntungan dan kerugian pemilihan host Host Advantages Fungi e.g.Aspergillus sp. Disadvantages Well established fermentation of filamentous fungi systems for High level of expression not yet achieved Growth inexpensive Genetics not well characterized A.niger is GRAS No cloning vectors available Can secrete large quantities of product into growth media, source of many industrial enzymes Plants Low transformation efficiency Long generation time 6.4.5 Pilihan Vektor Dalam rangka untuk mengkloning gen yang diinginkan semua vector yang telah direkayasa memiliki pilihan situs hilir restriksi unik dari urutan promotor transkripsi. Pilihan keluarga vector diatur oleh host/inang nya. Setelah host telah dipilih, berbagai macam vector yang berbeda dapat dipertimbangkan, dari ekspresi vector yang sederhana hingga vector yang mengeluarkan/mensekresikan protein fusi. Namun, seperti untuk pemilihan dari system host yang sesuai, pilihan terakhir dari vector harus mempertimbangkan persyaratan khusus dari aplikasi dan tentu saja akan dipengaruhi oleh perilaku dari protein target. Salah satu faktor kunci yang telah menyebabkan meningkatnya penggunaan vector protein fusi adalah amplifikasi dari protein fusi yang berisi tag dengan ukuran yang telah diketahui dan fungsi biologis sangat mudah untuk menyederhanakan isolasi, pemurnian dan selanjutnya deteksi. Dalam beberapa kasus hasil protein juga dapat ditingkatkan. Pemeliharaan dan protokol kloning sangat spesifik untuk setiap vector dan petunjuk yang diberikan oleh pemasok harus diikuti dengan hati-hati. Table 6.2. Memberikan tinjauan beberapa fitur amplifikasi fusi protein yang dapat mempengaruhi pilihan terakhir dari vektor. Advantages Fusion proteins Cell compartments can be targeted Disadvantages Tag may interfere with protein structure and affect folding and biological activity Provide a marker for expression Cleavage site is not always 100% specific if tag needs to be removed Simple purification using affinity chromatography under denaturing or non-denaturing conditions Easy detection 74 Refolding achievable on a chromatography column Ideal for secreted proteins as the product is easily isolated from the growth media Non- fusion proteins No cleavage steps necessary Purification and detection not as simple Problems with solubility may be difficult to overcome, reducing potential yield 6.4.6 Vektor untuk protein non-fusion Tabel 6.3. Menunjukkan contoh vektor non-fusion Vector family Comments pTrc 99 A Prokaryotic vector for expression of proteins encoded by inserts lacking a start codon, inducible by IPTG pKK223-3 For over-expression of proteins under the control of the strong tac promotor in prokaryotes pSVK 3 For in vivo expression in mammalian cell lines PSVL SV40 For high level transient expression in eukaryotic cells pMSG For inducible expression in mammalian cells 6.4.7 Vektor untuk protein fusi Tabel 6.4. Menunjukkan contoh dari vector untuk protein fusi bersama dengan produk pemurnian yang diperlukan. Vector family Tag Purification Products pGEX Glutathione S-transferase PQE 6 x Histidine pET 6 x Histidine GST MicroSpin™ Purification Module GSTrap™ Glutathione Sepharose™ Fast Flow His MicroSpin Purification Module HisTrap™ HiTrap™ Chelating Chelating Sepharose Fast Flow His MicroSpin Purification Module HisTrap HiTrap Chelating Chelating Sepharose Fast Flow pEZZ 18 (non-inducible expression) pRIT2T(expression inducible by temperature change) IgG binding domain of protein A IgG Sepharose 6 Fast Flow IgG binding domain of protein A IgG Sepharose 6 Fast Flow 75 6.4.8 Pilihan tag fusi Dua tag yang paling sering digunakan adalah glutathione S-transferase (GST tag) dan 6 x residu histidine (His)6 tag. Adapun pemilihan dari host dan vector, keputusan untuk menggunakan baik GST atau (His)6 tag harus dibuat sesuai dengan kebutuhan aplikasi spesifik Tabel 6.5. Menyoroti beberapa fitur kunci dari tag yang harus dipertimbangkan. GST tag Can be used in any expression system Purification procedure gives high yields of pure product Selection of purification products available for any scale pGEX6P PreScission™ protease vectors enable cleavage and purification in a single step Site-specific proteases enable cleavage of tag if required GST tag easily detected using an enzyme assay or an immunoassay Simple purification. Very mild elution conditions minimize risk of damage to functionality and antigenicity of target protein GST tag can help stabilize folding of recombinant proteins Fusion proteins form dimers (His)6 tag Can be used in any expression system Purification procedure gives high yields of pure product Selection of purification products available for any scale Small tag may not need to be removed e.g. tag is poorly immunogenic so fusion partner can be used directly as an antigen in antibody production Site-specific proteases enable cleavage of tag if required. N.B. Enterokinase sites that enable tag cleavage without leaving behind extra amino acids are preferable (His)6 tag easily detected using an immunoassay Simple purification, but elution conditions are not as mild as for GST fusion proteins. Purification can be performed under denaturing conditions if required. N.B. Neutral pH but imidazole may cause precipitation Desalting to remove imidazole may be necessary (His)6 - dihydrofolate reductase tag stabilizes small peptides during expression Small tag is less likely to interfere with structure and function of fusion partner Mass determination by mass spectrometry not always accurate for some (His)6 fusion proteins* 76 6.4.9 Penanganan badan inklusi Amplifikasi sering dapat dikendalikan sehingga protein rekombinan terakumulasi dalam ruang intraseluler atau disekresikan ke dalam ruang periplasmik. Sedangkan sekresi menguntungkan dari segi protein folding, kelarutan dan oksidasi sistein, hasilnya umumnya jauh lebih tinggi bila menggunakan ekspresi intraseluler. Namun demikian, protein rekombinan yang terakumulasi intrasel sering diatur dalam bentuk badan inklusi, agregat terlarut dari protein yang berkurang aktivitas biologisnya. Jadi, sementara kehadiran badan inklusi dapat membuat langkah awal dari isolasi menjadi sangat sederhana, isolasi protein dari badan inklusi sering menyebabkan kesulitan dengan lipatulang dari protein, mengembalikan reformasi yang benar dari ikatan disulfide dan dengan demikian terjadi pemulihan penuh aktivitas biologis. Tabel 6.6. Merangkum keuntungan dan kerugian dari bekerja dengan produk rekombinan yang dinyatakan sebagai badan inklusi. Advantages Disadvantages High expression levels can reduce fermentation costs Re-folding shifts difficulties and costs downstream Easily monitored by SDS-PAGE or immunoblotting Amplification cannot be monitored directly by functional assays Cytoplasmic proteins are easily washed away Minor contaminants are often hydrophobic, poorly soluble membrane proteins and cell wall fragments Major contaminants are oligomers and misfolded Can be difficult to separate multiple forms of the or proteolyzed forms of the protein same protein pL promoter with T induction often yields protein If the protein does not fold well, another expression where other systems fail system will be needed 6.5 APLIKASI Proses rekombinan protein digunakan untuk berbagai tujuan penelitian secara komersial, medis dan ilmiah. Dapat juga digunakan pada peternakan secara komersial untuk melawan penyakit pada ternak serta tanaman. Rekombinan protein mempunyai peran besar dalam penciptaan bahan terapeutik yang dapat memodifikasi dan memperbaiki kesalahan genetik, menghancurkan sel-sel kanker, mengobati gangguan system kekebalan tubuh, dan masih banyak fungsi-fungsi lainnya. 77 Sebagai contoh, Erythropoietin, sebuah protein hormone yang diproduksi dengan teknologi rekombinan dapat digunakan dalam merawat pasien dengan kekurangan/defisiensi eritrosit, yang merupakan penyebab umum dari komplikasi ginjal. Ada bidang medis yang disebut farmakologi rekombinan, dimana rekombinan protein digunakan untuk memproduksi pengobatan DNA yang diturunkan seperti interleukins; yang mengatur sel T, hormon pertumbuhan; digunakan untuk merangsang pertumbuhan, eritropoietin; yang merangsang produksi sel darah merah dalam sumsum tulang, dan insulin; digunakan untuk mengobati diabetes tipe 1. Protein rekombinan juga dapat digunakan di laboratorium sains untuk penelitian stem cell dan penelitian kloning. Di masa depan bioteknologi dapat menimbulkan peningkatan perkembangan dari organ manusia di laboratorium dan produksi dari tanaman yang dapat menghasilkan pestisida sendiri. Meskipun masih banyak perdebatan etis dan pertanyaan, teknologi rekombinan memiliki potensi untuk merevolusi produksi pangan, perawatan kesehatan dan proses penuaan. Protein Rekombinan di mulai dari pertama kali saat Insulin diproduksi oleh E. coli oleh Herbert Boyer di San Fransisco Amerika dibawah perusahaan Genentech Inc 1978. Peristiwa ini begitu mengagetkan dunia karena dengan keberhasilan produksi protein rekombinan tersebut merubah sebagian besar peta industri di dunia. Bayangkan sebelum dapat diproduksi oleh E. coli insulin didapatkan dengan cara membantai sekian ribu sapi dan babi, proses penjagalannya pun harus khusus demi menjamin kualitas insulin yang akan disolasi dari hewan ternak tersebut. Dengan keberhasilannya diproduksi pada E. coli maka ini akan mengurangi biaya produksi Insulin menjadi jauh dibawah prediksi sebelumnya. Escherichia coli adalah mikroorganisme yang paling terkait dengan berbagai bidang bioteknologi karena bakteri inilah organisme pertama yang dipelajari secara lengkap baik dari sisi metabolismenya, fisiologinya, regulasi genetikanya bahkan sampai sequence genomnya. Bukan hanya karena kemudahannya untuk di manipulasi akibat lengkapnya informasi tentang E.Coli melainkan juga karena kemudahannya untuk di kulturkan dan cepatnya proses pertumbuhannya berlangsung dibandingkan dengan berbagai macam organisme yang lain. Oleh karena itu E. Coli mendapatkan kehormatan menjadi organisme model yang cukup penting dalam dunia protein rekombinan. Proses regulasi gen yang telah lengkap dipelajari dan telah banyak dimanipulasi telah menyebabkan E. coli menjadi organisme model yang paling banyak mempunyai variasi pilihan untuk dijadikan host dalam proses produksi protein rekombinan 78 6.6 INSULIN REKOMBINAN Para peneliti membuat insulin manusia rekombinan dengan struktur yang identik denganinsulin manusia menggunakan vektor bakteri E. coli yang telah dilemahkan. Gambar 6.3. Bakteri Escherichia coli yang digunakan sebagai hospes pembuatan protein rekombinan 6.6.1 Bakteri Gram negatif, E. coli, penghuni alami saluran pencernaan manusia Sejak Banting dan Best menemukan hormon insulin pada tahun 1921, pasien diabetes mellitus yang mengalami peningkatan kadar gula darah disebabkan gangguan produksi insulin, telah diterapi dengan menggunakan insulin yang berasal dari kelenjar pankreas hewan. Meskipun insulin sapi dan babi mirip dengan insulin manusia, namun komposisinya sedikit berbeda. Akibatnya, sejumlah sistem kekebalan tubuh pasien menghasilkan antibodi terhadap insulin babi dan sapi yang berusaha menetralkan dan mengakibatkan respon inflamasi pada tempat injeksi. Selain itu efek samping dari insulin sapi dan babi ini adalah kekhawatiran adanya komplikasi jangka panjang dari injeksi zat asing yang rutin. Faktor-faktor ini menyebabkan peneliti mempertimbangkan untuk membuat Humulin dengan memasukkan gen insulin ke dalam vektor yang cocok, yaitu sel bakteri E. coli, untuk memproduksi insulin yang secara kimia identik dan dapat secara alami diproduksi. Hal ini telah dicapai dengan menggunakan teknologi DNA rekombinan. 79 6.6.2 Struktur insulin Secara kimia, insulin adalah protein kecil sederhana yang terdiri dari 51 asam amino, 30 di antaranya merupakan satu rantai polipeptida, dan 21 lainnya yang membentuk rantai kedua. Kedua rantai dihubungkan oleh ikatan disulfida. Gambar 6.4. Struktur protein insulin manusia Kode genetik untuk insulin ditemukan dalam DNA di bagian atas lengan pendek dari kromosom kesebelas yang berisi 153 basa nitrogen (63 dalam rantai A dan 90 dalam rantai B). DNA yang membentuk kromosom, terdiri dari dua heliks terjalin yang dibentuk dari rantai nukleotida, masing-masing terdiri dari gula deoksiribosa, fosfat dan nitrogen. Ada empat basa nitrogen yang berbeda yaitu adenin, timin, sitosin dan guanin. Sintesis protein tertentu seperti insulin ditentukan oleh urutan dasar tersebut yang diulang. 6.6.3 Proses produksi Escherrichia coli (E. coli), penghuni saluran pencernaan manusia, adalah „pabrik‟ yang digunakan dalam rekayasa genetika insulin. Ketika bakteri berreproduksi, gen insulin direplikasi bersama dengan plasmid. E. coli seketika memproduksi enzim yang dengan cepat mendegradasi protein asing seperti insulin. Hal tersebut dapat dicegah dengan cara menggunakan E. coli strain mutan yang sedikit mengandung enzim ini. Pada E. coli, Bgalaktosidase adalah enzim yang mengontrol transkripsi gen. Untuk membuat bakteri memproduksi insulin, gen insulin perlu terikat pada enzim ini. 80 Gambar 6.5. Skema pembuatan insulin rekombinan Enzim restriksi secara alami diproduksi oleh bakteri. Enzim restriksi bertindak seperti pisau bedah biologi, hanya mengenali rangkaian nukleotida tertentu, misal salah satunya rangkaian kode untuk insulin. Hal tersebut memungkinkan peneliti untuk memutuskan pasangan basa nitrogen tertentu dan menghapus bagian DNA yang berisi kode genetik dari kromosom sebuah organisme sehingga dapat memproduksi insulin. Sedangkan DNA ligase adalah suatu enzim yang berfungsi sebagai perekat genetik dan pengelas ujung nukleotida. Gambar 6.6. Skema kerja enzim restriksi endonuklease 81 Langkah pertama pembuatan humulin adalah mensintesis rantai DNA yang membawa sekuens nukleotida spesifik yang sesuai karakteristik rantai polipeptida A dan B dari insulin. Urutan DNA yang diperlukan dapat ditentukan karena komposisi asam amino dari kedua rantai telah dipetakan. Enam puluh tiga nukleotida yang diperlukan untuk mensintesis rantai A dan sembilan puluh untuk rantai B, ditambah kodon pada akhir setiap rantai yang menandakan pengakhiran sintesis protein. Antikodon menggabungkan asam amino, metionin, kemudian ditempatkan di setiap awal rantai yang memungkinkan pemindahan protein insulin dari asam amino sel bakteri itu. „Gen‟ sintetik rantai A dan B kemudian secara terpisah dimasukkan ke dalam gen untuk enzim bakteri, B-galaktosidase, yang dibawa dalam plasmid vektor tersebut. Pada tahap ini, sangat penting untuk memastikan bahwa kodon gen sintetik kompatibel dengan Bgalaktosidase. Plasmid rekombinan tersebut kemudian dimasukkan ke dalam sel E. coli. 6.7. Mikroskopis plasmid E. coli dengan mikroskop elektron Praktis penggunaan teknologi DNA rekombinan dalam sintesis insulin manusia membutuhkan jutaan salinan plasmid bakteri yang telah digabungkan dengan gen insulin dalam rangka untuk menghasilkan insulin. Gen insulin diekspresikan bersama dengan sel mereplikasi galaktosidase-B di dalam sel yang sedang menjalani mitosis. 82 6.8. Skema pembentukan insulin rekombinan pada kultur E. coli Protein yang terbentuk, sebagian terdiri dari B-galaktosidase, bergabung ke salah satu rantai insulin A atau B. Rantai insulin A dan rantai B kemudian diekstraksi dari fragmen Bgalaktosidase dan dimurnikan. Gambar 6.9. Struktur beta galaktosidase rantai A dan rantai B yang telah dimurnikan Kedua rantai dicampur dan dihubungkan kembali dalam reaksi yang membentuk menghasilkan jembatan Humulin silang murni disulfida, (insulin manusia sintetis). Gambar 6.10. ikatan disulfida yang terbentuk pada dua rantai protein insulin A dan B 83 6.6.4 Implikasi biologis dari rekayasa genetika Humulin rekombinan Humulin merupakan protein hewani yang dibuat dari bakteri sedemikian rupa sehingga strukturnya benar-benar identik dengan molekul alami. Hal ini akan mengurangi kemungkinan komplikasi yang disebabkan produksi antibodi oleh tubuh manusia. Dalam studi kimia dan farmakologi, insulin rekombinan DNA manusia yang diproduksi secara komersil telah terbukti bisa dibedakan dari insulin pankreas manusia. Awalnya, kesulitan utama yang dihadapi adalah kontaminasi produk akhir oleh sel inang, sehingga meningkatkan resiko kontaminasi dalam kaldu fermentasi. Bahaya ini diatasi dengan ditemukannya proses pemurnian. Ketika dilakukan tes pada produk akhir insulin, termasuk teknik terbaik radio-immuno assay, tidak ada „kotoran‟ yang terdeteksi. Seluruh prosedur, sekarang dilakukan dengan menggunakan sel ragi sebagai media pertumbuhan, karena sel ragi dapat menghasilkan sebuah molekul insulin manusia yang hampir lengkap dengan struktur tiga dimensi yang sempurna. Ini meminimalkan kebutuhan untuk prosedur pemurnian kompleks dan mahal. 6.7. Hormon Pertumbuhan rekombinan untuk memacu pertumbuhan ikan gurame (Osphronemus gouramy) Ikan gurame (Osphronemus gouramy) merupakan salah spesies target revitalisasi perikanan untuk tujuan konsumsi dalam negeri, yang diharapkan produksinya terus meningkat setiap tahun. Target produksi ikan gurame nasional tahun 2007 belum tercapai (Nurdjana, 2008). Rendahnya kualitas benih dan pakan yang digunakan petani ikan diduga merupakan faktor utama penyebab target produksi nasional tersebut tidak terealisasi. Kualitas benih ikan dapat ditingkatkan melalui aplikasi metode selektif breeding, hibridisasi, poliploidisasi (triploidisasi), dan transgenesis. Namun demikian, teknik pemijahan ikan gurame secara terkontrol/buatan sebagai prasyarat bagi teknologi-teknologi tersebut belum tersedia. Pendekatan lain yang bisa digunakan untuk memacu pertumbuhan ikan gurame adalah pemberian pakan berkualitas tinggi; kadar protein tinggi. Pakan buatan untuk memacu pertumbuhan ikan gurame mulai dari benih hingga untuk pembesaran disarankan menggunakan kadar protein tinggi, 33,9-43,3% (Mokoginta et al., 1994). Persentase kadar protein yang cukup tinggi tersebut, diduga menjadi salah satu penyebab petani kurang tertarik untuk menggunakannya, karena pakan yang memiliki protein tinggi adalah lebih mahal dibandingkan dengan pakan dengan kandungan protein rendah. Umumnya petani memberi makan ikan gurame berupa pakan buatan yang mengandung protein <30% atau dengan daun talas saja. Pakan dengan kadar protein rendah, sekitar 28%, 84 yang ditambahkan bahan stimulan pemacu pertumbuhan ikan, atau pemberian pakan alami diperkaya dengan bahan stimulan tersebut diduga menjadi alternatif untuk mengatasi masalah rendahnya kecepatan tumbuh ikan gurame. 6.8. REFERENSI 1. 2. 3. 4. 5. 6. 7. Anonim, The Recombinant Protein Handbook, Protein Amplification and Simple Purification, Edition AA, Amersham Pharmacia Biotech, page 6-8; 57 http://www.dnassequencing.com/category/recombinant-protein-images/ Kayser, O., dan Muller, R.H. (2004). Pharmaceutical Biotechnology; Drug Discovery and Clinical Applications. Willey-VCH: German. Production of Recombinant Protein, http://www.ehow.com/about_5366348_productionrecombinant-protein.html Recombinant Protein Definition, http://www.ehow.com/about_5407160_recombinant-proteindefinition.html Sudjadi. (2008). Bioteknologi Kesehatan. Kanisius: Yogyakarta. 151-178. What Are Recombinant Proteins?, http://www.ehow.com/info_8131260_recombinantproteins.html 85