coordination compounds
advertisement

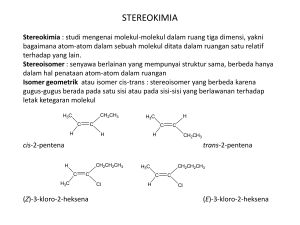
COORDINATION COMPOUNDS Coordination Compounds (senyawa koordinasi) adalah senyawa yang mengandung paling tidak satu ion komplek, yang merupakan jenis kation logam pusat(baik pada logam transisi ataupun golongan logam utama) yang terikat dengan molekul dan atau anion yang disebut ligan. Untuk mencapai netral dalam ikatan koordinasi,ion komplek biasanya bergabung dengan ion lainnya,yang disebut Counter Ions(ion yang berlawanan jenis). Gambar 23.9 Bagian dari Coordination Compound. Terdiri dari model (atas), gambar komplek (tengah), dan rumus kimia (bawah), biasanya mengandung ion kompleks dan counter ions untuk menetralkan. Ion kompleks punya logam pusat yang dikelilingi oleh ligand. Ketika [Co(NH3)6]Cl3 dilarutkan, ion kompleks dan counter ion akan berpisah,tetapi ligan tetap berikatan dengan ion logam. Enam ligan disekitar ion logam memberikan ion kompleks bentuk geometri octahedral. Ion kompleks dengan pusat dB sebagai ion logam punya empat ligan dan bentuk geometri square planar. Beberapa coordination compound ada di gambar 23.9A Senyawa koordinasinya adalah [Co(NH3)6]CI3, ion komplek (selalu di dalam kurung siku) adalah [Co(NH3)6]3+,enam molekul NH3 yang berikatan dengan atom pusat Co3+ adalah ligan, dan 3 Cl- adalah counter ion. Coordination compound memiliki sifat seperti elektrolit dalam air. Ion komplek dan counter ion saling berpisah satu sama lain. Dalam gambar 23.9A ditunjukkan 1 mol dari [Co(NH3)6]CI3 menghasilkan 1 mol ion [Co(NH3)6]3+ dan 3 mol ion Cl- . Ion Kompleks, Bilangan Koordinasi, Bentuk Geometri, dan Ligan Ion komplek yaitu hubungan ion logam dengan jumlah dan jenis dari ligan yang berikatan dengannya. Strukturnya memiliki 3 karakteristik ,yaitu bilangan koordinasi , bentuk geometri, dan jumlah atom yang diberikan oleh setiap ligan. Bilangan koordinasi : jumlah atom ligan yang berikatan langsung dengan ion atom pusat. Bilangan koordinasi dari ion Co3+ di [Co(NH3)6]3+ adalah 6 karena enam atom ligan (N dari NH3) berikatan dengannya. Bilangan koordinasi dari ion Pt2+ di berbagai kompleksnya adalah 4, dan ion Pt4+ di kompleksnya adalah 6. Tembaga (II) punya banyak bilangan koordinasi,yaitu 2,4, atau 6 di ion komplek yang berbeda. Secara umum,bilangan koordinasi yang paling sering ditemui di ion kompleks adalah 6. Geometri : bentuk ion komplek yang bergantung pada bilangan koordinasi dan sifat alami dari ion logam itu sendiri. Tabel 23.6 menunjukkan bentuk geometri dengan bilangan koordinasi 2,4,dan 6. Ion komplek dengan ion logam yang bilangan koordinasinya 2, seperti [Ag(NH3)2]+, adalah linear. Bilangan koordinasi 4 menghasilkan 2 bentuk seperti square planar atau tetrahedral. Kebanyakan ion logam d8 membentuk ion kompleks square planar, seperti pada gambar 23.9B. ion d10 membentuk ion kompleks tetrahedral. Bilangan koordinasi 6 menghasilkan bentuk octahedral seperti pada contoh [Co(NH3)6]3+ di gambar 23.9A. Atom yang diberikan oleh setiap ligan. Ligan dari ion komplek adalah molekul atau anion dengan 1 atau lebih atom yang setiap pemberian memberikan pasangan elektron ke ion logam dan membentuk ikatan kovalen. Mereka mempunyai setidaknya satu pasangan, donor atom yang lebih sering datang dari golongan 5A(15),6A(16), atau 7A(17). Ligan dibagi berdasarkan jumlah atom yang diberi dan dipakai berikatan dengan ion logam pusat. Monodentat,seperti Cl- dan NH3 yaitu ligan yang memberikan satu atom. Bidentat,yaitu ligan yang memberikan 2 atom, yang masing-masing berikatan dengan ion logam. Polidentat memberikan lebih dari 2 atom. Seperti pada table 23.7,menunjukkan beberapa ligan yang umum dijumpai di coordination compounds. Rumus dan Cara Penamaan Coordination Compound Ada 3 aturan penting untuk menuliskan rumus dari coordination compound. 1. Kation dituliskan sebelum anion. 2. Muatan dari kation diseimbangkan dengan muatan dari anion. 3. Dalam ion kompleks, ligan netral dituliskan sebelum ligan anion dan rumus dari semua ion di tempatkan di dalam kurung siku. Seluruh ion kompleks mungkin saja kation atau anion. Kompleks kation punya anion sebagai counter ionnya. Dan kompleks anion punya kation sebagai counter ionnya. Untuk menemukan muatan dari ion logam sebagai contoh dalam K2[Co(NH3)2CI4], 2K+ sebagai counter ion menyeimbangkan muatan kompleks anion [Co(NH3)2CI4]2- yang punya 2 molekul NH3 dan 4 ion Cl- sebagai ligannya. 2 NH3 netral, dan 4 Clmempunyai muatan total 4-,dan dari seluruh ion kompleks punya muatan 2-. Jadi ion logam pusat seharusnya Co2+. Muatan ion kompleks = muatan ion logam + jumlah muatan semua ligan 2- = muatan ion logam + [(2x0) + (4x1-)] Jadi, muatan ion logam = (2-) - (4-) = 2+ Kebanyakan coordination compound dinamakan berdasarkan sistem yang menggunakan beberapa peraturan seperti di bawah ini: 1. kation dinamakan sebelum anion. Dalam penamaan [Co(NH3)4Cl2]Cl sebagai contohnya, kita namakan ion [Co(NH3)4Cl2]+ sebelum ion Cl-. Sehingga namanya adalah tetraamindiklorocobalt(III) klorida. Spasi yang memisahkan kation dan anion. 2. Didalam ion kompleks, ligan dinamakan dari urutan alphabet sebelum ion logam. Catatan bahwa ion [Co(NH3)4Cl2]+ dinamakan dalam peraturan ke 1, 4 NH3 dan 2 CL- dinamakan sebelum Co3+. Karena dia mempunyai 6 donor atom,maka ion etilendiamintetraasetat (EDTA4-) mempunyai kompleks yang sangat stabil dengan berbagai ion logam. Sifat ini membuat EDTA sangat berguna untuk logam berat yang beracun. Setelah dimasukkan ke tubuh pasien, ion akan berperan menghilangkan timbale dan logam berat lainnya dari darah dan cairan tubuh lainnya 3. ligan netral mempunyai nama molekul, tetapi ada beberapa pengecualian (tabel 23.8). ligan anion berakhiran –ida dan ditambahkan –o pada akhir nama. Sebagai contoh nama flourida dari ion F– yang menjadi ligan bernama flouro.2 ligan di [Co(NH3)4Cl2]+ adalah ammina (NH3) dan kloro (Cl-) dengan ammina dinamakan terlebih dahulu sebelum kloro secara alphabet. 4. numerical prefix menunjukkan jumlah dari ligan. Tetraammina menyumbangkan 4 NH3 ,dikloro menyumbangkan 2 Cl-. Aturan ini tidak mempengaruhi urutan alphabet , sehingga tetraammine tetap dinamakan sebelum dikloro. Beberapa nama ligan sudah mempunyai numerical prefix,seperti etilendiamin, kita gunakan bis(2),tris(3),atau tetrakis(4) untuk menunjukkan jumlah ligan. 5. bilangan oksidasi dari ion logam pusat ditulis dalam bilangan romawi hanya saat ion logam punya lebih dari 1bilangan. 6. jika ion kompleksnya anion, diberi tambahan nama pada akhir logam –ate. Seperti K[Pt(NH3)Cl5] adalah potassium amminapentakloroplatinate (IV). Untuk beberapa logam,digunakan akhiran Latin dengan –ate pada akhirnya,ditunjukkan pada tabel 23.9. CONTOH MASALAH 23.3 MENULISKAN NAMA DAN RUMUS COORDINATION COMPOUND Masalah : (a) Apa nama dari Na3[AlF6]? (b) Apa nama dari [Co(en)2Cl2]NO3? (c) Apa rumus dari tetraamminbromokloroplatinum(IV) klorida? (d) Apa rumus dari hexaammincobalt(III) tetrakloroferrat(III)? Rencana permasalahan: Gunakan peraturan yng terdapat di tabel 23.8 dan 23.9 Penyelesaian : (a) Ion kompleksnya adalah [AlF6]- . terdapat 6 F- sebagai ligan sehingga menjadi hexaflouro. Ion kompleksnya adalah anion,sehingga akhiran logam dirubah menjadi –ate,hexaflouroaluminate. Alumunium hanya punya 1 bilangan oksidasi,yaitu +3 sehingga tidak digunakan aturan Roman Numerical. Ion counter positif dinamakan pertama dan diberi spasi,sehingga namanya menjadi sodium hexaflouroaluminate. (b) disusun secara alfabetis, ada 2 ion Cl- dan 2 en [dikloro dan bis(etilendiammine)] sebagai ligan. Ion kompleksnya positif,sehingga nama logam tetap. Tetapi kita harus menentukan bilangan oksidasinya karena Co punya beberapa. Ada 1 NO3- menyeimbangkan muatan +1. Dengan 2- dari 2 Cl- dan 0 dari 2 en, logam nya menjadi Co(III). Sehingga namanya menjadi diklorobis(etilendiamin)cobalt(III) nitrate. (c) Ion logam pusat ditulis pertama. Diikuti oleh ligan netral lalu ligan negatif yang telah diurutkan sesuai alphabet . tetraammin menunjukkan 4NH3, bromo menunjukkan 1 Br-,kloro menunjukkan 1 Cl-, dan platinum(IV) adalah Pt4+. Jadi ion kompleksnya adalah [Pt(NH3)4BrCl]2+ . muatan +2 berasal dari penjumlahan 4+ dari Pt4+ ,0 dari 4 NH3, 1- dari Br-, 1- dari Cl-, untuk menyeimbangkan muatan jadi ditambahkan 2 counter ion Cl-. > [Pt(NH3)4BrCl]Cl2. (d) Ikatan ini terdiri dari 2 ion kompleks yang berbeda. Di kation, hexaammine=6NH3,cobalt(III)=Co3+,jadi kationnya adalah [Co(NH3)6]3+. Muatan 3+ berasal dari jumlah 3+ dari Co3+ dan 0 dari 6 NH3. Di anion, tetrakloro=4Cl-,dan ferrat(III)=Fe3+. Jadi anionnya adalah [Fe(Cl)4]-. 1- berasal dari jumlah 3+ dari Fe3+ dan 4dari 4Cl-. Untuk membentuk ikatan netral, satu kation 3+ diseimbangkan dengan 3 anion 1-. >[Co(NH3)6][Fe(Cl)4]3. Alfred Werner dan Teori Koordinasi Coordination Compound ditemukan 200 tahun yang lalu oleh seorang ahli kimia muda asal Swiss bernama Alfred Werner yang dimulai pada 1980an. Dia meneliti berbagai jenis ikatan seperti jenis cobalt seperti pada tabel 23.10. Seperti yang bisa dilihat, data percobaan Werner menunjukkan jika total ligan yang ada tetap sama dalam setiap ikatannya, walaupun jumlah ion Cl- dan molekul NH3 berbeda di setiap ion kompleksnya. Sebagai contoh pada ikatan 3+ pertama[Co(NH3)6]Cl3,secara total mempunyai 4 ion, 1 pada [Co(NH3)6] dan 3 pada Cl-. Semua ion Cl- bebas membentuk AgCl . pada ikatan terakhir, [Co(NH3)Cl3] tidak punya ion yang terpisah. Alfred Werner mendapatkan Nobel pada 1913 di bidang kimia. Isomer dalam Coordination Compounds Isomer adalah ikatan antara rumus kimia yang sama namun berbeda propertinya. Figur 23.10 menunjukkan secara singkat jenis isomer di Coordination Compounds yang paling umum. Constitusional (struktur) isomers: Atom yang sama tersambung secara berbeda Dua buah ikatan dengan rumus yang sama, tetapi dengan atom yang tersambung berbeda, disebut dengan constitusional (struktur) isomer. 1. Coordination isomer, terjadi saat komposisi suatu ion kompleks berubah bukan pada ikatannya. Salah satu cara isomer ini bisa terjadi ketika ligan dan counter ion bertukar tempat. Seperti pada [Pt(NH3)4Cl2](NO2)2 dan [Pt(NH3)4(NO2)2]Cl2. Pada ikatan pertama, ion Cl- adalah ligan, dan ion NO2- adalah counter ion. Pada ikatan kedua,terjadi perpindahan tempat. Cara lain isomer ini bisa terjadi yaitu pada ikatan 2 ion kompleks dimana 2 set ligan di 1 ikatan saling bertukar. 2. Linkage isomer, terjadi ketika komposisi dari ion kompleks tetapi penempatan ligan dari donor atom berubah. Contoh, ion nitrit bisa mengikat pasangan N atom manapun. (nitro,O2N:) atau 1dari atom O,(nitrito,ONO:), untuk memberikan linkage isomer. Seperti pada ikatan pentaamminnitrocobalt(III) klorida [Co(NH3)5(NO2)]Cl2 (kiri) yang berwarna orange dan linkage isomer pentaamminnitritocobalt(III) klorida [Co(NH3 )5(ONO)]CI2 (kanan)yang berwarna merah. Stereoisomer : Pengurutan Spatial atom yang berbeda Stereoisomer adalah ikatan yang punya koneksi atomic yang sama tetapi pengurutan spatial atom yang berbeda.Terdiri dari,isomer geometri dan isomer optik. 1. Isomer geometri (juga disebut isomer cis-trans dan kadang diastereomers) terjadi ketika atom atau kumpulan atom diurutkan Figur 23.11 Geometrik (cis-trans) Isomer. secara berbeda ke ion logam pusat. A. cis dan trans isomer pada square planar Sebagai contoh, square planar coordination compound [Pt(NH3)2Cl2] [Pt(NH3)2Cl2] punya dua pengurutan, B. cis dan trans isomers pada ion kompleks octahedral [Co(NH3)4Cl2]+. Warna pada bentuk yang menjadikan 2 ikatan berbeda. menunjukkan warna asli pada jenis tersebut. I Isomer dengan ligan yang saling bersebelahan adalah cis-diammindikloroplatinum(II) (gambar A). dan isomer dengan ligan yang saling berseberangan adalah transdiammindikloroplatinum(II). Sifat dari keduanya akan berbeda. Octahedral kompleks juga terdiri dari cis-trans isomer. Cis isomer dari ion [Co(NH3)4Cl2]+ punya 2 ligan Cl- yang saling bersebelahan dan berwarna violet. Sedangkan trans isomer mempunyai dua ligan yang saling bersebrangan dan menghasilkan warna hijau. Antikanker geometri isomer Pada pertengahan 2. Isomer optic (disebut juga enantiomers) terjadi ketika molekul 1960,Barnett Rosenberg dan dan bayangan gambarnya tidak bisa superimposed. isomer temannya menemukan bahwa cis-[Pt(NH3)2Cl2] anti tumor optic diidentifikasi secara fisik dalam segala cara,kecuali satu, agen yang sangat efektif . arah dimana mereka berotasi. Ion Octahedral kompleks isomer geometri, trans[Pt(NH3)2Cl2], tidak punya menunjukkan banyak contoh dari isomer optic. Seperti contoh efek antitumor. Cisplastin + pada figur 23.12A, dua struktur (I dan II) dari [Co(en)2Cl2] , mungkin bekerja dengan diselipkan dengan DNA sel cis-diklorobis(etilendiamin)cobalt(III),merupakan bayangan kanker double helix, yang dari yang lainnya. Putar struktur I 180o vertical axis dan akan menyebabkan donor atom menggantikan ligan Cl- dan ditemukan III. Ligan Cl- pada III cocok dengan II, tetapi ligan mengikat platinum(II) dengan en tidak. II dan III (rotasi I) bukan superimposable, mereka kuat,mencegah replikasi DNA masih isomer optic. Salah satu isomer ditunjukkan sebagai d- [Co(en)2Cl2]+ dan yang lainnya adalah l-[Co(en)2Cl2]+ tergantung dari mana berotasi ke kanan (d- untuk “dekstro”) atau ke kiri (l- untuk “levo” ). Pada figur 23.12B, dua struktur dari transdiklorobis(etilendiammin)cobalt(III) ion bukanlah isomer optic. Putar I 90o sekitar vertikal axis dan akan ditemukan III, yang merupakan superimposable dari II. Figur 23.12 A. Struktur I dan bayangannya,struktur II,adalah isomer optic dari cis-[Co(en)2Cl2]+ . rotasi struktur I menghasilkan struktur III,yang tidak sama dengan struktur II B. trans isomer tidak punya isomer optic. Rotasi dari struktur I menghasilkan struktur III, yang merupakan sama dengan struktur II,bayangan dari struktur I Aplikasi Teori Ikatan Valensi ke Ion Kompleks Figure 23.13 hybrid orbital dan ikatan di octahedral [Cr(NH3)6]3+ a. ikatan valensi pada ion [Cr(NH3)6]+ b. diagram orbital parsial menunjukkan pencampuran dari dua 3d,satu 4s, dan tiga 4p orbital di Cr3+ untuk membentuk enam d2sp3 orbital hybrid, yang terisi dengan enam pasang NH3 (merah) Teori Ikatan valensi, yang membantu menjelaskan ikatan dan struktur dari ikatan golongan utama, juga digunakan untuk menjelaskan ikatan pada ion kompleks. Dalam pembentukan ion kompleks, ligan mengisi orbital mendahului orbital ion logam yang kosong. Ligan (basa lewis) memberikan pasangan electron dan ion logam (asam lewis) menerimanya untuk membentuk suatu ikatan kovalen dalam ion kompleks. (lewis adduct). Ikatan seperti itu, dimana satu atom dalam suatu ikatan memberikan semua elektronnya disebut coordinate covalent bond, meskipun setelah terbentuk mereka mirip seperti ikatan kovalen yang lainnya. CONTOH MASALAH 23.4 MENENTUKAN JENIS DARI STEREOISOMER Masalah: Gambar semua stereoisomer untuk setiap jenis isomer dibawah ini: (a) [Pt(NH3)2Br2](square planar) (b)[Cr(en)3]3+ (en=H2NCH2CH2NH2) Rencana penyelesaian: Pertama tentukan geometri dari setiap ion logam dan sifat dari ligan. Jika terdapat 2 ligan yang berbeda yang bisa ditempatkan di posisi yang berbeda,maka isomer geometri (cis-trans) bisa terjadi. Lalu kita liat apaah bayangan dari isomer itu superimposable terhadap yang asli. Jika tidak, isomer optic yang terjadi. Penyelesaian: (a) kompleks Pt(II) adalah square planar dan terdapat 2 monodentat ligan. Setiap pasangan ligan bisa berpindah bersebelahan ataupun berseberangan,sehingga isomer geometri terjadi dan setiap isomer superimposable terhadap bayangannya,sehingga tidak ada isomer optic. (b) etilendiamin (en) adalah ligan bidentat. Cr3+ punya bilangan koordinasi 6 dan octahedral geometri. Tiga bidentat ligan adalah identik sehingga tidak ada isomer geometri . ion kompleksnya tidak mempunyai bayangan superimposable, sehingga isomer optic terjadi. Kompleks octahedral ,ion hexaamminchromium(III) [Cr(NH3)6]3+ menggambarkan aplikasi dari valence bond (VB) teori untuk octahedral kompleks (figure 23.13). enam orbital dengan energy terendah dari ion Cr3+ -dua 3d,satu 4s, dan tiga 4p- bersatu dan membentuk eqivalen d2sp3 hybrid orbital. Enam molekul NH3 memberikan pasangan electron yang berasal dari nitrogen untuk membentuk enam ikatan logam-ligan. Tiga 3d yang tidak berpasangan dari ion Cr3+ pusat ([Ar]3d3), yang akan membentuk ion kompleks bersifat paramagnetic, tetap pada unhybridized orbital. Kompleks square planar, ion logam dengan konfigurasi d8 biasanya akan membentuk kompleks square planar(figur 23.14). pada ion [Ni(CN)4]2- sebagai contoh, model terdiri dari satu 3d,satu 4s, dan dua 4p orbital dari Ni2+ bergabung dan membentuk empat dsp2 hybrid orbital yang menerima satu pasangan electron dari setiap ligan CN-. Figur 23.14 Hybrid orbital dan ikatan pada square planar ion [Ni(CN)4]2A. ikatan valensi pada [Ni(CN)4]2B. dua pasang 3d electron berpasangan dan membebaskan satu 3d orbital untuk hybridisasi dengan 4s dan dua 4p orbital untuk membentuk empat dsp2 orbital yang menjadi pasangan dari empat ligan CN- (merah) Kompleks tetrahedral, ion logam yang sudah mengisi d sublevel, seperti Zn2+ ([Ar]3d10) , sering membentuk kompleks tetrahedral (figure 23.15). Figur 23.15 hybrid orbital dan ikatan pada tetrahedral ion [Zn(OH)4]2A. ikatan valensi pada [Zn(OH)4]2B.gabungan satu 4s dan tiga 4p orbital memberikan empat sp3 hybrid orbital yang tersedia untuk menerima pasangan dari ligan OH- (merah) Mengapa setiap substansi memiliki warna? Cahaya putih adalah radiasi elektromagnetik yang mengandung semua panjang gelombang (lamda). Cahaya putih bisa terdispersi menjadi spectrum warna, yang masing-masing mempunyai jarak panjang gelombang. Suatu objek terlihat berwarna pada cahaya putih karena mereka menyerap berbagai panjang gelombang dan memantulkannya. Jika suatu objek menyerap semua panjang gelombang yang terlihat, maka warnanya menjadi hitam, sebaliknya jika memantulkan semua maka warna yang terlihat adalah putih. Setiap warna mempunyai warna komplemen. Sebagai contoh hijau dan merah adalah warna komplemen. Gabungan dari warna komplemen menyerap semua panjang gelombang terlihat dan terlihat hitam. Seperti yang tertera pada figur 23.16 yang menunjukkan hubungan artist color wheel. Suatu objek memiliki particular color untuk alasan: 1. memantulkan cahaya dari warnanya sendiri,sehingga jika suatu objek menyerap semua panjang gelombang kecuali hijau, pantulan cahaya yang memasuki mata kita adalah warna hijau. 2. menyerap cahaya dari warna komplemen. Sehingga jika objek hanya menyerap merah, komplemen dari hijau, maka sisa panjang gelombang yang dipantulkan dan memasuki mata kita akan hijau juga. Tabel 23.11 menunjukkan daftar warna yang diserap dan hasil warnanya. Contoh sederhana yang sering dijumpai yaitu pergantian warna daun di musim tertentu. Pada musim semi dan panas, daun mengandung banyak sekali klorofil dan hanya mengandung sedikit pigmen warna yang lain yang disebut xantofil. Klorofil menyerap warna merah dan biru dengan sangat kuat, dan memantulkan banyak sekali panjang gelombang warna hijau ke mata kita. Pada musim gugur, dimana fotosintesis jarang terjadi, daun tidak lagi mengandung klorofil, sehingga warna hijau menghilang bersamaan dengan terdekomposisinya klorofil. Xantofil yang tertutup oleh klorofil keluar dan menyerap warna hijau dan biru dengan kuat. Sehingga menampilkan warna kuning dan merah pada musim gugur. Pemisahan d Orbital pada octahedral field pada ligan Figure 23.17A menunjukkan enam ligan bergerak menuju ion logam untuk membentuk komplek. Karena ligan bergerak pada sumbu x,y,dan z mereka muncul langsung menuju lobes dari dx2-y2 dan dz2 orbital (figure 23.17B dan C) tetapi diantara lobes pada dxy,dxz, dan dyz orbital (figur 23.17D sampai F). Lalu, electron pada dx2-y2 dan dz2 orbital memiliki repulse lebih kuat daripada di dxy,dxz,dyz. Energi diagram dari orbital menunjukkan kelima d orbital lebih tinggi di energi saat membentuk kompleks daripada di ion logam yang bebas karena repulsi dari munculnya ligan, tetapi energi orbital terbagi dengan dua orbital yang lebih tinggi di energy dibandingkan tiga yang lainnya. (figur 23.18). dua energy orbital yang lebih tinggi disebut eg dan tiga yang lainnya t2g orbital. Pemisahan energy orbital disebut crystal field effect dan perbedaan energy antara eg dan t2g adalah crystal field splitting energy (∆). berdasarkan figure 23.19, H20 termasuk weak-field ligan, dan CN- adalah strong-field ligan. Penjelasan warna pada logam transisi Warna dari coordination compound ditentukan oleh perbedaan energy (∆) antara t2g dan eg orbital di ion kompleksnya. Perbedaan antara dua energy level electron pada ion sama dengan energy dari photon yang terserap. ∆Eelektron = Ephoton = hv substansi punya warna karena hanya beberapa panjang gelombang dari cahaya putih yang diserap. Spektra absorbsi menunjukkan bahwa panjang gelombang yang terserap oleh ion logam dengan ligan yang berbeda dengan ion logam yang ligannya sama. Dari data tersebut, dapat dihubungkan energy dari cahaya yang diserap ke nilai ∆. Observasi pertama : 1. untuk ligan yang diberi, warna tergantung pada bilangan oksidasi dari ion logam. Larutan ion [V(H2O)6]2+ adalah violet dan larutan ion [V(H2O)6]3+ adalah kuning. Seperti yang tercantum pada figure 23.21A. 2. untuk ion logam yang diberi, warna tergantung pada ligan. Bahkan pergantian satu ligan bisa membuat dampak yang besar pada panjang gelombang yang diserap dan warna seperti yang bisa dilihat dua ion kompleks Cr3+ pada figure 23.21B. Observasi yang kedua yaitu memperbolehkan kita membuat rank ligan ke spectrochemical series berdasarkan kemampuan mereka untuk memisah d-orbital energy. Beberapa jenis bergerak dari weak-field ligan (kecil spiltting,kecil ∆) ke strong-field ligan.(besar splitting, besar ∆). Seperti yang ditunjukkan pada figure 23.22. dengan menggunakan cara ini,kita bisa memprediksikan ukuran relatif dari ∆ untuk octahedral kompleks yang sama ion logamnya Sifat Magnet dari Kompleks logam Transisi Pemisahan energy level menyebabkan sifat magnetic dengan mempengaruhi jumlah dari electron yang tidak berpasangan pada ion logam di d orbital. Jika semua energy orbital lemah sudah setengah terisi, maka electron selanjutnya bisa : mengisi orbital setengah penuh, atau mengisi orbital yang kosong dengan energy tertinggi sebagai contoh, ion Mn2+ ([Ar]3d5 ) punya lima electron tidak berpasangan di orbital 3d (figure 23.23A) Orbital terpengaruh dengan ligan dengan cara:. weak-field ligan dan high-spin kompleks. Seperti pada figure 23.23B strong-field ligan dan low-spin kompleks. Seperti pada figure 23.23C diagram orbital untuk d1 sampai d9 di octahedral kompleks menunjukkan kedua high-spin dan low-spin hanya tersedia untuk d4,d5,d6,dan d7. Seperti pada figure 23.24. Crystal Field Splitting pada Tetrahedral dan square planar kompleks. Tetrahedral kompleks, dengan ligan yang muncul dari ujung tetrahedron, tidak ada dari kelima d orbital yang menuju langsung mengikuti jalannya. (figure 23.25). Energy untuk memisahkan d orbital lebih kurang dari kompleks tetrahedral daripada di kompleks octahedral yang memiliki ligan yang sama. ∆tetrahedral < ∆oktahedral Hanya high-spin kompleks tetrahedral yang diketahui karena magnitude dari ∆ sangat kecil. CONTOH MASALAH 23.5 MENGURUTKAN CRYSTAL FIELD SPLITTING ENERGI UNTUK ION KOMPLEKS DARI LOGAM YANG DIBERI Masalah : Urutkan ion [Ti(H2O)6]3+, [Ti(NH3)6]3+, dan [Ti(CN)6]3- dalam urutan nilai relatif dari ∆ dan energi dari cahaya tampak yang diserap. Rencana penyelesaian: Rumus menunjukkan bilangan oksidasi titanium adalah +3 pada tiga ion. Dari figure 23.22,kita urutkan ligan berdasarkan kekuatan crystal field, ligan yang paling kuat, splitting terbesar, dan energy cahaya terserap yang paling tinggi. Penyelesaian: Kekuatan ligan field diurutkan CN->NH3>H2O. jadi nilai relatif dari ∆ dan energy cahaya yang terserap adalah Ti(CN)63->Ti(NH3)63+>Ti(H2O)63+ kompleks square planar, pengaruh dari ligan field di square planar mudah digambarkan. Yaitu dengan membayangkan octahedral geometri lalu menghilangkan dua ligan di sepanjang sumbu z. seperti pada figure 23.26. tanpa sumbu z, energy orbital pada dz2 berkurang begitu juga pada orbital yang lainnya. Sehingga bisa disimpulkan bahwa kompleks square planar adalah low spin. Tidak ada satupun model yang bisa memuaskan secara keseluruhan. Teori VB muncul menawarkan penggambaran mudah tentang informasi ikatan tetapi belum sampai menjelaskan terbentuknya warna. Crystal field model memprediksikan warna dan sifat magnetic secara bagus tapi belum mejelaskan tentang sifat kovalen alami ikatan logam-ligan. Saat ini, kimia menggunakan model lainnya, yaitu ligan field-molecular orbital theory. Yang merupakan gabungan dari dua model sebelumnya dengan teori MO. Sebagai tambahan tentang pentingnya aplikasi kimia, kompleks dari transisi punya peran penting dalam sistem kehidupan.