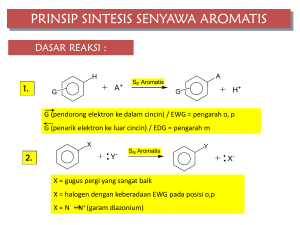
Hak Cipta dan Hak Penerbitan dilindungi Undang-undang Cetakan pertama, Desember 2016 Penulis : Wardiyah, M.Si., Apt Pengembang Desain Instruksional : Dra.Tutisiana Silawati, M.Ed Desain oleh Tim P2M2 : Kover & Ilustrasi : Tata Letak : Nursuci Leo Saputri Andy Sosiawan Kimia Organik DAFTAR ISI DAFTAR ISI iii BAB I: KONSEP DASAR KIMIA ORGANIK 1 Topik 1. Dasar Kimia Organik ……………………………………..……................................................... Latihan ………….……………………………………....................................................................... Ringkasan ……...………………………………….......................................................................... Tes 1 ……………………………………..……................................................................................ 3 14 15 16 Topik 2. Isomer, Stereoisomer, Gugus Fungsional dan Tatanama ......................................... Latihan ……………………………………..............................................……............................... Ringkasan ..…………………………………................................................................................. Tes 2 ……………………….…………………..……......................................................................... 19 32 35 36 PETUNJUK JAWABAN TES ........................................................................................ DAFTAR PUSTAKA ................................................................................................... 38 40 BAB II: SENYAWA HIDROKARBON 41 Topik 1. Alkana dan Sikloalkana ……………………………………………..…………….............................. Latihan ……….………………………………………....................................................................... Ringkasan …..…………………………………........................................................................... Tes 1 .……………………….…………………..……......................................................................... 45 53 55 56 Topik 2. Alkena dan Alkuna …………………………………………………………………………………………….. Latihan ……………………………………..............................................……............................... Ringkasan ………………………………….................................................................................. Tes 2 ……………………….…………………..……......................................................................... 59 68 71 71 PETUNJUK JAWABAN TES ........................................................................................ DAFTAR PUSTAKA ................................................................................................... 74 75 iii Kimia Organik BAB III: SENYAWA ALKOHOL, ETER, ALKIL HALIDA, DAN AMINA 76 Topik 1. Alkohol dan Eter ...................................................................................................... Latihan ………………………………………….............................................................................. Latihan ………………………………………….............................................................................. Ringkasan ………………………………….................................................................................. Tes 1 ……………………….…………………..……......................................................................... 78 79 85 87 87 Topik 2. AlkilHalida ............................................................................................................... Latihan ……………………………………..............................................……............................... Ringkasan ………………………………….................................................................................. Tes 2 ……………………….…………………..……......................................................................... 90 94 96 97 Topik 3. Amina ..................................................................................................................... Latihan ……………………………………..............................................……............................... Ringkasan ………………………………….................................................................................. Tes 3 ……………………….…………………..……......................................................................... 99 103 104 105 PETUNJUK JAWABAN TES ........................................................................................ DAFTAR PUSTAKA ................................................................................................... 107 108 BAB IV: SENYAWA ORGANIK DENGAN GUGUS KARBONIL 109 Topik 1. Aldehida dan Keton ................................................................................................ Latihan ………………………………………………....................................................................... Ringkasan ……..………………………………….......................................................................... Tes 1 ……………………….…………………..……......................................................................... 111 119 120 121 Topik 2. Asam Karboksilat .................................................................................................... Latihan ……………………………………..............................................……............................... Ringkasan …………………………………................................................................................. Tes 2 ……………………….…………………..……......................................................................... 124 138 139 140 PETUNJUK JAWABAN TES ........................................................................................ DAFTAR PUSTAKA ................................................................................................... 143 144 iv Kimia Organik BAB V: SENYAWA AROMATIK 145 Topik 1. Senyawa Aromatik Sederhana ................................................................................. Latihan ………………………………………………....................................................................... Ringkasan ……………..………………………........................................................................... Tes 1 ……………………….…………………..……......................................................................... 146 154 156 157 Topik 2. Senyawa Aromatik Polisiklik dan Heterosiklik ………………………................................. Latihan ……………………………………..............................................……............................... Ringkasan …………………………………................................................................................... Tes 2 ……………………….…………………..…….......................................................................... 159 168 170 170 PETUNJUK JAWABAN TES ........................................................................................ DAFTAR PUSTAKA ................................................................................................... 173 174 BAB VI: 175 KARBOHIDRAT, PROTEIN DAN LIPIDA Topik 1. Karbohidrat ............................................................................................................. Latihan ……….………………………………………....................................................................... Ringkasan ………………………………………........................................................................... Tes 1 ……………………….…………………..……......................................................................... 176 184 186 186 Topik 2. Asam Amino dan Protein ........................................................................................ Latihan ……………………………………..............................................……............................... Ringkasan ………………………………….................................................................................. Tes 2 ……………………….…………………..……......................................................................... 190 199 200 201 Topik 3. Lipida ...................................................................................................................... Latihan ……………………………………..............................................……............................... Ringkasan ………………………………….................................................................................. Tes 3 ……………………….…………………..……......................................................................... 203 210 212 212 PETUNJUK JAWABAN TES ........................................................................................ DAFTAR PUSTAKA ................................................................................................... 215 217 v BAB I KONSEP DASAR KIMIA ORGANIK Wardiyah, M.Si, Apt PENDAHULUAN Kimia organik merupakan bagian tidak terpisahkan dari kehidupan kita sehari-hari. Karena penyusun utama makhluk hidup merupakan senyawa organik yaitu protein, asam nukleat, lemak, karbohidrat, hormon, dan enzim. Prinsip kimia organik dipakai dalam berbagai bidang diantaranya adalah dalam bidang farmasi, kedokteran, biokimia, mikrobiologi, pertanian dan banyak ilmu pengetahuan yang lain. Untuk yang mempelajari bidang kefarmasian beberapa senyawa berikut tentu sudah tidak asing lagi : celecoxib amoxicillin Gambar 1.1 beberapa struktur kimia senyawa obat Dalam bidang lain senyawa organik juga merupakan bagian yang sangat penting, dalam bidang pertanian misalnya, insektisida, pupuk, dan sebagainya. Setiap hari kita juga menemui banyak golongan senyawa organik, bensin, minyak goreng, sabun, plastik atau polimer. Demikian luasnya bahasan tentang ilmu organik ini sehingga kimia organik merupakan bagian dari perkembangan ilmu pengetahuan dan peradaban manusia. 1 Kimia Organik Bab I Kimia Organik ini secara umum akan mempelajari tentang struktur atom, rumus kimia, ikatan kimia, isomeri, jenis-jenis isomer dan stereoisomer, gugus fungsi senyawa organik, tata nama senyawa organik, dan prinsip reaksi dalam senyawa organik yang meliputi reaksi adisi, substitusi, dan eliminasi. Sehingga setelah mempelajari bab ini anda diharapkan dapat : 1. Menjelaskan tentang perkembangan ilmu kimia organik 2. Menjelaskan tentang struktur atom dan orbital atom 3. Membedakan rumus kimia organik yaitu rumus empirik, rumus molekul dan rumus struktur 4. Menuliskan dengan tepat rumus empirik, rumus molekul, dan rumus struktur dari suatu contoh senyawa organik 5. Menjelaskan tentang ikatan kimia pada senyawa organik 6. Menyebutkan dengan tepat contoh ikatan kimia pada suatu senyawa organik 7. Menjelaskan tentang jenis-jenis isomer dan stereoisomer 8. Membedakan dengan tepat perbedaan isomer rantai, isomer gugus fungsi, dan isomer posisi 9. Membedakan stereoisomer dari isomer geometris dan isomer optis 10. Menyebutkan jenis gugus fungsional pada senyawa organik 11. Menyebutkan golongan senyawa organik berdasarkan gugus fungsinya 12. Menyebutkan contoh tiap senyawa berdasarkan gugus fungsionalnya 13. Menyebutkan deret homolog untuk sepuluh alkana pertama 14. Menuliskan contoh nama alkana, alkena, dan alkuna berdasarkan IUPAC 15. Menuliskan contoh nama alkohol berdasarkan IUPAC 16. Menuliskan contoh nama aldehid dan keton berdasarkan IUPAC 17. Menuliskan contoh nama asam karboksilat dan ester berdasarkan IUPAC 18. Menuliskan contoh nama amina dan alkil halida berdasarkan IUPAC 19. Menjelaskan dengan singkat tentang prinsip reaksi adisi, substitusi, dan eliminasi dalam senyawa organik 20. Memberikan contoh reaksi adisi, substitusi, dan eliminasi Setiap materi yang disusun dalam bab ini sudah dilengkapi dengan latihan soal dan tes. Sehingga setelah mempelajari bab ini para mahasiswa diharapkan dapat mengukur kemampuannya dalam memahami materi tiap selesai satu topik. Apabila belum dapat menyelesaikan latihan soal maupun tes dengan baik maka mahasiswa dapat mengulang kembali materi yang telah dipelajari. 2 Kimia Organik Topik 1 Dasar Kimia Organik A. PERKEMBANGAN KIMIA ORGANIK Sejarah kimia organik dimulai pada pertengahan tahun 1700an dimana pada awalnya kimia organik dikenal sebagai ilmu kimia yang mempelajari benda hidup. senyawa-senyawa yang diperoleh dari benda hidup tersebut (hewan, tumbuhan, dan manusia) sangat mudah terurai atau terdekomposisi dari pada senyawa yang diperoleh dari bahan bahan mineral. Hal ini yang menyebabkan seorang ahli kimia dari Swedia, Torbern Bergman, pada tahun 1770 menjelaskan sebagai perbedaan antara senyawa organik dan anorganik. Senyawa organik pada saat itu diyakini mempunyai vital force atau daya vital yang merupakan ciri khas dari senyawa yang berasal dari makhluk hidup. Karena memiliki daya vital ini maka senyawa organik dipercaya tidak dapat disintesi di laboratorium seperti senyawa anorganik. Tabel 1. Perbedaan Senyawa Organik Dan Anorganik Organik Anorganik Reaksi berjalan lambat Reaksi lebih cepat Titik didih dan titik leleh rendah Titik didih dan titik leleh tinggi Mudah terurai dengan pemanasan Lebih stabil dengan pemanasan Molekulnya dapat membentuk isomer Molekulnya tidak dapat membentuk isomer Mudah larut dalam pelarut nonpolar, kurang Mudah larut dalam air atau pelarut polar, larut dalam air atau pelarut polar kurang larut dalam pelarut nonpolar Teori tentang daya vital yang menyebabkan senyawa organik tidak dapat disintesis atau dimanipulasi di laboratorium ini mulai berubah sejak Michel Chevreul pada tahun 1816 menemukan bahawa sabun (suatu senyawa anorganik) dapat dibuat dari hasil reaksi antara lemak hewani (senyawa organik) dengan basa. Sabun yang merupakan senyawa anorganik dapat diubah menjadi senyawa organik yaitu asam lemak. 3 Kimia Organik NaOH Lemak hewani Sabun + Gliserin H2O H3O+ Sabun Asam lemak Pada tahun 1828 Wohler menemukan bahwa urea, suatu senyawa organik, yang sebelumnya ditemukan dalam urin manusia, dapat disintesis dari senyawa anorganik, ammonium sianat. Hal ini makin melemahkan teori vitalitas. Karbon ini menempati bagian utama dalam studi ilmu kimia karena karbon adalah atom yang unik karena karbon dapat terikat secara kovalen dengan atom karbon lain dan terhadap unsur-unsur lain dengan berbagai macam cara. Senyawa-senyawa karbon juga bervariasi yaitu dari senyawa yang paling sederhana yaitu metana (CH4), sampai dengan asam nukleat yang menjadi pengemban kode genetik.Dalam kimia organik selain unsur karbon (C), unsur-unsur yang sering kali ada adalah hidrogen (H), oksigen (O), dan unsur halogen (Cl, Br, I), Nitrogen (N), S dan P. walaupun senyawa organik terbentuk dari sejumlah kecil unsur akan tetapi keberadaan senyawa organik sangat berlimpah. Sekarang ini kita hidup di jaman karbon karena setiap hari kita dikelilingi oleh senyawa-senyawa karbon, kolesterol dan lemak tak jenuh, hormon pertumbuhan dan steroid, insektisida dan feromon, karsinogen dan agen kemoterapi, DNA dan kode genetik. dan masih banyak lagi yang lainnya. Berdasarkan penemuan di atas senyawa organik kemudian dapat didefinisikan sebagai senyawa karbon. Walaupun senyawa organik dikenal sebagai senyawa karbon tetapi tidak semua senyawa yang mengandung karbon adalah senyawa organik. Contohnya, CO2 atau CaCO3 walaupun mengandung atom karbon tetapi bukan merupakan senyawa organik. Jadi, bagaiamana membedakan senyawa organik atau anorganik?. Senyawa organik merupakan senyawa hidrokarbon dan turunannya. Senyawa hidrokarbon adalah senyawa yang tersusun dari hidrogen dan karbon. Setiap senyawa organik merupakan anggota deret homolog atau golongan senyawa tertentu. Deret homolog adalah urutan senyawa organik yang membentuk kelompok dengan gugus dan struktur tertentu yang teratur. Contoh dari deret homolog adalah CH4, CH3CH3, CH3CH2CH3 dan seterusnya, atau CH3OH, CH3CH2OH, CH3CH2CH2OH dan seterusnya. B. STRUKTUR ATOM DAN ORBITAL ATOM Sebelum mulai membahas tentang kimia organik, mari kita mengulas kembali pembahasan tentang struktur atom. Atom merupakan partikel dasar yang terdiri dari elektron, proton dan neutron. Atom terdiri atas nukleus atau inti atom dan elektron yang mengelilingi inti atom. Nukleus merupakan bagian atom yang terdiri dari proton yang bermuatan positif dan neutron yang tidak bermuatan atau netral, sedangkan elektron yang 4 Kimia Organik mengelilingi nukleus bermuatan negatif. Kedudukan partikel penyusun atom dalam atom disebut struktur atom. Atom merupakan partikel sangat kecil yang bahkan tidak dapat terdeteksi dengan mikroskop. Tetapi sifat-sifat atom dapat dipelajari apabila atom diberikan medan listrik, medan magnet atau cahaya, sehingga atom bisa dibuktikan mengandung elektron, proton, dan neutron sebagai bagian pembentuk atom. Nukleus memiliki diameter yang sangat kecil yaitu sekitar sekitar 10-14 hingga 10-15 meter (m) tetapi nukleus memegang peranan terhadap pembentukan massa atom. Elektron memiliki masssa yang sangat kecil sehingga cenderung diabaikan dan elektron mengilingi nukleus pada jarak sekitar 10 -10m. sehingga dapat diperkirakan diameter dari suatu atom adalah 2x 10 -10 m atau 200 pikometer (pm), dimana 1 pm = 10 -12 m.Beberapa ahli kimia menggunakan satuan angstrom (Å) untuk menunjukkan jarak atom dimana 1 Å = 100 pm = 10 -10 m Suatu atom mempunya nomor atom (Z) yang menggambarkan jumlah proton dalam inti atom dan nomor massa atom (A) yang menggambarkan jumlah proton dan neutron. Nomor atom untuk setiap atom selalu tetap misalnya hidrogen memiliki nomor atom 1, karbon memiliki nomor atom 6, oksigen dengan nomor atom 8, dan sebagainya. Tetapi setiap atom dapat memiliki nomor massa yang berbeda berdasarkan jumlah neutron yang dimilikinya. Sehingga atom yang memiliki nomor atom sama tetapi nomor massa berbeda disebut sebagai isotop. Karbon, hidrogen, oksigen, dan nitrogen merupakan unsur yang paling penting dalam ilmu kimia organik. Unsur-unsur ini berada di kedua periode pertama dalam sistem berkala unsur dan elektronnya berada dalam dua kulit elektron yang terdekat ke nukleus. Karbon merupakan atom terpenting yang dipelajari dalam ilmu kimia organik. Karbon merupakan atom yang memiliki enam elektron dengan konfigurasi 1s2 2s2 2p2. Karbon mempunyai empat elektron valensi, sehingga karbon dapat membentuk ikatan kovalen. Di dalam tabel periodik, atom karbon merupakan unsur golongan 4A yang berada pada posisi tengah dalam kolom periodenya. Atom di sebelah kiri karbon memiliki kecenderungan memberikan elektron sedangkan di sebelah kanannya memiliki kecenderungan menarik elektron. Elektron yang dekat dengan nukleus akan lebih tertarik oleh proton dalam nukleus dibanding elektron yang jauh kedudukannya terhadap nukleus. Sehingga semakin dekat elektron terhadap nukleus semakin rendah energinya dan sukar berpindah dalam reaksi kimia. Kulit elektron yang paling dekat dengan nukleus berada pada tingkat energi pertama, elektron pada kulit kedua berada pada tingkat energi kedua yang lebih besarnya energinya disbanding tingkat pertama, begitu seterusnya.Posisi relatif suatu elektron terhadap nukleus dapat digambarkan dengan teori mekanikal kuantum. Tiap kulit elektron dibagi menjadi orbital atom. Orbital atommenggambarkan ruang di mana elektron dapat ditemukan dengan probabilitas 90-95%. Orbital atom mempunyai empat sub kulit yaitu s, p, d, dan f. orbital s berbetuk bulat (sferis), orbital p berbentuk halter (seperti alat olahraga angkat beban) masing-masing sub kulit dapat menampung dua elektron. dalam ilmu kimia organik orbital s dan p ini yang paling penting. 5 Kimia Organik Kulit elektron pertama mengandung orbital 1s, sehingga jumlah elektron pada kulit ini adalah dua. kulit kedua mengandung satu orbital 2s dan 3 orbital 2p sehingga jumlah elektron pada kulit ini adalah delapan. Kulit ketiga berisi satuorbital s (3s), tiga orbital p (3p), dan lima orbital d (3d), jadi total elektron pada kulit ketiga ada delapan belas. orbital s orbital p orbital d Gambar 1.2 Bentuk orbital s, p, dan f Karbon memiliki konfigurasi 1s2 2s2 2p2 dari konfigurasi ini karbon memiliki dua electron yang tidak berpasangan yaitu pada orbital 2p, artinya karbon akan membentuk dua H. Faktanya karbon dapat membentuk empat ikatan C-H ikatan C-H. C H dan membentuk bangun ruang tetrahedral, bagaiamana hal ini bisa terjadi?. Atom karbon tidak menggunakan orbital s dan p ketika membentuk ikatan, tetapi menggunakan orbital baru dengan tingkat energy yang setara. Hal ini yang disebut dengan konsep hibridisasi yaitu beberapa orbital yang berbeda tingkat energinya bergabung bergabung membentuk orbital baru yang setara tingkat energinya. Gambar 1.3 Penataan tetrahedral dari CH4 tetra 6 Kimia Organik Penataan tetrahedral untuk CH4 tidak dapat terbentuk apabila karbon berada dalam keadaan dasarnya Gambar 1.4 Konfigurasi keadaan dasar atom karbon Konfigurasi keadaan dasar dari atom karbon adalah 1s 1 22s2 2px1 2py1. Pada kulit terluar dari karbon memiliki sepasang electron pada orbital 2s dan dua electron tidak berpasangan pada orbital 2p. pada konfigurasi ini hanya akan terbentuk dua ikatan C-H. C H. agar dapat C-H membentuk konfigurasi CH4 dengan 4 ikatan C H maka 1 elektron dari orbital 2s harus dipromosikan pada orbital 2pz sehingga pada kondisi ini akan ada empat elektron yang tidak berpasangan. Sehingga pada CH4 akan membentuk orbital hybrid sp3. Gambar 1.5 Konfigurasi atom karbon yang terhibridisasi Keempat orbital hybrid sp3 mempunyai tingkat energi setara dan mempunyai penataan orbital hibrid pada CH4 akan membentuk geomteris berbentuk tetrahedral. Masing-masing Masing ikatan sigma (σ). Setiap ikatan C – H mempunyai panjang ikatan 1,09 Å dan energy disosiasi ikatan 104 kkal/mol. Sudut ikatan antara C – H 109,50. 7 Kimia Organik s+px+py+pz Hibridisasi sp3 CH4 Gambar 1.6 Hibdridisasi sp3 pada metana H Bila pada metana hanya terbentuk ikatan C – H bagaimana dengan ikatan antar karbon karbon dalam etana memiliki panjang ikatan 1.54 Å dan kekuatan (C – C) ?. Ikatan karbon-karbon ikatan 88 kkal/mol. Untuk ikatan C-H C H memiliki karakteristik yang sama dengan metana. Pada etana dua karbon membentuk ikatan satu sama lain melalui overlap orbital sp 3 dan setiap karbon membentuk satu itan sigma (σ). Tiga orbital sp3 lain pada setiap karbon overlap dengan orbital 1s atom H membentuk enam ikatan sigma (σ) C – H. Karbon sp3 Karbon sp3 Ikatan karbon sp3 - sp3 etana Gambar 1.7 Pembentukan ikatan pada etana 8 Kimia Organik Pada etena, H2C = CH2, terdapat ikatan rangkap pada ikatan antar karbonnya. Atom karbon tidak menggunakan orbital s dan p untuk berikatan, tetapi menggunakan orbital baru yang mempunyai tingkat energy setara dan berbentuk segitiga planar, yaitu orbital sp2. Hibridisasi sp2 Gambar 1.8 Hibridisasi sp2 Karbon sp2 Karbon sp2 Ikatan rangkap karbon-karbon Gambar 1.9 Pembentukan ikatan pada etena Pada etena dua orbital sp2 dari kedua atom karbon yang berisi masing-masing satu electron akan overlap ujung ke ujung sehingga akan membentuk ikatan σ C – C. sedangkan dua orbital p yang masing-masing berisi satu electron akan overlap sisi ke sisi membentuk ikatan π antara atom C dan C. jadi pada ikatan C dan C terbentuk dua ikatan yaitu ikatan σ dan ikatan π (ikatan rangkap). Ikatan pada karbon dan karbon bisa berupa ikatan tunggal, ikatan rangkap dua, atau ikatan rangkap tiga. Etuna atau HC≡CH adalah salah satu senyawa hidrokarbon yang mempunyai ikatan rangkap tiga karbon-karbon. Ikatan rangkap tiga menggunakan orbital sp sebagai hasil dari hibridisasi satu orbital 2s dan satu orbital 2p, dua orbital 2p lainnya tidak berubah. 9 Kimia Organik Karbon tereksitasi Hibridisasi sp Gambar 1.10 Hibdridisasi sp Dua orbital sp dari dua atom karbon membentuk satu ikatan σ sedang dua orbital p akan membentuk ikatan π. Jadi, pada ikatan rangkap tiga akan terbentuk satu ikatan σ dan dua ikatan π. Ikatan rangkap tiga Gambar 1.11 Pembentukan ikatan pada etena C. IKATAN KIMIA Atom dapat terikat menjadi molekuldengan berbagai cara karena struktur elektron berbeda-beda. Ikatan kimia terjadi karena atom berkecenderungan untuk mempunyai konfigurasi seperti gas mulia yaitu unsur golongan 8A dalam sistem periodik. Unsur Unsur-unsur golongan IA, logam alkali, mempunyai satu elektron terluar, unsur pada golongan ini berkecenderungan membentuk konfigurasi gas mulia dengan melepaskan satu elektron sehingga membentuk kation. Ukuran kemampuan melepaskan elektron disebut energi atom golongan logam alkali mempunyai energi ionisasi rendah sehingga ionisasi. Atom-atom 10 Kimia Organik bersifat elektronegatif, sedangkan atom yang berada di kanan dan tengah tabel periodik unsur memiliki kemampuan melepaskan elektron yang lemah sehingga mempunyai energi ionisasi yang tinggi. Sedangkan unsur golongan halogen 7A berkecenderungan membentuk konfigurasi gas mulia dengan cara menarik elektron sehingga membentuk anion. Kemampuan menarik elektron ini disebut afinitas elektron. Unsur pada bagian kanan tabel periodik mempunyai afinitas elektron tinggi sehingga unsur-unsur ini bersifat elektronegatif. Ikatan yang terbentuk antara senyawa yang mempunyai energi ionisasi rendah dan afinitas elektron tinggi disebut dengan ikatan ion. Contohnya adalah ikatan dalam NaCl. Molekul NaCl terbentuk dari ikatan ion Na+ dan Cl- melalui gaya elektrostatik. Apabila sepasang elektron digunakan bersama antara dua atom disebut ikatan kovalen. Ikatan kovalen ini diperkenalkan pertama kali oleh G.N Lewis pada tahun 1916. Ikatan kovalen dapat digambarkan dengan struktur lewis, dimana elektron terluar digambarkan sebagai titik. Contohnya hidrogen mempunyai 1 titik, karbon 4 titik. Contohnya; H2, Cl2, C2H4, C2H2. ikatan antara C dan H atau C dan Cl akan membentuk 4 ikatan kovalen. Banyaknya ikatan kovalen yang terbentuk oleh atom tergantung pada banyaknya elektron tambahan yang diperlukan agar atom itu mencapai suatu konfigurasi gas mulia. Contoh : Orang yang pertama kali mengemukakan bahwa C dalam semua senyawa organik tetap bervalensi 4 adalah Kekule (1859). Dapat diperlihatkannya dengan menggambarkan tangan-tangan valensi Kekule ini identik dengan ikatan kovalen. Model penggambaran lain untuk ikatan kovalen adalah dengan struktur kekule. Dimana ikatan digambarkan sebagai sebuah garis. Satu ikatan (garis) merupakan pasangan elektron. Pada struktur kekule pasangan elektron bebas pada kulit terluar dapat diabaikan. Contoh : Metana (CH4) Air (H2O) Atom dengan kelektronegatifan yang sama atau hampir sama akan membentuk ikatan kovalen nonpolar, contoh : H2, N2, CH4, C2H6. bila keelektronegatifan antar atom yang membentuk ikatan berbeda maka akan terbentuk ikatan kovalen polar yaitu suatu ikatan 11 Kimia Organik dengan distribusi rapat elektron yang tidak merata. Dsitribusi elektron dalam molekul polar dapat dilambangkan oleh muatan parsial + dan - contoh : H+ - Cl- atau H – Cl Dari uraian di atas dapat diketahui, bahwa : 1. Ikatan ion dihasilkan dari perpindahan elektron dari satu atom ke atom lain 2. Ikatan kovalen dihasilkan dari penggunaan bersama-sama sepasang elektron oleh dua atom 3. Atom memindahkan atau membuat pasangan elektron untuk mencapai konfigurasi gas mulia. Konfigurasi ini biasanya adalah delapan elektron dalam kulit terluar. Teori ini disebut aturan oktet. D. RUMUS KIMIA DALAM KIMIA ORGANIK Etana memiliki 2 atom C dan 6 atom H, C2H6. Perbandingan terkecil dari C dan H dalam etana adalah 1 :3 atau CH3. CH3 dalam etana ini dikenal dengan nama rumus empiris sedangkan C2H6 adalah rumus molekul. Rumus empiris menggambarkan jenis atom dan perbandingan terkecilnya dalam suatu molekul. Rumus molekul menggambarkan jumlah atom yang sesungguhnyaa dalam molekul dan bukan hanya perbandingannya. Rumus struktur menunjukkan struktur dari molekul yaitu muatan dari kaitan atom-atomnya. Rumus struktur ini perlu diketahui untuk dapat menerangkan atau meramalkan kereaktifan kimia sehingga rumus struktur adalah yang paling berguna dari berbagai jenis rumus. CH3 H H H C C H H H C2H6 rumus empirik etana rumus molekul etana rumus strukturetana Penggambaran struktur molekul dapat menggunakan rumus titik, rumus garis, dan rumus termampatkan (rumus ringkas). Rumus lewis atau rumus titik jarang digunakan, yang umumnya rumus garis atau rumus kekule untuk setiap pasangan electron. Rumus titik Rumus garis 12 Kimia Organik Pada rumus garis sebagian atau semua garis ikatan dapat diabaikan, sehingga disebut sebagai rumus yang dimampatkan atau rumus ringkas. Semua garis ikatan pada hidrogen dapat diabaikan sehingga hidrogen ditulis langsung setelah atom yang mengikatnya. Pada gugus bercabang garis vertikal yang menunjukkan posisi percabangan pada rantai utama dapat dituliskan. Tetapi pada rumus ringkas lebih jauh, semua ikatan diabaikan, bila molekul mempunyai dua atau lebih gugus atom yang identik dapat digunakan tanda kurung untuk gugus atom yang mengulang diikuti subskrip yang menunjukkan berapa kali banyaknya gugus ditemukan pada posisi tersebut dalam molekul. H H H C C H H H Dapat dimampatkan menjadi CH3CH3 Selain rumus garis suatu molekul organik dapat digambarkan dengan garis ikatannya saja, atom karbon dan hidrogen diabaikan tetapi untuk heteroatom (N,O, X) dapat ditampilkan. 2-kloropentana dapat digambarkan sebagai berikut dalam rumus garis-ikatan Cl CH3CH3CH2CHCH3= | Cl Senyawa dengan ikatan rangkap juga dapat digambarkan dengan rumus garis ikatan CH3C = CHCHCH3 = | CH3 Pada senyawa siklik rumus ringkas garis ikatan dapat digambarkan dengan bentuk poligon sesuai jumlah atom karbon penyusunnya. H2 C H2C H2C HC CH2 H2 C CH2 = = CH 13 Kimia Organik LATIHAN 1. Hibridisasi apa yang terbentuk pada ikatan molekul karbon di bawah ini yang ditunjukkan dengan tanda panah ? a b 2. Tentukan rumus yang lebih ringkas dari : CH3CH2CH2CH2CH2CHCH2CH2Cl | Cl 3. Tentukan rumus garis-ikatan untuk molekul CH3CH2CH2CH2CH2OH 4. Tentukan rumus empirik, rumus molekul, rumus struktur, dan rumus struktur garisikatan untuk sikloheksana. 5. Tentukan rumus ringkas dari molekul dibawah ini : Petunjuk Jawaban Latihan 1. Untuk mengetahui jenis hibridasi pada suatu atom karbon, yang perlu diperhatikan adalah jenis ikatan dan berapa banyak jumlah atom lain yang terikat pada atom karbon tersebut. Struktur yang ditanyakan tersebut adalah struktur untuk 3-n-propil1-heptena. Rumus yangt ditunjukkan di atas adalah rumus garis ikatan dimana tidak semua atom digambarkan dalam ikatannya. Pada atom karbon terdapat 3 hibridisasi yaitu sp3, apabila karbon mengikat 4 atom lain, sp2 apabila karbon mengikat 3 atom lain, dan sp apabila karbon mengikat 2 atom lain. Pada tanda panah a merupakan atom karbon mengikat 4 atom lain yaitu 2 atom C dan 2 atom H, sehingga atom karbon a ini mengalami hibridisasi sp3. Pada karbon yang ditunjukkan tanda panah b, menunjukkan atom karbon yang mengikat 3 atom yang lain yaitu 2 atom C dan 1 atom atom hidrogen. Sehingga karbon b ini mengalami hibridisasi sp2. 14 Kimia Organik 2. CH3CH2CH2CH2CH2CHCH2CH2Cl | Cl Molekul senyawa ini mengandung gugus metil (CH3), metilena (CH2), dan Cl. Karena ada gugus yang mengalami pengulangan yaitu gugus metilena, maka gugus ini bisa diringkas dengan menggabungkan dalam tanda kurung dan diberi subskrip. Terdapat 2 gugus Cl sehingga gugus ini diletakkan sesuai dengan perlekatannya. Sehingga rumus diatas dapat diringkas lagi menjadi : CH 3(CH2)4CHCl(CH2)2Cl 3. Penggambaran struktur garis-ikatan untuk molekul berdasarkan pada orbital dari hibrid dari atom karbon CH3CH2CH2CH2CH2OH, sehingga rumus garis-ikatan untuk struktur ini adalah : HO 1-pentanol 4. Sikloheksana merupakan senyawa siklik 6 anggota karbon dengan ikatan tunggal, sehingga jumlah hidrogen yang terikat pada masing-masing karbon adalah 2. Sehingga dapat dibuat rumus molekulnya adalah C6H12, rumus empiriknya dalah CH2, rumus strukturnya : H 2C H 2C 5. H2 C C H2 CH2 CH2 Struktur garis-ikatan Untuk membuat rumus ringkas harus dipahami bahwa setiap ujung dari struktur dan perpotongan garis adalah atom karbon. Setiap karbon akan mengikat 4 atom lain pada ikatan tunggal, dan 3 atom lain pada ikatan rangkap dua. Percabangan dapat dituliskan dalam tanda kurung. Jadi, rumus ringkas untuk senyawa tersebut adalah : CH3CH2CH=CHCH2C(CH3)3 RINGKASAN 1. 2. 3. Pada awal perkembangannya kimia organik didefinisikan sebagai ilmu yang mempelajari benda-benda hidup. Sekarang ini kimia organik dikenal sebagai ilmu yang mempelajari senyawa organik atau senyawa karbon. Karbon merupakan atom terpenting yang dipelajari dalam ilmu kimia organik. 15 Kimia Organik 4. 5. 6. Karbon dapat berikatan dengan atom-atom lain seperti H, O, N, S dan unsur halogen dengan berbagai jenis ikatan seperti ikatan tunggal, ikatan rangkap dua, atau rangkap tiga. Ikatan karbon dengan atom lain dapat menggunakan orbital hidrid sp3 seperti pada metana dimana karbon mengikat 4 atom lain, sp2 bila karbon mengikat 3 atom lain dengan ikatan rangkap 2, dan orbital hibrid sp bila karbon mengikat 2 atom lain dengan ikatan rangkap tiga. Hidrokarbon dapat memiliki rumus empirik yaitu rumus yang menggambarkan perbandingan terkecil dari atom-atom penyusunannya, rumus molekul menggambarkan jumlah atom yang sesungguhnyaa dalam molekul dan bukan hanya perbandingannya. Rumus struktur menunjukkan struktur dari molekul yaitu muatan dari kaitan atom-atomnya. TES 1 1. Karbon menempati bagian utama dalam studi ilmu kimia karena karbon adalah atom yang unik, sifat khas dari atom karbon adalah : A. Hanya dapat terikat dengan atom hidrogen B. Dapat membentuk ikatan hidrogen C. Dapat membentuk ikatan kovalen D. Karbon dalam CO2 berikatan ion 2. Yang termasuk dalam golongan senyawa organik adalah A. CO2 dan CH4 B. CO2 dan CaCO3 C. CH4 dan CH3CH2OH D. CaCO3 dan CH3CH2OH 3. Pasangan molekul yang membentuk ikatan kovalen adalah : A. CH4 dan Cl2 B. CO2 dan NaCl C. HCl dan NaCl D. CaCO3 dan CH4 4. Rumus empirik untuk senyawa C4H8O2 A. (CH2)4O B. C2H4O C. (C2H4)O D. (C2H4)2O 16 Kimia Organik 5. CH3 1 4 2 3 Dari struktur diatas manakah yang menunjukkan hibridisasi sp2 A. 1 dan 3 B. 2 dan 4 C. 3 dan 4 D. 2 dan 3 6. Bagaimanakah rumus ringkas dari senyawa berikut ini : A. B. C. D. 7. CH3CH2CH=CHCH2CH2CH3 CH3(CH2)2CH=CHCH2CH3 CH3(CH2)2CH=CH | CH2CH3 CH3CHCH=CH | CH2CH3 1 2 3 Pada struktur diatas nomor 1, 2, dan 3 menunjukkan hibridisasi : A. sp, sp2, dan sp3 B. sp, sp3, dan sp3 C. sp, sp2, dan sp2 D. semuanya sp 8. Banyaknya hibridisasi sp3 pada senyawa ini adalah : 17 Kimia Organik A. B. C. D. 9. 2 3 4 5 Rumus garis-ikatan untuk senyawa (CH 3)3CCH2CH=CHCH2CH3 yang seusai adalah : A. B. C. D. 10. Geraniol adalah suatu monoterpenoid yang mempunyai struktur seperti di bawah ini. Bagaimana rumus molekul untuk geraniol : OH A. B. C. D. C10H21O C10H20O C10H18O C10H17O 18 Kimia Organik TOPIK 2 Isomer, Stereoisomer, Gugus Fungsional dan Tatanama Pada topik 1 telah dipelajari tentang rumus kimia, suatu molekul dapat mempunyai rumus empirik, rumus molekul, dan rumus struktur. Sebagai contoh senyawa dengan rumus molekul C4H10bila diringkas akan menjadi (C2H5)2. Rumus C2H5ini merupakan rumus empirik. Sedangkan C4H10bila digambarkan sesuai susunan atom-atomnya akan mempunyai beberapa struktur yang berbeda. Penyusunan dalam struktur-struktur yang berbeda inilah yang akan kita bahas dalam bagian “isomer”. H3C C H2 H2 C H3C CH3 CH CH3 CH3 n- butana 2- metilpropana Isomer dari C4H10 Di bidang farmasi tentu kita tidak asing dengan alkohol yang mempunyai berbagai fungsi, sebagai bahan bakar, antiseptik atau bahan pelarut. Nama alkohol sendiri merupakan nama untuk penggolongan senyawa organik yang mempunyai gugus fungsi hidroksil atau – OH. Senyawa yang sering kita sebut alkohol yang dapat digunakan sebagai antiseptik merupakan jenis senyawa alkohol yang mempunyai nama etanol atau etil alkohol (CH3CH2OH). Gambar 1.12 Etanol atau etil alkohol 19 Kimia Organik Selain alkohol tentu kita juga sudah mengenal asam cuka, bahan yang sering kita jumpai untuk memberi rasa asam pada makanan seperti bakso atau acar. Asam cuka merupakan nama lain dari asam asetat atau asam etanoat yang merupakan golongan senyawa asam karboksilat, yaitu senyawa organik mempunyai gugus karboksil (-COOH). Dari uraian ini ternyata senyawa organik mempunyai ciri yang berbeda-beda yang tentunya akan mengakibatkan penamaan yang berbeda. Untuk memudahkan mempelajari senyawa organik yang beraneka ragam maka dikembangkan sistem yang mengklasifikasikan senyawa organik berdasarkan gugus fungsionalnya. Gugus fungsional merupakan bagian molekul senyawa organik yang menjadi sifat khas dari molekul dan pusat kereaktivan dari molekul tersebut. Mengapa asam cuka mempunyai nama asetat dan asam etanoat? apa yang membedakan kedua penamaan tersebut?. Pada awal penemuan suatu senyawa organik, penamaan senyawa tersebut belum memiliki keteraturan, senyawa organik bisa diberi nama berdasarkan penemunya atau sumbernya. Sebagai contoh, asam semut merupakan nama lain dari asam formica atau asam format, yaitu suatu golongan senyawa karboksilat yang paling sederhana yang diperoleh dari penyulingan semut merah. Semut merah dalam bahasa latin adalah formica. Nama asetat dan formiat ini yang disebut nama trivial atau nama lazim. Tetapi dengan makin banyaknya senyawa organik yang telah ditemukan maka diperlukan suatu sistem penamaan yang sistematis dan teratur untuk itu digunakan sistem tatanama senyawa organik yang disebut dengan IUPAC yaitu The International Union of Pure and Applied Chemistry. A. ISOMER Suatu molekul kimia organik bisa jadi memiliki jenis dan jumlah atom yang sama tetapi penyusunannya dalam strukturnya berbeda. Peristiwa dimana senyawa-senyawa yang mempunyai rumus molekul sama tetapi rumus strukturnya tidak sama disebut sebagai isomer. Berdasarkan penyusunannya dalam bidang isomer dibedakan menjadi dua yaitu isomer struktur dan isomer ruang atau stereoisomer. Isomer struktur dibedakan menjadi isomer rantai, isomer gugus fungsi dan isomer tempat/posisi. Sedangkan isomer ruang atau stereoisomer dibedakan menjadi isomer geometris (cis-trans) dan isomer optis. Variasi dalam struktur molekul karena urutan atom yang terikat dalam rantai karbon disebut sebagai isomer rantai. Sebagai contoh C5H12 bisa jadi menunjukkan tigastruktur yang berbeda yaitu : H2 H H3C C C CH3 CH3 H2 H2 H2 H3C C C C CH3 n-pentana 2-metilbutana CH3 H3C C CH3 CH3 2,2-dimetilpropana 20 Kimia Organik atau C4H8O2 dapat berupa senyawa asam karboksilat yang berbeda susunan atom-atom dalam strukturnya, contohnya : O O OH OH Asam butanoat asam 2-metil propanoat Asam karboksilat dan ester merupakan pasangan isomer dimana jumlah dan jenis atom penyusunnya sama. Tetapi asam karboksilat dan ester mempunyai gugus fungsi yang berbeda. Jenis isomer ini disebut sebagai isomer gugus fungsi. Contoh pasangan isomer gugus fungsi lainnya adalah alkohol dengan eter dan aldehid dengan keton. Contoh isomer gugus fungsi asam butanoat dengan metil propanoat (C4H8O2), propanol dengan etil metil eter (C3H8O), propanal dengan propanon (C3H7O). O O OCH3 OH Asam butanoat metilpropanoat CH3-CH2-CH2OH CH3-CH2-O-CH3 Propanol metoksi etana (metil etil eter) O O propanal propanon 21 Kimia Organik Asam 2-hidroksi propanoat dan asam 3-hidroksi propanoat merupakan golongan senyawa karboksilat dengan adanya gugus hidroksil pada rantai karbonnya. Kedua senyawa ini mempunya jumlah dan jenis atom yang sama tetapi posisi dari gugus fungsi hidroksilnya berbeda. Isomer jenis ini disebut sebagai isomer posisi atau tempat. Isomer ini bersangkut paut dengan posisi dari gugus fungsi pada rantai C. HO O OH O HO Asam 2-hidroksi propanoat HO Asam 3-hidroksi propanoat OH O O HO OH O OH O asam oksalat B. OH OH asam tartrat STEREOISOMER Pembahasan mengenai molekul-molekul dalam ruang tiga dimensi, yaitu bagaimana atom-atom dalam sebuah molekul ditata dalam ruangan satu relatif terhadap yang lain. Isomer yang masuk dalam kategori stereoisomer adalah isomer geometri atau biasa disebut isomer cis-trans dan isomer optis. Isomer geometri (cis-trans) ini disebabkan adanya ikatan rangkap dua sehingga molekul menjadi kaku (rigid), sehingga susunan atomnya tertentu. Isomer optis terjadi pada senyawa yang mempunyai atom C asimetris. Atom C asimetris adalah atom C yang keempat gugus/atom yang terikat padanya mempunyai kelektronegatifan yang tidak sama. Senyawa yang mempunyai atom C asimetris demikian 22 Kimia Organik akan dapat memutar bidang polarisasi cahaya terkutub sifat yang demikian ini disebut senyawa yang optik aktif. Apabila senyawa tersebut dapat memutar bidang polarisasi ke kanan disebut dexter (d) atau diberi tanda (+), sedangkan yang dapat memutar ke kiri disebut levosa (l) atau diberi tanda (-). Berdasarkan teori Van’t Hoff- Le Bel asam tartrat (bentuk d dan l) merupakan bayangan cermin satu sama lain. Sehingga kristal atau zat tersebut asimetrik. Jika pada suatu zat pada setiap molekulnya mempunyai n buah atom C asimetris maka jumlah maksimum isomer ruangnya = 2n buah Tabel I.1 Rumus proyeksi asam tartrat I COOH H−C−OH HO−C−H COOH II III IV COOH COOH COOH HO−C−H H−C−OH HO−C−H H−C−OH H−C−OH HO−C−H COOH COOH COOH Catatan : 1. Bentuk I dan II disebut enantiomer (isomer antipoda) merupakan bayangan cermin total. 2. Bentuk I dan III adalah stereoisomer (isomer sebagian). 3. Bentuk III dan IV identik. Suatu bentuk meso. 4. Bentuk enantiomer mempunyai sifat-sifat fisis yang sama, misalnya ; titik leleh. Kelarutan, Ka sama. Kecuali rotasinya yang satu kanan (d) yang lainnya kiri (l) 5. campuran rasemat/rasemik adalah campuran dua macam zat optik aktif (bentuk ddan l-) sehingga daya putarnya saling meniadakan. C. GUGUS FUNGSIONAL DAN TATA NAMA Gugus fungsi merupakan bagian molekul yang mempunyai kereaktivan kimia. Senyawayang mempunyai gugus fungsi sama akan mengalami reaksi kimia yang sama. Untuk senyawa dengan gugus fungsi sama maka akan lebih mudah menggunakan rumus umum untuk senyawa-senyawa tersebut. Sebagai contoh : etana merupakan senyawa alkana mmepunyai rumus molekul CH3-CH3 pada senyawa ini hanya mempunyai ikatan C-H. rumus umum untuk alkana dituliskan sebagai R-H, dimana R menyatakan gugus alkil. Gugus alkil pada CH3CH3 adalah CH3CH2-. CH3OH dan CH3CH2OH merupakan contoh senyawa alkohol yang mempunyai gugus fungsi –OH, sehingga rumus umum untuk alkohol dituliskan sebagai R-OH, dimana pada CH3CH2OH gugus R atau gugus alkilnya adalah CH3CH2-. 23 Kimia Organik Beberapa gugus fungsional untuk senyawa organik seperti ditunjukkan dalam tabel 1.1 berikut ini : Tabel 1.1 Beberapa gugus fungsional dan golongan senyawa organik Gugus fungsional Nama golongan Rumus umum -C-C- alkana R-H -C=C- alkena R2C=CR2 Nama umum alkana ’ alkena -C≡C- alkuna RC≡CR alkuna -C-X haloalkana R-X haloalkana (X=halogen) -C-OH alkohol R-OH alkanol -C-O-C- eter R-OR’ alkoksialkana O -CH O aldehid O -C- alkanal O keton O -C-OH R-CH R-C-R’ alkanon O asam karboksilat O R-C-OH Asam alkanoat O -C-O ester R-C-OR’ Alkilalkanoat -NH2 amina RNH2, R2NH, R3N alkilamina O O -C-NH2 amida R-C-NH2 alkanamida -C≡N nitril R-C≡N alkananitril Setelah mempelajari tentang penggolongan senyawa organik berdasarkan gugus fungsinya maka akan lebih mudah untuk mempelajari senyawa kimia berdasarkan golongannya dan cara penamaannya. Pada akhir abad 19 nama kimia organik disistematikkan dengan menghubungkan nama senyawa dan strukturnya. Sistem ini disebut dengan nama Jenewa atau sistem IUPAC (International Union of Pure and Applied Chemistry). IUPAC adalah organisasi yang bertanggung jawab meneruskan perkembangan tata nama kimia. 24 Kimia Organik 1. Alkana dan sikloalkana Dasar sistem IUPAC ialah nama alkana rantai lurus. Senyawa-senyawa alkana diatur sedemikian rupa sehingga dalam satu deret akan berbeda hanya satu gugus metilena (CH 2) dengan tetangga terdekatnya. Pengelompokkan senyawa ini yang disebut dengan deret homolog dan senyawanya disebut homolog. Tabel.1.2 Deret homolog sepuluh senyawa alkana pertama Jumlah Karbon 1 2 3 4 5 6 7 8 9 10 Struktur CH4 CH3CH3 CH3CH2CH3 CH3(CH2 )2CH3 CH3(CH2 )3CH3 CH3(CH2 )4CH3 CH3(CH2 )5CH3 CH3(CH2 )6CH3 CH3(CH2 )7CH3 CH3(CH2 )8CH3 Nama metana etana propana butana pentana heksana heptana oktana nonana dekana Dalam deret homolog di atas, semua senyawa alkana berakhiran dengan –ana, suatu akhiran IUPAC untuk tata nama dalam bahasa Indonesia atau akhiran –ane dalam bahasa Inggris. Alkana merupakan senyawa hidrokarbon jenuh yang hanya terdiri dari atom karbon dan atom hidrogen. Alkana disebut sebagai hidrokarbon jenuh karena hanya mempunyai ikatan tunggal antar atom karbonnya. Senyawa alkana disebut juga sebagai senyawa alifatik Bila alkana alifatik merupakan senyawa alkana dengan rantai terbuka, maka terdapat senyawa alkana yang strukturnya membentuk cincin. Golongan senyawa ini yang disebut sebagai senyawa alisiklik (alifatik siklik). Penamaan senyawa alisiklik berdasarkan banyaknya atom karbon dalam cincin dengan penambahan awalan siklo. Siklopentana sikloheksana Bila senyawa alkana rantai terbuka tanpa percabangan diberi nama berdasarkan jumlah atom karbon penyusunnya sesuai deret homolog, untuk senyawa kimia organik yang bercabang penamaan dilakukan dengan mempertimbangkan rantai induk dengan cabang atau rantai sampingnya. rantai induk adalah rantai lurus yang terpanjang. Rantai samping 25 Kimia Organik atau rantai cabang adalah gugus alkil yang terikat pada rantai induk. Suatu gugus alkil dari rantai samping atau cabang dinamai menurut jumlah karbon penyusunnya sesuai deret homolog dengan mengubah akhiran ana menjadi –il. CH H2 3H2 H2 H2 H3C C C C C C CH3 H Pada contoh di atas rantai induknya adalah alkana dengan anggota tujuh karbon sehingga disebut sebagai heptana. Rantai cabangnya berupa alkana dengan satu karbon sehingga diberi nama metil yang terletak pada posisi karbon ketiga. Sehingga senyawa tersebut diberi nama sebagai 3-metilheptana. Senyawa organik bisa jadi tidak hanya memiliki rantai samping tunggal yang sederhana, kadang senyawa organik bisa mempunyai rantai samping yang bercabang. Beberapa gugus Untuk rantai samping mempunyai nama khusus misalnya untuk propil dan butil. Contohnya pada propil CH3CH2CH2-, gugus propil yang tidak bercabang diberi namadengan awalan n-(normal),sedangkan bila ada cabang metil pada ujung rantai samping alkil diberi awalan iso-(dari kata isomerik) yaitu isopropil. Contoh lain pada gugus butil, bisa berupa n-butil, isobutil, sekunder (sec-butil) atau tersier butil (tert-butil). Isobutil merupakan gugus butyl yang mempunyai cabang metil pada karbon ujung rantai. Sekunder butil mempunyai dua cabang metil yang terikat pada karbon kepala. Karbon kepala adalah karbon rantai samping yang terikat langsung pada induk. Gugus butil tersier (tert-butil atau t-butil) memiliki tiga karbon yang terikat pada karbon kepala. H3C CH2 CH2 CH2 n-butil CH3 CH3 CH3 H3C H3C CH CH2 CH2 CH Sec-butil isobutil H3C C CH3 ter-butil Contoh: CH3 H 3C CH 2 CH2 H3C CH CH 3 H3C propil CH2 CH(n-propil) 2 CH2 H3C C isopropi l CH3 n-butilsiklopentana Ter-butilsikloheksana Rantai induk suatu senyawa organik dapat memiliki lebih dari satu percabangan. Penamaan untuk cabang yang lebih dari satu ini memakai aturan penamaan diurutkan secara alfabetis menurut ejaan bahasa inggris, misalnya metil dan fenil maka penamaan 26 Kimia Organik untuk fenil diletakkan setelah metil, masing-masing cabang diberikan nomor yang menunjukkan posisi lekatan, jika ada lebih dari satu cabang yang sama pada induk maka gugus cabang tersebut digabung. CH3 H2 H2 H H3C C C C C CH3 H H3C CH2 CH3 H3C 2-etil-3-metilheksana CH3 1,3,5-trimetilsikloheksana 2. Alkena dan alkuna Alkena dan alkuna merupakan hidrokarbon tidak jenuh dengan ikatan rangkap dua dan ikatan rangkap tiga. Penamaan pada alkena dan alkuna menggunakan akhiran –ena dan – una untuk ikatan ganda tiga. Bila rantai induk mengandung empat karbon atau lebih digunakan nomor awalan untuk menunjukkan posisi ikatan rangkap atau ganda tiga tersebut yang nomornya serendah mungkin. H3C C H CH CH2 CH3 CH3 2-pentena 3-metilsikloheksena H3C CH2 CH C C CH3 CH3 4-metil-2-heksuna penomoran untuk menunjukkan posisi ikatan rangkap pada karbon pertama yaitu angka 1 pada struktur diatas dapat dihilangkan bila hanya ada satu posisi yang memungkinkan dan tidak ada masalah dalam kedudukan gugus fungsinya. Suatu senyawa organik kadang bisa memiliki lebih dari satu ikatan rangkap. Pada senyawa dengan lebih dari ikatan rangkap maka penamaannya harus mencantumkan nomor yang menunjukkan posisi dari ikatan rangkap tersebut. H2C CH C H CH2 1,3-butadiena H3C CH CH3 C H CH C H 5-metil-1,3-heksadiena 27 CH2 HC C CH2 C C 1,4-heptadiuna CH2 CH3 Kimia Organik 3. Alkohol Alkohol adalah senyawa organik dengan gugus fungsi –OH (hidroksil). Penamaan untukalkohol (R-OH) menggunakan nama hidrokarbon induk dari deret alkanadengan huruf a akhir diubah menjadi –ol. Prinsip penamaan pada alkohol gugus hidroksil tersebut memperoleh nomor serendah mungkin. H3C CH2 CH2 CH2 OH OH H3C 1-butanol CH2 CH2 C CH3 CH3 2-metil-2-pentanol 4. Amina Penamaan untuk amina sederhana atau alkil amina (RNH2, R2NH atau R3N) adalah dengan gugus alkil tersebut yang diikuti dengan akhiran amina. Untuk Substituen yang terikat pada nitrogen penamaannya kadang-kadang didahului oleh awalan N-. CH3CH2CH2NH2 propilamina (CH3)2NH (CH3)2NCH2CH3 dimetilamina etildimetilamina (N,N-dimetiletilamina) 5. Aldehid dan keton Aldehid adalah senyawa organik dengan gugus fungsi karbonil (-C=O) pada ujung rantai. Penamaan untuk aldehid disesuaikan dengan alkana dimana akhiran –a diganti dengan –al. Karena gugus fungsi aldehid terletak pada karbon ujung makagugus aldehid dianggap karbon 1. O O H2 H3C C C H H H2 H3C C C C H CH3 propanal 3-metilbutanal Keton adalah suatu senyawa organik dengan gugus fungsi keto, yaitu gugus karbonil yang terletak bukan pada karbon ujung. O C Gugus keto 28 Kimia Organik Gugus keto tidak dapat berada pada awal sebuah rantai karbon, sehingga pada senyawa keton diperlukan penomoran, kecuali untuk propanon atau karbon sederhana lainnya. Penomoran untuk gugus keto adalah serendah mungkin dengan akhiran nama keton adalah –on. O H H2 H2 H3C C C C C CH3 CH3 O H3C C CH3 propanon 3-metil-2-heksananon 6. Asam karboksilat dan ester Asam karboksilat merupakan senyawa dengan gugus karboksil pada karbon ujung. Penamaan untuk asam karboksilat seperti halnya pada aldehid karena gugus karboksil harus berada pada awal sebuah rantai karbon sehingga tidak diperlukan nomor. Dan imbuhan nama untuk asam karboksilat adalah asam –oat. O H3C C OH Asam etanoat (nama trivial = asam asetat) Ester merupakan senyawa derivat atau turunan asam karboksilat. suatu ester serupa dengan asam karboksilat tetapi hidrogen asam digantikan oleh gugus alkil. Penamaan untuk senyawa ester dilakukan dengan menyebutkan gugus alkil esternya terlebih dahulu kemudian diikuti dengan nama asam karboksilatnya dengan menghilangkan nama asam. O H3C H2C H2C C O CH3 Gugus alkil ester = metil Gugus karboksilat = butanoat Nama senyawa = metilbutanoat 7. Senyawa benzen Bila senyawa benzena sebagai induk maka penamaannya dimulai dari substituennya dan diikuti dengan nama benzena. Tetapi bila cincin benzen terikat pada rantai alkana yang memiliki suatu gugus fungsi atau pada suatu rantai alkana yang terdiri dari 7 atom atau lebih, maka benzen dianggap sebagai substituen dengan nama fenil. 29 Kimia Organik CH3 CH CH3 NO2 nitrobenzena isopropilbenzena Benzena sebagai substituen : OH CH CH3 2-fenil-2-etanol 8. Prioritas tata nama Suatu senyawa organik kadang memiliki lebih dari satu substituen. Misalnya : CH2C=CCH2CH≡CH2bagaimana memberi nama senyawa ini? 2-heksen-5-una atau 4-heksen-1una ? ClCH2CH2CH2CH2OH, apa nama yang sesuai ? 1-kloro-4-butanol atau 4-kloro-1-butanol ? Untuk itu dikembangkan suatu prioritas untuk nomor awalan. Sehingga substituen dengan prioritas lebih tinggi akan memperoleh nomor awalan lebih rendah. Tabel.I.2 Prioritas tata nama gugus fungsional pilihan Struktur parsial Nama -CO2H asam -oat O C H -al O C -on -OH -ol -NR2 -amina -ena C C C C -una R-, C6H5-, Cl-, Br-, -NO, etc Substituen awal 30 Kimia Organik Berdasarkan tabel prioritas di atasa maka nama yang tepat untuk senyawa CH2C=CCH2CH≡CH2adalah 2-heksen-5-una. ClCH2CH2CH2CH2OH nama yang tepat untuk senyawa ini adalah 4-kloro-1-butanol. D. REAKSI DASAR SENYAWA ORGANIK Senyawa organik dapat mengalami berbagai reaksi. Reaksi dasar yang dapat terjadi adalah reaksi adisi, substitusi, eliminasi, dan penataan ulang. 1. Reaksi adisi Reaksi adisi terjadi apabila dua molekul bergabung menjadi satu molekul baru tanpa ada pengurangan atom. Contoh reaksi ini adalah reaksi yang terjadi pada senyawa alkena. 2. H3C CH2 CH CH2 CH3CH2C=CH2 + HCl Reaksi substitusi Cl H Reaksi substitusi terjadi bila 2 molekul bereaksi menghasilkan dua produk baru yang merupakan pergantian atau pertukaran suatu gugus atom oleh gugus atom yang lain. CH3-CH3 + Br-Br CH3CH2Br + H-Br etana 3. Reaksi eliminasi Reaksi eliminasi merupakan kebalikan dari reaksi adisi, bila reaksi adisi terjadi dari molekul dengan ikatan rangkap yang akan menjadi ikatan tunggal. Pada reaksi eliminasi terjadi reaksi dari ikatan tunggal yang akan berubah menjadi ikatan rangkap karena adanya penghilangan beberapa atom/gugus atom -OH H3C CH2 CH CH 2 | Cl H 4. bromoetana CH3CH2CH=CH2 + HCl Penataan ulang (rearrangement) Reaksi penataan ulang terjadi apabila molekul mengalami penataan ikatan tanpa adanya penambahan, penghilangan, atau penggantian gugus atom, hanya akan terjadi perpindahan/perubahan posisi gugus atom. Pada reaksi penataan ulang akan menghasilkan suatu isomer. CH3CH2CH=CH2 1-butena katalis asam CH3CH=CH2CH3 2-butena 31 Kimia Organik LATIHAN 1. Tuliskan isomer fungsi dari senyawa berikut ini : a. O H3 C CH2 C OH 2. B. CH3CH2CH2CH2OH a. O H3C CH2 C CH2 CH3 Apa nama senyawa berikut ini : a. CH2=CHCH=CHCH=CH2 OH b. CH3 CH2 CH2CHCH3 CH3 c. HOCH2CHCH2 CH3 O ║ CH3CCHCH2CH2CH3 │ CH3 d. (CH3)2NCH2CH3 3. Tentukan struktur dari senyawa berikut ini : a. 3-etilheptana b. 3-sec-butilsikloheksena c. 3-metil-1-butanol 4. Tuliskan isomer struktur dari C6H14 5. Tuliskan reaksi adisi untuk 2-metil-1-pentena dengan HBr Petunjuk Jawaban Latihan 1. Isomer fungsi adalah senyawa yang mempunyai rumus molekul sama tetapi gugus fungsinya berbeda. pasangan isomer untuk isomer fungsi adalah asam karboksilat dengan ester, alkohol dengan eter, dan keton dengan aldehid. Pada soal a merupakan golongan senyawa asam karboksilat yaitu asam pentanoat sehingga isomernya adalah ester yaitu metil etanoat 32 Kimia Organik O H3C C OCH3 Soal b adalah golongan senyawa alkohol yaitu 1-butanol sehingga isomer fungsinya adalah eter. Jadi salah satu isomer fungsinya adalah dietileter CH3CH2-O-CH2CH3 Soal c adalah golongan senyawa keton yaitu 3–pentanon, isomer fungsinya adalah aldehid, jadi isomer fungsinya adalah pentanal O CH3CH2CH2CH2CH 2. Untuk menjawab soal nomor 2 maka kita perlu melihat kembali tentang aturan tata nama untuk senyawa organik. a. senyawa ini mempunyai ikatan rangkap dua sehingga termasuk golongan alkena. Terdapat 3 ikatan rangkap pada posisi karbon no 1,3 dan 5 sehingga nama senyawa ini adalah 1,3,5-heksatriena b. senyawa ini mempunyai gugus hidroksil pada posisi karbon nomor 2, gugus alkilnya merupakan alkana rantai lurus yang terdiri dari 5 anggota karbon, sehingga nama senyawa ini adalah 2-pentanol c. seperti pada soal b, senyawa ini juga memiliki gugus hidroksil (-OH) yang terletak di ujungm sehingga karbon yang mengikat –OH ini diberi nomor 1. Rantai induknya merupakan karbon 4 anggota, dan mempunyai substituen metil pada posisi karbon kedua sehingga nama untuk senyawa ini adalah 2-metil-1-butanol d. terdapat gugus karbonil pada posisi karbon kedua. Gugus karbonil di tengah merupakan ciri untuk senyawa keton. Rantai induknya merupakan hidrokarbon 6 anggota. Terdapat substituen metil pada posisi karbon ketiga. Sehingga nama untuk senyawa ini adalah 3-metil-2-heksanol e, pada senyawa ini terdapat atom N yang mengikat 2 metil (CH3) dan etil (CH2CH3) sehingga penamaannya menjadi etildimetilamina atau N,N-dimetiletilamina. 3. a. 3-etilheptana, senyawa ini mempunyai rantai induk heptana yaitu alkana 7 anggota karbon dengan substituen etil pada karbon nomor 3. Jadi strukturnya : H3C CH2 CH2 CH2 CH CH2 CH3 H2C CH3 b. 3-sec-butilsikloheksana, merupakan rantai siklik 6 karbon dengan ikatan rangkap (sikloheksena) substituen sekunder butil terikat pada karbon nomor 3. Penomoran dimulai dari karbon yang mempunyai ikatan rangkap. 33 Kimia Organik CH CH3 CH2 CH3 c. 4. 3-metil-1-butanol, senyawa ini merupakan senyawa alkohol dengan anggota 4 karbon, yang mempunyai substituen pada karbon nomor 3, gugus hidroksil (OH) ada di ujung (karbon nomor 1) OH H3C CH CH2 CH2 CH3 Isomer struktur dari C6H14. Isomer adalah senyawa yang mempunyai rumus molekul sama tetapi rumus strukturnya berbeda. H3C CH2 CH2 CH2 CH2 CH3 H3C n-heksana CH CH2 CH2 CH3 CH3 2-metilpentana H3C CH CH CH3 CH3 CH3 2,3-dimetilbutana H3C CH2 CH CH2 CH3 CH3 3-metilpentana H3C CH3 CH2 C CH3 CH3 2,2-dimetilbutana 5. Reaksi adisi untuk 2-metil-1-pentena dengan HBr, reaksi adisi adalah reaksi antara dua reaktan yang akan menghasilkan senyawa baru melalui penggabungan kedua reaktan tersebut. Reaksi adisi dapat terjadi pada senyawa alkena dengan halida yang akan berubah menjadi senyawa alkilhalida. Reaksi antara 2-metil-1-pentena dengan HBr akan menghasilkan 1-bromo-2-metil-pentana. H3C CH2 CH2 C CH +2 CH3 H H3C CH2 CH2 C CH2 CH3 Br H Br 34 Kimia Organik RINGKASAN 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. Isomer adalah senyawa yang memiliki jenis dan jumlah atom yang sama tetapi penyusunannya dalam strukturnya berbeda. Berdasarkan penyusunannya dalam bidang isomer dibedakan menjadi dua yaitu isomer struktur dan isomer ruang atau stereoisomer. Isomer struktur dibedakan menjadi isomer rantai, isomer gugus fungsi dan isomer tempat/posisi. Sedangkan isomer ruang atau stereoisomer dibedakan menjadi isomer geometris (cis-trans) dan isomer optis. Gugus fungsi merupakan bagian molekul yang mempunyai kereaktivan kimia. Senyawa yang mempunyai gugus fungsi sama akan mengalami reaksi kimia yang sama. Penamaan untuk senyawa organik menggunakan sistem IUPAC (International Union of Pure and Applied Chemistry). Penamaan sistem IUPAC mengikuti deret homolog. Alkana merupakan hidrokarbon jenuh karena hanya mempunyai ikatan tunggal antar atom karbonnya. Senyawa alkana yang strukturnya membentuk cincin disebut sebagai sikoalkana. Alkena dan alkuna merupakan hidrokarbon tidak jenuh dengan ikatan rangkap dua dan ikatan rangkap tiga. Penamaan pada alkena dan alkuna menggunakan akhiran –ena dan –una untuk ikatan ganda tiga.Alkohol adalah senyawa organik dengan gugus fungsi –OH (hidroksil). Penamaan untukalkohol (R-OH) menggunakan nama hidrokarbon induk dari deret alkana dengan huruf -a akhir diubah menjadi –ol. Penamaan untuk amina sederhana atau alkil amina (RNH2, R2NH atau R3N) adalah dengan gugus alkil tersebut yang diikuti dengan akhiran amina. Aldehid adalah senyawa organik dengan gugus fungsi karbonil (-C=O) pada ujung rantai. Penamaan untuk aldehid disesuaikan dengan alkana dimana akhiran –a diganti dengan –al. Asam karboksilat merupakan senyawa dengan gugus karboksil pada karbon ujung.Asam karboksilat merupakan senyawa dengan gugus karboksil pada karbon ujung. Ester merupakan senyawa derivat atau turunan asam karboksilat. suatu ester serupa dengan asam karboksilat tetapi hidrogen asam digantikan oleh gugus alkil. Senyawa benzena merupakan senyawa siklik aromatik. Suatu senyawa bisa memiliki lebih dari satu substituen gugus fungsi, penamaan untuk senyawa dengan lebih dari gugus fungsi ini mengikuti aturan prioritas tata nama. Reaksi yang dapat terjadi pada senyawa organik adalah reaksi adisi, substitusi, eliminasi, dan penataan ulang. 35 Kimia Organik TES 2 1. Senyawa-senyawa berikut ini yang mempunyai isomer adalah : A. CH4 B. C2H5 C. C3H8 D. C4H10 2. Isomer fungsi dari pentanol adalah : A. pentanal B. etilpropileter C. asam pentanoat D. pentanon 3. Penamaan yang kurang tepat adalah : A. asam 5,5-dimetilheksanoat B. 1-bromo-3-nitropentana C. 2-etil-3,5-dimetilheksana D. 2-kloro-3-butena 4. Urutan naiknya prioritas tatanama gugus fungsional yang benar adalah : A. R- , C6H5-, ClB. R-, -C≡C-, -NR2 C. -CO2H, -OH, -NR2 D. NR2-, -C≡C-, -R- 5. Apa nama IUPAC untuk senyawa berikut ini : (CH3)2C=CHCH3 A. 1,1-dimetil-1-propena B. isopropilpropena C. 2-metil-2-butena D. 2-metil-3-butena 6. Reaksi eliminasi senyawa 1-kloroheksana akan menghasilkan : A. 1-kloroheksena B. Heksena C. Heksana D. Heksuna 36 Kimia Organik 7. butanol merupakan senyawa golongan alkohol yang mempunyai rumus molekul C4H10O, struktur berikut ini yang bukan merupakan isomer dari butanol adalah : OH A. H3C CH2 CH2 CH2 B. H3C CH2 CH CH3 OH C. c H 3C CH CH2 CH3 OH D. H 3C CH CH CH3 CH3 OH 8. Apa nama IUPAC untuk senyawa ini : A. 2-metil-3-fenilpentanol B. 3-metil-2-fenilpentanol C. 3-fenilpentanol D. 3-fenil-4-metilpentanol 9. Berikut ini pernyataan yang tidak sesuai untuk reaksi substitusi adalah : A. Reaksi terjadi pada alkana dengan X2 B. Hasil reaksinya merupakan senyawa alkilhalida C. Merupakan kebalikan dari reaksi adisi D. Reaksi etana dengan Br2 akan menghasilkan bromoetana 10. Banyaknya isomer dari asam pentanoat adalah : A. 3 B. 4 C. 5 D. 6 37 Kimia Organik Petunjuk Jawaban Tes Tes 1 1. C 2. C 3. 4. A B 5. D 6. C 7. B 8. C 9. A 10. C karbon akan membentuk ikatan kovalen dengan atom lain (H, O, N, S, dan halogen) dengan ikatan tunggal, rangkap, atau rangkap tiga CO2 dan CaCO3 bukan termasuk senyawa organik walaupun mengandung atom karbon, karena keduanya tidak termasuk dalam deret homolog NaCl dan CaCO3 tidak terbentuk dengan ikatan kovalen rumus empirik untuk C4H8O2 adalah C2H4O karena menggambarkan perbandingan komposisi atom-atom yang paling kecil karbon no 1 dan 4 mengikat 4 atom lain sehingga hibridisasinya adalah sp3 sedangkan karbon 2 dan 3 mengikat 3 atom lain sehingga hibridisasinya adalah sp2 rantai induk dari senyawa ini adalah alkena 5 karbon dengan ikatan rangkap pada C nomor 1 dan terdapat rantai samping etil pada karbon nomor 2 sehingga jawaban yang tepat adalah C. pada karbon dengan panah nomor 1 mengikat 2 atom lain, karbon 2 dan 3 mengikat 4 atom lain. atom karbon yang mengikat 4 atom pada senyawa tersebut adalah 4, yaitu : pada senyawa (CH3)3CCH2CH=CHCH2CH3 memiliki 9 atom karbon dengan rantai induknya terdiri dari 7 atom, 2 substituen metil pada karbon no 6, dan ikatan rangkap pada karbon no 3 sehingga rumus garis-ikatan yang seseuai adalah yang A rumus molekul untuk geraniol adalah C10H18O. Susunan atom dalam strukturnya dapat digambarkan sebagai berikut : OH CH2 HC C H2C CH3 H2C H3C C CH3 38 Kimia Organik Tes 2 1. D 2. B 3. D 4. B 5. C 6. 7. 8. B D B 9. C 10. A senyawa yang memiliki isomer adalah paling sedikit memiliki jumlah karbon 4 isomer fungsi dari alkohol adalah etersehingga isomer fungsi dari pentanol adalah etilpropileter karena ikatan rangkap (alkena) menempati prioritas penamaan yang lebih tinggi dibandingkan halogen, sehingga penamaan yang tepat adalah 3-kloro-2-butena pada tabel prioritas tata nama gugus alkil (R) menempati urutan paling bawah diikuti C≡C- dan -NR2 rantai induknya adalah alkena dengan jumlah karbon 4 (butena), ikatan rangkap dan substituen metil ada pada karbon nomor 2 sehingga nama yang tepat adalah 2-metil-2-butena eliminasi alkilhalida akan menghasilkan alkena jumlah karbon pada D adalah 5 karbon merupakan senyawa alkohol berupa pentanol, gugus aromatiknya menjadi fenil pada posisi karbon ke-3 dan substituen metil pada karbon ke-2 kebalikan dari reaksi adisi adalah eliminasi asam pentanoat mempunya 3 isomer struktur 39 Kimia Organik Daftar Pustaka Fessenden, R.J., Fessenden, J.S, Alih Bahasa Pudjaatmaka, A.H, 1982, Kimia Organik Jilid 1, edisi ke-3 Jakarta : Erlanggan McMurry, J., 2007, Organic Chemistry,7th edition, California : Wadsworth Inc. Morrison, R.T, Boyd,R.N, 1992, Organic Chemistry, 7th edition, New Jersey: Prentice Hall Inc. Riawan, S, 1990, Kimia Organik, Jakarta : Binarupa Aksara 40 Kimia Organik BAB II SENYAWA HIDROKARBON Wardiyah, M.Si, Apt PENDAHULUAN Seperti sudah diuraikan di bab 1 bahwa sebagian besar senyawa kimia yang kita jumpai sehari-hari merupakan senyawa organik yang mempunyai atom karbon sebagai penyusunnya. Hidrokarbon adalah senyawa organik yang tersusun dari atom karbon dan hidrogen. Berdasarkan penyusunannya dalam struktur shidrokarbon dibedakan menjadi hidrokarbon alifatik, alisiklik, dan aromatik. Hidrokarbon alifatik adalah senyawa organik yang tersusun oleh karbon dan hidrogen dalam rantai terbuka. Hidrokarbon alifatik dapat berupa alifatik jenuh dan tidak jenuh. Alifatik jenuh apabila di dalam struktur molekulnya hanya mempunyai ikatan tunggal. Sedangkan alifatik tidak jenuh apabila di dalam srtukturnya terdapat ikatan rangkap. Hidrokarbon alisiklik adalah senyawa organik yang tersusun dalam suatu cincin atau rantai tertutup. senyawa aromatik merupakan hidrokarbon yang tersusun dalam cincin yang memiliki ketidakjenuhan yang tinggi dan memiliki aroma atau bau yang khas. Pembagian senyawa hidorkarbon dapat dilihat dalam bagan dibawah ini : 41 Kimia Organik CxHy CxHyOz alifatik Alkana Alkena Alkuna Alkohol Eter Aldehid Keton Asam karboksilat Ester CxHy Alkil halogenida CxHyNz Alkil amina Senyawa karbon alisiklik Homosiklik Aromatik siklik Heterosiklik polisiklik 42 Sikloalkana sikloalkena contoh : Benzena Fenol Toluena Asam benzoat Anilin TNT dll contoh : Piridin Furan Tiofena Kafein Nikotin dll contoh : Naftalena Antrasena Fenantrena dll Kimia Organik Pada bab 2 ini kita akan membahas senyawa hidrokarbon alifatik dan alisiklik yaitu alkana, sikloalkana, alkena, dan alkuna. Banyak senyawa yang mengandung ikatan rangkap yang ditemukan di alam, diantaranya adalah muscalure suatu zat penarik seks dari lala lalat. Neoprena adalah suatu karet sintetik yang dibuat dari polimerisasi kloroprena. muscalure neoprena Gambar 2.1 Beberapa contoh senyawa alkena Untuk mengenal penggolongan senyawa organik lebih lanjut, maka pada bab 2 akan dibagi dalam dua kegiatan belajar yang akan membahas tentang senyawa hidrokarbon alkana dan sikloalkana, alkena dan alkuna. Setelah mempelajari bab 2 ini mahasiswa diharapkan mencapai mencapai tujuan instruksional umum pembelajar yaitu mahasiswa dapat : 1. menyebutkan penggolongan senyawa hidrokarbon berdasarkan strukturnya 2. menerapkan prinsip tata nama pada senyawa hidrokarbon 3. menuliskan persamaan reaksi yang dapat terjadi pada senyawa hidrokarbon sederhana 4. menuliskan reaksi pembuatan senyaw hidrokarbon sederhana 5. menyebutkan beberapa contoh senyawa hidrokarbon yang ada di alam dan terkait bidang kefarmasian ujuan instruksional umum di atas dijabarkan dalam tujuan isntruksional Tujuan isntruksional khusus yang lebih spesifik. Sehingga mahasiswa diharapkan dapat : 1. membedakan senyawa alkana, sikloalkana, alkena, dan alkuna 2. menyebutkan rumus umum dari alkana, sikloalkana, alkena, dan alkuna 3. mengidentifikasi senyawa alkana dan sikloalkana 4. memberikan penamaan pada senyawa alkana dan sikloalkana 5. menuliskan rumus struktur untuk senyawa alkana dan sikloalkana sifat senyawa alkana dan sikloalkana 6. menjelaskan sifat-sifat dari alkana 7. menjelaskan hubungan struktur dan sifat-sifat sifat an contoh reaksi pada senyawa alkana 8. menuliskan 9. menuliskan reaksi pembuatan alkana 10. menyebutkan contoh senyawa alkana dan sikloalkana yang ada di alam 11. menyebutkan kegunaan senyawa alkana dan sikloalkana dalam bidang farmasi 12. menidentifikasi senyawa alkena alken 13. memberikan penamaan pada senyawa alkena sederhana 14. menuliskan struktur dari senyawa alkena sederhana 43 Kimia Organik 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. menjelaskan hubungan struktur dan sifat-sifat dari alkena menuliskan contoh reaksi yang terjadi pada alkena menuliskan reaksi pembuatan senyawa alkena menjelaskan prinsip reaksi alkena berdasarkan aturan markovnikov menyebutkan contoh senyawa alkena dalam bidang kefarmasian dan kegunaanya mengidentifikasi senyawa alkuna memberikan penamaan pada senyawa alkuna sederhana meuliskan struktur dari senyawa alkuna sederhana menjelaskan hubungan struktur dan sifta-sifat dari alkuna menuliskan contoh reaksi yang terjadi pada alkuna menuliskan reaksi pembuatan senyawa alkuna menyebutkan contoh senyawa alkuna dalam bidang kefarmasian dan kegunaannya 44 Kimia Organik Topik 1 Alkana dan Sikloalkana Kita telah pelajari sebelumnya di bab 1 bahwa senyawa alkana adalah senyawa hidrokarbon jenuh yang terdiri dari atom karbon dan hidrogen. Alkana dikatakan jenuh karena dalam strukturnya hanya terdiri dari ikatan tunggal antara C dan H. dua molekul alkana yang paling sederhana yang sudah kita bahas di bab 1 adalah metana dan etana. H H C H H H H H C C H H H etana metana Ikatan tunggal antara C – H pada alkana terbentuk karena overlap ikatan σ pada orbital hibridisasi sp3. Metana sebagai molekul alkana yang paling sederhana memiliki bentuk molekul tetrahedra dengan sudut ikatan antara H – C – H adalah 109,5 0. Etana yang merupakan alkana dengan anggota dua karbon juga mempunyai bentuk tetrahedral dengan sudut ikatan antara H – C – H adalah 1090. metana Gambar 2.2 Bentuk struktur tetrahedral dan bola pada metana Alkana adalah golongan senyawa hidrokarbon alifatik jenuh. Alifatik berasal dari bahasa yunani aleiphatos yang artinya lemak. Sejak dahulu lemak sudah dikenal sebagai contoh senyawa organik yang mempunyai gugus ester dan hidrokarbon. Alkana memiliki rumus umum CnH2n+2 atau CnH2n+1- H atau R-H Jika satu atom H hilang, maka rumus molekulnya menjadi CnH2n+1 atau R-, maka gugus baru itu disebut alkil. Pemberian nama untuk senyawa alkana menggunakan akhiran –ana. Penulisan rumus molekul dari alkana dapat menggunakan rumus termampatkan atau rumus ringkas dengan mengabaikan semua ikatannya. Karbon dengan tiga ikatan C – H dapat digambarkan dengan CH3. Apabila ada pengulangan gugus metilena (CH2) dapat disatukan dalam tanda kurung 45 Kimia Organik dengan menggunakan subskrip. Misalnya, pentana dapat dituliskan dengan CH3CH2CH2CH2CH3 atau rumus ringkas menjadi CH3(CH2)3CH3. Bila pada BAB 1 sudah disebutkan sepuluh alkana pertama dalam deret homolog, berikut ini merupakan dua puluh alkana pertama dalam deret homolog : Tabel 2.1 Dua Puluh Pertama Alkana Rantai Tidak Bercabang Nama Rumus molekul Nama Rumus molekul Metana CH4 Undekana CH3(CH2)9CH3 Etana CH3CH3 Dodekana CH3(CH2)10CH3 Propana CH3CH2CH3 Tridekana CH3(CH2)11CH3 Butana CH3(CH2)2CH3 Tetradekana CH3(CH2)12CH3 Pentana CH3(CH2)3CH3 Pentadekana CH3(CH2)13CH3 Heksana CH3(CH2)4CH3 Heksadekana CH3(CH2)14CH3 Heptana CH3(CH2)5CH3 Heptadekana CH3(CH2)15CH3 Oktana CH3(CH2)6CH3 Oktadekana CH3(CH2)16CH3 Nonana CH3(CH2)7CH3 Nonadekana CH3(CH2)17CH3 Dekana CH3(CH2)8CH3 Eikosana CH3(CH2)18CH3 Suatu alkana yang kehilangan satu hidrogen disebut sebagai alkil. Gugus alkil bukan merupakan gugus yangstabil sehingga alkil tidak bisa berdiri sendiri. Alkil merupakan suatu substituen dari molekul lain yang lebih besar. Penamaan gugus alkil berdasarkan nama alkananya dimana akhiran –ana pada alkana akan berubah menjai –il. Contohnya gugus alkil dari metana adalah metil, gugus alkil dari heksana adalah heksil. H H C H metil H H H C C H H etil H H H H C C C H H H propil Beberapa gugus alkil Alkana dengan satu rumus molekul misalnya C4H10 bisa mempunya lebih dari satu rumus struktur, yaitu bisa membentuk normal butana atau metilpropana. Senyawa ini yang disebut sebagai isomer rantai. C4H10 merupakan alkana terkecil yang dapat membentuk isomer. Semakin banyak atom karbonnya maka semakin banyak isomer yang bisa terbentuk. 46 Kimia Organik pembahasan tentang isomer sudah kita bahas di Bab 1 Topik 2. Silahkan saudara pelajari kembali apabil ada yang kurang jelas. H3C C H2 H2 C H3C CH3 CH CH3 CH3 2- metilpropana nbutana Bila alkana merupakan senyawa hidrokarbon jenuh rantai lurus maka sikloalkana adalah senyawa hidrokarbon yang membentuk cincin (siklik). Sikloalkana memiliki rumus umum (CH2)n. Sikloalkana paling sederhana adalah siklopropana yang merupakan cincin tiga anggota. siklopropana siklobutana siklopentana sikloheksana Beberapa senyawa sikloalkana sederhana A. PENAMAAN ATAU NOMENKLATUR Alkana diberi nama sesuai dengan penamaan dalam deret homolognya. Pemberian nama berdasarkan tata nama IUPAC. Aturan untuk penamaan pada senyawa alkana adalah sebagai berikut : 1. Jika berupa alkana rantai lurus tanpa percabangan, beri nama sesuai dengan jumlah atom C-nya (lihat Bab 1, Topik 2, bagian tata nama alkana) 2. Jika alkana mempunyai cabang atau rantai samping, maka gunakan langkah-langkah berikut : 1) tentukan rantai induknya, yaitu rantai terpanjang dalam senyawa tersebut. Rantai diluar rantai induk dianggap sebagai rantai cabang atau substituen. Jika ada dua rantai terpanjang, pilih rantai terpanjang yang mempunyai substituen terbanyak. H3C CH3CH2CH2CH2CH CH3 CH2CH3 CH CHCH2CH2CH3 CH3 CH2CH3 2-metil-3-etilheksana bukan 3-isopropilheksana Rantai induk : heptana Substituen : metil Nama : 3-metilheptana 47 Kimia Organik 2) Beri nomor pada rantai induk sedemikian rupa sehingga gugus cabang akan mendapat nomor terkecil. Jika ada rantai samping dengan urutan yang sama dari kedua ujung, perhatikan salah satu ujung yang substiuen keduanya lebih dekat dengan substituent pertama. CH3 2 1 CH3CH2CH CHCH3 5 4 3 4 CH3 5 CH3CH2CH CHCH3 bukan 2 1 CH3 3 CH3 Nama yang benar adalah : 2,3-dimetilpentana CH2CH3 CH3 3 CH3CH2 CH CH2 CH2 CH CH 9 8 7 6 5 4 2 1 CH2CH3 CH2CH3 3,7-dietil-4-metilnonana 3) Kenali rantai samping yang terikat pada induknya dan beri nama sesuai nomor urutnya. Jika terdapat lebih dari satu gugus cabang yang sama maka gugus cabang harus diberi awalan di-untuk dua gugus cabang yang sama, tri-untuk tiga gugus cabang yang sama, tetra-untuk empat gugus cabang yang sama, dan seterusnya.Bila pada rantai induk terdapat lebih dari satu gugus cabang yang tidak sama, maka urutan pemberian nama (dalam bahasa inggris) berdasarkan abjad. CH3 CH3 C CH2CH2 CHCH2CH3 CH3 CH3 2,2,5-trimetilheptana 4) tuliskan nama senyawa organik secara lengkap sebagai kata tunggal. CH3 CH3 CH3 C CH2CH2 CCH2CH3 CH3 CH2CH3 2,2,5-trimetil-5-etilheptana 48 Kimia Organik Pada rantai alkana terdapat empat macam atom karbon berdasarkan posisi terikatanya atom karbon tersebut, yaitu karbon primer apabila atom C tersebut mengikat satu atom C yang lain. Karbon sekunder apabila atom C tersebut mengikat dua atom C yang lain. Karbon tersier apabila karbon tersebut mengikat tiga atom C lain. Karbon kuartener apabila atom C tersebut mengikat empat atom C yang lain. 1 2 1 3 2 4 2 1 1 1 Keterangan : 1 : karbon primer 2 : karbon sekunder 3 : karbon tersier 4 : karbon kuartener Untuk tata nama pada senyawa sikloalkana, penamaannya prinsipnya sama seperti pada senyawa alkana hanya saja untuk rantai induknya diberi awalan siklo-. Rantai induk senyawa alkana ditentukan dari jumlah karbon penyusun cincinnya. Apabila sikloalkana mempunyai subtituen atau rantai samping maka penamaannya diawali dengan nama substituennya diikuti dengan nama rantai induknya. CH2CH3 etilsiklopentana Dari contoh senyawa sikloalkana diatas terlihat bahwa jumlah karbon pada substituen atau rantai samping (metil) lebih kecil dibandingkan dengan senyawa sikliknya, sehingga senyawa tersebut merupakan senyawa sikloalkana tersubstitusi alkil. Bagaimana bila sebaliknya ?jika jumlah karbon pada subtituen lebih besar daripada karbon penyusun cincin maka senyawa tesebut merupakan senyawa alkana tersubstitusi sikloalkil. CH2CH2CH2CH2CH3 1-siklobutilpentana Bila sikloalkana memiliki lebih dari satu substituen, maka penomoran diberikan sekecil mungkin. 49 Kimia Organik CH2CH3 H3C H3CH2C CH3 Br 1,3-dimetilsiklopentana B. NO2 CH3 1-bromo-3-etilsikloheksana 1-metil-2-nitro-4-etilsikloheksana SIFAT-SIFAT ALKANA Alkana merupakan senyawa nonpolar karena alkana terbentuk melalui ikatan kovalen dari dua atom dengan keelektronegatifan yang hampir sama. Ikatan kovalen nonpolar yang paling umum terbentuk adalah ikatan antara karbon-karbon dan karbon-hidrogen. Alkana dan sikloalkana yang tidak memiliki gugus fungsi seperti senyawa organik lain cenderung kurang reaktif. Karena sifatnya ini maka alkana sering disebut sebagai paraffin yang berasal dari bahasa latin parum affins yang artinya afinitasnya kecil sekali. Alkana dapat berupa rantai paling sederhana yaitu metana yang terdiri dari satu karbon sampai dengan rantai yang panjang yang terdiri dari puluhan atau bahkan ratusan karbon. Bentuk senyawa alkana dapat berupa padatan, cairan, atau gas. Untuk alkana rantai lurus C1-C4 berbentuk gas pada temperatur kamar, C5-C17 adalah cairan, dan alkana rantai lurus dengan 18 atom C atau lebih adalah zat padat. Titik didih senyawa dalam deret homolog akan bertambah sekitar 300C untuk tiap gugus metilena (CH2) tambahan, jadi setiap kenaikan bobot molekul dari senyawa alkana maka titik didihnya akan semakin tinggi karena titik didih suatu senyawa tergantung dari energi yang diperlukan oleh molekul-molekul untuk berubah dari fase cair menjadi fase gas.kenaikan titik didih ini tergantung dari gaya tarik van der waals. Makin panjang molekul maka makin besar gaya tarik van der waals.Sebagai contoh butane mempunyai titik didih 00 C, sedangkan pentana memiliki titik didih 360C. Perubahan titik didih juga dipengaruhi oleh percabangan dalam alkana. Adanya percabangan dalam alkana akan terganggunya gaya tarik van der waals sehingga akan menurunkan titik didih. Alkana bersifat nonpolar, sehingga alkana tidak larut dalam pelarut air. Alkanaakan larut dalam pelarut yang cenderung nonpolar atau sedikit polar misalnya dalam alkana lain, dietil eter atau benzena. Kelarutan ini diperngaruhi oleh gaya tarik van der waals antara pelarut dan zat terlarut. Alkana tidak dapat bercampur dengan air sehingga alkana akan berada di permukaan air. Sebagai contohnya sering kali kita melihat tumpahan minyak di laut yang mengapung di atas permukaan air laut. Ini terjadi karena minyak merupakan senyawa hidrokarbon yang nonpolar. Alkana yang memiliki afinitas kecil sehingga alkanakurang reaktif dan relatif inert terhadap senyawa lain. Walaupun demikian alkana masih dapat bereaksi dengan beberapa senyawa. Uraian lebih lanjut tentang reaksi yang terjadi pada alkana akan dibahas di bagian berikutnya dari kegiatan belajar 1 ini. 50 Kimia Organik C. REAKSI-REAKSI PADA ALKANA Sudah dibahas dibagian B dua contoh reaksi alkana yaitu pembakaran atau oksidasi dan halogenasi, berikut ini kita akan membahas beberapa contoh reaksi lain yang dapat terjadi pada alkana : 1. Oksidasi Alkana dapat mengalami reaksi pembakaran dengan oksigen. Pada reaksi pembakaran ini akan dihasilkan karbon dioksida dan air, serta melepaskan energi dalam bentuk kalor (panas). Sebagai contoh reaksi pembakaran metana membutuhkan dua molekul O2 yang akan membebaskan energi sebesar 890 kJ/mol. CH4 + 2O2 CO2 + 2H2O + 890 kJ/mol 2. Substitusi H oleh halogen Selain mengalami reaksi pembakaran, alkana juga dapat bereaksi dengan senyawa halogen. Reaksinya merupakan reaksi subtitusi. Pada temperatur biasa klor dan brom akan dapat mensubstitusi (mengganti) atom-atom hidrogen dari alkana. Berikut ini merupakan contoh reaksi alkana dengan Cl2 yang diradiasi dengan sinar ultraviolet. Dari reaksi ini akan dihasilkan campuran produk yang terdiri dari CH3Cl, CH2Cl2, CHCl3, dan CCl4 CH4 + Cl2cahaya CH3Cl + HCl CH3Cl + Cl2 CH2Cl2 + HCl CH2Cl2 + Cl2 CHCl3 + HCl CHCl3 + Cl2 CCl4 + HCl 3. Nitrasi Merupakan reaksi antara alkana dengan asam nitrat yang akan menghasilkan nitri alkana. Reaksi ini berlangsung melalui reaksi substitusi H oleh gugus nitro (penitroan). CH3-CH3 + HO-NO2 pekatCH3-CH2-NO2 + H2O 3. Pirolisis Terjadi karena peristiwa dekomposisi termal, dimana suatu molekul besar akan pecah menjadi molekul-molekul kecil karena pemanasan tanpa melibatkan oksigen. Peristiwa pirolisis ini disebut juga sebagai cracking. 4. Sulfonasi Alkana dapat bereaksi dengan asam sulfat yang akan menghasilkan asam alkanasulfonat. Sulfonasi merupakan reaksi antara suatu senyawa dengan asam sulfat. dalam reaksi terjadi pergantian satu atom H oleh gugus –SO3H. R-H + HO-SO3H R-SO3H + H2O 51 Kimia Organik D. PEMBUATAN ALKANA Alkana dapat dibuat di laboratorium melalui berbagai cara reaksi, diantaranya adalah: 1. Reduksi alkil halida Alkana dapat diperoleh dari reduksi alkil halida dengan menggunakan reduktor logam, misalnya logam Zn dan dengan adanya garam atau asam yang dapat menghasilkan hidrogen misalnya HCl. Reaksi juga dapat terjadi dengan reduktor logam Na dan alkohol. Reaksi umummya : RX + Zn + 2 HCl RH + 2ZnCl2 Contoh : 2CH3CH2CH2Cl + Zn + 2 HCl 2CH3CH2CH3 + 2 ZnCl2 2. Hidrogenasi alkena Merupakan reaksi hidrogenasi suatu alkena dengan H2, reaksi ini menggunakan katalis Nikel (Ni) atau Platinum (Pt) CH3CH=CH3 Ni CH3CH2CH3 3. Reaksi wurtz Merupakan reaksi pembuatan alkana dengan memanaskan alkilhalida dengan logam Na. CH3Br + CH3Br + 2 Na CH3- CH3 + 2 NaBr 4. Reaksi Grignard Reaksi ini dimulai dengan pembentukan suatu reagensia grignard dari alkilhalida yang direaksikan dengan Mg dalam eter. Hasil reaksinya berupa RMgX (reagensia Grignard). Kemudian reagensia grignard yang terbentuk direaksikan dengan senyawa yang mengandung gugus H aktif seperti air atau alkohol atau asam, sehingga akan terbentuk sneyawa alkohol CH3CH2CH2Br + Mg eter CH3CH2CH2MgBr CH3CH2CH2MgBr + H2O E. CH3CH2CH3 + Mg(OH)Br SENYAWA ALKANA YANG ADA DI ALAM 1. Gas alam Komposisi gas alam sebagian besar terdiri dari metana sebesar 60 – 90%. Metana merupakan gas alam yang terbentuk dari penguraian selulosa oleh bakteri, karena seringnya terbentuk di dasar rawa kemudian gas-gas ini timbul ke permukaan sehingga sering disebut 52 Kimia Organik sebagai gas rawa. Contoh gas alam lainnya adalah etana dan propane. Gas alam dan minyak bumi umumnya terdapat bersamaan. 2. Minyak bumi Minyak bumi terbentuk karena proses sedimentasi dari sisa tumbuhan dan hewan yang lambat laun akan berubah menjadi hidrokarbon. Perbedaan umur, temperature, dan proses pembentukan mimyak bumi akan menghasilkan bermacam-macam hidrokarbon yang bagian-bagiannya berbeda. Sebagai contoh minyak bumi di Indonesia banyak mengandung senyawa aromatik, di Amerika berisi senyawa hidrokarbon jenuh dan di Rusia berisi senyawa siklis. Minyak bumi yang diperoleh dari alam ini masih merupakan minyak mentah yang belum dapat dimanfaatkan. Minyak mentah ini merupakan campuran dari senyawa alifatik dan aromatic, termasuk sulfur dan nitrogen. Agar dapat diperoleh senyawa yang bisa dimanfaatkan maka minyak mentah harus melalui proses refining atau pemurnian. Minyak bumi ini merupakan sumber energi yang kita manfaatkan sehari-hari. Contohnya adalah bensin, minyak tanah, avtur, dan sebagainya. 3. Batubara Batubara terbentuk dari hasil peluruhan tumbuhan oleh bakteri dalam berbagai tekanan. Komposisi batubara dibedakan berdasarkan kadar karbon penyusunnya. Batubara keras atau antrasit mengandung kadar karbon terbesar, kemudian batubara bitumen atau batubara lunak, lignit dan terakhir adalah gambut. Pemanasan batubara tanpa oksigen akan menghasilkan gas batubara dengan komponen utama CH4 dan H2, ter batubara, dan kokas (residu) batubara. Bagian yang digunakan sebagai bahan bakar adalah gas batubara dan kokas. Sedangkan ter barubara merupakan komponen batubara yang kaya akan kandungan senyawa aromatic. Pengolahan minyak bumi sebagai sumber energi lebih murah dan tidak banyak memberikan pencemaran udara dibandingkan batubara sehingga sebagian besar bahan organik disintesis dari minyak organik. Akibatnya cadangan minyak bumi di dunia cepat menyusut. Minyak bumi dan batubara merupakan sumber energi dari alam yang tidak terbarukan, cadangan minyak bumi dan batubara di alam makin lama akan makin habis. Untuki itu perlu dicari sumber-sumber energi alam lainnya. LATIHAN 1. Urutkan titik didih senyawa berikut ini dari yang paling tinggi ke rendah. A. CH3CH2CH2CH2CH2CH3 B. CH3CH2CH2CH3 C. CH3CH2CH2CH2CH3 CH3CH CH3 D. CH3 53 Kimia Organik 2. Beri nama pada struktur berikut ini : A. CHCH2CH3 CH3 B. CH2CH2CH3 CH2CH2CH2CH2CH CCH3 CH3 CH3 CH3 3. 4. 5. Gambarkan rumus struktur dari senyawa berikut ini A. 4-bromo-1,3-dimetilsikloheksana B. 3-etil-2,4-dimetilheptana Tuliskan reaksi yang terjadi pada alkana berikut ini : a. Nitrasi pada etana b. Sulfonasi dari metana Tuliskan reaksi pembuatan alkana berikut ini “ a. Butena butana b. Bromopentana pentana Petunjuk Jawaban Latihan 1. Pada senyawa alkana, semakin panjang rantai karbon titik didih akan semakin tinggi titik didihnya, sedangkan percabangan akan menurunkan titik didih. Jadi urutan titik didih senyawa tersebut adalah A, C, B, dan D 2. A B pada senyawa sikloalkana apabila jumlah karbon penyusun gugus siklik lebih sedikit dibandingkan alkana rantai lurus maka sikloalkana sebagai substituen. Struktur ini memiliki gugus siklopropana dan butana, sehingga yang menjadi induknya adalah butana, siklopropana sebagai substituen diberi nama isopropil dan terikat pada karbon butana nomor 2 sehingga nama senyawa ini adalah : 2siklopropilbutana kenali rantai induknya, yaitu rantai terpanjang, beri nomor dari yang terdekat dengan percabangan, kenali substituen dan letaknya. Berikan nama senyawa tersebut dalam satu kata. 3 9 8 7 6 5 2 1 CH2CH2CH3 4 CH2CH2CH2CH2CH CCH3 CH3 CH3 CH3 10 4,4,5-trimetildekana 54 Kimia Organik 3. A. tentukan gugus induknya yaitu sikloalkana 6 karbon. Tentukan letak substituen sesuai aturan penomoran CH3 Br B. CH3 Tahapan untuk mneyelesaikan soal ini, tuliskan rantai induknya, beri nomor tiap karbon pada induk, letakkan substituen sesuai nomornya. CH3 CH3 CH3CHCH CHCH2CH2CH3 C CH3 H2 4. A. B. 5. A. B. nitrasi etana CH3CH3 + HO-NO2 CH3CH2 – NO2 Sulfonasi metana CH4 + HO-SO3H CH3-SO3H + H2O Butena butana Reaksi pembuatan alkana melalui hidrogenasi alkena. CH3CH2CH=CH3 NiCH3CH2CH2CH3 Bromopentana pentana Reaksi pembuatan alkana dengan menggunakan jalur reagensia Grignard eter CH3(CH2)4Br + Mg CH3(CH2)4MgBr + H2O CH3(CH2)3CH3 + Mg(OH)Br RINGKASAN 1. 2. alkana adalah senyawa hidrokarbon jenuh yang terdiri dari atom karbon dan hidrogen. Jenuh artinya dalam strukturnya hanya terdiri dari ikatan tunggal antara C dan H yang terbentuk karena overlap ikatan σ pada orbital hibridisasi sp3. Alkana yang kehilangan satu hidrogen disebut sebagai alkil. Sikloalkana adalah senyawa hidrokarbon yang membentuk cincin (siklik). Alkana dan sikloalkana yang tidak memiliki gugus fungsi seperti senyawa organik lain cenderung kurang reaktif. Sifat senyawa alkana : bentuk senyawa alkana C1-C4 adalah gas pada temperatur kamar, C5-C17 adalah cairan, dan alkana rantai lurus dengan 18 atom C atau lebih adalah zat padat.Titik didih senyawa dalam deret homolog akan bertambah sekitar 300C untuk tiap gugus metilena (CH2) tambahan. Adanya percabangan dalam alkana akanmenurunkan titik didih.Alkana bersifat nonpolar, sehingga alkana tidak larut dalam pelarut air. 55 Kimia Organik 3. 4. Reaksi kimia alkana yaitu oksidasi, halogenasi, nitrasi, pirolisis dan sulfonasi. Alkana dapat dibuat melalui jalur reaksi reduksi alkilhalida, hidrogenasi alkena, reaksi wurtz, dan reaksi Grignard. Contoh sumber alkana dari alam adalah gas alam, minyak bumi, dan batu bara. TES 1 1. Apa penamaan yang tepat untuk senyawa berikut ini : CH3 CH3 CH3CH2C CH2 CHCH2CH2CH3 H3C CH CH3 A. 3,5-dimetil-3-isopropiloktana B. 3,5-dimetil-3-propiloktana C. 3-etil-2,3,5-trimetiloktana D. 6-etil-4,6,7-trimetiloktana 2. Pernyataan berikut ini tentang alkana yang tidak tepat adalah : A. Merupakan senyawa hidrokarbon jenuh B. Mengalami hibridisasi sp3 dan sp2 C. Rumus umumnya CnH2n+2 D. Reaktivitasnya lebih rendah dibandingkan alkena 3. Diantara nama-nama berikut ini manakah yang tepat ? A. 5-metilheptana B. Isopropiletana C. 4-etil-2,4-dimetilnonana D. t-butilsiklopropana 4. manakah diantara senyawa alkana berikut ini yang berwujud cairan pada temperatur kamar : 1) butana 2) heptana 3) eikosana 4) dekana 5) undekana A. 1, 2, dan 3 B. 2, 3, dan 4 C. 2, 4, dan 5 D. 1, 3, dan 5 56 Kimia Organik 5. Manakah pernyataan berikut ini yang sesuai untuk sifat fisika kimia alkana ? A. Semakin panjang rantai alkana maka alkana akan berwujud gas B. Setiap penambahan gugus metilena pada rantai alkana akan meningkatkan titik didih C. Adanya percabangan akan menaikkan titik didih D. Alkana tidak dapat mengalami oksidasi 6. Manakah penamaan yang tepat untuk senyawa berikut ini : H3C sec-butilsiklopentana CH C CH3 1 H3C 3 CH3 2 1,3, 4-trimetilsikloheksana CH3 n-propilsikloheksana 3 CH2CH2CH3 4 A. B. C. D. C(CH3)3 t-butilsiklopentana 1 dan 2 2 dan 3 3 dan 4 1 dan 3 7. Berikut ini pernyataan tentang reaksi oksidasi 1 mol propana, yang tidak tepat adalah : A. dihasilkan 3 mol CO2 B. melepaskan 4 mol H2O C. dibutuhkan 3 mol O2 D. melepaskan kalor 8. Dari struktur berikut ini berapakah jumlah C sekunder : A. B. C. D. 2 3 4 5 57 Kimia Organik 9. Komposisi terbesar dari gas alam adalah : A. Metana B. Etana C. Propana D. Butana 10. Alkana dapat dibuat melalui reaksi-reaksi di laboratorium, reaksi yang sesuai adalah A. Propana dibuat dengan hidrogenasi propena dengan katalis Ni B. Reduksi alkilhalida akan menghasilkan suatu alkana apabila direaksikan dengan katalis Pt C. Reaksi wurtz dapat terjadi dengan melibatkan logam Zn D. alkiliodida yang dioksidasi dengan HI 58 Kimia Organik Topik 2 Alkena dan Alkuna Alkena adalah senyawa hidrokarbon yang mempunyai ikatan rangkap karbon-karbon. Ikatan rangkap ini terbentuk karena overlap ikatan σ dan ikatan π pada orbital hibridisasi sp 2. Ikatan sp2 pada alkena akan membentuk sudut ikatan kira-kira 120 0. Senyawa alkena merupakan senyawa tidak jenuh. Nama lain alkena adalaholefin, dari kata olefiant gas (gas yang membentuk minyak), yaitu nama lain untuk etilena (CH2=CH2). Beberapa alkena rantai pendek biasanya diberi nama dengan nama lazimnya. H2C CH2 etilena H2C CH CH3 propilena CH3 H2C C CH3 isobutilena Adanya ikatan rangkap pada alkena menyebabkan alkena bersifat tidak jenuh karena jumlah hidrogen pada alkena lebih sedikit dibandingkan alkana dengan jumlah karbon yang sama. Alkena mempunyai rumus umum CnH2n, berbeda dari alkana yang memiliki rumus umum CnH2n+2 satu ikatan rangkap pada alkena terbentuk karena berkurangnya dua atom hidrogen. Jumlah ikatan rangkap pada alkena menunjukkan derajat ketidakjenuhan senyawa alkena tersebut. Jika ada lebih dari satu ikatan rangkap maka jumlah hidrogennya akan makin berkurang. Contohnya bila ada suatu senyawa dengan rumus molekul C8H14 dan diketahui senyawa ini merupakan suatu alkena maka kita bisa menghidung derajat ketidakjenuhan dari alkena tersebut dengan menghitung berkurangnya hidrogen dibandingkan dengan alkananya. Alkana dengan anggota delapan karbon mempunyai rumus molekul C8H18 sehingga alkena yang mempunyai rumus molekul C 8H14 menunjukkan berkurangnya empat atom hidrogen dibandingkan alkananya. Setiap ikatan merangkap menunjukkan berkurangnya dua atom hidrogen sehingga senyawa alkena dengan rumus molekul C8H14 menunjukkan derajat ketidakjenuhannya adalah dua jadi senyawa tersebut memiliki dua ikatan rangkap. Alkuna adalah hidrokarbon yang mempunyai ikatan rangkap tiga karbon-karbon. Alkuna paling sederhana adalah asetilena ( H C C H) suatu nama trivial dari etuna.Dalam alkuna atom karbon yang mempunyai ikatan rangkap tiga akan mengalami hibridisasi sp. Dalam asetilena ikatan rangkap tiga antar karbonnya membentuk ikatan linier dengan sudut 1800. Rumus umum untuk alkuna adalah CnH2n-2. A. ISOMER CIS-TRANS PADA ALKENA Isomer cis-trans adalah suatu senyawa yang mempunyai rumus molekul dan letak ikatan atom-atom penyusunnya sama tetapi berbeda dalam penataanatomnya dalam ruang. Isomer cis-trans akan terjadi apabila satu atom karbon ikatan rangkap mengikat substituen yang berbeda dan ada substituen yang sama pada dua karbon iktan rangkap tersebut. 59 Kimia Organik misalnya pada 2-butena, masing-masing karbon ikatan rangkapnya akan mengikat hidrogen dan gugus metil. Isomer cis-2-butena terjadi apabila kedua substituen metil berada pada sisi yang sama. Sedangkan trans-2-butena terjadi apabila kedua substituen metil berada pada sisi yang berlawanan. CH3 H3C C H H3C C C H H C CH3 H trans-2-butena cis-2-butena Senyawa cis 2-butena dan trans 2-butena merupakan dua senyawa dengan sifat fisik dan kimia yang berbeda. senyawa trans lebih stabil dibandingkan cis karena pada isomer trans kedua gugus sama letaknya berjauhan sehingga tolakan antar kedua gugus menjadi lebih kecil. Isomer cis-trans dapat terjadi tidak hanya pada butena tetapi juga senyawa alkena lain, syaratnya adalah pada ikatan rangkap mempunyai dua gugus yang identik. CH3 Cl C H C C H H C CH3 trans-1-kloro-1-propena cis-1-kloro-1-propena B. H Cl PENAMAAN (NOMENKLATUR) Penamaan untuk alkena digunakan nama alkana tetapi akhiran –ana pada alkana diganti –ena. Sama seperti pada alkana penamaan untuk alkena langkah pertama yang perlu dilakukan adalah menentukan rantai induknya yang berupa rantai terpanjang. Kemudian tentukan substituent yang terikat pada rantai induknya. CH2=CH2 CH3CH=CH2 etena a. b. propena Bila jumlah ikatan rangkap lebih dari satu, maka diberi akhiran diena untuk dua ikatan rangkap, triena untuk tiga ikatan rangkap. CH2=CHCH=CH2 CH2=CHCH=CHCH=CH2 1,3-butadiena 1,3,5-heksatriena Letak ikatan rangkap dinyatakan dengan memberi nomor awalan untuk menunjukkan posisi ikatan rangkap. Jika pada rantai alkena terdapatb gugus fungsional yang memiliki prioritas tatanama yang lebih tinggi, maka penomoran dimulai dari karbon yangpaling dekat dengan gugus fungsi tersebut. Nomor awalan menunjukkan atom karbon darimana ikatan rangkap itu mulai. 60 Kimia Organik H2C CH CH2 CH2 CH CH3 H3C OH 5-Heksen-2-ol C CH CH2 CH3 Cl H3C H2C HC CH C O OH Asam 2-pentenoat 2-Kloro-2-pentena Penamaan untuk sikloalkena hampir sama seperti pada alkena, tetapi sikloalkena tidak memiliki ujung sehingga ikatan rangkap pada sikloalkena akan menempati posisi pada C1 dan C2. CH3 Br 1-metilsikloheksena 3-metil-1,4-dimetilsikloheksadiena 3-bromosikloheksena Bila alkana yang menjadi substituen dikenal dengan nama alkil karena kehilangan satu atom hidrogen, alkena yang menjadi substituen dikenal sebagai alkenil. Beberapa gugus alkenil mempunyai nama trivial yang sering digunakan yaitu, CH2 H2C CH metilena vinil H2C CH CH2 alil Contohnya : CH2 metilenasiklopentana H2C CHCH2 Br H2C CHCl vinilklorida alilbromida Tatanama pada alkuna pada dasarnya sama seperti alkena. Akhiran –ana pada alkana diganti menjadi –una. Ikatan rangkap tiga mendapatkan nomor posisi pada rantai induknya. Bila ada gugus fungsional yang lebih tinggi prioritasnya maka penomoran dimulai dari ujung yang paling dekat dengan gugus fungsi tersebut. CH3CH2CHCCH (CH3)3CC CH HC C CH2CH2CH2C CH OH 1,6-heptadiuna 3,3-dimetil-1-butuna 1-penten-3-ol Dalam tatanama trivial alkuna yang paling sederhana adalah asetilena sehingga gugus yang terikat pada ikatan rangkap asetilena dianggap sebagai substituen. H3C C C CH2 CH3 IUPAC : 2-pentuna trivial : etilmetilasetilena 61 Kimia Organik C. SIFAT FISIK ALKENA DAN ALKUNA Sifat fisik alkena dan alkuna praktis identik dengan alkana padanannya. Alkena suku rendah akan berbentuk gas, suku tengah berbentuk cair, sedangkan suku tinggi yang mengandung lebih dari 18 atom karbon berbentuk padatan. Seperti halnya alkana, setiap penambahan gugus gugus metilena titik didihnya akan naik sekitar 300. Adanya percabangan dalam alkena atau alkuna akan menurunkan titik didih sama seperti halnya pada alkana. Alkana, alkena, dan alkuna merupakan senyawa nonpolar, tetapi alkena dan alkuna sedikit lebih larut dalam air dibandingkan alkana padanannya. D. REAKSI-REAKSI ALKENA DAN ALKUNA Walaupun sifat fisik alkena dan alkuna identik dengan alkana, tetapi sifat kimianya berbeda. karena adanya ikatan rangkap menyebabkan alkena dan alkuna lebih reaktif dibandingkan alkana. 1. Reaksi Adisi Alkena dan alkuna dapat mengalami reaksi adisi. Pada reaksi adisi akan terjadi penambahan atom pada ikatan rangkap. a. Adisi hidrogen Reaksi alkena dengan H2 dikenal juga dengan nama reaksi hidrogenasi. Pada reaksi ini melibatkan katalis Pt, Ni, atau Pd. C Ni/Pt C H + H H C H C alkana alkena H CH3 CH3 Ni/Pt + H H CH3 H 1,2-dimetil-1-sikloheksena Reaksi hidrogenasi juga dapat terjadi pada alkuna Pt HC C CH3 + 2 H2 CH3CH2CH3 62 CH3 1,2-dimetilsikloheksana Kimia Organik b. Adisi halogen Reaksi adisi dengan halogen dapat terjadi pada alkena maupun alkuna. Reaksi adisi dengan halogen dikenal juga dengan nama reaksi halogenasi. Reaksi ini umumnya terjadi pada brom dan klor. Karena fluor akan bereaksi meledak dengan senyawa organik sedangkan iod akan membentuk reaksi yang tidak stabil. Reaksi adisi halogen dapat digunakan untuk mengidentifikasi golongan senyawa alkena. Suatu larutan bromin (Br2) dalam CCl4 atau CH2Cl2 yang berwarna coklat kemerahan apabila ditambahkan pada suatu larutan yang mengandung senyawa alkena maka warna coklat kemerahan tersebut akan hilang. Br Br H3C HC CH CH3 + Br2 CH2Cl2 HC CH CH3 2,3-dibromobutana (tidak berwarna) merah 2-butena H3 C Br Br H 3C C C CH3 + CH2Cl2 merah 2-butuna c. 2 Br2 H3C C C Br Br CH3 2,2,3,3-tetrabromobutana (tidak berwarna) Adisi oleh hidrogen halida (HX) HX akan mengadisi ikatan rangkap pada alkena dan menghasilkan alkil halida. Begitu juga dengan alkuna akan mengalami reaksi adisi dengan HX seperti pada alkena. Reaksi dengan HX dapat terjadi pada HBr, HCl, maupun HI. H2C CH2 + CH3CH2Br HBr bromoetana etena Pada contoh reaksi diatas karena letak ikatan rangkapnya simetris maka hanya akan terbentuk satu jenis senyawa alkilhalida. Bagaimana dengan reaksi yang terjadi pada propena ? Pada reaksi dengan propena ada dua kemungkinan senyawa alkil halida yang akan terbentuk yaitu 2-bromopropana dan 1bromopropana. Tetapi pada kenyataannya 1-bromopropana tidak terbentuk. . Pada tahun 1869 seorang ahli kimia dari rusia yaitu Vladimir Markovnikov membuat suatu aturan empiris bahwa adisi HX pada alkena atom H akan menuju pada karbon ikatan rangkap yang mempunyai jumlah hidrogen lebih banyak dan X akan menuju pada karbon yang mempunyai subsitituen lebih banyak. 63 Kimia Organik H3C HC CH2 + H3C H Br HC H3C HC CH2 + H Br 1-bromopropena Br H 2-bromopropena propena CH2 tidak terbentuk Jika reaksi adisi terjadi pada senyawa dengan ikatan rangkap yang mempunyai substituen yang derajatnya sama, maka yang terbentuk adalah produk campuran. Seperti pada 2-pentena berikutnya. Ikatan rangkap pada 2-pentena masing-masing mengikat satu substituen alkil sehingga akan menghasilkan produk campuran 3-kloropentana dan 2-kloropentana. H CH3CH2C CH3CH2CH CHCH3 + HCl Cl 2-pentena H H CCH3 + H CH3CH2C H H CCH3 Cl 2-kloropentana 3-kloropentana Adisi hidrogen halida dengan aturan markovnikov ini juga berlaku pada senyawa alkuna. CH3CH2C CH CH3CH2C CH + HBr Br H d. Adisi borana Diborana (B2H6) adalah suatu gas toksik yang dalam dietil eter akan berdisosiasi menjadi borana BH3. Borana akan bereaksi dengan cepat dan kuantitatif dengan alkena membentuk organoborana (R3B). reaksi adisi borana berlangsung dalam tiga tahap. Pada tiap tahapnya satu gugus alkil ditambahkan pada borana. H2C CH2 + H B H H BH2 H3C CH2 H2C CH2 H3C H2C B CH2 CH3 H3C CH2 2. H2C CH2 BH CH2 CH3 H3C CH2 Oksidasi Alkena dapat mengalami reaksi oksidasi yang akan membentuk senyawa glikol (diol), epoksida, pemaksapisahan (cleavage), dan oksidasi sempurna membentuk CO2 dan H 2O 64 Kimia Organik a. Oksidasi oleh KMnO4(hidroksilasi) Pembentukan 1,2-diol pada alkena dapat terjadi karena reaksi antara alkena dengan KmnO4 H H2O NaOH + KMnO4 H Sikloheksena b. OH OH sikloheksan-1,2-diol Pembentukan epoksida Suatu alkena yang direaksikan dengan asam peroksi akan menghasilkan senyawa epoksida atau oksirana. asam peroksi yang lazim digunakan adalah asam peroksibenzoat (C6H5CO3H) dan asam m-kloroperoksibenzoat. Cl Cl O H2C CH2 + COOH CH2 H2C oksirana Asam m-kloroperoksibenzoat c. O O + COH asam m-klorobenzoat Pemaksapisahan (cleavage) Oksidasi alkena dengan pemaksapisahan akan menghasilkan produk yang berbeda, tergantung pada kondisi oksidasi dan struktur alkena. Produk oksidasi pemaksapisahan ditentukan oleh ada tidaknya atom hidrogen yang terikat pada ikatan rangkap (karbon sp2). Bila tiap karbon alkena tidak mengikat hidrogen makan akan dihasilkan dua molekul keton. H3C C H3C C CH3 CH3 H3C [O] C CH3 H3C O + O C CH3 Bila karbon alkena mempunyai satu hidrogen, maka produk yang dihasilkan adalah aldehida atau asam karboksilat 65 Kimia Organik CH3 H3C H3C CH3 C C [O] H C H H [O] O + O C H aldehid CH3 H3C C O + O C OH HO asam karboksilat jika pada satu sisi ikatan rangkap alkena tersubsitusi dua alkil, sedangkan sisi yang lain hanya tersubstitusi satu alkil maka produk yang dihasilkan suatu keton pada sisi yang tersubstitusi dua alkil, dan pada sisi yang hanya tersubstitusi satu alkil akan menghasilkan aldehid atau asam karboksilat. CH3 H3C H3C C H C CH3 CH3 C [O] O + O CH3 keton H aldehid [O] CH3 H3C C O + O C CH3 HO asam karboksilat E. C keton PEMBUATAN ALKENA DAN ALKUNA 1. Dehidrasi alkohol (pengambilan / pengeluaran H2O) Reaksi pembuatan alkena dapat dibuat dengan reaksi eliminasi alkohol dalam asam kuat (H2SO4) atau menggunakan Al2O3. H3C CH2 CH2 OH H2SO4 pekat 1800C H3C C H CH2 + H2O Bila digunakan alkohol sekunder atau primer maka pereaksi yang digunakan adalah H2SO4 encer karena penggunaan H 2SO4 pekat akan menghasilkan polimerisasi alkena. Kereaktivan alkohol terhadap reaksi eliminasi adalah sebagai berikut : 66 Kimia Organik Alkohol primer > alkohol sekunder > alkohol tersier 180 C 2. Eliminasi alkil halida(dehidrohalogenasi) Reaksi eliminasi alkil halida akan menghasilkan alkena dengan menggunakan pereaksi KOH dalam alkohol dengan pemanasan. H3C CH2 CH2 Cl + KOH etanol H3 C C H CH2 + H2O + KCl 3. Cracking (pemecahan) Adalah pemecahan molekul besar menjadi molekul kecil dengan pengaruh tekanan dan temperature tinggi. 500 - 7000c H3C CH3 H2C Pt CH2 + H2 4. Pembuatan alkuna Alkuna dapat juga dibuat dengan menggunakan reaksi eliminasi tetapi dibutuhkan kondisi yang lebih kuat sehingga kadang dijumpai perpindahan ikatan rangkap tiga dari satu posisi rantai ke posisi lain. Reaksi lain untuk pembuatan alkuna adalah dengan reaksi dehidrohalogenasi alkil dihalida : H H3C C CH2 + 2 KOH Cl Cl F. H3C C CH + 2KCl + 2 H2O SUKU TERPENTING ALKENA DAN ALKUNA 1. CH2=CH2 : etena Gas yang tidak berwarna dan hampir tidak berbau, terbakar dengan nyala yang terang sehingga digunakan dalam gas lampu, etena juga digunakan untuk memeram buah-buahan, serta sebagai obat anestetik tetapi untuk penggunaan ini sangat berbahaya karena mudah meledak dengan udara. CH≡CH : ase len : etuna : gas karbid Kegunaan asetilen adalah untuk las, akan menghasilkan panas dengan suhu tinggi 0 (2500 -30000C), penerangan, untuk membuat asam cuka, alkohol, benzene dan bahan plastik. 2. 67 Kimia Organik LATIHAN 1. Tuliskan rumus struktur untuk senyawa berikut ini : A. Difeniletuna B. 1-etilsiklopentena C. 3-metil-1,5-heksadiuna D. 3-buten-1-ol 2. Apa nama senyawa berikut ini : CH3(CH2)7C CH A. H3C B. H C H C CH2CH3 CH2 C. CH3 D. 3. H3C C C C CH Jelaskan apakah pasangan senyawa dibawah ini yang merupakan isomer geometrik cistrans atau isomer struktur ? A. B. C. H CH2CH2CH3 C C H3 C H H CH2CH3 C C H3CH2C H H CH3 C C BrH2C H H CH2CH3 C C Br H H CH3 C C HOH2C H H H C C HOH2C CH3 68 Kimia Organik 4. Tuliskan persamaan reaksi untuk alkena dan alkuna berikut ini : A. CH3CH=C(CH3)2 dengan H2 B. 2-butuna dengan 2 mol Br2 C. 2-metil-2-pentena dengan proses pemaksapisahan D. CHCH3 E. 5. + HI Siklopentena dengan KMnO4 Tuliskan reaksi pembuatan senyawa berikut ini : a. Pembuatan 1-pentena dari 1-bromopentena dengan larutan KOH dalam etanol b. Pembuatan 1-butuna dari 1,2-dibromobutana Petunjuk Jawaban Latihan 1. A. difeniletuna, fenil merupakan suatu cincin aromatik dari benzen yang bila terikat pada suatu gugus fungsional maka benzen tersebut menjadi substituen dengan nama fenil. Difenil berarti terdapat dua cincin fenil yang terikat pada etuna suatu alkuna dengan dua karbon. C B. C 1-etilsiklopentena, induk dari senyawa ini adalah siklopentena yang mempunyai substituen etil pada karbon nomor 1. CH2CH3 C. D. 2. A. B. C. D. 3-metil-1,5-heksadiuna, merupakan senyawa alkadiuna dengan 6 karbon yang ikatan rangkap tiga ada pada posisi karbon 1 dan 5, dan mempunyai substituen metil pada karbon 3. HC C CH CH2 C CH CH3 3-buten-1-ol, merupakan senyawa alkohol dengan rantai karbon anggota 4 dimana gugus fungsi alkohol (-OH) ada pada karbon 1 dan mempunyai ikatan rangkap pada karbon nomor 3 H2C CH CH2 CH2 OH suatu senyawa alkuna, mempunyai anggota 10 karbon dengan ikatan rangkap 3 terletak pada karbon 1, 1-dekuna senyawa alkena dengan gugus yang sama berada pada posisi berseberangan, trans-2-pentena rantai induknya berupa sikloheksana dengan substituen metil dan metilena, 1metil-2-metilenasikloheksana senyawa alkuna 5 karbon, ikatan rangkap 3 ada pada posisi 1 dan 3, 1,3pentadiuna 69 Kimia Organik 3. A. 2-heksena dan 3-heksena yang letak ikatan rangkap pada karbon yang berbeda, sehingga pasangan alkena ini adalah suaru isomer struktur 1-bromo-2-butena dan 1-bromo-1-butena, pasangan isomer struktur karena letak ikatan rangkapnya berbeda Trans-2-buten-1-ol dan cis-2-buten-1-ol merupakan isomer geometri karena letak gugus yang sama berada pada posisi yang berbeda B. C. 4. CH3 H3C HC C CH3 a. + b. H3C C C CH3 c. H3C H2 Br Br H3C C C CH3 Br Br 2 Br2 CH2CH3 C H3C + CH3 CH3 CH2 CH CH3 H3C [O] C CH2CH3 C H O + O C H3C H [O] H3C CH2CH3 C O + O H3C OH I d. CHCH3 e. + + HI KMnO4 H2O NaOH C CH2CH3 OH OH 5. a. CH3CH2CH2CH2CH2Br + KOH b. H2C CH CH2 CH3 Br Br 2 KOH + etanol CH3CH2CH2CHCH2 + HC C CH2 CH3 + 70 H2O + KCl 2 H2O+ 2 KCl Kimia Organik RINGKASAN 1. 2. 3. 4. 5. 6. Alkena adalah senyawa hidrokarbon yang mempunyai ikatan rangkap dua karbonkarbon. Sedangkan alkuna adalah hidrokarbon yang mempunyai ikatan rangkap tiga karbon-karbon. Ikatan rangkap pada alkena menyebabkan alkena bersifat tidak jenuh. Rumus umum alkena adalah CnH2n dan alkuna CnH2n-2. Isomer cis-trans akan terjadi apabila satu atom karbon ikatan rangkap mengikat substituen yang berbeda dan ada substituen yang sama pada dua karbon iktan rangkap tersebut. Penamaan untuk alkena dan alkuna digunakan nama alkana tetapi akhiran – ana pada alkana diganti –ena untuk alkana dan –una untuk alkuna. Karbon pada ikatan rangkap mendapatkan nomor serendah mungkin, kecuali ada gugus fungsi lain yang lebih berprioritas. Sifat fisik alkena dan alkuna praktis identik dengan alkana padanannya, bersifat nonpolar tetapi alkena dan alkuna relatif lebih larut dalam air dibandingkan alkana. Alkena dan alkuna dapat mengalami reaksi adisi dan oksidasi. Reaksi adisi yang dapat terjadi adalah adisi dengan hidrogen, asam halida, halogen, dan borana. Reaksi oksidasi yang terjadi melibatkan KMnO4, pembentukan epoksida (oksirana) dan pemaksapisahan. Pembuatan alkena dan alkuna dapat dilakukan dengan cara eliminasi yaitu dengan alkohol dan alkilhalida. TES 2 1. Berikut ini nama untuk senyawa CH≡CH yang tepat adalah… A. etilena B. asetilen C. vinil D. alil 2. Substituen =CH2 diberi nama : A. metilena B. etilena C. vinil D. alil 3. Apa nama IUPAC untuk senyawa berikut ini : (CH3)2C=CHCH3 A. 1,1-dimetil-1-propena B. isopropilpropena C. 2-metil-2-butena D. 2-metil-3-butena 71 Kimia Organik 4. Pernyataan berikut ini yang tidak sesuai untuk senyawa alkena adalah : A. Merupakan senyawa tidak jenuh B. Mempunyai rumus umum CnH2n C. Tidak larut dalam air, tetapi larut dalam etanol dan benzena D. Mempunyai ikatan rangkap 5. Reaksi hidrogenasi alkena akan menghasilkan senyawa : A. Alkana B. Alkena C. Alkuna D. Alkilhalida 6. Produk oksidasi dengan pemaksapisahan dari 2,3-dimetil-2-butena adalah : A. 2 molekul keton B. Keton dan aldehida C. Aldehida dan asam karboksilat D. Keton dan asam karboksilat 7. 1-butanol yang direaksikan dengan asam sulfat pekat pada suhu 180 0 Cakan menghasilkan : A. Asam butanoat B. 2-butanol C. 1-butena D. 1-klorobutana 8. 1-propena bila direaksikan dengan HBr akan menghasilkan senyawa : A. 2-bromopropana B. 1-bromopropana C. 1-propanol D. 1,2-dibromopropana 9. Pembuatan alkena dapat dilakukan dengan cara sebagai berikut ini, kecuali : A. Dehidrasi alkohol B. Eliminasi alkil halida C. Cracking (pemecahan molekul besar) D. Pembentukan epoksida 72 Kimia Organik 10. Asetilena suatu senyawa alkuna banyak digunakan untuk : A. Obat anastetik B. Pengelasan logam C. Memeram buah D. Pelarut 73 Kimia Organik Petunjuk Jawaban Tes Tes1 1. C 2. B 3. 4. 5. C D B 6. 7. 8. 9. 10. C C D A A Tes 2 1. B. 2. A. 3. C. 4. C. 5. A. 6. 7. 8. 9. 10. A. C. A. D. B. penamaan berdasarkan rantai terpanjang yang memiliki substituen lebih banyak hibridisasi pada alkana adalah sp3 karena semua karbonnya mengikat 4 gugus atom lain penamaan mengikuti aturan IUPAC alkana berwujud cairan pada temperatur kamar untuk alkana C 5 – C17 setiap penambahan CH2 pada rantai alkana akan menaikkan titik didih sekitar 300C sesuai penamaan aturan IUPAC untuk senyawa sikloalkana C3H8 + 5O23 CO2 + 4H2O dibutuhkan 5 mol O2 C sekunder adalah karbon mengikat dua atom C yang lain 60 – 90 % gas alam terdiri dari metana alkana dapat dibuat dari alkena yang dihidrogenasi dengan H2 dan katalis Ni nama trivial dari etuna adalah asetilena metilena atau metiliden untuk substituen =CH2 letak metil dan ikatan rangkap pada C2 dari butena alkena senyawa nonpolar tidak larut dalam etanol hidrogenasi adalah reaksi adisi dengan H2 yang pada alkena akan menghasilkan alkana 2 molekul keton 1-butena, reaksi dehidrasi alkohol 2-bromopropana, adisi asam halida yang mengikuti aturan markovnikov epoksida merupakan hasil reaksi oksidasi suatu alkena asetilena atau gas karbid digunakan untuk pengelasan logam 74 Kimia Organik Daftar Pustaka Fessenden, R.J., Fessenden, J.S, Alih Bahasa Pudjaatmaka, A.H, 1982, Kimia Organik Jilid 1, edisi ke-3 Jakarta : Erlanggan McMurry, J., 2007, Organic Chemistry,7th edition, California : Wadsworth Inc. Morrison, R.T, Boyd,R.N, 1992, Organic Chemistry, 7th edition, New Jersey : Prentice Hall Inc. Riawan, S, 1990, Kimia Organik, Jakarta : Binarupa Aksara 75 Kimia Organik BAB III SENYAWA ALKOHOL, ETER, ALKIL HALIDA, DAN AMINA Wardiyah, M.Si, Apt PENDAHULUAN Kita sudah mempelajari tentang senyawa karbon dari golongan hidrokarbon yaitu alkana, alkena, dan alkuna. Pada bab 3 ini kita akan mempelajari tentang senyawa organik yang mempunyai gugus fungsi yaitu alkohol, eter, alkil halida, dan amina. Untuk memudahkan mempelajari bab 3 ini maka anda harus sudah mempelajari dahulu bab 1 dan bab 2. Alkohol merupakan ssnyawa organik dengan gugus fungi hidroksil dalam kehidupan sehari-hari alkohol banyak kita jumpai sebagai bahan bakar, pelarut maupun antiseptik, contohnya adalah metanol dan etanol. Eter banyak digunakan sebagai anaestetik misalnya dietil eter. Senyawa amina tersebar luas dalam tumbuhan dan hewan. Banyak dari senyawa amina yang mempunyai aktivitas farmakalogi misalnya norepinefrin. Senyawa organohalogen atau alkil halida banyak ditemukan dalam bahan-bahan organik sintetik sebagai desinfektan, pelarut, atau insektisida. Untuk memudahkan mempelajari tentang senyawa-senyawa alkohol, eter, alkil halida, dan amina maka pada bab 3 ini akan dibagi dalam 3 topik yaitu : Topik 1 : alkohol dan eter Topik2 : alkil halida Topik3 : amina Setelah mempelajari bab 3 ini mahasiswa diharapkan dapat mencapai tujuan pembelajaran yaitu : 1. menyebutkan rumus umum dari alkohol, eter, alkil halida, dan amina 2. mengidentifikasi senyawa alkohol, eter, alkil halida, dan amina 3. memberikan penamaan pada senyawa alkohol, eter, alkil halida, dan amina 4. menuliskan rumus struktur untuk senyawa alkohol, eter, alkil halida, dan amina 5. menjelaskan sifat-sifat senyawa alkohol, eter, alkil halida, dan amina 6. menjelaskan hubungan struktur dan sifat-sifat dari alkohol, eter, alkil halida, dan amina 7. menuliskan contoh reaksi pada senyawa alkohol, eter, alkil halida, dan amina 8. menuliskan reaksi pembuatan alkohol, eter, alkil halida, dan amina 9. menjelaskan contoh-contoh alkohol, eter, alkil halida, dan amina dalam kehidupan sehari-hari 76 Kimia Organik Agar dapat lebih memahami materi kimia organik maka anda harus membaca dan memahami dengan baik materi yang ada kemudian kerjakan latihan-latihan yang ada dan dilanjutkan dengan mengerjakan tes yang ada di bagian akhir tiap topik. 77 Kimia Organik Topik 1 Alkohol dan Eter Pada bab 1 kita sudah pelajari tentang alkohol dan eter sebagai isomer gugus fungsi. Alkohol dan eter memiliki rumus molekul yang sama tetapi struktur dan gugus fungsinya berbeda. gugus fungi adalah pusat kereaktifan dan sifat suatu molekul. Alkohol dalam kehidupan sehari-hari banyak kita jumpai. Masyarakat awam menyebut alkohol untuk etanol yaitu suatu jenis alkohol dengan dua karbon pada gugus alkilnya. Etanol digunakan sebagai pelarut, desinfektan atau bahkan minuman keras. Alkohol paling sederhana yaitu metanol lebih dikenal sebagai spiritus yang digunakan sebagai bahan bakar. Metanol merupakan bahan yang sangat toksik yang bisa menyebabkan kebutaan bila dikonsumsi dalam jumlah kecil, sedangkan bila dikonsumsi berlebihan metanol akan dapat menyebabkan kematian. Di bidang industri, metanol digunakan sebagai pelarut dan bahan baku pembuatan formaldehid (CH2O) dan asam asetat (CH3COOH). Golongan alkohol lain misalnya 2-propanol digunakan sebagai pembunuh kuman. Alkohol yang digunakan sebagai minuman dibuat dari fermentasi gula yang terkandung dalam biji-bijian seperti jagung, sorgum, dan juga berasal dari buahbuahan seperti anggur. Alkohol untuk tujuan industrial dibuat dari sintetis etilena yang dihidrasi dengan katalis asam kuat. Gambar 3.1 minuman alkoholik Alkohol memiliki rumus umum CnH2n+1OH atau R-OH, R merupakan lambang dari senyawa alkil, yaitu hidrokarbon rantai terbuka. Penggolongan alkohol berdasarkan pada adanya gugus hidroksil –OH yang terikat pada atom karbon dengan hibridisasi sp3. Sedangkan –OH yang terikat pada karbon terhibridisasi sp2 disebut sebagai senyawa enol. OH OH C C alkohol enol 78 C Kimia Organik Eter dikenal dalam kehidupan sehari-hari, misalnya dietil eter digunakan sebagai anestetik. Eter adalah golongan senyawa organik yang memiliki rumus umum C nH2n+1 – O – CmH2m+1 atau dilambangkan dengan R – O – R’. Alkohol dan eter terdiri dari molekul polar. Eter dapat berbentuk rantai terbuka maupun siklik. Untuk eter siklik dengan cincin lima anggota atau lebih, maka sifatnya akan mirip dengan eter rantai terbuka padanannya. Epoksida mengandung cincin eter beranggota tiga, epoksida ini lebih reaktif dibanding eter lainnya karena ukuran cincinnya kecil. Sistem cincin besar dengan satuan berulang –OCH2CH2- disebut eter mahkota yang merupakan pereaksi yang dapat digunakan untuk membantu melarutkan garam anorganik dalam pelarut organik. O H2 C CH2 epoksida atau oksirana eter mahkota LATIHAN A. 1. Tata nama Alkohol Berdasarkan kedudukan gugus OH dalam rantai atom C, maka alkohol dibagi atas: a. alkohol primer yaitu apabila gugus OH terikat pada atom C primer, yaitu atom C yang satuikatannyamengikatsatu atom C lain. b. alkohol sekunder yaitu apabila gugus OH terikat pada atom C sekunder, yaitu atom C yang telah terikat pada dua buah atom C lain. c. Alkohol tersier yaitu apabila gugus OH terikat pada atom C tersier, yaitu atom C yang telah diikat oleh tiga atom C lain. OH H3C C OH OH H H alkohol primer H3C C H CH3 alkohol sekunder H3C C CH3 CH3 alkohol tersier Penamaan secara umum untuk alkohol adalah akhir anana pada alkana diganti dengan anol atau diol atau triol dan atom C pada rantai utama diberi nomor sedemikian rupa sehingga gugus OH menempati nomor terkecil. Urutan pemberian nama untuk alkohol mengikuti aturan sebagai berikut : 79 Kimia Organik 1. 2. 3. 4. sebutkan nomor dari atom C tempatterikatnyaguguscabang sebutkan nama dari gugus cabang tersebut sebutkan nomor atom C yang mengikat gugus OH tersebut sebutkan nama rantai utamanya OH 1 H3C OH C 2 3 4 CH2CH3 OH CH3 2-metil-2-butanol 1,4-sikloheksanadiol atau sikloheksan-1,4-diol Bila terdapat lebih darisatugugushidroksil, digunakanpenamaandengan awalan di, tri, dansebagainyasebelumakhirn –ol. OH OH CH3 CHCH2CHCH3 1,4-Pentanadiol atau pentan-1,4-diol 2. Eter Eter rantai terbuka yang sederhana biasanya diberi nama dengan nama trivial sebagaieteralkil. Bila terdapat lebih dari satu gugus alkoksil (RO-) atau terdapat gugus fungsional yang lebih tinggi prioritasnya penamaannya menggunakan awal analkoksi. contoh : OH H3CH2C O CH2CH2CH3H3CH2C etil propil eter O CH2CHCH3 3-etoksi-2-propanol CH3OCH2CH2OCH3 1,2-dimetoksietana 80 Kimia Organik untuk suatu epoksida, dalam sistem IUPAC disebut oksirana, dengan nomor cincin, oksigen selalu diberi nomor 1. O O H2C CH2H3CHC oksirana B. CHCH2CH3 2-etil-3-metiloksirana SIFAT FISIS ALKOHOL DAN ETER Alkohol dapat membentuk ikatan hidrogen antar molekul-molekulnya sehingga titik didih alkohol lebih tinggi daripada titik didih alkil halida atau eter yang bobot molekulnya sebanding. Karena kemampuan membentuk ikatan hidrogen ini maka kelarutan alkohol dibandingkan alkil halida yang sebanding juga lebih besar. Alkohol berbobot molekul rendah larut dalam air, sedangkan alkil halida padanannya tidak larut. Alkohol R-OH memiliki bagian hidrofob (R-) dan hidrofil (-OH). Bagian hidrokarbon dari suatu alkohol bersifat hidrofob yakni menolak molekul-molekul air. Makin panjang rantai hidrokarbon maka makin rendah kelarutan alkohol dalam air. Bila rantai hidrokarbon cukup panjang, sifat hidrofobnya akan dapat mengalahkan sifat hidrofil (menyukai air) gugus hidrofil.Peningkatan kelarutan sebanding dengan bertambahnya jumlah gugus hidroksil dalam senyawa. Semakin banyak gugus hidroksil maka kelarutannya semakin tinggi. Eter (R – O – R) tidak mempunya atom hidrogen yang terikat pada oksigen sehingga eter tidak dapat membentuk ikatan hidrogen antar molekulnya. Tetapi eter dapat membentuk ikatan hidrogen dengan air, alkohol, atau fenol. Karena kemampuannya ini maka kelarutan dietil eter dan 1-butanol sebanding, keduanya mempunyai 4 karbon. C. REAKSI-REAKSI PADA ALKOHOL 1. Reaksi substitusi dalam larutan asam alkohol dapat mengalami reaksi substitusi : CH3CH2CH2CH2 – OH + H – Br H2SO4 CH3CH2CH2CH2 – Br + H2O 1-butanol 1-bromobutana (95%) (CH3)3C – OH + H – Cl (CH3)3C – Cl + H2O t-butil alkohol t-butil klorida (88%) tetapi alkohol tidak mengalami substitusi pada larutan netral atau basa. Karena gugus pergi (leaving group) haruslah basa yang cukup lemah. –OH yang akan menjadi gugus pergi dari suatu alkohol dalam larutan netral atau basa adalah suatu basa kuat karenanya alkohol akan menjadi gugus pergi yang buruk. 81 Kimia Organik 2. Reaksi Eliminasi alkohol akan bereaksi eliminasi dan menghasilkan alkena. Karena air dilepaskan dalam eliminasi ini maka reaksi ini disebut reaksi dehidrasi. tersier 600C 3. : (CH3)3COH H2SO4 pekat (CH3)2C=CH2 + H2O sekunder : 1000C (CH3)2CHOH H2SO4 pekat CH3C=CH2 + H2O primer CH3CH2OH : H2SO4 pekat CH2=CH2 + H2O 1800C Reaksi Oksidasi Alkohol alkohol dapat dioksidasi menjadi keton, aldehida atau asam karboksilat O RCH RCH2OH RCO2H Suatu alkohol primer yang dapat dioksidasi menjadi aldehida dan asam karboksilat OH RCHR [O] O RCR Alkohol sekunder akan dioksidasi menjadi keton sedangkan alkohol tersier tidak dapat dioksidasi. D. REAKSI PADA ETER Eter bersifat sangat tidak reaktif walaupun eter memiliki gugus fungsional. Sifat eter ini mirip dengan sifat alkena. Sangat sulit untuk mereaksikan eter dengan reagensia laboratorium melalui mekanisme oksidasi, reduksi, eliminasi atau reaksi dengan basa. Tetapi eter mudah mengalami reaksi auto-oksidasi dan pembakaran. Tetapi bila eter dipanaskan dengan asam, HI atau HBr eter dapat bereaksi substitusi menghasilkan alkohol dan alkil halida. Alkohol dari hasil reaksi substitusi ini dapat bereaksi lebih lanjut dengan HI atau HBI yang akan membentuk alkil halida tambahan. 82 Kimia Organik kalor CH3CH2OCH2CH3+ HBr CH3CH2Br + CH3CH2OH HBr CH3CH2Br E. PEMBUATAN ALKOHOL Alkohol dapat dibuat dengan beberapa reaksi yaitu reaksi substitusi alkil halida dengan ion hidroksida, reaksi dengan peraksi grignard, reduksi gugus karbonil, hidrasi alkena dan peragian (fermentasi). 1. Reaksi substitusi alkil halida Adalah reaksi antara suatu alkil halida dan ion hidroksida. Alkohol primer dapat dibuat dengan cara mereaksikan alkil halida primer yang dipanasi dengan natrium hidroksida dalam air. kalor CH3CH2CH2CH2OH + BrCH3CH2CH2CH2Br + OH1-butanol 1-bromobutana 2. Reaksi Grignard Alkohol primer, sekunder, dan tersier dapat dibuat dengan menggunakan pereaksi grignard. Pereaksi grignard merupakan senyawa dengan rumus umum RMgX, dimana R adalah alkil atau aril (cincin aromatik), X adalah halogen. Reaksi pembuatan alkohol dengan pereaksi grignard akan memberikan produk alkohol dengan perpanjangan rantai. Reaksi grignard dapat terjadi pada formaldehid, aldehid, atau keton, dimana reaksi dengan formaldehida menghasilkan alkohol primer, dengan aldehid lain menghasilkan suatu alkohol sekunder, dengan keton menghasilkan suatu alkohol tersier. Reaksi grignard ini terjadi dalam kondisi asam dalam pelarut air. O H RMgX H R'MgX H O R RCH2OH alkohol primer OH O R H2O, H+ H2O, H+ R"MgX R' H2O, H+ RCHR' alkohol sekunder OH RCR' R" alkohol tersier 83 Kimia Organik Contoh pembuatan alkohol dengan reaksi grignard : O CH3MgBr H H OMgBr H C H CH3 OH H C H CH3 H2O, H+ H3 C CH3CH2MgBr H OMgBr H3 C C H CH2CH3 H2O, H+ etanal CH3CH2MgBr O H3C Mg OH Br etanol formaldehid O + CH3 OMgBr H3C C CH3 CH2CH3 OH + H3C C H CH2CH3 2-butanol H2O, H+ OH H3C C CH3 + CH2CH3 Mg OH Br Mg OH Br 2-metil-2-butanol propanon 3. Reduksi senyawa karbonil Pembuatan alkohol dapat juga dilakukan dengan reaksi reduksi gugus karbonil. Hidrogen ditambahkan pada gugus karbonil tersebut. Reaksi ini dapat dilakukan dengan reaksi hidrogenasi katalitik atau menggunakan suatu reduktor hidrida logam misalnya natrium borohidrida (NaBH4) atau litium aluminium hidrida (LiAlH4). O H2 katalis Ni siklopentanol siklopentanon O H 3C C OH kalor, tekanan NaBH4 CH3 H2O, H+ OH H3 C C H 4. CH3 Hidrasi alkena Adalah proses pembuatan alkohol dengan pengolahan alkena dengan air dan suatu asam kuat, yang berperan sebagai katalis. Pada reaksi ini unsur-unsur air (H + dan OH-) akan 84 Kimia Organik mengadisi (ditambahkan ke dalam) ikatan rangkap. Karena adanya penambahan unsur air maka reaksi ini disebut juga dengan reaksi hidrasi. CH3CH CHCH3 + H2O 2-butena H+ OH CH3CH2 CH3CH3 2-butanol 5. Peragian (Fermentasi) Proses ini biasanya digunakan dalam pembuatan etanol yang digunakan dalam minuman yang diperoleh dari peragian karbohidrat yang berkataliskan enzyme (fermentasi gula dan pati). C6H12O6enzime CH3CH2OH F. PEMBUATAN ETER 1. Sintesa Williamson Na-alkanoat + alkil halogen → eter + Na-halogen CH3CH2O - Na + X-CH2CH3 CH3CH2 – O – CH2CH3 + Na-X 2. Dehidrasi alkohol dengan H2SO4 pekat pada temperature 1300C 2CH3 – CH2 – OH H2SO4 CH3CH2 – O – CH2CH3 + H2O 0 130 C 3. R – X dengan Ag2O kering 2(CH3-CH2Cl) + Ag2O CH3CH2 – O – CH2CH3 + 2AgCl ↓ LATIHAN 1. Tuliskan struktur dari : A. 3-buten-1-ol B. 2,2-dimetil-1,4-heksanadiol C. diisopropil eter D. 3-metilsikloheksanol E. 1,5-dietoksipentana 2. Tuliskan reaksi yang terjadi pada alkohol berikut ini : A. CH3CH2CH2OH direaksikan dengan HBr B. 2-pentanol direaksikan dalam H2SO4 pekat dan pemanasan 85 Kimia Organik 3. Buatlah alkohol dari sikoheksena dengan menggunakan cara hidrasi alkena ! 4. Tuliskan reaksi antara propanon dengan CH3MgBr ! 5. Tuliskan reaksi substitusi etil propil eter dengan HI dan pemanasan Petunjuk mengerjakan latihan 1. Struktur dari : A. 3-buten-1-ol : senyawa ini merupakan golongan alkohol yang mempunyai ikatan rangkap. Rantai induknya terdiri dari empat karbon (dari butana) dengan gugus hidroksil pada karbon nomor satu dan ikatan pada karbon nomor tiga. CH2=CHCH2CH2OH B. 2,2-dimetil-1,4-heksanadiol : alkohol 6 karbon dengan gugus hidroksil pada posisi karbon 1 dan 4 serta mempunyai dua substituen metil pada karbon 2 H3C C. D. diisopropil eter : senyawa eter dengan dua isopropil (CH3)2CH – O – CH(CH3)2 3-metilsikloheksanol : senyawa alkohol siklik 6 karbon dengan substituen metil pada karbon ke-3, gugus hidroksil terletak pada posisi karbon ke-1 H3 C E. 2. OH 1,5-dietoksipentana : terdapat dua gugus etoksi pada posisi 1 dan 5 dari pentana CH3CH2 – O – CH2CH2CH2CH2CH2 – O – CH2CH3 Reaksi yang terjadi pada alkohol : A. CH3CH2CH2OH direaksikan dengan HBr, merupakan reaksi substitusi gugus hidroksil dengan halogen yang terjadi dalam asam kuat dan pemanasan H2SO4 CH3CH2CH2 OH + H-Br CH3CH2CH2 Br + H2O kalor B. 3. CH3 H2C HC H2C C CH2 OH OH CH3 2-pentanol direaksikan dalam H2SO4 pekat dan pemanasan, pada reaksi ini akan terjadi eliminasi gugus hidroksil sehingga akan terbentuk senyawa alkena OH H2SO4 CH3CH2CH CHCH3 CH3CH2CH2CHCH3 kalor Alkohol dari sikoheksena dengan menggunakan cara hidrasi alkena diolah dengan air dan asam kuat. 86 Kimia Organik + H2O OH H+ 4. Reaksi antara propanon dengan CH3MgBr, reaksi ini melalui jalur reagensia grignard sehingga akan dihasilkan suatu alkohol tersier. OH O H2O H3C C CH3 H3C C CH3 + CH3MgBr H+ CH3 5. Substitusi etil propil eter dengan HI dan pemanasan CH3CH2 I + CH3CH2 O CH2CH2CH3 + HI HO CH2CH2CH3 RINGKASAN Alkohol merupakan senyawa organik dengan gugus hidroksil terikat pada atom karbon. Rumus umum alkohol adalah CnH2n+1OH atau R-OH. Eter adalah senyawa organik dengan atom oksigen yang terikat diantara dua alkil, rumus umum dari eter adalah CnH2n+1 – O – CmH2m+1 atau dilambangkan dengan R – O – R’. Sifat Alkohol titik didihnya lebih tinggi dibandingkan alkil halida atau eter padanannya karena dapat membentuk ikatan hidrogen antar molekulnya. Alkohol mudah larut dalam air karena membentuk ikatan hidrogen dengan air. kelarutan alkohol dipengaruhi oleh ukuran gugus alkilnya karena alkohol mempunyai gugus hidrofob ( R) dan hidrofil (-OH). Eter tidak dapat membentuk ikatan hidrogen antar molekulnya tetapi dapat berikatan hidrogen dengan air atau alkohol. Alkohol dapat mengalami reaksi substitusi dengan halida asam, reaksi eliminasi membentuk alkena dan reaksi oksidasi. Eter lebih sulit bereaksi, eter dapat mengalami reaksi substitusi dengan HI atau HBr membentuk alkohol dan alkil halida. Alkohol dapat dibuat dengan reaksi substitusi alkil halida dengan ion hidroksida, reaksi dengan peraksi grignard, reduksi gugus karbonil, hidrasi alkena dan peragian (fermentasi). Eter dibuat dengan sintesa williamson, reduksi alkohol dengan asam sulfat pekat dan pemanasan, dan reaksi alkil halida dengan Ag2O kering. TES 1 1. Oksirana adalah …. A. epoksida B. cincin eter anggota tiga C. etilena oksida D. semua benar 87 Kimia Organik 2. Reduksi senyawa propanon dengan NaBH4 akan menghasilkan : A. propanaldehida B. propanal C. 2-propano D. 1-propanol 3. 1-bromopentana dipanasi dengan menggunakan NaOH dalam air akan menghasilkan : A. 1-pentana B. 1-heksana C. 1-pentanol D. pentanon 4. Formaldehid direaksikan dengan CH3CH2CH2MgBr dalam air dan suasana asam, maka akan dihasilkan : A. 1-propanol B. 1-butanol C. 2-propanol D. 2-butanol 5. CH3CH2Br CH3CH2CH2OH Pernyataan yang tepat untuk menggambarkan reaksi diatas adalah… A. merupakan reaksi substitusi alkohol dengan alkil halida B. reaksi Grignard dengan menggunakan etanal C. reaksi substitusi eliminasi alkohol D. reaksi Grignard dengan formaldehid 6. Oksidasi alkohol sekunder akan menghasilkan : A. aldehid B. keton C. asam karboksilat D. ester 7. sifat fisik alkohol sesuai adalah… A. Titik didihnya lebih rendah dibandingkan alkil halida padanannya B Titik didihnya lebih rendah dibandingkan eter padanannya C. Semakin panjang gugus R pada alkohol maka kelarutannya semakin rendah D. Bertambahnya gugus hidroksil akan mengurangi kelarutan alkohol 8. pernyataan yang tidak sesuai tentang eter adalah … A. Eter tidak dapat membentuk ikatan hidrogen antar molekulnya B. Eter dapat membentuk ikatan hidrogen dengan air dan alkohol 88 Kimia Organik C. D. Eter dapat dengan mudah mengalami reaksi eliminasi Dietil eter dan 1-butanol mempunyai kelarutan yang sebanding 9. Pernyataan yang sesuai untuk reaksi eliminasi alkohol adalah …. A. Menghasilkan senyawa alkil halida B. Disebut dengan reaksi dehidrohalogenasi C. Membutuhkan katalis Ni D. Reaksi terjadi dengan asam sulfat pekat dan pemanasan 10. Contoh senyawa alkohol yang banyak digunakan untuk bahan bakar tetapi mempunyai sifat toksik yang cukup kuat, diantaranya dapat menyebabkan kebutaan bila dikonsumsi dalam jumlah kecil dan bila dalam jumlah besar menyebabkan kematian adalah … A. Metanol B. Etanol C. Propanol D. Butanol 89 Kimia Organik TOPIK 2 AlkilHalida Alkil halida disebut juga dengan senyawa organohalogen. Kebanyakan senyawa organohalogen adalah senyawa sintetik, senyawa ini sangat jarang dijumpai di alam. Organohalogen dikenal sebagai pelarut, insektisida dan bahan-bahan bahan bahan dalam sintesis senyawa organik. Banyak senyawa organohalogen yang memiliki toksisitas tinggi sehingga Misalnya karbon tetraklorida (CCl4) dan kloroform penggunaannya harus sangat berhati-hati. berhati han pelarut dapat mengakibatkan kerusakan hati bila dihirup (CHCl3) yang merupakan bahan berlebihan. Insektisida (diklorodifeniltrikloroetana atau DDT) yang mengandung organohalogen yang digunakan dalam bidang pertanian dapat menyebabkan kerusakan lingkungan. 1,1,1--Trikloro-2,2-bis(4-klorofenil)etana Atau diklorodifeniltrikloroetana (DDT) Walaupun sebagian besar senyawa organohalogen adalah senyawa sintetik, tetapi terdapat senyawa organohalogen yang dijumpai di alam contohnya adalah tiroksin suatu penyusun hormon tiroid tiroglobulin dan griseofulvin suatu metabolit dari jamur yang n sebagai terapi antijamur. digunakan tiroksina Contoh lain dari senyawa organohalogen yang digunakan dalam bidang kefarmasian adalah halotana atau fluothan adalah suatu anestetik inhalasi yang berupa cairan bening tidak berwarna, mudah menguap dan berbau harum. 90 Kimia Organik Cl Br F F F 1,,1,1-trifluoro-2-bromo-2-kloroetana atau halotan Suatu contoh senyawa organohalogen lain yang telah disintesis dari alam adalah Senyawa epibatidin, yaitu senyawa yang diisolasi dari kulit katak Ekuador dan mempunyai efek 200 kali lebih kuat daripada morfin untuk memblokir rasa sakit pada hewan hewan. epibatidin A. TATA NAMA Berdasarkan posisi terikatnya halogen pada atom karbonnya, alkil halida dibedakan menjadi alkil halida primer, sekunder, dan tersier. Alkil halida primer apabila atom halogen terikat pada karbon primer, begitu juga dengan alkil halida sekunder dimana halogen terikat pada karbon sekunder dan untuk tersier atom halogen terikat apda karbon tersier. Br I CH3CH2CH2F fluoropropana alkil halida primer H3C C H CH2CH3 2-iodobutana 2 allkil halida sekunder H3C C CH3 CH3 t-butil bromidaa atau 2-bromo-2-metilproopana alkil halida tersierr stem IUPAC penamaan untuk alkil halida adalah gugus halogen disebutkan Dalam sistem terlebih dahulu baru diikuti dengan nama nama alkananya. Sedangkan dalam si sistem trivial, penyebutan nama diawali dengan nama alkilnya kemudian diikuti dengan nama halidanya. 91 Kimia Organik Cl Cl CH3CH2I C Cl Cl nama IUPAC :tetraklorometana nama trivial : karbon tetraklorida nama IUPAC : iodoetana nama trivial : etil iodida Berdasarkan gugus yang mengikat atom halogen, senyawa alkil halida dibedakan atas tiga macam yaitu alkil halida, aril halida dan halida vinilik. Alkil halida dilambangkan dengan RX adalah senyawa dimana atom halogen terikat pada rantai alkil terbuka, contohnya iodoetana, fluoropropana, dan lain-lain. Aril halida dilambangkan dengan ArX adalah apabila atom halogen terikat pada sebuah karbon dari suatu cincin aromatik, contohnya : CH3 Cl Cl klorobenzena Cl 2,4-diklorometil-benzena Halida vinilik merupakan senyawa organik dimana atom halogen terikat pada karbon berikatan rangkap, contohnya : CH2= CHCl kloroetena atau nama trivialnya vinil klorida. Senyawa alkil dihalida yaitu senyawa alkana dengan substituen dua halogen. Pada senyawa dihalida dibedakan menjadi dua yaitu geminal dan visinal. Geminal dihalida adalah dua atom halogen berikatan dengan atom karbon yang sama. Visinal dihalida adalahdua atom halogen berikatan dengan atom karbon yang bersebelahan. Br H H C C H H Br H geminal dihalida B. H H C C H Br Br visinal dihalida SIFAT FISIK ALKIL HALIDA Sifat fisik dari alkil halida dipengaruh oleh jumlah atom karbon dan atom halogennya. Peningkatan bobot molekul senyawa alkil halida akan menaikkan titik didih dan titik leburnya. Titik didihnya lebih tinggi dibandingkan alkana padanannya karena bobot molekulnya lebih tinggi. Titik didihnya bertambah tinggi dengan bertambahnya berat atom halogen, contohnya F titik didihnya paling rendah dan I titik didihnya paling tinggi. Atom halogen yang sama apabila terikat oleh rantai alkil yang berbeda maka bobot jenisnya akan berbeda. Makin panjang rantai alkilnya maka bobot jenisnya akan semakin 92 Kimia Organik kecil. Kerapatan (densitas) dari alkil halida cair lebih tinggi dibandingkan senyawa organik lain, misalnya air. Sebagai contohnya kloroform CHCl3 akan tenggelam dalam air karena densitasnya lebih besar dibandingkan air. Alkil halida tidak dapat membentuk ikatan hidrogen dan tidak larut dalam air. Alkil halida akan larut dalam alkohol, eter, dan pelarut organik lainnya. C. REAKSI-REAKSI ALKIL HALIDA 1. Reaksi substitusi Alkil halida mempunyai muatan positif parsial pada atom karbon ujungnya. Atom karbon ujung ini mudah diserang oleh suatu anion yang memiliki pasangan elektron menyendiri pada kulit terluarnya. Adanya karbon dengan muatan positif parsial ini menyebabkan alkil halida mengalami reaksi subsititusi. Dalam reaksi substitusi alkil halida, halida disebut gugus pergi (leaving group). Gugus pergi adalah gugus yang akan digantikan oleh spesi (anion) lain. Ion halida merupakan basa lemah sehingga ion halida berupakan gugus pergi yang baik. Suatu Basa kuat, misalnya OH- bukan gugus pergi yang baik. Urutan reaktifitas ion halida dalam reaksi substitusi adalah sebagai berikut : RF RCl RBr Naiknya reaktifitas RI Dalam reaksi substitusi alkil halida, ion iodida adalah halida yang paling mudah digantikan, baru ion bromida dan kemudian klorida. Sedangkan F bukan gugus pergi yang baik karena F merupakan basa yang lebih kuat daripada ion halida lain, dan karena ikatan C-F lebih kuat daripada ikatan C-X lain. HO- + CH3CH2 – Br CH3O- + CH3CH2CH2 – Cl CH3CH2 – OH + BrCH3CH2CH2 – OCH3 + Cl- Reaksi substitusi yang terjadi pada alkil halida melibatkan suatu nukleofil. Spesies yang menyerang suatu alkil halida dalam suatu reaksi substitusi disebut nukleofil (penyuka nukleus). Dalam persamaan reaksi di atas OH- dan CH3O- adalah nukleofil. Umumnya nukleofil adalah spesi yang akan tertarik ke pusat positif, jadi sebuah nukleofil adalah suatu basa lewis. Kebanyakan nukleofil adalah anion; namun beberapa molekul polar yang netral seperti H2O, CH3OH dan CH3NH2 dapat juga bertindak sebagai nukleofil. Substitusi oleh nukleofilik disebut substitusi nukleofil (SN) atau pergantian nukleofil. Lawan nukleofil ialah elektrofil (pencinta elektron). Elektrofil adalah spesi apa saja yang akan tertarik ke suatu pusat negatif. 93 Kimia Organik 2. Reaksi Eliminasi Reaksi eliminasi dapat terjadi apabila alkil halidad diolah dengan suatu basa kuat. Reaksi eliminasi ini akan menghasilkan suatu alkena. Reaksi eliminasi alkil halida disebut juga dengan reaksi dehidrohalogenasi karena keluarnya unsure dan X dari dalam alkil halida. Br H CH3CH2CH CH2 + OH- CH3CH2CH CH2 + H2O + D. PEMBUATAN ALKIL HALIDA 1. dari alkohol dengan HX R-OH + H-X R – X + HOH alkohol + PX3 atau PX5 (X : Cl, Br, I) contoh : a. 3CH3-CH2-OH + PCl3 3 R – Cl + H3PO3 b. CH3 – CH2 – OH + PCl5 R – Cl + POCl3 + HCl adisi alkena dengan HX (hukum Markovnikov’s dan hukum anti Markovnikov’s) R – CH = CH2 + HX R – CH – CH3 X substitusi alkana dengan halogen, dengan katalisator sinar matahari CH3CH2CH3 + Br2 CH3CH2CH2Br + HBr 2. 3. 4. E. Br- ALKIL HALIDA DALAM KEHIDUPAN SEHARI-HARI Senyawa alkil halida yang digunakan dalam kehidupan sehari-hari adalah sebagai bahan pelarut contohnya kloroform (CHCl3). Kloroform merupakan bahan yang berbau khas, selain sebagai pelarut kloroform digunakan juga sebagai bahan anestetik. Bahan anestetik lain dari golongan alkil halida adalah halotan. Alkil halida juga dikenal sebagai bahan pendingin ruangan, nama dagangnya sebagai freon yaitu CF2Cl2 CFCl3. Ada juga alkil halida yang berpolimerisasi yaitu politetrafluoroetena (-CF2=CF2-) dikenal dengan PTFE merupakan bahan yang digunakan sebagai pelapis alat masak yaitu teflon. LATIHAN 1. Gambarkan struktur dari alkil halida berikut ini : A. Bromosikloheksana B. Iodometana C. 2-bromo-5-metilheksana D. 1-iodo-2-metilpropana E. 2-kloro-1-etanol 94 Kimia Organik 2. identifikasikan jenis alkil halida berikut ini : H3C CH CH3 Cl H3C CH2 F I (CH3)3C Br 3. Tentukan hasil reaksi dari substitusi : A. 1-bromopentana dengan OHB. 1-klorobutana dengan CH3O- 4. metilpropena merupana hasil reaksi eliminasi dari 2-kloro-2-metilpropana dengan suatu basa kuat, jelaskan bagaimana reaksi ini dapat terjadi ! 5. tuliskan reaksi pembuatan alkil halida berikut ini : A. 1-butanol dengan H-Br B. metilsikloheksena dengan HI Petunjuk mengerjakan latihan 1. A. bromosikloheksana : senyawa sikloheksana dengan substituen bromo Br B. C. iodometana : merupakan senyawa metil halida, halogen yang terikat pada metil CH3I 2-bromo-5-metilheksana : rantai induknya heksana, dengan substituen bromo pada karbon 2 dan metil pada karbon 5 Br CH3 CH3CHCH2CHCH3 D. 1-iodo-2-metilpropana : rantai induknya propana dengan iodo pada karbon 1 dan metil pada karbon 2 CH3 CH3CHCH2 I E. 2-kloro-1-etanol : senyawa etanol yang mengikat halogen Cl CH2CH2OH 2. H3C CH CH3 Cl : H3C CH2 F : merupakan senyawa alkil halida sekunder karena Cl terikat pada C sekunder merupakan alkil halida primer karena F terikat pada C primer 95 Kimia Organik (CH3)3C Br : merupakan alkil halida tersier karena Br terikat pada C tersier I : merupakan aril halida karena iodo terikat pada gugus aromatik CH3CH2CH2CH2CH2 – Br + OH-CH3CH2CH2CH2CH2 – OH + BrCH3CH2CH2CH2 – Cl + CH3OCH3CH2CH2CH2 – OCH3 + Cl- 3. A. B. 4. reaksi eliminasi pada alkil halida terjadi dalam basa kuat, unsur H dan halogen keluar dari senyawa alkil halida. Cl ClH3C C CH2 + H2O + H3C C CH3 + OHCH3 CH3 5. A. 1-Butanol dengan HBr CH3CH2CH2CH2 B. OH + HBr metilsikloheksena dengan HI CH3 + CH3CH2CH2CH2 Br + H2O I HI CH3 H RINGKASAN 1. 2. 3. 4. 5. 6. 7. Alkilhalida disebut juga senyawa organohalogen. Alkilhalida dibedakan menjadi alkilhalida primer, sekunder, dan tersier. Sistem IUPAC untuk penamaan untuk alkilhalida adalah gugus halogen disebutkan terlebih dahulu baru diikuti dengan nama alkananya. Untuk penamaan sistem trivial, penyebutan nama diawali dengan nama alkilnya kemudian diikuti dengan namah alidanya. Sifatfisik dari alkilhalida dipengaruh oleh jumlah atom karbon dan atom halogennya. Peningkatan bobot molekul senyawa alkilhalida akan menaikkan titik didih dan titik leburnya. Makin panjang rantai alkilnya maka bobot jenisnya akan semakin kecil. Alkilhalida tidak dapat membentuk ikatan hidrogen dan tidak larut dalam air. Alkilhalida akan larut dalam alkohol, eter, dan pelarut organik lainnya. Alkilhalida dapat mengalami reaksi substitusi menghasilkan alkohol dan reaksi eliminasi membentuk alkena. Alkilhalida dapat dibuat melalui reaksi alkohol dengan HX atau PX3, adisialkena dengan HX, dan substitusi alkana dengan halogen. 96 Kimia Organik TES 2 1. Berikut ini adalah senyawa alkil halida, yang merupakan senyawa halida sekunderadalah : A. 1-iodo-3-metilbutana B. fluorometana C. ter-butil klorida D. bromosiklopentana 2. Kloroetena termasuk dalam jenis senyawa alkil halida : A. metil halida B. aril halida C. alkilhalida D. halida vinilik 3. manakah diantara senyawa alkilhalida berikut ini yang paling tinggi titik didihnya ? A. CH3I B. CH3Br C. CH3Cl D. CH3F 4. Manakah diantara pernyataan berikut ini yang tidak sesuai untuk menyatakan sifat fisik dari alkil halida : A. Peningkatan bobot molekul senyawa alkilhalida akan menaikkan titik didih dan titik leburnya B. Titik didihnya lebih rendah dibandingkan alkana padanannya karena bobot molekulnya lebih tinggi C. Titik didihnya menurun dengan bertambahnya berat atom halogen D. Makin panjang rantai alkilnya maka bobot jenisnya akan semakin besar 5. Apa nama IUPAC dari alkil halida berikut ini : Cl Cl A. B. C. D. 6. OH 1,1-dikloro-2-sikloheksanol 2,2-diklorosikloheksanol 1,1,2-diklorosikloheksanol 1,1-dikloro-2-sikloheksandiol 1-metilsikloheksanol apabila direaksikan dengan HCl akan menghasilkan : A. 1-metilsikloheksana B. 1-metilsikloheksena 97 Kimia Organik C. D. 1-metil-1-klorosikloheksana Metilenasikloheksana 7. Reaksi 2-metil-2-pentena dengan HBr menghasilkan : A. 2-bromo-2-metilpentana B. 2-bromo-2-metilpentena C. 3-bromo-3-metilpentana D. 2-bromo-2-metilpentanol 8. reaksi antara propil klorida dengan basa kuat dalam air akan menghasilkan A. 1-propanol B. 2-propanol C. Propena D. kloropropana 9. Tetrafluoroetena merupakan monomer dari polimer alkil halida yang banyak digunakan sebagai bahan pelapis alat masak anti lengket, bagaimana rumus struktur tetrafluoroetena tersebut ? A. F2C=CF2 B. CF4 C. CHCF3 D. CH2CF2 10. Senyawa alkil halida yang berbau khas, digunakan sebagai anestetik dan bersifat mudah terbakar adalah : A. CH3Cl B. CH2Cl2 C. CHCl3 D. CCl4 98 mengikuti aturan markovnikov akan Kimia Organik TOPIK 3 Amina Amina adalah senyawa organik yang merupakan turunan dari ammonia, amina atom nitrogen trivalen, mengandung atom-atom trivalen, yang terikat pada satu atom karbon atau lebih. Dalam bidang farmasi amina banyak dikenal sebagai senyawa yang mempunyai aksi farmakologi.Berdasarkan posisi ikatannya amina secara umum dikelompokkan dalam tiga jenis yaitu RNH2, R2NH atau R3N. Amina tersebar luas dalam tumbuhan dan hewan, da dan banyak amina yang mempunyai keaktivan faali, misalnya norepinafrina dan epinafrina (adrenalina). Adrenalin (epinefrin) A. KLASIFIKASI DAN TATA NAMA Berdasarkan gugus tempat terikatnya amina, maka amina dapat dikelompokkan dalam alkilamina dan arilamina. Amina diklasifikasikan diklasifikasikan berdasarkan jumlah sunstituen organik yang terikat pada nitrogen yaitu amina primer (R-NH (R 2), amina sekunder (R2NH), dan amina tersier la satu C terikat pada nitrogen contohnya CH3NH2 (metilamina), (R3N). Amina primer bila Amina sekunder bila dua C terikat pada nitrogen, contohnya C6H5NHCH3. Amina tersier bi bila tiga C terikat pada nitrogen, contohnya (CH3CH2)3N. Amina primer adalah senyawa amina dimana nitrogen hanya mengikat satu gugus alkil atau aril. NH2 R N H contoh H sikloheksilamina s Amina sekunder adalah senyawa amina dimana dua gugus alkil atau aril terikat pada atom nitrogen. H3C NH contoh R N H CH2CH3 R etil metil amina 99 Kimia Organik Amina tersier terbentuk apabila pada atom nitrogen terikat 3 gugus alkil atau aril. R N R contoh R H3C N CH2CH3 CH3 etil dimetil amina Perhatikan contoh berikut ini : CH3 CH3 H3C C OH H3C C NH2 CH3 CH3 t-butilamina t-butil alkohol amina primer alkohol tersier Perhatikan dua contoh di atas, walaupun posisi gugus –OH dan –NH 2 terikat pada jenis karbon yang sama tetapi klasifikasi kedua molekul tersebut berbeda. pada klasifikasi alkohol dan juga alkil halida berdasarkan pada jumlah gugus yang terikat pada karbon yang mengikat gugus hidroksil atau halida. Sedangkan pada amina klasifikasinya berdasarkan jumlah gugus alkil atau aril yang terikat pada atom nitrogen. Suatu nitrogen amina dapat memiliki empat gugus yang terikat padanya, dalam hal ini nitrogen merupakan bagian dari suatu ion positif. Jika satu atau lebih yang terikat pada N adalah H maka senyawanya disebut garam amina. Jika yang terikat keempatnya adalah alkyl atau aril tanpa ada H pada N maka senyawanya disebut garam ammonium kuartener. Contoh : (CH3)2NH2+ Cldimetilamonium klorida garam dari suatu amina sekunder 1. (CH3)4N+ Cltetrametilamonium garam ammonium kuartener Penamaan untuk amina mengikuti aturan sebagai berikut : Amina sederhana diberi nama berdasarkan system gugus fungsioanal. Gugus alkil atau aril disebut lebih dahulu kemudian ditambahkan akhiran amina. CH3CH2CH2CH2NH2 (CH3)2CHNH butilamina diisopropilamina 2. Untuk senyawa yang mempunyai dua gugus amina diberi nama dengan akhiran diamina dari alkana induknya dengan pemberian angka yang sesuai. H2NCH2CH2CH2NH2 1,3-propanadiamina 3. Untuk amina yang mempunyai substituen yang sejenis maka penamaannya dengan memberi awalan di- atau tri- pada senyawa alkil yang diikuti dengan amina. H3C N CH3 CH3 trimetilamina NH difenilamina 100 Kimia Organik 4. Untuk amina sekunder dan tersier yang mempunya substituen lebih dari satu, maka gugus alkil terbesar dianggap sebagai induk. Gugus alkil tambahan dinyatakan sebagai awalan N-alkil. H3C N CH2CH2CH3 H3C N CHCH2CH3 CH3 H CH3 N-metil-2-butilamina N,N-dimetilpropilamina 5. Amina yang memiliki gugus fungsi lebih dari satu dan memiliki prioritas tata nama yang lebih tinggi maka –NH2diberi nama menjadi amino. CO2H CH3CH2CH2CHCH2OH NH2 2-amino-1-pentanol C. NH2 Asam 3-aminobenzoat SIFAT FISIS AMINA Amina dapat membentuk ikatan hidrogen antara atom nitrogen dari amina dengan hidrogen dari air, amina primer, dan amina sekunder. Tetapi ikatan hidrogen antara N dengan H ini lebih lemah dibandingkan ikatan hidrogen O dengan H karena N kurang elektronegatif dibandingkan N sehingga ikatan NH menjadi kurang polar. Amina primer, sekunder, dan tersier yang berbobot molekul rendah mudah larut dalam air. Karena adanya pasangan elektron bebas dari N yang dapat berikatan dengan hidrogen dalam air. Tetapi untuk amina dengan bobot molekul besar kelarutannya akan makin berkurang karena semakin bertambahnya gugus hidrofob yaitu gugus alkil. Urutan kelarutan amina primer, sekunder, dan tersier adalah amina primer > amina sekunder > amina tersier. Karena pada amina primer mempunyai kemampuan membentuk ikatan hidrogen lebih banyak dibandingkan sekunder dan tersier. Amina primer mempunyai 2 hidrogen dan pasangan elektron bebas dari nitrogen, amina sekunder mempunyai 2 hidrogen dan pasangan elektron bebas dari nitrogen, sedangkan amina tersier hanya mempunyai pasangan elektron bebas dari nitrogen. CH3 H3C N H H O H O H H 101 Kimia Organik D. REAKSI PADA AMINA 1. Reaksi asam basa amina Amina dapat beraksi dengan asam membentuk suatu garam alkil amonium halida. CH3 CH3 + + H Cl H N HCl+ H N CH3 CH3 dimetil amina garam dimetil amonium klorida Amina dalam larutan air akan bersifat basa lemah karena akan menerima sebuah proton dari air, reaksi ini bersifat reversibel. CH3 OHH C N CH + H OH H C N+ H + 3 E. CH3 3 3 CH3 PEMBUATAN AMINA 1. Sintesis dengan reaksi substitusi Amina atau ammonia dapat bertindak sebagai suatu nukleofil dalam suatu reaksi substitusi dengan suatu alkIl halida karena amina atau ammonia mempunyai pasangan elektron menyendiri. H3 N + CH3 – CH2 – Br H3N+ - CH2 – CH3 Br – amonia bromoetana etilamoniumbromida suatu garam amina Pengolahan dengan basa : CH3CH2NH3+ Br - + OH CH3CH2NH2 + H2O + Br – Etilamina Pada sintesis dengan cara ini seringkali diperoleh hasil yang berupa campuran mono, di-,dan trialkil-amina serta garam ammonium kartener dari suatu reaksi antara ammonia dan suatu alkil halida. NH3RX RNH2RX R2NH RX R3N RX R4N+ X2. sintesis dengan reduksi a. reduksi senyawa nitro aromatik menjadi arilamina H3C NO2 Fe, HCl OH- H3C 102 NH2 Kimia Organik b. Nitril akan mengalami reduksi LiAlH4 untuk menghasilkan amina primer dengan tipe RCH2NH2 dengan rendemen sekitar 70 %. Nitril diperoleh dari alkIl halidA; oleh karena itu suatu sintesis nitril adalah suatu teknik memperpanjang suatu rantai karbon maupun pembuatan suatu amina. - (CH3)2CHCH2Br CN - Br 1-bromo-2-metilpropana (1) LiAlH4 + (2) H2O, H (CH3)2CHCH2CN 3-metilbutananitril (CH3)2CHCH2CH2NH2 (3-metil-1-butil)amina LATIHAN 1. 2. 3. 4. 5. Amina dan alkohol digolongkan dalam senyawa primer, sekunder, dan tersier. Apa yang membedakan penggolongan kedua senyawa tersebut ? Amina dibedakan menjadi alkil amina dan aril amina, berikan contoh kedua senyawa tersebut. Diantara amina primer, sekunder, dan tersier bagaimana sifat kelarutan ? Jelaskan sifat basa dari amina ! Gambarkan struktur dari senyawa berikut ini : A. 3-amino-2-butanon B. N,N-difenil-propilamina C. Trimetilamina D. 1,3-pentanadiamina Petunjuk mengerjakan latihan 1. Pada amina dasar penggolongannya adalah berdasarkan jumlah gugus alkil atau aril yang terikat pada amina. Sedangkan pada alkohol penggolongannya berdasarkan letak gugus hidroksil pada karbon ujung. 2. Alkil amina yaitu amina yang mengikat gugus alkil, sedangkan aril amina adalah amina yang mengikat gugus aromatik. CH3CH2CH2Br : bromo propana (alkil amina) Br bromobenzena (aril amina) 3. Urutan kelarutan amina primer, skeunder, dan tersier adalah amina primer > amina sekunder > amina tersier. Karena pada amina primer mempunyai kemampuan membentuk ikatan hidrogen lebih banyak dibandingkan sekunder dan tersier 103 Kimia Organik 4. 5. 5. Amina dalam larutan air akan bersifat basa lemah karena akan menerima sebuah proton dari air, reaksi ini bersifat reversibel. A. 3-amino-2-butanon, senyawa amina yang terikat pada senyawa keton O CH3CHCCH3 NH2 B. N,N-difenil-propilamina, amina tersier dengan 2 substituen fenil dan 1 propil N (CH2)2CH3 C. Trimetilamina, amina tersier dengan 3 substituen yang sama (metil) H3C N CH3 CH3 D. 1,3-pentanadiamina, senyawa diamina yang terikat pada karbon 1 dan 3 dari pentana CH3CH2CHCH2CH2 NH2 NH2 RINGKASAN Amina adalah senyawa organik mengandung atom-atom nitrogen trivalen, yang terikat pada satu atom karbon atau lebih. Amina diklasifikasikan dalam amina primer, sekunder, dan tersier berdasarkan jumlah substituen yang terikat pada nitrogen. Penamaan amina berdasarkan pada gugus fungsi amina, diawali nama alkil atau aril diikuti nama amina. Bila ada gugus yang lebih berprioritas maka amina diberi nama menjadi amino. Amina dapat membentuk ikatan hidrogen antara atom nitrogen dari amina dengan hidrogen dari air, amina primer, dan amina sekunder. Amina primer, sekunder, dan tersier yang berbobot molekul rendah mudah larut dalam air. Urutan kelarutan amina primer, sekunder, dan tersier adalah amina primer > amina sekunder > amina tersier. Amina dapat beraksi dengan asam membentuk suatu garam alkil amonium halida. Amina dalam larutan air akan bersifat basa lemah karena akan menerima sebuah proton dari air. Amina dapat dibuat melalui reaksi substitusi maupun reduksi. 104 Kimia Organik TES 3 1. Penggolongan amina berdasarkan pada : A. Jumlahsubstituenalkilatau aril yang terikat pada Nitrogen B. Jumlah Nitrogen yang mengikatalkil C. Jumlah atom H yang terikat pada nitrogen D. Jenis atom karbon yang mengikat nitrogen 2. Unsur-unsur penyusun senyawa amina adalah A. Nitrogen, hidrogen, karbon B. Karbon, nitrogen, oksigen C. Oksigen, nitrogen, hidrogen D. Nitrogen dan hidrogen 3. Yang merupakan contoh senyawa aril amina adalah : A. Sikloheksilamina B. Etilmetilamina C. Dietilamina D. Difenilamina 4. Contoh senyawa amina tersier adalah A. t-butilamina B. dimetilpropilamina C. N,N-dietilamina D. 1,2-etildiamina 5. Diantara amina berikut ini manakah yang kelarutannya paling rendah : A. Metilamina B. Dimetilamina C. Trimetilamina D. Etildiamina 6. Manakah yang kelarutannya paling besar diantara senyawa amina berikut ini : A. Metilamina B. Etilamina C. Propilamina D. Butilamina 7. Apakah nama IUPAC yang tepat dari rumus molekul berikut ini (CH 3CH2)2NCH2CH2CH3 A. Dietilpropilamina B. Etilpropilamina 105 Kimia Organik C. D. 8. Propiletilamina N,N-dietilpropilamina Apakah nama yang tepat untuk senyawa berikut ini : O H2N CH2CH2CH2CCH3 A. B. C. D. 9. 5-amino-2-pentanon 5-amina-2-pentanon 1-amino-4-pentanon 1-amina-4-pentanon 1-bromo-2-metilpropana apabila direaksikan dengan suatu nitril akan diperoleh : A. 2-metil-propilamina B. 3-metil-1-butilamina C. 3-metil-1-propilamina D. 2-metil-1-butilamina 10. Berikut ini contoh senyawa amina yang mempunyai keaktifan faali yang digunakan dalam bidang farmasi : A. Karbontetrafluorida B. Kloroform C. Iodoform D. adrenalin 106 Kimia Organik Kunci Jawaban Tes TES 1 1. D 2. C 3. C 4. B 5. D 6. B 7. C 8. C 9. D 10. A TES 2 1. D, 2. D, 3. A, 4. A, 5. B, 6. 7. C, A, 8. C, 9. A, 10. C, bromo terikat pada C sekunder kloro terikat pada gugus vinil (etena) karena I memiliki bobot molekul paling tinggi dibandingkan halogen lain kenaikan titik didih berbanding lurus dengan kenaikan bobot molekul penomoran dimulai dari gugus hidroksil, sehingga –OH pada C nomor 1 dan Cl pada C nomor 2 merupakan reaksi substitusi gugus –OH dari alkohol dengan klorida bromo akan terikat pada karbon ikatan rangkap yang jumlah hidrogennya paling sedikit (karbon 2) reaksi propil bromida dengan basa kuat dan air akan menyebabkan eliminas sehingga terbentuk alkena senyawa etena dengan substituen 4 halogen (F) metil triklorida TES 3 1. A 2. A 3. D 4. B 5. C 6. A 7. D 8. A 9. B 10. D 107 Kimia Organik Daftar Pustaka Fessenden, R.J., Fessenden, J.S, Alih Bahasa Pudjaatmaka, A.H, 1982, Kimia Organik Jilid 1, edisi ke-3 Jakarta : Erlanggan McMurry, J., 2007, Organic Chemistry,7th edition, California : Wadsworth Inc. Morrison, R.T, Boyd,R.N, 1992, Organic Chemistry, 7th edition, New Jersey : Prentice Hall Inc. Riawan, S, 1990, Kimia Organik, Jakarta : Binarupa Aksara 108 Kimia Organik BAB IV SENYAWA ORGANIK DENGAN DENGAN GUGUS KARBONIL Wardiyah, M.Si, Apt PENDAHULUAN Pada bab sebelumnya telah kita pelajari tentang beberapa senyawa organik dengan gugus fungsional. Selanjutnya kita akan mempelajari senyawa organik dengan gugus karbonil ab 4. Senyawa organik mempunyi gugus karbonil adalah golongan aldehid, keton, da pada Bab dan asam karboksilat dan turunannya. Untuk lebih memahami tentang senyawa dengan gugus fungsi karbonil ini maka akan kita bahas dalam dua topikyaitu Topik opik 1 yang membahas opik 2 membahas tentang asam karboksilat dan turunannya. tentang aldehid dan keton, Topik enyawa organik dengan gugus karbonil banyak kita temukan dalam kehidupan sehari Senyawa seharihari. Contohnya adalah asam sitrat yang banyak ditemukan dalam buah lemon. Gambar 4.1 Asam sitrat yang diperoleh dari lemon Senyawa organik lain yang banyak digunakan dalam bidang kefarmasian adalah parasetamol atau asetaminofen yaitu suatu senyawa golongan amida yang merupakan turunan asam karboksilat dan masih banyak contoh senyawa karbonil lainnya. H3C C O H O N OH Asam asetat C C OH O O CH3 H HO Asam asetil salisilat (analgesik, antipiretik) (analgesik, antipiretik) O H C O Retiinal ( O C O O H2 C C ) H2 n Dakron (suatu polimer sintetik) Beberapa contoh senyawa karbonil 109 O CH3 Asetaminofen (asam cuka) C Kimia Organik Bab ini membagi tiap pokok bahasan dalam beberapa sub topik yang meliputi definisi, tata nama, sifat fisik, reaksi-reaksi yang dapat terjadi, reaksi pembuatan dan aplikasi atau penggunaan senyawa dalam kehidupan sehari-hari. Setelah mempelajari bab ini, maka anda diharapkan dapat : 1. Menjelaskan pengertian senyawa aldehid, keton, asam karboksilat dan turunannya 2. Mengidentifikasi beberapa turunan senyawa asam karboksilat. 3. menyebutkan rumus umum dari aldehid, keton, asam karboksilat dan turunannya 4. memberikan penamaan pada senyawa aldehid, keton, asam karboksilat dan turunannya 5. menuliskan rumus struktur untuk senyawa aldehid, keton, asam karboksilat dan turunannya 6. menjelaskan sifat-sifat senyawa aldehid, keton, asam karboksilat dan turunannya 7. menjelaskan hubungan struktur dan sifat-sifat dari aldehid, keton, asam karboksilat dan turunannya 8. menuliskan contoh reaksi pada senyawa aldehid, keton, asam karboksilat dan turunannya 9. menuliskan reaksi pembuatan aldehid, keton, asam karboksilat dan turunannya 10. menyebutkan contoh senyawa aldehid, keton, asam karboksilat dan turunannya bab ini dilengkapi dengan uraian materi, latihan, ringkasan, dan tes untuk tiap pokok bahasan. Agar anda dapat memahami dengan baik maka lakukan langkah-langkah berikut : 1. Baca dengan seksama dan pahami tiap pokok bahasan dalam masing-masing topik. Karena tiap bagian umumnya saling terkait, maka apabila ada bagian dari topiksebelumnya yang belum dipahami pelajari kembali. 2. Kerjakan latihan soal yang diberikan pada setiap topik, baca petunjuk mengerjakan latihan dengan baik. 3. Baca kembali ringkasan materi tiap topik 4. Ukur kemampuan pemahaman anda pada tiap topikdengan mengerjakan tes. Apabila hasil tes masih belum memenuhi target pencapaian belajar minimal, ulangi untuk membaca materi kembali. 110 Kimia Organik Topik 1 Aldehida dan Keton Aldehida (RCHO) dan keton (R2CO) lazim terdapat dalam sistem makhluk hidup. Contoh yang penting secara biologis dari aldehid adalah gula ribosa dan keton adalah hormon progesteron. Penggunaan aldehid dan keton sangat luas baik dibidang industri maupun farmakologi. Aldehid yang paling sederhana adalah formaldehida (H 2C=O) atau metanal yang punyai nama dagang formalin. Formaldehida banyak digunakan sebagai bahan mempunyai pengawet karena formaldehida mempunyai kemampuan untuk membunuh bakteri. Karena sifatnya bakterisid ini maka formaldehid banyak disalahgunakan sebagai pengawet makanan lain. Formaldehid juga digunakan dalam industri kayu lapis atau dalam baso, tahu, dan lain-lain. triplek karena formaldehid merupakan bahan baku pembuatan resin untuk lem permanen. Propanon atau aseton ((CH3)2C=O) merupakan keton paling sederhana yang banyak digunakan sebagai pelarut. Aseton atau propanon formaldehida Aldehid juga banyak diekstraksi dari alam, contohnya trans-sinamaldehid trans sinamaldehid yaitu suatu komponen penyusun minyak atsiri yang diperoleh dari kayu manis. Aldehid umumnya berbau cukup kuat dan merangsang. Contoh senyawa keton minyak jintan ((-) (( )-karvon), dan karvon). Senyawa keton berbau harum. minyak permen ((+)-karvon). A. TATA NAMA Aldehida mempunyai sekurangnya satu atom hidrogen yang terikat pada karbon karbonilnya. Gugus lain yaitu R, bisa berupa alkil, aril atau H.keton mempunyai dua gugus alkil (aril) yang terikat pada karbon karbonilnya. 111 Kimia Organik sinamaldehid Penamaan untuk aldehida dalam sistem IUPAC akhiran –aa dari alkana diubah menjadi – al. berbeda dengan alkohol atau keton yang membutuhkan penomoran untuk menunjukkan posisi gugus fungsionalnya, aldehida tidak perlu ada penomoran karena gugus CHO selalu memiliki nomor 1 untuk karbonnya. Penamaan untuk keton dilakukan dengan cara mengubah –aa alkana menjadi –on. rbonil pada keton bila perlu diberikan nomor, kecuali pada propanon (aseton) yang Gugus karbonil merupakan keton paling sederhana. O O R R H R' keton aldehid Senyawa aldehida siklik yang berupa rantai siklik alifatik maupun aromatik hiran karbaldehida. penamaannya menggunakan akhiran H3C O CH3C CH CH H2 C O CH CH3 H2C nama IUPAC : etanal nama trivial : asetaldehida C H CH3 2-etil-4-metilpentanal ldehida dan keton kadang menggunakan nama trivialnya, berikut ini beberapa nama Aldehida trivial dari aldehida dan keton. 112 Kimia Organik Tabel 4.1 Nama IUPAC dan trivial beberapa dan aldehida Rumus struktur O H H IUPAC trivial metanal formaldehida O H3C etanal H asetaldehida O Propanal CH3CH2 H propionaldehida O CH3CH2CH2 butanal butiraldehida benzenakarbaldehida benzaldehida H O H Tabel 4.2 nama IUPAC dan trivial beberapa keton Rumus struktur IUPAC trivial propanon aseton 2-butanon Etil metil keton 3-pentanon Dietil keton 2-pentanon Metil propil keton O CH3 CH3 O CH3CH2 CH3 O CH3CH2 CH2CH3 O CH3CH2CH2 CH3 Untuk senyawa keton siklik baik alifatik maupun aromatik umumnya menggunakan nama trivialnya. Contohnya : 113 Kimia Organik O O CH3 difenil keton (benzofennon) metil fenil keton (asetoffenon) Bila gugus karbonil sebagai substituen, maka gugus-gugus gugus gugus tersebut memiliki penamaan khusus dengan akhiran –il. O O O O C C C C H C CH3 R asil formil asetil benzoil Apabila terdapat lebih dari satu gugus karboksil, penamaannya memakai awalan di, tri, on. dan seterusnya diikuti akhiran –on. Contoh : O O O H H2 H3C C C C C C C C CH3 H3 C C C CH3 H H2 H2 H2 2-4-heptan-dion atau hepttan-2,4-dion C. 4-heksen-2-on atau heks-4-een-2-on SIFAT FISIK ALDEHID DAN KETON Yang berperan dalam menentukan sifat fisik dari aldehid dan keton adalah gugus karbonilnya. Gugus karbonil merupakan gugus yang terdiri dari atom karbon yang terhibridisasi sp2 dihubungkan dengan atom oksigen yang mempunyai ikatan rangkap yang atan sigma (σ) dan ikatan pi (π). Ikatan sigma gugus karbonil terletak dalam merupakan ikatan bidang datar dengan sudut ikatan sekitar 1200. Gugus karbonil bersifat polar karena oksigen bersifat lebih elektronegatif sehingga elektron dalam ikatan sigma dan pi akan tertarik tertarik ke oksigen yang akan menghasilkan ikatan yang terpolarisasi. Oksigen gugus karbonil memiliki pasangan atom menyendiri. Karena polaritas dalam gugus karbonil ini maka akan ada bagian yang lebih negatif dan lebih positif yang akan saling berinteraksi. berinteraks Interaksi ini disebut interasi dipol-dipol dipol yang akan 114 Kimia Organik menyebabkan aldehid dan keton memiliki titik didih lebih tinggi dibandingkan senyawa nonpolar yang sepadan. Adanya elektron menyendiri pada oksigen maka senyawa karbonil dapat membentuk ikatan hidrogen antar molekulnya dan molekul air, akibatnya senyawa karbonil berbobot molekul rendah dapat larut dalam air. Tetapi aldehid dan keton tidak dapat membentuk ikatan hidrogen dengan senyawa karbonil lain yang akibatnya titik didih aldehid dan keton masih lebih rendah dibandingkan alkohol padanannya. D. REAKSI-REAKSI ALDEHIDA DAN KETON 1. Reaksi Adisi Reaksi adisi diawali dengan protonasi dari oksigen. Protonasi ini akan menambah muatan positif pada karbon karbonil sehingga karbon akan lebih mudah diserang oleh nukleofil. Reaktivitas relatif reaksi adisi pada aldehida dan keton sebagian disebabkan oleh adanya muatan positif pada karbon karbonil. Makin besar muatan positif makin reaktif. Gugus alkil akan membantu menyebarkan muatan positif sehingga menjadi kurang reaktif.Contoh : formaldehida lebih reaktif dibanding aldehida atau keton lain karena formadehida tidak terdapat gugus alkil untuk membantu menyebarkan muatan positif. Apabila dalam struktur terdapat gugus penarik elektron (misalnya Cl) maka reaktivitas senya O O R R R keton O H H aldehid H formaldehid naiknya kereaktifan wa akan bertambah. A. dengan H2O Adisi air terhadap gugus karbonil akan membentuk suatu 1,1-diol yang disebut gemdiol atau hidrat. Reaksi reversible dan biasanya kesetimbangan terletak pada sisi karbonil. O R C R H2O + OH H+ R C R OH suatu hidrat (-diol) aldehid atau keton O H3C C H + H2O OH H+ H3C C H OH 1,1-etanaldiol etanal 115 Kimia Organik B. dengan alkohol Produk adisi satu molekul alkohol pada aldehida disebut hemiasetal. Sedangkan produk adisi dua molekul akcohol disebut asetal (untuk keton disebut hemiketal dan ketal).Reaksi ini dikatalisis oleh asam kuat. OR' O R C R'OH H R H+ aldehid C R R H+ H H+ aldehid H3 C C H OH + H2O + H2O OR' R'OH C R OH OCH2CH3 CH3CH2OH C H OR' suatu asetal H+ hemiketal Contoh : O C H+ R OR' R'OH keton H3C C H OH hemiasetal O R OR' R'OH R C R OR' suatu ketal CH3CH2OH H+ H3 C hemiasetal OCH2CH3 C H + OCH2CH3 H2O suatu asetal C. dengan Hidrogen sianida CN- dari HCN merupakan nukleofil kuat. Tetapi HCN tidak dapat mengadisi langsung ke suatu gugus karbonil. Adisi terjadi dalam kondisi reaksi sedikit basa seperti dalam larutan buffer NaCN-HCN. CN- merupakan nukelofil kuat sehingga CN- tidak membutuhkan katalis. Produk reaksi adisi dengan hidrogen sianida merupakan suatu produk sianohidrin. HCN + OH H2O + CN – OH O R C - R + HCN CN R aldehid atau keton C R CN suatu sianohidrin Sianohidrin merupakan senyaw antara yang penting, karena gugus CN pada sianohidrin dapat dihidrolisi menjadi karboksil (-COOH) atau ester (-COOR). Gugus OH dalam sianohidrin lebih reaktif dibandingkan –OH dalam alkohol. Gugus OH sianohidrin dapat disubsititusi oleh amonia sehingga dapat menjadi gugus amino. 116 Kimia Organik H3 C C OH OH O CH3 + H3 C HCN aldehid atau keton C CH3 CN H2O H3 C H+ C CH3 COOH suatu sianohidrin Pembentukan asam amino dari adisi karbonil dengan CN- : OH O H3C C H + HCN H3C NH3 C H CN NH2 H3C C H CN H2O H+ NH2 H3C C H COOH asam amino D. dengan reagensia grignard Reaksi dengan reagensia grignard akan menghasilkan alkohol primer, alkohol sekunder dan alkohol tersier. Reaksi adisi dengan reagensia grignard dapat terjadi pada formaldehidyang akan menghasilkan alkohol primer, dengan aldehid menghasilkan alkohol sekunder, dan dengan keton menghasilkan alkohol tersier. Reaksi ini bukan merupakan reaksi reversible. Apabila anda belum jelas, silahkan pelajari kembali materi tentang reaksi dengan reagensia grignard ini pada bab 3 Topik 1 tentang alkohol. 2. Adisi – Eliminasi Aldehida dan Keton adalah reaksi yang terjadi pada aldehida dan keton yang diawali dengan adisi kemudian diikuti dengan eliminasi air atau molekul kecil lain untuk memperoleh suatu produk yang mengandung ikatan rangkap. O R C H + H NH2 H+ OH R C H NH2 -H2O RCH=NH suatu imina 3. Reduksi aldehida dan keton Produk reduksi aldehida dan keton adalah suatu alkohol, hidrokarbon atau amina. Produk reduksi ini tergantung pada bahan pereduksi dan struktur senyawa karbonilnya. A. Hidrogenasi Hidrogenasi gugus karbonil diperlukan kalor dan tekanan. OH Ni H + H2 O kalor, tekanan sikloheksanol siklohesksanon apabila dalam sebuah struktur terdapat ikatan rangkap dan gugus karbonil maka ikatan rangkap dapat dihidrogenasi atau keduanya baik ikatan rangkap maupun gugus 117 Kimia Organik karbonilnya dapat direduksi. Sedangkan reduksi gugus karbonil saja pada struktur dengan ikatan rangkap dan gugus karbonil tidak dapat dilakukan. Apabila hanya gugus karbonilnya saja yang ingin direduksi maka reduksi bisa lakukan dengan hidrida logam. B. Hidrida logam Reduksi dengan hidrida logam dapat menggunakan Litium aluminium hidrida hidrida(LiAlH4) (NaBH4). Produk reaksi adalah suatu alkohol. atau Natrium boro hidrida(NaBH O H3CH2C C OH LiAlH4 CH3 H3CH2C H2O, H+ butanon 4. CH3 2-butanol Oksidasi Aldehida dan Keton eton tidak mudah dioksidasi sedangkan aldehida akan dioksidasi menjadi asam Keton karboksilat O O KMnO4 CH3CH2 C H CH3CH2 C OH H2O, H+ asam propanoat Propanal O CH3CH2 5. C H C KMnO4 CH3 H2O, H tidak bereaksi + Reaksi dengan reagensia tollens Reaksi dengan reagensia tollens dilakukan untuk mengidentifikasi senyawa aldehid. Senyawa aldehid akan memberikan hasil positif dengan membentuk cermin perak. yawa keton tidak akan memberikan reaksi. Sedangkan senyawa O O R C H + Ag(NH3)2+ R C O- + Cermin perak dari reaksi aldehid dengan reagensia tollens 118 Ag Cermin perak Kimia Organik E. KETON PEMBUATAN ALDEHIDA DAN D Cara yang paling lazim untuk mensintesis suatu aldehida atau keton sederhana ialah dengan oksidasi suatu alkohol. ohol. Oksidasi alkohol primer akan menghasilkan aldehid dan oksidasi alkohol sekunder akan menghasilkan keton. O OH Cr2O3 H3CH2C C H H3CH2C C H piridin H propanal 1-propa anol O OH H3CH2C C H CH C 3 Cr2O3 H3CH2C C CH H3 piridin butanon 2-butanol F. KETON PENGGUNAAN ALDEHID DAN D Aldehid dan keton suku rendah, misalnya formaldehid dan aseton banyak digunakan sebagai bahan pelarut. Asetaldehida merupakan aldehida yang cukup berharga karena ntara untuk sintesis asam asetat dan anhidrida asetat asetaldehida adalah zat antara asetat. Kemudian pada beberapaa aldehid yang lebih kompleks banyak digunakan sebagai pemberi aroma karena aldehid dan keton mempunyai aroma yang menarik, sebagai contoh adalah vanilin. Vanilin LATIHAN 1. Gambarkan rumus struktur dari : pentanon A. 3,3-dimetil-2-pentanon B. 4-heksenal metilsikloheksanakalbaldehida C. 2-metilsikloheksanakalbaldehida D. 4-kloro-2-pentanon E. 2,5-heksanadion 119 Kimia Organik 1. 2. 3. Tuliskan reaksi antara propanal dengan CH3MgBr ! Reaksikan antara aseton dengan NaBH4 ! Apabila senyawa berikut ini direaksikan dengan reagensia tollens, bagaimanakah reaksi yang akan terjadi ? A B 5. O CH3CH2 C CH3 O CH3CH2 C H Terangkan reaksi yang terjadi pada pembuatan aldehid dengan menggunakan alkohol ! Petunjuk mengerjakan latihan 1. Untuk menggambarkan rumus struktur dengan baik, pahami tata nama untuk senyawa aldehid dan keton. Tentukan rantai induknya terlebih dahulu dan kenali substituennya. Letakkan substituen yang sesuai dengan penomorannya. Bila ada gugus fungsi lain dalam aldehid dan keton maka tentukan gugus mana yang lebih yang lebih berprioritas. 2. reaksi propanal dengan CH3MgBr menggunakan prinsip reaksi dengan reagensia grignard dimana aldehid yang direaksikan dengan reagensia grignard akan menghasilkan suatu alkohol sekunder. 3. reaksi aseton dengan NaBH4 merupakan reaksi reduksi gugus karbonil, reaksi ini akan menghasilkan suatu alkhol 4. 5. reaksi dengan reagensia tollens digunakan untuk mengidentifikasi aldehid, untuk mengetahui reaksi yang terjadi maka kenali jenis senyawanya aldehid atau keton. Reaksi pembuatan aldehid dengan alkohol melalui mekanisme oksidasi dengan Cr2O3 dengan piridin, dimana untuk membuat aldehid diperlukan senyawa alkohol primer. RINGKASAN 1. 2. 3. Aldehida (RCHO) dan keton (R2CO) mempunyai sekurangnya satu atom hidrogen yang terikat pada karbon karbonilnya. Gugus R bisa berupa alkil, aril, atau H. prinsip penamaannya akhiran –a pada alkana diubah menjadi –on untuk keton dan –al untuk aldehida. Senyawa aldehida siklik yang berupa rantai siklik alifatik maupun aromatik penamaannya menggunakan akhiran karbaldehida. sifat fisik dari aldehid dan keton ditentukan oleh gugus karbonilnya. Ikatan pi, pasangan elektron menyendiri dan polaritas gugus karbonil akan menentukan reaktivitas dari gugus karbonil. Senyawa karbonil berbobot molekul rendah dapat larut dalam air. Aldehid dan keton memiliki titik didih lebih tinggi dibandingkan senyawa nonpolar yang sepadan. 120 Kimia Organik 4. 5. Aldehid dan keton dapat mengalami reaksi adisi, adisi-eliminasi, reduksi, dan oksidasi. Adisi terjadi dengan H2O, alkohol, HCN, dan reagensia grignard. Aldehid dan keton juga mengalami reaksi adisi-eliminasi yang menghasilkan suatu imina. Reaksi reduksi terjadi melalui reaksi hidrogenasi dan reduksi dengan hidrida logam. Reaksi oksidasi terjadi pada aldehid yang akan menghasilkan asam karboksilat, oksidasi sulit terjadi pada keton. Untuk membedakan aldehid dan keton dapat digunakan reaksi dengan reagensia tollens. Aldehid dan keton paling lazim dibuat dengan reaksi oksidasi. Oksidasi alkohol primer akan menghasilkan aldehid dan oksidasi alkohol tersier akan menghasilkan keton. TES 1 1. Berikut ini contoh senyawa yang mempunyai gugus karbonil, kecuali : A. Aldehid B. Ester C. keton D. Alkohol 2. Manakah yang merupakan senyawa keton ? Br H O H3C CH3 1 A. B. C. D. O O CH3 CH3 3 2 O O H CH3 4 CH3 CH3 5 1, 2, 3 1,3, 4 1,3, 5 2, 4, 5 3. Senyawa golongan aldehida yang banyak disalahgunakan sebagai pengawet makanan yang merupakan jenis aldehida paling sederhana adalah : A. Formaldehida B. Asetaldehida C. Propionaldehida D. Aseton 4. Apakah IUPAC nama struktur di bawah ini : H O A. 3-butilsikloheksanal 121 Kimia Organik B. C. D. 5. 1-butilsiklokarbaldehida 3-butilsiklokarbaldehida 3-t-butilsiklokarbaldehida Nama gugus karbonil sebagai substituen berikut ini yang sesuai adalah : O H A. B. C. D. C Asil Asetil Formil Benzoil 6. Manakah pernyataan tentang sifat aldehid-keton yang sesuai ? A. sifat fisik dari aldehid dan keton ditentukan oleh gugus karbonilnya B. oksigen dalam gugus karbonil kurang elektronegatif C. titik didih lebih aldehid-keton tinggi dibandingkan senyawa nonpolar yang sepadan karena interkasi dippol-dipol D. titik didih aldehid dan keton masih lebih rendah dibandingkan alkohol padanannya 7. Diantara aseton, butanon, 2-pentanon, 3-metil-2-pentanon manakah yang paling reaktif ? A. aseton B. butanon C. 2-pentanon D. 3-metil-2-pentanon 8. Reaksi aldehid dengan 2 molekul alkohol akan menghasilkan : A. Asetal B. Hemiasetal C. Ketal D. Hemiketal 9. Aldehid dan keton bila diolah dengan hidrogen sianida akan menghasilkan senyawa sianohidrin. Senyawa sianohidrin akan mengalami hidrolisis menghasilkan : A. Alkohol B. Aldehid C. Asam karboksilat D. Keton 122 Kimia Organik 10. 3-pentanol bila dioksidasi dengan Cr2O3 akan menghasilkan : A. Pentanal B. 3-Pentena C. 3-pentanon D. Asam pentanoat 123 Kimia Organik TOPIK 2 Asam Karboksilat Pada Topik 1 sudah kita pelajari tentang senyawa karbonil dari aldehid dan keton. Pada Topik 2 akan kita bahas golongan senyawa organik yang mengandung gugus karbonil yang lainnya yaitu asam karboksilat.Golongan senyawa asam karboksilat penting secara biologis dan komersial. Cuka atau asam asetat, salah satu golongan asam karboksilat yang banyak digunakan sebagai pelengkap makanan. Asam semut atau asam format,suatu senyawa organik yang merupakan golongan asam karboksilat yang paling sederhana dengan nama IUPAC asam metanoat. O O H C OH CH3 C OH asam asetat asam format Asam karboksilat yang lebih kompleks dan cukup berguna dalam bidang farmasi contohnya adalah aspirin atau asam asetil salisilat O O CH3 cis-CH3(CH2)7CH=CH(CH2)7CO2H OH asam oleat O aspirin atau asam asetil salisilat Asam karboksilat, RCO2H, adalah senyawa organik dengan gugus karboksil. Gugus ini mengandung gugus karbonil dan gugus hidroksil. Senyawa karboksilat cukup penting sebagai bahan dasar sintesis golongan senyawa lain seperti ester, klorida asam, amida, anhidrida asam, dan nitril. Senyawa-senyawa ini disebut sebagai derivat atau turunan asam karboksilat yaitu suatu senyawa yang apabila dihidrolisis akan menghasilkan asam karboksilat. Pembahasan tentang derivat asam karboksilat akan kita bahas pada bagian akhir dari pembahasan tentang asam karboksilat. Mungkin pernah diantara kita yang mengenal kosmetika yang mengandung AHA atau alpha hidroxy acid. AHA cukup banyak digunakan untuk tujuan perawatan kulit. Beberapa senyawa karboksil dengan gugus AHA diantaranya adalah : 124 Kimia Organik Beberapa asam karboksilat suku rendah lebih dikenal dengan nama trivialnya, berikut ini merupakan 10 nama trivial asam karboksilat pertama dan sumbernya. Tabel 4.3 Nama trivial sepuluh asam karboksilat pertama Jumlah atom C 1 2 3 Struktur Nama trivial Nama IUPAC HCO2H CH3CO2H CH3CH2CO2H asam format asam asetat asam propionat 4 5 CH3(CH2)2CO2H CH3(CH2)3CO2H asam butirat asam valerat semut (L. formica) cuka (L. acetum) susu, mentega, dan keju mentega (L. butyrum) akar valeria (L. valere) 6 7 CH3(CH2)4CO2H CH3(CH2)5CO2H asam kaproat asam enantat 8 9 CH3(CH2)6CO2H CH3(CH2)7CO2H 10 CH3(CH2)8CO2H asam kaprilat asam pelargonat asam kaprat asam metanoat asam etanoat asam propanoat asam butanoat asam pentanoat asam heksanoat asam heptanoat asam oktanoat asam nonaoat asam dekanoat kambing 125 Sumber kambing (L.caper) kuncup anggur kambing Pelargonium roseum Kimia Organik A. TATA NAMA Penamaan untuk asam karboksilat untuk empat karboksilat pertama menggunakan nama trivial yaitu asam format, asam asetat, asam propionat, dan asam butirat. H C O O O OH asam format CH3 C OH CH3CH2 C O OH CH3CH2CH2 asam propionat asam asetat C OH asam butirat Nama IUPAC dari suatu asam karboksilat alifatik diawali dengan kata asam dan akhiran –a dari alkana diganti -oat. Seperti halnya aldehida, karbon pada gugus karboksil selalu menempati posisi karbon nomor 1. Bila ada dua gugus karboksil maka penamaan dengan awalan asam dan akhiran –dioat. (CH3)3 CCH2COOH HO2CCH2CH2CO2H asam 3,3-dimetilbutanoat asam butanadioat O CH3CH2CH Cl C OH asam 2-klorobutanoat Gugus karboksil (-CO2H) yang terikat pada suatu cincin maka penamaannya menggunakan awalan asam dan akhiran karboksilat. O O H3C C OH C OH asam siklopentanakarboksilat asam 3-metilsikloheksanakarboksilat Gugus karboksil yang terikat pada cincin aromatik 6 karbon diberi nama sebagai asam benzoat, apabila ada substituen maka penomoran mengikuti posisi dari gugus karboksilnya. bila substituen terletak pada karbon 2 dapat diberi nama denga orto (dilambangkan dengan o), substituen pada karbon 3 diberi nama meta (m), dan para (p) bila posisi pada karbon 4. Pembahasan lebih lanjut tentang tata nama senyawa aromatik akan kita bahas di bab 5. 126 Kimia Organik O C asam benzoat O C H O C H asam 1-etilbenzoat atau asam o-etilbenzoat H H2 N asam 4-aminobenzoat atau asam p-aminobenzoat Pada penamaan trivial untuk menentukan posisi suatu substituen dapat menggunakan huruf yunani seperti halnya aldehida atau keton. Penentuan posisi dalam tata nama trivial berdasarkan letaknya terhdap gugus karbonil. Karbon yang paling dekat dengan gugus karbonil diberi nama karbon α, karbon berikutnya adalah β, dan sterusnya. O C CH3CH2 CH OH CH3 Asam α-butirat B. SIFAT ASAM KARBOKSILAT Seperti halnya pada aldehid dan keton sifat fisik dari asam karboksilat dipengaruh oleh gugus karbonilnya. Asam karboksilat bersifat polar karena mempunyai dua gugus yang bersifat polar yaitu hidroksil (−OH) dan karbonil (C=O). karena asam karboksilat mampu membentuk ikatan hidrogen antar molekulnya maupun dengan molekul lain maka memiliki kelarutan yang tinggi terutama untuk molekul kecil (asam karboksilat 1-4 karbon). Sifat fisik karboksilat tidak hanya ditentukan oleh gugus karbonil tetapi gugus hidroksil pada karboksilat juga ikut berperan dalam menentukan sifat fisik dari asam karboksilat. Karena adanya gugus hidroksil maka asam karboksilat dapat membentuk dimer (sepasang molekul yang saling berikatan) melalui ikatan hidrogen antar gugus polar dari dua gugus karboksil. 127 Kimia Organik O CH3 H O C C O H CH3 O dimer asam asetat C. REAKSI ASAM KARBOKSILAT 1. Reaksi Asam Karboksilat dengan Basa Sifat kimia yang paling menonjol dari asam karboksilat ialah keasamannya. Dibandingkan dengan asam mineral seperti HCl dan HNO3 asam karboksilat adalah asam lemah, namun bersifat lebih asam daripada alkohol atau fenol. Karena keasamannya ini maka asam kartboksilat dapat bereaksi dengan basa. Reaksi suatu asam karboksilat dengan suatu basa akan menghasilkan garam. CH3CO2H + Na+ OHasam asetat CH3CO2- Na+ + H2O natrium asetat 2. Esterifikasi Asam Karboksilat Reaksi esterifikasi adalah reaksi antara asam karboksilat dengan alkohol yang akan menghasilkan suatu ester. Reaksi esterifikasi memerlukan katalis asam dan reaksi berlangsung reversibel. O H+ O + H2O + R'OH kalor R OR' R OH O O OH + asam benzoat CH3CH2OH H+ OCH2CH3 kalor + H2O etilbenzoat etanol 3. Reduksi Asam Karboksilat Reduksi asam karboksilat dapat dilakukan dengan menggunakan hidrida logam seperti LiAlH4. LiAlH4 akan mereduksi gugus karboksil langsung menjadi gugus -CH2OH, reduksi ini juga akan mengubah gugus-gugus fungsional karbonil lain dalam molekul. 128 Kimia Organik CH3CO2H (1) LiAlH4 CH3CH2OH asam asetat (2) H2O, H- etanol COOH O D. COOH LiAlH4 CH2OH H2O, H(1) LiAlH4 H2O, H- HO CH2OH PEMBUATAN ASAM KARBOKSILAT Pembuatan asam karboksilat melalui jalur sintetik dapat dikelompokkan dalam tiga tipe reaksi yaitu (1) hidrolisis derivat asam karboksilat; (2) reaksi oksidasi ; (3) reaksi grignard. Hidrolisis adalah reaksi yang melibatkan air dengan katalis asam atau basa. Reaksi Hidrolisis dari beberapa derivat asam karboksilat dapat digambarkan sebagai berikut : ester amida anhidrida halida asam Nitril O ║ RC – OR’ + H2O O ║ RC – NR’2 + H2O O O ║ ║ RC – OCR’ + H2O H+ atau OHRCO2H + HOR’ H+ atau OHRCO2H + HNR’2 H+ atau OHRCO2H + HO2CR’ O ║ RC – X + H2O H+ atau OH- RC≡N + H2O H+ atau OH- 129 RCO2H + X- RCO2H + NH3 Kimia Organik Contoh reaksi hidrolisis : O O OCH3 + H2O H+ OH + metanol asam benzoat metil benzoat C N + H2O CH3OH O C OH H+ + NH2 Pada bab sebelumnya telah dibahas mengenai oksidasi senyawa alkohol. Oksidasi alkohol primer dan aldehida akan menghasilkan asam karboksilat. Perbedaan oksidasi antara alkohol dan aldehida, oksidasi alkohol membutuhkan oksidator kuat, sedangkan oksidasi aldehida membutuhkan oksidator lembut (Ag+). Selain oksidasi alkohol, asam karboksilat juga dapat diperoleh dari oksidasi alkena. Oksidasi alkena membutuhkan oksidator kuat. Berikut ini adalah ringkasan jalur pembuatan asam karboksilat melalui oksidasi. Oksidasi : Alkohol RCH2OH + [O] primer RCO2H alkena O ║ RCH + [O] RCH = CR2 + [O] RCO2H + R2C = O Alkil arena Ar-R + [O] ArCO2H aldehida RCO2H CH3CH2CH2CH2-OH + CrO3 CH3CH2CH2CO2H 1-butanol asam butanoat CH3 H3C COOH KMnO4 kalor HOOC 130 Kimia Organik Asam karboksilat dapat dibuat melalui jalur reaksi dengan reagensia grignard. Pada reaksi ini dibuat dari reaksi antara CO2 dengan reagensia grignard, dalam air dan katalis asam. Secara umum reaksinya dapat digambarkan sebagai berikut. (1) Mg, eter RX (2) CO2 (3) H2O, H+ CH3CH2CH2-Br RCO2H Mg CH3CH2CH2MgBr CO2, H+ CH3CH2CH2COOH 1-bromopropana asam butanoat (n-propil bromida) (asam butirat) E. DERIVAT ASAM KARBOKSILAT Derivat asam karboksilat adalah senyawa yang menghasilkan asam karboksilat bila direaksikan dengan air. Yang termasuk derivat asam karboksilat : 1. Ester 2. Halida asam karboksilat 3. Anhidrida karboksilat 4. Amida 5. Nitril Berikut ini tabel tentang derivat asam karboksilat dana contoh-contohnya : Tabel 4.4 derivat asam karboksilat Derivat ester Rumus umum O R C contoh O C OCH3 OR' O halida asam R C CH3COCl X 131 metil benzoat asetil klorida Kimia Organik Derivat anhidrida asam Rumus umum O O C R O C R contoh (CH3CO)2O asetat O amida nitril R C Anhidrida asam NH2 R C N O C NH2 benzamida C N benzonitril Asam karboksilat dan beberapa turunan dapat dijumpai di alam. Ester dan amida banyak dijumpai misalnya lemak dan lilin merupakan contoh senyawa ester, protein dengan gugus poliamida merupakan contoh senyawa amida. Derivat asam karboksilat mengandung gugus asil RCO- kecuali pada nitril. Kita ketahui bahwa gugus karbonil merupakan pusat kereaktifan sehingga senyawa derivat asam karboksilat ini mempunyai sifat kimia serupa. 1. Ester Berdasarkan susunannya, ester terbagi atas tiga golongan, yaitu sari buah-buahan, lemak atau minyak, dan lilin. 1. Sari buah-buahan, yaitu ester dari alkohol suku rendah atau tengah. Ester ini mempunyai aroma yang sedap, banyak digunakan dalam pemberi aroma pada makanan dan parfum. Contohnya : CH3CO2CH2CH2CH3 propil asetat mempunyai aroma seperti buah pir CH3CH2CH2CO2CH2CH3 etil butirat mempunyai aroma seperti buah nenas 2. Lemak dan minyak, yaitu ester dari gliserol dan asam karboksilat suku tengah atau tinggi. Lemak adalah ester yang terbentuk dari gliserol yang asam karboksilatnya jenuh (memiliki ikatan tunggal), sedangkan minyak asam karboksilatnya tak jenuh (memiliki ikatan rangkap). Contoh : tripalmitin 3. Lilin (waxes), yaitu ester dari alkohol suku tinggi dan asam karboksilat suku tinggi C15H31-COO-C30H61 H51-COO-C30H61 (mirisil palmitat/lilin tawon) (mirisil serotat/lilin carnauba) 132 Kimia Organik 1.1 Tata Nama Ester Ester diberi nama dengan menyebutkan terlebih dahulu gugus alkil yang terikat pada oksigen ester dan diikuti dengan nama karboksilatnya Rumus Struktur Nama IUPAC Nama Trivial HCOOCH3 Metil metanoat Metil formiat CH3CH2COOCH2CH3 Etil propanoat Etil propionat CH3 (CH2)3 COOCH2CH3 Etil pentanoat Etil valerat 1.2 Sifat Fisik Ester Ester bersuku rendah berwujud cair encer, ester bersuku tengah berwujud cair kental, ester bersuku tinggi berwujud padat. Ester tidak mampu membentuk ikatan hidrogen antar molekulnya sehingga titik didih dan titik leleh ester rendah dibandingkan asam karboksilat padanannya. 1.3 Reaksi Kimia pada ester Ester dapat mengalami reaksi kimia yang akan membentuk senyawa lain yaitu asam karboksilat, alkohol, amida, dan ester lain. Reaksi hidrolisisdapat terjadi dalam asam dan basa, reaksi hidrolisis dengan asam pada ester akan menghasilkan senyawa alkohol dan asam karboksilat. Reaksi hidrolisis dengan asam ini bersifat riversibel. Asam dalam reaksi ini bertindak sebagai katalis. CH3CH2 O C OCH3 metil propanoat + H2O H+, kalor CH3CH2 O C OH + asam propanoat berlebih CH3OH metanol Ester dapat bereaksi dengan basa yang akan membentuk suatu garam karboksilat, reaksi ini bersifat tidak riversible. Reaksi ester dengan basa disebut juga dengan reaksi saponifikasi. O O kalor C CH3OH + CH3CH2 O- Na+ + C CH3CH2 OCH3 + Na OH H2O metanol garam propanoat metil propanoat Perhatikan bahwa dalam reaksi ini basa bertindak sebagai pereaksi dan bukan katalis. Apabila garam karboksilat diasamkan maka akan diperoleh kembali asam bebas. . 133 Kimia Organik Transesterifikasi, merupakan reaksi pertukaran bagian alkohol dari suatu ester, reaksi ini dapat terjadi dalam asam dan basa yang bersifat riversible. O O H+ + CH3OH + CH CH OH CH2 CH OCH2CH3 3 2 CH2 HC OCH3 Reaksi dengan reagensia grignard, reaksi ester dengan reagensia grignard akan menghasilkan suatu alkohol tersier dengan dua gugus alkil yang identik. Dapat juga menghasilkan alkohol sekunder apabila digunakan suatu ester format (HCOOR). O CH3CH2 OCH2CH3 OH CH3CH2 C CH3 CH3 2CH3MgBr H2O, H+ alkohol tersier O H OCH3 OH H C CH3 CH3 alkohol sekunder 2CH3MgBr H2O, H+ 1.4 Pembuatan Ester Pembuatan ester dapat dilakukan dengan reaksi esterifikasi yaitu reaksi yang melibatkan asam karboksilat dan alkohol. CH3 C O H+, kalor O OH + CH3CH2OH CH3 C OCH2CH3 + H2O Perhatikan gugus oksigen pada alkoksi pada ester diatas (-OCH 2CH3), atom O pada ester berasal dari alkohol bukan dari asam karboksilat, gugus –OH dari asam karboksilat akan bergabung dengan hidrogen (H+) dari alkohol sehingga akan dilepaskan molekul air. 2. Halida Asam Halida asam adalah derivat asam karboksilat yang paling reaktif di antara semua derivat asam karboksilat. Ion halida merupakan gugus pergi (leaving grup) yang baik.Diantara halogen yang ada flourida, klorida, bromida dan iodida, klorida merupakan yang paling populer. Sehingga pada bagian ini akan dibahas lebih lanjut tentang klorida asam. 2.1 Tata Nama Halida Asam Penamaan pada halida asam berdasarkan pada asam karboksilat induknya dengan akhiran asam –at diubah menjadi –il diikuti nama halida. 134 Kimia Organik O O H3C H3CH2C Cl Cl propanoil klorida (propionil klorida) etanoil klorida (asetil klorida) 2.2 O CH3CH2CH2 butanoil klorida (butiril klorida) Reaksi Halida Asam Halida asam dapat mengalai reaksi hidrolisis, reaksi dengan alkohol, reaksi dengan amina dan amonia, pengubahan ke aril keton, reaksi dengan organologam, dan reaksi reduksi dengan hidrida logam. Pada reaksi ini hanya akan diberikan contoh reaksi hidrolisi dan reaksi dengan alkohol saja. Reaksi hidrolisis halida asam : O O CH3CH2 + Cl H2O CH3CH2 Reaksi dengan alkohol : + Cl + HCl + HCl O O CH3CH2 OH asam propanoat propanoil klorida CH3OH CH3CH2 OCH3 metil propanoat propanoil klorida 2.3 Cl Pembuatan Halida Asam Halida asam dapat dibuat langsung dari asam karboksilatnya melalui reaksi dengan tionil klorida (SOCl2) atau fosforus triklorida (PCl3). CH3CH2CH2 O C OH + CH3CH2CH2 SOCl2 O C Cl + HCl butanoil klorida asam butanoat 3. Anhidrida Asam Anhidrida asam karboksilat jarang ditemukan di alam. Salah contoh senyawa anhidrida asam yang ditemukan di alam adalah suatu anhidrida siklik yang terdapat dalam lalat spanyol yaitu kantaridin. Struktur dari anhidrida asam karboksilat merupakan penggabungan dari dua molekul asam karboksilat dengan menghilankan satu molekul air. Anhidrida berarti tanpa air. O O R OH HO -H2O R O R 135 O O R Kimia Organik 3.1 Tata Nama Anhidrida Penamaan untuk anhidrida diawali dengan kata anhidrida diikuti dengan nama karboksilatnya, bila gugus asilnya sama maka penamaan dengan menggunakan nama asam karboksilat induknya. Tetapi bila gugus asilnya berbeda penamaan menggunakan nama asam-asamnya. O O CH3 C O C CH2CH3 O O CH3 C O C CH3 anhidrida etanoat propanoat (anhidrida asetat propionat) anhidrida asam etanoat (anhidrida asam asetat) 3.2 Reaksi anhidrida Anhidrida dapat mengalami reaksi hidrolisis, reaksi dengan alkohol dan fenol, dan reaksi dengan amonia dan amina. Hidrolisis anhidrida akan menghasilkan senyawa asam karboksilat. Reaksi dengan alkohol akan menghasilkan ester, dan reaksi dengan amina akan menghasilkan amida. O O R C O C R O O R C O C R O O R C O C R + + + H2O O R C OH R-OH O R C OR NH2 - H O R C NH2 O R' C OH + O R' C OH O R' C OH + O CH3 C OH O O CH3 C O C CH2CH3+ H2O anhidrida etanoat propanoat 3.3 + + O CH3CH2 C OH asam etanoat asam propanoat Pembuatan Anhidrida Anhidrida asam dibuat dari derivat asam karboksilat yang yang lebih reaktif dengan suatu ion karboksilat. O O O Cl + O O O- Na+ 4. Amida Amida merupakan derivat asam karboksilat yang paling tidak reaktif. Amida banyak ditemukan di alam terutama sebagai protein yaitu suatu poliamida. 136 Kimia Organik 4.1 Tata Nama Amida Penamaan amida berdasarkan nama asam karboksilatnya dimana imbuhan asam –oat digantikan dengan amida. O O O NH2 CH3CH2 C NH2 CH3(CH2)3 C NH2 propanamida pentanamida benzamida Bila pada Nitrogen mengikat gugus alkil lain maka penamaanya menggunakan nama Nalkil. O O NHCH2CH3 CH3CH2 C N(CH3)2 N-etil-benzanamida N,N-dimetilpropanamida 4.2 Reaksi Amida Amida dapat mengalami reaksi hidrolisi dan reakdi reduksi dengan hidrida logam. Reaksi hidrolisis amida akan menghasilkan asam karboksilat dan amonia. Sedangkan amida yang direduksi dengan anhidrida logam (LiAlH4) akan membentuk senyawa amina. CH3CH2 O C H+ / OHNH2 CH3CH2 + H2O propanamida O CH3CH2 C OH asam propanoat LiAlH4 NH2 CH3CH2CH2NH2 propilamina propanamida 4.3 O C Pembuatan Amida Amida dapat dibuat dari turunan asam karboksilat dengan amoniak. O R Cl O O R O RNH2 RNH2 R R R RNH2 O O OR 137 NH2 + NH3 Kimia Organik LATIHAN 1. tentukan golongan senyawa karboksil berikut ini : O O NH2 Cl (1) O O (3) (2) 2. Gambarkan rumus struktur untuk senyawa berikut ini : A. asam 3-nitrobenzoat B. N,N-dimetilbutanamida C. anhidrida asetat benzoat D. benzoil klorida E. ter-butil sikloheksanakarboksilat 3. Bagaimana reaksi pembuatan dari senyawa berikut ini : COOH A. COOCH3 B. O C. Cl 4. Terangkan sifat fisik dari asam karboksilat berdasarkan jumlah karbon penyusunnya dan reaktivitas gugus karboksilnya. 5. Selesaikan reaksi berikut ini : O + NaOH A. H3C OH B. C. O CH3CH2 O H3C Cl + H2O OCH3 H+, kalor + CH3CH2OH 138 Kimia Organik Petunjuk mengerjakan latihan 1. penggolongan senyawa karboksilat ditentukan oleh gugus yang terikat pada gugus karbonilnya (RCO-), ester apabila mengikat alkoksi, amida apabila terdapat amina yang terikat pada karbonil, halida asam apabila karbonil mengikat halogen. 2. A. senyawa asam karboksilat, tentukan induknya dan letakkan substituen nitro pada posisi yang sesuai B. amida, dengan induknya butanamida dan pada gugus NH2, kedua H digantikan oleh metil C. senyawa anhidrida dengan gugus asetat dan benzoat D. senyawa klorida asam yang terikat pada gugus aromatik, gambarkan struktur aromatiknya kemudian letakkan gugus klorida asamnya (-COCl). E. ester, dengan gugus ester berupa t-butil dan gugus asam karboksilatnya berupa sikloheksana karboksilat. 3. A. Pembuatan asam karboksilat dapat dilakukan dengan reaksi hidrolisis dengan turunan asam karboksilat, misalnya ester. Reaksi hidrolisis ester akan menghasilkan asam karboksilat dan alkohol B. Pembuatan ester dapat dilakukan dengan reaksi esterifikasi dari asam karboksilat dengan alkohol C. Reaksi pembuatan senyawa amida dilakukan dengan mereaksikan asam karboksilat dengan SOCl2 4. Asam karboksilat sifat fisiknya dipengaruhi oleh gugus karboksil yang merupakan senyawa karbonil dan hidroksil. Sehingga kelarutan dan titik didih atau titik lebur dari asam karboksilat dipengaruhi oleh kemampuan asam karboksilat membentuk ikatan hidrogen dan dimer. 5. A. reaksi asam karboksilat dengan basa yang akan menghasilkan garam karboksilat B. reaksihi drolisis ester, lihat poin 2A. C. reaksi a klorida asam dengan alkohol yang akan menghasilkan ester dan HCl RINGKASAN 1. 2. 3. Asam karboksilat, RCO2H, adalah senyawa organik dengan gugus karbonil dan gugus hidroksil. Nama IUPAC dari suatu asam karboksilat alifatik diawali dengan kata asamdan akhiran –a dari alkana diganti –oat. Gugus karboksil (-CO2H) yang terikat pada suatu cincin maka penamaannya menggunakan awalan asam dan akhiran karboksilat. Asam karboksilat bersifat polar karena mempunyai dua gugus yang bersifat polar yaitu hidroksil (−OH) dan karbonil (C=O). karena asam karboksilat mampu membentuk ikatan hidrogen dan dimer antar molekulnya. Asam karboksilat dapat bereaksi dengan basa membentuk garam karboksilat, mengalami reaksi esterifikasi dengan alkohol, dan reduksi gugus karboksil menjadi alkohol. Asam karboksilat dapat dibuat dengan reaksi hidrolisis, oksidasi dan reaksi dengan reagensia grignard. 139 Kimia Organik 4. 5. 6. 7. 8. Derivat asam karboksilat adalah senyawa yang menghasilkan asam karboksilat bila direaksikan dengan air. Yang termasuk derivat asam karboksilat adalah ester, halida asam, amida, anhidrida asam, dan nitil. Ester merupakan senyawa yang mempunyai bau khas yang digunakan sebagai pemberi aroma pada makanan atau parfum. Ester tidak mampu membentuk ikatan hidrogen antar molekulnya sehingga titik didih dan titik leleh ester rendah dibandingkan asam karboksilat padanannya. Reaksi yang dapat terjadi pada ester adalah hidrolisis, transesterifikasi dan reaksi dengan reagensia grignard. Ester dibuat dengan reaksi esterifikasi dari asam karboksilat dengan alkohol. Halida asam adalah derivat asam karboksilat yang paling reaktif di antara semua derivat asam karboksilat. Halida asam dapat mengalai reaksi hidrolisis, reaksi dengan alkohol, reaksi dengan amina dan amonia, pengubahan ke aril keton, reaksi dengan organologam, dan reaksi reduksi dengan hidrida logam. Halida asam dapat dibuat langsung dari asam karboksilatnya melalui reaksi dengan tionil klorida (SOCl 2) atau fosforus triklorida (PCl3 Struktur dari anhidrida asam karboksilat merupakan penggabungan dari dua molekul asam karboksilat dengan menghilankan satu molekul air. anhidrida asam dapat bereaksi hidrolisis, Reaksi dengan alkohol/fenol, dan reaksi dengan amonia/amina. Anhidrida asam dibuat dari derivat karboksilat dengan ion karboksilat. Senyawa amida merupakan senyawa yang kurang reaktif dibandingkan derivat asam karboksilat lainnya. Amida dapat mengalami reaksi hidrolisi dan reakdi reduksi dengan hidrida logam. Amida dapat dibuat dari turunan asam karboksilat yaitu halida asam, anhidrida asam, dan ester dengan amoniak. TES 2 1. Diantara asam karboksilat berikut ini manakah yang awalnya disintesis dari semut merah ? A. Asam metanoat B. Asam etanoat C. Asam propanoat D. Asam butanoat 2. Apakah nama IUPAC yang tepat untuk senyawa berikut ini : HO O A. B. C. D. 2,3-dimetil heksanoat Asam 2,3-dimetilheksanoat 4,5-dimetilheksanoat Asam 4,5-dimetilheksanoat 140 Kimia Organik 3. Rumus struktur mana yang sesuai untuk N,N-dietilsiklokarbonamida A. HO O O B. N C H2N O D N O 4. Pernyataan yang tepat untuk menyatakan sifat fisik dari asam karboksilat dalah : A. Asam karboksilat kurang larut bila dibandingkan alkohol padananya B. Asam karboksilat memiliki titik didih yang lebih rendah dibanding alkohol padanannya C. Asam karboksilat dapat membentuk dua ikatan hidrogen antar molekul (dimer) D. Asam karboksilat kurang reaktif dibandingkan aldehid 5. Hidrolisis suatu suatu N-metilbenzamida akan menghasilkan : A. Asam benzaoat dan air B. Asam benzoat dan amoniak C. Asam benzoat dan metilamina D. Asam benzoat dan benzilamina 6. Derivat asam karboksilat berikut memiliki gugus asil, kecuali : A. Amida B. Anhidrida C. Halida asam D. Nitril 7. Turunan asam karboksilat yang terbentuk dari penggabungan dua molekul asam karboksilat dan kehilangan molekul air adalah : A. Amida B. Anhidrida C. Halida asam D. Nitril 141 Kimia Organik 8. Reaksi transesterifikasi antara etil pentanoat dengan metanol akan menghasilkan : A. Metil pentanoat dan etanol B. Etil metanoat dan asam karboksilat C. Etil pentanoat dan asam metanoat D. Metil pentanoat dan asam etanoat 9. Anhidrida benzoat etanoat apabila direaksikan dengan amonia akan menghasilkan : A. Benzamida dan asam etanoat B. Asam benzoat dan asam etanoat C. Benzilamina dan asam etanoat D. Benzil klorida dan asam etanoat 10. Senyawa turunan asam karboksilat yang paling tidak reaktif adalah … A. Nitril B. Halida asam C. Anhidrida D. Amida 142 Kimia Organik Petunjuk Jawaban Tes TES 1 1. D, 2. C, 3. A, 4. D, 5. C, 6. B, 7. A, 8. A, 9. C, 10. C, alkohol merupakan senyawa dengan gugus hidroksil dengan rumus umum R2CO maka keton adalah senyawa 1,3, dan 5 formaldehida atau formalin senyawa benzenakarbaldhida dengan substituen t-butil pada karbon ke-3 merupakan gugus formil oksigen dalam karbonil lebih elektronegatif halangan sterik paling rendah reaksi aldehid dengan 1 molekul alkohol menghasilkan hemiasetal, reaksi dengan 2 alkohol menghasilkan asetal hidrolisis sianida akan menghasilkan karboksilat dan ester oksidasi alkohol sekunder akan menghasilkan senyawa keton TES 2 1. A, asam semut atau asam format 2. B, posisi karboksil merupakan karbon ke-1 3. B, senyawa amida, dimana induknya berapa senyawa sikloheksana an substituen etil pada N. 4. C, asam karboksilat mempunyai gugus karbonil dan hidroksil yang dapat membentuk ikatan hidrogen dan dimer 5. C, hidrolisis amida akan menghasilkan asam karboksilat dan senyawa amina 6. D, gugus fungsi pada nitril adalah 7. B, anhidrida artinya tanpa air 8. A, transesterifikasi merupakan reaksi pertukana gugus ester dengan gugus alkil dari alkohol. 9. A, reaksi anhidrida dengan amonia akan memberikan produk senyawa amida dan alkohol 10. B, amida paling tidak reaktif 143 Kimia Organik Daftar Pustaka Fessenden, R.J., Fessenden, J.S, Alih Bahasa Pudjaatmaka, A.H, 1982, Kimia Organik Jilid 1, edisi ke-3 Jakarta : Erlanggan McMurry, J., 2007, Organic Chemistry,7th edition, California : Wadsworth Inc. Morrison, R.T, Boyd,R.N, 1992, Organic Chemistry, 7th edition, New Jersey : Prentice Hall Inc. Riawan, S, 1990, Kimia Organik, Jakarta : Binarupa Aksara 144 Kimia Organik BAB V SENYAWA AROMATIK Wardiyah, M.Si, Apt PENDAHULUAN Senyawa aromatik yang paling sederhana adalah benzena, yaitu suatu senyawa hidrokarbon siklik dengan ikatan rangkap terkonjugasi yaitu ikatan rangkap yang terdapat pada atom karbon yang saling berdampingan. Benzena dengan rumus molekul C6H6 bila dibandingkan dengan senyawa hidrokarbon lain yang beranggotakan 6 karbon misalnya heksana (C6H14) terlihat bahwa benzena memiliki tingkat ketidakjenuhan yang tinggi. Tetapi apakah anggapan tentang sifat ketidak jenuhan ini benar? Ternyata benzena walaupun memiliki ketidakjenuhan seperti halnya senyawa alkena tetapi benzena tidak memiliki sifatsifat kimia seperti halnya senyawa alkena. Tentang sifat benzena ini akan dibahas lebih lanjut di topik berikutnya tetang senyawa aromatik sederhana. Penamaan sebagai senyawa aromatik untuk benzena dan senyawa turunannya didasarkan pada aroma yang dimiliki sebagian dari senyawa-senyawa tersebut. Tetapi perkembangan kimia berikutnya menunjukkan bahwa klasifikasi senyawa kimia dilakukan berdasarkan struktur dan kereaktifannya, dan bukan atas dasar sifat fisikanya. Bab 5 ini akan membahas tentang senyawa aromatik yaitu benzena dan turunannya. Materi pokok senyawa aromatik akan dibagi dalam dua topik yaitu tentang senyawa aromatik sederhana dan senyawa aromatik heterosiklik. Setelah mempelajari materi dalam bab ini mahasiswa diharapkan mampu : 1. menyebutkan ciri-ciri senyawa benzena dan turunannya 2. menerapkan tata nama senyawa aromatik berdasarkan strukturnya 3. menjelaskan sifat-sifat senyawa aromatik. 4. menuliskan persamaan reaksi pembuatan benzena dan turunannya 5. menuliskan reaksi yang terjadi pada benzena dan turunannya 6. menyebutkan contoh kegunaan senyawa benzena dan turunannya. 7. menyebutkan ciri-ciri senyawa aromatik polisiklik dan heterosiklik 8. menerapkan tata nama senyawa aromatik polisiklik dan heterosiklik 9. menuliskan reaksi sederhana pada senyawa aromatik polisiklik 10. menjelaskan jenis senyawa heterosiklik berdasarkan jumlah atom karbon penyusunnya 11. menyebutkan contoh senyawa heterosiklik di alam. Untuk memudahkan mempelajari materi dalam bab ini, anda dapat membaca dengan seksama materi yang ada kemudian lanjutkan dengan mengerjakan latihan-latihan soal. Setelah satu topik selesai dipelajari maka lanjutkan evaluasi hasil belajar anda dengan menjawab soal-soal pada tes. 145 Kimia Organik Topik 1 Senyawa Aromatik Sederhana S Benzena adalah senyawa siklik dengan rumus molekul C6H6 yang memiliki enam atom karbon dengan setiap atom karbonnya terhibidrisasi sp2. Setiap atom karbon hanya memiliki satu hidrogen yang terikat. Benzena memiliki 3 ikatan rangkap dalam cincinny cincinnya, bila dibandingkan dengan senyawa hidorkarbon lain yang memiliki enam anggota karbon, misalnya heksana (C6H14) atau heksena (C6H12), diduga benzena memiliki sifat ketidakjenuhan yang tinggi seperti halnya alkena. Tetapi ternyata benzena tidak sifat seperti yang dimiliki oleh alkena. Sebagai contoh, benzena tidak menunjukkan sifta-sifat dapat bereaksi seperti alkena, bila benzena direaksikan dengan Br2warna coklat dari bromin tidak dapat hilang hal ini menandakan tidak terjadi reaksi adisi pada benzena oleh Br2.Reaksi yang terjadi pada benzena dengan halogen bukan merupakan reaksi adisi tetapi reaksi sifat kimia yang diperlihatkan oleh benzena memberi petunjuk bahwa substitusi. Sifat-sifat senyawa tersebut memang tidak segolongan dengan alkena ataupun sikloalkena. maan sebagai senyawa aromatik pada awalnya untuk menggambarkan beberapa Penamaan senyawa benzena dan turunan benzena yang mempunyai aroma khas, benzena memiliki aroma yang manis, benzaldehida memiliki aroma seperti buah ceri, peach dan almond, ngat khas yang merupakan aroma dari suatu resin tolu balsam aroma toluena juga sangat yangberasal dari pohon myroxylon. O C Benzena Benzaldehida CH3 H Toluena Benzena merupakan senyawa nonpolar yang banyak digunakan sebagai pelarut karena benzena bersifat karsinogenik. industri, tetapi penggunaannya harus sangat hati-hati hati Pada bidang kefarmasian senyawa aromatik banyak dijumpai dalam beberapa golongan obat seperti steroid. 146 Kimia Organik A. RUMUS STRUKTUR BENZENA Friedrich August Kekule pada tahun 1873 menyatakan rumus struktur dari benzena sebagai suatu struktur heksagonal dengan enam atom karbon yang memiliki ikatan rangkap berselang-seling. H H H C C C C H C C H H H C H C C C C C H H H H struktur kekule dengan semua atom dituliskan Bila benzena direaksikan dengan halogen (Cl atau Br) dengan katalis FeCl 3 maka hanya akan dihasilkan satu senyawa dengan rumus molekul C6H5X. hal ini menunjukkan bahwa benzena memiliki atom C dan H yang ekivalen. Tetapi, walaupun benzena mempunyai ikatan rangkap, benzena tidak mempunyai sifat seperti halnya senyawa alkena. Pada senyawa alkena reaksi dengan halogen akan menghasilkan reaksi adisi, sedangkan pada benzena reaksi dengan halogen akan menghasilkan reaksi substitusi. Sifat ini tidak dapat dijelaskan dengan struktur kekule. Ikatan rangkap pada benzena tidak terlokalisasi pada karbon tetentu tetapi dapat berpindah-pindah (delokalisasi), ini yang disebut dengan resonansi. Struktur Kekule memberikan sumbangan yang sama terhadap hibrida resonansi, yang berarti bahwa ikatanikatan C-C bukan ikatan tunggal dan juga bukan ikatan rangkap, melainkan di antara keduanya. struktur resonansi benzena Cincin benzena juga dapat ditampilkan dalam bentuk segienam beraturan dengan sebuah lingkaran di dalamnya, dimana pada setiap sudut segienam tersebut terikat sebuah atom H. hibrida resonansi dari 147 dan Kimia Organik B. TATA NAMA SENYAWA BENZENA TERSUBSTITUSI Beberapa senyawa benzena memiliki nama tersendiri yang tidak tersistem. Beberapa nama yang lazim seperti tercantum dalam tabel berikut ini : Tabel 5.1. struktur dan nama-nama beberapa benzena tersubstitusi yang umum Struktur Nama Struktur Nama CH3 CH3 toluena orto-xilena CH3 O OH fenol C NH2 benzaldehida H O anilin C asam benzoat OH H C C H O stirena C H Asetofenon CH3 Benzena diberi nama seperti alkana ranta lurus bila sebagai induk. Substituen yang terikat apda benzena diberi nama sebagai awalan dan diikuti benzena sebagai induknya. Benzena dapat memiliki satu substituen (monosubstitusi), dua substituen (disubstitusi), atau lebih dari dua substituen (polisubstitusi). Penamaan benzena mengikuti jumlah substituen yang terikat padanya. 1. Benzena monosubstitusi Penamaan untuk benzena monosubstitusi dilakukan seperti pada aturan hidrokarbon lainnya. Nama substituen sebagai awalan diikuti oleh nama benzenanya. 148 Kimia Organik Br CH2CH3 bromobenzena etilbenzena NO2 nitrobenzena Gugus benzena tersubstitusi oleh alkil ini disebut juga sebagai gugus arena. Penamaan untuk senyawa arena tersubstitusi ini tergantung dari jenis substituen yang terikat padanya. Bila alkil yang terikat lebih kecil (kurang dari 6 karbon) daripada jumlah karbon penyusun cincin benzena disebut sebagai benzena tersubstitusi alkil. Tetapi bila jumlah karbon alkil lebih besar (7 atau lebih karbon) daripada jumlah karbon penyusun cincin benzena maka disebut sebagai senyawa alkana tersubstitusi fenil (-C6H5). Fenil untuk menyatakan benzena sebagai substituen. Bila benzena mengikat suatu alkana dengan gugus fungsional disebut juga sebagai substituen sehingga penamaan untuk cincin aromatiknya sebagai fenil. Sedangkan penamaan benzil digunakan untuk gugus C6H5CH2CH2 gugus fenil gugus benzil OH CH3 CHCH3 CHCH2CH2CH2CH2CH3 1-fenil-1-etanol 2-fenilheptana 2. CH2Cl benzil klorida Benzena disubstitusi Penamaan untuk benzena dengan dua substituen menggunakan awalan orto (o), meta (m), dan para (p). orto (o) untuk menyatakan substituen pada posisi 1,2 dari cincin benzena. Meta (m) adalah posisi hubungan substituen pada 1,3. Para (p) menyatakan posisi hubungan substituen pada 1,4. Jika salah satu substituen memberikan nama khusus maka penamaannya menggunakan nama turunan senyawa tersebut. Apabila dua substituen yang diikat oleh benzena tidak memberikan nama khusus maka penamaan diurutkan berdasarkan abjad. 149 Kimia Organik H3CH2C O Br Br H3C C NH2 H Br Cl o-dibromobenzena m-metilanilina p-klorobenzaldehida m-bromo etilbenzena 3. Benzena polisubsititusi Benzena yang memiliki substituen lebih dari dua maka maka posisi masing-masing substituen ditunjukkan dengan nomor. Posisi karbon 1 ditentukan dengan memperhatikan posisi substituen dua sehingga substituen kedua memiliki posisi serendah mungkin terhadap substituen pertama. Jika salah satu substituen memberikan nama khusus pada senyawa aromatik tersebut, maka diberi nama sebagai turunan dari nama khusus tersebut. Jika semua substituen tidak memberikan nama khusus, posisisnya dinyatakan dengan nomor dan diurutkan sesuai urutan abjad, dan diakhiri dengan kata benzena. O2 N CH3 O2 N Br Cl NO2 OH Cl Cl O2 N 1,2,4-triklorobenzena 2-bromo-3-nitrofenol 2,4,6-trinitrotoluena (TNT) C. SIFAT FISIS SENYAWA AROMATIK Benzena dan senyawa hidrokarbon aromatik bersifat nonpolar, tidak larut dalam air, tetapi larut dalam pelarut organik seperti dietil eter atau pelarut lain yang nonpolar. Penggunaan benzena secara luas sebagai pelarut. Benzena bersifat toksik dan karsinogenik. Titik didih dan titik leleh senyawa aromatik besifat khas, tidak mempunyai pola tertentu. Misalnya benzena mempunyai titik leleh 5,50C dan titik didih 800C, sedangkan toluena mempunyai titik leleh -950C dan titik didih 1110C. untuk xilena mempunyai titik leleh yang berbeda, p-xilena mempunya titik leleh paling tinggi (130C) dibandingkan m-xilena (480C) dano-xilena (-250C). ciri khas dari senyawa aromatik adalah isomer para akan mempunyai titik leleh lebih tinggi dibandingkan dengan meta dan orto. Karena p-isomer lebih simetris dan membentuk kisi kristal yang lebih teratur dan lebih kuat. D. REAKSI-REAKSI BENZENA 1. Halogenasi Reaksi halogenasi merupakan reaksi subsititusi. Pada reaksi ini dibutuhkan katalis misalnya FeX3 misalnya FeCl3 atau FeBr3 yang berperan dalam mempolarisakan molekul 150 Kimia Organik halogen sehingga menghasilkan elektrofil X+. FeCl3 biasanya dibuat dari Fe dan Cl2. Katalis lain yang dapat digunakan adalah AlCl3. Prosesnya dapat berlangsung sebagai berikut : 2Fe + 3 Br2 Br – Br + FeCl3 Contoh reaksinya : + Br2 2FeBr3 Br+ + FeBr4Br FeBr3 + HBr + HCl Cl + Cl2 AlCl3 2. Nitrasi Reaksi nitrasi terjadi apabila benzena diolah dengan HNO3 pekat dengan katalis H2SO4 pekat. Pada reaksi nitrasi yang berperan sebagai elektrofil adalah NO2+. Pembentukan NO2+ ini dipercepat oleh H2SO4 pekat. Reaksinya berlangsung sebagai berikut : NO2 H2SO4 H2O + + HNO3 3. Sulfonasi Reaksi sulfonasi terjadi apabila benzena direaksikan dengan H2SO4 yang akan menghasilkan asam benzena sulfonat. Yang berperan sebagai elektrofil adalah SO 3 atau SO3H+. SO3H + H2SO4 + panas H2O 4. Alkilasi Friedel-Crafts Alkilasi benzena merupakan reaksi subsititusi benzena dengan gugus alkil halida yang menggunakan katalis Al halida, misalnya AlCl3. Reaksi ini pertama kali dikembangkan oleh Charles Friedel dan James Crafts, ahli kimia dari Amerika, pada tahun 1877. Contoh reaksinya : AlCl3 CH2CH2CH3 + HCl + CH CH CH Cl 3 2 2 benzena propilbenzena 151 Kimia Organik 5. Asilasi Friedel-Crafts Reaksi substitusi gugus asil (RC=O atau ArC=O) pada cincin benzena dapat terjadi dengan bantuan katalis Al halida (AlCl3). Reaksi ini dapat digunakan untuk menghasilkan suatu senyawa aril keton. E. PEMBUATAN BENZENA Sumber utama senyawa organik adalah dari coal (batubara) dan petroleum (minyak bumi). Senyawa organik dapat diperoleh dari destilasi ter batubara atau disintesis dari senyawa alkana yang berasal dari minyak bumi. Destilasi dari batubara akan menghasilkan berbagai senyawa aromatik seperti benzena, toluena, xilena, fenol, kresol, dan naftalena.Tetapi metode ini mulai digantikan dengan metode produksi dari minyak bumi sejak tahun 1930-1940-an, karena hasil produksinya yang rendah yaitu kurang dari 5 %. Minyak bumi yang kaya dengan senyawa sikloalkana dapat menjadi sumber pembuatan senyawa aromatik. Senyawa sikloalkana dapat dibuat menjadi senyawa aromatik melalui proses eliminasi hidrogen (dehidrogenasi), reaksi ini dikenal juga dengan nama catalytic reforming. Produksi dengan cara ini memberikan sumbangan 30 % dari produksi dunia untuk senyawa aromatik. CH3 CH3 Mo2O3 . Al2O3, 560 0C + 3H2 toluena metil sikloheksana Pada skala laboratorium benzena juga dapat dibuat dengan beberapa cara diantaranya adalah : 1. Distilasi dari natrium benzoat kering dengan natrium hidroksida berlebih. O + Na2CO3 + NaOH C ONa natrium benzoat 2. benzena Benzena atau alkil benzena juga dapat dibuat melalui proses pirolisis dari senyawa hidrokarbon alifatik. Contohnya : 470 0C CH3CH2CH2CH2CH2CH3 Cr2O3 benzena heksana 3. Mengalirkan gas asetilena ke dalam tabung yang panas dengan katalis Fe-Cr-Si akan menghasilkan benzena. HC CH 650 0C Fe-Cr-Si asetilena benzena 152 Kimia Organik 4. reduksi fenol dengan logam seng OH + + Zn fenol 5. benzena reaksi asam benzenasulfonat dengan uap air O S O OH + + H2O asam benzenasulfonat F. ZnO H2SO4 benzena BENZENA DALAM KEHIDUPAN SEHARI-HARI Benzena dan turunannya banyak digunakan dalam kehidupan sehari-hari, misalnya benzena sebagai pelarut. Stirena digunakan dalam bentuk polimer (polistirena) yang berguna dalam pembuatan isolator listrik, atau bahan pembungkus makanan (gelas, piring polistirena). Fenol dalam kehidupan sehari-hari dikenal sebagai karbol atau lisol yang berfungsi sebagai desinfektan. Toluena sebagai bahan baku pembuat trinitro toluena suatu bahan peledak (dinamit). Benzaldehida yang mempunyai bau khas digunakan sebagai bahan baku pembuatan parfum dan dapat juga digunakan sebagai bahan pengawet. Beberapa senyawa turunan asam benzoat banyak digunakan dalam bidang farmasi, misalnya asam asetil salisilat atau asetosal atau aspirin, metil salisilat yang digunakan sebagai bahan baku obat gosok, natrium benzoat sebagai bahan pengawet makanan, dan parasetamol sebagai analgesik-antipiretik. trinitro toluena (TNT) polistirena 153 Kimia Organik Aspirin atau asetosal Desinfektan LATIHAN 1. 2. Gambarkan rumus struktur benzena menurut kekule ! Manakah diantara struktur yang merupakan orto,meta, dan para ? NO2 COOH I Br OH CH3 A B CH3 Cl C D I NH2 E 3. Tuliskan struktur dari : A. iodobenzena B. p-kloro benzil bromida C. 4-bromo-1,2-dimetilbenzena 4. 5. Tuliskan reaksi pembuatan senyawa benzena dari senyawa alifatik dan aromatik. Bagaimana reaksi benzena dengan : A. Asam nitrat pekat dengan katalis asam sulfat B. Asam sulfat C. Kloroetana dengan katalis AlCl3 Petunjuk mengerjakan latihan 1. Benzena digambarkan sebagai struktur heksagonal dengan enam atom karbon yang memiliki ikatan rangkap berselang-seling. H H H C H H C H C C C C C C C C H C H H C H H H 154 Kimia Organik 2. Orto ditunjukkan pada struktur B dan D karena orto adalah posisi substituen pada cincin aromatik pada karbon 1,2. Meta ditunjukkan pada struktur A dan E karena meta adalah posisi substituen pada cincin aromatik pada karbon 1,3. Para ditunjukkan pada struktur C karena para adalah posisi substituen pada cincin aromatik pada karbon 1,4. A. 3. A. iodobenzena : menunjukkan benzena monosubstitusi yaitu hanya ada substituen I (iodo) I B. p-kloro benzil bromida : benzena disubstitusi dengan substituen kloro yang terikat pada benzilbromida pada posisi para Cl C. CH2Br 4-bromo-1,2-dimetilbenzena : benzena polisubstitusi dengan 3 substituen pada cincin aromatik. CH3 CH3 Br 4. Reaksi pembuatan benzena dengan senyawa alifatik : 650 0C Fe-Cr-Si HC CH asetilena benzena Reaksi pembuatan benzena dengan senyawa aromatik : OH + fenol 5. A. + Zn ZnO benzena Reaksi benzena dengan asam nitrat (HNO3) pekat dengan H2SO4akan menghasilkan senyawa nitrobenzena NO2 H2SO4 H2O + + HNO3 155 Kimia Organik B. Reaksi benzena dengan H2SO4akan menghasikan asam benzena sulfonat SO3H + H2SO4 C. H2O + panas Reaksi benzena dengan kloroetana (alkil halida) dengan katalis AlCl3akan menghasilkan reaksi alkilasi pada senyawa benzena + CH3CH2Cl AlCl3 CH3CH2Cl + HCl etilbenzena benzena RINGKASAN 1. 2. 3. 4. 5. 6. 7. 8. 9. Benzena adalah senyawa siklik dengan rumus molekul C6H6 yang memiliki enam atom karbon dengan satu hidrogen yang terikat pada setiap karbonnya dan tiga ikatan rangkap. Beberapa benzena dengan substituen tertentu memiliki nama khusus seperti toluena, fenol, anilina, xilena, asam benzoat, benzaldehida, asetofenon, dan stirena. Benzena dapat tersubstitusi mono, di, atau poli. Penamaan benzen nama substituen sebagai awalan diikuti oleh nama benzenanya. Penamaan untuk benzena dengan dua substituen menggunakan awalan orto (o), meta (m), dan para (p). Benzena yang memiliki substituen lebih dari dua maka maka posisi masing-masing substituen ditunjukkan dengan nomor. Benzena dan senyawa hidrokarbon aromatik bersifat nonpolar, tidak larut dalam air, tetapi larut dalam pelarut organik seperti dietil eter atau pelarut lain yang nonpolar. Titik didih dan titik leleh senyawa aromatik besifat khas, tidak mempunyai pola tertentu. iri khas dari senyawa aromatik adalah isomer para akan mempunyai titik leleh lebih tinggi dibandingkan dengan meta dan orto. Benzena dapat mengalami reaksi halogenasi, nitrasi, sulfonasi, alkilasi dan asilasi friedel craft. Pembuatan benzena dan turunan dapat dilakukan pada skala industri dengan bahan baku dari batu bara atau minyak bumi. Pada skala yang lebih kecil dapat dilakukan dengah menggunakan senyawa alifatik atau aromatik. Misalnya, destilasi dari natrium benzoat kering dengan natrium hidroksida berlebih, pirolisis dari senyawa hidrokarbon alifatik, reaksi gas asetilena dengan katalis Fe-Cr-Si, reduksi fenol dengan logam seng, dan reaksi asam benzenasulfonat dengan uap air. 156 Kimia Organik TES 1 1. Pernyataan yang sesuai untuk benzena adalah : A. Senyawa siklik dengan keenam karbon dan hidrogen ekivalen B. Mempunyai sifat yang sama seperti alkena C. Dapat diadisi oleh senyawa halogen D. Mudah diperoleh di alam 2. Reaksi antara benzena dengan bromin dapat terjadi dengan katalis FeBr3 melalui mekanisme reaksi : A. Adisi B. Eliminasi C. Substitusi D. Oksidasi 3. Apakah nama IUPAC dari senyawa berikut ini : A. Butilbenzoat B. Isobutilbenzoat C. Sec-butilbenzoat D. Tert-butilbenzoat 4. Penamaan yang tepat untuk senyawa dibawah ini adalah : A. 1-metil-2,5-diklorobenzena B. 1-4-dikloro-6-metilbenzena C. 2,5-diklorotoluena D. 1,4-diklorotoluena 5. Diantara pernyataan berikut : I. Benzena dan senyawa hidrokarbon aromatik bersifat nonpolar II. Benzena tidak larut dalam air dan dietil eter III. Isomer para pada benzena mempunyai titik leleh lebih tinggi dibandingkan meta dan orto IV. Benzena banyak diperoleh dari minyak bumi Manakah yang sesuai untuk benzena ? A. I, II, dan III B. I, III, dan IV C. I, II, dan IV D. II, III, dan IV 157 Kimia Organik 6. Benzena dapat mengalami reaksi halogenasi, nitrasi, sulfonasi, asilasi dan alkilasi melalui reaksi .. A. Adisi B. Eliminisai C. Substitusi D. oksidasi 7. Reaksi benzena dengan senyawa klor dengan katalis AlCl3 akan menghasilkan… A. Klorosikloheksana B. Klorosikloheksena C. Klorobenzena D. Klorobenzoat 8. O C CH3 asetofenon I. Dibuat dengan reaksi dari benzena dengan II. Membutuhkan katalis H2SO4 III. Reaksinya melalui alkilasi friedelcraft IV. Membutuhkan katalis AlCl3 pernyataan yang sesuai tentang reaksi pembuatan asetofenon adalah … A. I dan II B. I dan III C. I dan IV D. II dan III 9. Untuk dapat memperoleh benzena dapat dilakukan dengan reaksi berikut kecuali : A. Destilasi Natrium benzoat dengan NaOH berlebih B. Nitrasi senyawa anilina C. Pirolisis dari hidrokarbon alifatik pada suhu 470 0C dan katalis Cr2O3 D. Reduksi fenol dengan logam seng 10. Senyawa turunan benzena yang banyak digunakan sebagai bahan pembuat wadah makanan adalah… A. Toluena B. Asetofenon C. stirena D. xilena 158 Kimia Organik Topik 2 Senyawa Aromatik Polisiklik dan Heterosiklik Pada Topik 1 sudah dipelajari tentang senyawa benzena dan turunannya. Senyawa benzena merupakan senyawa aromatik monosiklik karena benzena hanya memiliki satu cincin aromatik. Senyawa aromatik polisiklik polisiklik disebut juga senyawa cincin terpadu. Contoh yang sering kita jumpai sehari-hari sehari hari adalah naftalena yang digunakan sebagai pengusir serangga. Turunan dari naftalena digunakan dalam bahan bakar motor. Gambar 5.1 Naftalena Selain sebagai senyawa aromatik monosiklik, benzena juga dikenal sebagai senyawa homosiklik karena dalam atom penyusun cincinnya hanya terdiri dari atom karbon. Pada kelompok senyawa aromatik dikenal juga senyawa heterosiklik, yaitu suatu senyawa siklik atom penyusunnya terdiri dari dua atau lebih unsur yang berlainan. Banyak dimana atom-atom senyawa aromatik di alam yang penting seperti alkaloid contohnya nikotin dan asam nukleat dengan gula penyusunnya seperti sitosina, timina, adenina, dan guanina. Nikotina Adenin 159 Kimia Organik A. TATA NAMA SENYAWA POLISIKLIK Penamaan untuk senyawa aromatik polisiklik memakai nama individual. Aturan penomoran pada cincin aromatiknya sudah ditetapkan melalui perjanjian dan tidak berubah bagaimanapun posisi substituennya. Tiga senyawa aromatik polisiklik yang akan kita pelajari adalah naftalena, antrasena, dan fenantrena. 5 8 1 8 2 7 6 1 4 2 7 6 3 5 9 4 10 9 1 4 7 8 3 2 3 5 6 10 Untuk naftalena yang mempunyai substituen posisi substituen tersebut dapat dinyatakan dengan huruf yunani. Terdapat 2 posisi yaitu α dan β. α adalah posisi yang menunjukkan letak karbon yang paling dekat dengan pertemuan cincin, posisi lainnya adalah β. sehingga untuk naftalena ada 4 posisi α dan 4 posisi β. Penamaan dengan sistem huruf yunani ini hanya berlaku untuk naftalena, untuk antrasena dan fenantrena berlaku sistem bilangan. NO2 Br O2 N 2-bromonaftalena 3,7-dinitrofenantrena (β-bromonaftalena) B. REAKSI PADA SENYAWA AROMATIK POLISIKLIK 1. Reaksi Oksidasi Senyawa aromatik polisiklik dapat mengalami reaksi oksidasi. Dibandingkan dengan benzena senyawa aromatik polisiklik lebih reaktif terhadap reaksi oksidasi, reduksi, dan substitusi karena senyawa aromatik polisiklik dapat bereaksi pada satu cincin dan masih mempunyai cincin lain yang utuh. Benzena tidak mudah dioksidasi sedangkan oksidasi naftalena dapat menghasilkan anhidrida asam ftalat atau senyawa kuinon. Antrasena dan fenantrena juga dapat mengalami reaksi oksidasi menjadi senyawa kunion. O O V2O5 udara kalor naftalena OH OH -H2O O O O asam o-ftalat 160 anhidrida asam ftalat Kimia Organik Oksidasi naftalena, antrasena dan fenantrena menghasilkan senyawa kuinon. O dengan CrO3 dengan asam dapat CrO3 CH3CO2H kalor O 1,4-naftokuinon naftalena O CrO3 H2SO4 kalor O antrasena 9,10-antrakuinon CrO3 H2SO4 kalor O O fenantrena 9,10-fenantrakuinon 2. Reduksi Senyawa aromatik polisiklik Reduksi senyawa aromatik polisiklik merupakan reaksi hidrogenasi. Reaksi reduksi dengan natrium dan etanol akan menghasilkan hidrogenasi parsial, pada kondisi ini benzena tidak dapat direduksi. Cincin polisiklik dapat dihidrogenasi dengan lengkap seperti halnya benzena dengan menggunakan kalor dan tekanan. Na, CH3CH2OH kalor naftalena + 3 H2 Pt 0 225 , 35 atm dekalin tetralin + 5 H2 Pt 0 225 , 35 atm dekalin naftalena Na, CH3CH2OH kalor antrasena 9,10-dihidroantrasena 161 Kimia Organik 3. Reaksi Substitusi Naftalena Naftalena, antrasena, dan fennatrena dapat mengalami reaksi substitusi, tetapi substitusi pada senyawa antrasena dan fenantrena seringkali diperoleh campuran isomer yang sukar dipisahkan. Reaksi substitusi pada naftalena dapat terjadi reaksi brominasi, nitrasi, sulfonasi, dan asilasi. Brominasi Br Br2 1-bromonaftalena Nitrasi NO2 HNO3, H2SO4 hangat 1-nitroaftalena sulfonasi SO3H H2SO4 pekat, 800C hangat asam 1-naftalenasulfonat Asilasi O O CCH3 CH3CCl , AlCl3 1-asetilnaftalena C. TATA NAMA SENYAWA HETEROSIKLIKAROMATIK Senyawa heterosiklikaromatik banyak terdapat di alam, baik yang berupa cincin aromatik 5 anggota atau 6 anggota. Senyawa heterosiklik, yaitu senyawa yang memiliki lebih dari satu jenis atom dalam sistem cincinnya.Senyawa heterosiklik aromatik ini mempunyai nama khusus. Beberapa nama senyawa aromatik heterosiklik seperti berikut ini : 162 Kimia Organik N N H O pirola N H N H S imidazola tiazola S furan tiofena N N N pirazola N N N N H N pirimidina piridina N purina N N N N indola isokuinolina kuinolina N H Penomoran untuk senyawa heterosiklik aromatik dimulai dari atom yang bukan karbon. Tetapi bila ada lebih dari satu atom bukan karbon maka penomoran berasarkan prioritas. Misalnya untuk S dan N, S diberi nomor lebih kecil (prioritas lebih tinggi) dibandingkan N. 4 3 2 5 O 1 furan 4 4 N 3 5 3 2 5 2 6 S 1 N 1 piridina tiazola Penamaan dengan huruf yunani dapat dilakukan untuk senyawa heterosiklik. Tetapi hanya berlaku untuk heterosiklik yang hanya mengandung satu heteroatom. Atom karbon yang dekat dengan heteroatom adalah karbon α. Karbon berikutnya dinamakan sebagai karbon . Apabila setelah karbon α dan karbon masih ada karbon, maka karbon tersebut dinamakan karbon γ. γ α N α piridina 163 Kimia Organik Contoh : COOH N asam 3-piridinakarboksilat D. SO3H N H N 2-fenilpiridina asam 2-pirolasulfonat SENYAWA HETEROSIKLIK AROMATIK LIMA ANGGOTA CINCIN Senyawa heterosiklik lima anggota yang paling sederhana adalah pirola, furan, dan tiofena. N H O pirola S furan tiofena Karakteristik kimia dari senyawa heterosiklik aromatik lima anggota adalah mudah mengalami reaksi substitusi elektrofilik terutama pada posisi kedua cincin. Reaksi substitusi elektrofilik yang dapat terjadi adalah nitrasi, halogenasi, sulfonasi, dan asilasi Friedel-Crafts Contoh : HNO3 + O C Cl + S NO2 N H N H SnCl4 S 2-Benzoiltiofena Tiofena O furan O C + Br2 dioksan 250C O Br 2-bromofuran Pirola dan tiofena dapat diperoleh dalam jumlah kecil dari batubara melalui proses destilasi. Tetapi hasilnya sangat kecil. Tiofena dapat disintesis dalam skala industri melalui reaksi antara n-butana dan sulfur (S) dengan suhu tinggi (560 0C). 164 Kimia Organik CH3CH2CH2CH3 + S 560 0C + S n-butana H2 S tiofena Pirola dapat disintesis dalam berbagai cara, diantaranya adalah : HC CH + 2HCHO Cu2C2 HOCH2C CCH2OH NH3 tekanan 1,4-butunadiol E. N H pirola SENYAWA HETEROSIKLIK AROMATIK ENAM ANGGOTA CINCIN Contoh senyawa heterosiklik aromatik enam anggota adalah piridina. Piridina memiliki struktur sama dengan benzena, yaitu cincin datar dengan lima atom karbon dan satu atom nitrogen. Setiap atom dalam cincin terhibridisasi secara sp2. piridina memiliki satu atom nitrogen yang bersifat elektronegatif maka senyawa piridina bersifat polar, sedangkan benzena bersifat nonpolar. Karena nitrogen pada piridina bersifat elektronegatif, maka atom karbon lain dalam cincin menjadi bermuatan positif parsial karena kekurangan elektron. Karena adanya muatan positif parsial ini menyebabkan piridina reaktifitasnya rendah terhadap reaksi substitusi elektrofilik dibandingkan benzena. Cincin aromatik pada piridina tidak mudah mengalami oksidasi seperti halnya benzena. Oksidasi akan terjadi pada rantai samping yang dapat berubah menjadi senyawa karboksilat dan cincin aromatiknya akan tetap utuh. CH3 KMnO4, H2O, H+ asam benzoat toluena CH3 N 3-metilpiridina CO2H CO2H KMnO4, H2O, H+ N asam 3-piridinakarboksilat Piridina dapat mengalami reaksi substitusi nukleofilik yang akan berlangsung paling mudah pada posisi kedua dan diikuti posisi keempat. NH3 kalor N NH2 N Br 2-bromopiridina 2-aminopiridina 165 Kimia Organik Substitusi nukleofilik juga dapat terjadi pada piridina tanpa substituen. Reaksi terjadi jika digunakan basa yang sangat kuat seperti reagensi litium atau ion amida (NH 2-). Reaksi ini tidak akan terjadi pada benzena. F. KUINOLINA DAN ISOKUINOLINA Senyawa heterosiklik aromatik lainnya adalah kuinolina dan isokuinolina. Kuinolina adalah Senyawa heterosiklik aromatik yang strukturnya serupa dengan naftalena tetapi dengan nitrogen pada posisi kesatu. Isokuinolina adalah isomer dari kuinolina dengan atom nitrogen terletak pada posisi kedua. Penomoran pada isokuinolina tidak dimulai dari atom nitrogen tetapi dari atom karbonnya. 4 5 6 7 8 N 1 5 3 6 2 7 3 8 kuinolina 4 N2 1 isokuinolina Cincin nitrogen dalam kuinolina dan isokuinolina dapat mengalami reaksi substitusi elektrofilik dengan lebih mudah dibandingkan piridina. Substitusi elektrofilik terjadi pada posisi 5 dan 8. NO2 HNO3 H2SO4 N kuinolina + N N NO2 5-nitrokuinolina 8-nitrokuinolina NO2 N HNO3 H2SO4 N + N NO2 isokuinolina 5-nitroisokuinolina 8-nitroisokuinolina Kuinolina dan isokuinolina dapat mengalami reaksi substitusi nukleofilik seperti halnya piridina. Reaksi ini dapat terjadi pada posisi α terhadap nitrogen. 166 Kimia Organik CH3Li H2O N kuinolina CH3 N 2-metilkuinolina N NH2H2O N NH2 isokuinolina G. 1-aminoisokuinolina AROMATIK DI ALAM CONTOH SENYAWA HETEROSIKLIK HETER Alkaloid adalah salah satu senyawa basa bernitrogen yang umumnya berupa senyawa hetrosiklik yang diekstraksi dari bahan alam. Contoh alkaloid adalah nikotin dan morfin. Nikotin adalah senyawa yang dalam dosis rendah dapat bertindak sebagai stimulan sistem syaraf otonom seperti efek yang timbul dari rokok. Nikotin dalam dosis tinggi dapat bersifat toksik. Nikotin Alkaloid dari getah biji candu (Papaver somniverum) salah satunya dalah morfin. Morfina adalah alkaloidanalgesik yang sangat kuat bekerja bekerja langsung pada sistem saraf pusat untuk menghilangkan rasa sakit. Morfin banyak disalahgunakan oleh para pecandu obat terlarang. morfina 167 Kimia Organik LATIHAN 1. Berilah nama pada senyawa berikut ini : Br Br A. OH O B. O C. 2. 3. 4. 5. CH3 Bagaimanakah reaksi antara naftalena dengan : A. natrium dan etanol B. asam nitrat dan katalis asam sulfat Bagaimana reaksi oksidasi yang terjadi pada antrasena dan fenantrena Berikan struktur untuk nama senyawa berikut ini : A. 2-metoksifuran B. 4,5-diklorokuinolina C. Asam-3-tiofenakarboksilat Bagaimana hasil dari reaksi berikut ini : A. Tiofena dengan H2SO4 B. isokuinolina dengan C6H5Li C. 4-bromopirimidina dengan NH3 Petunjuk Mengerjakan Latihan : 1. Nama senyawa tersebut adalah : A. senyawa naftalena dengan substituen Br pada posisi karbon 1 dan 8, 1,8dibromonaftalena B. senyawa naftokuinon dengn gugus hidroksi pada karbon 8, 8-hidroksi-1,4naftokuinon C. senyawa dihidroantrasena dengan substituen metil pada karbon 1, 1-metil-9,10dihidrofenantrena 2. A. reaksi antara naftalena dengan natrium dan etanol merupakan reaksi reduksi sehingga akan terjadi hidrogenasi Na, CH3CH2OH kalor naftalena tetralin 168 Kimia Organik B. reaksi naftalena dengan asam nitrat (HNO3) dengan katalis asam sulfat (H2SO4) merupakan reaksi nitrasi. NO2 HNO3, H2SO4 hangat 3. 4. 1-nitroaftalena Reaksi oksidasi pada antrasena dan fenantrena akan menghasilkan senyawa kuinon, reaksi berlangsung dengan adanya CrO3 dan asam sulfat. Reaksi oksdasi berlangsung pada posisi 9 dan 10 sehingga akan dihasilkan 9,10-antrakuinon pada antrasenan dan 9,10-fenantrakuinon pada fenantrena. A. 2-metoksifuran, merupakan senyawa heterosiklik aromatik lima anggota dari furan dengan substituen metoksi (OCH3) pada posisi kedua. O OCH3 B. 4,5-diklorokuinolina, kuinolina dengan substituen Cl pada posisi 4 dan 5 Cl Cl C. N Asam-3-tiofenakarboksilat, senyawa tiofena dengan gugus karboksilat pada posisi 3. S COOH 5. A. B. Tiofena dengan H2SO4, reaksi substitusi elektrofilik pada posisi kedua menghasilkan senyawa asam 2-tiofenasulfonat + H2SO4 SO3H S S asam 2-tiofenasulfonat Isokuinolina dengan C6H5Li, reaksi substitusi nukleofilik dimana serangan terjadi pada posisi α. N isokuinolina C6H5Li H2O N 1-fenilisokuinolina 169 Kimia Organik C. 4-bromopirimidina dengan NH3, substitusi nukleofilik pada piridin dengan substituen pada posisi-4. Br NH2 NH3 N kalor 4-bromopiridina N 4-aminopiridina LATIHAN 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. Contoh senyawa aromatik polisiklik adalah naftalena, antrasena, dan fenantrena. Aturan penomoran pada cincin aromatiknya sudah ditetapkan melalui perjanjian dan tidak berubah bagaimanapun posisi substituennya. Oksidasi senyawa naftalena dapat menghasilkan senyawa anhidrida asam ftalat. Naftalena, antrasena dan fenantrena bila dioksidasi juga dapat menghasilkan senyawa kuinon, yaitu 1,4-naftokuinon pada naftalena, 9,10-antrakuinon pada antrasena, dan 9,10-fenantrakuinon pada fenantrena. Reduksi senyawa aromatik polisiklik merupakan reaksi hidrogenasi. Naftalena, antrasena, dan fenantrena dapat mengalami reaksi substitusi, tetapi substitusi pada senyawa antrasena dan fenantrena seringkali diperoleh campuran isomer yang sukar dipisahkan. Senyawa heterosiklikyaitu senyawa yang memiliki lebih dari satu jenis atom dalam sistem cincinnya. Senyawa heterosiklikaromatik dapat berupa cincin aromatik 5 anggota atau 6 anggota. Penomoran untuk senyawa heterosiklik aromatik dimulai dari atom yang bukan karbon. Tetapi bila ada lebih dari satu atom bukan karbon maka penomoran berasarkan prioritas. Senyawa heterosiklik lima anggota yang paling sederhana adalah pirola, furan, dan tiofena. Senyawa heterosiklik aromatik lima anggota adalah mudah mengalami reaksi substitusi elektrofilik terutama pada posisi kedua cincin. Contoh senyawa heterosiklik aromatik enam anggota adalah piridina. Piridina dapat mengalami reaksi substitusi nukleofilik yang akan berlangsung paling mudah pada posisi kedua dan diikuti posisi keempat. TES 2 1. Senyawa aromatik polisiklik yang terdiri dari 2 cincin benzena adalah … A. Antrasena B. Fenantrena C. Naftalena D. Toluena 170 Kimia Organik 2. Manakah sistem penomoran untuk senyawa aromatik polisiklik berikut ini yang benar ? A. I dan II B. I dan III C. I, II, dan III D. Hanya I yang benar 3. Bagaimana penamaan untuk struktur molekul berikut ini : A. Asam 5,7-dimetilantrasena-1-sulfonat B. Asam 6,8-dimetilantrasena-1-sulfonat C. 5,7-dimetilantrasena-1-sulfonat D. 1,3-dimetilantrasena-6-sulfonat 4. Manakah pernyataan yang sesuai : I. Benzena tidak mudah dioksidasi II. naftalena dioksidasi menjadi senyawa dihidronaftalena. III. Reaksi oksidasi Antrasena dengan CrO3 dengan H2SO4 menghasilkan 9,10antrakuinon IV. Reduksi naftalena dengan dengan Natrium dan etanol akan menghasilkan tetralin A. I, II, dan III benar B. I,II, dan IV benar C. I dan II benar D. Hanya IV yang benar 5. Pernyataan yang sesuai untuk reaksi naftalena dengan asam sulfat pekat pada suhu 800C adalah … A. Reaksi oksidasi manghasilkan senyawa kuinon B. Reaksi substitusi yang akan menghasilkan senyawa nitornaftalena C. Reaksi dehidrasi yang kan menghasilkan senyawa dihidronaftalena D. Reaksi substitusi yang akan menghasilkan senyawa asam naftalena sulfonat. 6. Berikut ini adalah senyawa heterosiklik aromatik yang dalam cincinnya mengandung atom nitrogen adalah : A. Pirola, tiofena, dan piridina B. Piridina, pirimidina, dan furan C. Piridina, furan, dan tiazola D. Pirazola, pirimidina, imidazola 7. Penamaan yang sesuai untuk struktur berikut ini adalah : A. 1,3-dinitrotiazola B. 2,4-dinitrotiazola 171 Kimia Organik C. D. 2,5-dinitrotiazola 1,4-dinitrotiofena 8. Reaksi nitrasi pada pirola akan menghasilkan… A. 1-nitropirola B. 2-nitropirola C. 3-nitropirola D. 4-nitropirola 9. Pernyataan yang sesuai tentang piridina dengan benzena adalah .. A. Piridina dan benzena merupakan senyawa nonpolar B. Piridina dan benzena tidak mudah dioksidasi C. Reaktifitas piridina terhadap substitusi tinggi D. Reaksi eliminasi piridina akan menghasilkan benzena 10. Kuinolina merupakan senyawa heterosiklik aromatik yang mempunyai struktur mirip dengan naftalena tetapi dengan satu atom nitrogen. Sifat-sifat senyawa kuinolina yang sesuai adalah … I. Mempunyai isomer isokuinolina II. Dapat mengalami reaksi substitusi elektrofilik pada posisi 5 dan 8 III. Mengalami reaksi substitusi nukleofilik pada posisi 5, dan 8 IV. Mengalami reaksi substitusi nukleofilik pada posisi α A. I dan II benar B. I dan III benar C. II dan III benar D. III dan IV benar 172 Kimia Organik Petunjuk Jawaban Tes Tes I 1. 2. 3. 4. 5. A, C, D, C, B, 6. 7. C, C, 8. C, 9. B, 10. C, Tes 2 1. C, 2. B, 3. A, 4. 5. B, D, 6. D, 7. 8. 9. 10. C, A, B, A, sifatnya berbeda dengan alkena dan tidak diadisi oleh halogen reaksi dengan halogen melalui substitusi merupakan ester benzoat dengan gugus alkilnya berupa tersier butil. merupakan senyawa toluena, substituen Cl terletak pada karbon 2 dan 5 benzena bersifat nonpolar, isomer para titik leleh lebih tinggi, dan minyak bumi salah satu sumber dari benzena reaksi pada benzena melalui substitusi elektrofilik reaksi dengan halogen merupakan reaksi substitusi sehingga tidak ada perubahan pada ikatan rangkap asetofenon dibuat dengan asilasi friedel craft, dengan halida asam dan katalis AlCl3 benzena dapat dibuat dengan senyawa alifatik dan aromatik, tetapi bukan melalui reaksi nitrasi stirena dalam bentuk polimer berguna dalam pembuatan wadah makanan (piring, gelas) naftalena adalah senyawa aromatik polisiklik yang paling sederhana penomoran sistem aromatik polisiklik mengikuti pola baku, untuk naftalena seperti no I dan fenantrena no III penomoran untuk antrasena mengikut aturan baku, SO3H berada pada posisi 1, CH3 terikat pada posisi 5 dan 7 oksidasi naftalena akan menghasilkan senyawa kuinon reaksi substitusi yang merupakan reaksi sulfonasi yang akan menghasilkan senyawa sulfonat. furan dalam cincinnya mengandung atom Oksigen dan tiofena mengandung atom S penomoran senyawa dimulai dari atom S. reaksi substitusi elektrofilik pada pirola terjadi pada posisi kedua cincin. oksidasi pada benzena atau piridina akan terjadi apabila terdapat rantai samping isomer kuinolina adalah isokuinolina, reaksi substitusi elektrofilik pada posisi 5 dan 8 173 Kimia Organik Daftar Pustaka Fessenden, R.J., Fessenden, J.S, Alih Bahasa Pudjaatmaka, A.H, 1982, Kimia Organik Jilid 1, edisi ke-3 Jakarta : Erlanggan McMurry, J., 2007, Organic Chemistry,7th edition, California : Wadsworth Inc. Morrison, R.T, Boyd,R.N, 1992, Organic Chemistry, 7th edition, New Jersey : Prentice Hall Inc. Riawan, S, 1990, Kimia Organik, Jakarta : Binarupa Aksara 174 Kimia Organik BAB VI KARBOHIDRAT, PROTEIN DAN LIPIDA Wardiyah, M.Si, Apt PENDAHULUAN Karbohidrat banyak dijumpai di alam. Gula dan pati yang terdapat pada makanan, selulosa yang terdapat dalam kayu atau kapas merupakan contoh karbohidrat yang banyak dijumpai pada bahan alam. Protein merupakan kelompok senyawa yang dijumpai di alam yang mempunyai berbagai fungsi penting. Sedangkan lipid termasuk dalam kelompok senyawa organik yang tidak larut dalam air yang juga mempunyai berbagai fungsi penting dan derivat senyawa yang termasuk dalam kelompok lipid juga mempunyai fungsi biologis yang beragam. Bab keenam ini akan membahas tiga kelompok senyawa tersebut yaitu karbohidrat, protein, dan lipida. Setelah mempelajari bahasan bab 6 ini diharapkan mahasiswa dapat : 1. menjelaskan definisi karbohidrat, protein, dan lemak 2. menjelaskan klasifikasi dari karbohidrat 3. menjelaskan konfigurasi monosakarida 4. menuliskan reaksi monosakarida 5. menuliskan contoh monosakarida, disakarida, dan polisakarida 6. menjelaskan struktur asam amino sebagai pembentuk protein 7. menuliskan sintesis asam amino 8. menuliskan reaksi asam amino 9. menjelaskan tentang peptida dan protein 10. menuliskan contoh senyawa protein yang penting 11. menjelaskan perbedaan lemak dan minyak 12. menjelaskan perbedaan sabun dan deterjen 13. menjelaskan beberapa senyawa penting yang termasuk dalam kelompok turunan lemak Agar tujuan pembelajaran tercapai peran aktif anda sangat dibutuhkan. Tanggung jawab anda sebagai mahasiswa yang berupa kewajiban belajar mandiri sangat penting agar hasil belajar menjadi optimal. Agar proses pembelajaran berjalan dengan baik anda harus membaca setiap uraian dan contoh materi yang diberikan kemudian lanjutkan dengan mengerjakan soal latihan dan evaluasi hasil belajar pada setiap topik dengan mengerjakan tes. 175 Kimia Organik Topik 1 Karbohidrat Istilah karbohidrat berasal dari glukosa sebagai karbohidrat pertama yang berhasil diperoleh secara murni. Glukosa dengan rumus molekul C6H12O6 atau (CH2O)6 disangka sebagai senyawa hidrat dari karbon. Tetapi kemudian istilah ini diketahui merupakan istilah yang salah karena karbohidrat merupakan suatu polihidroksi dari aldehid dan keton atau turunannya. Glukosa mempunya nama lain dekstrosa. H HO H H O CH C OH C H C OH C OH CH2OH glukosa Karbohidrat diperoleh dari tanaman melalui proses fotosintesis. Dengan bantuan sinar matahari maka CO2 dan H2O akan diubah menjadi glukosa dan O2. Karbohidrat ini menjadi sumber energi apabila dikonsumsi melalui proses metabolisme dalam tubuh. 6 CO2 + 6 H2O A. sinar matahari 6 O2 + C6H12O6 glukosa KLASIFIKASI KARBOHIDRAT Klasifikasi karbohidrat disusun berdasarkan ukuran molekul penyusunnya dan gugus yang dikandungnya. Berdasarkan ukuran molekulnya karbohidrat dibagi menjadi dua yaitu gula sederhana dan karbohidrat kompleks. Yang disebut dengan gula sederhana adalah kelompok monosakarida. Karbohidrat kompleks tersusun dari dua atau lebih gula sederhana. Sehingga klasifikasi karbohidrat berdasarkan ukuran molekulnya dibedakan menjadi tiga yaitu : a. Monosakarida ; karbohidrat yang tersederhana yang tidak dapat dihidrolisis menjadi molekul karbohidrat yang lebih kecil. Contohnya glukosa, fruktosa, galaktosa. Glukosa disebut juga gula darah (karena dijumpai dalam darah), gula anggur (dijumpai dalam buah anggur), atau dekstrosa (karena memutar bidang polarisasi). Glukosa yang merupakan monosakarida penyusun sukrosa, laktosa, maltosa dan pati dapat diubah oleh mamalia menjadi glukosa yang menjadi sumber energi bagi organisme atau disimpan sebagai sebagai glikogen yang meruapakan cadangan energi. Karbohidrat 176 Kimia Organik yang berlebih dapat diubah menjadi lemak, steroid (seperti kolesterol) dan secara terbatas dapat diubah menjadi protein. Fruktosa disebut juga levulosa karena dapat memutar bidang polarisasi ke kiri. Fruktosa terdapat dalam buah-buahan dan madu. Galaktosa merupakan monosakarida penyusun laktosa, suatu gula susu, yang terikat bersama dengan glukosa. H C O H C OH HO C H H C OH H C OH CH2OH D-glukosa H O C H C OH CH2OH C O HO C H H C OH HO C H HO C H H C OH CH2OH H C OH CH2OH D-fruktosa D-galaktosa Berdasarkan jumlah atom C pada monosakarida dibedakan : 1. triosa : monosakarida terkecil dengan tiga atom C, yaitu gliseraldehida dan dihidroksi aseton. 2. tetrosa : terdiri dari 4 atom C misalnya eritrosa 3. pentosa : terdiri dari 5 atom C misalnya ribosa 4. heksosa : terdiri dari 6 atom C misalnya glukosa 5. heptosa : terdiri dari 7 atom C, dan seterusnya. b. Oligosakarida ; karbohidrat terdiri dua sampai delapan satuan monosakarida. karbohidrat yang terdiri dari dua molekul monosakarida disebut dengan disakarida. Contohnya sukrosa, laktosa, maltosa. Disakarida adalah monosakarida yang dihubungkan dengan ikatan glikosidik dari karbon 1 satu monosakarida ke gugus OH dari monosakarida lainnya. Ikatan ini merupakan ikatan α dan β, yaitu 1,4’-α atau 1,4’β. Sukrosa merupakan gula pasir yang merupakan disakarida yang tersusun dari glukosa dan fruktosa. Laktosa disebut juga gula susu yang komposisi kimianya terdiri dari dua monosakarida glukosa dan galaktosa. Maltosa banyak digunakan dalam makanan bayi dan susu bubuk. Maltosa merupakan disakarida yang terdiri dari glukosa yang diperoleh dari hidrolisis dari pati. Enzim α-glukosidase merupakan enzim yang bertindak sebagai katalis dalam reaksi hidrolisis maltosa menjadi glukosa. 177 Kimia Organik sukrosa c. Polisakarida ; karbohidrat yang tersusun lebih dari delapan satuan monosakarida. Polisakarida adalah senyawa yang tersusun dari banyak molekul monosakarida yang dihubungkan dengan ikatan glikosida. Selulosa dan kitin merupakan contoh polisakarida yang berfungsi sebagai bahan bangunan. Selulosa menjadi komponen dalam dahan dan kayu dari tanaman, sedangkan kitin menjadi komponen dalam struktur kerangka luar serangga. Pati merupakan contoh polisakarida yang menjadi sumber nutrisi. Heparin merupakan contoh polisakarida yang mempunyai fungsi spesifik yaitu mencegah koagulasi darah. Berdasarkan gugus yang dikandungnya dibedakan : a. Aldosa : mengandung gugus aldehid, misalnya glukosa. b. ketosa : mengandung gugus keton, misalnya fruktosa. Ketosa-ketosa sering diberi akhiran –ulosa. Fruktosa merupakan suatu contoh heksulosa (ketosa enam karbon). H O CH2OH C H O CH2OH C O C H C OH H O C O HO C H H C OH HO C H C H C OH H C OH H C OH H C OH H C OH H C OH H C OH H C OH H C OH H C OH CH2OH CH2OH CH2OH CH2OH CH2OH glukosa aldoheksosa B. ribosa aldopentosa fruktosa ketoheksosa ribulosa ketopentosa eritrosa aldotetrosa KONFIGURASI MONOSAKARIDA 1. Proyeksi Fischer dan Konfigurasi R/S Karbohidrat memiliki atam-atom karbon kiral. Emil Fischer (1891) membuat suatu proyeksi tetrahedral dari karbohidrat dalam bidang datar. Di alam, molekul berada dalam bentuk tiga dimensi, proyeksi fischer menggambarkan bentuk tiga dimensi molekul ini menjadi bentuk dua dimensi dalam bidang datar. Proyeksi fischer ini untuk menunjukkan penataan gugus-gugus di sekitar atom karbon kiral. Karbon kiral atau karbon asimetrik adalah karbon yang mengikat empat gugus yang berlainan. Molekul-molekul kiral yang tidak dapat dihimpitkan pada bayangan cerminnya merupakan senyawa enantiomer. 178 Kimia Organik H H C C O OH H menjadi CH2OH H C C O OH CH2OH proyeksi Fischer Penamaan untuk enantiomer menggunakan konfigurasi R/S. R berarti rectus (kanan) dan S adalah sinister (kiri). Pusat atom kiral diberi nama R atau S berdasarkan aturan ChanIngold-prelog (CIP), dimana keempat gugus diurutkan berdasarkan prioritasnya. Nomor 1 adalah gugus dengan nomor atom terbesar dan nomor 4 adalah gugus dengan nomor atom terkecil. Jika urutan no 1-4 searah jarum jam maka disebut konfigurasi R, sebaliknya jika berlawanan arah jarum jam disebut S. penamaan dengan R atau S dapat ditentukan dengan beberapa langkah : 1) tentukan prioritas tiap gugus 2) letakkan gugus yang prioritasnya paling kecil sedemikian rupa sehingga gugus ini akan berada di belakang. 3) Tentukan arah rotasi dari gugus yang paling tinggi prioritasnya ke gugus dengan prioritas tinggi berikutnya 1 2 3, bila searah jarum jam berarti konfigurasi R dan bila berlawanan adalah S. 2 3 H3C CHO H 1 OH konfigurasi S 2. Konfigurasi D dan L pada monosakarida Untuk memberikan tanda D atau L yang digunakan sebagai patokan adalah letak terikatnya gugus OH pada atom karbon kiral terbesar ( karbon kiral terjauh dari karbon 1). Suatu monosakarida anggota deret D jika hidroksil pada karbon kiral yang terjauh dari karbon 1 terletak di sebelah kanan dalam proyeksi Fischer. Bila hidroksil pada karbon kiral terjauh dari karbon 1 terletak pada sebelah kiri maka monosakarida tersebut merupakan anggota deret L. H O H O H O H O C C C C H C OH HO C H HO C H H C OH H C OH HO C H HO C H H C OH HO C H H C OH HO C H H C OH CH2OH CH2OH CH2OH CH2OH D-ribosa L-ribosa D-liksosa 179 L-liksosa Kimia Organik 3. Konfigurasi aldoheksosa Glukosa mempunyai enam atom karbon, empat diantaranya bersifat kiral (karbon 2, 3, 4, dan 5). Proyeksi Fischer dari semua D-aldosa dari D-gliseraldehida sampai dengan Daldoheksosa dipaparkan dalam gambar di bawah ini. Dimulai dari triosa, yaitu dgliseraldehida yang menghasilkan sepasang tetrosa. Tiap tetrosa menghasilkan sepasang pentosa, dan tiap pentosa menghasilkan sepasang heksosa. CHO H OH CH2OH D-gliseraldehida CHO CHO H OH HO H OH H D-eritrosa OH HO H OH H OH HO H OH H OH H H HO H OH H OH HO H OH H OH OH OH H OH HO H H H OH H OH H OH H D-alosa CH2OH D-altrosa H H H OH HO HO H H OH H D-glukosa CH2OH D-manosa CH2OH D-gulosa OH HO H CHO CHO CHO HO CH2OH H D-liksosa H OH H HO CH2OH OH H HO H OH CHO OH H H D-xilosa CHO CHO OH CH2OH CH2OH D-arabinosa H CH2OH C. H H CH2OH D-ribosa CHO CHO CHO CHO CHO OH CH2OH D-treosa CH2OH CHO H OH HO H OH HO H HO H H HO H HO H H OH CH2OH D-idosa H H OH CH2OH D-galaktosa H OH CH2OH D-talosa MONOSAKARIDA BENTUK SIKLIK Glukosa mempunyai suatu gugus aldehida pada karbon 1 dan gugus hidroksil pada karbon 4 dan 5 (seperti juga pada karbon 2,3 dan 6). Reaksi umum antara alcohol dan aldehida ialah pembentukan hemiasetal. Dalam larutan air glukosa dapat bereaksi intramolekul untuk menghasilkan hemiasetal siklik, baik hemiasetal cincin lima anggota atau hemiasetal cincin enam anggota. 180 Kimia Organik Monosakarida dalam bentuk hemiasetal cincin lima anggota disebut furanosa dari nama furan, senyawa heterosiklik oksigen lima anggota. Monosakarida bentuk hemiasetal cincin enam anggota disebut piranosa dari nama piran. Contoh penamaannya, Dglukopiranosa dari D-glukosa atau D-fruktofuranosa dari fruktosa. O furan O piran Pemaparan struktur siklik gula lebih baik dikembangkan rumus perspektif Haworth. Pada rumus Haworth gugus CH2OH ditempatkan di atas bidang cincin untuk deret-D, dan di bawah bidang cincin untuk deret –L. gugus yang berada di sebelah kanan pada proyeksi Fischer berada di sebelah bawah dalam proyeksi Haworth, gugus yang berada di sebelah kiri dalam proyeksi Fischer akan berada di sebelah atas dalam rumus Haworth. 1 6 CHO H HO H H 2 3 4 5 CH2OH OH 5 H 4 OH OH O 1 OH 2 3 OH OH OH 6 CH2OH Selain dalam bentuk rumus haworth, cincin pironosa dapat juga digambarkan dalam bentuk rumus konformasi : CH2OH HOH2C O OH OH OH HO HO O OH OH OH D-glukopiranosa Pada pembentukan piranosa, gugus hidroksil pada karbon 5 dari glukosa akan menyerang karbon aldehid (karbon-1) sehingga akan terbentuk gugus hemiasetal. Pada siklisasi ini akan terbentuk karbon kiral baru, yaitu karbon 1, sehingga akan dihasilkan dua diasttereomer. Diassteromer adalah monosakarida yang berbeda pada konfigurasi karbon 1 yang disebut anomer satu sama lain. –OH pada karbon 1 yang diproyeksikan ke bawah disebut α-anomer, sedang OH yang diproyeksikan ke atas disebut β-anomer. 181 Kimia Organik CH2OH O OH OH OH OH a-D-glukopiranosa D. OH CH2OH O OH OH OH b-D-glukopiranosa GLIKOSIDA Bila suatu hemiasetal diolah dengan alkohol maka akan dihasilkan suatu senyawa asetal. Asetal yang terbentuk dari reaksi suatu glukopiranosa akan menghasilkan senyawa glikosida. CH2OH O OH OH OH OH H + CH3OH -D-glukopiranosa + CH2OH O OCH3 OH OH OH + H2O metil--D-glukopiranosa suatu glikosida Glikosida dapat dihidrolisis menjadi bentuk hemiasetal bila direaksikan dengan asam dalam air. OH CH2OH O OCH3 OH + H2 O H+ OH metil--D-glukopiranosa suatu glikosida E. CH2OH O OH OH OH OH + CH3OH -D-glukopiranosa REAKSI MONOSAKARIDA 1. Oksidasi Monosakarida Gugus aldehida dapat dioksidasi menjadi gugus karboksil, Gula mempunyai gugus aldehid. Salah satu zat pengoksidasi yang dapat mengoksidasi gula adalah regensia Tollens, yaitu suatu larutan basa dari Ag(NH3)2+, gula yang mengalami oksidasi karena reagensia Tollens ini disebut sebagai gula pereduksi, karena gula dapat menyebabkan reduksi dari zat pengoksidasi tersebut. Reaksi ini ditandai dengan terbentuknya cincin perak yang merupakan endapan dari Ag. Zat pengoksidasi yang lain yang dapat bereaksi dengan gula adalah reagensia Benedicts (Cu+ dalam Natrium sitrat) dan reagensia Fehling (Cu+ dalam Natrium tartrat). 182 Kimia Organik Fruktosa tidak memiliki gugus aldehid tetapi fruktosa juga merupakan gula pereduksi karena dalam suasana basa fruktosa berada dalam keseimbangan dengan dua aldehid diastereomerik. CH2OH C O HO H H OH H OH CH2OH H O H O C C H OH HO H NaOH HO + HO H H H2O H OH H OH H OH H OH CH2OH CH2OH OH C OH H C HO H H OH H OH CH2OH NaOH H2O D-glukosa enediol D-fruktosa D-manosa Reagensi Tollens dapat mengoksidasi suatu aldosa menjadi asam aldonat, tetapi kondisi basa dapat menyebabkan dekomposisi dari karbohidrat. Sehingga untuk mendapatkan hasil asam aldonat yang lebih mudah dan murah dapat digunakan pereaksi larutan brom (Br2). Reaksi oksidasi dengan larutan brom spesifik untuk aldosa, ketosa tidak dapat bereaksi dengan Br2. H H HO H H C HO O OH H OH OH CH2OH Br2, H2O pH 6 H HO H H C O OH H OH OH CH2OH asam D-glukonat D-glukosa Bila oksidasi monosakarida menggunakan suatu zat pengoksidasi kuat seperti HNO3 maka gugus hidroksil ujung dan gugus aldehid pada monosakarida akan dioksidasi menjadi karboksilat. H H HO H H C HO O OH H OH OH CH2OH HNO3, H2O kalor C H HO H H HO O OH H OH OH C O asam D-glukarat D-glukosa 183 Kimia Organik 2. Reduksi monosakarida Reduksi aldosa atau ketosa dapat dilakukan dengan zat pereduksi seperti hidrogen dan katalis atau suatu hidrida logam. Hasil reduksi berupa polialkohol yang disebut alditol. Produk reduksi D-glukosa disebut D-glusitol atau sorbitol. H H HO H H C O OH H OH OH CH2OH H HO H H NaBH4 H 2O CH2OH OH H H OH CH2OH D-glusitol (sorbitol) D-glukosa LATIHAN 1. Tentukan klasifikasi monosakarida berikut ini berdasarkan gugus aldehid atau keton dan berdasarkan jumlah atom karbon penyusunnya : CHO CH2OH HO H C O H OH H OH H OH H OH H OH CH2OH CH2OH altrosa 2. ribulosa Tentukan konfigurasi D atau L dari : CHO A. H OH B. H OH C. H OH CHO D. H H HO H H OH HO H OH HO H H OH H H OH H HO CH2OH 3. CHO CHO OH CH2OH Gambarkan proyeksi Fischer untuk : A. L-treosa B. L-arabinosa C. L-altrosa 184 HO H CH2OH HO OH H OH H CH2OH Kimia Organik 4. 5. Gambarkan proyeksi hawort untuk α-D-manosa Tuliskan reaksi oksidasi brom dari D-xilosa Petunjuk mengerjakan latihan 1. Altrosa : mempunyai gugus aldehid dan tersusun dari 6 karbon maka termasuk klasifikasi aldoheksosa Ribulosa : mempunyai gugus keton dan tersusun atas 5 karbon maka termasuk klasifikasi pentulosa 2. Konfigurasi D jika OH pada karbon kiral yang terjauh dari karbon 1 terletak di sebelah kanan dalam proyeksi Fischer. Bila hidroksil pada karbon kiral terjauh dari karbon 1 terletak pada sebelah kiri merupakan anggota konfigurasi L. sehingga A dan B adalah konfigurasi D, C dan D konfigurasi L 3. Deret D dan L merupakan suatu enantiomer yang merupakan bayangan cermin satu sama lain. CHO CHO H OH CHO H OH HO H H OH HO H HO H HO H HO H HO H CH2OH CH2OH CH2OH L-treosa 4. L-arabinosa L-altrosa Berdasarkan aturan proyeksi Haworth : deret D berarti gugus CH2OH berada di atas bidang, gugus yang berada di sebelah kiri proyeksi Fischer berada di atas, gugus sebelah kanan berada di sebelah bawah dan posisi α berarti gugus OH pada karbon 1 berada disebelah bawah dalam proyeksi Haworth CH2OH O OH OH OH OH OH -D-manosa 5. Reaksi oksidasi dengan larutan brom spesifik untuk senyawa aldosa, oksidasi gugus aldehid dari gula akan menghasilkan gugus karboksilat. HO O H O C C H OH H OH Br2, H2O HO H HO H pH 6 H OH H OH CH2OH CH2OH 185 Kimia Organik RINGKASAN 1. 2. 3. 4. 5. 6. 7. 8. Karbohidrat merupakan suat polihidroksi dari aldehid dan keton atau turunannya. Berdasarkan ukuran molekulnya karbohidrat diklasifikasikan menjadi monosakarid, disakarida, dan polisakarida. Berdasarkan struktur yang terkandung dalam molekulnya dibedakan menjadi aldosa dan ketosa. Penggambaran konfigurasi monosakarida dapat dilakukan dengan proyeksi Fischer, rumus Haworth, dan rumus konformasi. proyeksi fischer menggambarkan bentuk tiga dimensi molekul ini menjadi bentuk dua dimensi dalam bidang datar. Pada proyeksi Fischer suatu monosakarida dikelompokkan dalam deret D atau L berdasarkan letak gugus OH pada karbon kiral terjauh dari karbon 1, Deret D bila OH terletak pada sebelah kanan dan L bila terletak di sebelah kiri, gugus CH 2OH ditempatkan di atas bidang cincin untuk deret-D, dan di bawah bidang cincin untuk deret –L. gugus yang berada di sebelah kanan pada proyeksi Fischer berada di sebelah bawah dalam proyeksi Haworth, gugus yang berada di sebelah kiri dalam proyeksi Fischer akan berada di sebelah atas dalam rumus Haworth. Monosakarida dapat mengalami reaksi oksidasi dan reduksi. Oksidasi dapat terjadi dengan reagensia Tollens, reagensia Benedicts, dan reagensia Fehlings. Keton juga dapat mengalami reaksi oksidasi dengan pereaksi logam tersebut. Oksidasi dengan larutan brom spesifik untuk aldosa akan menghasilkan asam aldonat. Oksidasi dengan HNO3 akan menyebabkan oksidasi gugus hidroksil dan aldehid dalam monosakarida menghasilkan asam aldarat. Reduksi aldosa dan ketosa akan menghasilkan senyawa polialkohol. TES 1 1. Manakah diantara pernyataan berikut ini yang sesuai I. Karbohidrat meruapakan senyawa hidrat arang II. karbohidrat merupakan suatu polihidroksi dari aldehid dan keton atau turunannya. III. Karbohidrat murni yang diperoleh pertama kali adalah glukosa IV. Proses fotosintesis tanaman akan menghasilkan senyawa karbohidrat A. I, II, dan III benar B. I, II, dan IV benar C. I dan III benar D. II, III, dan IV benar 2. Berikut ini yang merupakan kelompok disakarida adalah…. A. Sukrosa, laktosa, dan manosa B. Sukrosa, galaktosa, dan manosa 186 Kimia Organik C. D. 3. Sukrosa, laktosa, dan maltosa Sukrosa, laktosa, dan galaktosa Contoh dari senyawa pentulosa adalah …. A. CH2OH C O HO H H OH H OH CH2OH H B. C. H HO H C OH H OH CH2OH CH2OH C O H OH H OH CH2OH HO D. 4. O H HO H C O OH H OH CH2OH Proyeksi Fischer yang tepat untuk pasangan enantiomer D dan L berikut ini adalah …. A. CH2 OH C O HO H dan H OH H OH CH2 OH D-fruktosa H B. H H H C O OH OH OH CH2 OH D-ribosa CHO CH2 OH C O HO H H OH HO H CH2 OH L-fruktosa H dan HO HO HO C O H H H CH 2OH L-ribosa CHO 187 Kimia Organik 2 2 D-ribosa C. CHO H OH HO H HO H H OH CH 2OH D-galaktosa HO D. H HO H C L-ribosa dan O OH H OH CH 2OH D-xilosa CHO OH H H H CH2 OH L-galaktosa H HO HO HO HO dan HO HO H C O H H OH CH2 OH L-xilosa 5. Dalam larutan air glukosa dapat bereaksi intramolekul menghasilkan hemiasetal siklik. Monosakarida dalam bentuk hemiasetal cincin 6 anggota disebut …. A. Furanosa B. Piranosa C. Pirimidin D. Purin 6. Manakah yang bukan merupakan sifat fruktosa : A. suatu monosakarida B. suatu polihidroksi aldehida C. suatu heksulosa D. mereduksi fehling 7. Berikut ini pernyataan yang tidak tepat tentang disakarida …. A. disakarida terdiri atas 2 molekul monosakarida dengan ikatan glikosidik B. sukrosa adalah disakarida yang terbentuk dari glukosa dan fruktosa C. disebut juga ikatan 1,4’-α atau 1,2’-β D. ikatan glikosidik merupakan ikatan dari karbon ke suatu OH satuan yang lain 8. Proyeksi haworth yang sesuai untuk β-D-idosa adalah …. CHO HO H H OH HO H H OH CH2OH -D-idosa 188 Kimia Organik OH A. CH2OH O OH OH OH OH CH2OH O OH OH B. OH OH OH CH2OH O OH OH OH C. OH OH D. OH CH2OH O OH OH OH OH 9. Oksidasi glukosa dengan Br2 dalam air pada pH 6 akan menghasilkan senyawa …. A. Asam glukonat B. Asam glukarat C. Asam aldonat D. Sorbitol 10. Reagensia yang tidak dapat digunakan untuk mengoksidasi fruktosa adalah …. A. Pereaksi Fehling B. Pereaksi Tollens C. Pereaksi Benedicts D. Larutan brom 189 Kimia Organik Topik 2 Asam Amino dan Protein Protein dijumpai dalam organisme hidup, protein terdiri dari beraneka jenis dan fungsi biologi. keratin kulit dan kuku, aneka enzim dalam tubuh termasuk dalam golongan protein. Protein adalah poliamida, yang tersusun dalam rantai asam amino, hidrolisis protein menghasilkan asam-asam amino. A. STRUKTUR ASAM AMINO Asam-asam amino yang terdapat dalam protein adalah asam α-aminokarboksilat. Asam amino mengandung gugus amino (-NH2) dan karboksilat (-COOH). Struktur asam amino dapat digambarkan seperti di bawah ini dengan variasi dalam struktur monomer-monomer ini terjadi dalam rantai samping (R). CO2H H2N H R struktur umum asam amino Asam amino akan berikatan sehingga membentuk poliamida, ikatan yang terbentuk disebut dengan ikatan peptida. H R O R O H R O R O N C C N C C N C C N C C H H H H H H ikatan peptida Asam amino mengandung suatu gugus amino yang berada dalam bentuk kation amonium dan gugus karboksil yang berada dalam bentuk anion karboksilat. Sehingga asam amino mengandung gugus yang bersifat basa dan gugus bersifat asam dalam molekul yang sama. Suatu asam amino mengalami reaksi asam-basa internal yang menghasilkan suatu ion dipolar, yang juga disebut zwitterion. Karena strukturnya ini maka asam amino tidak selalu bersifat seperti senyawa-senyawa organik. Asam amino mempunyai titik leleh yang tinggi (di atas 200 0C), tidak larut dalam pelarut organik tetapi larut dalam pelarut polar. Asam amino berdasarkan fungsi biologisnya diklasifikasikan menjadi : 190 Kimia Organik 1. 2. asam amino esensial, yaitu asam amino yang hanya diperoleh dari makanan yang dikonsumsi karena asam amino jenis ini tidak dapat disintesis dalam tubuh. asam amino non esensial, yaitu asam amino yang diperoleh dari makanan juga dapat disintesis dalam tubuh sendiri. Dalam protein tumbuhan dan hewan, hanya terdapat duapuluh asam amino yang lazim dijumpai, ke-20 asam amino tersebut seperti tercantum dalam tabel 6.1 di bawah. Dari ke-20 asam amino tersebut sepuluh diantaranya merupakan asam amino esensial yaitu asam amino yang diperlukan untuk sintesis protein dan tidak disintesis sendiri oleh organisme itu tetapi harus terdapat dalam makanannya. Sepuluh asam amino esensial tersebut adalah arginina, histidina, isoleusina, leusina, lisina, metionina, fenilalanina, treonina, triptofan, dan valina. Tabel 6.1. Dua puluh asam amino Nama Singkatan Struktur Alanina Ala CH3CHCO2H NH2 Arginina Arg H2N CNHCH2CH2CH2CHCO2H NH NH2 Asparagina Asn O NH2CCH2CHCO2H NH2 asam aspartat Asp HO2CCH2CHCO2H NH2 Sisteina (cysteine) Cys HSCH2CHCO2H NH2 asam glutamat Glu HO2CCH2CH2CHCO2H NH2 Glutamin Gln O H2NCCH2CH2CHCO2H NH2 Glisina Gly CH2CO2H NH2 Histidina His N N H 191 CH2CHCO2H NH2 Kimia Organik Nama Isoleusina Singkatan Struktur CH3 Ile CH3CH2CHCHCO2H NH2 Leusina (CH3)2CHCH2CHCO2H Leu NH2 Lisina Lys NH2CH2CH2CH2CH2CHCO2H NH2 Metionina Met CH3SCH2CH2CHCO2H NH2 Fenilalanina Phe CH2CHCO2H NH2 Prolina Pro Serina Ser Treonina Thr Triptofan Try CO2H N H HOCH2CHCO2H NH2 OH CH3CHCHCH2O2H NH2 CH2CHCO2H NH2 N H Tirosina (tyrosine) Tyr Valina Val HO CH2CHCO2H NH2 (CH3)2CHCHCO2H NH2 Asam amino yang mengandung rantai samping karboksil dikelompokkan dalam asam amino asam, sedangkan asam amino yang mengandung rantai samping amino dikelompokkan sebagai asam amino basa, sisa dari kedua kelompok ini disebut sebagai asam amino netral. Asam amino asam adalah asam glutamat dan asam aspartat, asam amino basa adalah lisina, histidina, dan arginina, sedangkan sisanya adalah asam amino netral. 192 Kimia Organik B. SINTESIS ASAM AMINO Asam amino dapat disintesis di laboratorium dengan berbagai cara, salah satunya adalah reaksi brominasi asam karboksilat dengan menggunakan Br2 dan PBr3 kemudian dilanjutkan dengan reaksi dengan NH3. CH3 O CH3CHCH2CH2COH Br2, PBr3 H2O asam 4-metilpentanoat OH O CH3CHCH2COH Br2, PBr3 H2O asam 3-hidroksibutanoat C. CH3 O NH3 CH3CHCH2CHCOH Br asam 2-bromo-4-metilpentanoat CH3 O CH3CHCH2CHCOH NH2 leusina OH O OH O NH3 CH3CHCHCOH CH3CHCHCOH NH2 Br asam 2-bromo-3-hidroksibutanoat treonina REAKSI ASAM AMINO a. Keamfoteran Asam Amino Suatu asam amino dapat bereaksi dengan asam ataupun dengan basa, masing-masing akan menghasilkan suatu kation atau suatu anion. Dalam larutan asam, asam amino akan bersifat basa yang akan menerima proton sehingga akan menghasilkan kation. Dalam larutan basa, asam amino akan bersifat asam yang akan memberikan proton sehingga akan menghasilkan suatu anion. dalam larutan asam : CO2+H3N H CO2H + H+ +H3N R H R dalam larutan basa CO2+H3N H CO2+ OH- H2 N R H R 193 Kimia Organik b. Asilasi Asilasi gugus amino dengan suatu halida asam atau anhidrida asam akan menghasilkan amida. O O O O + + CH + CH3COCHCH3 3COH NH3CHCO2 H3C C NHCHCO2H CH3 CH3 alanina anhidrida asam asetat asam asetat N-asetilalanina Tetapi sifat dari amida ini akan berbeda dibandingkan dengan senyawa asam amino karena Nitrogen pada amida tidak bersifat basa, sehingga senyawa amino yang terasilasi membentuk amida ini berbeda sifatnya dibandingkan asam amino. c. Reaksi dengan ninhidrina Reaksi dengan ninhidrin digunakan sebagai uji bercak senyawa asam amino pada pada kertas kromatiografi. Asam-asam amino bereaksi dengan ninhidrin untuk membentuk produk yang disebut ungu Ruherman. O OH OH O ninhidrin D. O- O + CO2H H2NCH R O N O + RCH + CO2 + H2O O ungu ruhermann (biru-ungu) PEPTIDA Peptida dan protein adalah polimer yang terbentuk dari satuan asam amino melalui ikatan peptida antara suatu gugus α-amino dari satu asam amino dan gugus karboksil dari asam amino lain. Ikatan peptida ini akan membentuk gugus amida. Asam amino pembentuk peptida disebut sebagai residu. Contoh peptida yang dibentuk dari glisina dan serina disebut glisilserina. Untuk dipeptida ada dua kemungkinan penggabungan seperti dibawah ini. Tripeptida dapat membentuk kombinasi gabungan asam amino dengan enam cara. Jadi semakin banyak residu asam amino penyusun peptida maka semakin banyak kemungkinan kombinasi gabungan asam amino tersebut. Penamaan peptida dimulai dari nama asam amino dari kiri ke kanan. O NH2CH2C NHCHC OH CH2OH O O O NH2CHC NHCH2C OH CH2OH serilglisina (ser-gly) glisilserina (gly-ser) Peptida yang tersusun dari dua residu asam amino disebut dipeptida, tiga residu asam amino disebut tripeptida, dan polipeptida adalah peptida yang tersusun atas banyak residu 194 Kimia Organik asam amino. Apa yang membedakan peptida (polipeptida) dengan protein protein ? Polipeptida dan protein adalah poliamida, keduanya sama. Hanya saja untuk poliamida dengan residu asam amino kurang dari 50 dikenal sebagai peptida, sedangkan yang lebih dari 50 disebut sebagai protein. Beberapa contoh peptida yang mempunyai aktifitas aktifitas fisiologis dalam tubuh adalah oksitosin dan enkefalin. Oksitosin adalah suatu hormon yang berasal dari kelenjar di bawah otak (pituitary hormone) yang membantu proses persalinan yang bekerja dengan cara menyebabkan kontraksi uterin. Struktur oksitosin zat yang dihasilkan oleh tubuh yang mempunyai efek Enkefalin adalah zat-zat menghilangkan nyeri.enkefalin ini adalah peptida-peptida peptida peptida otak yang mengandung hanya lima residu asam amino. Contoh dua enkefalin adalah tyr-gly-gly-phe-met tyr met dan tyr tyr-gly-glyphe-leu. Leu-enk aphalin.png tyr-gly-gly-phe-leu E. PROTEIN Protein adalah suatu polipeptida yang tersusun dari banyak asam amino. Protein merupakan molekul yg sangat vital untuk organisme yang terdapt di semua sel. Rantai asam amino dihubungkan dengan kovalen yg spesifik. Struktur dan fungsi protein ditentukan oleh kombinasi, jumlah, dan urutan asam amino. Sifat fisika dan kimiawi kimiawi asam amino dipengaruhi asam amino penyusunnya. Protein dalam tubuh dikelompokkan berdasarkan oleh asam-asam tugas dan fungsi dari protein tersebut. Kelompok protein tersebut adalah protein serat, protein globular, dan protein konjugasi. but juga protein struktural yang bertugas membentuk kulit, otot, Protein serat disebut pembuluh darah, dan rambut. Protein-protein Protein protein pembentuk tersebut diantaranya adalah 195 Kimia Organik kolagen yang bertugas membentuk jaringan penyambung, elastin yang membentuk urat dan pembuluh darah, dan keratin yang membentuk rambut dan kuku. Protein globular adalah protein larut, yang termasuk dalam kelompok protein ini adalah albumin yang terdapat telur dan serum, globulin terdapat dalam serum, histon terdapat dalam jaringan kelenjar dan bersama dengan asam nukleat, rotamina yang berhubungan dengan asam nukleat. Contoh dari protein globular adalah hemoglobin (bagian dari eritrosit) yang bertanggung jawab atas pengangkutan oksigen dalam aliran darah. Satu satuan hemoglobin mempunyai bobot molekul sekitar 65.000, mengandung empat molekul protein yang disebut globin. Keracunan karbon monoksida terjadi bila molekul CO menggantikan tempat molekul O2 dalam hemoglobin. Molekul CO terikat erat oleh besi dan dilepaskan tidak semudah molekul oksigen. Protein konjugasi adalah protein yang berhubungan dengan suatu bagian nonprotein misalnya gula yang mempunyai pelbagai fungsi dalam seluruh tubuh. Contoh yang termasuk dalam kelompok ini adalah nukleoprotein yang bersenyawa dengan asam nukleat, mukoprotein dan glikoprotein yang berhubungan dengan karbohidrat, lipoprotein berhubungan dengan lipida, fosfogliserida atau kolesterol. Struktur protein dibedakan menjadi struktur primer, sekunder, tersier, dan kuartener Struktur primer adalah rentetan asam amino dalam suatu molekul protein. Bentuk kerangka atau tulang belakang dari suatu protein disebut sebagai struktur sekunder yang merupakan pola lipatan berulang dari rangka protein. Dua pola terbanyak adalah alpha helix dan beta sheet. D escription: http://images.tutorv ista.com/cms/images/81/protein-secondary -stru ct u re . j p e g D escription: http://sw h.schoolw orkhelper.netdna-cdn.com/w p-content/uploads/2010/11/P ept i d e . g i f ?e 6 e ce a Fluvastatin Struktur primer protein Struktur sekunder protein Antaraksi lebih lanjut dari struktur sekunder yang membentuk bulatan disebut struktur tersier, dan antaraksi sub-unit protein tertentu yang membentuk protein besar seperti globin dalam hemoglobin disebut struktur kuartener. 196 Kimia Organik D escription: M y oglobin.png D escription: http://hemoglobina.net/files/img/hemoglobin a . j p g Struktur tersier protein Struktur kuartener protein Denaturasi Protein Protein dapat mengalami denaturasi yang mengakibatkan hilangnya sifat biologis dari protein. Denaturasi adalah rusaknya ikatan hidrogen dan gaya sekunder lain dalam protein sehingga menyebabkan hilangnya sifat-sifat struktur yang lebih tinggi. Faktor-faktor yang menyebabkan denaturasi antara lain : 1. perubahan temperatur, seperti memasak putih telur akan mengakibatkan albumin itu membuka lipatan dan mengendap; dihasilkan suatu zat padat putih. 2. perubahan pH, bila susu menjadi asam perubahan pH yang disebabkan oleh pembentukan asam laktat akan menyebabkan penggumpalan susu (curdling), atau pengendapan protein yang semula larut. 3. Detergen 4. radiasi 5. zat pengoksidasi atau pereduksi Denaturasi dapat reversibel bila kondisi denaturasi yang lembut seperti sedikit perubahan pH. Jika protein ini dikembalikan ke lingkungan alamnya, protein ini dapat memperoleh kembali struktur lebih tingginya yang alamiah dalam suatu proses yang disebut renaturasi. Tetapi umumnya renaturasi ini sangat lambat dan tidak terjadi sama sekali. F. ENZIM Enzim, suatu protein besar, adalah suatu senyawa yang bertindak sebagai katalis dalam reaksi biologi. Enzim merupakan katalis yang lebih efisien daripada kebanyakan katalis laboratorium atau industri. Enzim bekerja menurunkan energi aktivasi reaksi sehingga akan mempercepat terjadinya reaksi. Enzim bekerja secara spesifik. Satu jenis enzim hanya akan bekerja pada substrat tertentu saja. Contohnya enzim amilase yang ditemukan dalam saluran cerna manusia hanya bekerja pada pati yang akan menghasilkan glucosa, amilase tidak bekerja pada selulosa atau karbohidrat jenis lain. Tetapi terdapat enzim yang bekerja 197 Kimia Organik dalam substrat yang lebih luas, misalnya papain, suatu protein globular yang diisolasi dari buah pepaya dapat bekerja dengan cara menghidrolisis banyak ikatan peptida sehingga papain dapat digunakan untuk melunakkan daging. Penamaan suatu enzim umumnya memakai akhiran –ase. Misalnya suatu polimerase adalah enzyme yang mengkatalisis suatu reaksi polimerisasi. Enzim diklasifikasikan dalam 6 kategori berdasarkan jenis reaksi yang dikatalisasinya. Keenam kelompok enzim tersebut adalah : 1. Oksidoreduktase adalah enzim yang pada reaksi oksidasi-reduksi. Yang termasuk dalam kelompok enzim ini adalah dehidrogenase yang bekerja pada ikatan rangkap, oksidase, dan reduktase. 2. Transferase adalah enzim yang bekerja pada proses perpindahan suatu gugus pada satu substrat ke yang lainnya. Contoh enzim golongan ini adalah kinase yang bekerja pada gugus fosfat dan transaminase yang bekerja pada gugus amino. 3. Hidrolase adalah enzim yang bekerja pada reaksi hidrolisis amida, ester, dan substrat sejenis. Contohnya adalah protease yang menghidrolisis amida, lipase yang menghidrolisis ester, dan nuklease menghidrolisis phospat. 4. Liase adalah enzim yang bekerja pada reaksi eliminasi dan adisi molekul kecil seperti H2O dari dan terhadap substrat. Contohnya dalah dekarboksilase yang menyebabkan eliminasi CO2 dan dehidrasi yang mengeliminasi H2O. 5. Isomerase adalah enzim yang bekerja mengkatalis reaksi isomerisasi. Contohnya adalah epimerase yang mengkatalis reaksi pada pusat kiral. 6. Ligase adalah enzim yang mengkatalis ikatan antar dua molekul dan bersamaan dengan hidrolisis ATP. Contohnya adalah karboksilase yang bekerja pada adisi CO2 dan sintetase yang bekerja pada pembentukan senyawa baru. Untuk aktivitas biologis, beberapa enzim memerlukan gugus-gugus prostetik atau kofaktor. Kofaktor merupakan bagian nonprotein dari enzim tersebut yang dapat berupa gugus anorganik seperti Zn2+. Gugus prostetik organik disebut sebagai koenzim. Jika suatu organisme tidak dapat mensintesis suatu kofaktor yang diperlukan, maka kofaktor itu harus terdapat dalam makanan dalam jumlah kecil. Satuan-satuan aktif dari banyak kofaktor adalah vitamin. Enzim bekerja dengan cara menyesuaikan diri dengan di sekitar substrat (molekul yang akan dikerjakan) untuk membentuk kompleks enzim-substrat. Ikatan-ikatan substrat dapat menjadi tegang oleh gaya tarik antara substrat dan enzim. Ikatan tegang memiliki energi tinggi dan lebih mudah terpatahkan ; oleh karena itu, reaksi yang diinginkan berlangsung lebih mudah dan menghasilkan suatu kompleks enzime-produk. E + Enzim S E–S substrat kompleks enzim-substrat E–P E kompleks enzim enzim-produk 198 + P protein Kimia Organik LATIHAN 1. Kelompokkan asam amino dibawah ini sebaga asam amino asam, basa, atau netral. CH2CO2H NH2 (A) HSCH2CHCO2H NH2 (D) 2. 3. 4. 5. N H CO2H H2N CNHCH2CH2CH2CHCO2H NH (B) (C) NH2 O HO2CCH2CHCO2H H2NCCH2CH2CHCO2H NH2 NH2 (E) (F) Bagaimana pembuatan asam amino isoleusina dari asam karboksilat ? gambarkan ikatan peptida yang terbentuk antara alanin dan serina Tuliskan contoh reaksi asilasi antara anhidrida asam asetat dengan valina ! Tuliskan kombinasi gabungan tiga asam amino glisina, alanina dan fenilalanina dan gambarkan salah satu tripeptida yang terbentuk dalam rumus strukturnya. Petunjuk mengerjakan latihan 1. Asam amino asam bila rantai samping mengandung karboksilat, asam amino basa bila rantai samping mengandung amino, dan asam amino netral rantai samping tidak mengandung karboksil atau amino. Sehingga A, B, D dan F adalah asam amino netral, C asam amino basa, dan D asam amino asam. 2. Pembuatan asam amino dari asam karboksilat dapat dilakukan dengan menggunakan Br2, PBr3, dan NH3. Pada isoleusina asam karboksilat yang dapat digunakan adalah asam 3-metilpentanoat. Setelah direaksikan dengan Br2 dan PBr3 dalam air akan diperoleh asam 2-bromo-3-metilpentanoat, selanjutnya direaksikan dengan NH 3 sehingga akan dihasilkan senyawa asam α-amino yaitu isoleusina. 3. Alanina dan serina akan membentuk ikatan peptida yang terbentuk antara karbonil dari alanina dengan amino dari serina. O O H2NHCC NHCHC OH H3C CH2OH 4. Reaksi asilasi adalah reaksi antara asam amino dengan halida asam atau anhidrida asam asetat dengan asam amino. Reaksi ini akan membentuk senyawa amida. Reaksi valina dengan anhidrida asam asetat akan menghasilkan N-asetilvalina dan asam asetat (lihat kembali ke bagian reaksi asam amino). 5. Tripeptida yang terbentuk antara glisina (gly), alanina (ala) dan fenilalanina (phe) dapat menghasilkan enam bentuk tripeptida yaitu : 199 Kimia Organik O O O NH2CHC NHCHC NHCH2C OH CH2 CH3 phe - ala - gly RINGKASAN 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. Asam amino adalah asam α-aminokarboksilat. Struktur asam amino mengandung gugus karboksil, amino, hidrogen, dan alkil (R). Variasi asam amino tergantung dari jenis gugus R nya. Asam amino akan berikatan sehingga membentuk poliamida, ikatan yang terbentuk disebut dengan ikatan peptida. asam amino mengandung gugus yang bersifat basa yaitu amino dan gugus bersifat asam yaitu karboksil dalam molekul yang sama. Asam amino mempunyai titik leleh yang tinggi (di atas 200 0C), tidak larut dalam pelarut organik tetapi larut dalam pelarut polar. Asam amino diklasifikasikan menurut fungsi biologisnya menjadi asam amino esensial dan asam amino nonesensial. Terdapat 10 asam amino esensial di antara 20 asam amino di alam. Asam amino esensial adalah asam amino yang terdapat dalam makanan yang tidak dapat disintesis dalam tubuh. Asam amino yang mengandung rantai samping karboksil adalah asam amino asam, sedangkan asam amino yang mengandung rantai samping amino adalah asam amino basa, sisa dari kedua kelompok ini disebut sebagai asam amino netral. Salah satu cara sintesis asam amino adalah reaksi brominasi asam karboksilat dengan menggunakan Br2 dan PBr3 kemudian dilanjutkan dengan reaksi dengan NH 3. Asam amino bersifat amfoter karena suatu asam amino dapat bereaksi dengan asam ataupun dengan basa, masing-masing akan menghasilkan suatu kation atau suatu anion. Asam amino dapat mengalami reaksi asilasi dan reaksi dengan ninhidrin. Peptida adalah penggabungan asam amino dengan ikatan peptida. Protein adalah suatu polipeptida yang tersusun dari banyak asam amino. Jenis protein adalah protein struktural, protein globular, dan protein konjugasi. Protein dapat mengalami kerusakan sehingga sifat fisik dan aktivitas biologinya dapat berubah yang disebut denaturasi protein. Enzim adalah senyawa yang bertindak sebagai katalis dalam reaksi biologi.kelompok enzim adalah oksidoreduktase, Transferase, hidrolase, liase, isomerase, dan ligase. 200 Kimia Organik TES 2 1. Sifat asam amino dipengaruhi oleh gugus …. A. Amino dan karbonil B. Amino dan karboksil C. Amino dan alkil D. Amino dan hidroksil 2. Manakah yang termasuk dalam kelompok asam amino esensial ? A. Alanina, arginina, asparagina B. Glutamina, glisina, leusina C. Histidina, leusina, lisina D. Asam glutamat, serina, prolina 3. Manakah diantara asam amino dibawah ini yang bila dilarutkan dalam air akan bersifat asam ? A. Asam glutamat B. Glutamin C. Leusina D. Lisina 4. Manakah diantara asam amino dibawah ini yang bila dilarutkan dalam air akan bersifat asam ? A. Asam glutamat B. Glutamin C. Leusina D. Lisina 5. Yang termasuk peptida adalah… A. Oksitosin B. Globulin C. Albumin D. Kolagen E. Prostaglandin 6. Peristiwa berikut bisa menyebabkan denaturasi protein, kecuali…. A. Putih telur yang dimasak sampai menjadi zat padat B. Penambahan zat pengoksidasi C. Radiasi D. Susu yang disimpan dalam kondisi dingin E. Penambahan asam kuat 201 Kimia Organik 7. Reaksi asilasi antara asetoil klorida dengan isoleusina akan menghasilkan senyawa dengan gugus …. A. Amida B. Amina C. Amino D. Asam karboksilat 8. Kelompok protein struktural yang bertugas membentuk kuku dan rambut adalah…. A. Albumin B. Elastin C. Keratin D. Kolagen 9. Enzim yang betugas untuk menghidrolisis gugus amida adalah …. A. Amilase B. Oksidase C. Lipase D. Protease 10. Ikatan peptida terbentuk antara dua asam amino melalui ikatan antara gugus…. A. Karboksil dengan amino B. Alkil dengan amino C. Alkil dengan karboksil D. Amino dengan karbonil 202 Kimia Organik Topik 3 Lipida Lipida adalah senyawa penyusun jaringan tumbuhan dan hewan yang mempunyai struktur beragam. Contoh kelompok senyawa lipida adalah lemak, minya, lilin, beberapa vitamin dan hormon, dan komponen penyusun membran sel nonprotein. lipida dikelompokkan berdasarkan sifat fisisnya. Sifat fisis dari lipida tersebut adalah : 1. Tidak larut dalam air, tetapi larut dalam pelarut organik seperti dietil eter, benzena, dan kloroform. 2. Bila dihidrolisis akan menghasilkan asam karboksilat yang dikenal dengan asam lemak 3. Mempunyai fungsi dalam sistem metabolisme organisme 4. Lipida bukan merupakan polimer yang mempunyai satuan berulang. 1. 2. 3. Lipida digolongkan kedalam tiga kelompok yaitu : Lipida sederhana adalah ester dari asam lemak dengan alkohol, contohnya lemak dan lilin (waxes) Lipida kompleks adalah ester asam lemak yang mempunyai gugus tambahan, contohnya fosfolipida Turunan lipida adalah senyawa yang dihasilkan dari hidrolisis lipida misalnya asam lemak, gliserol, dan sterol. CH2O2C(CH2)16CH3 CHO2C(CH2)16CH3 H H CH2O2C(CH2)16CH3 H tristearin (gliseril tristearat) HO kolesterol A. LILIN, LEMAK, DAN MINYAK Lilin adalah campuran ester asam karboksilat rantai panjang dengan alkohol rantai panjang. Rantai karboksilatnya umumnya memiliki jumlah karbon 16 sampai dengan 36, dan alkohol dengan rantai karbon 24 sampai dengan 36. Lemak dan minyak adalah kelompok trigliserida atau triasilgliserol, strukturnya saling berhubungan satu sama lain, tetapi terdapat perbedaan sifat fisik diantara keduanya. Trigliserida atau triasilgliserol adalah ester dari gliserol dengan tiga asam lemak. Lemak berbentuk padat dan minyak berbentuk cair dalam suhu kamar. Lemak banyak terdapat dalam hewan, sedangkan minyak dalam tumbuhan, sehingga dikenal dengan nama lemak 203 Kimia Organik hewani dan minyak nabati. Lemak terdapat dalam jaringan adiposa dibawah kulit pada hewan, dan minyak nabati terdapat dalam kacang-kacangan, biji-bijian, buah-buahan, dan sayuran. Lemak disebut sebagai trigliserida karena dalam strukturnya terdiri dari satu molekul gliserol dan tiga molekul asam lemak, disebut juga dengan triasilgliserol. Asam lemak ini umumnya merupakan rantai hidrokarbon panjang dan tidak bercabang. Jika ketiga asam lemak penyusunnya sama disebut sebagai trigliserida sederhana sedangkan jika asam lemaknya berbeda disebut sebagai trigliserida campuran. Hidrolisis suatu lemak atau minyak akan menghasilkan asam lemak dan gliserol. O CH2O C R1 R1COOH CH2OH + O H + 3 H 2O + R2COOH CH O C R2 CHOH O R3COOH CH2O C R3 CH2OH gliserol trigliserida asam lemak Penamaan untuk trigliserida, diawali dengan nama gliseril dan diikuti dengan nama asam lemaknya. Untuk asam lemak campuran maka penamaannya dimulai dari asam lemak pertama, kedua, dan ketiga. 1. Klasifikasi Asam Lemak Asam lemak penyusun trigliserida dapat dibedakan berdasarkan ikatan dalam rantai hidorkarbonnya, yaitu : 1. asam lemak jenuh apabila ikatan dalam rantai karbonnya berupa ikatan tunggal 2. asam lemak tidak jenuh apabila ikatannya dalam rantai karbon berupa mengandung ikatan rangkap. 204 Kimia Organik Tabel 6.2 kelompok asam lemak Nama Asam lemak Rumus molekul Struktur Jenuh: Asam butirat CH3(CH2)2CO2H C3H7COOH Asam palmitat CH3(CH2)14CO2H C15H31COOH Asam stearat CH3(CH2)16CO2H C17H35COOH Asam palmitoleat CH3(CH2)5CH=CH(CH2)7CO2H C15H29COOH Asam oleat CH3(CH2)7CH=CH(CH2)7CO2H C17H33COOH Asam linoleat CH3(CH2)4CH=CHCH2CH=CH(CH2)7CO2H C17H31COOH Asam linolenat CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7CO2H C17H29COOH Tidak Jenuh : 2. 1. 2. 3. 4. 5. 6. Sifat-Sifat Asam Lemak Sifat-sifat lemak dapat diketahui sebagai berikut : Lemak hewani pada suhu ruangan berupa zat padat, sedang minyak nabati berupa cairan. Lemak dengan asam lemak jenuh mempunyai titik lebur tinggi, sedangkan minyak yang mengandung asam lemak tidak jenuh titik leburnya lebih rendah. lemak dengan asam lemak rantai pendek dapat larut dalam air, sedangkan lemak dengan asam lemak rantai panjang tidak larut dalam air. lemak dapat larut dalam pelarut organik seperti benzena, kloroform, dan alkohol panas. Di udara lemak akan mengalami hidrolisis dengan melepaskan asam lemak bebas sehingga timbul bau yang tidak enak. Oksidasi lemak akan menghasilkan warna dan rasa tidak enak (tengik). 3. Reaksi Kimia Lemak dan Minyak Lemak dan minyak dapat mengalami reaksi kimia, diantaranya adalah reaksi hidrolisis, penyabunan, hidrogenasi, dan oksidasi. 1. Reaksi hidrolisis Reaksi hidrolisis akan memecah lemak dan minyak menjadi asam lemak dan gliserol. CH2O2C(CH2)16CH3 CHO2C(CH2)16CH3 CH2OH + 3 H 2O H+ CH2O2C(CH2)16CH3 CHOH + 3 CH3(CH2)16CO2H CH2OH gliserol tristearin (gliseriltristearat) 205 Asam stearat Kimia Organik 2. Reaksi penyabunan Reaksi antara lemak dengan basa akan menghasilkan sabun dan gliserol. reaksi ini disebut juga dengan reaksi saponifikasi CH2O2C(CH2)16CH3 CHO2C(CH2)16CH3 CH2OH + 3NaOH H2O CH2O2C(CH2)16CH3 CHOH + 3 CH3(CH2)16CO2- Na+ CH2OH gliserol tristearin (gliseriltristearat) narium stearat 3. Reaksi hidrogenasi Hidrogenasi adalah proses untuk mengubah minyak nabati cari menjadi padatan, proses ini dilakukan dalam proses pembuatan margarin. Proses ini juga bertujuan untuk menstabilkan minyak dari pengaruh reaksi oksidasi. 4. Reaksi oksidasi Oksidasi lemak dan minyak dapat terjadi apabila terjadi kontak dengan oksigen. Pada proses oksidasi ini akan menimbulkan bau dan rasa tidak enak (tengik). B. SABUN DAN DETERJEN Sabun adalah garam alkali dari asam-asam lemak. Sabun dapat diperoleh melalui reaksi saponifikasi antara lemak atau minyak dengan larutan alkali. Larutan alkali yang biasa digunakan adalah Natrium hidroksida (NaOH) dan Kalium hidroksida (KOH). O CH2OCR O CH2OH O + + NaOH CHOH 3 RCO Na CHOCR H2 O CH2OH O CH2OCR trigliserida gliserol sabun Molekul sabun mengandung suatu rantai hidrokarbon panjang dengan ujung ion. Rantai hidrokarbon merupakan bagian yang bersifat hidrofobik yang akan berinteraksi dengan zat-zat nonpolar. Ujung ion akan bersifat hidrofilik dan akan larut dalam air. sabun akan mengemulsikan kotoran berminyak sehingga memudahkan untuk dibilas dan terpisah. Kerja sabun dengan cara bagian hidrofobik sabun (rantai hidrokarbon) akan berinteraksi dengan tetesan minyak, ujung ion sabun akan tertarik ke air, sehingga akan terjadi 206 Kimia Organik pemisahan molekul minyak dengan air. kelemahan dari sabun adalah sabun akan mengendap dalam air sadah yaitu air yang mengandung Ca2+, Mg2+, Fe3+, dan lain-lain. Sabun termasuk dalam golongan surfaktan yaitu senyawa yang dapat menurunkan tegangan permukaan air. surfaktan adalah senyawa yang mengandung ujung hidrofobik dan hidorfilik. Agar efektif kerja surfaktan maka ujung hidrokarbon surfaktan harus mengandung 12 atom karbon atau lebih. Surfaktan dibedakan dalam tiga kelompok yaitu surfaktan anionik, kationik, dan netral. Sabun termasuk dalam kelompok surfaktak anionik. Surfaktan kationik adalah surfaktan yang mengandung gugus kation seperti amonium contohnya adalah benzalkonium klorida atau N-benzil amonium kuartener klorida. Surfaktan netral adalah surfaktan yang mengandung gugus non ion seperti karbohidrat yang dapat berikatan dengan air. Deterjen adalah kelompok surfaktan anionik seperti halnya sabun, tetapi deterjen dibuat secara sintetis. Contoh deterjen adalah garam dari sulfonat atau sulfat rantai panjang dari natrium. Deterjen sintetik ini bekerja seperti halnya sabun, tetapi kelebihannya deterjen sintetik tidak meninggalkan endapan pada air sadah. O O S O R deterjen sintetik C. FOSFOLIPID Lilin, lemak, dan minyak adalah lipid yang mengandung gugus asam karboksilat, sedangkan fosfolipid adalah lipid adalah lipida yang mengandung gugus ester fosfat. Fosfolipid ditemukan dalam jaringan tanaman dan hewan yang menyusun 50 – 60 % membran sel. Fosfolipid dibedakan dalam dua kelompok besar yaitu gliserofosfolipid atau fosfoglisrida dan sfingomielin. Gliserofosfolipida adalah senyawa fosfolipida yang mengandung ester asam lemak pada dua gliserol dan satu ester fosfat pada posisi ketiga gliserol. asam lemak gliserofoslipida pada C1 biasanya berupa asam lemak jenuh dan pada C2 asam lemak tidak jenuh, sedangkan C3 mengandung gugus fosfat dengan yang terikat pada amino alkohol seperti kolin [HOCH2CH2N(CH3)3]_ contohnya adalah lesitin , etanolamin (HOCH2CH2NH2) contohnya sefalin, atau serin [HOCH2CH(NH2)CO2H]. C2 pada gliserofosfolipida merupakan karbon kiral dengan konfigurasi L atau R. lesitin dan sefalin adalah gliserofosfolipida yang banyak ditemukan dalam otak, sel syaraf dan hati hewan, ditemukan juga dalam telur, kecambah, gandum, kedelai dan makanan lainnya. 207 Kimia Organik O CH2OCR O CHCOR OCH2OPOCH2CH2NH3+ O fosfatidiletanolamin(suatu sefalin) O CH2OCR O CHCOR OCH2OPOCH2CH2NH+(CH3)3 O fosfatidilkolin (suatu lesitin) O CH2OCR O CHCOR OCH2OPOCH2CHNH3+ CO2O fosfatidilserin Kelompok kedua fosfolipida adalah sfingomielin, suatu ester fosfat bukan gliserol dengan alkohol alilik berantai panjang dengan suatu rantai samping amida. Sfingomelin banyak ditemukan dalam jaringan otak dan syaraf. sfingomielin D. PROSTAGLANDIN Prostaglandin adalah lipida dengan karbon 20 yang mengandung cincin siklopentana dengan dua rantai samping panjang. Senyawa ini disebut prostaglandin karena pada awalnya diisolasi oleh Sune Bergstrom dan Bengt Samuelsson dari kelenjar prostat dan banyak ditemukan dalam mani (semen). Tetapi ternyata senyawa ini banyak ditemukan dalam jumlah kecil di seluruh tubuh dan juga disintesis dalam paru-paru, hati, uterus, dan organ serta jaringan lain. Beberapa dosis dari prostaglandin dapat memberikan efek biologi seperti merangsang kontraksi uterin selama proses persalinan. Ketidakseimbangan prostaglandin dalam tubuh dapat menyebabkan gangguan saluran cerna seeperti mual dan diare, peradangan, nyeri, demam, kekacauan siklus menstruasi, asma, tukak lambung, tekanan 208 Kimia Organik darah tinggi dan penggumpalan darah. Kerja prostaglandin dapat dihambat oleh aspirin (asam asetil salisilat) atau anti radang kortison, aspirin akan mendeaktivasi enzim siklooksigenase yang berperan dalam sintesis prostaglandin. Prostaglandin dapat disintesis dari asam arakhidonat : O CO2H OH H H OH PGE2 CO2H HO asam arakhidonat CO2H OH H H OH PGF2 PG berarti prostaglandin, E berarti alkohol keto, F berarti diol, angka 2 merujuk pada jumlah ikatan rangkap dan α berarti konfigurasi OH pada karbon 9. E. TERPENA Terpena adalah senyawa alam dengan komponen penyusun karbon dan hidrogen dengan perbandingan 5 : 8. Terpena mengandung gabungan senyawa isoprena dari kepala ke ekor, posisi kepala adalah posisi yang paling dekat dengan ujung metil. ekor kepala CH3 CH2 H3CC CHCH2 CH2CCH CH2 atau terpena Struktur seperti terpena yang mengandung unsur selain C dan H disebut dengan terpenoid. CH2OH terpenoid 209 Kimia Organik Terpena atau terpenoid dikelompokkan berdasarkan jumlah karbon penyusunnya : Monoterpena merupakan penggabungan dua isoprena (C10), seskuiterpena penggabungan dari tiga satuan isprena (C15), diterpena penggabungan empat satuan isoprena (C20), triterpena merupakan penggabungan enam satuan isoprena (C30), dan tetraterpena penggabungan delapan satuan isoprena (C40). kamfor suatu monoterpenoid lanosterol suatu triterpenoid Golongan senyawa terpena ini banyak ditemukan dalam tanaman, seperti dalam minyak atsiri yang merupakan komponen minyak mudah menguap yang diisolasi dari tanaman. Contoh senyawa terpena yang diisolasi dari bunga mawar adalah geraniol, sitral dari minyak sereh, limonena dari buah jeruk, atau mentol dari tanaman mint. O CH CH2OH sitral (geranial) geraniol OH limonena mentol kamfor O Geraniol dan sitral termasuk dalam kelompok monoterpena asiklik. Limonena, mentol, kamfor termasuk dalam kelompok monoterpena siklik. LATIHAN 1. 2. 3. Gambarkan rumus struktur dari tripalmitin ! Bagaimana reaksi antara tripalmitin dengan suatu basa kuat (NaOH) ? Bagaimana mekanisme sabun dalam membersihkan kotoran pada baju ? 210 Kimia Organik 4. 5. Apakah perbedaan lemak dan minyak dengan fosfolipid dalam hal strukturnya ? Manakah satuan isoprena dari struktur berikut ini : OH mentol Petunjuk Mengerjakan Latihan 1. Struktur dari tripalmitin adalah suatu trigliserida yang tersusun atas tiga satuan asam palmitat. CH2O2C(CH2)14CO2H CHO2C(CH2)14CO2H 2. CH2O2C(CH2)14CO2H Reaksi tripalmitin dengan NaOH merupakan reaksi penyabunan yang akan menghasilkan gliserol dan tiga molekul natrium palmitat CH2O2C(CH2)14CO2H CHO2C(CH2)14CO2H + 3 NaOH kalor CHOH CH2O2C(CH2)14CO2H 3. 4. 5. CH2OH + 3 CH3(CH2)14CO2- Na+ CH2OH Mekanisme sabun membersihkan kotoran adalah berdasarkan sifat sabun yang mempunyai ujung hidrofobik yaitu rantai hidrokarbon panjang dan hidrofilik berupa ujung ion. Bagian hidrofobik akan mnegikat kotoran sehingga sabun akan mengemulsikan kotoran yang akan dibuang dengan pembilasan. Perbedaan lemak dan minyak dengan fosfolipida adalah berdasarkan strukturnya dalam ikatan dengan gliserol. lemak dan minyak adalah gliserol dengan tiga molekul asam lemak sedangkan fosfolipida adalah gliserol dengan molekul asam lemak dan molekul ester fosfat yang terikat pada karbon tiga. Isoprena adalah satuan molekul yang mengandung lima karbon yang menyusun suatu terpena. Mentol adalah suatu monoterpena yang tersusun atas dua molekul isoprena. OH satuan isoprena 211 Kimia Organik RINGKASAN 1. 2. 3. 4. 5. 6. 7. 8. 9. Lipida dikelompokkan berdasarkan sifat fisisnya. Lipida dikelompokkan dalam lipida sederhana, lipida komplek, dan turunan lipida. Lemak dan minyak adalah kelompok trigliserida atau triasilgliserol yang merupakan ester dari gliserol dengan tiga asam lemak. Hidrolisis suatu lemak atau minyak akan menghasilkan asam lemak dan gliserol. Asam lemak penyusun lemak atau minyak dibedakan yaitu asam lemak jenuh apabila ikatan dalam rantai karbonnya berupa ikatan tunggal dan asam lemak tidak jenuh apabila ikatannya dalam rantai karbon berupa mengandung ikatan rangkap. Lemak dan minyak dapat mengalami reaksi hidrolisis, penyabunan, hidrogenasi, dan oksidasi. Sabun adalah garam alkali dari asam-asam lemak. Sabun dapat diperoleh melalui reaksi saponifikasi antara lemak atau minyak dengan larutan alkali. Molekul sabun mengandung suatu rantai hidrokarbon panjang dengan ujung ion, sehingga sabun mengandung gugus hidrofobik dan hidrofilik. Deterjen adalah kelompok surfaktan anionik seperti halnya sabun, tetapi deterjen dibuat secara sintetis. fosfolipid adalah lipid adalah lipida yang mengandung gugus ester fosfat. Fosfolipid dibedakan dalam dua kelompok besar yaitu gliserofosfolipid atau fosfoglisrida dan sfingomielin. Prostaglandin adalah lipida dengan karbon 20 yang mengandung cincin siklopentana dengan dua rantai samping panjang. prostaglandin dapat memberikan efek biologi seperti merangsang kontraksi uterin selama proses persalinan. Terpena adalah senyawa alam dengan komponen penyusun karbon dan hidrogen dengan perbandingan 5 : 8. Komponen penyusun terpena adalah isoprena. Terpena dibedakan berdasarkan jumlah satuan isoprena penyusunnya yaitu monoterpena, seskuiterpena, diterpena, triterpena, dan tetraterpena. Terpena banyak ditemukan dalam tanaman misalnya dalam komponen minyak atsiri. TES 3 1. Pernyataan yang sesuai tentang lipida adalah …. I. lipida dikelompokkan berdasarkan sifat fisisnya II. Tidak larut dalam air, tetapi larut dalam pelarut organik III. merupakan polimer yang mempunyai satuan berulang IV. dapat dihidrolisis yang akan menghasilkan asam lemak A. I, II, dan III B. I, II, dan IV C. II, III, dan IV D. I, III, dan IV 212 Kimia Organik 2. Berikut ini yang termasuk dalam asam lemak tidak jenuh adalah…. A. asam sterat, asam oleat, asam linolenat B. asam oleat, asam linoleat, asam palmitat C. asam oleat, asam linoleat, asam palmitoleat D. asam palmitat, asam palmitoleat, asam linolenat 3. Manakah lipida yang mengandung ester fosfat dalam strukturnya ? A. Tristearin B. Tripalmitin C. Lesitin D. geranial 4. Manakah pernyataan yang benar tentang reaksi hidrolisis tristearin ? A. Hasil reaksinya berupa gliserol dan asam lemak B. Disebut juga reaksi saponifikasi C. Membutuhkan basa kuat D. Akan terbentuk senyawa garam 5. Proses pembuatan margarin adalah mengubah minyak nabati cair menjadi padatan, hal ini dapat dibuat dengan melibatkan reaksi …. A. Oksidasi B. Saponiifkasi C. Hidrolisis D. Hidrogenasi 6. Senyawa lipida yang ditemukan dalam tubuh manusia yang disintesis dari asam arakhidonat adalah …. A. Prostaglandin B. Lesitin C. Sefalin D. sitral 7. Kelompok terpenoid apakah senyawa berikut ini ? A. B. C. D. Monoterpenoid Sesquiterpenoid Diterpenoid Tetraterpenoid 213 Kimia Organik 8. Senyawa yang bila dihidrolisis akan menghasilkan asam lemak, asam fosfat, dan kolina adalah …. A. Sefalin B. Lesitin C. Tristearin D. Tripalmitin 9. Manakah asam lemak berikut yang titik leburnya paling rendah…. A. Asam stearat B. Asam oleat C. Asam linoleat D. Asam linolenat 10. Manakah asam lemak berikut ini yang kelarutannya lebih tinggi dalam air ? A. Asam butirat B. Asam palmitat C. Asam stearat D. Asam oleat 214 Kimia Organik Petunjuk Jawaban Tes Tes 1 1. D, 2. C, 3. C, 4. B, 5. 6. 7. 8. B, B, C, A, 9. A, 10. D, pernyataan No I salah karbohidrat bukan senyawa hidrat arang tetapi senyawa polihidroksi aldehid dan keton disakarida tersusun dari dua molekul monosakarida, manosa dan galaktosa merupakan monosakarida pentulosa, senyawa monosakarida dengan gugus keton, dengan jumlah karbon = 5 deret D dan L menurut enantiomer yang merupakan bayangan cermin satu sama lain. piranosa karena mengandung cincin piran. fruktosa merupakan polihidroksi keton ikatan pada disakarida adalah 1,4’-α atau 1,4’-β deret D berarti gugus CH2OH berada di atas bidang, gugus OH dikiri akan berada di atas dan gugus OH di kanan berada di bawah dan posisi β berarti gugus OH pada karbon 1 berada disebelah atas dalam proyeksi haworth oksidasi dengan larutan Br2 akan mengoksidasi gugus aldehid menjadi karboksilat sehingga pada glukosa akan dihasilkan asam glukonat larutan brom spesifik untuk aldosa Tes 2 1. 2. 3. 4. 5. B, C, A, D, A, 6. D, 7. 8. A, C, 9. D, 10. A, gugus amino yang bersifat basa dan karboksil yang bersifat asam histidina, leusina, dan lisina termasuk 3 dari 10 asam amino esensial karena asam glutamat mengandung rantai samping gugus karboksil lisina mengandung gugus amino yang bersifat basa oksitosin termasuk peptida, globulin, albumin dan kolagen termasuk protein dan protaglandin turunan lipida denaturasi disebabkan oleh perubahan temperatur tinggi, perubahan pH, radiasi, deterjen, zat pengoksidasi/pereduksi reaksi asilasi akan menghasilkan senyawa amida albumin adalah protein globular, elastin yang membentuk urat dan pembuluh darah, dan kolagen membentuk jaringan penyambung. protease adalah kelompok enzim hidrolase yang bertugas menghidrolisis amida ikatan peptida akan menghasilkan amida, merupakan ikatan antara gugus amino suatu asam amino dengan gugus karboksil asam amino lainnya. 215 Kimia Organik Tes 3 1. B, 2. 3. C, C, 4. 5. A, D, 6. A, 7. 8. B, B, 9. D, 10. A, lipida bukan polimer dengan satuan berulang, lipida mempunyai struktur yang beraneka ragam. ? asam stearat dan asam palmitat termasuk asam lemak jenuh lesitin adalah kelompok gliserofosfolipida yang strukturnya mengandung 2 ester asam lemak dan ester fosfat hidrolisis trigliserida akan menghasilkan gliserol dan 3 asam lemak. reaksi hidrogenasi adalah proses untuk mengubah minyak nabati cari menjadi padatan lesitin dan sefalin adalah kelompok fosfolipida dan sitral adalah kelompok terpena karena jumlah karbonnya 15 lesitin kelompok fosfolipid yang mengandung asam fosfat, asam lemak, dan kolina. semakin banyak ikatan rangkapnya semakin rendah titik leburnya semakin panjang rantai hidrokarbonnya semakin kurang larut. 216 Kimia Organik Daftar Pustaka Fessenden, R.J., Fessenden, J.S, Alih Bahasa Pudjaatmaka, A.H, 1982, Kimia Organik Jilid 1, edisi ke-3 Jakarta : Erlanggan McMurry, J., 2007, Organic Chemistry,7th edition, California : Wadsworth Inc. Morrison, R.T, Boyd,R.N, 1992, Organic Chemistry, 7th edition, New Jersey : Prentice Hall Inc. Riawan, S, 1990, Kimia Organik, Jakarta : Binarupa Aksara 217