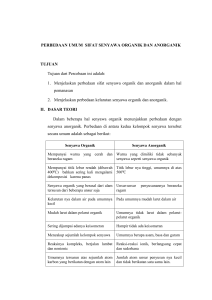
AMINA DAN AMIDA Mutiara Dwi Cahyani, M.pd AMINA PENGERTIAN Amina adalah turunan organik dari ammonia dimana satu atau lebih atom hidrogen pada nitrogen telah tergantikan oleh gugus alkil atau aril. Karena itu amina memiliki sifat mirip dengan ammonia seperti alkohol dan eter terhadap air. Seperti alkohol, amina bisa diklasifikasikan sebagai primer, sekunder dan tersier. Meski demikian dasar dari pengkategoriannya berbeda dari alkohol. Alkohol diklasifikasikan dengan jumlah gugus non hidrogen yang terikat pada karbon yang mengandung hidroksi, namun amina diklasifikasikan dengan jumlah gugus nonhidrogen yang terikat langsung pada atom nitrogen (Stoker, 1991). RUMUS UMUM Rumus umum untuk senyawa amina adalah Cn H2n+3 N, dimana R dapat berupa alkil atau aril. Terdapat 3 macam amina : Amina Primer Amina Sekunder Amina Tersier RUMUS UMUM R-NH2 – Amina primer, contoh: CH3-CH2-CH2-CH2-NH2 = butanamina (R)2NH – Amina sekunder, contoh: (CH3)2NH = dimetilamin (R)3N – Amina tersier, contoh: (CH3)3N = trimetilamin ARIL AMIN Gugus NH2- juga dapat berikatan dengan senyawa aromatic (benzene) sehingga sering dikatakan senyawa aril amina SUMBER-SUMBER AMINA • Morfina (pereda nyeri) : dari opium, getah kering biji mentah tumbuhan apiun • Putresina : dari daging busuk • Efedrina (obat pelutuh dahak) : di ekstrak dari tanaman ma-huang • Meskalina : diisolasi dari kaktus peyote • Nikotina : tembakau TATA NAMA Tata Nama IUPAC (Sistematik) Nama sistematik untuk amina alifatik primer diberikan dengan cara seperti nama sistematik alkohol, monohidroksi akhiran –a dalam nama alkana induknya diganti oleh kata amina. Contoh : CH3- CH-CH3 2-propanamina │ NH2 CH3-CH2-CH-CH2-CH3 │ NH2 3-pentanamina TATA NAMA Untuk amina sekunder dan tersier yang asimetrik (gugus yang terikat pada atom N tidak sama), lazimnya diberi nama dengan menganggapnya sebagai amina primer yang tersubtitusi pada atom N. Dalam hal ini berlaku ketentuan bahwa gugus sustituen yang lebih besar dianggap sebagai amina induk, sedangkan gugus subtituen yang lebih kecil lokasinya ditunjukkan dengan cara menggunakan awalan N (yang berarti terikat pada atom N) CH3-CH2-CH2-NH-CH3 N-metil-2-propanamin TATA NAMA Tata Nama Trivial Nama trivial untuk sebagian besar amina adalah dengan menyebutkan gugus-gugus alkil/aril yang terikat pada atom N dengan ketentuan bahwa urutan penulisannya harus memperhatikan urutan abjad huruf terdepan dalam nama gugus alkil/aril kemudian ditambahkan kata amina di belakang nama gugus-gugus tersebut. Contoh: TATA NAMA Dalam menomori cincin heterosiklik, heteroatom dianggap berposisi 1. Oksigen lebih diprioritaskan daripada nitrogen KLASIFIKASI AMINA Kelas kimiawi Amina Rumus Rumus struktural Awalan Akhiran Contoh Amina primer RNH2 CH3 – N – H I H amino- -amina Metilamina Amina sekunder R2NH amino- -amina Amina tersier R3N amino- -amina Gugus CH3 – N – CH3 I H CH3 – N – CH3 I CH3 Dimetilamina Trimetilamina SIFAT-SIFAT AMINA SIFAT FISIS AMINA • Ketiga golongan amina dapat membentuk ikatan hidrogen dengan gugus –OH dari air yaitu H - N. Tetapi ikatan hidrogen antara N dengan H ini lebih lemah dibandingkan ikatan hidrogen O dengan H karena N kurang elektronegatif dibandingkan N sehingga ikatan NH menjadi kurang polar (mudah larut dalam air). • Amina primer dengan berat molekul rendah berupa gas atau cairan yang mudah menguap. Sedangkan kelarutan dalam air berkurang dengan naiknya berat molekul. • Pada umumnya mempunyai bau seperti ammonia dan tidak berwarna. Amina sekunder dan tersier berbau seperti ikan (amis), tetapi penguapannya lebih rendah daripada amina primer. SIFAT-SIFAT AMINA Tabel 1. Titik Didih dan Kelarutan dalam Air Senyawa Amina Titik Didih Kelarutan dalam Air (g 100mL) ∞ Nama Rumus Struktur Metilamin CH3NH2 (°C) –6,3 Dimetilamin (CH3)2NH 7,5 ∞ Trimetilamin (CH3)3N 3,0 ∞ Etilamin CH3CH2NH2 17,0 ∞ Benzilamin C6H5CH2NH2 185,0 ∞ Anilin C6H5NH2 184,0 3,7 SIFAT-SIFAT AMINA SIFAT KIMIA AMINA Pada senyawa dengan rantai pendek, merupakan senyawa polar yang mudah larut dalam air. Memiliki titik didih dan titik leleh yang dengan seiring bertambah cenderung bertambah panjangnya rantai karbon. Semua amina bersifat sebagai basa lemah dan larutan amina dalam air bersifat basis. REAKSI AMINA Reaksi Amina dengan Asam Nitrit 1. Amina alifatik primer dengan HNO2 menghasilkan alkohol disertai pembebasan gas N2 menurut persamaan reaksi di bawah ini : CH3-CH-NH2 + HNO2 │ CH3 → CH3-CH-OH + N2 + H2O │ CH3 Isopropilamina (amina 1°) isopropil alkohol (alkohol 2°) 2. Amina alifatik/aromatik sekunder dengan HNO2 menghasilkan senyawa Nnitrosoamina yang mengandung unsur N-N=O, contoh : H N=O N + HNO2 → N + H2OCH3CH3 N-metilanilina N-metilnitrosoanilina REAKSI AMINA 3. Amina alifatik/aromatik dengan HNO2 memberikan hasil reaksi yang ditentukkan oleh jenis amina tersier yang digunakan. Pada amina alifatik/aromatik tersier reaksinya dengan HNO2 mengakibatkan terjadinya substitusi cincin aromatik oleh gugus –NO. contoh: CH3 CH2 N + HNO2 → N + H2O CH3 CH3 N,N-dietilanilina p-nitroso –N,N- dimetilanilina 4. Amina aromatik primer jika direaksikan dengan HNO2 pada suhu 0°C menghasilkan garam diazonium. Contoh: NH2 + HNO2 + HCl N= : Cl + 2H2O Anilina benzenadiaazonium klorida REAKSI AMINA Reaksi Substitusi 1. Reaksi dengan suatu alkil halida : RNH2 + R’Cl RNH2Cl- dan juga RNHR’2Cl- dan RNR’3 Cl2. Reaksi dengan keton CH3C OCH2CH3 + HNCH3 CH3C NHCH3 + CH3CH2OH 3. Reaksi dengan asam anhidrida CH3C OCCH3 + HNCH3 CH3C NHCH3 + HOCCH3 4. Reaksi dengan alkil halide CH3C CL + HNCH3 CH3C NHCH3 + HCL REAKSI AMINA 5. Reaksi dengan asam nitrit R3N + H ONO (amina tersier) (garam amina) R2NH + HONO (amina sekunder) R3N+H –ONO R2N N═ O (nitrosamin) RNH2 + HONO dingin R N2+ -N2 R+ (tidak stabil) (amina primer) PEMBUATAN AMINA Pembuatan amina primer Untuk pembuatan amina primer, reaksi terjadi dalam dua tahapan. Pada tahapan pertama, terbentuk sebuah garam – dalam hal ini, etilamonuim bromida. Garam ini sangat mirip dengan amonium bromida, kecuali bahwa salah satu atom hidrogen dalam ion amonium telah diganti oleh sebuah gugus etil. Dengan demikian, ada kemungkinan untuk terjadinya reaksi reversibel (dapat balik) antara garam ini dengan amonia berlebih dalam campuran Amonia mengambil sebuah atom hidrogen dari ion etilamonium sehingga menjadikannya amina primer, yakni etilamina. PEMBUATAN AMINA Pembuatan amina sekunder Reaksi di atas tidak berhenti setelah amina primer terbentuk. Etilamina juga bereaksi dengan bromoetana – dalam dua tahapan yang sama seperti reaksi sebelumnya. Pada tahap pertama, terbentuk sebuah garam – kali ini, dietilamonium bromida. Anggap garam yang terbentuk ini adalah amonium bromida dengan dua atom hidrogen yang digantikan oleh gugus-gugus etil. PEMBUATAN AMINA Pembuatan amina sekunder Lagi-lagi terdapat kemungkinan terjadinya reaksi reversibel (dapat balik) antara garam ini dengan amonia berlebih dalam campuran tersebut, seperti diperlihatkan pada gambar berikut: Amonia mengambil sebuah ion hidrogen dari ion dietilamonium sehingga menjadikannya amina sekunder, yakni dietilamin. Amina sekunder adalah amina yang memiliki dua gugus alkil terikat pada atom nitrogen PEMBUATAN AMINA Pembuatan amina tersier Setelah amina sekunder terbentuk, reaksi masih belum berhenti. Dietilamina juga bereaksi dengan bromoetana – dalam dua tahapan yang sama seperti pada reaksi sebelumnya. Pada tahapan pertama, terbentuk trietilamonium bromida. PEMBUATAN AMINA Lagi-lagi ada kemungkinan terjadinya reaksi reversibel (dapat balik) antara garam ini dengan amonia berlebih dalam campuran tersebut, sebagaimana ditunjukkan berikut Amonia mengambil sebuah ion hidrogen dari ion trietilamonium sehingga menjadikannya amina tersier, yakni trietilamin. Amina tersier adalah amina yang memiliki tiga gugus alkil terikat pada nitrogen. PENGGUNAAN AMINA Sebagai katalisator Dimetil amina : pelarut, absorben gas alam, pencepat vulkanisasi, membuat sabun, dll. Trimetil amina : suatu penarik serangga. IDENTIFIKASI AMINA 1. Hinsberg Test Tampatkan 1ml cairan amina, tambahkan 0,2 gram p-toulena sulfonyl chloride atau benzena sulfonyl chloride dan 5ml larutan KOH 10% didalm tabung reaksi. Tutup tabung reaksi dengan rapat dan kocoklah selama 3-5 menit, kemudian buka tutupnya dan panaskan tabung reaksi dengan steam bath selama 1menit sambil dikocok. Dinginkan larutan dan amati dengan kertas pH yang bertujuan untuk mengetahui ada tidaknya amina. Jika tidak terdapatkandungan amina didalm tabung reaksi tersebut, maka tambahkan KOH sampai terbentuk endapan. Kemudian tambahkan dengan 5ml aquadest dan kocoklah larutan tersebut. Jika endapan tidak terlarut maka sulfonamide dimungkinkan telah terbentuk mengandung 2-amina. IDENTIFIKASI AMINA 2. Asam nitrat Test Perubahan terhadap gas yang terjadi pada suhu 5oC dapat menunjukkan adanya amina primer(aliphatic), RNH2. Terbentuknya cairan yang menyerupei minyak yang berwarna kuning atau endapan kuning dapat membuktikan adanya amina sekunder, R2NH. Amina yang lain yang tentunya berupa amina tersier tidak dapat bereksi atau dapat dikategorikan kedalam golongan amina sekunder. Apabila perubahan yang terjadi terhadap gas sangatlah minim pada suhu 50C, maka diamkan sebentar dan panaskan secra perlahan-lahan hingga mencapai suhu kamar. Gelembung yang terbentuk pada suhu kamar dapat menunjukkan senyawa asli yang bisa kita sebut dengan amina primer (aromatik), ArNH2. Ambil bekas larutan tersebut dan tambahkan seteets demi seteets larutan β- naphtol. Jika terbentuk endapan merah, maka kita dapat membuktikan bahwa cairan yang tersedia tersebut adalah amina primer (aromatik ), ArNH2. IDENTIFIKASI AMINA 3. pH dari larutan Jika campuran tersebut larut dalam air, siapkan larutan tersebut dan amati pHnya dengan menggunakan kertas pH. Jika cairan tersebut berupa amina maka dapat dibuktikan dengan pH yang tinggi. Apabiala campuran tersebut tidak larut dalam air maka dapat dilarutkan terlebih dahulu dalam ethanol air atu 2-dimethoxyetane. 4. Acetyl Chgloride Amina dapat digunakan untuk membuktikan adanya acetyl chloride. Identifikasi ini dapat diuraikan dengan percobaan pada alkohol. Jika campuran ini dapt dinetralkan dengan air,maka amina primer dan sekunder dapat menghasilkan acetamide padat, sedangkan amina tersier tidak dapat menghasilkan padatan saama sekali. AMIDA PENGERTIAN Amida merupakan salah satu turunan dari asam karboksilat. Turunanturunan asam karboksilat memiliki stabilitas dan reaktifitas yang berbeda tergantung pada gugus yang melekat pada gugus karbonil. Stabilitas dan reaktifitas memiliki hubungan terbalik, yang berarti bahwa senyawa yang lebih stabil umumnya kurang reaktif dan sebaliknya. Karena asil halida adalah kelompok paling tidak stabil, masuk akal bahwa senyawa ini dapat secara kimia diubah ke jenis lain. Karena amida adalah jenis yang paling stabil, secara logis harus mengikuti bahwa amida tidak dapat dengan mudah berubah menjadi jenis molekul lain TATA NAMA Dalam tatanama biasa, amida disebut sesuai dengan nama asam tempat ia berasal. Jadi, amida paling sederhana berasal dari asam asetat, asetamida (CH3CONH2). IUPAC merekomendasikan ethanamide, tetapi ini sangat jarang ditemui. Ketika amida yang berasal dari amina primer atau sekunder, substituents pada nitrogen ditunjukkan pertama pada nama amida tersebut. Jadi amida yang terbentuk dari dimetilamin dan asam asetat adalah N,N- dimetilasetamida (CH3CON(CH3)2). Biasanya bahkan nama ini adalah dimetilasetamida (disederhanakan). Amida siklik disebut lactams, mereka harus berupa amida sekunder atau tersier. Kelompok fungsional yang terdiri dari -P (O) NR2 dan SO2NR2 adalah phosphonamides dan sulfonamides. HCONH2 = methanamide CH3CONH2 = ethanamide CH3CH2CONH2 = propanamide TATA NAMA O Struktur Formula CH3 O C N H H IUPAC ethanamide CH3CH2 O C N H CH3CH2 C N CH3 H propanamide H N- methylpropanamide SN2 TATA NAMA Jika rantai itu bercabang, karbon pada gugus -CONH2 dianggap sebagai atom karbon nomor satu, misalnya : STRUKTUR DAN IKATAN Amida paling sederhana adalah turunan dari amonia dimana satu atom hidrogen telah digantikan oleh gugus asil. Pada umumnya amida direpresentasikan sebagai RC (O) NH2. Amida dapat berasal dari amina primer (R'NH2) dengan rumus RC (O) NHR '. Amida juga umumnya berasal dari amina sekunder (R'RNH) dengan rumus RC (O) NR'R. Amida biasanya dianggap sebagai turunan dari asam karboksilat di mana gugus hidroksil telah digantikan oleh amina atau amonia. Gambar 2 Terdelokalisasinya pasangan elektron amida SIFAT FISIKA DAN KIMIA Sifar Fisika • Khusus untuk senyawa amida, ternyata harga titik didihnya cukup tinggi. Hal ini disebabkan oleh adanya ikatan hidrogen antar molekulnya. • Semua turunan asam karboksilat dapat larut dalam pelarut organik, sedangkan dalam air kelarutannya tergantung pada jumlah atom karbon yang terdapat dalam molekulnya. Sebagai contoh, untuk kelompok senyawa ester yang mengandung 3-5 atom C dapat larut dalam air, tetapi untuk kelompok senyawa amida yang larut dalam air adalah yang memiliki 5-6 atom C. • Berbagai ester yang volatil mempunyai bau sedap sehingga sering digunakan dalam pembuatan parfum atau bahan penyedap rasa sintetik. Kelompok senyawa klorida asam memiliki bau yang tajam karena mudah terhidrolisis dan menghasilkan asam karboksilat dan HCL yang masing-masing memiliki bau khas. SIFAT FISIKA DAN KIMIA Sifat-sifat Kimia Dalam mempelajari sifat-sifat kimia masing-masing kelompok turunan asam karboksilat, terlebih dahulu harus dipahami. Ciri-ciri umum reaksinya seperti yang di uraikan di bawah ini : a. Keberadaan gugus karbonil dalam turunan asam karboksilat sangat menentukan kereaktifan dalam reaksinya, walaupun gugus karbonil tersebut tidak mengalami perubahan. b. Gugus asil ( R-C=O ) menyebabakan turunan asam karboksilat mudah mengalami substitusi nukleofilik. Dalam substitusi ini, atom/gugus yang berkaitan dengan gugus asil digantikan oleh gugus lain yang bersifat basa. Pola umum reaksi substitusi nukleofilik tersebut dituliskan dengan persamaan reaksi c. Reaksi substitusi nukleofilik pada turunan asam karboksilat berlangsung lebih cepat dari pada reaksi substitusi nukleofilik pada rantai karbon jenuh (gugus alkil) TITIK LELEH Seperti yang kita lihat, ada banyak ikatan hidrogen yang dapat dibentuk. Setiap molekul memiliki dua atom hidrogen sedikit positif dan dua pasang elektron bebas pada atom oksigen. Ikatan hidrogen ini memerlukan jumlah energi yang besar untuk memutuskannya. Oleh sebab itu titik leleh dari senyawa-senyawa amida cukup tinggi. KELARUTAN Kelarutan dari amida dan ester secara kasar sebanding. Biasanya amida kurang larut dibandingkan amina dan asam karboksilat yang sebanding karena senyawa ini dapat dengan baik menyumbangkan dan menerima ikatan hidrogen PEMBUATAN AMIDA Dari asam karboksilat Asam karboksilat diubah terlebih dahulu menjadi sebuah garam amonium yang kemudian menghasilkan amida pada pemanasan. Garam amonium dibentuk dengan menambahkan amonium karbonat padat kepada suatu kelebihan asam. Sebagai contoh, amonium etanoat dibuat dengan menambahkan amonium karbonat ke kelebihan asam etanoat. Ketika reaksi selesai campuran dipanaskan dan terjadi dehidrasi garam ammonium memproduksi ethanamide. PEMBUATAN AMIDA Dari asil klorida Asil klorida (juga dikenal sebagai asam klorida) memiliki rumus umum RCOCl. Atom klorin sangat mudah diganti dengan subtituents lain. Misalnya mudah digantikan oleh sebuah kelompok -NH2 untuk membuat suatu amida. Untuk membuat ethanamide dari klorida ethanoyl, biasanya kita menambahkan ethanoyl klorida ke dalam sebuah larutan yang terdiri dari amonia dalam air. Ada beberapa reaksi yang sangat keras yang menghasilkan banyak asap putih (seperti campuran amonium klorida padat dan ethanamide). Beberapa campuran tetap dilarutkan dalam air sebagai larutan tidak berwarna. PEMBUATAN AMIDA Dari asil klorida Kita dapat menganggap reaksi yang terjadi dalam dua tahap. Pada tahap pertama, amonia bereaksi dengan klorida ethanoyl untuk menghasilkan ethanamide dan gas hidrogen klorida. Kemudian hidrogen klorida yang dihasilkan bereaksi dengan amonia berlebih untuk menghasilkan amonium klorida. Hasilnya kita dapat menggabungkan kedua reaksi ini bersama-sama untuk memberikan satu persamaan sebagai berikut PEMBUATAN AMIDA Dari anhidrida asam Sebuah anhidrida asam adalah sesuatu yang kita peroleh jika melenyapkan sebuah molekul air dari dua kelompok asam -COOH karboksilat. Misalnya jika kita mengambil dua molekul asam etanoat dan mengeluarkan sebuah molekul air di antara mereka maka kita akan mendapatkan anhidrida asam, anhidrida etanoat (nama lama: anhidrida asetat). PEMBUATAN AMIDA Reaksi-reaksi anhidrida asam mirip seperti asil klorida, kecuali bahwa selama reaksi, molekul asam karboksilat lebih dominan dihasilkan daripada HCl pada waktu asil klorida bereaksi. Jika anhidrida etanoat akan ditambahkan ke larutan amonia pekat, ethanamide dibentuk bersamasama dengan amonium etanoat. Sekali lagi, reaksi terjadi dalam dua tahap. Pada tahap pertama ethanamide dibentuk bersama-sama dengan asam etanoat. Kemudian asam etanoat yang dihasilkan bereaksi dengan amonia berlebih untuk menghasilkan amonium etanoat. Hasilnya kita dapat menggabungkan kedua reaksi ini bersama-sama untuk memberikan satu persamaan sebagai berikut. PEMBUATAN AMIDA Reaksi Schmidt Reaksi Schotten-Baumann PEMBUATAN AMIDA Reaksi Passerini Reaksi Ritter PEMBUATAN AMIDA Reaksi Ugi SN2 SENYAWA AMIDA Formamida Formamida juga dikenal sebagai metanamida, merupakan amida yang berasal dari asam formiat. Ini adalah cairan bening yang dapat larut dalam air dan memiliki bau seperti amonia. Senyawa ini digunakan terutama untuk pembuatan obat sulfa dan mensintesis vitamin serta sebagai pelembut untuk kertas dan serat. Dalam bentuk murni sering digunakan sebagai pelarut. SENYAWA AMIDA Akrilamida Akrilamida adalah senyawa kimia dengan rumus kimia C3H5NO. Nama IUPAC adalah 2 propanamida. Senyawa ini berbau, kristal padat putih, larut dalam air, etanol, eter, dan kloroform. Kebanyakan digunakan untuk mensintesis poliakrilamida, termasuk penggunaan dalam air limbah pengobatan, elektroforesis gel ( SDS-PAGE ), pembuatan kertas, bijih pengolahan, dan pembuatan tekan permanen kain. Beberapa akrilamida digunakan dalam pembuatan zat warna dan pembuatan monomer. SN2 SENYAWA AMIDA Sulfonamida Sulfonamida adalah dasar dari beberapa kelompok obat-obatan. Sulfonamida antibakteri asli (kadang-kadang disebut obat sulfa) adalah agen-agen anti mikroba sintetik yang berisi kelompok sulfinamida. Beberapa sulfonamida juga tidak memiliki aktivitas antibakteri, misalnya antikonvulsi sultiame. SENYAWA AMIDA Tioamida Tioamida adalah kelompok fungsional dengan struktur umum R-CS-NR'R, dimana R adalah kelompok organik. Mereka analog dengan amida tetapi menunjukkan ikatan yang lebih besar sepanjang ikatan CN, hasilnya terjadilah penghalang rotasi yang lebih besar. Salah satu yang terkenal dari tioamida terbaik adalah thioacetamide yang digunakan sebagai sumber ion sulfida dan merupakan blok bangunan di kimia heterosiklik. Tioamida biasanya dibuat dengan mereaksikan amida dengan sulfida fosfor seperti pentasulfida fosfor dalam suatu aplikasi khusus. SENYAWA AMIDA Salisilamida Salisilamida adalah nama umum untuk o-hidroksibenzamida. Salisilamida adalah obat yang penggunaannya mirip dengan aspirin. Salisilamida digunakan dalam kombinasi dengan aspirin dan kafein yang dikenal sebagai SM Powder. SN2 SENYAWA AMIDA Nikotinamida Nikotinamida juga dikenal sebagai niasinamida dan amida asam nikotinat, merupakan amida dari asam nikotinat (vitamin B3/niasin). Nikotinamida adalah vitamin yang dapat larut dalam air dan merupakan bagian dari vitamin B. Asam nikotinat juga dikenal sebagai niasin, dikonversi menjadi nikotinamida. Walaupun keduanya identik sebagai vitamin, nikotinamida tidak memiliki efek farmakologis dan sifat yang beracun seperti niasin (hal ini terkait dengan konversi niasin). Jadi nikotinamida tidak mengurangi kolesterol, walaupun begitu nikotinamida mungkin beracun untuk hati pada dosis melebihi 3g/hari untuk orang dewasa. Dalam sel niasin dimasukkan ke dalam dinukleotida nikotinamida adenin (NAD) dan nikotinamida adenin dinukleotida fosfat (NADP). LATIHAN 1. Tentukanlah masing-masing senyawa berikut ini, apakah merupakan amina primer, sekunder, dan tersier sebagai suatu garam amina dari salah satunya a. CH3CH2NH2 b. (CH3)2CH2NH2 c. (CH3)3N 2. Prediksilah, manakah pasangan senyawa berikut yang titik didihnya lebih tinggi. Jelaskan alasan Anda. a. Etanamin atau etanol. b. Butana atau 1-propanamin. c. Metanamin atau air. d. Etilmetilamin atau butane. 3. Gambarkan struktur masing-masing senyawa berikut: a.Dietilamin. b.3-Dekanamin. c. 3-Bromo-2-pentanamin. d.Trifenilamin. 4. Gunakan sistem tatanama IUPAC dan sistem tatanama untuk nama masing-masing amida berikut: 5. Tentukan, dimanakah terdapat gugus amida pada struktur sakarin, pemanis buatan berikut: TERIMA KASIH