amina
advertisement

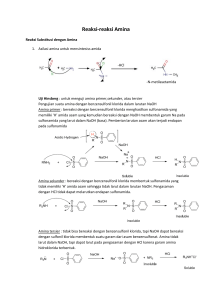
AMINA Beberapa senyawa obat dari golongan amina OH N efedrina suatu decongestan, menyebabkan menyusutnya membran hidung yg membengkak sehingga lendir tidak dpt keluar H3CO H3CO NH2 H3CO meskalina, suatu halusinogen yang diisolasi dari kaktus peyote NH2 amfetamina, suatu stimulan yang menyebabkan kegugupan dan tdk bisa tidur, digunakan untuk mengobati kegemukan krn menekan nafsu makan AMINA Senyawa yang mengandung gugus NH2 Rumus molekul : RNH2 Jenis Amina primer (1o) Amina sekunder (2o) Amina tersier (3o) : R N H H amina 1 R N R' amina 2 H R N R'' R' amina 3 Tatanama Amina sederhana diberinama berdasarkan sistem gugus fungsi; alkil/aril disebut lebih dulu, kemudian ditambahkan akhiran amina CH3CH2CH2NH2 propilamina NH2 sikloheksilamina (CH3CH2)2NH dietilamina Diamina diberi nama dari nama alkana induknya (dengan angka awalan yang sesuai), yang diikuti dengan akhiran -diamina H2NCH2CH2CH2NH2 1,3-propanadiamina 1,3-propildiamina Apakah nama dan jenis amina berikut? H CH3 CH3 CH CH2 isobutilamin 1 CH3 CH3 NH2 CH2 N CH CH2 CH3 trietilamin 3 CH2 N CH CH3 etilisopropilamin 2 CH3 CH3 Tatanama Jika lebih dari satu tipe gugus alkil terikat pada nitrogen, gugus alkil terbesar dianggap sebagai gugus induk. Gugus alkil tambahan dinyatakan dengan awalan N-alkilCH3 CH3 CH3CHNHCH3 CH3CHN(CH3)2 N-metil-2-propilamina N,N-dimetil-2-propilamina Jika ada gugus fungsi berprioritas tata nama lebih tinggi, digunakan awalan amino NHCH3 H2NCH2CH2OH 2-aminoetanol CH3CHCO2H asam 2-(N-metilamino)propanoat Tata Nama : Jika atom N mengikat 4 gugus hidrokarbon/atom lainnya, maka N akan bermuatan positif, dikenal sebagai ion ammonium kuartener CH3 CH3 + CH Cl N 3 CH3 tetrametil ammonium klorida CH3 CH3 + N CH3 OH CH3 tetrametil ammonium hidroksida Tata Nama : Senyawa yang mengandung gugus –NH2 pada cincin benzena dinamakan sebagai derivat anilin. NH2 NH2 NH2 CH3 anilin O CH3 p-metoksianilin (p-anisidin) o-metilanilin (o-toluidin) Senyawa siklis dimana satu atom C atau lebih diganti dengan atom nitrogen, diberi nama khusus sebagai heterosiklik amin. Beberapa Contoh Senyawa Heterosiklis Amin Alkaloid : senyawa yang mengandung nitrogen yang bersifat basa dari tumbuhan dan hewan. Conroh : Nikotin dari tembakau Porfirin : senyawa heterosiklis yang mengandung 4 cicin pirol yang saling berikatan. Porfirin membentuk kompleks dengan ion logam. Apabila membentuk kompleks dengan Fe membentuk besi-porfirin yang menyebabkan warna darah merah pada darah arteri Hemoglobin Contoh Senyawa Heterosiklis Klorofil berwarna hijau adalah kompleks Mg dengan porfirin yang termodifikasi. HC HC CH2 CH3 H3C N CH2 C CH3 H2 N N Mg Fe N CH3 H3C H C N CH2 N N CH3 H3C N CH3 H3C HOOCH2CH2C HOOCH2CH2C CH2CH2COOH O H3COOC Hemoglobin Klorofil-a Latihan Apakah nama dan jenis amina dari struktur berikut? H3C H N NH2 CH3 H3CH2C N CH2CH3 CH2CH3 alkilamina tersier alkilamina sekunder alkilamina primer CH3 (CH3)2NH2+ Cl- Br - N CH3 dimetilamonium klorida garam dari suatu amina sekunder N-metilpiperidinium bromida garam dari suatu amina tersier Garam amonium kuarterner: (CH3)4N+ Cltetrametilamonium klorida CH3CO2CH2CH2N(CH3)3 Clasetilkolina klorida terlibat dalam transmisi impuls syaraf Sifat Fisik Amina Amina membentuk ikatan hidrogen, tapi ikatan hidrogen N---HN lebih rendah daripada ikatan hidrogen O---HO karena N kurang elektronegatif dibandingkan O dan karena itu ikatan NH kurang polar. Pengikatan hidrogen yg lemah antara molekul amina menyebabkan titik didihnya berada antara titik didih senyawa tanpa ikatan hidrogen (alkana, eter) dan senyawa berikatan hidrogen kuat (alkohol) dg bobot molekul yg bersamaan CH3CH2OCH2CH3 t.d 34,5°C (CH3CH2)2NH t.d 56°C Chapter 20 CH3CH2CH2CH2OH t.d 117°C 13 Sifat Fisik Amina Amina tersier dalam bentuk cairan murni tdk dapat membentuk ikatan hidrogen karena tidak memiliki ikatan NH, sehingga titik didihnya lebih rendah daripada amina primer atau sekunder dlm bobot molekul yg sepadan (CH3)3N t.d 3°C CH3CH2CH2NH2 t.d 48°C Chapter 20 14 Sifat Fisik Amina : Amina 1 dan 2 bersifat lebih polar karena mampu membentuk ikatan hydrogen intermolekuler. Larut dalam air karena mampu membentuk ikatan hidrogen dengan air. Ikatan hidrogen N H N N H < O Garam amina dan garam amonium kuarterner bersifat spt garam anorganik : t.d tinggi, larut dlm air dan tdk berbau H Chapter 20 16 Structure of Amines The nitrogen atom in an amine is sp3 hybridized The three groups and the unshared electron pair around nitrogen result in a tetrahedral geometry If only the location of the groups (and not the unshared electron pair) are considered, the shape of the amine is trigonal pyramidal Partial negative charge is localized in the region of the nonbonding electrons It is usually impossible to resolve amine enantiomers that are chiral at nitrogen because they interconvert rapidly The interconversion occurs through a pyramidal or nitrogen inversion involving the unshared electron pair Chapter 20 17 Quaternary ammonium salts can be resolved into enantiomers Chiral quaternary ammonium salts cannot undergo nitrogen inversion because they lack an unshared electron pair on the nitrogen atom Chapter 20 18 Kebasaan Amina Amina bersifat basa lemah dalam air karena memiliki PEB Kebasaan amina dapat ditentukan oleh nilai : Kb pKb Ka dari asam konjugat pKa dari asam konjugat Chapter 20 19 Basicity Constant (Kb) and pKb Kb is the equilibrium constant for the reaction: R3N •• + H OH •• Kb = and + R3N •• pKb = [R3NH+][HO–] [R3N] - log Kb – •• H + •• OH •• R3N •• + H + R3N •• OH •• Kb = – •• H + •• OH •• [R3NH+][HO–] [R3N] Menurut persamaan tersebut, dapat diprediksi : 1. Jika amina bebas terstabilkan relatif thd kationnya, maka amina itu bersifat basa yang lebih lemah 2. Jika kation itu terstabilkan relatif thd amina bebasnya, maka amina itu bersifat basa yang lebih kuat. 3. Karena semakin besar nilai Kb, sifat kebasaan semakin kuat and pKb = - log Kb Semakin kecil nilai pKb, sifat kebasaan semakin kuat Hal-hal yg mempengaruhi kebasaan amina 1. Adanya gugus pelepas elektron dapat meningkatkan sifat kebasaan 2. Kation akan terstabilkan oleh bertambahnya solvasi (kelarutan dalam pelarut), bersifat basa lebih kuat 3. Hibridisasi nitrogen Sp2 bersifat basa lebih lemah daripada Sp3 4. Adanya peristiwa resonansi akan menstabilkan amina bebas, bersifat basa lebih lemah Chapter 20 22 Pengaruh gugus pelepas elektron Contoh gugus pelepas elektron : alkil Alkil yang terikat pada nitrogen akan meningkatkan kebasaan dengan cara menyebarkan muatan positif dalam kation, sehingga kation menjadi terstabilkan Pada reaksi SN1, gugus alkil akan melepaskan elektron dan membentuk karbokation 23 Pengaruh solvasi Kation terstabilkan oleh bertambahnya solvasi karena pelarut (misal air) membantu menyebarkan muatan positif. Contoh : (CH3)3N (pKb = 4,19) bersifat basa lebih lemah daripada (CH3)2NH (pKb = 3,27) Karena trimetilamina tdk memiliki ikatan hidrogen sehingga interaksi dg pelarut lebih lemah Chapter 20 24 Pengaruh Hibridisasi Hibridisasi Nitrogen Sp2 pada suatu amina menyebabkan sifat basa lebih lemah karena PEBnya lebih kuat terikat, sehingga amina bebas lebih terstabilkan Contoh : Piridina pKb = 8,75 Piperidina pKb = 2,88 Chapter 20 25 Pengaruh Resonansi Anilin pKb = 9,37 Sikloheksilamina pKb = 3,3 PEB pada anilin bebas akan terdelokalisasi dalam cincin aromatis, sehingga anilin bebas lebih terstabilkan. Anilin bersifat basa lebih lemah Sementara ion anilinium tidak dapat terdelokalisasi oleh awan pi aromatis 26 Latihan Urutkan kebasaan dari yang paling kuat dan jelaskan penyebabnya ! Chapter 20 27 Pembuatan Amina Sintesis amina dapat dilakukan dengan melakukan reaksi berikut : Substitusi Nukleofilik Reduksi Penataan ulang Chapter 20 28 Chapter 20 29 Sintesis dg substitusi nukleofilik Molekul amina memiliki 1 PEB, sehingga amina bersifat nukleofilik Amonia + RX garam amina + Basa (NaOH) Amina bebas Ukuran kereaktifan alkil halida : CH3X>primer>sekunder Alkil halida tersier (R3X) tdk dpt bereaksi substitusi dg amina, reaksi yg terjadi akan menghasilkan produk eliminasi Chapter 20 30 Kelemahan metode ini : garam amina yg terbentuk bisa mempertukarkan proton dg amonia/amina awal, sehingga dapat menghasilkan campuran mono-, di-, trialkilamina, bahkan amonium kuarterner Chapter 20 31 Bila ingin dihasilkan amina primer/monoalkilamina, maka dalam proses sintesis gunakan amonia/amina awal berlebih Bila ingin dihasilkan garam amonium kuarterner, maka dalam proses sintesis gunakan alkilhalida berlebih Chapter 20 32 Sintesis Ftalimida Gabriel (Substitusi Nukleofilik) Produk yg dihasilkan adalah amina primer tanpa produk samping amina sekuder atau tersier Ftalimida dibuat dengan memanaskan anhidrida asam ftalat dengan amonia 33 Sintesis Asam Amino Metode Gabriel dapat diaplikasikan untuk mensintesis asam amino 34 Sintesis dengan Reduksi Reduksi nitro aromatik menjadi arilamina Reaksi senyawa nitro aromatik dg kawat besi dan HCl pekat menjadi amina terprotonkan, penambahan basa untuk mendapatkan amina Contoh : Chapter 20 35 Sintesis arilamina dari arilhalida Aril halida tidak bereaksi substitusi dan eliminasi karena ada kekuatan ekstra dari ikatan C sp2 Aril halida dapat mengalami reaksi subsitusi aromatik nukleofilik Reaktivitasnya dibesarkan oleh adanya substituen yg menarik elektron pada cincin Substituen penarik elektron menyebabkan cincin miskin elektron dan menjadi lebih menarik bagi nukleofil yang menyerang + NH3 Kalor Tekanan Chapter 20 36 Reduksi Nitril dengan LiAlH4 Nitril diperoleh dari suatu alkil halida Merupakan teknik memperpanjang rantai karbon suatu amina Chapter 20 37 Chapter 20 38 Reduksi Amida dg Zat Pereduksi Chapter 20 39 Aminasi Reduktif Chapter 20 40 Penataan ulang Hofmann Chapter 20 41 Penataulangan Curtius Chapter 20 42 Reaksi-Reaksi Amina Reaksi Substitusi dengan Amina 1. Asilasi Amina Chapter 20 44 Chapter 20 45 Uji Hinsberg (Uji kualitatif Amina) Merupakan pengujian suatu amina dg benzensulfonil klorida dalam larutan NaOH encer Amina Primer : bereaksi dg benzensulfonil klorida menghasilkan sulfonamida yg memiliki H asam yg kemudian bereaksi dg NaOH membentuk garam Na pd sulfonamida yg larut dalam NaOH (basa). Pemberian larutan asam akan terjadi endapan pada sulfonamida. Chapter 20 46 Observasi visual : penambahan amina pada larutan hinsberg test menunjukkan larutan yg jernih, asidifikasi dg HCl akan terbentuk suatu endapan Chapter 20 47 Amina sekunder : bereaksi dg benzensulfonil klorida membentuk sulfonamida yg tidak memiliki H asam shg tidak larut dalam larutan NaOH encer. Pengasaman dg HCl tidak dapat melarutkan endapan sulfonamida Observasi visual : reaksi menghasilkan suatu suspensi yg mengandung endapat yg tidak dapat larut pada pengasaman dengan HCl Chapter 20 48 Amina tersier : tidak dapat bereaksi dg benzensulfonil klorida, tetapi NaOH dapat bereaksi dg benzensulfonil klorida membentuk suatu garam dari benzensulfonat. Amina tidak larut dalam larutan NaOH encer, tetapi larut pada pengasaman dg HCl karena garam amina klorida terbentuk Observasi visual : tidak dapat bereaksi dg larutan Hinsberg test, terbentuk endapan atau minyak yg tidak larut, pada pengasaman dg HCl endapan terlarut menghasilkan larutan jernih dari suatu garam amina Chapter 20 49 2. Reaksi substitusi dengan Aldehid atau keton Reaksi substitusi dg amina primer Chapter 20 50 2. Reaksi substitusi dengan Aldehid atau keton Reaksi substitusi dengan amina sekunder Chapter 20 51 Reaksi Amina dengan Asam Nitrat Reaksi Amina primer Chapter 20 52 Reaksi Amina dengan Asam Nitrat Reaksi Amina sekunder Chapter 20 53 Reaksi Amina dengan Asam Nitrat Reaksi Amina tersier Chapter 20 54 Oksidasi Amina Amina primer dan sekunder menghasilkan N- oksidasi, tapi produknya tdk dapat ditentukan karena reaksi2 sampingnya Amina tersier menghasilkan N-oksida bersih N-oksida amina tersier mengalami cope elimination ketika dipanaskan 55 Eliminasi Hofmann 56 Latihan Bagaimana asam amino di bawah ini dibuat dg suatu sintesis ftalimida? 57 Terima Kasih