1 Enzim
advertisement
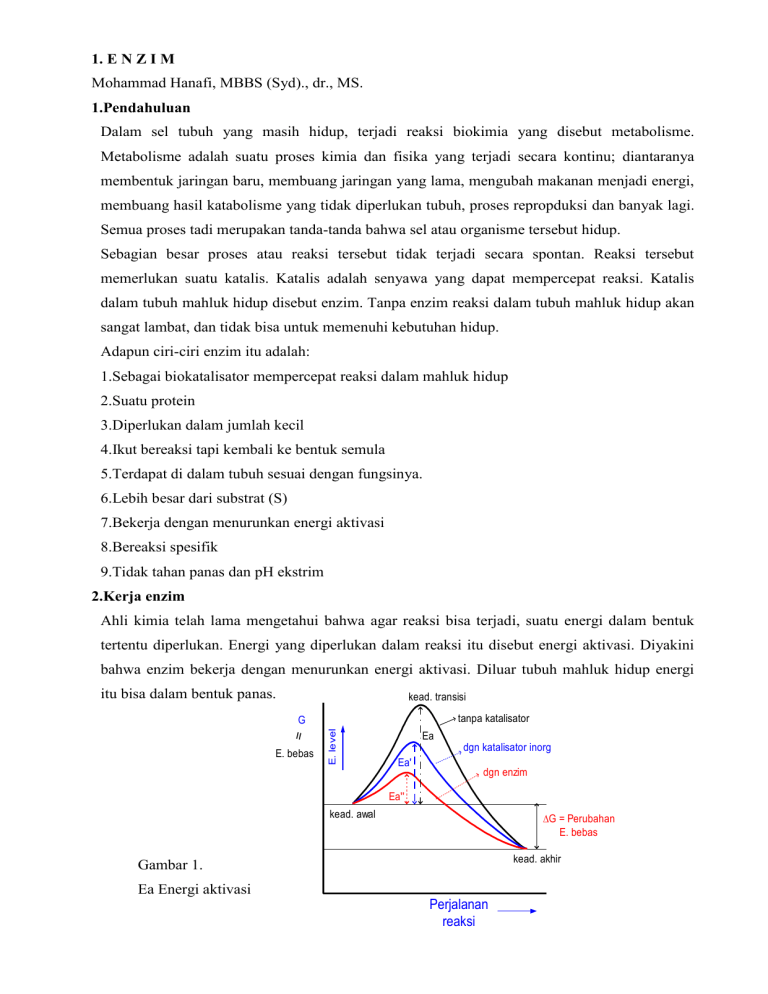
1. E N Z I M Mohammad Hanafi, MBBS (Syd)., dr., MS. 1.Pendahuluan Dalam sel tubuh yang masih hidup, terjadi reaksi biokimia yang disebut metabolisme. Metabolisme adalah suatu proses kimia dan fisika yang terjadi secara kontinu; diantaranya membentuk jaringan baru, membuang jaringan yang lama, mengubah makanan menjadi energi, membuang hasil katabolisme yang tidak diperlukan tubuh, proses repropduksi dan banyak lagi. Semua proses tadi merupakan tanda-tanda bahwa sel atau organisme tersebut hidup. Sebagian besar proses atau reaksi tersebut tidak terjadi secara spontan. Reaksi tersebut memerlukan suatu katalis. Katalis adalah senyawa yang dapat mempercepat reaksi. Katalis dalam tubuh mahluk hidup disebut enzim. Tanpa enzim reaksi dalam tubuh mahluk hidup akan sangat lambat, dan tidak bisa untuk memenuhi kebutuhan hidup. Adapun ciri-ciri enzim itu adalah: 1.Sebagai biokatalisator mempercepat reaksi dalam mahluk hidup 2.Suatu protein 3.Diperlukan dalam jumlah kecil 4.Ikut bereaksi tapi kembali ke bentuk semula 5.Terdapat di dalam tubuh sesuai dengan fungsinya. 6.Lebih besar dari substrat (S) 7.Bekerja dengan menurunkan energi aktivasi 8.Bereaksi spesifik 9.Tidak tahan panas dan pH ekstrim 2.Kerja enzim Ahli kimia telah lama mengetahui bahwa agar reaksi bisa terjadi, suatu energi dalam bentuk tertentu diperlukan. Energi yang diperlukan dalam reaksi itu disebut energi aktivasi. Diyakini bahwa enzim bekerja dengan menurunkan energi aktivasi. Diluar tubuh mahluk hidup energi itu bisa dalam bentuk panas. kead. transisi tanpa katalisator E. bebas E. level = G Ea dgn katalisator inorg Ea' dgn enzim Ea'' kead. awal G = Perubahan E. bebas kead. akhir Gambar 1. Ea Energi aktivasi Perjalanan reaksi Dalam gambar di atas, energi aktivasi ( Ea ) tanpa enzim ( warna hitam) lebih besar bila dibandingkan dengan adanya enzim (warna merah). Enzim bereaksi spesifik, artinya : Suatu enzim hanya dapat bekerja dengan suatu substrat tertentu atau dengan sejumlah kecil senyawa sejenis. Spesifitas atau kekhususan enzim – Kekhususan Absolut: enzim hanya akan mempercepat reaksi (mengkatalisis) satu macam reaksi saja. Contoh Glukokinase Glukokinase Glukose + ATP Glukosa 6 P (fosfat) + ADP – Kekhususan Relatif : enzim bekerja pada lebih dari satu macam reaksi. Contoh Heksokinase. Selain glukosa bisa memakai Fruktose – Kekhususan Optik (Stereochemical specificity): Amilase hanya bisa memecah amilosa atau amilopektin yang alfa saja. – Kekhususan Gugus (group specifisity): enzim bekerja pada molekul yang mempunyai gugus yang berfungsi spesifik, misalnya asam amino, fosfat, metil. Contoh Alkohol dehidrogenase Banyak hal yang mempengaruhi kerja enzim. Secara umum kerja enzim dipengaruhi oleh, iktatan antara Enzim dan Substrat (E-S komplek), sifat gugus katalitik dan kofaktor. 3.Pembagian enzim Pemberian nama suatu enzim yang paling lazim adalah menurut reaksi yang dikatalisis, yang diikuti akhiran ase. Sebagai contoh dehidrogenase, reaksinya membuang hidrogen, protease menghidrolisis protein. Kadang dengan nama substrat yang dipakai, misalnya amilase substratnya amilum (terdiri dari amilosa dan amilopektin), xanthine oksidase (hypoxanthine dan xanthine). Bisa dengan memakai sumber enzim tersebut, contoh ribonuklease pankreas yang diproduksi oleh pankreas. Bisa juga dengan memakai regulatornya (yang mengatur kecepatan reaksi), misalnya hormon sensitive lipase. Dan banyak lagi. Karena jumlah enzim makin banyak yang ditemukan, untuk mempermudah serta mengurangi kerancuan dalam pemberian nama maka International Union of Biochemists, mengatur pemberian nama Enzim. Tata nama Enzim menurut IUB, 1.Reaksi dan enzimnya dibagi dalam 6 kelas utama 2.Nama enzim ada dua bagian: Bagian pertama, nama substrat Bagian ke dua, jenis reaksi + ase Mis: Alkohol : NAD Oksidoreduktase = alkohol dehidrogenase Bila ada informasi tambahan diberi kurung ( ) Mis: L-Malat : NAD Oksidoreduktase (decarboxylating) L-Malat + NAD+ Piruvat + CO2 + NADH + H+ L-Malat : NAD Oksidoreduktase L-Malat + NAD+ Oksaloasetat + NADH + H+ 3.Nomor Kode Sistematik Contoh enzim di bawah ini mempunyai kode EC.2.7.1.1 ATP:D-hexose 6-phosphotransferase Angka 2 menunjukkan enzim tersebut termasuk kelas yang ke dua yaitu Transferase Angka 7 yang ditransfer (sub klas yaitu fosfat) Angka 1 pertama, akseptor gugus (sub-subklas , alkohol) Angka 1 kedua, enzim yang dimaksud (heksokinase) Heksosa 6, alkohol yang terfosforilasi pada C yang ke 6 dari heksosa. Contoh : ATP:D-hexose 6-phosphotransferase Nama sehari-hari heksokinase -D-GLUKOSA + ATP -D-GLUKOSA 6-P + ADP ++ Mg Pembagian Enzim 3.1.Oksidoreduktase: Mengkatalisis reaksi oksidasi reduksi Contoh : Enzim-enzim pada proses oksidasi biologis. Laktat dehidrogenase Piruvat + NADH + H+ Laktat + NAD+ 3.2.Transferase : Mengkatalisis transfer/pemindahan gugus fungsional (bukan hidgrogen) antara sepasang substrat. S–G + S’ S’–G + S Heksokinase/Glukokinase -D-GLUKOSA+ATP -DGLUKOSA-6-P +ADP 3.3.Hidrolase : Mengkatalisis pembelahan hidrolitik. Contoh : Enzim Amilase - Lipase - Karboksi peptidase A -D-Galaktosida + H2O suatu alkohol + D-galaktosa 3.4.Liase (Lyase) : Mengkatalisis reaksi pembentukan atau pemecahan ikatan rangkap dua, atau pembelahan lain yang menyangkut penyusunan kembali elektron. Contoh: Aldolase : Ketosa-I-P Aldosa + Dihidroksi Aseton-P Fumarase : Malat Fumarat 3.5.Isomerase : Mengkatalisis penyusunan kembali intramolekuler All Trans – retinin 11 – cis – retinin 3.6.Ligase : Menggabungkan 2 molekul, disertai pemutusan ikatan pirofosfat pada ATP atau senyawa senjenis. Contoh: ~ Piruvat karboksilase: Piruvat + CO2 + ATP Oksaloasetat + ADP 4.Struktur Protein Agar kita bisa membayangkan dan dapat mengerti cara kerja enzim secara fisik atau dalam bentuk tiga dimensi, maka kita perlu mempelajari struktur enzim itu sendiri. Enzim adalah suatu protein yang tersusun dari asam amino. Maka secara bertahap kita membangun struktur enzim. Secara teoritis, struktur protein itu ada beberapa bentuk, yaitu: 4.1.Struktur primer protein. H O H O H O H | || | || | || | +H N – C – C – N – C – C – N – C – C – – – N – C – C 3 | | | | | | | R1 H R2 H R3 H R ujung amino bebas IKATAN PEPTIDA O O– ujung karboksil bebas STRUKTUR PRIMER PROTEIN : Definisi : Urutan asam amino dari ujung amino bebas (awal) sampai ujung karboksil (akhir) yang dipertahankan oleh iktan peptida. Ikatan peptida terbentuk dari gugus hidroksil ( -OH ) asam amino dengan gugus –NH3+ (atau sering ditulis -NH2) asam amino lain, H2O terbentuk. 4.2.Struktur sekunder: Karena keterbatasan rotasi antara Karbonil Karbon (CO) dan Nitrogen yang membentuk ikatan peptida pada struktur primer protein, serta sudut tertentu yang terbentuk, dan adanya sudut antara CO dan C, maka timbul struktur sekunder yang disebut alfa Helix dan Beta sheet. Struktur sekunder dipertahankan oleh ikatan hidrogen yang lemah dan iktan disulfida yang kuat. Termasuk struktur sekunder adalah bend, turn, dan loop H H | | – N – C – | CH2 | S | S | CH2 | – N – C – | | H H * L a in O || C – ik a t a n d is u lf id a C – || O 2 : * H e lix R | C – C – N – || | | O H H : : : : ik a t a n : : H id r o g e n : : H H O | | || – N – C – C | R * L I P IT = - P L E A T E D * K UM P AR AN A C AK = R A N D O M CO IL 4.3.Struktur tersier Struktur tersier suatu protein adalah bentuk tiga dimensi dari suatu polipeptida. Hal ini menunjukkan adanya penempatan ruangan tiga dimensi. Struktur sekunder, seperti helices, sheets, bends, turns, dan loops bergabung membentuk suatu domains berhubungan dalam ruang tiga dimensi. Salt bridge = Ikatan iomik Domain berarti suatu macam struktur bagian dari protein yang mempunyai fungsi yang sama yang bisa terdapat dalam protein lain. Pada temperatur yang tinggi, dan pH yang ekstrim enzim akan mengalami kerusakan atau denaturasi. Struktur protein kecuali yang primer akan mengalami kerusakan. 5.Cara enzim bekerja ditinjau dari struktur tiga dimensi c e la h a k t if = c e la h k a t a lit ik = c e la h p e n g ik a t s u b s t r a t E + S E + K o m p le k s E - S P E : EN Z IM S : S U B S T R AT P : PRO DU K U KU RA N M O LEKU L E : BE SAR U K U RA N M O L E K U L S : K E C IL D A LA M S IS T E M B IO LO G IS : K A D A R E < < K A D A R S U B S T R AT IK ATA N E – S IK ATA N LEM AH Sebelum enzim mengkatalisis substrat menjadi produk, sustrat tersebut harus masuk kecelah atau groove atau disebut juga “active site”, “catalytic site” yang secara fisik bentuk dan besarnya pas atau “fit”. Pada celah tersebut ada dua gugus reaktif yaitu –SH dari cysteine dan –OH dari serin. Gugus tersebut bertindak sebagai pengikat dan katalitik. Ada dua teori tentang bagaimana cara enzim itu bekerja bila ditinjau dari segi fisik atau mekaniknya, yaitu pertama teori “Lock and Key” dari Emil Fischer. Menurut Emil Fischer kesesuaian bentuk antara substrat dan enzim telah ada sebelum terjadi interaksi antara substrat dan enzim (E-S komplek). Namun teori ini tidak bisa menjawab pertanyaan mengapa kalau pH atau temperaturnya dirubah kecepatan reaksinya berubah. Maka diajukan teori kedua oleh Daniel Kushland yang mengatakan bahwa kesesuaian bentuk antara substrat dan enzim terjadi setelah keduanya berinteraksi. Perhatikan gambar berikut! TEORI KUNCI & ANAK KUNCI FISHER TEORI KESESUAIAN IMBAS (KOSHLAND INDUCE FIT THEORY) PERUBAHAN KONFIRMASI (SUSUNAN ATOM DLM RUANG) PENGIKATAN S KESESUAIAN BENTUK FIT = PAS 6.Kofaktor dan koenzim 6.1.Macam kofaktor dan koenzim Enzim yang sederhana hanya terdiri dari protein saja. Namun yang lebih kompleks terdiri dari protein dan kofaktor. Apabila kofaktornya berupa logam, tetap disebut kofaktor. Apabila kofaktornya berupa senyawa organik, maka disebut koenzim. Kofaktor stabil terhadap panas. Biasanya koenzim bukan protein, namun ada yang berupa protein (lihat metabolisme lipida). Kofaktor adalah senyawa yang diperlukan oleh enzim kelas satu, dua, lima dan enam agar enzimenzim tersebut bisa bekerja. Enzim dan kofaktor berikatan secara kovalen (kuat) atau ada yang berikatan lemah. Enzim yang memerlukan kofaktor, terlebih dahulu mengikat kofaktornya sebelum melakukan proses katalisis. Mg++ Contoh: GLUKOSA + ATP • GLUKOSA–6P + ADP Heksokinase Ada beberapa mineral yang berikatan kuat dengan enzim, misalnya: – Zn++ Karboksipeptidase – Mg++ Heksokinase – Fe++ / Fe+++ Sistem sitokhrom Apabila enzim memerlukan koenzim maka bersama-sama disebut Holoenzim. Enzim tanpa koenzimnya disebut Apoenzim yang tidak aktif. Apabila antara enzim dan koenzim membentuk ikatan yang kuat maka koenzim tersebut disebut juga gugus prostetik. Contoh: Katalase. Gugus prostetiknya suatu heme Selama enzim bekerja, Heme mengalami oksidasi dan reduksi Fe++ Fe+++ Apabila ikatan antara enzim dan koenzimnya lemah maka koenzim tersebut disebut juga kosubstrat. Laktat dehidrogenase PIRUVAT + NADH + H+ LAKTAT + NAD+ Dalam reaksi di atas NADH disebut Kosubstrat 6.2.Fungsi koenzim Sebagai pembawa suatu gugus, atom, atau elektron. NAD+ membawa H – NADP+ membawa H – FMN membawa H – FAD membawa H – KoQ membawa H – HEME membawa elektron – ATP membawa Fosfat (P) PIRIDOKSAL FOSFAT membawa -NH2 KoA membawa Amil Sebagian besar koenzim adalah bagian dari struktur atau molekul suatu vitamin. Vitamin B termasuk koenzim – TPP THIAMIN – NAD NIASIN – NADP NIASIN – FAD RIBOFLAVIN – KoA ASAM PANTOTENAT Enzim disekresi dalam keadaan tidak aktif yang disebut Zymogen atau Proenzim, yang bertujuan untuk melindungi organ tubuh dan menyediakan bahan setengah jadi. Contoh: Pepsinogen disekresi oleh Chief sel lambung, diaktifkan oleh HCl lambung menjadi Pepsin. 7.Isosim (Isozyme) Isosim adalah suatu enzim yang mengkatalisis satu reaksi namun secara fisik ada beberapa macam yang dibedakan misalnya dengan pemisahan memakai elektroforesis. Contoh Laktat dehidrogenase, ada lima macam • • MENGKATALISIS REAKSI YG. SAMA CONTOH : LAKTAT DEHIDROGENASE (LDH) • • T.D. 4 RANTAI POLIPEPTIDA 2 JENIS RANTAI : M H ISOZIM LDH ADA 5 : I1=H4 I2=H3M I3=H2M2 I4=HM3 I5=M4 M & H : SUSUNAN ASAM AMINO BERBEDA DISTRIBUSI ISOZIM DLM. JARINGAN BERVARIASI DAPAT MEMBANTU DIAGNOSIS PENYAKIT SIFAT FISIK, KIMIA, IMUNOLOGIS SEDIKIT BEDA K a to d a (-) Anoda (+ ) + LDH – Ja n t A N B H a ti C 5 4 3 2 A B C 1 5 I5: M 4 I1= H E le k t ro fo re sis S e lu l o s a a s e t a t p H 8 ,6 4 4 3 2 1 A – In fa rk m io k a rd B – N C – p e n y a k it h a t i 44 LDH elektroforesis 8.Pengukuran kadar enzim dalam plasma 8.1.Enzim plasma non fungsional Kadar enzim dalam plasma dapat diukur. Apabila suatu enzim berfungsi di luar plasma, misalnya di lumen usus contoh amilase pankreas maka kadar enzim tersebut dalam plasma sangat rendah. Enzim amilase atau enzim yang fungsinya bukan di dalam plasma disebut juga enzim plasma non fungsional. Enzim yang lain yang termasuk enzim plasma non fungsional diantaranya: SGOT (serum glutamat oksaloasetat transaminase), SGPT (serum glutamat piruvat transaminase), LDH (laktat dehidrogenase). 8.2.Enzim plasma fungsional Enzim plasma fungsional memang berfungsi dalam plasma dan kadarnya dalam plasma agak tinggi misalnya lipoprotein lipase, enzim-enzim yang terlibat dalam proses pembekuan darah. Apabila organ yang membuat enzim tersebut mengalami radang, contoh hepatitis, maka kadar SGOT dan SGPT dalam darah akan meningkat. Enzim-enzim berikut akan meningkat apabila organ yang bersangkutan mengalami radang, kerusakan atau menjadi kanker: Pankreas : amilase, lipase Tulang : fosfatase alkali Prostat : fosfatase asam Hepar : SGOT SGPT LDH Otot : SGOT CPK (Creatine phospho kinase) LDH Paru : LDH Pemeriksaan enzim-enzim tersebut di atas dapat membantu menegakkan diagnosis, misalnya seseorang yang mual-mual dan dicurigai menderita hepatitis, diperiksa SGOT SGPTnya. Menurut National Academy of Clinical Biochemistry (NACB) tahun 2005, total CK yang disebut juga CPK (Cretine Kinase atau Creatine Phospho Kinase), LDH, dan SGOT tidak digunakan lagi sebagai marker untuk serangan jantung atau adanya sel dari jantung yang mengalami nekrosis atau kematian sel sebab kurang spesifik. Isozim dari CK atau CPK yang disebut CKP 2 atau CK-MB lebih baik, karena 90% berasal dari otot jantung, sedangkan yang 10 % bisa berasal dari usus halus, lidah, diafrahma, dan uterus. Sekarang telah ditemukan kanker marker untuk organ tertentu. 9.Kinetika Enzim Kinetika enzim adalah suatu bagian dari ilmu Biokimia yang mempelajari pengukuran kecepatan dari reaksi Biokimia atau reaksi yang dikatalisis enzim dan faktor-faktor yang mempengaruhinya. Untuk mempertahankan homeostasis tubuh diperlukan beberapa macam enzim yang bekerja secara utuh, berkesinambungan, dan dalam keadaan keseimbangan. Dengan mempelajari kinetika enzim, kita bisa mengetahui bagaimana suatu stres fisiologi, misalnya gangguan keseimbangan asam basa bisa diarahkan ke keadaan semula atau dalam keseimbangan fisiologis. Keseimbangan fisiologis yang dimaksud adalah kadar senyawa tertentu dikembalikan kearah normal. Dengan mempelajari kinetika enzim juga dapat diketahui bagaimana obat-obatan bekerja dalam tubuh untuk mengembalikan kesehatan. Kinetika enzim sangat berperan dalam penemuan obat baru untuk menanggulangi berbagai penyakit. Yang tak kalah pentingnya adalah untuk mengisolasi suatu enzim diperlukan ilmu kinetika enzim. Pengukuran aktivitas enzim: ( S P) Berdasar pada aktivitasnya. 1 IU, micromol P/menit Pada enzim tertentu : 0 t Gambar 2 Kurve Perjalanan dari suatu reaksi enzimatik 1 IU, perobahan kepekatan pada 340nm sebesar 0,001 per menit. Kecepatan reaksi : jumlah substrat yg diubah per satuan waktu jumlah produk yg terbentuk per satuan waktu Kec di 0 = tg A = __ = Kec di A A’ Kec di B = tg S ( C B P) A Gambar 3 0 A’ B’ C’ t Kec rata-rata B d i B = __ B’ Kec rata-rata C di C = __ C’ Kecepatan pada titik 0 adalah tangen sudut alfa A / A’, demikian pula untuk titik B dan C. Makin kecil sudutnya makin pelan jalan reaksinya, sehingga apabila datar maka tidak ada reaksi. Kecepatan awal (Vo): Pada waktu kadar substrat, produk dan enzim, suhu, pH dapat diketahui dengan tepat. Pada awal reaksi. Pada waktu kurve perjalanan masih lurus. Biasanya berkurangnya substrat < 10%. Cara mengukur kecepatan awal: Ambil bagian pada kurve perjalanan yang masih berupa garis lurus (pada awal reaksi). Kecepatan awal berbanding lurus dengan kadar enzim Dalam sistem biologi, enzim hanya mempercepat tercapainya keseimbangan tetapi tidak mengubah konsentrasi akhir dari masing-masing reaktan. Faktor-faktor yang mempengaruhi kecepatan reaksi atau kecepatan katalisis suatu enzim: 9.1.Kadar substrat. V = K3[ES] tidak ada bagian dari ES yang kembali ke E + S Kecepatan pembentukan ES = K1[E][S]…………………………….1) Kecepatan pemecahan atau dissosiasi ES = (K2 + K1)[ES]…………2) L adalah keadaan keseimbangan (steady state). Kecepatan pembentukan ES tetap konstan sewaktu S dan P berubah. K1 [E][S] = K2 + K3) [ES] K1 [E][S] [ES] = ----------K2 + K3 K2 + K3 Km = ------------- Michaelis constant K1 Persamaan Michaelis-Menten bisa ditulis juga sebagai berikut: Vomax x [S] Vo = -----------------Km + [S] Gambar 4 Ada tiga keadaan yang bisa kita pelajari dari diagram parabola di atas, yaitu: 1.Apabila kadar S atau [S] sangat kecil bila dibandingkan dengan Km 2.Apabila kadar S atau [S] sama dengan harga Km 3.Apabila kadar S atau [S] sangat besar bila dibandingkan dengan Km 9.1.1.[S] <<< Km Gambar 5 Apabila [S] sangat kecil dalam rumus bisa dianggap nol, sehingga rumusnya berubah menjadi: Vomax x [S] Vo = -----------------Km Vo max Vo = ------- x [S] Km Artinya kecepatan awal berbanding lurus dengan kadar substrat 9.1.2.[S] = Km Rumus persamaan berubah menjadi: Vomax x [S] [S] Vo = ------------------ = Vomax x -----[S] + [S] 2 [S] 1 Vo = ----- x Vomax = ½ Vomax 2 9.1.3.[S] >>> Km Rumus persamaan berubah menjadi: Vomax x [S] Vo = ------------------ = Vomax [S] Gamabr 6 9.1.4.Pengukuran harga Km Untuk membuat suatu hiperbola dalam diagram diatas sedikitnya diperlukan sembilan titik. Lineweaver-Burk mengambar kembali, namun bukan sebagai hiperbola akan tetapi sebagai suatu garis lurus. Persamaan Hiperboilanya diubah menjadi persamaan garis linier. 1 Km 1 1 --- = ----- x --- + --Vo Vomax [S] Vomax Gambar 7 Double reciprocal atau Lineweaver-Burk Plot. 9.2.Pengaruh pH terhadap reaksi enzimatik Enzim adalah suatu protein, yang bermuatan. Muatan enzim dipengaruhi oleh pH. Pada pH rendah enzim bermuatan positif, sedangkan pada pH yang tinggi enzim akan O + H 3N C C OH R O + H 3N C C OR pH = 7 pH = 3 O H2 N pH = 11 C C O- R bermuatan negatif. Apabila suatu polipeptida atau protein digantikan dengan suatu asam amino, maka tidaklah berbeda artinya atau maknanya dalam hal muatan yang dapat dipengaruhi oleh pH. Lihat diagram di atas! Karena pKa dari suatu karboksil berkisar sekitar 5 , maka pada pH 3 sebagian besar karboksil belum berdissosiasi. Pada pH sekitar 5 kira-kira separuh berdissosiasi. pKa NH3 sekitar 9, jadi pada pH 11 sebagian besar NH3 berdissosiasi menjadi NH2 dan H+. Perubahan pH akan menyebabkan perubahan muatan. Perubahan muatan akan mengubah bentuk tiga dimensi protein. Perubahan bentuk akan merubah ikatan ES komplek, selanjutnya akan merubah kecepatan reaksi enzimatik. pH optimum adalah pH dimana enzim bekerja maksimal. Gambar 8 Contoh : Pepsin mempunyai pH optimum 1,6 (a) Glukosa 6 fosfatase mempunyai pH optimum 7,8 (b) 9.3.Pengaruh temperatur terhadap reaksi enzimatik Kenaikan temperatur dapat meningkatkan kecepatan reaksi enzimatik hingga temperatur tententu dalam mahluk hidup. Pada manusia reaksi enzimatik akan meningkat seiring meningkatnya temperatur tubuh hingga maksimum 45oC atau lebih sedikit. Karena di atas 0 50 C temperatur tersebut protein akan kehilangan ikatan 0 60 C 0 700 C 40 C 0 80 C S nonkovalennya sehingga struktur tiga dimensinya ( P) berubah hingga protein mengalami kerusakan t2 t 0 atau denaturasi, enzim menjadi tidak aktif lagi. Pada awal reaksi kecepatan reaksi (Vo) secara V Rata-rata S = __ t __S t teoritis hampir berbanding lurus dengan temperatur, karena pada awal reaksi yang berlaku adalah 0 40 50 0 600 70 0 80 0 Suhu reaksi non enzimatik. Gambar 9 Pada gambar di atas, makin tinggi temperatur makin cepat rusak suatu enzim (∆S / ∆P versus). Enzim pada percobaan tersebut mempunyai kecepatan rata-rata tertinggi pada temperatur 50oC Q10, atau koeffisien temperatur adalah faktor yang menunjukkan peningkatan kecepatan reaksi enzimatik dalam proses biologis pada tiap kenaikan temperatur 10oC. Biasanya menjadi dua kali lipat tiap kenaikan 10oC. Ini bisa terjadi pada binatang seperti kadal atau ikan. Temparatur tubuhnya bisa berubah sesuai dengan temperatur sekitar. Suatu cara untuk mempertahankan hidup. 9.4.Pengaruh Inhibitor. Inhibitor adalah senyawa yang menghambat aktivitas enzim. Inhibitor mengurangi kecepatan reaksi enzimatik. Inhibitor bisa ditemukan secara natural atau sengaja dibuat manusia misalnya obat-obatan, atau senyawa untuk penelitian. Ada dua macam inhibitor: 9.4.1.Inhibitor kompetitif. Inhibitor kompetitif mempunyai struktur mirip dengan substrat, sehingga bisa pas (fit) masuk ke active site atau tempat katalitik. Dengan demikian berkompetisi dengan substrat untuk mencapai tempat katalitik, sehingga kecepatan reaksi menjadi lebih lambat. Penambahan kadar substrat akan mengembalikan kecepatan reaksi. Hambatan biasanya bersifat sementara dan reversibel. Inhibitor kompetitif meningkatkan harga Km, Suksinat dehidrogenase COOH CH 2 CH 2 COOH As.Suksinat COOH HOOC As. Fumarat COOH COOH CH 3 CH 2 CH 2 COOH C H2 CH 2 COOH COOH COOH CH 2 As.Malonat As.Propionat COOH As.Oksalat As.Glutarat tetapi tidak mempengaruhi Vomax. Jadi kecepatan reaksi enzimatik bisa mencapai sama seperti kecepatan semula apabila substrat ditambah cukup tinggi. Suksinat dehidrogenase dapat dihambat secara kompetitif oleh asam glutamat, 8.4.2.Inhibitor nonkompetitif. Molekul inhibitor nonkompetitif berbeda strukturnya dengan substrat dan tidak mempunyai struktur yang sesuai dengan tempat katalitik. Inhibitor ini mengikat enzim dilain tempat, dan merubah bentuk enzim. Substrat tidak bisa lagi masuk ke tempat katalitik. Inhibitor nonkompetitif mengurangi jumlah enzim yang aktif. Inhibitor nonkompetitif menurunkan harga Vomax tapi tidak mempengaruhi nilai Km. Inhibitor ini biasanya mengikat kuat enzim sehingga tidak reversibel atau irreversibel. Contoh heavy metal ions Hg++ racun sianida (cyanide). Banyak racun saraf bekerja seperti ini. 9.4.3.Inhibitor feedback (allosteric effectors) Aktivitas beberapa enzim dapat diatur oleh molekul tertentu yang dapat mengikat enzim ditempat tertentu yang disebut tempatregulator spesifik (allosteric site). Molekul yang berbeda dapat menghambat atau mempercepat (activate) kecepatan reaksi enzimatik. Biasanya enzim tersebut terletak pada awal reaksi dalam rangkayan reaksi (jalur atau alur reaksi) yang panjang. Enzim tersebut sering diaktivasi oleh sustrat pada awal reaksi dan dihambat oleh hasil jalur reaksinya.Proses ini disebut feedback inhibition. 10.Bahan bacaan 10.1.Harper's Illustrated Biochemistry, by Robert K. Murray, David A Bender, Kathleen M. Botham, Peter J. Kennelly, Victor W.Rodwell, P. Anthony Wei., twenty eigth edition, 2009 10.2.Principles of Biochemistry by Lehninger A.L. et al, third edition, 2000 10.3.Biochemistry by Lubert Stryer, fourth edition, 2000 10.4. http://www.biologymad.com/resources/Ch%204%20-%20Enzymes.pdf Latihan soal: 1.Enzim 1.Apakah makromolekul itu? Supra molekul? 2.Apakah fungsi enzim? 3.Sebutkan ciri-ciri enzim! 4.Bagaimana enzim bekerja ditinjau dari segi Energi? 5.Apa artinya ∆ G < 0 ? 6.Apaka energi akttivasi itu? 7.Terangkan apa artinya “active side”! 8.Ada enam kelas enzim, sebutkan apa saja! 9.Berilah contoh struktur protein sekunder! Dipertahankan oleh ikatan apa saja? 10.Terangkan Teori Ficher dan teori Koshland tentang cara kerja enzim menurut bentuk protein yang empat demensi! 11.Apa kofaktor itu? Apa bedanya dengan koenzim? 12.Apa Holo-enzim itu? 13.Sebutkan koenzim pembawa H! 14.Apa artinya enzim non plasma fungsional? 15.Kalau terjadi serangan jantung, enzim apa yang mungkin kadarnya meningkat dalam plasma? 2.Kinetika Enzim 2.1.Tulislah rumus Michaelis Menten! 2.2.Apabila kedalam larutan ditambah substrat yang sangat banyak, berapakah kecepatan V0 nya? 2.3.Kalau [S] = Km berapakah V0? 2.4.Pada pH yang tinggi bagaimana muatan sutau protein dalam larrutan? 2.5.Sebutkan ciri-ciri Inhibitor kompetitif reversibel! 2.6.Sebutkan beberapa contoh inhibitor kompetitif revesibel dari asam suksinat terhadap enzim suksinat dehidrogenase! 2.7.Bagaimana pengaruh inhibitor kompetitif reversibel terhadap Kmnya?








