Enzim
advertisement
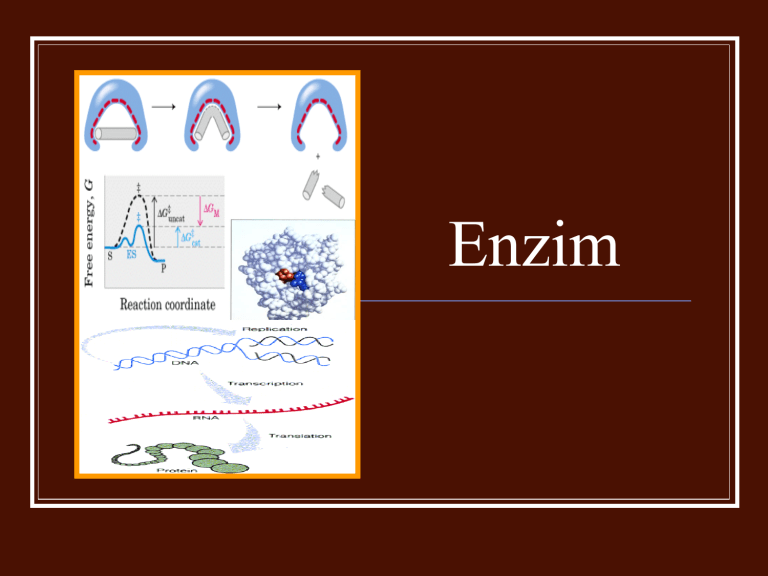
Enzim Definisi Umum Dlm system biologi reaksi kimia selalu memerlukan katalis. Tanpa katalis sangat lama shg diperlukan Enzim yg berfungsi sbg biokatalisator protein yang berfungsi untuk mempercepat reaksi dengan jalan menurunkan tenaga aktivasi dan tidak mengubah kesetimbangan reaksi, serta bersifat sangat spesifik. Katalis yg paling efisien mampu mempercepat reaksi 1020 kali lbh cepat Enzim bersifat sangat spesifik, baik jenis reaksi maupun substratnya , Tripsin Trombin Enzim tidak ikut bereaksi dgn substrat atau produknya Aktifitas dapat dikontrol sesuai dengan kebutuhan organisme itu sendiri Contoh : enzim yg mengkatalisis reaksi pertama pada suatu siklus biosintesis biasanya di hambat oleh produk akhirnya (feedback inhibition) bbrp enzim disintesis dlm btk tidak aktif. Dan akan diaktifkan oleh kondisi dan waktu yang sesuai (enzim allosterik) . prekursor yg tidak aktif disebut zymogen Tiga sifat utama enzim : Kemampuan katalitiknya Spesifisitas Kemampuan untuk diatur (regulasi) Bagian-bagian enzim Kita mengenal istilah: Holoenzim Apoenzim/ apoprotein Gugus prostetik Koenzim Kofaktor Bagian-bagian enzim (lanjutan) Seperti halnya protein lain, enzim memiliki BM antara 12,000 – 1 juta kd Beberapa enzim tidak membutuhkan molekul kimiawi lain untuk aktifitasnya, beberapa membutuhkan kofaktor / koenzim Kofaktor ion-ion anorganik yg dibutuhkan enzim untuk melakukan fungsinya Koenzim molekul organik (komplek) yang dibutuhkan enzim untuk melakukan fungsinya Koenzim atau kofaktor yang terikat sangat kuat bahkan terikat dengan ikatan kovalen dengan enzim gugus prostetik Enzim aktif lengkap dengan semua komponennya holoenzim Bagian yang terdiri dari protein saja pada suatu enzim Apoenzim / apoprotein Fungsi koenzim adalah sebagai karier sementara dari gugus fungsional yg berperan dalam reaksi enzimatis tersebut. Klasifikasi enzim Bagaimana enzim bekerja Reaksi tanpa enzim: Lambat Membutuhkan suhu yang tinggi Tekanan yang tinggi Reaksi enzimatis Enzim memberikan suatu lingkungan yg spesifik di dalam sisi aktifnya, sehingga reaksi secara energetik dapat lebih mudah terjadi Perbedaan antara energi reaktan (fase awal) dgn energi produk (fase akhir) selisih energi bebas standar (ΔGº) Agar reaksi berjalan spontan, bagaimanakah nilai ΔGº Enzim mempercepat reaksi tetapi tidak mengubah keseimbangan reaksi atau ΔGº Kesetimbangan reaksi antara Reaktan dan produk mencerminkan perbedaan energi bebas pada fase awal Kecepatan reaksi tergantung energi aktifasi ΔGº≠ suatu pasokan energi dibutuhkan untuk mengawali suatu reaksi Energi aktifasi untuk reaksi yg dikatalis dengan enzim lebih rendah dr reaksi tanpa enzim Glukosa + 6 O2 6 CO2 + 6 H2O ΔGº = -2880 kJ/mol Enzim penting untuk menurunkan energi aktifasi untuk memulai suatu reaksi Enzim mengikat substrat menciptakan jalan reaksi yg berbeda yg mempunyai fase transisi lebih rendah dbanding reaksi tanpa enzim Inti dr reaksi katalisis ikatan yg spesifik pd fase transisi Substrat terikat interaksi nonkovalen E + S ↔ ES ↔ EP ↔ E + P Kekuatan enzim dlm mengkatalisis suatu reaksi kemampuan enzim membawa substrat bersama-sama pd orientasi yang tepat untuk terjadinya suatu reaksi Substrat terikat pd sisi aktif y/ cekukan pd protein yg berisi asam amino yg penting untuk tjdnya suatu reaksi kimia Karakteristik sisi aktif enzim merupakan bagian kecil dari enzim sisi aktif merupakan suatu cekukan yang bersifat 3 dimensi. memberikan lingkungan mikro yg sesuai utk terjadinya suatu reaksi kimia substrat terikat pada sisi aktif dengan interaksi / ikatan yang lemah. Spesifitas enzim dipengaruhi oleh asam amino yg menyusun sisi aktif suatu enzim Gambar sisi aktif enzim dan asam amino yang terlibat Sisi aktif mempunyai 2 bagian yg penting: Bagian yang mengenal substrat dan kemudian mengikatnya Bagian yang mengkatalisis reaksi, setelah substrat diikat oleh enzim Asam amino yang membentuk kedua bagian tersebut tidak harus berdekatan dalam urutan secara linear, tetapi dalam konformasi 3D mereka berdekatan Teori untuk menjelaskan kerja enzim: Lock and Key analogy Enzim memiliki struktur sisi spesifik yang cocok dengan substrat. Mampu menerangkan spesifitas enzim ttp tidak dapat menerangkan stabilitas fase transisi enzim Induced Fit theory mempertimbangkan fleksibilitas protein, sehingga pengikatan suatu substrat pada enzim menyebabkan sisi aktif mengubah konformasinya sehingga cocok dgn substratnya. dpt menerangkan fase transisi komplek ES Lock and key model Induced Fit model Faktor-faktor yg mempengaruhi kerja enzim pH setiap enzim mempunyai pH optimum utk bekerja. contoh : pepsin pH 2, amylase pH 7.0 Temperatur setiap kenaikan suhu 10˚C (sampai 40˚C), kecepatan reaksi naik 2 x lipatnya dan reaksi terhambat dan berhenti pada 60˚C. Mengapa? [S] dan atau [E] Kinetika Reaksi Enzimatis K1 E+S K2 ES E+P K-1 K1 : kecepatan konstan pembentukan ES komplek K2 : kecepatan konstan konfersi ES komplek ke P K-1 : kecepatan konstan pemecahan ES komplek ke E bebas Enzim sangat efisien dalam mengkatalis suatu reaksi, steady state (keseimbangan reaksi) segera dapat tercapai apabila : Kecepatan pembentukan ES komplek sama dengan kecepatan pemecahannya K-1 + K2 = Km K2 Vmax [S] V= Km + [S] konstanta Michaelis Persamaan Michaelis-Menten Penghambatan Reaksi Enzimatis Kerja enzim dapat dihambat secara reversible atau irreversible Irreversible pembentukan atau pemecahan ikatan kovalen dalam enzim Reversible suatu senyawa dapat terikat dan kemudian dpt lepas kembali Reversible inhibitor ini dpt dibagi : competitive non-competitive un-competitive penghambatan competitive inhibitor bersaing dgn substrat untuk terikat pd sisi aktif Biasanya inhibitor berupa senyawa yg menyerupai substratnya, & mengikat enzim membentuk komplek EI krn terikat scr reversible penghambatan nya bias, yaitu ketika ditambah substrat maka penghambatan berkurang penghambatan non-competitive inhibitor terikat pada sisi lain dari enzim (bkn sisi aktif) jadi tidak memblok pembtkan enzim-substrat komplek Enzim mjd tidak aktif ketika inhibitor terikat walau enzim mengikat substrat Inhibitor mengurangi konsentrasi enzim yg aktif, sehingga mempengaruhi Vmax –nya Penghambatan un-competitive Terikat pd sisi selain sisi aktif enzim Berbeda dgn noncompetitive inhibitor ini hanya terikat pd komplek ES Sehingga tidak terikat pd enzim bebas Vmax berubah, dan Km juga berubah Enzim allosterik Enzim allosterik mengalami perubahan konformasi sebagai respon terhadap pengikatan modulator efektor Allosterik enzim biasanya lebih komplek dari non allosterik enzim, memiliki sub unit lebih dari satu Memiliki satu atau lebih sisi allosterik / regulator untuk mengikat modulator. Seperti halnya substrat, setiap regulator memiliki sisi pengikatan yang berbeda Untuk enzim homotropik sisi aktif dan sisi regulator sama











