modul praktikum kimia dasar lingkungan
advertisement

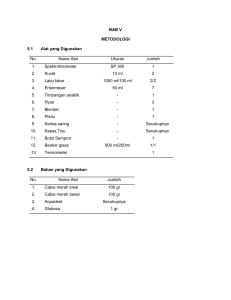
MODUL PRAKTIKUM KIMIA DASAR LINGKUNGAN Dosen Pengampu : Angga Dheta Sirajuddin Aji, S.Si, M.Si LABORATORIUM TEKNIK SUMBER DAYA ALAM DAN LINGKUNGAN JURUSAN KETEKNIKAN PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN UNIVERSITAS BRAWIJAYA MALANG 2014 TATA TERTIB PRAKTIKUM KIMIA DASAR LINGKUNGAN 1. Wajib memakai jas laboratorium saat praktikum berlangsung. Sebelum memasuki laboratorium jas lab wajib di kancingkan. 2. Wajib mengenakan baju lengan panjang dan celana/rok panjang saat praktikum 3. Wajib mengenakan sepatu tertutup dan berkaos kaki 4. Wajib mengenakan ID card praktikum kimia dasar lingkungan 5. Wajib membawa masker dan sarung tangan 6. Praktikan harus membawa modul, tiket masuk, buku pre-post dan kartu kendali saat praktikum 7. Toleransi keterlambatan 5 menit, jika terlambat tidak diperkenankan mengikuti pretest 8. Jika praktikan tidak dapat hadir saat praktikum karena sakit, harus memberikan surat dokter kepada Co praktikum kimia dasar lingkungan. Jika mengganti jadwal praktikum wajib konfirmasi kepada Co praktikum kimia dasar lingkungan dan asisten praktikum yang memegang materi praktikum yang tidak di ikuti 9. Jika ada kerusakan alat yang disebabkan oleh praktikan, maka praktikan wajib mengganti 10. Praktikan dilarang makan, minum dan merokok pada saat praktikum berlangsung 11. Praktikan harus men-silent gadget selama praktikum berlangsung 12. Pengumpulan laporan dilakukan 4 x 24 jam. Pengumpulan laporan dilakukan secara kolektif di ketua kelompok. Keterlambatan pengumpulan akan mendapat penggurangan poin PENGENALAN ALAT DAN BUDAYA K3 I. II. TUJUAN - Mampu mengidentifikasi beberapa macam alat dan menggunakannya dengan benar - Mengenalkan peralatan Kesehatan dan Keselamatan Kerja (K3) di laboratorium - Mampu menggunkan peralatan kesehatan dan keselamatan kerja (K3) di laboratorium dengan benar PENGENALAN ALAT Berikut akan dibicarakan mengenai beberapa alat yang akan digunakan dalam praktikum kimia dasar lingkungan : 1. Pipet volume. Pipet ini terbuat dari kaca dengan skala/volume tertentu, digunakan untuk mengambil larutan dengan volume tepat sesuai dengan label yang tertera pada bagian yang menggelembung (gondok) pada bagian tengah pipet. Gunakan propipet atau bulb untuk menyedot larutan. 2. Pipet ukur. Pipet ini memiliki skala, digunakan untuk mengambil larutan dengan ukuran tertentu. Pipet ini lebih presisi jika dibandingkan dengan pipet volume. Gunakan bulb atau katet penghisap untuk menyedot larutan, jangan dihisap dengan mulut. 3. Pipet tetes. Berupa pipa kecil terbuat dari plastik atau kaca dengan ujung bawahnya meruncing serta ujung atasnya ditutupi karet. Berguna untuk mengambil cairan dalam skala tetesan kecil. 4. Bulb atau Bola Hisap. Alat ini terbuat dari karet, digunakan untuk menghisap larutan. Biasanya di pasang pada pipet ukur dan pipet volume. 5. Labu ukur (labu takar). Digunakan untuk menakar volume zat kimia dalam bentuk cair pada proses preparasi larutan. Alat ini tersedia berbagai macam ukuran. 6. Gelas ukur, digunakan untuk mengukur volume zat kimia dalam bentuk cair. Alat ini mempunyai skala, tersedia bermacam-macam ukuran. Tidak boleh digunakan untuk mengukur larutan/pelarut dalam kondisi panas. Perhatikan meniskus pada saat membaca skala. 7. Gelas beaker, alat ini bukan alat pengukur (walaupun terdapat skala, namun ralatnya cukup nesar). Digunakan untuk tempat larutan dan dapat juga untuk memanaskan larutan kimia. Untuk menguapkan solvent/pelarut atau untuk memekatkan. 8. Buret. Alat ini terbuat dari kaca dengan skala dan kran pada bagian bawah, digunakan untuk melakukan titrasi (sebagai tempat titran) 9. Erlenmeyer. Alat ini terbuat dari alat pengukur, walaupun terdapat skala pada alat tersebut (ralat cukup besar). Digunakan untuk tempat zat yang akan di titrasi. Kadang-kadang boleh juga digunakan untuk memanaskan larutan. 10. Spektrofotometer. merupakan alat yang digunakan untuk mengukur absorbansi dengan cara melewatkan cahaya dengan panjang gelombang tertentu pada suatu obyek kaca atau kuarsa yang disebut kuvet. Sebagian dari cahaya tersebut akan diserap dan sisanya akan dilewatkan. Nilai absorbansi dari cahaya yang dilserap sebanding dengan konsentrasi larutan di dalam kuvet. 11. Kuvet. Kuvet serupa dengan tabung reaksi, namun ukurannya lebih kecil. Kuvet tidak boleh dipanaskan. Bahan dapat dari silika (quartz), polistirena atau polimetakrilat. 12. Tabung reaksi. Sebagai tempat untuk mereaksikan bahan kimia dalam skala kecil dan dapat digunakan sebgai wadah untuk perkembangbiakan mikroba. 13. Corong. Biasanya terbuat dari gelas namun ada juga yang terbuat dari plastik. Digunakan untuk menolong pada saat memasukkan cairan ke dalam suatu wadah dengan mulut sempit, sepeti : botol, labu ukur, buret dan sebagainya. 14. Timbangan analitik. Digunakan untuk menimbang masa suatu zat padat. Timbangan ini lebih akurat dibandingkan timbangan analog. 15. Gelas alroji. Digunakan untuk tempat bahan padatan saat menimbang, mengeringkan bahan, dll. 16. Pengaduk gelas, digunakan untuk mengaduk larutan, campuran, atau mendekantir (memisahkan larutan dari padatan). 17. Spatula. Digunakan untuk mengambil bahan padat. III. PENGENALAN BUDAYA KESEHATAN DAN KESELAMATAN KERJA (K3) DI LABORATORIUM Ketrampilan bekerja di laboratorium maupun dunia kerja dapat diperoleh melalui kegiatan praktikum. Disamping itu, ada kemungkinan bahaya yang terjadi di laboratorium seperti adanya bahan kimia yang karsinogenik, bahaya kebakaran, keracunan, sengatan listrik dalam penggunaan alat listrik (kompor, oven, dll). Disamping itu, orang ynag bekerja di laboratorium dihadapkan pada resiko yang cukup besar, yang disebabkan karena setiap percobaan digunakan: 1. Bahan kimia ynag mempunyai sifat mudah meledak, mudah terbakar, korosif, karsinogenik, dan beracun. 2. Alat gelas yang mudah pecah dan dapat mengenai tubuh. 3. Alat listrik seperti kompor listrik, yang dapat menyebabkan sengatan listrik. 4. Penangas air atau minyak bersuhu tinggi yang dapat terpercik. Untuk mencegah terjadinya kecelakaan di laboatorium, hal yang harus dilakukan pada saat bekerja di laboratorium adalah: 1. Tahap persiapan a. Menetahui secara pasti (tepat dan akurat) cara kerja pelaksanaan praktikum serta hal yang harus dihindari selama praktikum, dengna membaca petunjuk praktikum. b. Mengetahui sifat bahan yang akan digunakan sehingga dapat terhindar dari kecelakaan kerja selama di laboratorium. Sifat bahan dapat diketahui dari Material Data Sheet (MSDS). c. Mengetahui peralatan yang digunakan serta fubgsi dan cara penggunaanya. d. Mempersiapkan alat pelindung diri seperti jas praktikum lengan panajng, kacamata, sarung tangan karet, sepatu, dan masker, dll. 2. Tahap Pelaksanaan a. Mengenakanpelindung diri b. Mengambil dan memeriksa alat dan bahan yang akan digunakan c. Menggunakan bahan kimia seperlunya, jangan berlebihan karena dapat mencemari lingkungan d. Menggunakan peralatan percobaan dengan benar. e. Membuang limbah percobaan pada tempat yang sesuai, disesuaikan dengan kategori limbahnya f. Bekerja dengan tertib, tenang dan hati-hati, serta catat data yang diperlukan 3. Tahap Pasca Pelaksanaan a. Cuci peralatan yang digunakan, kemudian dikeringkan dan dikembalikan ke tempat semula b. Matikan listrik, kran air, dan tutup bahan kimia dengan rapat (tutup jangan tertukar) c. Bersihkan tempat atau meja praktikum IV. Selain pengetahuan mengenai penggunaan alat dan teknis pelaksanaan di laboratorium, pengetahuan resiko bahaya dan pengetahuan sifat bahan yang digunakan dalam petcobaan. Sifat bahan secraa rinci dan lengkap dapat dibaca pada Material Data Sheet (MSDS) yang dapat di download di internet. Berikut ini sifat bahan berdasarkan kode gambar yang ada pada kemasan bahan kimia: MATERI 1 ASIDI ALKALIMETRI I. Tujuan 1. Membuat larutan standar HCL 0,1 M 2. Membuat larutan standar NaOH 0,1 M dan standar primer H2C2O4 3. Melakukan standarisasi larutan HCL 0,1 M dan NaOH 0,1 M 4. Menggunakan larutan standar NaOH 0,1 M untuk menetapkan kadar asam asetat cuka perdagangan. II. Dasar Teori 2.1. Analisi Volumetri Analisis volumetri adalah suatu analisis kimia kuantitatif untuk menentukan banyaknya suatu zat dalam volume tertentu dengan mengukur banyaknya volume larutan standar yang dapat bereaksi secara kuantitatif dengan zat yang akan ditentukan. Penentuan konsentrasi zat atau larutan dilakukan dengan mereaksikannya secara kuantitatif dengan larutan lain pada konsentrasi tertentu. Larutan standar primer merupakan larutan yang telah diketahui konsentrasinya (molaritas atau normalitas) secara pasti melalui pembuatan langsung.Larutan standar primer berfungsi untuk menstandarisasi (membakukan) atau untuk memastikan konsentrasi larutan tertentu yang konsentrasinya belum diketahui (larutan standar sekunder). Larutan standar sekunder (titran) biasanya ditempatkan pada buret yang kemudian ditambahkan kedalam larutan zat yang telah diketahui konsentrasinya (larutan standar primer). Proses penmabahan larutan standar sekunder (titran) kedalam larutan yang akan ditentukan sampai terjadi reaksi sempurna disebut titrasi. Sedangkan, saat dimana reaksi sempurna tercapai disebut titik ekivalen atau titik akhir titrasi. Pada proses titrasi ditambahkan indicator kedalam larutan standar primer untuk mengetahui perubahan warna sebagai indikasi bahwa titik ekuivalen titrasi tealh tercapai. Zat yang dapat digunakan sebagai larutan standar primer harus memenuhi syarat berikut: a. Kemurniannya tinggi b. Stabil (tidak mudah menyerap H2O atau CO2, tidak bereaksi dengan udara, tidak mudah menguap, tidak terurai, mudah dan tidak berubah pada pengeringan) c. Memiliki massa molekul (Mr atau BM) yang tinggi. Analisis volumetri dapat dibagi menjadi 3, yaitu: 1. Titrasi netralisasi (asam-basa): yaitu suatu proses titrasi yang tidak mengakibatkan perubahan nilai valensi ataupun terbentuknya endapan (termasuk senyawa konpleks) dari zat-zat yang saling bereaksi. Yang termasuk dalam titrasi netralisasi adalah: a. Titrasi asidimetri: yaitu titrasi terhadap larutan basa bebas dan larutan garam-garam terhidrolisis yang berasal dari asam lemah dengan larutan standar asam. b. Titrasi alkalimetri: yaitu titrasi terhadap larutan asam bebas dan larutan garam-garam terhidrolisis yang berasal dari basa lemah dengan larutan standar basa. Pada titrasi netralisasi, pH titik akhir titrasi ditentukan dengan banyaknya konsentrasi H+ yang berlebihan dalam larutan, sehingga besarnya tergantung pada sifat asam, basa dan konsentrasi larutan. Oleh karena itu, pada penambahan titran (larutan standar sekunder) yang lebih lanjut (pada titik akhir titrasi)akan menyebabkan perubahan nilai pH yang cukup beasar dan indikator yang digunakan harus berubah warna sehingga perubahan indikator asam-basa tergantung pada pH titik ekuivalen. 2. Titrasi pengendapan dan atau pembentukan kompleks: yaitu suatu proses titrasi yang dapat mengakibatkan terbentuknya suatu endapan dan atau terjadinya suatu senyawa kompleks dari zat-zat yang saling bereaksi, yaitu suatu zat yang akan ditentukan dengan larutan standarnya. 3. Titrasi reduksi-oksidasi (redoks): yaitu suatu proses titrasi yang dapat mengakibatkan terjadinya perubahan nilai valensi atau perpindahan elektron antara zat-zat yang saling bereaksi. Dalam hal ini sebagai larutan standarnya adalah larutan dari zat-zat pengoksidasi atau zat-zat pereduksi. 2.2. Larutan Standar Larutan standar adalah larutan yang mengandung suatu zat dengan berat ekivalen dan volume tertentu.Larutan standar dapat dinyatakan dalam Molar (M) atau Normal.Larutan dengan konsentrasi satu normal (1 N) adalah larutan yang mengandung 1 grek suatu zat tertentu dalam volume 1 liter air.Larutan standar dapat dibuat dari zat yang berbentuk cair (missal HCl) atau dari zat yang berbentuk padat atau Kristal (missal NaOH). 1. Pembuatan larutan dari padatan atau Kristal (missal NaOH) 𝐌= 𝐆 𝟏𝟎𝟎𝟎 𝐱 𝐌𝐫 𝐕(𝐦𝐋) Keterangan: M = konsentrasi larutan (Molar) G = massa padatan / Kristal (g) Mr = massa molekul relative (g/mol) V = volume larutan (mL) 2. Membuat larutan dari larutan pekat (missal H2SO4) Untuk membuat larutan dari larutan pekat seperti H2SO4terlebih dahulu perlu diketahui konsentrasi dari larutan pekat tersebut. Konsentrasi larutan pekat dapat dihitung dengan persamaan: 𝐌= 𝛒 𝐱 % 𝐱 𝟏𝟎 𝐌𝐫 Keterangan: M = molaritas % = kadar (%) 𝜌 = berat jenis 𝑀𝑟 = massa molekul relatif Selanjutnya untuk membuat larutan dengan konsentrasi tertentu dari larutan pekat, dapat digunakan rumus pengenceran berikut: V1 x M1 = V2 x M2 Keterangan: V1 = volume larutan yang akan diencerkan M1 = konsentrasi larutan yang akan diencerkan V2 = volume larutan hasil pengenceran M2 = konsentrasi larutan hasil pengenceran 3. Larutan standar dari zat yang berbentuk padat / Kristal a. Larutan standar primer, yaitu larutan standar yang terbuat dari zat padat yang kemurniannya tinggi. Contoh: Na2Co3, Na2C2O4, 2H2O, K2Cr2O7, Na2B4O7.10H2O b. Larutan standar sekunder, yaitu larutan standar yang terbuat dari zat padat yang kemurninannya rendah. Konsentrasi larutan sekunder ditentukan dengan menstandarisasi (membakukan) larutan tersebut dengan larutan standar primer untuk menentukan faktor normalitasnya yaitu perbandingan antara normalitas larutan yang terjadi dengan normalitas yang dikehendaki. Contoh: NaOH, Ba(OH)2, KMnO4, Na2S2O3, dan sebagainya. 4. Pembuatan larutan standar primer Natrium Tetraborat / Boraks (Na2B4O7.10H2O) Untuk membuat 500 mL Natrium Tetraborat 0,05 M; 0,1 N, terlebih dahulu berat Natrium Natrium Tetraboratyang akan digunakan: M= G= G 1000 x Mr V(mL) M x Mr x V 0,05x381x500 = = 9,6 gram 1000 1000 Larutkan 9,6 gram Natrium Tetraborat dengan akuades dalam gelas beker, kemudian pindahkan ke dalam labu takar 500 mL dan tambahkan akuades sampai tanda batas. III. Bahan dan Alat 3.1.Bahan a. HCl 0,1 M b. NaOH 0,1 M c. Indikator fenolftalein (PP) d. Indikator metil orange/ metil merah e. Boraks (Na2B4O7.10H2O) f. Akuades g. H2C2O4.2H2O h. Asam cuka perdagangan 3.2.Alat a. Gelas ukur 25 mL b. Labu takar 100 mL c. Timbangan analitik d. Erlenmeyer e. Pipet tetes f. Buret g. Labu takar 250 mL IV. Cara Kerja 4.1.Membuat Larutan Standar HCl 0,1 M Terlebih dahulu hitunglah konsentrasi HCl pekat (molaritas) menggunakan persamaan: M= ρ x % x 10 Mr Harga ρ, % dan Mr dapat dilihat dari botol reagen. Setelah diketahui molaritasnya, lakukan pengenceran menggunakna persamaan: V1 x M1 = V2 x M2 Ambil x mL (V1) HCl pekat M1 dengan gelas ukur atau pipet ukur dan dimasukkan kedalam labu takar yang mempunyai isi V2 mL, sehingga diperoleh HCl 0,1 M sebanyak V2 mL. jika akan membuat 250 mL maka masukkan HCl pekat tersebut dalam labu takar 250 mLdan tambahkan akuades hingga tanda batas. Kocok perlahan hingga homogen. 4.2. Standarisasi Larutan HCl dengan Boraks (Na2B4O7.10H2O) Persamaan reaksi: Na2B4O7.10H2O + 2HCl 2NaCl + 4H3BO3 + 5H2 1 grammol HCl = 2 x grammol Na2B4O7.10H2O Sehingga larutan Hcl 0,1 M (0,1 N) distandarisasi dengan bantuan boraks 0,05 M (0,1 N) Konsentrasi HCl hasil standarisasi dapat dihitung sebagai berikut: Mboraks = 0,05 M Vboraks = 25 mL VHCl = a mL MHCl= ? VHCl x MHCl mol HCl 2 = = Vboraks x Mboraks mol Boraks 1 MHCl = 2 x Vboraks x Mboraks VHCl Tahapan Kerja: 1. Menimbang Na2B4O7.10H2O yang tepat di dalam botol penimbang 1,9 gram (untuk membuat larutan boraks 0,05 M) 2. Larutkan dalam gelas beker kemudian masukkan ke dalam labu ukur 100 mL, tambahkan akuades sampai volume 100mL (tanda batas) 3. Ambil 10 mL dan masukkan kedalam Erlenmeyer. Beri 2 tetes indicator metal orange 4. Larutan boraks dititrasi dengan HCl dalam buret sapai terlihat perubahan warna dan catatlah volume HCl. Perhitungan: Mr Na2B4O7.10H2O = 381 g/mol Massa boraks = 1,9 gram Mboraks = 0,05 M Vboraks = 10 mL VHCl = a mL MHCl = molaritas HCl MHCl = 2 x Vboraks x Mboraks VHCl 4.3. Membuat Larutan Standar NaOH 0,1 M Untuk membuat larutan NaOH 0,1 M dari kristal NaOH, dihitung dengan persamaan: M= G 1000 x Mr V(mL) 0,1 M = G 1000 x 40g/mol 100 mL G = 0,4 gram Timbang 0,4 gram kristal NaOH kemudian larutkan kristal tersebut dan diencerkan hingga 100 mL (labu takar). Standarisasi NaOH dengan H2C2O4.2H2O (asam oksalat) Persamaan reaksi: H2C2O4+ 2 NaOH Na2C2O4 + 2 H2O 1 grammol NaOH = 2 Grammol H2C2O4 Tahapan Kerja: 1. Timbang dengan tepat asam oksalat dihidrat sebanyak 0,63 gram pada gelas arloji. Larutkan dalam gelas beker kemudian pindahkan ke dalam labu ukur 100 mL dan tambahkan akuades sampai tanda batas. 2. Ambil 100 mL larutan asam oksalat dan masukkan ke dalam Erlenmeyer. 3. Beri 1-2 tetes indicator PP lalu titrasi dengan larutan NaOH yang akan distandarisasikan hingga terjadi perubahan warna. Catat volume NaOH yang ditambahkan. Perhitungan: Mr H2C2O4= 126 g/mol Massa H2C2O4= 0,63 gram MH2C2O4= 0,05 M VH2C2O4= 10 mL V NaOH = a mL Molaritas NaOH = MNaOH MNaOH= 2 x V H2C2O4 x M H2C2O4 V NaOH 4.4. Penggunaan Larutan Standar Asam dan Basa untuk Menetapkan Kadar Asam Asetat pada Cuka Tahapan kerja: 1. Larutkan asam cuka perdagangan sebanyak 10 mL yang diambil dengan menggunakan pipet ukur, dimasukkan ke dalam labu ukur 100 mL, encerkan dengan akuades sampai tanda batas (pengenceran 10 kali, Fp = 10). 2. Ambil 10 mL larutan yang telah diencerkan tersebut denga pipet kemudian dimasuukan ke dalam Erlenmeyer 250 mL, tambahkan 2-3 tetes indicator PP. 3. Larutan tersebut kemudian dititrasi denagn larutan NaOH yang telah distandarisasikan/dibakukansamapi terjadi perubahan warna (perubahan warna tidak akan berubah apabila digoyang-goyangkan). 4. Catac volume akhir titasi NaOH dan hitung asam asetat dalma cuka tersebut. 5. Lakukan duplo. Perhitungan: Reaksi: NaOH + CH3COOH CH3COONa + H2O Konsentrasi asam cuka perdagangan: Molaritas NaOH (hasil standarisasi) : a mL Volume titrasi rata-rata : b mL (Vasam cuka x Masam cuka ) = (VNaOH x MNaOH) x Fp Masam cuka = (VNaOH x MNaOH) x Fp Masam cuka = Vasam cuka (aM x b mL)x Fp Vasam cuka Kadar asam cuka perdagangan: M= G 1000 x Mr V(mL) G= M x Mr x 1000 kadar= V (mL) G 0,01L x 100% = …% (b/v) MATERI 2 PENENTUAN KONSENTRASI ZAT WARNA MENGGUNAKAN SPEKTROFOTOMETER UV-VIS I. TUJUAN: 1. Menentukan nilai absorbansi sampel methylene blue dan panjang gelombang maksimum. 2. Membuat kurva standar larutan sampel methylene blue 3. Menentukan konsentrasimethylene blue dalam larutan sampel yang belum diketahui konsentrasinya dengan metode spektrometri. II. TEORI DASAR Spektroskopi adalah studi mengenai interaksi antara energi cahaya dan materi. Warna yang tampak dan fakta bahwa orang bisa melihat adalah akibat absorbansi energi oleh senyawa organik maupun senyawa anorganik. Panjang gelombang dimana suatu senyawa organic menyerap energy bergantung pada struktur senyawa itu, sehingga teknik spektroskopi dapat digunakan untuk menentukan struktur senyawa yang tidak diketahui dan untuk mempelajari karakteristik ikatan dari senyawa yang diketahui. Spektroskopi adalah suatu keadaan yang terjadi jika suatu cahaya mengenai suatu benda atau materi. Kemudian cahaya itu bisa jadi diserap, dihamburkan, diteruskan, dan dipancarkan kembali oleh materi itu dengan yang sama maupun berbeda. Apabila benda itu diubah atau dibelokkan sudut getarnya, maka disebut polarimetri. Suatu larutan yang mempunyai warna khas dapat menyerap sinar dengan . Dalam hubungannya dengan senyawa organik, maka senyawa ini mampu menyerap cahaya. Senyawa organik mempunyai elektron valensi yang dapat dieksitasi ketingkat yang lebih tinggi. Hal penting yang mendasari prinsip ini adalah bahwa penyerapan sinar tampak atau ultraviolet dapat mengakibatkan tereksitasinya elektron dari molekul. Spektrofotometri adalah sebuah metode analisis untuk mengukur konsentrasi suatu senyawa berdasarkan kemampuan senyawa tersebut mengabsorbsi berkas sinar atau cahaya. Spektrofotometri juga dapat diartikan sebagai pengukuran konsentrasi larutan dengan menggunakan instrumen. Instrumen yang digunakan untuk mengukur jumlah cahaya yang diserap atau intensitas warna yang sesuai dengan panjang gelombang disebut spektrofotometer. Spektrofotometer menghasilkan sinar dari spektrum dengan panjang gelombang tertentu, sementara fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau diabsorbsikan (Riyadi,2008). Secara umum spektrofotometer dibedakan menjadi empat macam, yaitu: spektrofotometer ultraviolet,spektrofotometer sinartampak (visible), spektrofotometer inframerah, dan spektrofotometer serapan atom. Analisis spektrofotometri visible (spektrofotometri sinar tampak) didasarkan pada pengukuran intensitas warna larutan yang akan ditentukan konsentrasinya dibandingkan dengan warna larutan standar (larutan yang telah diketahui konsentrasinya). Penentuan konsentrasi didasarkan pada pengukuran absorbsi (serapan) radiasi gelombang elektromagnetik. Jumlah intensitas radiasi yang diserap oleh larutan sampel dikonversi dengan konsentrasi analit menjadi data kuantitatif. Larutan yang dianalisis menggunakan spektorfotometer UV harus terdiri dari senyawa yang mempunyai gugus kromofor (gugus molekul yang mengandung sistem elektronik yang dapat menyerap energi pada daerah UV).Lain halnya dengan larutan yang dianalisis dengan spektrofotometer visible, senyawa larutannya harus berwarna karena absorbsi terjadi pada bagian sinar tampak dari spektrum gelombang elektromagnetik. Jika larutan tidak berwarna, maka larutan harus direaksikan dengan pereaksi kimia yang sesuai agar senyawa dalam larutan menjadi berwarna. Di bawah ini adalah warna-warna yang teramati oleh mata dan warna-warna yang diserap: Warna yang Teramati Hijau Biru-Hijau Ungu Merah-Ungu Merah Jingga Kuning Warna yang Diserap Merah Jingga-Merah Kuning Kuning-Hijau Hijau Biru Ungu Panjang gelombang (nm) 700 600 550 530 500 450 400 Bila radiasi elektromagnetik dilewatkan pada suatu bahan atau larutan dalam media transparan, maka beberapa kemungkinan yang terjadi adalah radiasi diserap (absorbed), diteruskan (transmitted), dihamburkan (scattered) atau dipantulkan (reflected). Meskipun efek dari kemungkinan di atas pada umumnya terjadi, tetapi memperkecil efek penghamburan dan pemantulan dapat diusahakan Jika ditulis dalam persamaan, maka sinar atau intensitas yang datang (Io) (cahaya yang melewati pada suatu bahan) adalah penjumlahan dari sinar yang diserap (Ia), yang diteruskan(It), yang dipantulkan(Ir), dan sinar yang dihamburkan(Is). Io= Ia+ It+ Ir + Is Cara kerja spektrofotometer dimulai dengan dihasilkannya cahaya monokromatik dari sumbersinar. Cahaya tersebut kemudian menuju ke kuvet (tempatsampel). Banyaknya cahaya yang diteruskan maupun diserap oleh larutan akan dibaca oleh detektor yang kemudian menyampaikan ke layar pembaca (Hadi, 2009). Hukum yang Melandasi Spektrofotometri: Hukum Lambert-Beer: “Jika suatu cahaya monokromator melalui suatu media transparan, maka logaritma intensitas cahaya yang datang dibanding intensitas cahaya yang diteruskan sebanding dengan absorbansi serta absorptivitas molar (koefisien ekstingsi molar), tebal media (kuvet), dan konsentrasi larutan.” log (Io/It) = -log T = A = abc b Io It Larutan pengabsorbsi berkonsentrasi c Keterangan: Io: Intensitas cahaya yang datang It: Intensitas cahaya yang diteruskan T: Transmitansi A: Absorbansi a: Absorptivitas molar b: tebal media c: konsentrasi larutan SPEKTRUM ABSORPSI Spektrum absorpsi menyatakan hubungan antara absorbansi (A) sebagai sumbu y dengan panjang gelombang maksimum sebagai sumbu x. Spektrum absorpsi berguna dalam penentuan panjang gelombang maksimum. Pengukuran spektrum absorpsi dilakukan dengan cara mengukur absorbansi larutan dengan konsentrasi tetap pada berbagai panjang gelombang. Panjang gelombang maksimum diperoleh dari pemilihan panjang gelombang yang menghasilkan absorbansi maksimum. Untuk mengetahui apakah senyawa pengabsorpsi memenuhi hukum Lambertbeer, maka diperlukan plot kurva baku/standar absorbansi terhadap konsentrasi. Konsentrasi larutan yang akan di ukur ditentuakan dari pengukuran absorbansi atau transmitansi pada panjang gelombang tertentu atau tetap, beberapa larutan yang telah diketahui konsentrasinya(larutan baku), selanjutnya dibuat plot (grafik) kurva standard antara absorbansi (sumbu y) dengan konsentrasi (sumbu x). III. INSTRUMENTASI SPEKTROFOTOMETER (SPECTRONIC) Spektrofotometer atan spektrinic pada prinsipnya terdiri dari monokromator kisi difraksi dan sistem deteksi elektronik, amplifikasi dan pengukuran. Atau secara garis besar terdiri dari sumber radiasi, kuvet (tampat sampel) dan detektor. Sumber radiasi berupa lampu tungsen (wolfram), kuvet dari bahan gelas atau kuartz, dan detektor berupa solid-state silicon. Panjang gelombang berkisar antara 340-950 nm dan lebar piat efektif 20 nm. ALAT DAN BAHAN 3.1 Alat: 1. Spektrofotometer Visible 2. Labu takar 100ml 3. Pipet ukur 4. Bulb IV. 5. Gelas beker 6. Pipet tetes 7. Kuvet 8. Tabung reaksi 9. Penutup tabung reaksi 10. Pipet ukur 11. Rak tabung reaksi 3.2 Bahan: 1. Larutan methylene blue 1x10-3 M 2. Larutan sampel methylene blue 3. Aquades 4. Tisu 5. Label CARA KERJA 1. Buat larutan standar metylen blue dengan mengencerkan larutan metylen blue 10-3M menjadi 4x 10-4, 3,5 x 10-4, 3x10-4, 2,5x10-4, 2x10-4, 1x10-4M menggunakan aquades. 2. Kemudian ukur absorbansi (A) larutan metylen blue. Tentukan panjang gelombang maksimumnya. 3. Ukur A masing-masing larutan pada panjang gelombang maksimum yang diperoleh pada langkah kedua. 4. Buat kurva standar antara absorbansi (y) terhadap konsentrasi (sumbu x) 5. Letakkan larutan sampel metylen blue yang ingin diketahui konsentrasinya dalam kuvet dan ukur A larutan sampel pada panjang gelombang maksimum. 6. Gunakan kurva standar untuk menentukan konsentrasi larutan sampel metylen blue. 7. Bahas hasil yang diperoleh. Note: pembacaan absorbansi pada range 0,2-1,0 DAFTAR PUSTAKA Tim Dosen Pengampu Mata Kuliah Kimia Dasar FTP. 2013. Spektrofotometri UVVis.Malang: Universitas Brawijaya MATERI 3 DAYA HANTAR LISTRIK, pHMETER DAN TURBIDITYMETER DAYA HANTAR LISTRIK I. Tujuan Tujuandaripraktikuminiadalahsebagaiberikut: 1. Mengetahuinilaidanprinsipkerjadayahantarlistrikpadasuatularutan 2. Memahamipengaruhdayahantarlistrikterhadappengujiankualitas air II. TinjauanPustaka Daya hantar listrik di dalam air merupakan kemampuan untuk menghantarkan arus listrik, dengan satuan yang digunakan mikro mhos per cm. Pengukuran daya hantar listrik ini bertujuan mengukur kemampuan ion-ion dalam air untuk menghantarkan listrik serta memprediksi kandungan mineral dalam air. Berikut ini manfaat pengukuran daya hantar listrik sebagai parameter kualiatas air: 1. Menetapkan Tingkat Mineralisasi dan derajat ionisasi 2. Memperkirakan efek total dari konsentrasi ion 3. Memperkirakan jumlah zat padat terlarut dalam air Kation (ion bermuatanpositif) dan anion (ion bermuatannegatif) dalam air merupakan unsur penghantar listrik, jika semakin besar jumlah ion-ionnya maka semakin besar pula harga daya hantar listriknya. Besarnya daya hantar listrik juga dapat bergantung pada kandungan ion anorganik ( Total Dissolved Solid ) yang disebut juga materi tersuspensi. NO 1. 2. 3. 4. III. AIR Air hasilpenyulingan Air hujan Air hujantercemar Air lautatau air fosil DHL (mikromhos/cm) 1-5 10-50 >100 >10.000 ProsedurPercobaan 3.1 Alat 1. Labutakar 250 ml 2. Gelaskimia 3. Conductivity-meter 3.2 Bahan 1. Aquades 2. Air sampel 3. Air limbah 3.3 Cara Kerja 1. Siapkan alat dan bahan 2. Masukkan air sampel ke dalam labu takar dan homogenkan 3. 4. 5. 6. 7. Ambil air sampel, lalu masukkan ke labu takar Lakukan pengenceran dengan aquades Masukkan ke dalam gelas kimia Lakukan pengukuran dengan konduktivitimeter Ulangi langkah tersebut untuk sampel berikutnya pHmeter IV. Tujuan Tujuan dari praktikum ini adalah sebagai berikut: V. 1. Mengetahui kegunaan pH meter dalam lingkungan 2. Mengetahui prinsip kerja pH meter TinjauanPustaka pH merupakan satuan ukur yang menguraikan kadar keasaman atau kadar basa dari suatu larutan. pH = -log[H+] Jikanilai pH = pOH = 7, makalarutanbersifatnetral. Jikanilai pH < 7, makalarutanbersifatasam. Jikanilai pH > 7, makalarutanbersifatbasa. Pengukuran pH biasanya dilakukan dengan menggunakan kertas pH atau kertas indikator pH, agar lebih akurat dilakukan pengukuran dengan menggunakan pHmeter. Umumnya air di alam agak sedikit basa (pH < 7), air sungai dan air tanah mempunyai pH berkisar dari 6 sampai 8,5. Sedangkan air yang tercemar oleh limbah tambang, industri, dan mata air panas dapat menyebabkan air bertambah asam dengan (pH < 5). Tinggi rendahnya pH pada air tidak berpengaruh pada kesehatan, akan tetapi untuk air dengan (pH < 6) akan menyebabkan korosi pada metal (misalnya pada pipa saluran air minum) yang melarutkan logam timbal, tembaga, dan logam lainnya yang bersifat racun. Demikian pula jika (pH > 8,5) dapat membentuk endapan pada pipa air atau peralatan pabrik yang terbuat dari metal yang kemudian menghasilkan senyawa yang bersifat racun. VI. ProsedurPercobaan 6.1 Alat pHmeter Gelaskimia Gelasukur Pipet volume pH meter LabuUkur 6.2 Bahan Air minumkemasan Air limbah Air keranlaboratorium TSAL Aquades 6.3 Cara Kerja Siapkan alat dan bahan Kalibrasi alat Lakukan pengukuran air sampel dengan pHmeter TURBIDIMETER I. Tujuan Percobaan Tujuan dari praktikum ini adalah sebagai berikut: 1. Mengetahui kegunaan Turbidimeter dan aplikasinya dalam lingkungan 2. Mengetahui prinsip kerja Turbidimeter 3. Mengetahui metode dalam pengukuran Turbidimeter II.Tinjauan Pustaka Kekeruhan merupakan keadaan mendung atau kekaburan dari cairan yang disebabkan oleh individu partikel (suspended solids) yang umumnya tidak terlihat oleh mata telanjang, mirip dengan asap di udara. Salah satu faktor pengujian kualitas air adalah kekeruhan. Kekeruhan mengacu pada konsentrasi ketidaklarutan padatan dalam air, padatan tersebut umumnya berasal dari tanah liat, buangan industri, dan mikroorganisme. Keberadaan partikel dalam air diukur dalam satuan Nephelometric Turbidity Units(NTU). Penting untuk diketahui bahwa kekeruhan adalah ukuran kejernihan sampel, bukan warna. Alat untuk mengukur kekeruhan dalam air ialah Turbidimeter. Pengukuran turbidimeter menggunakan larutan standar dan larutan sample. Larutan sample merupakan larutan yang akan diukur kekeruhannya. Turbidimeter akan memancarkan cahaya pada media atau sample, dan cahaya tersebut akan diserap, diteruskan, dipantulkan atau menembus media tersebut. Cahaya yang menembus/diserap media akan diukur dan dikonversi dalam bentuk angka yang merupakan tingkat kekeruhan dalam satuan NTU. Semakin banyak cahaya yang diserap maka semakin keruh media tersebut. Perhitungan turbidimeter adalah sebagai berikut: Hasil pemeriksaan x NTU x Pengenceran = .....NTU Kekeruhan larutan standard Pengujian kualitas air berdasarkan pengukuran kekeruhanberguna untuk mengetahui indikasi pencemaran air. Air yang kekeruhannya tinggi akan menghambat sinar matahari masuk dan memperlambat proses fotosintesis mahkluk hidup didalamnya. Dalam jangka panjang, mahkluk hidup didalam air akan mati dan ekosistem air akan terganggu. Oleh karena itu, pengujian kualitas air sangat penting bagi kehidupan mahkluk di ekosistem tersebut dan sekitarnya. III. Prosedur Percobaan 3.1 Alat 1. Turbidimeter 2. Wadah sampel 3.2 Bahan 1. Larutan Standar 2. Larutan sampel 3. Air limbah IV. Cara Kerja 1. Siapkan Alat dan Bahan 2. Kalibrasi alat 3. Masukkan air yang akan diuji kedalam botol sample sesuai garis yang ada dibotol 4. Tekan ON, tekan MODE sampai muncul tulisan NTU pada display 5. Masukkan botol sample ke dalam ruang sample dan tutup 6. Tekan READ, tunggu selama 8 detik kemudian nilai kekeruhan akan muncul di display 7. Ulangi langkah yang sama sebanyak 3 kali 8. Ulangi langkah tersebut pada sampel yang berbeda MATERI 4 UJI AMONIUM DAN NITRAT BAB I PENDAHULUAN 1.1 Tujuan Percobaan Tujuan dari percobaan ini adalah untuk menentukan kadar amonium dan kadar nitrat dengan metode kolorimetri pada limbah domestik. 1.2 Metode Percobaan Metode yang digunakan adalah metode kolorimetri 1.3 Prinsip Percobaan Pengujian kadar amonium dan nitrit didahului dengan pembuatan larutan standar. Setelah itu dibuat kurva kalibrasi dengan mengukur absorbansi larutan standar yang telah diberi reagen menggunakan spetrofotometer pada panjang gelombang tertentu. Kemudian dilakukan analisis sampel dengan mengukur absorbansi sampel dan memplotkan hasil pembacaan pada kurva kalibrasi standa BAB II TINJAUAN PUSTAKA 2.1 Kondisi Eksisiting Wilayah Sampling Pada praktikum amonium dan nitrit kali ini, Sampel yang digunakan adalah limbah domestik atau limbah rumah tangga yang diambil di IPAL Tlogomas Malang. Cara pengambilan sampel itu sendiri yaitu dengan cara menampung limbah domestik atau limbah rumah tangga yang ada pada kolam aerasi. Botol diisi dengan limbah domestik atau limbah rumah tangga tersebut ,kemudian langsung ditutup agar tidak ada udara yang masuk kedalamnya. 2.2 Teori 2.2.1 Nitrat Nitrat (NO3) merupakan bentuk anorganik dari Nitrogen. Nitrat adalah bentuk utama nitrogen di perairan alami dan merupakan nurtien utama bagi pertumbuhan tanaman dan algae. Nitrit nitrogen sangat mudah larut dalam air dan bersifat stabil. Senyawa ini dihasilkan dari proses oksidasi sempurna senyawa nitrogen di perairan. Nitrifikasi yang merupakan proses oksidasi ammonia menjadi nitrit dan nitrat adalah proses yang penting dalam siklus nitrogen dan berlangsung pada kondisi aerob. Oksidasi ammonia menjadi nitrit dilakukan oleh bakteri Nitrosomonas, sedangkan oksidasi nitrit menjadi nitrat dilakukan oleh bakteri Nirobacter (Effendi, 2003) 2.2.2 Amonium Ammonium (NH4) merupakan bentuk trasnsisi dari ammonia (NH3). Ammonium adalah bentuk anorganik dari Nitrogen. Semua senyawa amonum dapat larut dalam air. Sama seperti nitrat, ammonium merupakan sumber utama nitrogen dalam perairan. Namun, ammonium lebih disukai oleh tumbuhan (Effendi. 2003). BAB III PROSEDUR PERCOBAAN 3.1 Alat 1. Neraca Analitik 2. Labu takar 50 ml, 100 ml, 500 ml, 1000 ml 3. Beakerglass 100 ml 4. Erlenmeyer 50 ml dan 100 ml 5. Pipet ukur dan pipet tetes 6. Gelas Alroji 7. Spektrofotometer dan Kuvet 8. Bunsen + Korek api + penyangga 3.2 Bahan 1. Serbuk amonium klorida 2. Padatan NaOH 3. Serbuk merkuri clorida (HgCl2) 4. Serbuk kalium iodida (KI) 5. Fenol 6. Sulfat 7. Amoniak pekat 8. KNO3 9. Aquadest 10. Sampel limbah 3.3 Cara Kerja 3.3.1 Pembuatan Reagen Penunjang Analisis Amoniak Dengan Metode Nessler 1. Larutan induk amoniak (1000 mg NH4+/L) Melarutkan 3,819 g amonium korida yang telah dikeringkan pada suhu 100-105o C ke dalam air bebas amoniak di dalam labu ukur 1000 mL. Menambahkan air suling sampai tepat tanda tera. 1 mL larutan ini = 1mg N = 1,22 mg NH3. 2. Larutan Standar Amoniak 100 mg NH4+/L Memipet 10 mL larutan induk amoniak ke dalam labu ukur 1000 mL. Menambahkan 3. 3. Larutan reagen Nessler Melarutkan 100 g NaOH dengan 500 mL air suling bebas amoniak ke dalam labu ukur 1000 mL. Mendinginkan larutan NaOH tersebut. Melarutkan 100 g merkuri clorida (HgCl2) dan 70 g kalium iodida (KI) dengan sedikit air suling bebas amoniak ke dalam beaker glass 100 mL. Menambahkan larutan campuran dalam beaker glass ini sedikit demi sedikit ke dalam labu ukur 1000 mL yang berisi larutan NaOH yang telah dingin tadi. Menambahkan air suling bebas amoniak sampai tepat tanda tera. 3.3.2 Penentuan kadar N sebagai NH3 dengan metode Nessler a. Pembuatan Larutan Standar Amoniak Menyiapkan 7 buah labu takar 50 mL. Memipet larutan induk amoniak 10 mg/L sebanyak 0,00 mL; 2 mL; 5 mL; 10 mL; 20 mL dan 25 mL, salah satu secara duplo, kemudian memasukkannya masing-masing ke dalam labu takar 50 mL. Masing-masing labu takar 50 mL tersebut selanjutnya ditambah dengan aquades sampai tepat tanda tera kemudian dikocok hingga homogen. Diperoleh larutan standar nitrat dengan kadar 0,00 mg/L; 0,4 mg/L; 1 mg/L; 2 mg/L; 4 mg/L dan 5 mg/L. b. Pembuatan Kurva Kalibrasi Memipet 25 mL masing-masing larutan standar amoniak, salah satu secara duplo, kemudian masing-masing masukkan ke dalam erlenmeyer 100 mL. Menambahkan 2 mL reagen Nessler ke dalam masing-masing labu takar setelah itu mengocoknya sampai homogen. Membiarkan larutan tersebut selama 10 menit, agar reaksi berlangsung optimal. Mengukur absorbansi larutan-larutan tersebut dengan alat spektrofotometer pada panjang gelombang 420 nm. Membuat kurva kalibrasi larutan standar amoniak kemudian menentukan persamaan garis lurus atau regresinya. c. Pelaksanaan Analisis Sampel Memipet 2 mL masing-masing larutan sampel, salah satu secara duplo, kemudian memasukkannya ke dalam erlenmeyer 50 mL. Menambahkan 2 mL reagen Nessler ke dalam masing-masing labu takar setelah itu mengocoknya sampai homogen. Membiarkan larutan tersebut selama 10 menit, agar reaksi berlangsung optimal. Mengukur absorbansi larutan tersebut dengan alat spektrofotometer pada panjang gelombang 420 nm. Memplotkan hasil pembacaan pada kurva kalibrasi standar atau melalui persamaan garis lurus yang telah dibuat sebelumnya. 3.3.3 Analisis Nitrat Dengan Metode Fenol Sulfat 1. Larutan induk nitrat (100 mg/L) Melarutkan 721,8 mg KNO3 ke dalam 100 mL air suling pada labu ukur 1000 mL. Menambahkan air suling sampai tepat tanda tera. 2. Larutan campuran fenol sulfat Mencampurkan 10 mL larutan fenol dan 10 mL asam sulfat dalam labu ukur 100 mL. Menambahkan air suling sampai tepat tanda tera. 3.3.4 Penentuan kadar N sebagai ion NO3- dengan metode Fenol Sulfat secara kolorimetri a. Pembuatan Larutan Standar Nitrat Memipet larutan induk nitrat 100 mg/L sebanyak 50 mL dan dimasukkan dalam erlenmeyer, menguapkan di atas penangas air dan dikeringkan. Menambahkan 2 mL larutan fenol sulfat untuk melarutkan endapan yang ada dengan bantuan batang kaca untuk mengaduk. Memasukkan campuran dalam labu takar 500 mL dan diencerkan dengan akuades hingga tanda tera. Menyiapkan 7 labu takar 50 mL dan memipet 0,00 mL; 0,25 mL; 0,50 mL; 1,00 mL; 1,50 mL dan 2,00 mL, salah satu secara duplo, kemudian memasukkannya masing-masing ke dalam labu takar 50 mL. Masing-masing labu takar 50 mL tersebut selanjutnya ditambah dengan aquades sampai tepat tanda tera kemudian dikocok hingga homogen. Diperoleh larutan standar nitrat dengan kadar 0,00 mg/L; 0,05 mg/L; 0,10 mg/L; 0,20 mg/L; 0,30 mg/L dan 0,40 mg/L. b. Pembuatan Kurva Kalibrasi Memipet 10 mL masing-masing larutan standar nitrat, salah satu secara duplo, kemudian memasukkannya masing-masing ke dalam labu takar 50 mL. Menambahkan 7 mL amoniak pekat dan ke dalam masing-masing labu takar 50 mL, ditambahkan aquades kemudian mengocoknya perlahan dan dibiarkan. Mengukur absorbansi larutan-larutan tersebut dengan alat spektrofotometer pada panjang gelombang 410 nm. Membuat kurva kalibrasi standar dan menentukan persamaan garis lurus atau regresinya c. Pelaksanaan Analisis Sampel Memipet 5 mL masing-masing larutan sampel secara duplo, kemudian memasukkannya ke dalam erlenmeyer 50 mL, menguapkan di atas penangas air dan dikeringkan. Menambahkan 2 mL larutan fenol sulfat untuk melarutkan endapan yang ada dengan bantuan batang kaca untuk mengaduk. Memasukkan campuran dalam labu takar 50 mL. Tambahkan 7 mL amoniak sehingga timbul warna kuning dalam larutan dan diencerkan dengan akuades hingga tanda tera.. Mengukur absorbansi larutan tersebut dengan alat spektrofotometer pada panjang gelombang 410 nm. Memplotkan hasil pembacaan pada kurva kalibrasi standar atau melalui persamaan garis lurus yang telah dibuat sebelumnya. MATERI 5 REAKSI SAPONIFIKASI PADA LEMAK 1. TUJUAN a. Mempelajari proses saponifikasi suatu lemak dengan menggunakan kalium hidroksida dan natrium hidroksida b. Mempelajari perbedaan sifat sabun dan detergen 2. DASAR TEORI Trigliserida adalah suatu ester lemak atau minyak dengan berat molekul relatif tinggi dan dapat disaponifikasi (dihidrolisis) menjadi larutan yang bersifat basa menghasilkan sabun dan gliserol (Fessendenet al, 2003) Berdasarkan reaksi tersebut, sabun dikatakan sebagai suatu campuran garam dari anion – anion karboksilat dan suatu kation univalen. Campuran anion – anion tesebut dapat terbentuk karena setiap molekul trigliserida mengandung variasi jenis residu asam lemak dan karena minyak atau lemak itu sendiri merupakan suatu campuran molekul – molekul asam lemak. Sabun kalium lebih mudah larut dalam air daripada sabun natrium. Sabun kalium biasa digunakan sebagai sabun cair dan pembasuh. Sabun bersifat keras apabila terbuat dari lemak/minyak padat yang memiliki derajat kejenuhan yang tinggi seperti gajih dan shortening. Proses saponifikasi dari minyak jenuh akan menghasilkan sabun lunak. Perlakuan larutan sabun dengan asam klorida encer akan menghasilkan campuran asam lemak : Asam lemak dari asam karboksilat dengan rantai karbon panjang (C10 – C18) dapat berupa asam lemak jenuh atau tidak jenuh. Detergen sintetik berbeda dari sabun karena detergen merupakan garam dari asam sulfurik akil rantai panjang atau suatu asam alkil benzensulfonat, yang berbeda dengan asam karboksilat (Fessenden et al, 2003). Fungsi sabun dan detergen adalah untuk menghilangkan kotoran dan lemak dengan jalan mengemulsikan partikel tersebut menjadi suatu suspensi. Kotoran akan teradhesi dari kain dan melekat ke permukaan pada suatu lapisan tipis. Dengan adanya pencucian maka lapisan tersebut akan terpisah dan terbawa oleh air. Bagaimana molekul sabun detergen dapat melarutkan partikel – partikel non polar seperti lemak, minyak dan gajih? Molekul sabun dan detergen terdiri dari ujung hidrokarbon yang bersifat non polar dan ujung yang lain bersifat polar/ionik. Bagian non polar akan mengelilingi tetesan minyak dan melarutkannya sesuai dengan asas like dissolves like (senyawa yang memiliki kemiripan kepolaran akan saling melarutkan). Ujung polar/ionik dari molekul sabun segera akan terlarut dalam air. Sabun tidak dapat bekerja dengan baik pada air sadah karena adanya kation divalen seperti Ca2+, Mg2+, atau Fe2+ yang akan membentuk endapan dengan anion karboksilat dari sabun. Hal ini sering dijumpai sebagai kerak pada dinding dan keran pada kamar mandi. Pada sisi lain anion dari detergen yaitu alkil sulfat/alkil sulfonat tidak dapat membentuk endapan dengan kation – kation tersebut. Dengan demikian detergen dapat digunakan secara efektif pada air sadah. 3. ALAT DAN BAHAN Alat yang digunakan dalam percobaan adalah : - Tabung reaksi - Pipet volume - Pipet tetes - Beaker glass 250 ml - Kertas saring - Gelas arloji - Bunsen + korek api + penyangga Bahan yang digunakan dalam percobaan adalah : - Lemak - KOH 10% dalam etanol 95% - NaCl - Aquades - CaCl2 0,1% - MgCl2 0,1% - FeCl2 0,1% - Detergen - Air kran - Minyak 4. PROSEDUR KERJA A. SAPONIFIKASI LEMAK : Pembuatan Sabun Kalium - Tempatkan lemak seberat 1,5 gram pada tabung reaksi - Tambahkan 10 mL larutan KOH 10% (v/v) dalam etanol 95% - - B. - Tempatkan tabung reaksi pada beaker glas 250 mL yang berisi air panas sebagai penangas air (proses pemanasan diteruskan hingga mendidih Tambahkan etanol 2 mL untuk menggantikan etanol yang menguap Setelah tabung dipanaskan selama 10 menit, lakukan uji penyabunan untuk melihat apakah proses saponifikasi sudah berlangsung sempurna atau belum Cara pengujian dilakukan dengan meneteskan hasil reaksi ke dalam air. Saponifikasi sempurna jika tidak ada tetesan lemak Jika saponifikasi sudah sempurna, tuang hasil reaksi pada gelas beaker dan panaskan sampai alkohol menguap sempurna (dengan ditandai terbentuknya cairan kental dan liat, jangan sampai gosong). Tambahkan akuades 30 mL Aduk secara konstan sehingga diperoleh sabun kalium Larutan dibagi 2, untuk pembuatan sabun natrium (langkah B) dan untuk pengujian (langkah C) SAPONIFIKASI LEMAK : Pembuatan Sabun Natrium Separuh sampel dari langkah A ditambah 15 mL larutan NaCl jenuh Campuran diaduk dengan kuat sampai terbentuk padatan Padatan yang diperoleh dipisahkan dengan kertas saring Padatan berupa sabun natrium ditekan supaya terbebas dari air C. SIFAT SABUN DAN DETERGEN - Pengujian dilakukan dengan menggunakan masing – masing 1 mL larutan sabun kalium (dari langkah A) dan 1 mL larutan sabun natrium (dari langkah B) - Oleskan minyak atau lemak pada permukaan gelas arloji - Gunakan larutan sabun kalium tersebut apakah dapat menghilangkan lemak yang ada (denga cara menggoyangkan gelas arloji) - Proses diulangi dengan menggunakan detergen yang dihasilkan dari pelarutan 0,5 gram detergen ke dalam 50 mL akuades - Ambil 4 tabung reaksi, masing – masing diisi berurutan 1 mL larutan CaCl2 0,1%, 1 mL larutan MgCl2 0,1%, 1 mL larutan FeCl2 0,1% dan air kran - Setiap tabung reaksi diaduk dan diamati endapan yang terjadi - Ulangi proses yang terjadi dengan menggunakan bahan sabun natrium dan detergen. DAFTAR PUSTAKA Fessenden, R. J., J. S. Fessenden and M. Logue. Organic Chemistry. 2003. 6th edn., Brooks/Cole, Pacific Grove