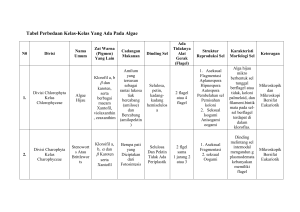
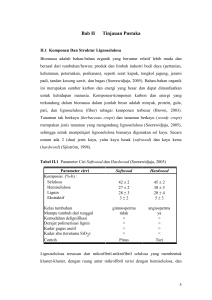
HIDROLISIS TONGKOL JAGUNG OLEH BAKTERI
advertisement

H F-XC A N GE H F-XC A N GE c u-tr a c k N y bu to k lic HIDROLISIS TONGKOL JAGUNG OLEH BAKTERI SELULOLITIK UNTUK PRODUKSI BIOETANOL DALAM KULTUR CAMPURAN Oleh : M. EDY SHOFIYANTO F34104118 2008 FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR BOGOR .d o o .c m C m w o .d o w w w w w C lic k to bu y N O W ! PD O W ! PD c u-tr a c k .c H F-XC A N GE H F-XC A N GE c u-tr a c k N y bu to k lic HIDROLISIS TONGKOL JAGUNG OLEH BAKTERI SELULOLITIK UNTUK PRODUKSI BIOETANOL DALAM KULTUR CAMPURAN SKRIPSI Diajukan sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Teknologi Industri Pertanian Fakultas Teknologi Pertanian Institut Pertanian Bogor Oleh : M. EDY SHOFIYANTO F34104118 2008 FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR BOGOR .d o o .c m C m w o .d o w w w w w C lic k to bu y N O W ! PD O W ! PD c u-tr a c k .c H F-XC A N GE H F-XC A N GE c u-tr a c k N y bu to k lic INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN HIDROLISIS TONGKOL JAGUNG OLEH BAKTERI SELULOLITIK UNTUK PRODUKSI BIOETANOL DALAM KULTUR CAMPURAN SKRIPSI Diajukan sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Teknologi Industri Pertanian Fakultas Teknologi Pertanian Institut Pertanian Bogor Oleh : M. EDY SHOFIYANTO F34104118 Dilahirkan di Tegal, 19 Januari 1986 Tanggal lulus : 12 September 2008 Disetujui, Bogor, 17 September 2008 Dr. Ir. Titi Candra Sunarti, MSi Dosen Pembimbing I Dr. Anja Meryandini, MS Dosen Pembimbing II .d o o .c m C m w o .d o w w w w w C lic k to bu y N O W ! PD O W ! PD c u-tr a c k .c H F-XC A N GE H F-XC A N GE c u-tr a c k N y bu to k lic SURAT PERNYATAAN Saya yang bertanda tangan di bawah ini menyatakan dengan sebenarbenarnya bahwa skripsi dengan judul “Hidrolisis Tongkol Jagung oleh Bakteri Selulolitik untuk Produksi Bioetanol dalam Kultur Campuran” adalah hasil karya saya sendiri dengan arahan dosen pembimbing akademik, kecuali yang dengan jelas ditunjukan rujukannya. Bogor, September 2008 M. Edy Shofiyanto F34104118 .d o o .c m C m w o .d o w w w w w C lic k to bu y N O W ! PD O W ! PD c u-tr a c k .c H F-XC A N GE H F-XC A N GE c u-tr a c k N y bu to k lic RIWAYAT HIDUP Penulis dilahirkan di Tegal, Jawa Tengah pada tanggal 19 Januari 1986 dari ayah yang bernama M. Taufik dan ibu yang bernama Sri Mundjayani. Penulis merupakan anak kedua dari lima bersaudara. Riwayat pendidikan penulis dimulai pada tahun 1990 di Taman Kanak-kanak Aisyiah. Pada tahun 1991 sampai 1997 penulis mengikuti pendidikan di Sekolah Dasar Negeri Keraton 2 Tegal, kemudian melanjutkan ke Sekolah Lanjutan Tingkat Pertama (SLTP) Negeri 6 Tegal sampai tahun 2000. Pada tahun 2000 sampai tahun 2003 penulis mengikuti pendidikan di Sekolah Lanjutan Tingkat Atas (SLTA) Negeri 2 Tegal. Tahun 2004 penulis melanjutkan pendidikannya pada Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB). Penulis melakukan praktek lapang di PT. PG Rajawali Unit 2 (Unit Produksi Spirtus dan Alkohol), Cirebon, Jawa Barat. Penulis mengakhiri masa studi di IPB setelah menyelesaikan skripsi yang berjudul “Hidrolisis Tongkol Jagung oleh Bakteri Selulolitik untuk Produksi Bioetanol dengan Kultur Campuran”. .d o o .c m C m w o .d o w w w w w C lic k to bu y N O W ! PD O W ! PD c u-tr a c k .c H F-XC A N GE H F-XC A N GE c u-tr a c k N y bu to k lic KATA PENGANTAR Alhamdulillah, Puji Syukur penulis haturkan ke hadirat Allah SWT yang telah memberikan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penyusunan skripsi yang berjudul “Hidrolisis Tongol Jagung oleh Bakteri Selulolitik untuk Produksi Bioetanol dalam Kultur Tercampur” ini dengan baik. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Penulis sepenuhnya menyadari bahwa penulisan skripsi ini tidak akan selesai tanpa adanya bimbingan dan dukungan yang penuh ketulusan baik secara moril maupun materil dari semua pihak. Oleh karena itu, dalam kesempatan ini penulis mengucapkan banyak terimakasih kepada pihak-pihak yang turut membantu dalam penyusunan skripsi ini. Penghargaan dan ucapan terimakasih penulis haturkan kepada : 1. Ibu Dr. Ir. Titi Candra Sunarti, MSi selaku dosen pembimbing I dan Dr. Anja Meryandini, MS selaku dosen pembimbing II atas bimbingan dan saran-saran yang diberikan selama penulis menyelesaikan skripsi. 2. Ibu Dr. Ir. Ani Suryani, DEA selaku dosen penguji atas kritik dan saran yang diberikan kepada penulis. Penulis menyadari masih banyak kekurangan di berbagai sisi baik dari penyajian isi maupun penulisan dan penyusunan skripsi ini. Oleh sebab itu saran dan kritik akan menjadi masukan yang terbaik untuk lebih membangun, memperbaiki dan menyempurnakannya untuk saat ini maupun masa mendatang. Semoga segala sesuatu yang tertuang dalam skripsi ini akan bermanfaat bagi yang memerlukannya. Amien. Bogor, September 2008 Penulis i .d o o .c m C m w o .d o w w w w w C lic k to bu y N O W ! PD O W ! PD c u-tr a c k .c H F-XC A N GE H F-XC A N GE c u-tr a c k N y bu to k lic DAFTAR ISI Halaman KATA PENGANTAR .................................................................................... i DAFTAR ISI .................................................................................................. ii DAFTAR TABEL ........................................................................................... v DAFTAR GAMBAR ...................................................................................... vi DAFTAR LAMPIRAN ................................................................................... vii I. PENDAHULUAN A. LATAR BELAKANG .......................................................................... 1 B. TUJUAN .............................................................................................. 2 II. TINJAUAN PUSTAKA A. JAGUNG .............................................................................................. 3 B. SELULOSA .......................................................................................... 5 C. DELIGNIFIKASI .................................................................................. 7 D. HIDROLISIS BAKTERI SELULOLITIK ............................................. 9 E. FERMENTASI ETANOL ...................................................................... 11 III. METODOLOGI A. BAHAN DAN ALAT ........................................................................... 14 B. METODE PENELITIAN ...................................................................... 15 1.Tahapan Penelitian............................................................................... 15 a. Perlakuan Pendahuluan................................................................... 15 b. Hidrolisis Bakteri selulolitik ........................................................... 16 c. Prosedur Penelitian ......................................................................... 16 2. Prosedur Penelitian ............................................................................. 17 3. Rancangan Percobaan ......................................................................... 18 IV. HASIL DAN PEMBAHASAN A. KARAKTERISASI SUBSTRAT........................................................... 20 1. Karakteristik Tongkol Jagung ............................................................. 20 2. Perlakuan Pendahuluan ...................................................................... 21 B. SAKARIFIKASI BAKTERI ................................................................. 28 ii .d o o .c m C m w o .d o w w w w w C lic k to bu y N O W ! PD O W ! PD c u-tr a c k .c H F-XC A N GE H F-XC A N GE c u-tr a c k N y bu to k lic C. FERMENTASI ETANOL ..................................................................... 33 1. Laju Pembentukan CO2 ....................................................................... 35 2. Karakteristik Produk ........................................................................... 36 V. KESIMPULAN DAN SARAN A. KESIMPULAN .................................................................................... 39 B. SARAN ................................................................................................ 39 DAFTAR PUSTAKA ..................................................................................... 40 LAMPIRAN ................................................................................................... 44 iii .d o o .c m C m w o .d o w w w w w C lic k to bu y N O W ! PD O W ! PD c u-tr a c k .c H F-XC A N GE H F-XC A N GE c u-tr a c k N y bu to k lic DAFTAR TABEL Halaman Tabel 1. Karakteristik dan komposisi tongkol jagung ...................................... 5 Tabel 2. Karakteristik enzim selulase dari isolat bakteri lokal........................... 10 Tabel 3. Perbandingan hidrolisa selulosa secara kimiawi dan enzimatis ........... 11 Tabel 4. Perbandingan hasil analisa proksimat tongkol jagung ......................... 20 Tabel 5. Komposisi kimia tongkol jagung dan hasil delignifikasi tongkol jagung ............................................................................................... 21 Tabel 6. Komposisi kimia tongkol jagung hasil delignifikasi dan hasil ekstraksi selulosa .............................................................................................. 22 Tabel 7. Komposisi kimia alfa selulosa dan fraksi selulosa............................... 25 Tabel 8. Aktivitas enzim isolat C4-4 pada berbagai substrat............................. 31 Tabel 9. Hasil kuantifikasi mikroba.................................................................. 38 Tabel 10. Analisa jumlah etanol dan total asam................................................ 38 iv .d o o .c m C m w o .d o w w w w w C lic k to bu y N O W ! PD O W ! PD c u-tr a c k .c H F-XC A N GE H F-XC A N GE c u-tr a c k N y bu to k lic DAFTAR GAMBAR Halaman Gambar 1. Tanaman jagung ........................................................................... 3 Gambar 2. Pohon industri jagung .................................................................. 4 Gambar 3. Struktur selulosa .......................................................................... 6 Gambar 4. Model struktur lignin ................................................................... 8 Gambar 5. Mekanisme pemotongan rantai selulosa ........................................ 9 Gambar 6. Diagram alir tahapan penelitian.................................................... 15 Gambar 7. Reaktor proses fermentasi etanol.................................................. 19 Gambar 8. Struktur (a) tongkol jagung, (b) hasil delignifikasi, (c) fraksi selulosa, (d) selulosa amorf perbesaran 400x ............................. 24 Gambar 9. Neraca masa proses persiapan substrat ......................................... 27 Gambar 10. Perbandingan hubungan waktu dengan jumlah gula hasil hidrolisa pada berbagai substrat; (a) hasil delignifikasi, (b) fraksi selulosa, (c) alpha selulosa................................................ 29 Gambar 11. Hasil Mikroskop (a) struktur selulosa tongkol jagung, (b) Struktur selulosa yang telah terhidrolisis enzim, (c) struktur selulosa dengan cahaya polarisasi, (d) struktur selulosa hidrolisis enzim dengan cahaya polarisasi perbesaran 400x ........ 32 v .d o o .c m C m w o .d o w w w w w C lic k to bu y N O W ! PD O W ! PD c u-tr a c k .c H F-XC A N GE H F-XC A N GE c u-tr a c k N y bu to k lic DAFTAR LAMPIRAN Halaman Lampiran 1. Diagram alir proses persiapan substrat.......................................... 43 Lampiran 2. Analisis kimia tongkol jagung ..................................................... 44 Lampiran 3. Prosedur analisis parameter fermentasi......................................... 49 Lampiran 4. Prosedur analisa aktivitas FP-ase.................................................. 51 Lampiran 5. Prosedur analisa aktivitas CMC-ase ............................................. 52 Lampiran 6. Prosedur kandungan protein terlarut dalam filtrat ......................... 53 Lampiran 7. Diagram alir proses penelitian ...................................................... 55 Lampiran 8. Data analisa total gula hidrolisis fraksi selulosa oleh berbagai isolat bakteri.................................................................. 56 Lampiran 9. Analisa total gula hidrolisis hasil delignifikasi oleh berbagai isolat bakteri.................................................................. 57 Lampiran 10. Analisa total gula hidrolisis alpha selulosa oleh berbagai isolat bakteri............................................................................... 58 Lampiran 11. Kromatogram etanol hasil fermentasi ......................................... 59 Lampiran 12. Analisa jumlah mikroba ............................................................. 62 vi .d o o .c m C m w o .d o w w w w w C lic k to bu y N O W ! PD O W ! PD c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c I. PENDAHULUAN A. LATAR BELAKANG Jagung adalah salah satu produk pertanian yang banyak dihasilkan di negara Indonesia. Pada tahun 2007 produksi jagung nasional mencapai 13.287.527 ton dan diperkirakan meningkat menjadi 14.854.050 ton pada tahun 2008 (Anonima, 2008). Menurut Irawadi (1990) buah jagung terdiri dari 30% limbah yang berupa tongkol jagung. Jika dikonversikan dengan jumlah produksi jagung pada tahun 2008, maka negara Indonesia berpotensi menghasilkan tongkol jagung sebanyak 4.456.215 ton. Jumlah limbah tersebut dapat dikatakan sangat banyak dan akan menjadi sangat potensial jika dapat dimanfaatkan secara tepat. Pemanfaatan jagung saat ini sangat beraneka ragam. Salah satunya adalah produksi xilan dari tongkol jagung. Saat proses produksi xilan, bahan yang diekstrak dari tongkol jangung berupa hemiselulosa. Residu yang berupa selulosa umumnya belum dimanfaatkan secara optimal. Selulosa merupakan bahan yang kaya akan karbon. Karbon yang terkandung dalam selulosa dapat dimanfaatkan dalam proses fermentasi mikroba. Dalam hal ini, selulosa dapat dimanfaatkan untuk menghasilkan etanol dengan fermentasi menggunakan Saccharomyces cerevisiae. Sebelum difermentasi, selulosa tersebut harus disakarifikasi terlebih dahulu menjadi gula-gula sederhana (glukosa dan fruktosa). Hidrolisis dapat dilakukan dengan penambahan asam atau secara enzimatis. Berdasarkan penelitian Subekti (2006), substrat yang dihidrolisis dengan enzim akan menghasilkan etanol yang lebih banyak daripada substrat yang dihidrolisa dengan asam. Enzim selulase dapat dihasilkan dari mikroorganisme. Beberapa mikro organisme yang dapat menghasilkan selulase antara lain kapang dan bakteri. Menurut Alam et al. (2004), bakteri mempunyai tingkat pertumbuhan yang lebih cepat sehingga waktu yang dibutuhkan untuk menghasilkan enzim selulase akan lebih pendek. Penggunaan bakteri penghasil enzim selulase dalam fermentasi dapat menjadi alternatif pada proses hidrolisis. Pemanfaatan .d o m o o c u-tr a c k C w w w .d o m C lic k to 1 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c bakteri dalam hidrolisis selulosa dilakukan dengan tujuan menghemat penggunaan enzim atau asam sebagai bahan untuk hirolisa. Fermentasi etanol menggunakan Saccharomyces cerevisiae dilakukan dengan metode pencampuran kultur (mixed culture). Substrat yang berupa selulosa akan dihidrolisa terlebih dahulu menggunakan bakteri. Pada waktu dimana kandungan gula optimal maka penanaman khamir dilakukan. Hal tersebut dilakukan untuk mengoptimalkan produksi etanol karena masingmasing mikroorganisme akan bekerja secara sinergis. Proses produksi etanol menggunakan metode pencampuran kultur mikroba sangat memungkinkan untuk dilakukan terutama setelah proses sakarifikasi. Proses sakarifikasi merupakan bagian yang sangat penting dalam produksi etanol. Oleh karena itu, perlu dilakukan kajian sehingga akan diperoleh hasil sakarifikasi dan etanol yang optimal. B. TUJUAN Penelitian ini bertujuan untuk : 1. Memilih substrat hasil perlakuan pendahuluan tongkol jagung, seperti delignifikasi, ekstraksi selulosa, dan pembuatan alfa selulosa dalam proses sakarifikasi oleh bakteri selulolitik. 2. Mengetahui pengaruh menggunakan kultur tercampur secara berurutan antara bakteri selulolitik dengan Sacharomyces cerevisiae terhadap proses produksi bioetanol. .d o m o o c u-tr a c k C w w w .d o m C lic k to 2 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c II. TINJAUAN PUSTAKA A. JAGUNG Tanaman jagung (Zea mays L.) termasuk ke dalam famili rumputrumputan (graminae). Tanaman ini di negara Indonesia sudah dikenal sejak 400 tahun lalu, yang pertama kali dibawa oleh bangsa Portugis dan Spanyol. Jagung merupakan tanaman penting kedua setelah padi yang sebagian besar ditanam di Pulau Jawa, terutama di Jawa Timur. Klasifikasi tanaman jagung (Zea mays L.) Divisi : Spermatophyta Sub Divisi : Angiospermae Kelas : Monocotyledonae Bangsa : Graminales Suku : Graminae Marga : Zea Jenis : Zea mays L. Gambar 1. Tanaman jagung Tanaman jagung merupakan tanaman berumpun, tegak, tinggi ± 1,5 m. Batang bulat masif, tidak bercabang, pangkal batang berakar, berwarna kuning atau jingga. Daun tunggal, berpelepah, bulat panjang, ujung runcing, tepi rata, panjang 35-100 cm, lebar 3-12 cm, berwarna hijau. Bunga tanaman jagung majemuk, berumah satu, bunga jantan dan betina berbentuk bulir, bunga terletak diujung batang dan di ketiak daun, benang sari ungu, bakal buah berbentuk bulat telur, berwarna putih, buah berbentuk tongkol dengan panjang 8-20 cm, hijau kekuningan (Anonimb, 2008). Jagung mempunyai potensi besar untuk dikembangkan menjadi beragam macam produk. Produk turunan potensial yang bisa dihasilkan dari komoditas jagung disajikan pada Gambar 2. .d o m o o c u-tr a c k C w w w .d o m C lic k to 3 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c Pakan Daun Kompos Pakan Kulit Kompos Industri Rokok Pakan Grit Kompos Pakan Tepung Jagung Buah Jagung Pipilan Pangan Bahan Baku Industri Pakan Pati Pangan Bahan Baku Industri Lembaga Kulit ari Tongkol Minyak Bahan Baku Industri Pakan Pulp Kompos Bahan Bakar Rambut Batang Kompos Pakan Pulp Kompos Bahan Bakar Gambar 2. Pohon industri jagung (Anonim, 2005) Garrote et al., (2002), menyatakan bahwa limbah buah jagung yaitu tongkol jagung, dapat dimanfaatkan sebagai bahan baku industri dengan proses biomass refening berdasarkan sparasi fraksi-fraksi kimianya. .d o m o o c u-tr a c k C w w w .d o m C lic k to 4 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c Menurut Koswara (1991), tongkol jagung adalah tempat pembentukan lembaga dan gudang penyimpanan makanan untuk pertumbuhan biji. Jagung mengandung kurang lebih 30 % tongkol jagung sedangkan sisanya adalah kulit dan biji. Menurut Irawadi (1990) limbah pertanian (termasuk tongkol jagung), mengandung selulosa (40-60%), hemiselulosa (20-30%) dan lignin (15-30%). Komposisi kimia tersebut membuat tongkol jagung dapat digunakan sebagai sumber energi, bahan pakan ternak dan sebagai sumber karbon bagi pertumbuhan mikroorganisme. Karakteristik dan komposisi tongkol jagung dapat dilihat pada Tabel 1. Tabel 1. Karakteristik dan komposisi tongkol jagung Kandungan (%) Jumlah Nutrisi (%) Air 9,4 Protein, N x 6,25 2,5 Selulosa 41 Lemak, ester, dll 0,5 Hemiselulosa 36 Serat kasar 32 Xilan 30 Abu 1,5 Lignin 6 Ekstrak nitrogen bebas 53,5 Pektin 3 Neutral detergen fiber 83 Pati 0,014 Total nutrien dapat dicerna 42 Sumber : Johnson (1991) B. SELULOSA Selulosa adalah polimer glukosa yang membentuk rantai linier dan dihubungkan oleh ikatan -1,4-glikosidik. Struktur linier ini menyebabkan selulosa bersifat kristalin dan tidak mudah larut. Selulosa tidak mudah didegradasi secara kimia maupun mekanis. Di alam, biasanya selulosa .d o m o o c u-tr a c k C w w w .d o m C lic k to 5 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c berasosiasi dengan polisakarida lain seperti hemiselulosa atau lignin membentuk kerangka utama dinding sel tumbuhan (Holtzapple, 1993). Kebanyakan selulosa berasosiasi dengan lignin sehingga sering disebut sebagai lignoselulosa. Selulosa, hemiselulosa, dan lignin dihasilkan dari proses fotosintesis. Pada saat yang sama, komponen-komponen utama penyusun tanaman ini diuraikan oleh aktivitas mikroorganisme. Beberapa mikroorganisme mampu menghidrolisis selulosa untuk digunakan sebagai sumber energi, seperti bakteri dan kapang (Enari, 1983). Rantai selulosa terdiri dari satuan glukosa anhidrida yang saling berkaitan melalui atom karbon pertama dan keempat. Ikatan yang terjadi adalah ikatan 1,4-glikosidik. Selulosa merupakan jenis polisakarida yang paling melimpah pada hampir setiap struktur tanaman. Kandungan selulosa pada kayu rata-rata 48-50% sedangkan pada bagas berkisar antara 50-55% dan pada kapas mencapai 85-90%. Molekul selulosa merupakan mikrofibril dari glukosa yang terikat satu dengan lainya membentuk rantai polimer yang sangat panjang. Hidrolisis sempurna selulosa akan menghasilkan monomer selulosa yaitu glukosa, dan hidrolisis tak sempurna akan menghasilkan disakarida dari selulosa yang disebut selobiosa. Secara singkat struktur selulosa dapat terlihat pada Gambar 3. Gambar 3. Struktur selulosa (Anonimc, 2008) Selulosa adalah homopolisakarida dengan glukosa sebagai monomernya dan juga merupakan molekul organik yang terdapat pada tumbuhan, sedangkan hemiselulosa merupakan heteropolimer kompleks yang memiliki kandungan utama xilosa dan juga sejumlah arabinosa, manosa, glukosa dan galaktosa .d o m o o c u-tr a c k C w w w .d o m C lic k to 6 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c (Burchadt dan Ingram, 1992). Fengel dan Wegener (1995) menyebutkan bahwa selain arabinosa, manosa dan glukosa, beberapa hemiselulosa juga mengandung galaktosa dan senyawa tambahan yaitu asam uranoat. Lignin merupakan bahan organik bukan karbohidrat yang berbentuk amorf dan tersusun atas satuan-satuan fenol (Chang et al., 1981). Selulosa dapat dikonversi menjadi produk-produk bernilai ekonomi yang lebih tinggi seperti glukosa, etanol dan pakan ternak dengan jalan menghidrolisis selulosa dengan bantuan selulase sebagai biokatalisator atau dengan hidrolisis secara asam/basa (Ariestaningtyas, 1991) Ada tiga jenis selulosa yaitu selulosa, selulosa dan selulosa adalah bagian yang tidak larut dalam alkali, selulosa. dan selulosa adalah bagian yang larut dalam dalam alkali, dan kemudian dapat mengendap jika ditambahkan asam, sedangkan selulosa adalah bagian yang larut dalam alkali dan tetap larut jika ditambahkan asam (Fengel dan Wegner, 1995). Selama ekstraksi hemiselulosa ada yang larut terutama dan selulosa. C. DELIGNIFIKASI Selain polisakarida salah satu komponen dalam kayu dan biomassa adalah lignin yang jumlahnya pada kayu 25-30%, pada bagas berkisar 20-30%. Lignin merupakan jaringan polimer fenolik yang berfungsi merekatkan serat selulosa sehingga menjadi sangat kuat. Kekuatan ikatan lignin merupakan salah satu penghalang pada proses pulping kimia dan proses pemutihan pada pembuatan kertas yang pada akhirnya diterapkan metode bleaching untuk menghilangkan lignin tanpa mengurangi serat selusosa secara signifikan. Pada proses konversi biomassa menjadi etanol dengan proses hidrolisis dan fermentasi kekuatan ikatan lignin juga menjadi penghalang dalam proses hidrolisisnya. Secara umum struktur lignin yang cukup kompleks dapat dilihat pada Gambar 4. .d o m o o c u-tr a c k C w w w .d o m C lic k to 7 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c Gugus Fenol Cincin aromatik (fenyl) Ikatan -4 ether Gugus Alkohol Rantai methoxyl Struktur Dibenzodioxocin Gambar 4. Model struktur lignin (Brunow, 2001) Lignin adalah polimer tiga dimensi yang terdiri dari unit fenil propana yang diikat dengan ikatan eter (C-O-C) dan ikatan karbon (C-C). Lignin bersifat tahan terhadap hidrolisis karena adanya ikatan arilalkil dan ikatan eter (Judoamidjojo et al., 1989), serta tidak larut dalam air, dalam larutan asam dan larutan hidrokarbon (Krik dan Othmer 1952). Proses delignifikasi merupakan perlakuan pendahuluan terhadap bahan baku sehingga mempermudah pelepasan hemiselulosa. Proses ini berfungsi untuk membersihkan lignin. Berbagai perlakuan pendahuluan atau delignifikasi dapat dilakukan seperti perlakuan secara fisik (penggilingan, pemanasan dengan uap, radiasi atau pemanasan dengan udara kering) dan secara kimia .d o m o o c u-tr a c k C w w w .d o m C lic k to 8 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c (pelarut, larutan pengembang, gas SO2) (Frida, 1998). Menurut Foody et al., (1999) menyatakan bahwa perlakuan pendahuluan dapat dilakukan dengan mengkombinasikan antara perlakuan fisik dan kimia. Perlakuan fisik seperti penggilingan, tekanan, pengepresan dan sebagainya sedangkan kimia seperti penggunaan panas, pelarut dan asam. Hidrolisis bahan lignoselulosik dapat dilakukan dengan asam atau enzim. Perlakuan awal terhadap substrat lignoselulosik diperlukan agar substrat mudah bereaksi dengan asam atau enzim. Perlakuan awal yang efisien harus dapat membebaskan struktur kristal selulosa dengan memperluas daerah amorf serta membebaskan dari lapisan lignin. D. SAKARIFIKASI BAKTERI SELULOLITIK Sakarifikasi pada selulosa dapat dilakukan dengan bantuan biokatalisator yang berupa enzim selulase atau dengan hidrolisis secara asam atau basa. Pada hidrolisis selulosa dengan bantuan biokatalisator, enzim selulase dapat ditambahkan secara langsung pada selulosa atau dapat juga dengan penambahan bakteri selulolitik. Enzim selulase merupakan sistem enzim yang terdiri atas endo-1,4- glukanase, ekso-1,4- -glukanase, dan -D-glukanase memotong ikatan rantai dalam selulosa menghasilkan molekul selulosa yang lebih pendek, ekso-1,4- glukanase memotong ujung rantai selulosa menghasilkan molekul selobiosa, sedangkan -D-glukanase memotong molekul selobiosa menjadi dua molekul glukosa gambar mekanisme pemotongan dapat dilihat pada Gambar 5. Rantai selulosa Selulosa rantai pendek Selobiosa Glukosa Gambar 5. Mekanisme pemotongan rantai selulosa (Kim, 1995). .d o m o o c u-tr a c k C w w w .d o m C lic k to 9 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c Mikroorganisme selulolitik dari kelompok bakteri memiliki tingkat pertumbuhan yang cepat sehingga waktu yang dibutuhkan untuk produksi enzim menjadi lebih pendek. Selain itu, tingkat variasi genetik kelompok bakteri sangat beragam sehingga memungkinkan dilakukan rekayasa genetika untuk optimasi produksi maupun aktivitas enzim selulasenya (Alam et al., 2004). Bakteri penghasil enzim selulase mempunyai karakteristik yang berbedabeda. Sebelumnya telah dilakukan penelitian terhadap isolat lokal yang mempunyai aktivitas selulolitik tinggi. Pada isolat tersebut diberikan kode C11-1, C4-4 dan C5-1. Isolat tersebut berasal dari pengomposan kulit pisang dari daerah yang berbeda-beda. Bakteri tersebut tergolong Gram positif yang tumbuh pada CMC (Carboxymethylcellulose) pada suhu 50 oC. Karakteristik enzim selulase dapat dilihat pada Tabel 2. Table 2. Karakteristik enzim selulase dari isolat bakteri lokal Parameter Isolat Bakteri C4-4 C5-1 C11-1 Suhu optimum (oC) 70 90 70 pH optimum 5.0 3.5 8.0 Aktivitas pada tongkol jagung(nkat) 81 80 128 Kecamatan Panyingkiran, Kab. Karawang Kecamatan Cikalong Kulon, Kab. Cianjur Kecamatan Asal Biakan Panyingkiran, Kab. Karawang Sumber: Maranatha (2008) .d o m o o c u-tr a c k C w w w .d o m C lic k to 10 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c Tabel 3. Perbandingan hidrolisis selulosa secara kimiawi dan enzimatis Hidrolisis Asam Hidrolisis Enzim Asam adalah katalis yang tidak khusus menghidrolisis selulosa saja tetapi juga sekaligus mendelignifikasinya sebagai perlakuan awal. Enzim selulase adalah makromolekul yang khusus menghidrolisa selulosa saja, sehingga diperlukan perlakuan awal pada substrat sebelum dihidrolisa. Dapat menguraikan hemiselulosa Menghasilkan sirup glukosa yang membentuk senyawa penghambat jernih dan siap difermentasi seperti furfural. membentuk etanol Kondisi reaksi yang cukup berat (120 Kondisi reaksi yang ringan (50 oC, o C, diatas tekanan atmosfir dan pH tekanan atmosfer dan pH 4,8). dibawah 1,0), sehingga perlu biaya perawatan alat hidrolisa untuk daya tahan panas dan korosifnya. Laju hidrolisa tinggi Laju hidrolisa lebih rendah Hasil glukosa secara keseluruhan Hasil glukosa tinggi tergantung rendah karena adanya penguraian pada sistem dan perlakuan awalnya Biaya bahan kimia (asam) yang tinggi, Biaya untuk produksi enzim sehingga perlu daur ulang penggunaan tinggi, sehingga perlu daur ulang penggunaan enzim asam. Sumber : Kosaric et al., (1983) E. FERMENTASI ETANOL Fermentasi adalah suatu proses perubahan kimia pada substrat organik, baik karbohidrat, protein lemak atau lainnya, melalui kegiatan katalis biokimia yang dikenal sebagai enzim dan dihasilkan oleh mikroba spesifik (Prescott dan Dunn, 1981). Khamir yang sering digunakan pada proses fermentasi etanol secara industri adalah Saccharomyces cerevisiae, S. uvarium, Schizosaccharomyces sp., dan Kluyveromyces sp. Lackhe (2002) menyatakan bahwa sejumlah besar bakteri juga mampu membentuk etanol sebagai produk utama, misalnya Clostridium dan Bacillus (B. macerans). .d o m o o c u-tr a c k C w w w .d o m C lic k to 11 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c Khamir mampu mengkonsumsi berbagai substrat gula, tergantung spesies yang digunakan. Secara umum, mikroorganisme ini dapat tumbuh dan memfermentasi gula menjadi etanol secara efisien pada pH 3,5-6,0 dan suhu 28-35 oC. Walaupun laju awal produksi etanol meningkat pada suhu lebih tinggi, produktifitas keseluruhan menurun karena efek penghambatan etanol meningkat (Ratledge, 1991). Menurut Paturau (1969), fermentasi etanol memakan waktu 30-72 jam. Frazier dan Westhoff (1978) menambahkan bahwa suhu optimum untuk fermentasi antara 25-30 oC dan kadar gula antara 10-18%. Jika konsentrasi gula terlalu tinggi, aktivitas khamir dapat terhambat dan waktu fermentasi menjadi lebih lama serta tidak semua gula dapat difermentasi. Saccharomyces cerevisiae adalah salah satu spesies khamir yang memiliki daya konversi gula menjadi etanol sangat tinggi. Mikroba ini biasanya dikenal dengan baker’s yeast dan metabolismenya telah dipelajari dengan baik. Produk metabolit utama adalah etanol, CO2 dan air, sedangkan beberapa produk lain dihasilkan dalam jumlah sedikit. Khamir ini bersifat fakultatif anaerobik. Saccharomyces cerevisiae memerlukan suhu 30 oC dan pH 4,0 - 4,5 agar dapat tumbuh dengan baik. Selama proses fermentasi akan timbul panas. Bila tidak dilakukan pendinginan, suhu akan terus meningkat sehubungan proses fermentasi terhambat (Oura, 1983). Disamping kondisi lingkungan seperti suhu dan pH, kebutuhan nutrien dan kofaktor juga memegang peranan penting bagi kehidupan khamir. Sejumlah kecil oksigen harus disediakan pada proses fermentasi oleh khamir karena oksigen merupakan komponen yang diperlukan dalam biosintesis beberapa asam lemak tidak jenuh. Biasanya diberikan tekanan oksigen 0,050,10 mmHg. Lebih besar dari nilai tersebut, konversi akan cenderung kearah pertumbuhan sel (Kosaric et al.,1983). Kebutuhan relatif nutrien sebanding dengan komponen utama sel khamir, yaitu mencakup karbon, oksigen, nitrogen dan hidrogen. Pada jumlah lebih rendah, fosfor, sulfur, potasium, dan magnesium juga harus tersedia untuk sintesis komponen-komponen minor. Beberapa mineral (Mn, Co, Cu dan Zn) dan faktor pertumbuhan organik (asam amino, asam nukleat, dan vitamin) .d o m o o c u-tr a c k C w w w .d o m C lic k to 12 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c diperlukan dalam jumlah kecil. Substrat yang digunakan untuk memproduksi etanol dalam jumlah besar biasanya mengandung nutrien yang diperlukan untuk pertumbuhan khamir. Dalam beberapa hal, mungkin diperlukan tambahan nutrien dan biasanya ditambahkan dalam bentuk komponen tunggal seperti garam amonium dan potasium fosfat atau dari sumber murah seperti corn steep liquor (Kosaric et al., 1983). Pada permulaan proses fermentasi khamir memerlukan oksigen untuk pertumbuhannya, oleh karena itu perlu diberikan oksigen. Sesudah terjadi akumulasi CO2 dan reaksi berubah menjadi anaerob, alkohol akan menghalangi fermentasi lebih lanjut setelah tercapai konsentrasi antara 13-15 % volume. Konsentrasi alkohol akan menghambat fermentasi tergantung pada suhu dan jenis khamir yang digunakan (Prescott dan Dunn, 1981) Pada kondisi anaerobik, khamir memetabolisme glukosa menjadi etanol sebagian besar melalui jalur Embden Meyerhof Parnas. Setiap mol glukosa terfermentasi menghasilkan dua mol etanol, CO2 dan ATP. Oleh karena itu, secara teoritis setiap glukosa memberikan 0,51 g etanol. Pada kenyataannya etanol biasanya tidak melebihi 90-95% dari hasil teoritis. Hal ini dikarenakan sebagian nutrisi digunakan untuk sintesa biomassa dan memelihara reaksi. Reaksi samping juga dapat terjadi, yaitu terbentuknya gliserol dan suksinat yang dapat mengkonsumsi 4-5% substrat (Oura, 1983). .d o m o o c u-tr a c k C w w w .d o m C lic k to 13 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c III. METODOLOGI PENELITIAN A. BAHAN DAN ALAT 1. Bahan a. Bahan Baku Bahan Baku yang digunakan dalam penelitian ini adalah tongkol jagung manis varietas Golden yang diperoleh dari daerah Leuwikopo. Mikroorganisme yang digunakan adalah Saccharomyces cerevisiae yang diperoleh dari Laboratorium Bioindustri Departemen Teknologi Industri Pertanian IPB dan bakteri selulolitik isolat lokal yang diambil dari Laboratorium Bioteknologi Hewan dan Biomedis, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB. b. Bahan Kimia 1. Bahan kimia untuk perlakuan pendahuluan: NaOH 15%, NaOCl 1%, dan H2SO4 45%. 2. Bahan kimia /nutrien untuk pertumbuhan : PDA, PDB, pepton, pupuk NPK dan ZA. 3. Bahan kimia untuk analisa : H2SO4 pekat, fenol 5%, NaOH 0,1N, Indikator fenolftalein, larutan DNS dan sebagainya. 2. Alat Peralatan yang digunakan dalam penelitian ini antara lain : erlenmeyer 300 ml dan 500 ml, leher angsa, shaker (inkubator goyang), gelas piala 2000 ml, gelas ukur, mikroskop, spektrofotometer, kromatografi gas (merek Hitachi 263-50). .d o m o o c u-tr a c k C w w w .d o m C lic k to 14 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c B. METODE PENELITIAN 1. Tahapan Penelitian Penelitian dilakukan dalam beberapa tahapan yang disajikan pada Gambar 5. Mulai Perlakuan Pendahuluan Hidrolisis Menggunakan Bakteri Selulolitik Produksi Etanol menggunakan khamir Saccharomyces cerevisiae Selesai Gambar 6. Diagram alir tahapan penelitian A. Perlakuan Pendahuluan 1. Karakterisasi Tongkol Jagung Pada tahap ini, bahan yang berupa tongkol jagung dikeringkan menggunakan oven pada suhu 50 oC. Hasil pengeringan dikecilkan ukurannya menggunakan Hammer mill hingga +40 mesh. Pada proses ini uji yang dilakukan adalah uji proksimat, yaitu uji kadar air, abu, lemak, protein, serat kasar, dan karbohidrat (by difference). 2. Persiapan Substrat Persiapan substrat dilakukan melalui tiga prose, yaitu substrat hasil delignifikasi (S1), substrat fraksi selulosa (S2), dan substrat alfa selulosa(S3). Proses pertama adalah delignifikasi. Delignifikasi dilakukan dengan tujuan untuk menghilangkan lignin hingga diperoleh hemiselulosa dan selulosa. Menurut Anggraini (2003) delignifikasi .d o m o o c u-tr a c k C w w w .d o m C lic k to 15 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c dilakukan dengan merendam serbuk tongkol jagung dalam larutan NaOCl 1% selama 5 jam pada suhu 28 oC. Lignin akan terlarut pada fraksi cairan sedangkan fraksi padatan merupakan hemiselulosa dan selulosa. Proses ekstraksi selulosa dilakukan dengan merendam bahan hasil dari proses delignifikasi ke dalam NaOH 15% selama 24 jam pada suhu 28 oC (Anggraini, 2003). Hemiselulosa yang terkandung pada bahan akan terlarut pada larutan tersebut. Fraksi padatan merupakan selulosa tongkol jagung. Pemisahan dilakukan menggunakan kain saring dengan dibilas berulang kali hingga pH 8. Alpha selulosa dibuat dengan merendam selulosa tongkol jagung pada H2SO4 65% selama 4 jam pada suhu 25 oC (Xiang et al., 2003). Larutan dipisahkan menggunakan gelas penyaring dan dibilas beberapa kali menggunakan akuades. Proses persiapan substrat dapat dilihat pada Lampiran 1. 3. Karakterisasi Substrat Pada tahap ini bahan hasil persiapan substrat dikarakterisasi komposisi seratnya yang meliputi kandungan selulosa, hemiselulosa dan lignin. Prosedur uji dapat dilihat pada Lampiran 2. B. Hidrolisis Bakteri Selulolitik Tahap keempat adalah dilakukan hidrolisa pada substrat (S1, S2, dan S3). Pada tahap ini dilakukan pengamatan terhadap aktivitas bakteri selulolitik isolat C4-4, C5-1, C11-1, dan Cmix (kultur yang merupakan pencampuran dari ketiganya). Pengamatan tersebut didasarkan pada terbentuknya produk yang berupa gula total. Adapun prosedur karakterisasi total gula dapat dilihat pada Lampiran 3. Aktivitas dan aktivitas spesifik enzim dari bakteri selulolitik ditentukan pada Lampiran 4, 5, dan 6. C. Produksi Etanol Tahap terakhir adalah produksi etanol. Pada produksi etanol menggunakan metode pencampuran mikroba (mixed Culture) antara .d o m o o c u-tr a c k C w w w .d o m C lic k to 16 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c bakteri selulolitik yang dalam hal ini sebagai penghidrolisa selulosa dan Saccharomyces cerevisiae sebagai agen pengkonversi. Penentuan waktu inokulasi Saccharomyces cerevisiae dilakukan pada fase akhir eksponensial dan awal fase stasioner bakteri dan substrat terpilih. Pengamatan dilakukan dengan menghitung etanol yang diproduksi dan produk samping yang berupa kandungan total asam (Lampiran 3). 2. Prosedur Penelitian Prosedur penelitian yang pertama adalah dengan mengubah tongkol jagung secara fisik dengan pengeringan dan penggilingan hingga 40 mesh. Proses berikutnya yaitu penghilangan lignin (delignifikasi) menggunakan NaOCl 1% selama 5 jam pada suhu 280C kemudian mengekstrak selulosa dengan ekstraksi menggunakan NaOH 15% selama 24 jam, pada suhu 280C kemudian dicuci menggunakan air akuades. Fraksi selulosa yang diperoleh direndam menggunakan H2SO4 65% selama 4 jam dan dinetralkan dengan dicuci menggunakan akuades. Hasilnya berupa alfa selulosa yang mempunyai struktur amorf. Semua substrat dihidrolisis dengan menanamkan bakteri selulolitik (C4-4, C11-1, C5-1 dan Cmix). Sebelum digunakan bakteri selulolitik disegarkan terlebih dahulu dalam media CMC 1% agar miring. Proses hidrolisis dilakukan pada suhu 30oC, pH 4,8-5 selama 48 jam. Proses berikutnya adalah fermentasi gula menjadi etanol. Proses fermentasi didasarkan pada penelitian yang dilakukan oleh Rinaldy (1987). Penyegaran kultur dilakukan dengan menumbuhkannya pada media PDA (Potato Dextrose Agar). Khamir Saccharomyces cerevisiae diinokulasikan secara aseptis dengan ose, tabung reaksi ditutup dengan sumbat kapas dan dimasukkan dalam inkubator selama 2 hari pada 30 0C sebelum diinokulasikan pada media cair PDB (Potato Dextrose Broth). Sebelum diinokulasikan, terlebih dahulu dilakukan penyiapan inokulum (starter) dengan media cair PDB (Potato Dextrose Broth). Sebanyak 10 ml media cair disterilkan terlebih dahulu, kemudian + 3 ose hasil biakan khamir diinokulasikan secara aseptis dan ditumbuhkan secara aerobik selama 24 jam menggunakan inkubator goyang 120 rpm pada 30 0C atau suhu kamar. .d o m o o c u-tr a c k C w w w .d o m C lic k to 17 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c Substrat fermentasi hasil hidrolisa sebelum diinokulasikan khamir ditambahkan pupuk NPK dan ZA masing-masing sebanyak 0,04% dan 0,15%, kemudian ditambahkan starter sebanyak 10% dari volume substrat ditambahkan fermentasi berlangsung pada sistem tertutup dan tidak dilakukan aerasi. Labu ditutup dengan sumbat dan leher angsa yang dihubungkan dengan saluran pada gelas ukur dalam air untuk mengukur laju gas CO2 yang dihasilkan dari proses fermentasi (Gambar 7). Proses fermentasi dilakukan pada inkubator goyang pada suhu ruang. Hasil fermentasi kemudian dianalisa dengan terlebih dahulu dipasteurisasi pada suhu 650C untuk menginaktifkan mikroorganisme. Secara keseluruhan diagram proses penelitian ini disajikan pada Lampiran 7. 3. Rancangan Percobaan Pada penelitian ini percobaan dirancang sebagai berikut : S = Jenis Substrat S1 = Substrat Tongkol Jagung Terdelignifikasi S2 = Substrat Fraksi Selulsoa S3 = Substrat Alfa Selulosa M = Isolat Bakteri Selulolitik M1 = Isolat C4-4 M2 = Isolat C5-1 M3 = Isolat C11-1 M4 = Isolat campuran ketiga kultur (C4-4, C5-1, dan C11-1) Pengamatan dilakukan terhadap analisa total gula yang terbentuk yang terdapat pada Lampiran 2. Pada tahap ini akan diperoleh isolat yang unggul untuk dikarakterisasi aktivitas enzimnya (CMC-ase, FP-ase dan Xilanase) dan diamati kurva pertumbuhannya sebelum ditanamkan khamir. Penanaman khamir dilakukan pada dua waktu yang berbeda. Pertama pada fase akhir eksponensial (P1) dan pada awal fase stasioner (P2) dari pertumbuhan bakteri. Pengamatan dilakukan terhadap etanol yang terbentuk dan produk samping yang berupa kandungan total asam. .d o m o o c u-tr a c k C w w w .d o m C lic k to 18 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c Gas CO2 H2SO4 pekat Sumbat Karet Kultur broth Gambar 7. Reaktor proses fermentasi etanol .d o m o o c u-tr a c k C w w w .d o m C lic k to 19 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic IV. HASIL DAN PEMBAHASAN A. KARAKTERISASI SUBSTRAT 1. Karakteristik Tongkol Jagung Bahan baku yang berupa tongkol jagung mempunyai karakteristik proksimat tertentu yang meliputi kadar air, abu, lemak, protein, serat kasar dan karbohidrat (by difference). Selain itu analisa kandungan serat yang meliputi analisa kandungan lignin, selulosa, dan hemiselulosa. Hasil analisa proksimat tongkol jagung dapat dilihat pada Tabel 4. Tabel 4. Perbandingan hasil analisa proksimat tongkol jagung Varietas Hawaii Varietas Golden (% B.B)* (% B.B) Air 7,04 10,01 Abu 1,67 1,5 Lemak 4,68 3,07 Protein 1,82 1,81 Kadar Serat kasar 40,65 39,5 Karbohidrat (by Difference) 44,14 55,89 Komponen Keterangan : * = Subekti(2006) % B.B = Persentase berdasarkan berat basah Data berdasarkan Tabel 4 menunjukkan hasil bahwa setiap jenis tongkol jagung mempunyai komposisi yang berbeda. Pada analisa proksimat tongkol jagung varietas Hawaii yang dilakukan oleh Subekti (2006) yang menyatakan bahwa kadar abu 1,67%, kadar lemak 5,03% dan kadar serat 43,73% sedangkan pada penelitian ini hasil menunjukkan kadar abu 1,5%, kadar lemak 3,07% dan kadar serat kasar 39,5%. Perbedaan tersebut dikarenakan komposisi kimia tongkol jagung akan dipengaruhi oleh beberapa faktor, seperti perbedaan varietas, tempat .d o o .c m C m w o .d o w w w w w C lic k to bu y 20 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic tumbuh, kelembaban dan cuaca saat pemanenan. Kandungan tersebut merupakan bahan yang terbentuk hasil fotosintesis tumbuhan yang terakumulasi yang juga dipengeruhi faktor-faktor tersebut. 2. Perlakuan Pendahuluan Proses perlakuan bahan awal dilakukan melalui beberapa tahapan proses antara lain adalah proses delignifikasi, proses ekstraksi selulosa dan proses pembuatan alpha selulosa. Proses tersebut dilakukan dengan tujuan untuk menyederhanakan bahan sehingga dengan mudah dapat di hidrolisis menggunakan enzim selulase oleh bakteri. Selain itu, perlakuan bahan awal dilakukan dengan tujuan untuk menghilangkan bahan-bahan yang menghambat pada proses hidrolisis seperti lignin. Menurut Irawadi (1990), pemecahan molekul selulosa dihambat oleh tingginya derajat polimerisasi dan kristalisasi molekul selulosa serta kandungan lignin yang membungkus molekul selulosa. Hidrolisis selulosa sulit terjadi selama derajat polimerisasi, kristalinitas dan kandungan lignin belum berkurang. Pada kondisi yang demikian produktivitas mikroorganisme dalam menghasilkan selulase akan rendah. Kandungan selulosa, hemiselulosa dan lignin dalam tongkol jagung akan berbeda baik sebelum ataupun sesudah delignifikasi. Hasil tersebut dapat dilihat pada pada Tabel 5. Tabel 5. Komposisi kimia tongkol jagung dan hasil delignifikasi tongkol jagung Sebelum Delignifikasi Setelah Delignifikasi Komponen (% B.K) (% B.K) Selulosa 37,44 68,44 Hemiselulosa 39,81 32,73 Lignin 12,57 11,25 % B.K = Persentase berdasarkan berat kering .d o o .c m C m w o .d o w w w w w C lic k to bu y 21 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Berdasarkan Tabel 5, kadar lignin sebelum delignifikasi 12,57% sedangkan kadar lignin setelah delignifikasi 11,25%. Data tersebut menunjukkan bahwa kadar lignin tidak dapat dihilangkan secaara keseluruhan. Penurunan sebesar 1,32% tidak jauh berbeda dengan penelitian yang dilakukan oleh Subekti (2006) yaitu sebesar 1%. Lignin akan larut dalam larutan NaOCl sehingga yang tersisa adalah selulosa dan hemiselulosa yang berupa padatan. Delignifikasi dilakukan untuk meningkatkan efisiensi kerja enzim dalam menghidrolisis selulosa. Proses lain untuk persiapan bahan adalah ekstraksi selulosa. Pada proses delignifikasi residu yang berupa padatan merupakan selulosa dan hemiselulosa. Pada proses ini penambahan NaOH 15% untuk menghilangkan hemiselulosa sehingga bahan yang tersisa adalah selulosa. Penurunan kadar hemiselulosa dapat dilihat pada Tabel 6. Tabel 6. Komposisi kimia tongkol jagung hasil delignifikasi dan hasil ekstraksi selulosa Hasil Delignifikasi Hasil Ekstraksi Selulosa Komponen (% B.K) (% B.K) Selulosa 21,73 77,08 Hemiselulosa 39,81 11,98 Lignin 11,25 7,52 Berdasarkan Tabel 6, terdapat perbedaan yang signifikan antara kadar selulosa hasil delignifikasi dan setelah ekstraksi selulosa. Kadar selulosa pada hasil proses delignifikasi adalah 21,73% sedangkan hasil ekstraksi selulosa sebesar 77%. Pada proses ekstraksi selulosa perendaman tongkol jagung hasil delignifikasi pada NaOH menyebabkan larutnya hemiselulosa. Hal tersebut juga ditandai dengan menurunnyau kadar hemiselulosa dari 39% menjadi 11,98%. Kenaikan kadar selulosa hingga 77,08% disebabkan karena meningkatkan luas permukaan spesifik dan larutnya hemiselulosa dalam NaOH. Pada penelitian Resita (2006), perendaman dengan NaOH akan mengembangkan intrafibril selulosa .d o o .c m C m w o .d o w w w w w C lic k to bu y 22 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic yang menyebabkan meningkatkan luas permukaan spesifiknya. Konsentrasi NaOH sebesar 15% digunakan karena pada konsentrasi tersebut NaOH dapat melepas hemiselulosa lebih tinggi dibandingkan dengan konsentrasi 10% dan 20% (Anggraini, 2003). Selulosa yang berupa padatan dipisahkan menggunakan kain saring. Selain penurunan kadar hemiselulosa kadar lignin juga akan menurun karena NaOH dapat melarutkan lignin. Berdasarkan Murdiatmo (1985), NaOH dapat melarutkan hemiselulosa dan struktur kristalin (lignin) dari serbuk tongkol jagung. Selulosa yang diperoleh tersebut akan disederhanakan dengan merendam pada H2SO4. Berdasarkan Xiang (2006), perendaman selulosa dengan H2SO4 65% akan menyebabkan struktur selulosa menjadi amorf. Namun pada saat penelitian perendaman pada H2SO4 menyebabkan selulosa terbakar, sehingga dilakukan penurunan kadar hingga 45%. Penurunan kadar dilakukan secara bertahap dengan parameter penampakan fisik yang ditimbulkan. Pada saat perendaman pada kadar 50% dan 55% penampakan yang timbul hitam. Hal tersebut diperkirakan masih terjadi reaksi pembakaran oleh H2SO4 pada selulosa tongkol jagung karena konsentrasi yang terlalu tinggi. Perbedaan tongkol jagung setelah proses dapat telihat pada gambar hasil mikroskop pada Gambar 8. .d o o .c m C m w o .d o w w w w w C lic k to bu y 23 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic (a) (b) (c) (d) Gambar 8. Struktur (a) Tongkol jagung, (b) Hasil delignifikasi, (c) Selulosa, (d) Selulosa amorf menggunakan mikroskop cahaya perbesaran 400x Pada Gambar 8 terlihat perbedaan yang cukup nampak jika dibandingkan antara tongkol jagung sebelum delignifikasi, setelah delignifikasi, fraksi selulosa dan alfa selulosa. Gambar 8 (a) adalah gambar struktur tongkol jagung sebelum delignifikasi namun telah dilakukan pengecilan ukuran. Menurut Lynd (2002), delignifikasi dapat dilakukan dengan pengecilan ukuran, namun hal tersebut tidak dapat merubah struktur molekul tongkol jagung secara keseluruhan. Berdasarkan Resita (2006), pengecilan ukuran dan delignifikasi menyebabkan rantai polimer putus yang panjang menjadi rantai polimer yang lebih pendek. Selain itu, pengecilan ukuran dapat meningkatkan daerah amorf, dengan kata lain menurunkan derajat kristalinitas dan memisahkan sebagian lignin dari selulosa. Pada Gambar 8 (a), struktur .d o o .c m C m w o .d o w w w w w C lic k to bu y 24 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic serat tongkol jagung sebelum delignifikasi nampak bentuknya yang masih utuh walaupun telah dilakukan pengecilan ukuran. Struktur tersebut masih terdiri dari lignin, selulosa dan hemiselulosa. Lignin merupakan bahan yang berfungsi sebagai bahan pengisi dinding sel dan berasosiasi dengan selulosa dan hemiselulosa (Ingram dan Doran, 1995). Gambar 8 (b) merupakan gambar tongkol jagung yang telah dihilangkan ligninnya (delignifikasi). Pada proses delignifikasi pengikatan lignin yang menyebabkan strukturnya mengerut. Pada tahap ini digunakan perlarut yang berupa NaOCl 1% selama 5 jam pada suhu 28 oC (Widyani, 2002). Natrium hipoklorit merupakan salah satu pelarut yang mengandung ion-ion hipoklorit yang mampu memecah ikatan karbon. Gambar 8 (c), merupakan struktur selulosa yang telah dilakukan penghilangan hemiselulosanya. Pada gambar terlihat serat-serat sejajar dan seragam yang merupakan serat selulosa. Hemiselulosa akan larut kedalam NaOH pada saat perendaman. Gambar 8 (d), merupakan struktur selulosa amorf (alfa selulosa) yang telah dilakukan perendaman dalam H2SO4. Serat yang terlihat pada gambar merupakan serat selulosa yang telah mengalami penggoyangan struktur sehingga sudah terlihat amorf. Asam yang ditambahkan akan memotong rantai panjang pada selulosa menjadi lebih pendek (Xiang, 2006). Jumlah komposisi alfa selulosa dibandingkan dengan fraksi selulosa dapat dilihat pada Tabel 7. Tabel 7. Komposisi kimia alfa selulosa dan fraksi selulosa Fraksi Selulosa Alfa Selulosa (%) (%) Selulosa 77,08 68,44 Hemiselulosa 11,96 6,22 Komposisi Dari Tabel 7 dapat diketahui bahwa kandungan selulosa dan hemiselulosa pada fraksi selulosa sebesar 77,08% dan 11,96% lebih tinggi dari kandungan selulosa dan hemiselulosa pada alfa selulosa yaitu .d o o .c m C m w o .d o w w w w w C lic k to bu y 25 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic sebesar 68,44% dan 6,22%. Hal tersebut dimungkinkan terjadi karena pada saat perendama H2SO4 45% selulosa dan hemiselulosa mengalami hidrolisis menjadi gula-gula sederhana. Asam adalah katalis non spesifik yang akan memotong rantai selulosa secara acak menjadi bentuk yang lebih sederhana (Tsao et al., 1978). Neraca massa pada penelitian ini dapat dilihat pada Gambar 9. Berdasarkan neraca massa pada Gambar 9 dapat dihitung bahwa fraksi selulosa yang diperoleh dari tongkol jagung sebesar 37,59%. Jumlah sebesar ini sesuai dengan perhitungan yang dilakukan melalui uji kuantitas selulosa yang diperoleh yaitu 37,44%. Nilai tersebut juga sesuai dengan pernyataan Irawadi (1990) yang menyatakan bahwa tongkol jagung terdiri dari 40% selulosa. .d o o .c m C m w o .d o w w w w w C lic k to bu y 26 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Bubuk Tongkol Jagung 40 mesh (1000 g) Perendaman dalam NaOCl 1% Sebanyak 8 l (8932 g) Selama 5 jam pada suhu 28 oC Air (15.000 g) Air + lignin (23.491,62 g) Pencucian dan penyeringan Pengeringan pada suhu 50 oC selama 48 jam Bubuk tongkol jagung hasil delignifikasi kering (901 g) Perendaman dalam NaOH 15% 4 l (4.246,64 g) selama 24 jam pada suhu 28oC Air (9.000 g) Pencucian dan penyaringan Air + lignin+hemiselulosa (10.486,92 g) Pengeringan pada suhu 50 oC selama 48 jam Bubuk fraksi selulosa tongkol jagung (375,91 g,) Perendaman dalam H2SO4 45% 1l ( 1108,7 g) selama 5 jam pada suhu 28oC Air (7.000 g) Pencucian dan Pengendapan Pengeringan pada suhu 50 oC selama 48 jam Bubuk alfa selulosa tongkol jagung 174 g Gambar 9. Neraca masa proses persiapan substrat Air + selulosa amorf (8.086,92 g) .d o o .c m C m w o .d o w w w w w C lic k to bu y 27 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic B. SAKARIFIKASI SELULOLITIK TONGKOL JAGUNG OLEH Hidrolisis selulosa dapat dilakukan dalam beberapa cara BAKTERI antara lain hidrolisis secara enzimatik dan asam. Hidrolisis secara enzimatik dilakukan dengan menambahkan enzim selulase yang akan mendegradasi rantai pada selulosa menjadi selulosa yang lebih pendek sedangkan hidrolisis asam dilakukan dengan menambahkan asam pada konsentrasi tertentu untuk memecah ikatan glikosidik secara acak. Dalam penelitian yang dilakukan oleh Subekti (2006), hidrolisis enzim lebih banyak menghasilkan gula dibanding dengan hidrolisis asam. Hal ini karena enzim selulase yang dihasilkan oleh mikroba merupakan enzim kompleks sehingga tongkol jagung dapat dihidrolisis secara sempurna. Berdasarkan Kim (1995), enzim selulase merupakan sistem enzim yang terdiri atas endo-1,4- -glukanase, ekso-1,4- glukanase, dan -D-glukanase. Ikatan pada selulosa yang dipotong antara lain endo-1,4- -glukanase memotong selulosa rantai panjang menjadi selulosa rantai pendek, ekso-1,4- -glukanase memotong ujung rantai selulosa menghasilkan molekul selobiosa, sedangkan -D-glukanase memotong molekul selobiosa menjadi dua molekul glukosa. Mekanisme pemotongan dapat dilihat pada Gambar 5. Setiap bakteri selulolitik menghasilkan kompleks enzim selulase yang berbeda beda, tergantung dari gen yang dimiliki dan sumber karbon yang digunakan (White, 1995). Pada penelitian ini semua isolat bakteri dipropagasikan menggunakan media CMC dengan beberapa nutrisi tambahan seperti, glukosa dan ekstrak khamir. Aktivitas bakteri selulolitik mulai terjadi saat glukosa pada medium telah habis sehingga bakteri akan memanfaatkan sumber karbon selulosa dengan mensintesis enzim selulase. Pada tahap ini digunakan empat jenis galur bakteri selulolitik, yaitu isolat C11-1, C4-4, C5-3 dan Cmix yang merupakan pencampuran ketiga jenis isolat yaitu C11-1, C4-4 dan C5-3. Semua isolat tersebut merupakan isolat lokal murni hasil isolasi dari kulit buah pisang yang busuk dengan karakteristik seperti pada Tabel 2. Hasil hidrolisis dilihat pada Gambar 10 dan data di Lampiran 8 sampai dengan 10 . .d o o .c m C m w o .d o w w w w w C lic k to bu y 28 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic . (a) (b) (c) Gambar 10. Perbandingan hubungan waktu dengan jumlah gula hasil hidrolisa pada berbagai substrat; (a) hasil delignifikasi, (b) fraksi selulosa, (c) alpha selulosa. .d o o .c m C m w o .d o w w w w w C lic k to bu y 29 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Dari Gambar 10 ditunjukkan bahwa semua bakteri dapat tumbuh dalam berbagai tongkol jagung yang telah mengalami perlakuan seperti delignifikasi ekstraksi fraksi selulosa dan alfa selulosa. Gambar 10 (a) menunjukkan grafik proses sakarifikasi yang dilakukan pada substrat tongkol jagung yang telah mengalami delignifikasi. Pada proses ini grafik menunjukkan aktivitas yang tidak stabil dengan kecenderungan meningkat. Pada grafik terjadinya fluktuasi (naik turun) dikarenakan aktifitas bakteri dalam media yang juga memanfaatkan substrat untuk pertumbuhan sel. Selain itu, ketidakstabilan pada saat hidrolisis menunjukkan bakteri tidak dapat tumbuh dengan baik. Hal tersebut dimungkinkan karena kandungan lignin yang masih tinggi (11,25%). Lignin yang terdapat pada tongkol jangung dapat menghalangi atau memperlambat akses enzim dalam memecah polisakarida pada proses hidrolisis sehingga dapat menurunkan kinerja enzim pada proses sakarifikasi (Sun, 2002) Gambar 11 (c), merupakan grafik aktivitas sakarifikasi yang dilakukan pada substrat alfa selulosa yang menunjukkan grafik yang juga tidak stabil namun cenderung tetap walaupun kadar gula yang telah dihitung berada pada kadar yang cukup tinggi dibandingkan substrat yang lain. Hal tersebut dimungkinkan sangat sedikit terjadi aktivitas mikroba karena terbentuknya HMF (hidroksi Metil Furfural) sebagai senyawa inhibitor pertumbuhan. Larutan asam yang digunakan dalam perendaman akan memotongan rantai selulosa menjadi selulosa rantai pendek selain itu juga dapat menghasilkan hidroksi metil furfural. Taherzadeh (1999) dan Ulbricht et al. (1984) menyatakan bahwa selama hidrolisis menggunakan asam selain menghasilkan gula juga menghasilkan 5-Hidroksimetil furfural (HMF) yang merupakan komponen inhibitor pada pertumbuhan mikroba sehingga konversi selulosa menjadi gula tidak banyak terjadi. Pada Gambar 11 (b) sakarifikasi dilakukan pada bahan fraksi selulosa. Grafik tersebut menggambarkan aktifitas bakteri yang terlihat teratur. Grafik yang menunjukkan kandungan total gula pada bahan mengalami fase lag pada jam ke-20 dan mulai stasioner pada saat jam ke 32. Berdasarkan penelitian yang telah dilakukan oleh Maranatha (2008), puncak aktifitas enzim terjadi .d o o .c m C m w o .d o w w w w w C lic k to bu y 30 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic antara hari pertama dan hari kedua. Penelitian ini dapat menunjukkan dengan lebih spesifik. Pada fase tersebut kandungan total gula yang dihasilkan berada pada titik maksimum. Menurut Martia et al. (2002), pada fase stasioner kecepatan pembelahan sel sama dengan kecepatan kematian sel dan lisis sel sehingga aktivitasnya menurun. Aktivitas hidrolisis terlihat paling tinggi pada isolat C4-4. Hal tersebut dapat dilihat dari posisi grafik yang selalu berada diatas grafik-grafik yang lain. Bakteri dengan isolat C4-4 mampu menghidrolisis substrat-substrat kompleks pada fraksi selulosa tongkol jagung yang dimungkinkan masih mengandung hemiselulosa dan sedikit lignin. Aktivitas enzim bakteri selulolitik pada berbagai substrat dapat dilihat pada Tabel 8. Tabel 8. Aktivitas enzim isolat C4-4 pada berbagai substrat Aktivitas Bahan (nkat/ml) x 10 Aktivitas Spesifik -3 (nkat/mg) x10-3 CMC (funix) 35,2 106,67 Kertas Saring 39,5 119,70 57,9 81,0 175,45 245,45 Xilan * Tongkol Jagung Sumber : *=Maranatha (2008) Aktivitas enzim pada berbagai substrat tersebut menunjukkan bahwa enzim yang diproduksi oleh bakteri dapat digunakan untuk menghidrolisis substrat kompleks tongkol jagung. Berdasarkan hasil penelitian yang dilakukan oleh Maranatha (2008), besarnya aktifitas isolat C11-1, C5-1 dan C4-4 masing-masing adalah 128 nkat/ml, 80 nkat/ml dan 81 nkat/ml. Berdasarkan data tersebut aktivitas yang tertinggi adalah isolat C11-1 akan tetapi pada penelitian kali ini yang terpilih adalah C4-4 hal tersebut dimungkinkan karena kemampuan tiap isolat untuk menghasilkan enzim yang kompleks dan kemampuan isolat bertahan pada substrat yang kompleks berbeda. Isolat C4-4 dapat mengidrolisa substrat lebih baik dari isolat C11-1. .d o o .c m C m w o .d o w w w w w C lic k to bu y 31 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic (a) (b) (c) (d) Gambar 11. Hasil Mikroskop (a) struktur selulosa tongkol jagung, (b) struktur selulosa yang telah terhidrolisis enzim, (c) struktur selulosa dengan cahaya polarisasi, (d) struktur selulosa hidrolisis enzim dengan cahaya terpolarisasi, perbesaran 400x Pada Gambar 11 merupakan merupakan perbandingan antara struktur selulosa dengan struktur selulosa yang telah terhidrolisis enzim. Pada Gambar 11 (a), nampak struktur selulosa yang masih tersusun lurus dengan gambar cahaya terpolarisasi pada Gambar 11 (c). Pada penampakan selulosa dengan cahaya terpolarisasi terdapat warna hijau kebiruan merupakan struktur kristalin yang masih terdapat pada selulosa seperti lignin. Lignin adalah polimer tiga dimensi yang terdiri atas unit fenil propana yang diikat dengan ikatan eter (CO-C) dan ikatan karbon (C-C). Lignin bersifat tahan terhadap hidrolisis karena adanya ikatan arilalkil dan ikatan eter (Judoamidjojo et al., 1989), serta tidak larut dalam air, dalam larutan asam dan larutan hidrokarbon (Kirk dan Othmer 1952). .d o o .c m C m w o .d o w w w w w C lic k to bu y 32 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Pada Gambar 11 (b) terlihat aktifitas enzim yang menyerang selulosa dengan memotong ikatan pada selulosa menjadi rantai yang lebih pendek. Proses tersebut berlanjut dengan peranan enzim-enzim spesifik lain yang dikeluarkan mikroba untuk menyederhanakan bentuk selulosa hingga menjadi molekul glukosa. Berdasarkan Enari (1983), mekanisme hidrolisis secara enzimatis pertama adalah pemotongan rantai selulosa menjadi selulosa rantai pendek oleh enzim endo-glukanase, kemudian oleh enzim ekso-glukanase disederhanakan lagi menjadi selobiosa. Tahap akhir adalah penyederhanaan selobiosa oleh enzim beta-glukosidase menjadi glukosa. Pada Gambar 11 (d) dengan cahaya terpolarisasi nampak struktur selulosa yang amorf yang dapat dengan mudah ditembus oleh cahaya dibandingkan fraksi selulosa pada awal fermentasi. C. FERMENTASI ETANOL DENGAN KULTUR CAMPURAN Etanol merupakan salah satu produk fermentasi dengan substrat utama gula. Etanol dapat diproduksi dari pati atau selulosa dengan hidrolisis sehingga menghasilkan gula-gula sederhana yang kemudian dikonversi menjadi etanol oleh mikroba. Salah satu mikroorganisme yang dapat digunakan sebagai agen pengkonversi adalah khamir. Menurut Ratladge (1991), khamir dari jenis Sacharomyces cerevisiae adalah mikroorganisme yang paling banyak digunakan dalam fermentasi heksosa (glukosa dan manosa). Sacharomyces cerevisiae dapat memproduksi etanol dari glukosa dan manosa jika konsentrasi gulanya tinggi dan pada kondisi anaerob. Metabolisme glukosa menjadi piruvat melalui jalur Embden Meyerhof Parnas kemudian pada kondisi anaerob piruvat akan dikonversi menjadi etanol. Pada jalur Embden Meyerhof Parnas terjadi reaksi-reaksi fosforilasi dan defosforilasi dengan ATP dan ADP sebagai donor dan akseptor fosfat. Selain itu, pada jalur reaksi tersebut juga terjadi reaksi pemecahan C 6 menjadi 2 molekul C3 yang terfosforilasi, reaksi oksidasi reduksi. Glukosa mengalami fosforilasi menjadi glukosa-6-P dan fruktosa-6-P dengan ATP sebagai donor fosfat. Fruktosa-6-P kemudian menjadi fruktosa 1,6-di-fosfat dengan ATP sebagai donor fosfat. Fruktosa-1,6-difosfat .d o o .c m C m w o .d o w w w w w C lic k to bu y 33 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic kemudian dipecah menjadi 2 molekul C3 yang terfosforilasi yaitu dehidroksi aseton fosfat dan gliseraldehida-3-fosfat. Dehidroksi aseton fosfat selanjutnya teroksidasi menjadi gliserolfosfat kemudian menjadi gliserol yang merupakan metabolit sekunder. Gliseraldehida-3-fosfat tereduksi menjadi asam 1,3-difosfogliserat kemudian mengalami defosforilasi menjadi 3-P-asam gliserat dengan melepaskan fosfat dengan aseptor fosfat ADP membentuk ATP. 3-pasam gliserat selanjutnya membentuk 1-P-asam gliserat kemudian menjadi asam fosfoenol piruvat dengan melepaskan H2 O. Asam fosfoenol piruvat kemudian akan terdefosforilasi menjadi asam piruvat dengan menghasilkan ATP. Asam piruvat akan membentuk asetaldehid dan CO2 melalui reaksi dekarboksilasi dan membentuk etanol melalui reaksi oksidasi. Etanol merupakan metabolit sekunder yang diproduksi pada fase stasioner. Beberapa hal yang menjadi parameter indikator pembentukan etanol antara lain laju pembentukan CO2 dan pengukuran kadar etanol akhir. Pengukuran CO2 dilakukan untuk mengetahui laju fermentasi yang terjadi. Dalam penelitian ini perlakuan yang dilakukan adalah pembedaan waktu inokulasi khamir pada media. Perlakuan dilakukan dengan tujuan untuk mengetahui efektifitas inokulasi khamir. Perlakuan dilakukan dengan cara pembedaan waktu inokulasi khamir yaitu pada jam ke-20 dan jam ke-32. Pembedaan tersebut dimaksudkan untuk penentuan efektifitas dalam waktu produksi etanol sesuai dengan grafik pertumbuhannya yang dapat dilihat pada Gambar 12. P1 P2 Gambar 12. Kurva pertumbuhan bakteri selulolitik isolat C4-4 .d o o .c m C m w o .d o w w w w w C lic k to bu y 34 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Pada Gambar 12 dapat terlihat pada jam ke-20 mikroba berada pada fase akhir eksponensial. Pada waktu itu pertumbuhan masimal dengan akivitas mikroba yang maksimal pula. Saat jam ke-32 pertumbuhan mikroba mengalami fase awal stasioner, dimana aktivitas bakteri selulolitik mulai menurun atau tetap. Pada penelitian juga dilakukan penambahan nutrien lain seperti nitrogen dan fosfor yang diperoleh dengan menambahkan pupuk NPK dan ZA. 1. Laju Pembentukan CO2 Hasil pengukuran laju pembentukan CO2 selama fermentasi menggunakan substrat selulosa tongkol jagung pada waktu penanaman khamir jam ke-20 dan jam ke-32 dapat dilihat pada Gambar 13 Gambar 13. Grafik laju rata-rata pembentukan CO2 selama fermentasi pada perlakuan waktu penanaman khamir Karbondioksida merupakan salah satu produk yang dihasilkan saat terjadi fermentasi. Bahan dasar yang merupakan monosakarida oleh khamir diubah menjadi alkohol dan karbondioksida (CO2). Secara umum persamaan reaksinya dapat ditulis sebagai berikut: C6H12O6 khamir (S. cerevisiae) (Glukosa) 2 C2H5OH + 2 CO2 H= -31,2 kkal (etanol) (gas karbondioksida) Berdasarkan Gambar 13 dapat dilihat bahwa pada saat fermentasi terjadi kenaikan dan penurunan pembentukan CO2. Kenaikan dan penurunan pembentukan CO2 tersebut sebagai indikasi terjadinya fluktuasi pada laju fermentasi. Pada penelitian, penanaman khamir tidak didahului dengan pasteurissasi atau sterilisasi bakteri setelah hidrolisis karena .d o o .c m C m w o .d o w w w w w C lic k to bu y 35 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic diasumsikan kinerja bakteri dalam menghidrolisis selulosa akan sinergis dengan kinerja khamir dalam menghasilkan etanol. Hal tersebut yang menjadi dasar bahwa fluktuasi laju pembentukan CO2 merupakan akibat aktivitas bakteri yang masih ada. Laju pembentukan CO2 terbesar terjadi pada jam ke-6 pada penanaman jam ke-32. Berdasarkan Taherzadeh (1999), laju fermentasi optimum terjadi antara 4 – 6 jam. Pada jam tersebut inokulasi khamir sebanyak 10% dan kandungan gula tertinggi saat sakarifikasi menjadikan aktivitas Saccharomyces cerevisiae paling tinggi. Berbeda dengan perlakuan dengan inokulasi khamir pada jam ke-20, inokulasi dilakukan saat aktivitas bakteri berada pada kondisi yang optimal atau pada fase eksponensial. Fase tersebut merupakan fase kinerja bakteri untuk menghasilkan enzim maksimal sehingga kemungkinan glukosa yang terbentuk sama-sama dimanfaatkan oleh khamir. Sesuai dengan yang di sebutkan oleh Maranatha (2008), aktivitas bakteri selulolitik untuk isolat galur C11-1, C5-1, dan C4-4 maksimal pada pengamatan hari kedua. Laju fermentasi semakin melemah setelah jam ke-6 namun masih terjadi kenaikan pembentukan karbondioksida. Pada saat fermentasi dimungkinkan terjadi penghambatan-penghambatan baik yang dilakukan oleh bakteri ataupun oleh khamir karena bahan yang dibutuh oleh khamir ataupun oleh bakteri sama, yaitu glukosa. Bakteri memanfaatkan glukosa untuk pertumbuhan selnya begitupula dengan khamir. Disisi lain, penghambatan tersebut dapat dimanfaatkan karena bakteri selulolitik akan menghasilkan enzim selulase dengan kondisi glukosa yang sangat minim sedangkan hasilnya dapat dimanfaatkan khamir untuk fermentasi menghasilkan etanol. 2. Karakteristik Produk Kadar etanol yang dihasilkan dalam penelitian ini pada perlakuan inokulasi khamir jam ke-20 dan jam ke-32 berturut-turut adalah 0,39 g/l dan 0,47 g/l (dapat dilihat pada Tabel 10). Jumlah tersebut masih sangat kecil. Rendahnya hasil pada tiap perlakuan dimungkinkan karena faktor .d o o .c m C m w o .d o w w w w w C lic k to bu y 36 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic ketersediaan gula setelah sakarifikasi yang sangat kecil. Selulosa yang merupakan substrat pada saat sakarifikasi belum terurai sempurna menjadi gula sederhana. Dari pengamatan secara visual, selulosa masih berupa endapan lunak yang diduga telah terputus rantai-rantainya menjadi selulosa amorf. Hal tersebut dibuktikan dengan hasil mikoskopik pada Gambar 11. Gambar 11 perlakuan pertama (P1) inokulasi khamir yang dilakukan pada jam ke-20 bakteri masih berada pada fase eksponensial dengan kandungan gula yang lebih rendah. Berbeda dengan kondisi pada perlakuan dengan inokulasi khamir pada jam ke-32 (P2), pada saat itu bakteri sudah mengalami fase stasioner dimana aktivitas bakteri stabil dan produk yang dihasilkan maksimal sehingga khamir dapat memproduksi etanol yang sedikit lebih banyak. Berdasarkan data pengamatan terhadap jumlah mikroba yang dapat dilihat pada Lampiran 10, diperkirakan terjadi penghambatan pertumbuhan khamir yang terjadi pada saat fermentasi. Data menunjukkan jumlah khamir awal sebesar 41 x 10 7 koloni per ml sedangkan pada akhir fermentasi 58 x 106 koloni per ml untuk P1(inokulasi jam ke20) dan 51 x 10 6 koloni per ml untuk P2 (inokulasi jam ke-32). Jumlah tersebut menunjukkan pertumbuhan yang tidak baik pada khamir atau terjadinya penghambatan. Hal yang dimungkinkan menjadi penyebab terhambatnya pertumbuhan khamir adalah ketersediaan substrat untuk khamir berupa gula sederhana yang sangat sedikit. Namun, disisi lain pertumbuhan bakteri cenderung baik karena bakteri dapat hidup dengan substrat yang berupa selulosa rantai pendek. Data pertumbuhan bakteri tercatat 23 x 108 koloni per ml pada awal penanaman. Pada akhir penanaman jumlah bakteri terhitung meningkat menjadi 25 x 109 koloni per ml untuk P1 dan 20 x 10 9 koloni per ml. Penghambatan pada khamir yang berfungsi sebagai agen pengkonversi gula menjadi etanol menyebabkan produksi etanol menjadi rendah. Hasil kuantifikasi bakteri dan khamir dapat dilihat pada Tabel 9. Selain etanol, produk lain yang juga dihasilkan adalah asam. Berdasarkan pengujian kadar total asam pada inokulasi khamir jam ke-20 dan ke-32 masing-masing adalah 1,2 % dan 1,28 %. Terdapatnya asam .d o o .c m C m w o .d o w w w w w C lic k to bu y 37 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Tabel 9. Hasil kuantifikasi mikroba Jumlah bakteri Jumlah khamir (koloni/ml) (koloni/ml) Waktu Awal fermentasi Jam Ke 20 (P1) 23 x 108 41 x 107 Akhir fermentasi 25 x 109 51 x 106 Awal fermentasi Jam Ke-32 (P2) 23 x 108 41 x 107 9 Akhir fermentasi 20 x 10 6 58 x 10 selama fermentasi dikarenakan pada saat fementasi etanol, konversi gula akan melalui jalur Embeden Meyerhouf-Parnas dimana gula akan diubah menjadi etanol melalui produk-produk seperti asam piruvat, aseteldehid. Selain itu juga terbentuk asam-asam organik seperti asam laktat, asam asetat dan gliserol yang merupakan hasil samping dari fermentasi etanol. Hasil analisa total asam dapat dilihat pada Tabel 10. Tabel 10. Analisa jumlah etanol dan total asam Etanol (g/ml) Total Asam (%) Jam Ke 20 (P1) Ulangan 1 0,39 1,2 Ulangan 2 0,31 1,16 Ulangan 1 0,47 1,28 Ulangan 2 0,31 1,2 Jam Ke-32 (P2) .d o o .c m C m w o .d o w w w w w C lic k to bu y 38 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic V. KESIMPULAN DAN SARAN A. KESIMPULAN Tongkol jagung dapat dimanfaatkan menjadi sumber karbon dalam bentuk gula sederhana untuk fermentasi etanol. Perlakuan pendahuluan pada substrat tongkol jagung, seperti delignifikasi, ekstraksi selulosa, dan pembuatan alfa selulosa sangat penting dilakukan dalam proses hidrolisis. Namun aktivitas hidrolitik bakteri selulolitik terbaik pada substrat fraksi selulosa dengan menghasilkan kandungan gula 3,50 g/l oleh isolat bakteri C4-4. Proses produksi etanol dapat dilakukan dengan kultur campuran bakteri dan khamir. Proses produksi etanol dengan perlakuan inokulasi khamir pada jam ke-20 menghasilkan produk sebesar 0,39 g/l dan pada inokulasi jam ke32 0,47 g/l. Berdasarkan pengujian kadar total asam yang merupakan produk samping, pada inokulasi khamir jam ke-20 dan ke-32 masing-masing adalah 1,2 % dan 1,28 %. Produksi etanol dengan kultur campuran menyebabkan pertumbuhan khamir tertekan karena substrat masih berupa selulosa amorf rantai panjang yang tidak larut air sehingga sulit digunakan untuk tumbuh dan produksi etanol. B. SARAN Perlu dilakukan optimalisasi proses hidrolisis seperti konsentrasi jumlah substrat dan suhu agar proses hidrolisis dengan bakteri selulolitik optimal. Selain itu perlu dilakukan kajian mengenai pengeruh konsentrasi jumlah mikroba pada saat penanaman khamir. .d o o .c m C m w o .d o w w w w w C lic k to bu y 39 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c Daftar Pustaka Alam, M. Z., Manchulur M. A., Anwar M. N. 2004. Isolation Purification, Characterization of Cellulolytic Enzyme Produced by The Isolate Streptomyces omiyaensis. Pakist J Biol Sci 7(10):1647-1653. Anggraini, F. 2003. Kajian Ekstraksi dan Hidrolisis Xilan dari Tongkol Jagung (Zea mays L.). Skripsi. Fakultas Teknologi Pertanian, IPB, Bogor. Anonima. 2008. http://www.iptek.apjii.or.id/artikel/ttg_tanaman_obat/depkes/ buku 1/1-295 .pdf. 28 juli 2006 Anonim b. 2008. Prospek dan Arah Pengembangan Agribisnis Jagung. http://www.litbang_deptan.go.id/spesial/ komoditas/ files/0104JAGUNG.pdf AOAC. 1984. Official Methods Analysis The Association of Official Analytical Chemist. 14 th ed. AOAC, Inc. Arlinton. Virginia. Apriyantono,A., D. Fardiaz, N. L. Puspitasari, Sedarnawati, dan S. Budiyanto. 1989. Petunjuk Laboratorium Analisis Pangan. Penerbit Institut Pertanian Bogor. Bogor. Ariestaningtyas, Y.1991. Pemamfaaatan Tongkol Jagung untuk Produksi Enzim Selulase oleh Trichoderma viride. Skripsi. Fateta IPB. Bogor. Bradford, M. M. 1976. A rapid and sensitive for the quantitation of microgram quantitites of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72 : 248-254. Brunow, G., Karhunen, P., Lundquist, K., Olson, S. dan Stomberg, R. (1995). Investigation of Lignin Models of the Biphenyl Type by X-Ray Crystallography dan NMR Spectroscopy, J. Chem. Crystallogr. 25, 1-10. Burchadat, G dan L.O. Ingaram. 1992. Conversion of Xylan to Ethanol by Ethanologic Strain of Escherisia Coli and Clebsiella Ocytoca. Appl. And Environ Microbiol. 58: 1128-1133. Casey, J. P. 1952. Pulp and Paper. Chemistry and Chemical Technology. Interscience Publiser. London. Chang, M.M., T. C. Chon dan G.T. Tsao. 1981. Structure Pretreatment and Hydrolysis Cellulose. Adv. Biochem. Eng. 20: 14-25. Enari, T.M. 1983. Microbial Cellulase. Di dalam W. M. Fogarty (ed). Microbial Enzyme and Biotechnology Applied Science Publisher. New York Fengel, D. dan D. Wegner. 1995. Kimia Kayu, Reaksi Ultrastruktur: Terjemahan S. Hardjono. UGM Press. Yogyakarta. Foody, B.J., S. Tohan dan J.D. Bernstein.1999. Pretreatmen Process for Conversion of Cellulose to Fuel Ethanol. U.S. pat. No..6.090.595. Fraizer, W.C. dan D.C. Westhoff. 1978. Food Microbiology 4 th (ed). McGrawHill Book. Publishing. Co. Ltd. New York. .d o m o o c u-tr a c k C w w w .d o m C lic k to 40 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c Frida, T. 1989. Pengaruh Cara Delignifikasi Terhadap Sakarifikasi Limbah Ligniselulolitik. Skripsi. Fateta IPB. Bogor. Garotte, G, H. Domingguez dan J. C Parajo. 2002. Auto Hydrolysis of Corncob: Study of Non-Isothermal Operation for Xylooligosaccharide Production. J. of Food Eng. 52:211-218 Holtzapple M.T. 1993. Cellulose. In: Encyclopedia of Food Science., Food Technology and Nutrition, 2: 2731-2738. Academic Press. London. Ingram, L. O. Dan Doran, J. B. . 1995. Conveersion of Selulosic Material to Ethanol. FEMS Microbiology Reviews. 16 (2-3), 235-241. Irawadi, T.T. 1990. Selulase. PAU-Biotek. Institut Pertanian Bogor, Bogor Johnson, L.A. 1991. Corn: Production, Processing and Utilization. Didalam K.J. Lorentz and K. Kulp (ed). Handbook of Cereal Science and Technology. Marcell Dekker, Inc., New York Judoamidjojo, R.M, E.G. Said, L. Hartoto. 1989. Biokonversi. Depdikbud. Dirjen Pendidikan Tinggi. Pusat Antar Universitas Bioteknologi, IPB, Bogor. Kim, H. 1995. Characterization and Substrate Specivicity of an Endo-Betha-1,4D-Glukanase (Avicelase I) from An Extracelluler Multienzyme Complex of Bacillus Circulans. Appl Environ Microbiol 61: 959-965. Krik, R.E. dan D.F. Othmer. 1952. Encyclopedia of Chemical Technology. Vo.8. p : 327-338. The Interscience Encyclopedia. Inc, New York. Kosaric, H., A. Wieczorec, G, P. Cosentino, R. J. Magee dan J. E. Presonil. 1983. Ethanol Fermentation. Didalam H. Dellweg (ed). Biotechnology Volume III. Verlag Cheme, Weinheim. Lachke, A. 2002. Biofuel from D-Xylose The Second Most Abundant Sugar. Biochemical Science of Chemical Laboratory. India. Lynd, L.R., P.J. Weimer, W.H. van Zyl, and I.S. Pretorius. 2002. Microbial Cellulase Utilization: Fundamentals and Biotechnology. Microbiol. and Mol. Biol. Rev. 66(3): 506-577. Maranatha, B. 2008. Aktivitas Ensim Selulase Isolat Asal Indonesia pada Berbagai Substrat Limbah Pertanian. FMIPA IPB. Murdiayatmo, U. 1985. Perlakuan dengan Natrium Hidroksida (NaOH) dan Konversinya Menjadi Gula Reduksi oleh Enzim Selulase. Bull. BPPPG. 108 :1-8 Oura, E. 1983. Reaction Product of Yeast Fermentation. Didalam H. Dellweg (ed). Biotechnology Volume III. Academic Press, New York. Paturau, J. M. 1969. By Product of The Cane Sugar Industry: An Introduction to their Industrial Utilization. Elsevier Scientific Publ. Co., Amsterdam. Prescott, S. C. dan C.G. Dunn.1981. Industrial Microbiology. MCGraw-Hill BookCo.Ltd., New York. Ratledge, C. 1991. Yeast Physiology - a Micro-synopsis. Bioprocess Engineering. 6:195-203. .d o m o o c u-tr a c k C w w w .d o m C lic k to 41 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N y bu bu y N O W ! PD O W ! PD to k lic .c Resita, T.D. 2006. Produksi Selooligosakarida dari Tongkol Jagung. Skripsi. Fateta IPB. Bogor. Subekti, H. 2006. Produksi Bioetanol dari Tongkol Jagung menggunakan Hidrolisis Asam dan Hidrolisis Enzim. Skripsi. Fateta IPB. Bogor. Sun, Y. dan Cheng, J. 2002. Hydrolysis of lignocellulosic material for ethanol production: areview. Biores. Technol. 83:1-11. Taherzadeh, M.J. 1999. Ethanol from Lignocellulose: Physiological Effects of Inhibitors and Fermentation Strategies. Ph.D. Tesis. Universitas Chalmers, Goteborg, Swedia. Tsao, G.T., M. Ladisch, T. A. Hsu, B. Dale, C. Ladisch dan T. Chou.1978. Fermentation Substrates From Cellulosic Material. Di dalam D. Perlman (ed). Annual Report on Fermentation Processes Volume 2. Academic Press, New York. Van Soest, P.J. 1963. Use of Detergent in Analysis of Fibrous Feeds III. Di dalam M.L. Dreher (ed.). The Handbook of Dietary Fiber. New York, USA. Widyani, I. G. A. 2002. Ekstraksi Xilan dari Tongkol Jagung dan Kulit Ari Kedelai. Skripsi. Departemen Teknologi Industri Pertanian, Teknologi Pertanian, Institut Pertanian Bogor, Bogor.White, D. 1995. The Physiology and Biochemistry of Prokaryotes. New York: Oxford University Pres. Xiang, Q., Y.Y. Lee, P.O. Pettersson, and R.W. Torget. 2003. Heterogenous Aspects of Acid Hydrolysis of -cellulose. App. Biochem. And Biotechnol. 105:505-514. .d o m o o c u-tr a c k C w w w .d o m C lic k to 42 w w w c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Lampiran 1. Diagram alir proses persiapan substrat Tepung Tongkol Jagung + 40 mesh Delignifikasi menggunakan NaOCl 1%, 5 jam, 280C Pencucian dan pengeringan Hasil Delignifikasi (S1) Ekstraksi menggunakan NaOH 15%, 24 jam, 28 0C Pencucian dan pengeringan Fraksi Selulosa (S2) Hidrolisis Alfa selulosa menggunakan H2SO4 45%, 4 jam Alfa Selulosa (S3) Hemiselulosa .d o o .c m C m w o .d o w w w w w C lic k to bu y 43 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Lampiran 2. Analisis kimia tongkol jagung 1. Kadar Air (Apriyantono et al., 1989) Cawan kosong dioven selama 15 menit kemudian didinginkan dalam desikator dan ditimbang sebanyak 5 g sampel ditimbang kemudian dimasukkan dalam cawan. Sampel dalam cawan dioven selama 2 jam pada suhu 105 °C. Setelah itu cawan dimasukkan ke desikator dan ditimbang. Pengovenan dilakukan berulang-ulang untuk mendapatkan berat konstan. Cawan kosong dikeringkan dalam oven 15 menit Didinginkan dalam desikator, ditimbang 5 g sampel ditimbang Dimasukkan dalam cawan Dikeringkan dalam oven 105 °C, 2 jam Dimasukkan dalam desikator Ditimbang sampai konstan W1 –W2 Ka = x 100 % W1 Keterangan : Ka = Kadar Air (Berat Basah) W1 = Berat sampel sebelum dikeringkan (g) W2 = Berat sampel setelah dikeringkan (g) .d o o .c m C m w o .d o w w w w w C lic k to bu y 44 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic 2. Kadar Protein (AOAC, 1984) Sampel sebanyak 0,1 g dimasukkan ke dalam labu kjedhal dengan CuSO4 dan Na2SO4 katalisator masing-masing 1 g serta H2SO4. Labu kjedhal yang berisi sampel dipanaskan selama 1-1,5 jam sampai cairan jernih kemudian didinginkan. Isi labu dipipet dan dimasukkan dalam labu destilasi. Setelah itu ditambah 15 ml NaOH 50 % kemudian dibilas dengan aquades. Labu Erlenmeyer berisi HCl 0,02 N 25 ml ditambah 2-4 tetes indikator (campuran metal merah 0,02% dalam alkohol dan metal biru 0,02 dalam alkohol dengan perbandingan 2:1) diletakkan di bawah kondensor dengan ujungnya terendam dalam labu larutan HCl. Destilasi (hingga 25 ml destilat dalam labu erlenmeyer). Titrasi dengan NaOH 0,02 N (sampai warna hijau jadi ungu) (ml NaOH–ml blanko) x N NaOH x 16,25 x 14 % Total N = x 100 % mg sampel %Protein = % total N x faktor konversi 3. Kadar Abu (AOAC, 1984) Contoh sebanyak 3-5 g dimasukkan ke dalam cawan porselin yang telah diketahui bobotnya, kemudian diabukan dalam furnace pada suhu 6000C selama kurang lebih 4 jam atau sampai diperoleh abu berwarna putih. Setelah itu cawan didinginkan dalam desikator sampai suhu ruang dan ditimbang. Bobot abu Kadar Abu = x 100% Bobot Contoh 4. Kadar Lemak (Metode Ekstraksi Soxhlet) (AOAC, 1984) .d o o .c m C m w o .d o w w w w w C lic k to bu y 45 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Sebanyak ± 5 g sampel yang telah ditepungkan dibungkus dengan kertas saring, dimasukkan ke dalam labu Soxhlet, lalu ditambahkan heksan secukupnya dan direfluks selama 5-6 jam. Kemudian, labu lemak yang berisi lemak hasil ekstraksi dan pelarut dipanaskan pada oven dengan suhu 1050C. setelah itu didinginkan dalam desikator dan ditimbang beratnya. Berat lemak (g) Kadar lemak = x 100% Berat sampel (g) 5. Kadar Serat Kasar (AOAC, 1984) Contoh sebanyak 5 g dimasukkan ke dalam labu erlenmeyer 500 ml kemudian ditambahkan 100 ml H2SO4 0,325 N dan dididihkan selama kurang lebih 30 menit. Ditambahkan lagi 50 ml NaOH 1,25 N dan dididihkan selama 30 menit. Dalam keadaan panas disaring dengan kertas Whatman No.40 setelah diketahui bobot keringnya. Kertas saring yang digunakan dicuci berturut-turut dengan air panas, 25 ml H2SO4 dan etanol 95%. Kemudian dikeringkan di dalam oven bersuhu 100-1100C sampai bobotnya konstan. Kertas saring didinginkan dalam desikator dan ditimbang. Bobot endapan kering Kadar serat kasar (%) = x 100% Bobot contoh 6. Kadar Lignin (AOAC, 1984) Sampel sebanyak 1 g ditimbang dalam labu erlenmeyer 250 ml kemudian ditambahkan H2SO4 20 ml. Selanjutnya didiamkan selama 2 jam dan dikocok perlahan-lahan. Sampel kemudian ditambahkan aquades sebanyak 250 ml, dipanaskan dalam waterbath pada suhu 100 0C selama 3 jam. Selanjutnya dilakukan penyaringan dengan menggunakan kertas saring yang telah diketahui bobotnya (A). Erlenmeyer dan corong dibilas dengan aquades sebanyak 3 kali. Kertas saring beserta residu diovenkan pada suhu 1050C selama 1-2 jam atau pada suhu 500C selama 24 jam. Kertas saring didinginkan dan ditimbang bobotnya (B). Kertas saring dengan residu .d o o .c m C m w o .d o w w w w w C lic k to bu y 46 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic diabukan dengan muffle furnace pada suhu 6000C selama 3-4 jam. Kemudian didinginkan dan ditimbang (C). B –A –C Kadar lignin (%) = x 100% Bobot contoh Keterangan: B = bobot kertas saring dan residu setelah dioven (g) A = bobot kertas saring (g) C = bobot abu (g) 7. Kadar NDF ( Van Soest, 1963) Sampel sebanyak A g, dimasukkan ke dalam gelas piala berukuran 500 ml serta ditambahkan dengan larutan NDS. Larutan NDS terdiri dari bahan kimia sebagai berikut : aquades 1 l; Natrium sulfat 30 g; EDTA 18,81 g; Natrium Borat 10 H2O 6,81 g; di-Na-HPO4 anhidrat 4,5 g dan 2etoksi etanol murni 10 ml. Selanjutnya menimbang filter glass G-3 (B). Sampel yang telah ditambahkan larutan NDS disaring dengan bantuan pompa vakum, dibilas dengan air panas dan aseton. Hasil penyaringan tersebut dikeringkan dalam oven 105°C, setelah itu dimasukkan dalam esikator selama satu jam, kemudian dilakukan penimbangan terakhir (C). C-B % NDF = x 100% A Keterangan : A = bobot sampel (g) B = bobot filter glass (g) C = bobot filter glass dan sampel setelah dioven 8. Kadar ADF dan Hemiselulosa ( Van Soest, 1963) Sampel sebanyak A g, dimasukkan ke dalam gelas piala serta ditambahkan dengan 50 ml larutan ADS. Larutan ADS terdiri dari : H2SO4; CTAB (cethyle trimethyl ammonium bromide). Sampel yang telah .d o o .c m C m w o .d o w w w w w C lic k to bu y 47 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic ditambahkan larutan tersebut dipanaskan selama satu jam di atas penangas listrik. Penyaringan dilakukan dengan bantuan pompa vacum dengan juga menggunakan filter glass yang ditimbang (B). Pencucian dilakukan dengan aseton dan air panas. Dilakukan pengeringan dan memasukkan hasil penyaringan tersebut ke dalam oven. Setelah itu dimasukkan lagi ke dalam desikator untuk melakukan pendinginan dan ditimbang (C). C-B % ADF = x 100% A Keterangan : A = bobot sampel (g) B = bobot filter glass (g) C = bobot filter glass dan sampel setelah dioven Kadar Hemiselulosa = % NDF - % ADF 9. Kadar Selulosa Residu ADF (C) yang berada di dalam filter glass diletakkan di atas nampan yang berisi air setinggi kira-kira 1 cm. Kemudian ditambahkan H2SO4 setinggi ¾ bagian filter glass dan dibiarkan selama 3 jam sambil diaduk-aduk. Penyaringan dilakukan dengan bantuan pompa vacum dengan juga menggunakan filter glass. Pencucian dilakukan dengan aseton dan air panas. Dilakukan pengeringan dan memasukkan hasil penyaringan tersebut ke dalam oven. Setelah itu dimasukkan lagi ke dalam desikator untuk melakukan pendinginan dan ditimbang (D). D-C % Selulosa = x 100% A Keterangan : A = bobot sampel (g) D = bobot filter glass dan residu ADF setelah dioven (g) C = bobot filter glass dan residu ADF awal (g) .d o o .c m C m w o .d o w w w w w C lic k to bu y 48 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Lampiran 3. Prosedur analisis parameter fermentasi 1. Penentuan Total Gula , Metode Phenol H2SO4 Sebelum melakukan pengujian sampel maka perlu diketahui kurva standar fenol yang digunakan. Pembuatan kurva standar fenol adalah sebagai berikut : 2 ml larutan glukosa standar yang mengandung 0, 10, 20, 30, 40, dan 60 µg masing-masing dimasukkan kedalam tabung reaksi, ditambahkan 1 ml larutan fenol 5% dan dikocok. Kemudian 5 ml asam sulfat pekat ditambahkan dengan cepat. Biarkan selama 10 menit, kocok lalu tempatkan pada penanggas air selama 15 menit. Absorbansinya diukur pada 490 nm. Pengujian sampel sama dengan pembuatan kurva standar fenol hanya 2 ml larutan glukosa diganti dengan 2 ml sampel. 2. Total Biomassa Pengukiran biomassa dilakukan dengan penyaringan menggunakan metode TPC (Total Plate Count). Cairan yang diduga mengandung mikroorganisme diencerkan kemudian diambil 1 ml untuk ditanamkan kedalam media agar. 3. Total Asam Total asam ditentukan dengan cara titrasi dan dinyatakan dalam persen asam laktat (Rinaldy, 1987).Sebanyak 1 ml cairan dipipet kedalam erlenmeyer 50 ml, ditambahkan 9 ml air suling, kemudian dipanaskan untuk menghilangkan CO2 yang ada. Dititrasi dengan NaOH 0,1 N dengan indikatorfenolftalein. ml titer x normalitas Total Asam = x9 ml contoh 4. Kadar Etanol .d o o .c m C m w o .d o w w w w w C lic k to bu y 49 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Pengukuran kadar etanol sampel dilakuakan menggunakan GC (Gas Chomatrography). Penentuan dilakukan dengan membandingkan waktu retensi sampel dengan waktu retensi standar etanol. Standar etanol yang diinjeksikan dengan konsentrasi 1% (v/v). Kadar etanol yang terdapat dalam sampel dihitung dengan menggunakan persamaan berikut : Luas Area Sampel Kadar Etanol = x [standar] Luas Area Standar .d o o .c m C m w o .d o w w w w w C lic k to bu y 50 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Lampiran 4. Prosedur analisa aktivitas FP-ase 1. Pembuatan Pereaksi a. Buffer sitrat Larutan 0,05 M Na-sitrat dicampur dengan larutan 0,05 M asam sitrat dengan perbandingan 27 : 23, maka akan diperoleh larutan buffer sitrat dengan pH 4,8 pada konsentrasi 0,05 M. b. Peraksi DNS 10,6 g DNS dan 19,8 g NaOH dilarutkan dalam 1416 ml air, kemudian ditambahkan 306 g garam Rochele (Na-K tartarat) dan 7,6 ml fenol serta 8,3 g metabisulfit. 2. Pengujian aktivitas FP-ase Pengujian aktivitas enzim filter paperase (FP-ase) dapat mencerminkan aktivitas umum selulase, karena substrat untuk pengujiannya digunakan serat yang masih bersifat kristal sehingga melibatkan aktivitas C1 yang berperan sebagai pengaktif selulosa kristal menjadi selulosa reaktif (Reese et al., 1950). Substrat yang digunakan untuk pengujian ini adalah kertas saring Whatman No. 1 sedangkan pereaksinya adalah DNS. Sebagai standar digunakan larutan glukosa. Bagan alir pengujiannya adalah sebagai berikut : 1 ml filtrat 1 ml buffer enzim sitrat pH 4,8 kertas saring Whatman no. 1 Inkubasi pada suhu 50ºC Selama 60 menit Ditambah 3 ml pereaksi DNS Ditempatkan dalam air mendidih selama 5 menit Dibaca absorbansi pada panjang gelombang 550 nm .d o o .c m C m w o .d o w w w w w C lic k to bu y 51 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Lampiran 5. Prosedur analisa aktivitas CMC-ase 1. Pembuatan Pereaksi a. Larutan CMC 1 % CMC sebanyak 10 g dilarutkan dalam 800 ml air panas sambil dikocok secara kontinyu, selanjutnya diambil 100 ml buffer sirat 0,05 M pH 4,8, 10 ml merthiolat 1 % dan ditepatkan volumenya sampai 1 l. Larutan ini disimpan dalam lemari pendingin dan dipanaskan (500C) sebelum digunakan. b. Pereaksi DNS Prosedur pembuatan pereaksi DNS sama dengan Lampiran 4. 2. Pengujian aktivitas CMC-ase Pengujian aktivitas enzim carboxy methyl cellulase (CMC-ase) dapat mencerminkan aktivitas enzim endoglukanase yang menyerang selulosa yang telah diregangkan struktur seratnya ataupun selulosa yang telah disubtitusi. Substrat yang digunakan untuk pengujian ini adalah larutan CMC 1% sedangkan pereaksinya adalah DNS (dinitro salicylic acid). Sebagai standar digunakan larutan glukosa. Bagan alir pengujiannya adalah sebagai berikut : 0,5 ml filtrat enzim 0,5 ml larutan CMC 1% Inkubasi pada suhu 50ºC Selama 30 menit Ditambah 3 ml pereaksi DNS Ditempatkan dalam air mendidih selama 5 menit Dibaca absorbansi pada panjang gelombang 550 nm .d o o .c m C m w o .d o w w w w w C lic k to bu y 52 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Lampiran 6. Prosedur Kandungan Protein Terlarut Dalam Filtrat 1. Persiapan Pereaksi Bradford Sebanyak 25 mg Coomasie Brilliant Blue G-250 dilarutkan ke dalam 12,5 ml etanol 95%, kemudian ditambah 25 ml asam fosfat 85%. Selanjutnya larutan diencerkan dengan air bebas ion sehingga menjadi 250 ml dan disaring menggunakan kertas saring. 2. Pembuatan Kurva Standar Protein BSA (Bovine Serum Albumin) Sebagai standar digunakan BSA fraksi V yang dibuat dengan melarutkan 50 mg BSA dalam 25 ml akuades. Reaksi dibiarkan tanpa dikocok, setelah larut semua kemudian diencerkan dengan akuades sampai 50 ml. Setelah itu dibuat larutan standar protein dengan konsentrasi sebagai berikut : No Tabung 1 2 3 4 5 6 7 8 9 10 Volume Standar (ml) 0,5 1 2 3 4 5 6 7 8 9 Volume Akuades (ml) 9,5 9 8 7 6 5 4 3 2 1 [Protein] (mg/ml) 0,05 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 3. Pengukuran Kadar Protein Terlarut dalam Filtrat (Bradford, 1976) Masing-masing larutan protein sebanyak 0,1 ml dimasukkan ke dalam tabung reaksi, sedangkan sebagai blankonya, dimasukkan 0,1 ml akuades ke dalam tabung reaksi. Selanjutnya ditambahkan 5 ml pereaksi Bradford dan dikocok selama 2 menit. Selain itu larutan diukur absorbansinya dengan spektrofotometer pada panjang gelombang 595 nm. .d o o .c m C m w o .d o w w w w w C lic k to bu y 53 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Lampiran 7. Diagram Alir Proses Penelitian Kultur bakteri selulolitik pada agar miring CMC Sigma 1% Substrat S1, S2, dan S3 Hidrolisis menggunakan Bakteri selulolitik (C4-4, C5-1, C11-1 dan Cmix) Penentuan waktu penanaman khamir Penambahan Nutrien/pupuk 0,04 g NPK dan 0,15 g ZA pada 100 ml substrat Pengaturan pH 4,8 Inikolasi dengan starter (10% Volume Substrat) Fermentasi (Kondisi anaerobik, suhu kamar) Pasteurisasi 650C, 5 menit Analisa Produk Kultur bakteri selulolitik pada buffer CMC Sigma 1% (b/v) Kultur khamir pada PDA, Inkuasi 48 jam, aerobik, suhu kamar Inikulasi pada PDB, 24 jam, aerobik, suhu kamar Starter Saccharomyces sereviceae .d o o .c m C m w o .d o w w w w w C lic k to bu y 54 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic .d o m w o .c C m o .d o w w w w w C lic k to bu y 55 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Lampiran 8. Data analisa total gula hidrolisis fraksi selulosa oleh berbagai isolat bakteri Ulangan 1 jam ke 0 4 8 14 20 32 44 68 92 116 140 164 c11-1 1,76 1,89 1,43 2,01 2,01 1,54 1,97 1,87 1,42 1,33 2,66 1,36 c5-1 1,52 1,56 1,21 1,74 1,92 1,69 1,97 1,93 2,32 1,03 1,03 2,57 Ulangan 2 Jam ke C11-1 C5-1 0 1,48 4 1,14 8 1,18 14 1,15 20 1,14 32 1,87 44 1,98 68 2,17 92 1,89 116 1,77 140 1,98 164 1,78 c4-4 1,10 1,19 1,26 1,39 1,89 1,59 1,64 1,67 1,53 0,91 1,54 3,16 1,47 1,63 1,27 1,27 1,11 2,03 2,13 2,00 1,97 1,85 1,81 1,87 cMix 0,92 1,05 1,10 1,44 1,58 1,59 1,59 1,61 0,84 2,27 1,18 3,14 C4-4 Cmix 1,60 1,73 1,63 1,64 1,31 1,33 1,21 1,24 1,24 1,12 1,89 1,60 2,05 2,06 2,23 2,06 2,26 2,17 1,96 1,87 1,85 1,79 2,00 1,68 Ulangan 3 Jam ke C11-1 C5-1 C4-4 Cmix 0 0,85 1,71 1,58 1,78 4 1,40 1,78 1,55 1,93 8 1,35 1,69 1,51 1,84 14 1,38 1,80 1,59 1,75 20 1,81 1,94 1,81 1,73 32 2,68 3,20 3,50 3,55 44 2,63 3,19 3,47 3,38 68 2,57 2,97 3,39 3,27 92 2,46 3,07 3,43 3,24 116 2,43 2,97 3,34 3,00 140 2,50 3,02 3,08 2,96 164 2,44 3,12 2,93 3,36 .d o o .c m C m w o .d o w w w w w C lic k to bu y 55 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Lampiran 9. Analisa total gula hidrolisis hasil delignifikasi oleh berbagai isolat bakteri Ulangan 1 jam ke 0 4 8 14 20 32 44 68 92 116 140 164 C11-1 1,07 1,07 1,22 1,17 1,08 1,23 1,18 1,03 1,00 0,98 1,42 1,17 C5-1 1,02 1,06 1,22 1,00 1,14 1,20 1,09 1,12 1,08 1,04 0,98 1,35 C4-4 1,23 1,25 1,27 1,28 0,96 1,03 1,06 1,16 1,37 1,40 1,88 2,00 CMix 1,13 1,24 1,25 1,09 1,03 1,30 1,09 1,01 0,82 1,01 1,39 1,28 Ulangan 2 Jam ke 0 4 8 14 20 32 44 68 92 116 140 164 C11-1 C5-1 1,64 1,74 1,52 1,27 1,44 1,16 1,64 1,36 1,58 1,68 1,48 1,24 C4-4 1,59 1,82 1,86 1,55 1,56 1,33 1,64 1,36 1,42 1,41 1,33 1,41 1,78 1,85 1,47 1,36 1,17 1,85 1,59 1,46 1,46 1,53 1,52 1,87 Cmix 1,90 1,89 1,86 1,71 1,45 1,42 1,55 1,61 1,42 1,65 1,72 1,70 .d o o .c m C m w o .d o w w w w w C lic k to bu y 56 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Lampiran 10. Analisa total gula hidrolisis alpha selulosa oleh berbagai isolat bakteri Ulangan 1 jam ke 0 4 8 14 20 32 44 68 92 116 140 164 C11-1 2,85 2,37 2,44 2,43 2,61 2,57 2,33 2,88 2,70 2,60 2,41 2,28 C5-1 2,23 2,43 2,43 2,33 2,57 2,41 2,47 2,33 2,51 2,49 2,76 2,67 C4-4 2,80 2,62 2,49 2,30 2,47 2,45 2,23 2,34 2,55 2,45 2,87 2,52 Cmix 2,37 2,30 2,44 2,43 2,37 2,30 2,17 2,21 2,33 2,40 2,95 2,26 Ulangan 2 Jam ke C11-1 0 2,43 4 2,63 8 2,63 14 2,60 20 2,59 32 2,66 44 2,61 68 2,69 92 2,67 116 2,66 140 2,74 164 2,60 C5-1 2,72 2,68 2,67 2,60 2,66 2,60 2,59 2,62 2,65 2,62 2,63 2,73 C4-4 2,61 2,61 2,71 2,55 2,52 2,47 2,57 2,52 2,54 2,59 2,60 2,75 Cmix 2,62 2,57 2,63 2,59 2,70 2,62 2,52 2,33 2,68 2,67 2,71 2,42 .d o o .c m C m w o .d o w w w w w C lic k to bu y 57 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Lampiran 11. Kromatogram etanol hasil fermentasi A. Standar B. Perlakuan waktu inokulasi jam ke-20 Ulangan 1 .d o o .c m C m w o .d o w w w w w C lic k to bu y 58 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Ulangan 2 C. Perlakuan waktu inokulasi jam ke-32 Ulangan1 .d o o .c m C m w o .d o w w w w w C lic k to bu y 59 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Ulangan 2 Spesifikasi jenis kromatografi yang dipakai : Merek : Hitachi 263-50 Detektor : Fid Kolom OV-17, 250oC Suhu Injek : 100 oC Suhu kolom : 200 oC Volume Inject : 2 µl Konsentrasi Standar : 1% .d o o .c m C m w o .d o w w w w w C lic k to bu y 60 c u-tr a c k .c H F-XC A N GE H F-XC A N GE N N O W ! PD O W ! PD c u-tr a c k y bu to k lic Lampiran 12. Hasil analisa jumlah mikroba Waktu Jumlah bakteri Jumlah khamir (koloni/ml) (koloni/ml) Jam Ke 20 (P1) Awal fermentasi Ulangan 1 18 x 108 46 x 107 Awal fermentasi Ulangan 2 28 x 108 36 x 107 Rata-rata 23 x 108 41 x 107 Akhir fermentasi Ulangan 1 28 x 109 60 x 106 Akhir fermentasi Ulangan 2 22 x 109 42 x 106 Rata-rata 25 x 109 51 x 106 Jam Ke-32 (P2) Awal fermentasi Ulangan 1 18 x 108 46 x 107 Awal fermentasi Ulangan 2 28 x 108 36 x 107 Rata-rata 23 x 108 41 x 107 Akhir fermentasi Ulangan 1 23 x 109 52 x 106 Akhir fermentasi Ulangan 2 17 x 109 64 x 106 Rata-rata 9 20 x 10 6 58 x 10 .d o o .c m C m w o .d o w w w w w C lic k to bu y 61 c u-tr a c k .c