transgenic mice - Website Staff UI
advertisement

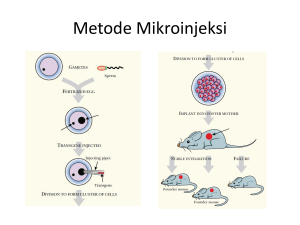
1 PENGEMBANGAN MODEL HEWAN COBA (TRANSGENIC MICE) DALAM MENUNJANG PENELITIAN KANKER ** dr. Ahmad Aulia Jusuf, PhD Bagian Histologi Fakultas Kedokteran Universitas Indonesia 2009 PENDAHULUAN Tikus transgenik telah banyak digunakan secara luas di dalam penelitian biomedik. Riwayat tikus transgenik dimulai ketika Palmitter pada tahun 1981 memasukan gen thymidine kinase dari virus herpes ke dalam sel telur tikus yang telah dibuahi (zygot).2,3 Beberapa makalah tentang tikus transgenik telah dipublikasikan oleh Palmitter (1986)4, Jaenisch (1988)5 dan Hanahan (1989)6. Gordon dkk pada tahun 1983 telah mengembangkan tehnik yang lebih baik dan fleksibel yaitu dengan menyuntikkan gen yang akan diamati secara langsung ke dalam pronucleus telur tikus yang telah dibuahi (zigot)7. Metode untuk membuat tikus transgenik makin disempurnakan oleh Hogan dkk pada tahun 1994.8 Tikus transgenik digunakan sebagai model hewan coba untuk mempelajari regulasi gen-gen yang terkait dengan perkembangan jaringan tubuh dan gen-gen yang spesifik yang berperan dalam pertumbuhan jaringan tubuh tertentu serta mempelajari fenotif gen pada jaringan tubuh. Disamping itu tikus transgenik juga dapat digunakan untuk mempelajari regulasi gen-gen yang berperan dalam proses terjadinya kanker (oncogenesis) dan mempelajari efek zat atau senyawa tertentu dalam terapi penyakit.1,2,3,10 Makalah ini akan menguraikan pengertian tikus transgenik dan kegunaannya, metoda untuk membuat tikus transgenik, peran tikus transgenik sebagai hewan model untuk mempelajari proses karsinogenesis dan penggunaan tikus transgenik dalam mencari bahan-bahan herbal yang dapat digunakan dalam terapi kanker.1,2,20 ** Disampaikan pada Simposium Penelitian Bahan Obat Alami XIV dan Muktamar XI Perhipba, Jakarta 11-12 Agustus 2009 2 DEFINISI Tikus transgenik adalah tikus yang mempunyai genom (susunan gen) yang telah dimodifikasi secara artifisial melalui rekayasa genetik (genetic engineering) dan dapat diteruskan kepada turunannya.1,2 Fragmen DNA atau gen yang dimasukkan kedalam suatu sel akan diligasikan secara ujung ke ujung (end to end) kesuatu tempat tertentu di dalam suatu kromosom secara acak oleh ensim ligasi intraselular sehingga gen atau fragmen DNA itu akan tersusun secara tandem2,9 (Gb-1). Telur tikus yang telah dibuahi (fertilized eggs/zigot) yang kedalam pronukleusnya telah disuntikkan fragmen DNA akan berkembang menjadi tikus dengan banyak sel-sel tubuhnya mengandung fragmen DNA atau gen yang dimasukkan tersebut. Fragmen DNA atau gen yang injeksikan kedalam pronukleus telur tikus yang telah dibuahi ini dikenal sebagai transgen.3 Transgen ini bisa merupakan gen yang tidak dipunyai oleh tikus (gen eksogen/exogenous gene) atau gen yang sudah ada pada tikus (gen endogen/endogenous gene) Transgen yang diinjeksikan ini akan menempel dan tersusun secara tandem pada tempat tertentu di dalam suatu kromosom individu transgenik (host) tersebut secara random.2,3 Bila kromosom yang telah dimodifikasi ini hadir pada sel-sel kelamin (sel telur dan sperma) maka tikus tersebut akan meneruskan kromosom yang telah dimodifikasi ini ke tikus turunannya. Tikus yang susunan gennya telah berubah secara permanen ini dikenal sebagai tikus transgenik (transgenic mice).3 Tikus transgenik yang membawa gen-gen yang terlibat dalam proses onkogenesis dikenal sebagai ”oncomice”.18 gen gen gen gen Gen yang tersusun secara tandem Gambar 1- Susunan tandem dari gen yang diinsersikan secara acak pada suatu kromosom tertentu pada setiap sel tubuh tikus 3 KEGUNAAN TIKUS TRANSGENIK Tikus transgenik digunakan sebagai model hewan coba untuk mempelajari regulasi gen-gen yang terkait dengan perkembangan jaringan tubuh dan gen-gen yang spesifik yang berperan dalam pertumbuhan jaringan tubuh tertentu serta mempelajari fenotif gen pada jaringan tubuh. Disamping itu tikus transgenik juga dapat digunakan untuk mempelajari regulasi gen-gen yang berperan dalam proses terjadinya kanker (oncogenesis) dan mempelajari efek zat atau senyawa tertentu dalam terapi penyakit.2,3,10 PROSES PEMBUATAN TIKUS TRANSGENIK Gambar-2. Ada 2 metoda pembuatan tikus transgenik: (1) metoda insersi transgen kedalam ES cells (kiri) dan (2) metoda pronuclear microinjection. Pembuatan tikus transgenik merupakan proses yang sulit dan membutuhkan waktu yang lama. Ada 2 metoda untuk membuat tikus transgenik yaitu19,20: (1) Pronuclear microinjection yaitu transgen dimasukkan secara langsung kedalam pronukleus telur tikus yang sudah difertilisasi (fertilized egg/zygote), (2) Embryonic Stem (ES) cell electroporation and subsequent blastocyst injection yaitu insersi transgen kedalam sel induk embrionik (embryonic stem cells/ES cells) yang dilanjutkan dengan 4 pemasukkan ES cells kedalam blastokista. Berikut ini akan diuraikan cara membuat tikus transgenik dengan metoda pronuclear microinjection. Sebelum membuat tikus transgenik serangkaian perisapan yang harus dilakukan adalah (1) persiapan gen (transgen) yang akan dimasukkan ke dalam pronukleus telur tikus yang telah dibuahi (fertilized eggs/zigotes), (2) persiapan tikus yang akan digunakan, (3) persiapan alat dan bahan, (4) persiapan sistem deteksi ada tidaknya transgen dalam susunan genom ”calon” tikus transgenik (tikus yang berkembang dari zigot yang disuntikkan transgen). 1. Persiapan Transgen Fragmen DNA atau gen yang akan dimasukkan ke dalam pronukleus zigot harus mengandung promoter, complete protein coding region, sedikitnya satu intron dan polyadenylation site.11 Transgen ini didapatkan dan di amplifikasi dari suatu genom organisme tertentu dengan menggunakan Polymerase Chain Reaction (PCR). Produk PCR kemudian ditanam pada daerah kloning (cloning site) vector tertentu misalnya plasmid dengan menggunakan ensim ligase. Vektor yang mengandung transgen ini kemudian ditransfeksikan kedalam bakteri tertentu dengan tehnik heat shock. Bakteri kemudian ditanam dan ditumbuhkan pada media agar (agar plate). Setelah tumbuh, bakteri kemudian diperbanyak (dibiakkan) pada media agar yang cair. Vektor yang mengandung transgen kemudian diisolasi dari bakteri yang telah dilisiskan dengan tehnik tertentu. Fragmen transgen ini kemudian diisolasi dari vektor dengan menggunakan ensim restriksi (restriction enzyme) dikuti dengan pemisahan dan pemurnian pada gel agarosa dan electroelution (Gb-3) Ada 3 faktor yang perlu diperhatikan dalam mempersiapkan transgen yang akan diinjeksikan kedalam pronukleus fertilized eggs yaitu konsentrasi, ukuran dan kemurnian DNA.19 Walaupun sekuens (fragmen DNA) dari vector prokariotik tampaknya tidak mengganggu integrasi transgen pada hostnya tetapi sekuens tersebut dapat menghambat ekspresi dari transgen tersebut.10,12 Karenanya konstruksi gen yang akan ditransfer (transgen) tersebut harus dipurifikasi dahulu sebelum diinsersikan ke dalam pronukleus zigot untuk menghindari hal tersebut. Tak diketahui apakah hambatan ekspresi transgen ini akibat adanya susunan nukleotida tertentu dalam sekuens vektor prokariotik tersebut 5 atau merupakan sifat umum dari sekuens DNA vektor prokariotik tersebut.10,12 Panjang DNA pada transgen tidak dibatasi, bisa dari beberapa kilo base pair (Kbp) hingga 1000 kb (Lamb et 1999)13. Hal yang harus dipertimbangkan adalah vektor yang digunakan dan cara konstruksinya. Gambar-3 Tahapan pembuatan transgen Transgen yang dimasukkan kedalam host dapat satu macam atau lebih dari satu macam yang dicampur dalam satu pelarut dan disuntikkan secara bersamaan. Bila lebih dari satu transgen yang diinsersikan konsentrasi dari masing-masing transgen harus sama. Bila gen yang diinsersikan merupakan gen yang memang sudah ada pada tikus (endogenous transgene), untuk membedakan produk dari transgen tersebut dengan RNA atau protein dari gen endogennya dapat dilakukan penyisipan oligonucleotida pada daerah yang transgen yang tidak ditranslasikan (untranslated region)14,15 atau menginsersikan gen kecil yang mengkode RNA yang pendek pada transgen tersebut16. Akan tetapi harus diingat adanya protein kecil yang ”mendompleng” pada protein yang 6 dikode oleh transgen tersebut mungkin berpengaruh terhadap fungsi protein yang dikode oleh transgen. Fusi dari sebuah epitope/peptida yang pendek dengan protein dari transgen dapat mempermudah pengenalan adanya protein yang dikode oleh transgen pada tikus host tersebut dengan menggunakan epitope-specific antibody, atau fusi antara protein yang dikode oleh transgen dengan protein ”Green fluorescent Protein (GFP)” yang dikode oleh gen reporter alkaline phosphatase akan mempermudah pendeteksian adanya ekspresi transgen pada tikus host tersebut17. Efisiensi dari trangen yang ditransfer dipengaruhi oleh beberapa faktor8 yaitu 1. bentuk DNA Bentuk linier dari DNA transgen akan meningkatkan efisiensi integrasi transgen tersebut pada genom tikus hostnya 2. konsentrasi DNA Konsentrasi DNA yang rendah akan menurunkan efisiensi pengintegrasian transgen. Sebaliknya konsentrasi yang terlalu tinggi bersifat toksik bagi zigot. Konsentrasi DNA yang dianjurkan adalah 1.5-2 nanogram/mikroliter 3. kemurnia DNA DNA yang diinseriskan harus bebas dari semua kontaminasi termasuk sisa phenol, etanol atau ensim) 4. buffer DNA Buffer yang dipakai untuk melartkan DNA juga berperan dalam meningkatkan efisiensi pengintegrasian transgen pada hostnya. Pelarut yang sering dipakai adalah TE buffer yang mengandung 1mM EDTA. 2. Persiapan tikus yang akan dipakai Tikus yang akan dipakai untuk membuat tikus transgenik dikelompokkan menjadi 4 kelompok yaitu 1. Kelompok tikus betina yang dibuat superovulasi (superovulated female mice) Pada kelompok ini tikus betina dibuat menjadi superovulasi untuk mendapatkan telur yang dibuahi (zigot) dalam jumlah banyak. Untuk membuat superovulated female mice, tikus betina disuntik dengan Pregnant Mare’s Serum Gonadotrophin (PMSG) yang mempunyai efek yang serupa dengan hormone FSH untuk menstimulasi perkembangan dan pematangan telur tikus dalam jumlah banyak. 7 Dua hari setelah penyuntikan PMSG tikus ini disuntik dengan Human Chorionic Gonadotrophin (HCG) untuk menstimulasi ovulasi. Baik hormone PMSG maupun HCG disuntikan secara intraperitoneal. Tikus yang dipakai adalah yang sudah dewasa dengan umur 4-8 minggu tergantung pada strain yang dipakai. Tikus ini kemudian dikawinkan dengan tikus jantan kelompok fertile stud male mice dan diperiksa ada tidaknya plug kopulasi (copulation plug) besok paginya. Gambar-4. Vasektomi pada tikus kelompok sterile stud male mice 2. Kelompok tikus jantan pengawin (fertile stud male mice) Tikus ini dipakai untuk mengawini tikus betina untuk mendapatkan zigot. Tikus yang dipakai berumur 6-8 minggu dan mempunyai penampilan reproduksi yang 8 baik. Setelah dipakai mengawini superovulated female mice tikus jantan ini diistirahatkan beberapa hari. 3. Kelompok tikus betina yang dibuat hamil palsu (pseudopregnant female mice) Kelompok ini adalah tikus betina yang akan menerima zigot yang telah diinsersikan transgen kedalam pronukleusnya. Tikus ini dikawinkan dengan tikus dari kelompok sterile male mice dan dicek ada tidaknya plug kopulasi (copulation plug) besok paginya. Tikus yang dipakai berumur 6-8 minggu dengan berat badan antara 25-35 gram. Untuk mempermudah transfer zigot disarankan untuk menggunakan tikus yang mempunyai infundibulum yang besar agar mempermudah proses transfer, misalnya strain ICR. 4. Kelompok tikus jantan yang disteril (sterile male mice) Kelompok ini adalah kelompok tikus jantan yang telah disterilkan dengan cara vasektomi (Gb-4). Tikus ini akan dikawinkan dengan tikus betina pseudopregnant female mice. Tikus yang dipakai berumur sediktinya 2 bulan. Sebelum dipakai sebaiknya tikus ini dicek ke ”steril” annya. 3. Persiapan alat dan bahan Peralatan dan bahan yang harus dipersiapkan untuk membuat tikus transgenik meliputi A. Alat dan bahan untuk mengumpulkan telur tikus yang dibuahi (zigot) 1. Spuit disposible 2. Hormon Pregnant Mare’s Serum Gonadotrophin (PMSG) 3. Hormon Human Chorionic Gonadotrophin (HCG) 4. Larutan kultur yaitu larutan D-PBS atau larutan lainnya yang ditambahkan bovine serum albumin (BSA), asam piruvat dan antibiotik (penisilin dan streptomisin) 5. Larutan kultur yang mengandung ensim hyaluronidase 6. Inkubator (temperatur 37C, dengan kelembaban 95% dan mengandung 5% CO2) 7. Surgical set termasuk watchmaker’s forceps 8. Alkohol 70% 9. Stereomikroskop 9 10. Mouth controlled pipette (Gb-5) 11. 35 mm petri dish Gambar-5 Mouth controlled pipette B. Alat dan bahan yang dipakai untuk menginsersikan transgen ke pronukleus zigot 1. Holding pipette (Gb-6) yaitu pipet yang dipakai untuk “memegang” zigot selama proses penyuntikan transgen ke dalam pronukleus zigot. Untuk ini diperlukan Borosilicate glass capilary dan mechanical pipette puller 2. Injection pipette (Gb-6) yaitu pipet yang dipakai untuk memasukkan transgen kedalam pronukleus zigot. Untuk ini diperlukan glass capillary tubing dengan internal glass filament dan mechanical pipette puller. 3. Mikroskop yang mempunyai mikromanipulator. 4. Paraffin oil 5. Petri dish injection chamber 6. Transgen yang dilarutkan dalam buffer TAE 7. Mikroskop yang mempunyai mikromanipulator. 8. Paraffin oil 9. Petri dish injection chamber 10. Transgen yang dilarutkan dalam buffer TAE 11. Mikroskop yang mempunyai mikromanipulator. 12. Paraffin oil 13. Petri dish injection chamber 10 14. Transgen yang dilarutkan dalam buffer TAE Gambar-6 Holding dan injection pipette C. Alat dan bahan yang dipakai untuk identifikasi ada tidaknya transgen pada tikus host Analisa ada tidaknya transgen di dalam ”calon” tikus transgenik (tikus yang berkembang dari zigot yang diinsersikan transgen) dapat dilakukan menggunakan Southern blot, Northern blot dan Western Blot. TAHAPAN (PROSEDUR) PEMBUATAN TIKUS TRANSGENIK Pembuatan tikus transgenik memerlukan banyak tahapan dan proses yang panjang. Adapun tahap-tahap kegiatan terdiri atas 1. Penyuntikan hormone PMSG intraperitoneal pada tikus superovulated female mice, dilanjutkan dengan penyuntikan hormon HCG 48 jam kemudian. Setelah disuntik HCG superovulated female mice dikawinkan dengan fertile stud male mice dan diperiksa ada tidaknya plug kopulasi keesokan harinya. Pada saat yang bersamaan tikus pseudopregnant mice dikawinkan dengan sterile stud male mice dan diperiksa ada tidaknya pulg kopulasi keesokan harinya. Tikus dengan plug positif dipisahkan dari tikus dengan plug negatif. 2. Isolasi dan pengumpulan telur tikus yang dibuahi (zigot) dari superovulated female mice dengan plug kopulasi positif. Superovulated female mice dengan plug positif dimatikan dengan cara cervical dislocation (Gb-8). Setelah disemprot dengan alkohol 70% rongga perut dibuka dan saluran telur (oviduct) diangkat (Gb-9) dan diletakkan dalam medium kultur. 11 Gambar-7. Cara memegang tikus (kiri) dan cara penyuntikan hormon intraperitoneal (kanan) Gambar-8 Cervical dislocation Telur tikus yang telah dibuahi (fertilized eggs/zigotes) diisolasi dari saluran telur (oviduct) dengan cara merobek saluran telur tersebut di bawah mikroskop. Saluran telur yang banyak mengandung zigot akan tampak menggelembung (Gb9). Zigot yang telah dibebaskan dari saluran telur kemudian diletakkan dalam medium kultur yang mengandung ensim hyaluronidase di dalam 35mm petri dish selama beberapa menit (1-2 menit). Ensim hyaluronidase ini berfungsi untuk menghilangkan sel-sel kumulus yang menempel pada permukaan zigot. Setelah dicuci dalam media kultur yang tidak mengandung hyaluronidase telur-telur tikus yang telah dibuahi (zigot) (Gb-10) dikumpulkan dalam 35mm petri dish yang 12 Gambar-9 Isolasi saluran telur (oviduct) pada superovulated female mice 13 Gambar-10. Pembebasan zigot dari saluran telur (oviduct) mengandung media kultur dan diinkubasi dalam inkubator 37C dengan kelembaban 95% dan mengandung 5% CO2. 3. Penyuntikan transgen kedalam pronukleus telur tikus yang dibuahi (zigot) Sebelum dilakukan penyuntikan transgen kedalam zigot, holding pipette diisi terlebih dahulu dengan mineral oil dan dipasang pada tempatnya pada micromanipulator. Injection pipette diisi dengan larutan yang mengandung 14 Gambar-11 Telur tikus di dalam media kultur pada 35mm petri dish transgen dengan menggunakan daya isap kapiler. Injection pipette dipasang pada tempatnya pada micromanipulator (Gb-12). Petri dish injection chamber diisi dengan sedikit media kultur dan ditutup dengan paraffin oil (Gb-13). Gambar-12 Holding dan injection pipette serta micromanipulator Petri dish injection chamber diisi dengan sedikit media kultur dan ditutup dengan paraffin oil (Gb-13). Telur tikus yang dibuahi (zigot) ditransfer dari 35mm petri dish ke petri dish injection chamber dengan menggunakan mouth controlled pipette. Zigot yang ditransfer haruslah normal yang ditandai oleh adanya 2 pronukleus dan 2 polar bodi (Gb14). 15 Gambar-13 Petri dish injection chamber yang mengandung media kultur dan ditutup dengan paraffin oil Gambar-14. Zigot yang normal mengandung 2 pronukleus (kiri) dan zigot dalam ”genggaman” holding pipette, sementara injection pipette tampak dibawah zigot (kanan) Zigot tanpa pronukleus atau pronukelus lebih dari 2 adalah tidak normal dan tidak dapat digunakan. Pada saat hendak disuntik zigot di ”pegang” oleh holding pipette. Setelah injection pipette ditusukan ke dalam pronukleus zigot, transgen kemudian dipompakan ke dalam pronukleus (Gb-15). Masuknya transgen kedalam pronukleus zigot ditandai oleh adanya gelembung kecil (small bubble) dan pembesaran pronukleus. Setelah penyuntikan injection pipette segera ditarik dari zigot dan zigot dilepaskan dari genggaman holding pipette. Satu demi satu zigot kemudian akan disuntikkan dengan transgen. Zigot yang telah disuntik kemudian dikumpulkan didalam 35mm petri dish selama beberapa saat sebelum ditransfer ke dalam saluran telur (oviduct) pseudopregnant mice. 16 Gambar-15 Proses Penginsersian transgen kedalam pronukleus zigot 4. Transfer zigot yang telah disuntikkan transgen ke saluran telur (oviduct) pseudopregnant female mice (Gb-16). Organ reproduksi pseudopregnant female mouse dikeluarkan dari tubuh dengan membuat sayatan pada daerah punggung. Fimbrie dan infundibulum saluran telur tikus dikenali. Setelah itu zigot yang telah disuntik dengan transgen ditransfer kedalam infundibulum pseudopregnant mice dengan menggunakan mouth controlled pipette. 17 Gambar-16 transfer zigot kedalam infundibulum pseudopregnant mice 5. Zigot yang ditransfer kedalam pseudopregnant mice kemudian akan tumbuh dan berkembang selama 21 hari. Setelah 21 hari ”calon” tikus transgenik ini akan lahir. Anak tikus ini keudian ditunggu hingga besar dan mencapai umur 3minggu. 18 Setelah itu dilakukan pemeriksaan ada tidaknya transgen yang terintegrasi di dalam genom anak tikus tersebut dengan menggunakan metoda Southern blot. Gambar-17. Pendeteksian Transgen dan ekspresinya dengan menggunakan motoda Southern blot dan Northern blot Ekspresi transgen diperiksa dengan metoda Northern blot. Tikus transgenik yang berkembang dari zigot tersebut dikenal sebagai ”Founders” dan bersifat hemizygote. Untuk perbanyakan tikus transgenik, founders mice ini kemudian dikawinkan dengan tikus non transgenik. Untuk mendapatkan tikus transgenik yang homozygote, tikus transgenik hemizygote dikawinkan antar sesamanya. Tikus transgenik yang homozygote ini kemudian dipelajari fenotifnya dengan mengamati ada tidaknya kelainan pada organ atau jaringan tertentu selama proses tumbuh kembangnya. PERAN DAN PENGGUNAAN TIKUS TRANSGENIK SEBAGAI HEWAN MODEL UNTUK MEMPELAJARI PROSES KARSINOGENESIS DAN MENCARI BAHAN-BAHAN HERBAL UNTUK TERAPI KANKER 19 Hingga saat ini tikus transgenik telah banyak digunakan untuk mempelajari patogenesis terjadinya kanker, mempelajari regulasi gen-gen yang termasuk onkogen dan tumor supressor serta perubahan jaringan akibat kanker. Green et.al21 telah membuat tikus transgenik sebagai hewan model untuk mempelajari kanker prostat dengan menginsersikan simian virus 40 large tumor antigencoding region dengan prostate-specific rat probasin sebagai promoternya. Tikus transgenik ini menunjukkan kelainan berupa terjadinya hyperplasia intraepitel hingga terbentuknya neoplasia nodular besar yang bersifat ganas yang disertai dengan peningkatan ekspresi gen p53 dan menurunnya ekspresi gen reseptor androgen pada prostat. Janz et.al22 telah membuat tikus transgenik untuk mempelajari Lymphoma Burkitt’s dengan menginsersikan gen MYC berikut promoternya. Rao et.al.23 telah membuat tikus transgenik untuk mempelajari kanker payudara dengan menginsersikan oncogen c-neu. Tikus transgenik juga digunakan untuk mempelajari keterlibatan gen-gen tertentu yang terdapat pada virus dalam terjadinya kanker. Kim et.al.24 telah menginsersikan keseluruhan gen HBx yang berasal dari virus hepatitis B berikut elemen regulasinya kedalam tikus transgenik dalam upaya untuk mempelajari keterlibatan dan peran gen tersebut dalam terjadinya kanker hati. Tikus transgenik yang membawa transgen ini menunjukkan kelainan jaringan hati yang progresif mulai dari terjadinya adenoma yang jinak hingga terjadinya karsinoma. Tikus transgenik yang mengekspresikan protein oncogen E6 dan E7 Human Papillomavirus (HPV) tipe 16 menunjukkan terjadinya kelainan pada epitel skuamosa berupa hiperplasia, papillomatosis dan displasi pada kulit, telinga, muka, palpebra dan anus.25 Selain itu tikus transgenik ini juga menunjukkan terjadinya kanker mulut rahim.26 Kanker lambung ditemukan pada tikus transgenik yang mengekspresikan HPV-16 early region genes.27 Selain untuk mempelajari proses terjadinya kanker, tikus transgenik juga dipakai untuk mencari bahan-bahan atau zat-zat yang dapat digunakan untuk mengobati kanker, termasuk bahan-bahan herbal. Venkateswaran et.al.28 dengan menggunakan Lady transgenic mice membuktikan bahwa pemberian antioksidan (vitamin E, selenium dan likopen) dapat mencegah terjadinya kanker prostat. Kato et al.29 membuktikan bahwa 20 Sho-saiko-to bersifat anti tumor terhadap melanoma dan juga dapat mencegah terjadinya metastasis kanker kulit ini. PENUTUP Telah diuraikan pengertian tikus transgenik dan kegunaannya, metoda untuk membuat tikus transgenik, peran tikus transgenik sebagai hewan model untuk mempelajari proses karsinogenesis dan penggunaan tikus transgenik dalam mencari bahan-bahan herbal yang dapat digunakan dalam terapi kanker. RUJUKAN 1. Aguzzi A, Brandner S, Isenmann S, Steinbach JP, and Sure U : Transgenic and gene disruption techniques in the study of neurocarcinogenesis. Glia 1995: 15: 348-364 2. Jusuf, A.A : Transgenic and gene disruption techniques from a concept to a tool in studying the basic pathogenesis of various human disease. Medical Journal Of Indonesia. 1998: 7; 2 : 55-64 3. Brinster R, Chen H, Trumbauer M et al : Somatic expression of herpes thymidine kinase in mice following injection of a fusion gene into eggs. Cell 1981: 27: 223231 4. Palmitter R.D and Brinster R.L: Germ-line transformation of mice. Annu. Rev. Genet 1986: 20; 465-499 5. Jaenisch R : Transgenic animals. Science 1988: 240; 14681474 6. Hanahan D. : Transgenic mice as probes into complex system. Science 1989: 246; 1265-1275 7. Gordon J, Ruddle F : Gene transfer into mouse embryos: production of transgenic mice by pronuclear injection. Methods Enzymol. 1983: 102: 411-433 8. Hogan B, ConstantiniF, Lacy E. : Manipulating the mouse embryos: A laboratory manual.2nd Ed .New York : Cold Spring Harbor: 1994 9. Albert, B., Bray, D., Lewis, J., Raff, M., Roberts, K., Watson, J.D. (1994), Cellular Mechaninsm of development in Molecular Biology of The Cell., 3rd Ed., Garland Publishing, New York and London, pp. 10. Nagy A, Gertsenstein M, Vintersen K, Behringer R, Manipulating the mouse embryo: A laboratory manual. 3rd Ed New York: Cold Spring Harbor: 2003 11. Brinster R, Allen J, BehringerR, Gelimas R et al.: Intron s increase transcriptional efficiency in transgenic mice. Proc Natl. Acad.Sci.USA. 1988: 85; 836-40 12. Chada K, Magram J, Raphael K, Radice G, Lacy E and Constantini F. Spesific expression of a foreign beta globin gene in eryrthroid cells of transgenic mice. Nature.1985: 314: 377-380 13. Lamb B.T, Bardel K.A, Kulnane L.S. Anderson J.J, Holtz G, Wagner S.L, Sisodia S.S, and Hoeger E.J. Amyloid production and deposition in mutant amyloid 21 precursor protein and presenilin-1 yeast artificial chromosome transgenic mice. Natl. Neurosci. 1999: 2; 695-697 14. Peschon J.J, Behringer R.R, Brinster R.L, and Palmiter R.D. Spermatide-specific expression of protamine 1 in transgenic mice. Proc Natl.Acad.Sci.USA. 1987:84; 5316-5319 15. Shi Y, Son H.J, Shahan K, Rodriguez M, Constantini F and Derman E. Silent genes in the mouse major urinary protein gene family. Proc Natl.Acad.Sci.USA. 1989:86; 4584-4588 16. Krumlauf R, Hammer R.E, Tilghman S.M, and Brinster R.L Developmental regulation of alpha-fetoprotein genes in transgenic mice. Mol. Cell. Biol. 1985:5; 1639-1648. 17. van Roessel P and Brand A.H. Imaging into the future: visualizing gene expression and protein interactions with fluorescent proteins.Nat.Cell.Biol. 2002:4; 15-20 18. Hanahan, D., Wagner, E.F., Palmiter, R.D. The origins of oncomice: a history of the first transgenic mice genetically engineered to develop cancer. Genes & Dev. 2007:21:2258-2270 19. Transgenic mice, diunduh dari htpp://cancer ucsd.edu/tgm/pronuclear.asp 20. Eddy M. The use of transgenic mice for environmental health research Environmental Health Perspectives Volume 101, Number 4, September 1993 21. Greenberg NM, Demayo FJ, Finegold M, et al Prostate cancer in a transgenic mouse. Proc Natl Acad Sci USA. 1995:92: 3439-43. 22. Janz, HC Morse III, et al. Burkitt's lymphoma in the mouse. Journal of Experimental Medicine.2000: 92:8:1183-90 23. Rao G.N., Ney,E., Herbert R.A. Influence of diet on mammary cancer in transgenic mice bearing an oncogene expressed in mammary tissue. Breast Cancer Research and Treatment. 1997:45:2:149-158(10) 24. Kim C.M., Koike.K., Saito, I., Miyamura, T., Jay, G. HBx gene of hepatitis B virus induces liver cancer in transgenic mice. Nature. 1991: 351: 317 - 320 25. Arbeit, J.M., Munger,K., Howley,P.M.,Hanahan,D. Progessive squamous epithelial neoplasia in K14-human papillomavirus type 16 transgenic mice. J Virol. 1994: 68(7): 4358-4368 26. Riley, R.R., Duensing,S., Brake,T., Münger,K., Lambert, P.F., Arbeit, J.M. Dissection of Human Papillomavirus E6 and E7 Function in Transgenic Mouse Models of Cervical Carcinogenesis. Cancer Research.2003: 63:4862-4871 27. Searle, P.F., Thomas, D.P., Faulkner, K.B., Tinsley, J.M. Stomach Cancer in Transgenic Mice Expressing Human Papillomavirus Type 16 Early Region Genes From a Keratin Promoter. J Gen Virol. 1994: 75: 1125-1137 28. Venkateswaran, V., Fleshner, N.E., Sugar,L.M., Klozt, L.H. Antioxidants block prostate cancer in lady transgenic mice. Cancer Research.2004:64:5891-96. 29. Kato,M., Liu, W., Yi, H., Asai, N., Hayakawa, A., Kozaki, K., Takahashi, M., Nakashima, I. The Herbal Medicine Sho-saiko-to Inhibits Growth and Metastasis of Malignant Melanoma Primarily Developed in ret-Transgenic Mice. Journal of Investigative Dermatology.1998: 111: 640–644