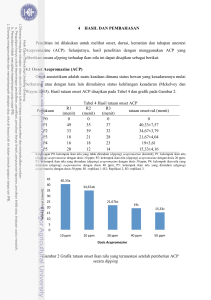
POTENSI PENGGUNAAN ACEPROMAZINE
advertisement

POTENSI PENGGUNAAN ACEPROMAZINE SEBAGAI BAHAN ALTERNATIF ANESTESI IKAN NILA (Oreochromis niloticus) Oleh: Rudi Setiawan C34061179 DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR BOGOR 2012 PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI Dengan ini saya menyatakan bahwa skirpsi yang berjudul “POTENSI PENGGUNAAN ACEPROMAZINE SEBAGAI BAHAN ALTERNATIF ANESTESI IKAN NILA (Oreochromis niloticus)” ini belum pernah diajukan pada Perguruan Tinggi lain atau lembaga lain manapun untuk memperoleh gelar akademik tertentu. Saya juga menyatakan bahwa skripsi ini benar-benar hasil karya saya sendiri dan tidak mengandung bahan-bahan yang pernah ditulis atau diterbitkan oleh pihak lain kecuali sebagai bahan rujukan yang dinyatakan dalam naskah. Bogor, Mei 2012 Rudi Setiawan C34061179 POTENSI PENGGUNAAN ACEPROMAZINE SEBAGAI BAHAN ALTERNATIF ANESTESI IKAN NILA (Oreochromis niloticus) Oleh: Rudi Setiawan C34061179 SKRIPSI Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Departemen Teknologi Hasil Perairan Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR BOGOR 2012 LEMBAR PENGESAHAN Judul : Potensi Penggunaan Acepromazine sebagai Bahan Alternatif Anestesi Ikan Nila (Oreochromis niloticus) Nama Mahasiswa : Rudi Setiawan NIM : C34061179 Program Studi : Teknologi Hasil Perairan Menyetujui Pembimbing I Pembimbing II Dr. Ir. Ruddy Suwandi, MS, M.Phil NIP: 195805111985031002 Dr. Ir. Agoes M. Jacoeb, Dipl,- Biol. NIP : 195911271986011005 Mengetahui Ketua Departemen Dr. Ir. Ruddy Suwandi, MS, M.Phil NIP: 195805111985031002 Tanggal Kelulusan : ii KATA PENGANTAR Puji dan syukur kepada Allah SWT karena atas rahmat dan hidayahNya penulis dapat menyelesaikan laporan tugas akhir yang berjudul ”Potensi Penggunaan Acepromazine sebagai Bahan Alternatif Anestesi Ikan Nila (Oreochromis niloticus)” dengan baik. Penulis juga mengucapkan terima kasih kepada semua pihak yang telah membantu penulis dalam menyelesaikan laporan praktek lapang ini, terutama kepada: 1. Bapak Dr. Ir. Ruddy Suwandi, MS, MPhil, selaku dosen pembimbing saya dan selaku Ketua Departemen Teknologi Hasil Perairan. 2. Dr. Ir. Agoes M. Jacoeb, Dipl,- Biol. selaku dosen pembimbing saya. 3. Ayah Rusman Effendi, Almarhumah Ibu Syahdati, kakak Budi Pratidinasari dan Andi serta adik Rangga Wijaya yang telah memberikan kasih sayang dan semangat yang luar biasa. 4. Arie Yuanitasari yang telah memberi dukungan, perhatian, kasih sayang dan semangat yang luar biasa. 5. Seluruh jajaran staf pegawai Departemen Teknonologi Hasil Perairan yang telah banyak membantu dengan ikhlas. 6. Sahabat-sahabat (Vickar, Rio, Hendra, Alvin, Idris, Ozy dan sahabat yang lain) terimakasih atas kebersamaan yang telah tejalin selama ini, akan menjadi kenangan yang indah di hati. 7. Teman-teman THP 43 yang selama ini telah memberi warna-warni dalam menjalani hidup. 8. Adik-adik kelas THP (Afif, Mprit, Helmi dan adik kelas yang lain) yang selama ini telah membantu dan bekerjasama sehingga memberikan kenangan yang indah selama saya kuliah. iii Penulis menyadari bahwa Laporan Tugas Akhir ini masih banyak kekurangannya. Tak ada gading yang tak retak, begitupula dengan Laporan Tugas Akhir ini. Oleh karena itu, Penulis mengharapkan saran dan kritik yang bersifat membangun untuk perbaikan rencana kerja ini. Semoga tulisan ini bermanfaat bagi semua pihak yang memerlukannya. Bogor, Mei 2012 Rudi Setiawan iv RIWAYAT HIDUP Penulis dilahirkan di Jakarta, pada tanggal 30 Juli 1988 dari pasangan Bapak Rusman Effendi dan Ibu Syahdati sebagai anak kedua dari tiga bersaudara. Pendidikan formal penulis dimulai di TK An-Nuriyah Depok dan lulus pada tahun 1994. Penulis menyelesaikan pendidikan sekolah dasar pada tahun 2000 di SDN Beji Timur 1 Depok. Pada tahun 2003, penulis menyelesaikan pendidikan menengah pertama di SMP Negeri 2 Depok. Pada tahun 2006, penulis menyelesaikan pendidikan menengah atas di SMA Negeri 3 Depok. Pada tahun yang sama, penulis diterima di Institut Pertanian Bogor (IPB) melalui Seleksi Penerimaan Mahasiswa Baru (IPB) di Program Studi Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan. Selama studi di Institut Pertanian Bogor, penulis masuk anggota tim futsal IPB dan Himpunan Profesi HIMASILKAN divisi Pengembangan Sumberdaya Manusia periode 20072008. Penulis pernah mendapat juara 2 Poster dan juara 3 Presentasi pada Pekan Ilmiah Nasional ke XXI di Semarang dan Juara 2 Presentasi pada Pekan Ilmiah Nasional ke XXII di Malang. Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, penulis melakukan kegiatan penelitian pada tahun 2011 dengan judul Potensi Acepromazine sebagai Bahan Alternatif Anestesi Ikan Nila (Oreochromis niloticus) dengan dosen pembimbing yaitu Bapak Dr. Ir. Ruddy Suwandi, MS, MPhil dan Bapak Dr. Ir. Agoes M. Jacoeb, Dipl,- Biol. DAFTAR ISI KATA PENGANTAR...............................................................................................................ii RIWAYAT HIDUP .................................................................................................................. iv DAFTAR TABEL .................................................................................................................... vi DAFTAR GAMBAR...............................................................................................................vii 1 PENDAHULUAN ................................................................................................................ 1 1.1 Latar Belakang............................................................................................................... 1 1.2 Tujuan............................................................................................................................ 1 1.3 Manfaat.......................................................................................................................... 2 2 TINJAUAN PUSTAKA ....................................................................................................... 3 2.1 Deskripsi dan Klasifikasi Ikan Nila (Oreochromis niloticus) ....................................... 3 2.2 Kegunaan Anestesi dalam Menanggulangi Stres pada Ikan.......................................... 4 2.3 Anestesi ......................................................................................................................... 5 2.4 Acepromazine ................................................................................................................ 8 3 METODOLOGI.................................................................................................................. 10 3.1 Waktu dan Tempat....................................................................................................... 10 3.2 Bahan dan Alat ............................................................................................................ 10 3.3 Rancangan Percobaan.................................................................................................. 10 3.4 Parameter yang Diamati .............................................................................................. 13 3.5 Analisis Data................................................................................................................ 13 4 HASIL DAN PEMBAHASAN .......................................................................................... 14 4.1 Onset Acepromazine (ACP) ........................................................................................ 14 4.2 Durasi Acepromazine (ACP) ....................................................................................... 17 4.3 Kematian Ikan Nila...................................................................................................... 18 4.4 Kualitas Air.................................................................................................................. 20 4.5 Pemingsanan Ikan Nila Besar...................................................................................... 21 5 KESIMPULAN DAN SARAN .......................................................................................... 23 5.1 Kesimpulan.................................................................................................................. 23 5.2 Saran ............................................................................................................................ 23 DAFTAR PUSTAKA.............................................................................................................. 24 vi DAFTAR TABEL Nomor Halaman 1 Tahapan Anestesi Ikan......................................................................................................... 6 2 Pengaruh perubahan pH terhadap ikan.............................................................................. 11 3 Kisaran nilai konsentrasi DO dan pengaruhnya pada ikan................................................ 12 4 Hasil rataan onset ACP...................................................................................................... 14 5 Tingkah laku ikan nila pada proses perendaman ACP ...................................................... 16 6 Hasil rataan durasi ACP .................................................................................................... 17 7 Hasil rataan persentase kematian ACP.............................................................................. 18 8 Pengujian kualitas air pada pemingsanan ikan nila dengan ACP...................................... 20 9 Hasil pemingsanan nila besar dengan ACP....................................................................... 21 10 Perbandingan waktu onset dan durasi ACP ikan kecil dengan ikan besar yang direndam dengan larutan ACP 40 ppm.............................................................................................. 22 vii DAFTAR GAMBAR Nomor Halaman 1 Ikan nila (Oreochromis niloticus)........................................................................................... 3 2 Grafik rataan onset ikan nila yang teranestesi setelah pemberian ACP secara dipping ...... 14 3 Ikan nila mulai teranestesi .................................................................................................... 15 4. Grafik rataan durasi ikan nila setelah peberian ACP secara dipping .................................. 17 5 Ikan nila recovery ................................................................................................................. 18 6 Ikan nila mati ........................................................................................................................ 19 viii DAFTAR LAMPIRAN Nomor Halaman 1 Data Bobot Ikan Nila Kecil dan Besar ................................................................................. 27 2 Analisi Nilai Waktu Onset Acepromazine............................................................................ 28 3 Analisis Nilai Durasi Acepromazine..................................................................................... 29 4 Analisis Nilai Tingkat Kelangsungan Hidup Acepromazine................................................ 30 5 DO Meter.............................................................................................................................. 31 6 pH Meter............................................................................................................................... 32 1 PENDAHULUAN 1.1 Latar Belakang Ikan nila merupakan ikan yang memiliki kemampuan menyesuaikan diri yang baik dengan lingkungan sekitarnya. Ikan ini memiliki toleransi yang tinggi terhadap lingkungan hidupnya, sehingga bisa dipelihara di dataran rendah yang berair payau maupun dataran yang tinggi dengan suhu yang rendah (Trewavas 1986). Nila mampu hidup pada suhu 14-38 oC dengan suhu terbaik adalah 25-30 oC. Nilai pH air tempat hidup ikan nila antara 6-8,5; oleh karena itu, ikan nila cocok dipelihara di dataran rendah sampai agak tinggi (Suyanto 2003). Hal tersebut membuat permintaan benih ikan nila meningkat di Indonesia. Transportasi benih merupakan proses yang mempunyai arti penting. Transportasi terlalu lama dengan penanganan yang tidak tepat dapat menyebabkan stres yang berakhir pada kematian ikan. Oleh karena itu, untuk meminimalkan stres dan kematian ikan nila maka ikan nila dibuat setengah tidur dengan menggunakan anestetikum. Salah satu anesthetikum yang digunakan untuk ikan adalah acepromazine (ACP). Selain itu masalah yang dihadapi oleh para peneliti dan praktisi ikan adalah pengambilan sampel yang memerlukan sediaan anestetikum. Anestetikum dapat mengurangi stres pada saat ikan dibiopsi. Selain itu, harga anestetikum yang biasa digunakan pada ikan nila (tricaine atau MS-222) yang harganya relatif mahal dan susah didapat menjadi masalah yang perlu dicarikan alternatif solusinya. Solusi untuk memecahkan masalah tersebut salah satunya adalah penggunaan ACP sebagai sediaan anestetikum pada ikan nila. Acepromazine digunakan sebagai tranquilizer pada anjing dan kucing. Termasuk golongan phenotiazine, cara kerjanya dengan mendepres dopamin, dimetabolisme di hati dan diekskresikan melalui urin (Forney 2004). Menurut Mckelvey dan Wayne (2003) acepromazine dapat digunakan sebagai sedasi ketika transportasi hewan sehingga hewan merasa nyaman dan seperti tertidur. 1.2 Tujuan Tujuan penelitian ini adalah untuk mempelajari gejala-gejala anestesi dan tahapantahapan anestesi ACP pada ikan nila. Ikan mulai teranestesi (onset) dan lamanya ikan teranestesi (durasi), tingkat keamanan (safety) penggunaan acepromazine pada ikan nila. Selain itu, penelitian ini dilakukan untuk memperoleh data dasar untuk penelitian selanjutnya. 2 1.3 Manfaat Manfaat penelitian ini adalah untuk mengetahui potensi penggunaan acepromazine sebagai anestetikum ketika transportasi ikan sehingga ikan tidak stress. Manfaat lain untuk praktisi, peneliti, dan breeder ikan adalah dapat melakukan pengambilan sampel dengan mudah dan akurat. Selain itu dapat mendapatkan bahan anestesi kimia yang mudah didapatkan, karena untuk bahan anestesi kimia yang biasa digunakan seperti MS-222 sulit ditemukan di Indonesia. 2 TINJAUAN PUSTAKA 2.1 Deskripsi dan Klasifikasi Ikan Nila (Oreochromis niloticus) Ikan nila berasal dari Afrika bagian timur. Ikan nila memiliki bentuk tubuh yang pipih ke arah vertikal (compress). Posisi mulutnya terletak di ujung hidung (terminal) dan dapat disembulkan (Suyanto 2003). Morfologi ikan nila dapat dilihat pada Gambar 1. Gambar 1 Ikan nila (Oreochromis niloticus) Sumber: Rahmat (2008) Menurut Saanin (1984), ikan nila (Oreochromis niloticus) mempunyai klasifikasi sebagai berikut: Filum : Chordata Subfilum : Vertebrata Kelas : Osteichtyes Subkelas : Acanthopterygii Ordo : Percomorphi Subordo : Percoidea Famili : Cichlidae Genus : Oreochromis Spesies : Oreochromis niloticus Ikan nila memiliki ciri morfologi, yaitu berjari-jari keras, sirip perut torasik, letak mulut subterminal dan berbentuk meruncing. Selain itu, tanda lainnya yang dapat dilihat dari ikan nila adalah warna tubuhnya hitam dan agak keputihan. Bagian bawah tutup insang berwarna putih, sedangkan pada nila lokal, putih agak kehitaman bahkan ada yang kuning. 4 Sisik ikan nila besar, kasar dan tersusun rapi. Sepertiga sisik belakang menutupi sisi bagian depan. Tubuhnya memiliki garis linea lateris yang terputus antara bagian atas dan bawahnya. Line lateralis bagian atas memanjang mulai dari tutup insang hingga belakang sirip punggung sampai pangkal sirip ekor. Ukuran kepalanya relative kecil dengan mulut berada di ujung kepala serta mempunyai mata yang besar (Kottelat et al. 1993). Ikan nila memiliki kemampuan menyesuaikan diri yang baik dengan lingkungan sekitarnya. Ikan ini memiliki toleransi yang tinggi terhadap lingkungan hidupnya, sehingga bisa dipelihara di dataran rendah yang berair payau maupun dataran yang tinggi dengan suhu yang rendah (Trewavas 1986). 2.2 Kegunaan Anestesi dalam Menanggulangi Stres pada Ikan Stres adalah suatu keadaan yang ditimbulkan oleh faktor-faktor lingkungan atau faktorfaktor lainnya yang mempengaruhi daya penyesuaian diri dari seekor hewan melebihi batasbatas daya normalnya, atau mengganggu fungsi-fungsi normal hewan hingga ke batas harapan untuk dapat bertahan secara jelas-jelas berkurang. Lingkungan perairan dan ketidakmampuan ikan sebagai hewan poikilothermik (yang suhunya bergantung pada suhu lingkungan, ini sedikit diatas atau dibawah) untuk mengatur suhu badannya, telah merubah dan menyesuaikan anatomi dan fisiologi dari ikan. Rantai kejadian sebagai akibat dari setiap perubahan patologis, misal infeksi oleh mikroba, kerusakan-kerusakan oleh trauma atau defisiensi nutrisipun sangat dipengaruhi oleh kedua faktor di atas. Pengaruh faktor-faktor stres lebih jelas terlihat pada penyakit ikan dari pada penyakit-penyakit pada spesies hewan lainnya. Tanda-tanda penyesuaian umum (General Adaptation Syndrome = GAS) adalah perubahan-perubahan ini tidaklah spesifik secara fisiologik dan biokemik, serta umumnya berjalan dalam tiga fase yaitu reaksi permulaan (alarm reaction), masa bertahan (stage of resistance), dimana hewan berusaha menyesuaikan diri untuk tetap mempertahankan keseimbangan fisiologis (homeostatis) di dalam keadaan-keadaan lingkungan yang berubah, dan masa kehabisan daya (exhaution), dimana usaha-usaha adaptasi terhenti dan homeostatispun tidak tercapai (Nabib dan Pasaribu 1989). Kejadian-kejadian yang timbul pada GAS dikendalikan oleh sistem hormonal dan syaraf. Pengeluaran dari hormon-hormon adenocorticotropic (ACTH) dan corticostreroid menyebabkan retensi ion Na+ dan Cl– sedang ion K+ dikeluarkan, maka ada penambahan dalam kadar glukosa darah dan metabolisme nitrogen, sedang kelenjar thyroid distimulasi dan pengeluaran thyroxinnya bertambah, dalam darah terjadi lymphocitemia dan neurophilia. Kemudian sistem syaraf simpatik bereaksi secara berlebihan, yang menyebabkan kontraksi 5 limpa, meningkatkan pernafasan dan kenaikan tekanan darah. Sebagian besar dari efek-efek ini telah dilaporkan juga pada ikan, meskipun mekanisme pengaturannya belum diketahui benar (Nabib dan Pasaribu 1989). Tingkat stress yang terjadi pada ikan juga berbeda-beda. Kajian yang lebih mendalam menunjukkan tingkatan stress yang terjadi dapat ditelusuri dengan kandungan kortisol. Banyak hal berkenaan dengan kortisol selama proses metabolisme, misalnya saat starvasi (puasa), osmoregulasi, pengerahan simpanan energi untuk migrasi, proses pematangan gonad, pemijahan dan selama stress yang dialami oleh ikan itu sendiri (Van Ginneken et al. 1997). Pada saat ditransportasikan, ikan harus dikondisikan dalam keadaan aktivitas biologis rendah sehingga konsumsi energi dan oksigen juga rendah sehingga kemungkinan terjadinya stress pada ikan dapat dicegah. Penggunaan transportasi sistem kering merupakan salah satu cara yang efektif untuk untuk mengkondisikan ikan dalam keadaan aktivitas biologis yang rendah. Untuk menurunkan aktivitas biologis ikan dapat dilakukan dengan menggunakan suhu rendah dan menggunakan bahan metabolik atau anestetikum (Wibowo 2001). Anestesi diperlukan ikan dalam sistem transportasi, kegiatan penelitian, diagnosa penyakit, penandaan ikan pada bagian kulit atau insang, pengambilan sampel darah dan proses pembedahan. Pada kegiatan penelitian, anestesi bertujuan untuk menurunkan seluruh aktivitas ikan untuk menghindari stress. Ikan dapat menyerap bahan anestesi melalui jaringan otot, saluran pencernaan dengan cara injeksi atau melalui insang. Anestesi melalui insang adalah cara yang ideal karena konsentrasi bahan anestesi yang digunakan dapat dikontrol dan stress dapat diminimalisir. Salinitas, suhu, pH, dan oksigen harus diperhitungkan dalam penggunaan bahan anestesi karena faktor-faktor ini dapat mempengaruhi aktivitas bahan anestesi, kecepatan metabolisme ikan, dan kemampuan ikan untuk menyerap bahan anestesi (Gunn 2001). 2.3 Anestesi Anestesi berarti pembiusan; berasal dari bahasa Yunani an-"tidak, tanpa" dan aesthētos, "persepsi, kemampuan untuk merasa", secara umum berarti suatu tindakan menghilangkan rasa sakit ketika melakukan pembedahan dan berbagai prosedur lainnya yang menimbulkan rasa sakit pada tubuh. Istilah anestesi digunakan pertama kali oleh Oliver Wendel Holmes Sr pada tahun 1846. Obat untuk menghilangkan nyeri terbagi dalam 2 kelompok, yaitu analgetik dan anestesi. Analgetik adalah obat pereda nyeri tanpa disertai hilangnya perasaan secara total. Seseorang yang mengkonsumsi analgetik tetap berada dalam keadaan sadar. Analgetik tidak selalu menghilangkan seluruh rasa nyeri, tetapi selalu 6 meringankan rasa nyeri. Beberapa jenis anestesi menyebabkan hilangnya kesadaran, sedangkan jenis yang lainnya hanya menghilangkan nyeri dari bagian tubuh tertentu dan pemakainya tetap sadar (Suryanto 1998). Anestesi menurut Mckelvey dan Wayne (2003) ada 4 tahapan, tahap pertama atau sering disebut stadium analgesia, hewan masih sadar tetapi disorientasi dan menunjukkan sensitivitas terhadap rasa sakit berkurang, respirasi dan denyut jantung normal atau meningkat, semua reflek masih ada, hewan masih bangun dan dapat juga urinasi, defekasi. Tahap kedua yaitu kesadaran mulai hilang namun refleks masih ada, pupil membesar (dilatasi) tetapi akan menyempit (konstriksi) ketika ada cahaya masuk. Tahap kedua atau stadium eksitasi berakhir ketika hewan menunjukkan tanda-tanda otot relaksasi, respirasi menurun dan refleks juga menurun. Tahap ketiga atau stadium anestesi, pada stadium ini biasanya dilakukan operasi. Hewan kehilangan kesadaran, pupil mengalami konstriksi dan tidak merespon cahaya yang masuk, refleks hilang (refleks palpebrae). Tahapan keempat adalah pernafasan dan jantung terhenti, dan hewan mati. Indikator tahapan anestesi antara lain aktivitas refleks (refleks palpebrae, pedal refleks, kornea refleks, refleks laring, refleks menelan), relaksasi otot, posisi mata dan ukuran pupil, sekresi saliva dan air mata, respirasi dan denyut jantung. Stadium anestesi dan gejalanya pada ikan menurut Scott et al. (2009) yaitu stadium eksitasi ditandai dengan peningkatan gerakan opercular atau aktivitas. Setelah beberapa menit gerakan ikan melambat, menjadi ataksia, berenang tidak seimbang dan mulai memutar ke samping. Kadang-kadang posisi ikan menjadi dorsal recumbency, depresi, ikan menjadi berada di dasar kolam dan respirasi meningkat. Menurut Bowser (2001), tahapan anestesi dapat dilihat pada Tabel 1: Tabel 1 Tahapan Anestesi Ikan Tahapan 0 1 Normal Awal Sedasi 2 Sedasi total 3 Kehilangan sebagian keseimbangan 4 Kehilangan keseimbangan total Kehilangan reflex 5 6 Deskripsi Medulla kolaps asphyxia) (stadium Gejala Kesadaran ada; opercular rate dan otot normal Mulai kehilangan kesadaran; opercular rate sedikit menurun; keseimbangan normal Kehilangan kesadaran total; penurunan opercular rate; keseimbangan menurun Sebagian Otot mulai relaksasi; berenang tidak teratur; peningkatan opercular rate; Bereaksi hanya ketika ada tactile yang kuat dan rangsangan getaran Kehilangan keseimbangan dan otot secara total; lambat tetapi teratur opercular rate; kehilangan refleks spinal Kehilangan kesadaran total; opercular lambat dan tidak teratur; denyut jantung sangat lambat; kehilangan refleks Opercular berhenti bergerak; jantung menahan biasanya diikuti dengan gerakan cepat. 7 Menurut Harms (1998), anestesi pada ikan dilakukan untuk pemeriksaan, transportasi, diagnostik dan operasi. Prosedurnya yaitu menyiapkan air, memeriksa kondisi ikan, mengistirahatkan ikan. Penggunaan anestesi yang berlebihan atau overdosis digunakan untuk euthanasia. Anestesi untuk ikan biasanya penggunaannya melalui air (perendaman), dan bisa juga dengan cara anestesi inhalasi (seperti anestesi gas pada mamalia). Anestesi melalui injeksi efektif digunakan pada mamalia dan tidak efektif pada ikan. Faktor-faktor yang mempengaruhi respon penggunaan anestetikum antara lain spesies, kualitas air dan status kesehatan ikan. Berbeda spesies berbeda juga responnya, spesies dengan berat badan yang berbeda akan menimbulkan respon yang berbeda pula. Ikan dengan berat badan yang lebih besar akan menimbulkan respon yang lebih efektif. Ikan dengan lapisan lemak yang tinggi, ikan yang berumur tua, dan ikan betina gravid (berproduksi) akan memperpanjang durasi dan recovery akan semakin lama apabila menggunakan anestetikum yang mudah larut misal MS-222 atau benzocaine. Kualitas air berupa temperatur sangat mempengaruhi tetapi polanya tidak dapat dipercaya, misalnya MS-222 dan benzocaine memerlukan suhu tinggi untuk dosis yang tinggi. Keasaman juga mempunyai efek terhadap respon anestetikum, contohnya sebagian besar anestetikum bekerja pada air laut tetapi barbiturat bersifat antagonis terhadap ion Ca2+. Nilai pH juga mempengaruhi ionisasi obat sehingga efek obat menjadi meningkat. Ikan yang sakit akan menjadi subjek yang jelek pada proses anestesi (Ferguson 1988). Ferguson (1988) menyatakan bahwa tipe anestesi dan anestetikum yang biasa digunakan antara lain anestesi irigasi atau perendaman, jenis anestetikumnya yaitu MS-222, 2-phenoxyethanol dan benzocaine. Anestesi parenteral contoh sediaan anestetikumnya adalah alphaxolone (saffan), propanidid (epontol), sodium pentobarbitone (nembutal), ketamin hydrochloride (ketalar). Carbon dioxide, halothan, hypothermia menggunakan metode yang lainnya. Tipe anestesi yang lainnya yaitu dengan elektrik anestesi. Anestetikum yang digunakan pada ikan banyak jenisnya, misalnya ethanol, diethyl ether, halothane, lidocaine, tricaine methanesulfonate (MS-222), eugenol, ketamine, metomidate, propofol, and carbon dioxide. Dua diantaranya yang sering digunakan sekarang adalah tricaine methanesulfonate (MS-222) dan eugenol. Isofluran digunakan sebagai anestesi inhalasi pada mamalia dan burung, dapat juga untuk ikan dengan cara dicampurkan ke dalam air meskipun ada juga efek sampingnya (Harms 1998). Tricaine nama kimianya yaitu 3-aminobenzoic acid ethyl ester methanesulfonate, ethyl m-aminobenzoate methadesulfonate, methadesulfonate salt of alkyl aminobenzoate, and 8 methandesulfonate salt of ethyl meta-aminobenzoate. Nama dagangnya adalah tricaine methanesulfonate (MS-222), Tricaine-Stm and Meta-caine. Finqueltm and Tricaine-Stm yang biasa digunakan pada ikan. Ikan yang telah diberi anestesikum Finqueltm and Tricaine-Stm tidak boleh dimakan sebelum 21 hari setelah pemberian. Komposisinya larut air dan juga larut dalam lemak. Konsentrasi tricaine 15-330 mg/L. Dosis yang digunakan disesuaikan dengan jenis anestesi, ukuran, spesies, temperatur air dan tekanan air. Tricaine lebih baik digunakan dalam air hangat dan tekanan air yang rendah (Bowser 2001). Cara kerja tricain menurut Lewbart (2001) adalah dengan cara memblokir saluran sodium dan penggunaanya melalui pakan ikan. Sediaan sedatif tertentu dalam dosis tinggi akan mendepres sistem saraf pusat hingga tingkat tertentu yang dikenal sebagai tahap III dari anestesi umum. Akan tetapi kecocokan suatu senyawa tertentu sebagai senyawa pembantu dalam anestesi sangat bergantung pada sifat fisikokimia yang menentukan kecepatan mulai kerja dan lama kerja dari efek obat. Redistribusi dalam jaringan yang sangat cepat menentukan lama kerja yang singkat dari obatobat tersebut, yang sangat berguna di dalam praktik anestesi (Katzung 2001). 2.4 Acepromazine Acepromazine tergolong phenothiazine yang berwarna kuning, tidak berbau, rasanya pahit dan berbentuk bubuk dan cair (Plumb 2008). Menurut Mckelvey dan Wayne (2003) ada tiga macam kelas sedasi (tranquilizer) yang digunakan dalam kedokteran hewan yaitu phenothiazine, benzodiazepine dan alpha-2 agonist. Golongan ini bekerja pada susunan syaraf pusat dan menghasilkan efek penenang pada hewan. Obat-obat ini dapat juga menyebabkan ataksia, dan prolapsus membran niktitan. Hanya alpha-2 agonist yang mempunyai efek analgesik, sedangkan yang lainnya tidak punya. Efektif pada berbagai spesies hewan dan dapat dikombinasikan dengan obat lainnya, yakni atropin, opoid dan ketamin. Pemberian phenothiazine dapat melalui per oral, intra muscular, intra vena dan sub kutan. Efek yang ditimbulkan golongan phenothiazine antara lain sedasi, antiemetik, antiaritmia, antihistamin, vasodilatasi pembuluh darah, perubahan perilaku dan prolapsus penis pada kuda. Efek samping acepromazine yaitu hipotensi, anemia dan dehidrasi. Pada kuda dan anjing ras boxer penggunaan acepromazine sebaiknya dihindari. Acepromazine digunakan sebagai transquilizer pada anjing, kucing dan kuda. Acepromazine bersifat anti-kholinergik, anti-emetik, antispasmodik, antihistamin, dan memblok alpha-adrenergik. Acepromazine menyebabkan hipotensi dan menurunkan 9 vasomotorik. Dapat juga berpengaruh terhadap respirasi, denyut jantung dan suhu tubuh (Forney 2004). Acepromazine adalah golongan phenothiazine neuroleptik yang mempunyai potensi untuk memblok postsinapsis reseptor dopamin. Dopamin terutama berfungsi sebagai penghambat aktivitas otak (Adams 2008). Acepromazine mendepres susunan syaraf pusat (CNS) sehingga menghasilkan efek sedasi, relaksasi otot, dan menurunkan aktifitas refleks. Selain itu efek lainnya adalah anti kholinergik, antihistamin dan memblok alpha-adrenergik. Acepromazine seperti golongan phenothiazine lainnya dimetabolisme di hati dan ekresinya melalui urin. Acepromazine digunakan sebagai agen preanestesi, sebagai pengontrol satwa liar, antiemetik pada anjing dan kucing dan sebagai tranquilizer pada kuda. Acepromazine akan lebih efektif apabila dikombinasikan dengan tranquilizer lainnya dan dengan senyawa yang mempunyai potensi sebagai anestesi general. Tranquilizer harus diberikan dalam dosis yang kecil selama anestesi general dan hewan yang lemah, hewan dengan penyakit jantung, hypovolemik atau shock. Acepromazine jangan digunakan pada hewan yang lemah, betina bunting, breed giant, greyhound, dan boxer. Hasil penelitian menyatakan pada pengerat acepromazine menyebabkan embryotoxycity. Phenothiazine tidak boleh digunakan pada hewan yang mempunyai depresi tulang belakang (Crowell-Davis dan Murray 2005). Crowell-Davis dan Murray (2005) menyatakan bahwa phenothiazine mendepres sistem reticular aktif dan bagian otak yang mengontrol pergerakan tonus otot, tingkat metabolisme basal, dan keseimbangan hormonal. Efek samping pada cardiovascular adalah hipotensi, bradicardia, pembuluh darah kolaps, dan tachicardya. Acepromazine onsetnya 15 sampai dengan 60 menit setelah pemberian dan durasinya antara 3 sampai dengan 7 jam pada anjing dan kucing. 3 METODOLOGI 3.1 Waktu dan Tempat Penelitian ini dilakukan di Laboratorium Karekteristik Bahan Baku, Teknologi Hasil Perairan dan Laboratorium Lingkungan Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Penelitian dimulai pada bulan Juli 2010 sampai Desember 2011. 3.2 Bahan dan Alat Bahan yang digunakan antara lain, ikan nila sebanyak 90 ekor yang berumur 1 bulan, memiliki bobot sekitar 40 gram dan ikan nila sebanyak 15 ekor berumur 4 bulan dengan bobot 200 gram serta bahan anestesi kimia acepromazine. Alat yang digunakan antara lain, pipet volumetrik, gelas ukur, toples, akuarium, DO meter dan pH meter. 3.3 Rancangan Percobaan Rancangan percobaan yang digunakan pada penelitian ini adalah Rancangan Acak Lengkap (RAL) yang terdiri atas 6 perlakuan. Selanjutnya, setiap perlakuan tersebut diulang sebanyak 3 kali. Masing-masing ulangan terdiri atas 5 ekor ikan. Selain itu, untuk meminimalisir galat penelitian ini menggunakan replikasi sebanyak 3 kali pada waktu yang berbeda. Selanjutnya, perlakuan tersebut dapat diuraikan sebagai berikut: Perlakuan 0 (P0) : Kelompok ikan nila yang tidak direndam (dipping) acepromazine (kontrol) Perlakuan 1 (P1) : Kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis 10 ppm Perlakuan 2 (P2) : kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis 20 ppm Perlakuan 3 (P3) : Kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis 30 ppm Perlakuan 4 (P4) : Kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis 40 ppm Perlakuan 5 (P5) : Kelompok ikan nila yang direndam (dipping) dengan dosis 50 ppm acepromazine 11 Perlakuan nila besar : Kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis terbaik Parameter kualitas air yang diamati meliputi derajat keasaman (pH), oksigen terlarut (DO), dan kadar total amoniak nitrogen (TAN). a) Derajat keasaman (pH) (Rand et al. 1975) Perubahan pH menyebabkan stress pada ikan. Kemampuan air menahan perubahan pH sangatlah penting bagi kelangsungan hidup ikan. Kemampuan kapasitas buffer perairan ini berhubungan dengan adanya karbonat, bikarbonat, dan hidroksida. Air dengan kesadahan rendah memiliki kemampuan yang rendah dalam menahan keasaman (Shepherd 1992). Pengaruh pH terhadap ikan disajikan dalam Tabel 2. Tabel 2 Pengaruh perubahan pH terhadap ikan Kisaran pH Pengaruh terhadap ikan < 4,0 Titik mati asam 4,0 – 5,0 Tidak ada reproduksi 5,0 – 6,5 Pertumbuhan lambat 6,5 – 9,0 Kisaran yang layak untuk reproduksi > 9,0 Titik mati basa Sumber: Swingle (1969) dalam Boyd (1982) Derajat keasaman (pH) air diukur dengan melakukan pembacaan skala mengunakan pH meter. b) Oksigen terlarut (DO) (Rand et al. 1975) Konsentrasi DO merupakan salah satu parameter kualitas air yang penting bagi kelangsungan hidup lobster air tawar. Deplesi oksigen merupakan penyebab kematian kematian ikan secara mendadak dalam jumlah besar. Rust (2000) menyatakan bahwa oksigen dibutuhkan untuk mempertahankan kesehatan ikan dan sebagai fasilitator proses oksidatif kimiawi. Jika konsentrasi DO yang sesuai tidak dipertahankan, ikan akan mengalami stres dan mati. Kisaran nilai konsentrasi DO dan pengaruhnya terhadap kehidupan ikan disajikan dalam Tabel 3. 12 Tabel 3 Kisaran nilai konsentrasi DO dan pengaruhnya pada ikan Kisaran DO (mg/l) Kondisi ikan 0,0 – 0,3 Ikan kecil hidup untuk beberapa saat 0,3 – 1,0 Mematikan dalam jangka waktu yang lama 1,0 – 5,0 Ikan hidup tapi pertumbuhan lambat bila terjadi dalam jangka waktu yang lama > 5,0 Baik untuk pertumbuhan Sumber: Swingle (1969) dalam Boyd (1982) Oksigen terlarut (DO) diukur menggunakan DO-meter. Nilai DO yang terukur dapat diketahui melalui pembacaan skala. Metode penggunaan DO-meter adalah sebagai berikut: DO-meter dikalibrasi terlebih dahulu dengan air dari hasil analisis metode Winkler, kemudian DO-meter nilainya dibuat nol. Air uji sebanyak 100 ml dimasukkan ke dalam gelas piala 125 ml, ke dalam gelas piala ditambahkan stirer magnetik, gelas piala tersebut selanjutnya diletakkan di atas stirer. Stik/batang DOmeter dicelupkan ke dalam air uji tersebut. Stirer dan DO-meter dinyalakan secara bersamaan untuk mengetahui DO pada air uji. Nilai DO yang terukur diketahui melalui pembacaan skala pada alat. c) Amonia (Rand et al. 1975) Sumber utama amonia di lingkungan perairan adalah metabolisme ikan, eksresi ikan, pemupukan dan dekomposisi mikrobial dari komponen nitrogen (Boyd 1982). Ketika amonia memasuki perairan, ion hidrogen langsung bereaksi dan mengubah amonia ke dalam suatu kondisi kesetimbangan antara ion amonium yang tidak beracun (NH4+) dan amonia tidak terionisasi (NH3) yang beracun. Total amoniak nitrogen (TAN) diukur menggunakan alat spektrofotometer dengan metode sebagai berikut: air uji dipipet sebanyak 25 ml dan dimasukkan ke dalam gelas beker 100 ml. Larutan standar NH4Cl sebanyak 25 ml disiapkan dari larutan standar amoniak. Blanko dibuat dengan menggunakan 25 ml akuades. Satu tetes MnSO4, 0,5 ml chlorox, dan 0,6 ml reagen fenat ditambahkan ke dalam larutan standar, air uji, dan blanko sampai warna biru kehijauan kemudian dibiarkan sampai 15 menit. Spektrofotometer diatur pada absorbansi 0 dan panjang gelombang 630 nm menggunakan larutan blanko. Konsentrasi amoniak (TAN) pada air uji dihitung menggunakan rumus: 13 Mg NH3/L Keterangan: C : konsentrasi larutan standar (0,30 mg/L) Abs sampel : nilai absorbance larutan sampel Abs standar : nilai absorbance larutan standar 3.4 Parameter yang Diamati Parameter yang diamati dalam penelitian ini adalah onset dan durasi ACP pada ikan nila dengan metode dipping serta kualitas air awal pemingsanan dan akhir pemingsanan. Selain itu, ikan nila juga diamati tahapan anestesi dan tingkat kematiannya. Serta mengamati perubahan kualitas air awal dan akhir pada proses anestesi. 3.5 Analisis Data Data yang diperoleh dianalisis dengan Analysis of Varian (ANOVA) yang dilanjutkan dengan uji Tukey untuk melihat perbedaan pada masing-masing perlakuan. 4 HASIL DAN PEMBAHASAN Penelitian ini dilakukan untuk melihat onset, durasi, kematian dan tahapan anestesi Acepromazine (ACP). Selanjutnya, hasil penelitian dengan menggunakan ACP yang diberikan secara dipping terhadap ikan nila ini dapat disajikan sebagai berikut. 4.1 Onset Acepromazine (ACP) Onset anestetikum adalah suatu keadaan dimana status hewan yang kesadarannya mulai berkurang atau dengan kata lain dimulainya status kehilangan kesadaran (Mckelvey dan Wayne 2003). Hasil rataan onset ACP disajikan pada Tabel 4 dan grafik pada Gambar 2. Perlakuan P0 P1 P2 P3 P4 P5 R1 (menit) 0 49 33 18 16 20 Tabel 4 Hasil rataan onset ACP R2 R3 rataan onset±sd (menit) (menit) (menit) 0 0 0 35 37 40,33±7,57 39 32 34,67±3,79 21 28 21,67±4,04 18 23 19±3,61 12 14 15,33±4,16 Keterangan P0: kelompok ikan nila yang tidak direndam (dipping) acepromazine (kontrol); P1: kelompok ikan nila (dipping) acepromazine dengan dosis 10 ppm; P2: kelompok ikan nila (dipping) acepromazine dengan dosis 20 ppm; P3: kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis 30 ppm; P4: kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis 40 ppm; P5: kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis 50 ppm; R1: replikasi 1; R2: Replikasi 2; R3: replikasi 3. 45 Waktu Onset (menit) 40 40,33a 34,67ab 35 30 25 21,67bc 20 19c 15 15,33c 10 5 0 10 ppm 20 ppm 30 ppm 40 ppm 50 ppm Dosis Acepromazine Gambar 2 Grafik rataan onset ikan nila yang teranestesi setelah pemberian ACP secara dipping 15 Tabel 4 menunjukkan bahwa pada P0 memiliki waktu onset 0, karena ikan nila pada P0 tidak direndam (dipping) ACP sehingga ikan tidak teranestesi. Secara berurutan onset yang terpendek adalah P5 (15,33 menit), P4 (19 menit), P3 (21,67 menit), P2 (34,67 menit), dan P1 (40,33 menit). Perendaman ikan pada P5 memiliki onset yang lebih baik dibandingkan kelompok perlakuan lainnya. Sementara itu, P1 (10 ppm) memiliki onset terlama yaitu 40.33 menit. Terlihat perbedaan nyata antara P1 dan P5 serta P2 dengan P5. P5 lebih baik daripada P1 dan P2 karena onset pada P5 lebih cepat. Terlihat dari Tabel 4 bahwa semakin besar dosis maka semakin cepat onsetnya. Kecepatan onset anestetikum berarti ikan semakin cepat teranestesi. Perlakuan dengan dosis yang lebih tinggi akan lebih pendek onsetnya, karena pada perlakuan dengan dosis tinggi, tubuh ikan lebih banyak menyerap ACP sehingga onset lebih cepat. Faktor lain yang mempengaruhi kecepatan onset adalah kandungan lemak ikan. Ikan yang memiliki kandungan lemak lebih besar akan memiliki waktu onset yang pendek (lebih cepat teranestesi). Hal ini berkaitan dengan sifat dari acepromazine yang mudah terlarut atau terabsorbsi pada lemak (Crowell-Davis dan Murray 2005), sehingga ikan yang mempunyai kandungan lemak yang banyak akan lebih mudah teranestesi. Perubahan tingkah laku ikan pada proses pemingsanan ikan nila dengan ACP dapat dilihat pada Tabel 5. Salah satu parameter utama untuk mengetahui onset suatu sediaan anestetikum adalah hilangnya beberapa refleks (Mckelvey dan Wayne 2003). Tahapan pingsan atau kehilangan beberapa refleks ikan nila dapat dilihat pada Tabel 5. Menurut Bowser (2001) pada saat ikan nila kehilangan refleks maka ikan nila masuk pada tahapan kehilangan refleks, dengan ciriciri kehilangan kesadaran total, denyut jantung sangat lambat, dan kehilangan refleks. Gambar ikan yang teranestesi dapat ditunjukkan pada Gambar 3. Gambar 3 Ikan nila mulai teranestesi 16 Tabel 5 Tingkah laku ikan nila pada proses perendaman ACP Waktu Pengamatan (menit) Perlaku an P1 P2 P3 P4 P5 0-10 10-20 20-30 30-40 40-50 Posisi tubuh tegak, gerakan operkulum normal, sesekali diam di dasar, respon terhadap rangsangan luar tinggi Posisi tubuh tegak, sirip punggung meregang, gerakan operkulum mulai melemah Ikan mulai kehilangan keseimbangan, mulut disembulkan ke permukaan, posisi tubuh rebah, respon terhadap rangsangan luar lambat Ikan kehilangan keseimbanga n, posisi tubuh terbalik, masih ada gerakan tetapi jarang dan lemah Pingsan Posisi tubuh tegak, gerakan operkulum normal, mulut sesekali disembulkan ke permukaan Posisi tubuh agak miring, mulut sesekali disembulkan ke permukaan, respon terhadap rangsangan luar lambat Ikan kehilangan keseimbanga n, posisi tubuh terbalik, masih ada gerakan tetapi jarang dan lemah Ikan mulai hilang keseimbanga n, Pingsan Ikan kehilangan keseimbangan, posisi tubuh terbalik, masih ada gerakan tetapi jarang dan lemah Posisi tubuh agak miring, mulut sesekali disembulkan ke permukaan Posisi tubuh agak miring, mulut sesekali disembulkan ke permukaan, masih ada gerakan tetapi jarang dan lemah Posisi tubuh agak miring, mulut sesekali disembulkan ke permukaan, ikan kehilangan keseimbangan Pingsan Pingsan Pingsan 17 4.2 Durasi Acepromazine (ACP) Durasi anestetikum adalah suatu keadaan lamanya hewan teranestesi sampai dengan hewan pulih kembali (recovery). Recovery dimulai ketika stadium anestesi berakhir dan konsentrasi anestetikum di otak mulai berkurang (Mckelvey dan Wayne 2003). Selanjutnya hasil rataan durasi ACP disajikan pada Tabel 6 dan pada grafik Gambar 4. Perlakuan P0 P1 P2 P3 P4 P5 R1 (menit) 0 40 54 60 75 83 Tabel 6 Hasil rataan durasi ACP R2 R3 (menit) (menit) rataan durasi±sd (menit) 0 0 0 51 56 49±8,19 55 66 58,33±6,66 67 69 65,33±4,73 79 95 83±10,58 102 97 94±9,85 Keterangan P0: kelompok ikan nila yang tidak direndam (dipping) acepromazine (kontrol); P1: kelompok ikan nila (dipping) acepromazine dengan dosis 10 ppm; P2: kelompok ikan nila (dipping) acepromazine dengan dosis 20 ppm; P3: kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis 30 ppm; P4: kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis 40 ppm; P5: kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis 50 ppm; R1: replikasi 1; R2: Replikasi 2; R3: replikasi 3 94c Durasi Acepromazine (menit) 100 90 83bc 80 70 60 50 58,33a 65,33ab 49a 40 30 20 10 0 10 ppm 20 ppm 30 ppm 40 ppm 50 ppm Dosis Acepromazine Gambar 4. Grafik rataan durasi ikan nila setelah peberian ACP secara dipping Berdasarkan Tabel 6 terlihat bahwa P0 tidak mempunyai durasi. Hal tersebut karena ikan nila pada P0 tidak direndam (dipping) ACP sehingga durasinya 0. Perlakuan 1 (P1) memiliki durasi 49 menit, P2 mempunyai durasi 58,33 menit, P3 memiliki durasi 65,33 menit, P4 memiliki durasi 83 menit dan P5 memilki durasi 94 menit. Tabel 2 menunjukkan bahwa perlakuan yang cenderung mempunyai durasi paling lama adalah P5 yaitu 94 menit dan durasi tercepat pada P1 yaitu 49 menit. Hal ini karena semakin besar dosis yang digunakan, maka semakin lama durasinya. 18 Tanda-tanda pulih kembali menurut Mckelvey dan Wayne (2003) antara lain refleks, tonus otot dan rasa nyeri telah pulih kembali dan hewan mulai sadar. Hal ini terlihat jelas pada ikan nila yang kembali sadar setelah beberapa menit dipindahkan ke dalam air tanpa ACP. Tubuh ikan kembali seimbang, terlihat dari ikan berenang dengan aktif. Ikan merespon ketika diberi rangsangan, hal ini berarti refleks ikan telah pulih kembali. Gambar ikan telah recovery dapat ditunjukkan pada Gambar 5. Gambar 5 Ikan nila recovery 4.3 Kematian Ikan Nila Penggunaan anestetikum selalu mempunyai resiko. Pemberian anestetikum mempengaruhi otak terutama otak pada bagian yang mengontrol kardiovaskular, respirasi dan termoregulasi. Kematian terjadi apabila aktivitas pada pusat pengontrol tersebut di otak terdepres dan berhenti (Mckelvey dan Wayne 2003). Hasil rataan kematian ACP disajikan pada Tabel 7. Perlakuan P0 P1 P2 P3 P4 P5 Tabel 7 Hasil rataan persentase kematian ACP R1 R2 0% 0% 0% 0% 0% 0% 0% 0% 0% 0% 20% 40% R3 0% 0% 20% 0% 0% 20% Ketererangan P0: kelompok ikan nila yang tidak direndam (dipping) acepromazine (kontrol); P1: kelompok ikan nila (dipping) acepromazine dengan dosis 10 ppm; P2: kelompok ikan nila (dipping) acepromazine dengan dosis 20 ppm; P3: kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis 30 ppm; P4: kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis 40 ppm; P5: kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis 50 ppm; R1: replikasi 1; R2: Replikasi 2; R3: replikasi 3. Berdasarkan Tabel 7 terlihat kematian ikan nila pada P0 adalah 0%, karena ikan nila pada P0 tidak diberikan perlakuan ACP. Kematian ikan nila pada P0 ini menunjukkan air yang digunakan aman terhadap ikan nila dan kepadatan ikan masih dalam kepadatan yang normal. Sementara itu, kematian ikan nila pada P1 sampai P4 sebesar 0%. Meskipun pada P2 19 replikasi ke-3 terdapat kematian sebesar 20% namun kematian ini mungkin terjadi dikarenakan kondisi ikan yang mati kurang baik. Sedangkan pada P5 menunjukkan tingkat kematian 20% pada replikasi pertama, 40% pada replikasi ke-2, dan 20% pada replikasi ke-3. Data ini sebanding dengan pemingsanan ikan menggunakan MS-222 40 ppm yaitu memiliki tingkat kelangsungan hidup yang masih 100% (Daud et al. 1997). Hal ini menunjukkan bahwa dosis 50 ppm dapat menyebabkan kematian pada pemingsanan ikan nila, sebagaimana tampak pada Gambar 6. Gambar 6 Ikan nila mati Kematian pada dosis 50 ppm menurut Wiryoatmodjo (2000) disebabkan oleh kelebihan dosis (overdosis, terlalu dalam, keracunan) sehingga terjadi kelumpuhan pada pusat pernafasan dan sirkulasi yang letaknya di medulla oblongata. Berdasarkan Gambar 6 terlihat bahwa kematian terbesar pada perlakuan 5, hal ini disebabkan perlakuan 5 mendapatkan dosis yang terlalu tinggi (overdosis). Menurut Crowell-Davis dan Murray (2005) senyawa acepromazine dapat mendepres saluran respirasi. Ikan yang banyak mati adalah ikan dengan kandungan lemak yang besar. Hal ini berkaitan dengan sifat dari acepromazine yang mudah terlarut atau terabsorbsi pada lemak (Crowell-Davis dan Murray 2005). Ikan yang mempunyai lemak tinggi akan lebih cepat teranestesi dan proses ekskresi ACP dari tubuh berlangsung lama, sehingga durasinya menjadi lama dan ACP mendepres pusat respirasi lebih lama sehingga terjadi asphyxia. Kematian oleh karena anestesi dalam waktu singkat (akut) terjadi karena yaitu anestesi terlalu dalam (overdose, kelebihan dosis), gangguan pernapasan dan gangguan sirkulasi. Sementara itu, kematian dalam waktu yang lama terjadi karena kegagalan fungsi hati dan fungsi ginjal dalam mengeliminasi senyawa anestetikum (Wirjoatmodjo 2000). 20 4.4 Kualitas Air Kualitas air merupakan salah satu faktor yang memberikan pengaruh mendasar bagi kelangsungan hidup ikan air tawar. Pengujian kualitas air pada penelitian ini bertujuan untuk mengetahui karakteristik kimia fisik air baik sebelum maupun setelah proses pemingsanan. Pengujian sebelum proses pemingsanan bertujuan untuk melihat kelayakan kualitas air yang akan digunakan sebagai media pada proses pemingsanan. Sedangkan, proses pengujian kualitas air setelah proses pemingsanan bertujuan untuk mengetahui ada tidaknya pengaruh pemberian berbagai konsentrasi berbeda terhadap karakteristik fisik kimia air yang telah digunakan setelah proses pemingsanan. Pengujian kualitas air pada proses pemingsanan ikan nila dapat dilihat pada Tabel 8. Tabel 8 Pengujian kualitas air pada pemingsanan ikan nila dengan ACP Parameter Uji DO Perlakuan pH TAN Sebelum Sesudah Sebelum Sesudah Sebelum Sesudah P0 5,19±0,01 5,15±0,0265 7,20±0,02 7,19±0,265 0,212±0,01 0,232±0,0361 P1 5,17±0,0173 5,01±0,01 7,16±0,0361 7,07±0,01 0,215±0,02 0,263±0,0361 P2 5,16±0,02 5,03±0,0265 7,11±0,01 7,04±0,0265 0,209±0,0265 0,258±0,02 P3 5,16±0,0265 5,04±0,0436 7,08±0,361 7,04±0,361 0,216±0,02 0,254±0,02 P4 5,15±0,0361 7,03±0,0265 7,00±0,02 0,207±0,0265 0,243±0,01 P5 5,14±0,0265 5,07±0,0265 6,98±0,01 6,96±0,01 0,208±0,0361 0,241±0,0265 5,07±0,02 Ketererangan P0: kelompok ikan nila yang tidak direndam (dipping) acepromazine (kontrol); P1: kelompok ikan nila (dipping) acepromazine dengan dosis 10 ppm; P2: kelompok ikan nila (dipping) acepromazine dengan dosis 20 ppm; P3: kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis 30 ppm; P4: kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis 40 ppm; P5: kelompok ikan nila yang direndam (dipping) acepromazine dengan dosis 50 ppm; Keasaman air menurut Pudjianto (1984) adalah kemampuan kuantitatif (banyaknya asam) untuk menetralkan basa kuat sampai pH yang dikehendaki. Kandungan oksigen terlarut dalam air merupakan faktor pembatas dalam mendukung optimalisasi organisme perairan. Oksigen dibutuhkan untuk mempertahankan kesehatan ikan dan sebagai fasilitator proses oksidatif kimiawi. Jika konsentrasi DO yang sesuai tidak dipertahankan, ikan akan stres yang akhirnya menyebabkan kematian. Berdasarkan Tabel 8 di atas, dapat dilihat perubahan kualitas air sebelum dan sesudah dilakukan pemingsanan. Sebelum dilakukan pemingsanan, kadar DO air terukur pada kisaran 5,14-5,19; pH 6,98-7,20; dan kadar TAN 0,207-0,216. Sesudah dilakukan pemingsanan, kadar air terukur pada kisaran 5,01-5,15; pH 6,96-7,19; dan TAN 0,232-0,263. Kisaran 21 perubahan kualitas air tersebut masih dalam ambang batas yang layak untuk kelangsungan hidup ikan nila. Menurut Arie (2000), kualitas perairan yang baik bagi ikan nila untuk dapat hidup secara alami adalah kadar DO minimal 4 mg/L air, pH 4-11, dan kadar TAN 0,23-1,04 ppm. Perubahan kualitas air yang tidak signifikan ini juga menunjukkan bahwa penyebab ikan nila pingsan adalah penambahan acepromazine sebagai zat anestesi, bukan diakibatkan oleh perubahan kualitas air. 4.5 Pemingsanan Ikan Nila Besar Dosis terbaik yang didapat dari data waktu onset, durasi acepromazine, dan tingkat kematian ikan nila dari P1-P6 adalah P5 (perendaman ACP 40 ppm). Sehingga pada ikan besar dilakukan perlakuan dengan perendaman ACP 40 ppm. Hasil waktu onset, durasi acepromazine, tingkat kematian dan kualitas air untuk ikan besar dapat dilihat pada Tabel 9. Tabel 9 Hasil pemingsanan nila besar dengan ACP Pengujian Waktu Onset (menit) Durasi ACP (menit) Tingkat Kematian (%) Nilai DO Nilai pH Nilai TAN A B A B A B 1 63 45 0 5,20 5,14 7,15 7,08 0,217 0,276 2 69 42 0 5,21 5,13 7,15 7,08 0,217 0,277 3 64 46 0 5,21 5,11 7,15 7,10 0,217 0,277 Ulangan Ketererangan A: Awal; B: Akhir Pada Tabel 9 dapat dilihat bahwa waktu onset rata-rata ikan nila besar yang direndam acepromazine 40 ppm selama 65,33 menit. Durasi acepromazine rata-rata untuk ikan besar yang direndam dengan acepromazine 40 ppm selama 44,33 menit dan untuk tingkat kematiannya sebesar 0%. Hal ini menunjukkan bahwa dosis 40 ppm aman untuk kelangsungan hidup ikan nila pada proses pemingsanan. Sedangkan untuk hasil pengujian kualitas air pada ikan nila besar juga tidak terjadi perubahan yang besar terlihat dari nilai DO pada awal berkisar 5,20-5,21 dan pada akhir berkisar 5,11-5,14. Nilai pH pada awal pemingsanan ikan besar dengan acepromazine sebesar 7,15 dan pada akhir berkisar 7,087,10. Serta untuk nilai TAN pada awal pemingsanan ikan nila besar dengan acepromazine sebesar 0,217 dan pada akhir berkisar 0,276-0,277. Data hasil penelitian terhadap kedua kelompok ikan (besar/kecil) dengan perlakuan perendaman acepromazine 40 ppm menunjukkan perbedaan yang sangat jelas pada waktu onset dan durasi acepromazine, hal ini dapat terlihat pada Tabel 10. 22 Tabel 10 Perbandingan waktu onset dan durasi ACP ikan kecil dengan ikan besar yang direndam dengan larutan ACP 40 ppm Jenis Ikan Berat Badan Ikan (gram) Waktu Onset (menit) Durasi Acepromazine (menit) Nila Kecil 40 19 83 Nila Besar 200 65,33 44,33 Berdasarkan Tabel 10 dapat dilihat bahwa waktu onset dan durasi acepromazine untuk ikan besar yang memiliki berat badan 200 gram yaitu 65,33 menit dan 44,33 menit, nilai tersebut sangat berbeda jika dibandingkan dengan waktu onset dan durasi acepromazine untuk ikan kecil yang memiliki berat badan 40 gram yaitu 19 menit dan 83 menit. Hal ini menunjukkan ukuran ikan mempengaruhi waktu onset dan durasi acepromazine. Kemampuan ikan untuk bertahan pada media yang berbeda tergantung pada kemampuan untuk mengatur cairan tubuh sehingga mampu mempertahankan tingkat tekanan osmotik yang mendekati normal. Ikan yang lebih besar mempunyai kemampuan mengatur cairan tubuh yang lebih baik (Slembrouck et al. 2003). Menurut Ferguson (1988) faktor-faktor yang mempengaruhi anestesi antara lain spesies, kualitas air dan status kesehatan ikan. Spesies termasuk di dalamnya adalah berat badan, lapisan lemak, ikan yang berumur tua, dan ikan betina gravid (berproduksi). Kualitas air meliputi temperatur, keasaman dan PH. 5 KESIMPULAN DAN SARAN 5.1 Kesimpulan Berdasarkan hasil penelitian dapat disimpulkan dosis acepromazine yang efektif adalah dosis 40 ppm (P4). Perlakuan 5 (P4) memiliki onset 19 menit, durasi 83 menit dan kematian 0%, walaupun onsetnya lebih lama dibandingkan onset perlakuan 6 (P5) dan durasi acepromazine juga lebih cepat dibandingkan perlakuan 6 (P5), tetapi tingkat kematian P5 tidak 0% bahkan lebih dari 20%. Tahapan anestesi terlihat jelas pada kelompok tersebut yaitu posisi tubuh, keseimbangan yang berkurang, beberapa refleks dan respon terhadap rangsangan hilang. Sedangkan untuk perubahan kualitas air pada penelitian ini tidak memberikan pengaruh dan perubahan yang besar. Ikan besar memiliki waktu onset yang lebih lama dibandingkan dengan ikan kecil, sedangkan untuk durasi acepromazine lebih cepat dibandingkan ikan kecil. 5.2 Saran Saran yang dapat diberikan pada penelitian ini adalah perlu dilakukan penelitian lebih lanjut mengenai keamanan bahan terhadap daging ikan (residu dalam daging) dan perlunya simulasi transportasi sisterm kering untuk mengetahui efektifitas acepromazine sebagai bahan anestesi. DAFTAR PUSTAKA Adams HR. 2008. Veterinary Pharmacology and Therapeutics. United Kingdom: Blackwell Publishing. Arie U. 2000. Pembenihan dan Pembesaran Nila Gift. Penebar Swadaya. Jakarta. Bowser PR. 2001. Anesthetic Options for Fish. http://www.ivis.org/advances/Anesthesia_Gl [16 Juli 2009]. Boyd CE. 1982. Water Quality Management for Pond Fish Culture. Elsevier Scientific Publishing Company. New York. Hlm: 318. Crowell-Davis, SL, Murray T. 2005. Veterinary Psychopharmacology. United Kingdom: Blackwell Publishing. Daud R, Suwardi, Jacob MJ, Utojo . 1997. Penggunaan MS-222 (Tricaine) untuk pembiusan Bandeng Umpan. Jurnal Penelitian Indonesia. Vol: 3(3) : 47 - 51 Ferguson H. 1988. Anesthesia and treatment. Proceeding Fish Disease 106 23-27 May 1988. The university of Sydney: Post Gradute Committee in Veterinary Science University Of Sydney. Forney B. 2004. Acepromazine Maleate For Veterinary Use. http://www.wedgewoodpharmacy.com/monographs/AcepromazineMaleate.asp/ [16 Juli 2009]. Gunn E. 2001. Floundering in the Foibes of Fish Anestesia. Hlm: 211. Harms CA. 1998. Anesthesia in fish. In Fowler ME and Miller RE: Zoo & Wild Animal Medicine Current Therapy 4. W.B. Philadelphia: Saunders Company, Hlm: 158-163. Katzung BG. 2001. Farmakologi Dasar dan Klinik edisi ke 8. Jakarta: Salemba Medika. Kottelat M, Whitten AJ, Kartikasari SN, Wirjoatmojo S. 1993. Freshwater fishes of Western Indonesia and Sulawesi. Hong Kong: Periplus Editions. Hlm: 344. Lewbart, Greg MS. 2001. Anesthesia, Analgesia, and Surgery in Pet Fish. http://www.vin.com/VINDBPub/SearchPB/Proceedings/PR05000/PR00342.htm/ [16 Juli 2009]. Mckelvey D, Wayne K. 2003. Veterinary anesthesia and analgesia. Amerika: Occation the veterinarian. Nabib R, Pasaribu F. 1989. Patologi dan penyakit ikan. Bogor: Institut Pertanian Bogor Press. Plumb DC. 2008. Veterinary Drug Handbook. United Kingdom: Blackwell Publishing. Pudjianto WE. 1984. Analisis Kualitas Air. Surabaya: Bina Indra Karya. Rahmat H. 2008. Gambar ikan nila. http://google.com/search/gambar ikan nila/[16 Juli 2009]. Rand MC, Greenberg AE, Taras MJ. 1975. Standard Methods for the Examination of Water and Wastewater. 14th Ed. Washington, DC: APHA, 1015 Eighteenth Street NW. Rust MB. 2000. Recirculation System: Procces Enginering. Dalam Encyclopedia of Aquaculture. Jhon Wiley and sons, Inc. New York. Hlm: 731-736. Saanin H. 1984. Taksonomi dan kunci identifikasi ikan. Jakarta: Bina Cipta. 25 Scott W, Chick W, Tobias S, Charles I, Alan MK. 2009. Anesthesia, Diagnostic Imaging, and Surgery of Fish. http://www.vetlearn.com/ME2/Audiences/dirmod.asp? [16 Juli 2009]. Shepherd J, Bromage N. 1992. Insentive Fish Farming.Blackwell Scintivic, Inc. London. Hlm: 404 . Slembrouck J, Pamungkas W, Subagja J, Hadle W, Legendre M. Larval Biology. In Slembrouck, J,. Komarudin, O., Maskur, and Legendre, M. (eds). Technical Manual for Artificial Propagation of the Indonesian Catfish, Pangasius djambal. Karya Pratama, Jakarta, Hlm:87-93. Suryanto. 1998. Anestesi. http://id.wikipedia.org/wiki/Anestesi/ [16 Juli 2009]. Suyanto R. 2003. Nila. Jakarta: Penebar Swadaya Trewavas F. 1986. Tilapias: Taxonomi and Speciation . In R.S.V. Dullin and R.H Low Mc. Connell ( Eds ). The Biology and Culture of Tilapias . ICLARM Converence , Mamalia. van Ginneken VJ T, Addink ADF, van den Thillart, GEEJM., Korner F, Noldus L, Buma, M. (1997). Metabolic rate and level of activity determined in tilapia (Oreochromis mossambicus Peters) by direct and indirect calorimetry and videomonitoring. Thermochim. Acta 291. Hlm: 1-13. Wibowo S. 2001. Transportasi udang hidup sistem kering. Info Budidaya. BPPL Slipi. Jakarta. Wirjoatmodjo K. 2000. Anestesiologi Dan Reaminasi Modul Dasar Untuk Pendidikan S1 Kedokteran. Jakarta: Ditjen Pendidikan Tinggi Departemen Pendidikan Nasional. 26 LAMPIRAN 27 Lampiran 1 Data Bobot Ikan Nila Kecil dan Besar Bobot K (gr) Bobot K (gr) Bobot K (gr) Bobot B (gr) 41 38 39 201 42 39 44 199 39 42 45 201 44 35 44 200 45 35 36 200 35 44 37 198 39 42 38 200 38 42 43 199 37 42 43 198 36 43 43 200 43 44 43 202 45 40 36 198 40 40 39 200 41 40 38 199 43 40 38 200 44 39 39 42 41 40 35 35 35 36 35 37 38 45 39 37 42 39 42 35 35 42 40 42 43 43 36 41 38 36 Bobot rata-rata ikan kecil Bobot rata-rata ikan besar = 39,88 gram = 199,67 gram 28 Lampiran 2 Analisi Nilai Waktu Onset Acepromazine A. Tabel ANOVA waktu onset Acepromazine ANOVA waktuonset Between Groups Sum of Squares 1385,733 Within Groups Total Df 4 Mean Square 346,433 236,667 10 23,667 1622,400 14 B. Tabel uji Tukey waktu onset Acepromazine waktuonset Tukey HSD Subset for alpha = .05 Dosis 50 ppm N 3 1 15,3333 40 ppm 3 19,0000 30 ppm 3 21,6667 20 ppm 3 10 ppm 3 Sig. 2 3 21,6667 34,6667 34,6667 40,3333 ,532 ,051 ,626 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3,000. F 14,638 Sig. ,000 29 Lampiran 3 Analisis Nilai Durasi Acepromazine A. Tabel ANOVA waktu onset Acepromazine ANOVA durasiacepromazine Between Groups Sum of Squares 4031,600 Within Groups Total Df 4 Mean Square 1007,900 685,333 10 68,533 4716,933 14 B. Tabel uji Tukey waktu onset Acepromazine durasiacepromazine Tukey HSD Subset for alpha = .05 dosis 10 ppm N 3 1 49,0000 20 ppm 3 58,3333 30 ppm 3 65,3333 40 ppm 3 50 ppm 3 Sig. 2 3 65,3333 83,0000 83,0000 94,0000 ,188 ,141 ,514 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3,000. F 14,707 Sig. ,000 30 Lampiran 4 Analisis Nilai Tingkat Kelangsungan Hidup Acepromazine A. Tabel ANOVA tingkat kelangsungan hidup Acepromazine ANOVA tingkatkelangsunganhidup Between Groups Sum of Squares 1706,667 Within Groups Total Df 4 Mean Square 426,667 266,667 10 26,667 1973,333 14 F 16,000 B. Tabel uji Tukey tingkat kelangsungan hidup Acepromazine tingkatkelangsunganhidup Tukey HSD Subset for alpha = .05 Dosis 50 ppm N 3 1 73,3333 2 10 ppm 3 100,0000 20 ppm 3 100,0000 30 ppm 3 100,0000 40 ppm 3 100,0000 Sig. 1,000 1,000 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3,000. Sig. ,000 31 Lampiran 5 DO Meter 32 Lampiran 6 pH Meter