asam karboksilat
advertisement

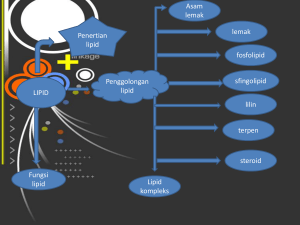
ASAM KARBOKSILAT Deskripsi: Struktur, tata nama, penggolongan dan manfaat asam karboksilat DEFINISI ASAM KARBOKSILAT Senyawa yang mempunyai satu gugus karbonil yang berikatan dengan satu gugus hidroksil yang disebut dengan ―gugus karboksil‖ (karbonil + hidroksil). O R C OH TATA NAMA IUPAC Dimulai dengan asam + rantai karbon terpanjang yang mengandung gugus karboksilat (CO2H) + akhiran oat. Contoh : O H C OH O O CH3 CH3 C CH3 C OH asam butanoat asam etanoat CH3 O CH CH2 OH asam metanoat CH3 CH2 CH2 H3C C OH C CH3 O C O CH3 OH CH OH CH2 C OH CH3 5 CH2 4 Jika mengandung rantai cabang, maka atom C dari gugus karboksilat dengan rantai terpanjang diberi nomor 1 Contoh : CH 3 CH3 CH2 2 asam-3 - metil pentanoat COOH 1 5 CH3 4 CH OH 3 CH2 2 CH 1 COOH CH3 asam-4 - hidroksi - 2 - metil pentanoat Jika terdapat lebih dari satu cabang atau gugus cabang maka penulisan rantai atau gugus cabang menurut abjad Jika senyawa mempunyai 2 gugus karboksilat, penamaan rantai utama diberi akhiran dioat. O O C CH 2 HO HO asam propandioat (asam malonat) C OH O O C C asam etandioat (asam oksalat) OH O HO C O CH 2 CH 2 CH 2 CH 2 C OH asam heksandioat (asam adipat) TATA NAMA TRIVIAL Tidak mempunyai sistematika O H asam formiat C OH O CH3 CH2 CH2 C OH asam butirat Letak susbtituen dinyatakan dengan , , , dan seterusnya O CH3 5 CH2 4 CH2 3 CH2 2 C 1 OH Cl CH3 CH COOH asam - kloropropanoat Formula/struktur IUPAC Trivial HCO2H As. metanoat Asam formiat CH3CO2H Asam etanoat Asam asetat CH3(CH2)2CO2H Asam butanoat Asam butirat CH3(CH2)2CO2H As. pentanoat Asam valerat CH3(CH2)4CO2H As. heksanoat Asam kaproat CH3(CH2)5CO2H As. heptanoat Asam enantat HO2CCO2H As. etandioat Asam oksalat HO2CCH2CO2H As.propandioat As. malonat HO2(CH2)2CO2H As. butandioat As. suksinat Practice O HO C O H2 C H2 C H C C OH CH3 O HO CH3 H2 C H C C H2 C O H2 C C H CH3 O HO C O C H C H H2 C C OH C OH Sifat-sifat Asam Karboksilat Asam karboksilat mempunyai 3 ikatan kovalen polar senyawa polar O C+ H3C - + H O Asam karboksilat mampu membentuk ikatan hidrogen melalui gugus C O dan O + O CH 3 C H C O H H + O O- C CH 3 ikatan hidrogen yang terbentuk > ikatan hidrogen pada alkohol titik didih asam karboksilat > titik didih alkohol yang Mr sama O CH 3 CH 2 C OH > CH 3 CH 2 td CH 2 CH 2 OH td Asam karboksilat mampu membentuk ikatan hidrogen dengan air mudah larut dalam air O R C OH rantai C non polar gugus polar Keasaman Asam Karboksilat Asam karboksilat terionisasi di dalam air membentuk larutan yang bersifat sedikit asam Keasaman asam karboksilat asam-asam anorganik karena asam karboksilat terionisasi sebagian di dalam air asam lemah O O CH3 CH2 C CH3 OH C [CH 3CO2 ] [ H ] Ka 1.8 x 105 [CH 3CO2 H ] - O + +H o Dibanding dengan alkohol, Ka asam karboksilat lebih besar karena asam karboksilat dapat beresonansi CH3 CH2 O tidak dapat beresonansi alkohol O CH3 C O O CH3 C O asam karboksilat Asam karboksilat dapat bereaksi dengan basa (NaOH) membentuk garam karboksilat O 1 C O OH + NaOH C - + O Na + H 2O asam benzoat O 2 CH3 C O OH + Na 2 CO 3 asam asetat CH3 C - + O Na + H 2CO3 Na - asetat CO2 H2O Pembuatan Asam Karboksilat Asam karboksilat dapat disintesis atau dibuat melalui beberapa cara : 1. Oksidasi alkohol primer dan aldehida CH 3 CH 3 CH 2 CH 2 CH 2 CH 2 H+ OH + K 2Cr 2O7 CH 2 OH + KMnO CH 3 H+ 4 CH 2 CH 3 C OH CH 2 CH 2 oksidator kuat alkohol O CH 2 O CH OH aldehida OH C + Ag (NH3)2 H + NH 4OH COOH O CH 2 OH oksidator lemah CH OH C OH 2. Oksidasi alkena RCH HR dan R2C CHR O H 3C C H C CH 2 CH 3 Oks C H 3C H3C H2 C H 2C H 2C H3C CH CH C H2 sikloheksena Oks H2 C H2C H2C COOH COOH C H2 asam adipat O HO C CH 2 CH 3 3. Oksidasi gugus alkil pada cincin benzena Cl Cl CH 2 CH 2 COOH CH 3 + KMnO4 CH OH- CH 3 COOH CH 3 seberapa panjangpun gugus alkil, akan didegradasi menjadi gugus karboksilat benzoat. Beberapa Reaksi Asam Karboksilat 1. Reduksi O R katalis + 2 H2 C D OH R C OH + H 2O asam karboksilat O CH3 O C CH2 OH C OH + H 2 Pt O 25 c asam 3 - keto butanoat OH + LiAlH4 CH3 CH2 C OH asam 3 - hidroksi butanoat O C CH3 CH O H2C OH H2O CH3 2. Dekarboksilasi asam - keton dan - dikarboksilat. Reaksi dekarboksilasi ini khusus hanya terjadi pada asam karboksilat yang mempunyai gugus - keton O H 3C C O O H2 C C CH3 C OH asam 3 - ketobutanoat aseton CH3 + CO 2 3. Asam Lemak/Hidrolisis Lemak/minyak dihidrolisis menghasilkan asam karboksilat O H2C HC H2C O O O C O (CH2)16CH3 C O (CH2)16CH3 C (CH2)16CH3 Tristearin (gliserol tristearat) H2C + 3 H2O H+ OH HC H2C OH + OH Gliserol CH 3(CH2)16CO 2H As. Stearat (As. Lemak) ESTER Ester Ester memiliki rumus umum RCOOR’, dimana gugus karbonil terikat pada gugus alkoksi (―OR). • Rumus umum ester: Tatanama Ester Tatanama ester diturunkan dari penamaan alkohol (diberi akhiran -il) dan asam (dengan akhiran –oat). Penulisannya dituliskan turunan alkohol terlebih dahulu sehingga menjadi alkil alkanoat. Contoh: CH3CH2COOCH3 metil propanoat Sifat Fisika Ester 1. 2. Ester merupakan senyawa polar, tetapi tidak dapat membentuk ikatan hidrogen yang kuat karena tidak ada atom H yang berikatan dengan atom O. sehingga, ester memiliki titik didih yang lebih rendah dibanding asam karboksilat maupun alkohol dengan berat molekul yang sebanding. 3. Titik didih ester hampir sama dengan aldehid dan keton padannya. 4. Ester biasanya memiliki bau yang wangi, beberapa mirip dengan bau buah-buahan dan digunakan di industri untuk pembuatan perasa buatan. Tabel Senyawa Ester dan Aromanya No. Ester Aroma 1. Isoamil asetat Pisang 2. Etil asetat Penghapus cat kuku 3. Metil salisilat Tanaman wintergreen 4. Etil butirat Nanas 5. Benzil butirat Ceri 6. Etil propionat Buah-buahan 7. Etil benzoat Rum 8. Benzyl asetat Buah persik 9. Metil butirat Apel 10. Oktil asetat Jeruk 11. n-propil asetat Buah pir 12. etil fenilasetat Madu Sifat Kimia Ester 1. 2. Gugus karbonil menentukan kereaktifan ester. Dapat mengalami reaksi substitusi nukleofil dengan mudah. Reaksi-reaksi pada Ester 1. 2. Reaksi Hidrolisis Transesterifikasi Hidrolisis Ester Esters dapat mengalami hidrolisis oleh basa seperti pada hidrolisis asam karboksilat. Hidrolisis dengan basa disebut penyabunan. H2O R—COOR’ + NaOH → RCOONa + R’OH Transesterifikasi Ester dapat disintesis melalui reaksi transesterifikasi. R—COOR’ + R’’OH Ester t.didih tinggi H+, panas Alkohol t.didih tinggi RCOOR’’ + R’OH Ester t.didih lebih tinggi Alkohol t.didih lebih rendah