Pengaruh Pemberian Ekstrak Buah Mahkota Dewa
advertisement

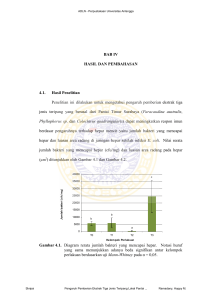
BioSMART Volume 6, Nomor 2 Halaman: 91-98 ISSN: 1411-321X Oktober 2004 Pengaruh Pemberian Ekstrak Buah Mahkota Dewa [Phaleria macrocarpa (Scheff) Boerl] terhadap Struktur Histologis Hepar Tikus Putih (Rattus norvegicus L.) setelah Perlakuan dengan Karbon Tetraklorida (CCl4) secara Oral The effect of [Phaleria macrocarpa (Scheff) Boerl] fruits extract on the histological structure of white rat (Rattus nervogicus L.) liver after orally carbon tetrachloride (CCl4) exposure DIAN ENDRI SULISTIANTO, MARTI HARINI♥, NOOR SOESANTI HANDAJANI Jurusan Biologi FMIPA Universitas Sebelas Maret Surakarta 57126 Diterima: 5 Januari 2004. Disetujui: 11 Maret 2004 ABSTRACT The aim of this research is to investigate the effect of Phalleria macrocarpa fruit ekstract on white rat liver againts hepatotoxican CCl4. The subjects consisted of twenty rats Rattus norvegicus ages 2-2,5 month old with body weight around 200-250 grams which divided into 5 groups of four rats each. The first group was given water and standar diet. The second group was given 0,2 ml CCl4. the third group was given 1,3 ml Phaleria macrocarpa fruits extract. The fourth group was given 0,2 ml CCl4 for 15 days to continued with 1,5 ml extract for 15 days. The rest of group was given 1,3 ml extract for 15 days to continued with 0,1 ml CCl4 for 15 days. Treatment were given per oral daily during 30 days. The result indicated that the hepar cells of all control group was normal. Histological feature in the group of rats treated with CCl4 showed bad liver features compared to the other groups. The group of rats firstly treated with CCl4 then extract showed fatty liver features but hepar cells mostly normal detected. The last group of rats firstly treated with extract then CCl4 showed some of liver damage such as fatty liver, karyolysis, and karyorrehxis. Normal hepar cells were least detected. It is concluded that the effect of Phaleria macrocarpa fruits extract could be help hepar cell recovery from carbon tetrachloride exposure. Keywords: fruits extract of Phaleria macrocarpa, CCl4, anti hepatotoxic, hepar cell. PENDAHULUAN Dalam kehidupan sehari-hari manusia terancam oleh zat kimia berbahaya yang terpapar secara langsung maupun tidak langsung. Zat-zat kimia yang masuk ke dalam tubuh tidak hanya perlu dipelajari sifat-sifat racunnya namun harus disertai pemahaman tentang keamanan pemakaiannya. Penggunaan zat kimia atau obat selalu menimbulkan risiko meskipun telah diusahakan untuk menekannya sekecil mungkin pengaruh toksik dari suatu obat merupakan risiko yang dapat timbul. Karbon tetraklorida (CCl4) merupakan pelarut organik yang bersifat toksik terhadap hati, ginjal dan jantung (Darmansjah et al., 1995). Dalam penelitiannya, Ariyani (2002) menunjukkan kerusakan hepar berupa perlemakan sel hepar dan gambaran sel yang mengalami karioreksis dan kariolisis. Beberapa penelitian terdahulu telah memanfaatkan sifat hepatotoksik CCl4 sebagai model kerusakan sel hepar untuk menguji kemampuan bahan alam seperti ekstrak heksan meniran sebagai zat anti penghambat kerusakan pada hepar (Syamasundar et al., 1985 dalam Lestariana, 1997). Bahan ♥ Alamat korespondensi: Jl. Ir. Sutami 36A Surakarta 57126 Tel. & Fax.: +62-271-663375. e-mail: [email protected] alam hayati lain yang diduga memiliki efek serupa adalah tanaman obat mahkota dewa. Oleh Harmanto (2001) secara empiris buah dan daun mahkota dewa telah digunakan untuk pengobatan terhadap sirosis hepar dan penyakit lever. Efek terapi yang dimiliki berkaitan erat dengan senyawa kimia yang terkandung didalamnya. Dalam kulit buahnya terkandung senyawa alkaloid, saponin dan flavonoid (Gotama et al., 1999). Efek terapi sebagai anti hepatotoksik diduga oleh adanya senyawa flavonoid yang terkandung dalam mahkota dewa. Uji anti hepatotoksik dari tanaman ini dilakukan secara klinis untuk memberikan dukungan ilmiah terhadap bahan kimia bioaktif dan efek terapi yang dimiliki. Karbon tetraklorida telah terbukti menimbulkan efek toksik pada hepar hewan percobaan. Derajat kerusakan yang ditimbulkan menyebabkan suatu efek awal atas fungsi suatu organisme dan perubahan patologi di dalam organ spesifik misalnya hepar (Loomis, 1978). Hepar merupakan organ yang sangat rentan terhadap pengaruh zat kimia. Sebagian besar zat kimia memasuki tubuh melalui sistem gastrointestinal yang akan menyerap dan membawanya ke hati melalui vena porta (Lu, 1995). Dalam hepar zat kimia mengalami metabolisme yang menyebabkan sifat toksiknya berkurang dan lebih mudah larut dalam air. Disamping itu hepar memiliki daya regenerasi yang sangat baik. Pada tikus, hepar dapat memulihkan kehilangan sampai 75% dari 2004 Jurusan Biologi FMIPA UNS Surakarta 92 B i o S M A R T Vol. 6, No. 2, Oktober 2004, hal. 91-98 beratnya dalam waktu satu bulan. Namun bila kerusakan terjadi berulang-ulang maka akan terbentuk banyak jaringan ikat bersama regenerasi sel hati dan akan menyebabkan struktur hepar yang tidak teratur. BAHAN DAN METODE Waktu dan tempat Penelitian ini dilakukan pada Januari sampai Maret 2003. Tempat penelitian meliputi Unit Pengembangan Hewan Percobaan (UPHP) UGM Yogyakarta dan Sub Lab Biologi Labolatorium Pusat F.MIPA UNS Surakarta. Alat dan bahan Alat untuk perlakuan berupa kandang pemeliharaan tikus putih beserta tempat pakan dan minum, Alat yang digunakan yaitu timbangan analitik, pisau, oven, corong, gelas ukur, pipet ukur, kertas saring, rotary evaporator (vaccum evaporator) dan centrifuge. Alat untuk Perlakuan antara lain gelas ukur, canule, kandang pemeliharaan dan timbangan. Alat yang diguanakan untuk pembuatan preparat yaitu bak parafin, disecting kit, kertas label, botol flakon, gelas benda dan gelas penutup, rotary mikrotom, oven, staning kit, cawan petri, pipet ukur, mikroskop dengan mikrometer, holder kayu, kertas filter, hot plate, pipet, karton serta kamera foto untuk dokumentasi. Bahan-bahan yang diperlukan untuk penelitian ini meliputi tikus putih (Rattus norvegicus L.) Jantan strain Wistar umur 2-3 bulan dengan berat badan 200-250 gram sebanyak 20 tikus, pellet sebagai pakan sehari-hari, air ledeng, karbon tetraklorida bentuk cair. Bahan pembuat ekstrak antara lain ethanol 50% dan buah mahkota dewa matang berwarna merah dari tanaman yang telah diidenifikasi dan determinasi di Laboratorium Farmakognisi Fakultas Farmasi UGM. Bahan yang digunakan untuk pembuatan preparat histologis dengan metode parafin meliputi: Larutan Bouin untuk fiksasi, garam fisiologis NaCl (0,9%), alkohol teknis, toluol, xylol, parafin dengan titik cair 50-55oC, pewarna Haematoxylin dan Eosin Y, akuades, Meyer’s albumin, enthelan (Suntoro, 1983). Cara kerja Rancangan percobaan Penelitian ini menggunakan rancangan percobaan dengan metode Rancangan Acak Lengkap (RAL) dengan lima macam perlakuan, setiap perlakuan dengan 4 ulangan. Persiapan hewan percobaan Tikus putih jantan berumur 2-3 bulan dengan berat badan rata-rata 200-250 gram dan dipelihara di kandang, masing-masing kandang perlakuan berisi empat tikus putih (total 5 macam perlakuan = 20 tikus) sebelum memulai perlakuan hewan percobaan diaklimatisasi dalam kandangnya selama 5 hari. Pembuatan ekstrak dan pengenceran Pemilihan buah yang telah matang berwarna merah untuk kemudian melalui pengeringan akan dibuat serbuk halus. Ethanol ditambahkan untuk melakukan ekstraksi dari serbuk ini selama kurang lebih 2 (dua) jam kemudian dilanjutkan maserasi selama 24 jam. Setelah masuk ke tahap filtrasi, akan diperoleh filtrat dan residu. Filtrat yang didapatkan akan diteruskan ke tahap evaporasi dengan Rotary evaporator pada suhu 40 derajad celcius sehingga akhirnya diperoleh ekstrak kering sebesar 89,6 gram. Dari ekstrak ini dibuat larutan ekstrak dengan konsentrasi 20% B/V (persen berat per volume , untuk 1% B/V = 1 g/100 ml). Hal tersebut bertujuan untuk memudahkan perhitungan dan pembuatan larutan ekstrak. Untuk pengenceran harus dicari terlebih dahulu akuades yang dibutuhkan sesuai dengan konsentrasi 20% B/V, sehingga akuades yang dibutuhkan adalah sebesar 448 ml. Penentuan dosis CCl4 Senyawa CCl4 yang diberikan dalam bentuk cair sehingga tidak memerlukan pengenceran dengan senyawa lain. Penentuan dosis oral untuk semua kelompok perlakuan adalah sebesar 3,6 ml/ kg BB tikus (Loomis, 1978). Batas aman yang digunakan adalah sebesar 20% dari LD 50 yaitu 0,72 ml/ kg BB = 0,144 ml/ 200 g BB atau sama dengan 0,72. 10 -3 ml/ g BB. Senyawa CCl4 dipilih sebagai model kerusakan pada hati tikus putih. Pembuatan larutan ekstrak dan penentuan dosis Dalam pemakaian sehari-hari pemakaian buah mahkota dewa untuk pengobatan oleh manusia adalah sebesar 15 g. Dari tabel konversi penetapan volume cekok tunggal dari manusia ke hewan uji menurut Laurence dan Bacharach (1964), diketahui bahwa faktor konversi untuk manusia Eropa (70 kg) ke tikus dengan berat 200 g adalah 0,018 sehingga dosis untuk tikus adalah: 0,27 g/200 gBB tikus yang diperoleh dari perhitungan (0,018x15 g/kg BB). Penentuan dosis untuk masing-masing perlakuan ditetapkan atas rata-rata berat badan hewan uji. Ekstrak dibuat dalam konsentrasi 20% B/V yang artinya mengandung 20 g berat ekstrak per 100 ml akuades. Untuk 1 ml ekstrak mengandung 200 mg sehingga dosis sebesar 270 mg/200 g BB akan sebesar 1,35 ml. Perlakuan terhadap hewan percobaan Perlakuan diberikan selama 30 hari, seluruh kelompok perlakuan mendapakan diet standar berupa pellet dan air ledeng. Dalam setiap kelompok perlakuan dan antar kelompok perlakuan terdapat perbedaan pemberian dosis senyawa CCl4 maupun ekstrak buah mahkota dewa. Perbedaan ini karena setiap pemberian dosis ditentukan berdasarkan berat rata-rata hewan uji. Kelompok IV dan V memiliki dua fase perlakuan, yaitu perlakuan selama 15 hari pertama dan 15 hari kedua. setelah 30 hari perlakuan hewan uji akan dikorbankan pada hari ke-31. Selengkapnya sebagai berikut: • Kelompok I (K I) : Pemberian diet standar tanpa senyawa CCl4 dan ekstrak buah mahkota dewa. • Kelompok II (K II) : Pemberian 0,2 ml CCl4 selama 30 hari. • Kelompok III (K III) : Pemberian 1,3 ml ekstrak buah mahkota dewa selama 30 hari. • Kelompok IV (K IV) : Pemberian 0,2 ml CCl4 selama 15 hari dilanjutkan dengan 1,5 ml ekstrak buah mahkota dewa selama 15 hari. ENDRI dkk., – Pengaruh ekstrak buah Phaleria macrocarpa pada hepar Rattus norvegicus • Kelompok V (K V) : Pemberian 1,3 ml ekstrak buah mahkota dewa selama 15 hari dilanjutkan dengan 0,1 ml CCl4 selama 15 hari. Teknik pengambilan data Perlakuan diberikan selama 30 hari dan pada hari ke-31 semua tikus putih dikorbankan. Hepar yang telah dibuat dalam preparat histologis diamati secara mikroskopis. Data penelitian berupa hasil pengamatan deskriptif terhadap preparat histologis untuk melihat adanya degenerasi atau nekrosis sel hepar dan pengamatan ada tidak perbaikan pada sel hepar setelah pemberian ekstrak buah mahkota dewa. Derajat kerusakan atau nekrosis hepar akan dikuantitatifkan dengan menentukan persentase tingkat kerusakan sel. Setiap ulangan kelompok perlakuan dinilai dengan tiga tingkat kerusakan sel dan kemudian diambil nilai reratanya. Penentuan persentase (%) memiliki 3 (tiga) tingkat yaitu: A: untuk kerusakan 0%. B: untuk kerusakan 20-40%. C: untuk kerusakan >40% (Sunityoso, dkk, 1998). Analisis data Pengamatan secara deskriptif yaitu dengan cara melihat ada tidaknya kerusakan struktur hepar setelah pemberian perlakuan dibandingkan dengan kelompok kontrol, menentukan jenis kerusakan yaitu perlemakan hepar, karioreksis atau kariolisis dan memberikan penilaian terhadap kerusakan hepar terhadap kemungkinan perbaikan setelah pelakuan dengan ekstrak buah mahkota dewa. HASIL DAN PEMBAHASAN Pengamatan makroskopis Hasil pengamatan makroskopis (morfologi) organ hepar masing-masing kelompok perlakuan menunjukkan adanya perubahan warna. Hepar kelompok (K) KI berwarna merah tua sangat berbeda dengan hepar KII yang tampak berwarna kuning pucat. Hepar KI tampak berwarna merah tua dan mengkilat, warna ini disebabkan oleh darah yang terdapat sangat banyak dalam organ hepar. Perubahan warna dari merah tua menjadi kuning pucat disebabkan oleh senyawa CCl4 yang bersifat hepatotoksik sangat kuat dan menyebabkan perlemakan hepar. Hepar KIII memiliki warna merah kecokelatan dan mengkilat. Hal ini karena ekstrak buah mahkota dewa tidak merusak sel hepar sehingga mendekati warna hepar KI. Pada hepar KIV dan KV yang mendapat perlakuan dengan CCl4 dan ekstrak buah mahkota dewa memperlihatkan perbedaan warna yang jelas. Hepar KIV berwarna merah kecoklatan relatif sama dengan KIII, sedangkan KV cenderung berwarna merah muda-kekuningan. Senyawa karbon tetraklorida mengakibatkan perlemakan hepar yang ditunjukkan oleh massa hepar yang berwarna kuning pucat dengan bintikbintik putih. Pengaruh hepatotoksikan pada KV cukup kuat sehingga menampilkan warna seperti KII. Pengamatan terhadap masing-masing kelompok tidak memperlihatkan perubahan bentuk atau morfologi. Perubahan warna dan morfologi organ biasanya disebabkan adanya perubahan fisiologis dan struktur makroskopis jaringan yang cukup berarti. 93 Pengamatan mikroskopis Hepar Kelompok I Pengamatan menyeluruh terhadap sediaan histologis memperlihatkan gambaran normal sel hepar. Setiap lobulus hepar tersusun dari sel hepar dengan inti terpulas biru tua, memiliki kromatin tersebar, jelas dan menyerap zat warna kuat. Sel hepar tampak tersusun radier dalam lobulus. Lempeng sel beranastomosis bebas dan memiliki batas antar sel yang jelas. Beberapa sel hepar dijumpai dengan inti sel lebih dari satu. Sitoplasma sel hepar terpulas merah merata dengan intensitas lebih kuat dibandingkan sitoplasma sinusoid yang berwarna merah muda. Sinusoid terdiri atas sel-sel endotel dengan inti gepeng dan gelap serta sedikit sitoplasma. Sel yang nampak di bagian ini yaitu sel kupffer (Gambar 1.). Hepar Kelompok II Pengamatan mikroskopis memperlihatkan kerusakan sel yang berarti. Kerusakan berupa degenerasi berlemak atau steatosis merata di seluruh lobulus. Steatosis dalam sediaan histologis tampak sebagai vakuola-vakuola bening berukuran kecil sampai besar. Vakuola dalam hepatosit berjumlah banyak membentuk vakuola besar dan mendesak inti ke perifer. Steatosis menyerang sampai ke daerah sentrolobular. Ditemukan sel yang mengalami karioreksis dan kariolisis. Dalam lempeng sel hepar batas antar sel relatif sulit dibedakan sedangkan sinusoid mengalami penyempitan. Sel hepar normal tidak ditemukan dalam pengamatan mikroskopis. Jumlah vakuola perlemakan dalam jumlah banyak memicu terjadinya jaringan nekrosis. (Gambar 2.) Hepar Kelompok III Pengamatan terhadap hepar yang diperlakukan dengan ekstrak buah mahkota dewa memperlihatkan kondisi jaringan hepar normal. Sel-sel hepar berbentuk polyhedral berada dalam lempeng sel dan dipisahkan oleh sinusoid yang terpulas lebih pucat dibandingkan sitoplasma hepatosit. Inti sel bulat dengan pulasan hitam kompak berjumlah satu atau dua inti. Penampang histologis memperlihatkan inti sel yang sangat gelap, berupa bintik hitam. Hepatosit memiliki batas sel jelas, terpulas lebih merah dibandingkan sitoplasma yang berwarna merah muda. Di dalam vena sentralis yang mengalami pelebaran ditemukan eritrosit (Gambar 3.). Hepar Kelompok IV Pengamatan terhadap bidang pandang preparat KIV memperlihatkan bagian lobulus yang mengalami perlemakan atau steatosis. Kondisi ini tampak berupa vakuola berukuran kecil-kecil di lobulus hepar namun tidak berada di setiap bagian lobulus. Dengan demikian sel hepar ditemukan lebih dominan dibandingkan perlemakan dalam lobulus. Sel hepar normal ditemukan di antara sel yang mengalami perlemakan. Vakuola dalam lobulus dan sel hepar tidak mengakibatkan inti sel terdesak ke perifer bahkan ditemukan sel mengalami pembelahan. Steatosis KIV tidak separah steatosis pada KII. Vena sentralis mengalami pelebaran disertai eritrosit yang dijumpai pada penampang histologis (Gambar 4.). B i o S M A R T Vol. 6, No. 2, Oktober 2004, hal. 91-98 94 3 4 7 6 5 6 2 5 4 1 3 1 2 Gambar 1.. Penampang melintang hepar kelompok kontrol. Perbesaran: 200x. Pewarnaan: HE. Keterangan: 1. inti sel hepar, 2. sitoplasma, 3. membran sel, 4. sel kupffer, 5. sinusoid, 6. sel hepar berinti dua, 7. vena sentralis. Gambar 2.. Penampang melintang hepar setelah pemberian 0,2 ml CCl4 selama 30 hari. Perbesaran: 200x. Pewarnaan: HE. Keterangan: 1. degenerasi perlemakan makrovesikuler, 2. degenerasi perlemakan mikrovesikuler, 3. sel piknotik, 4. kariolisis, 5. sinusoid, 6. vena sentralis. 1 5 4 2 7 3 6 2 4 3 5 1 Gambar 3. Penampang melintang hepar setelah pemberian 1,3 ml ekstrak buah mahkota dewa selama 30 hari. Perbesaran: 200x. Pewarnaan: HE. Keterangan: 1. sel hepar normal, 2. membran sel, 3. sinusoid, 4. sitoplasma, 5. sel piknotik, 6. sel hepar normal berinti dua, 7. vena sentralis dengan eritrosit utuh. Gambar 4.. Penampang melintang hepar setelah pemberian 0,2 ml CCl4 selama 15 hari dilanjutkan 1,5 ml ekstrak buah mahkota dewa selama 15 hari. Perbesaran: 200x. Pewarnaan: HE. Keterangan: 1. degenerasi perlemakan makrovesikuler, 2. degenerasi perlemakan mikrovesikuler, 3. sel hepar normal, 4. sinusoid yang menyempit, 5. inti sel hepar normal, 6. vena sentralis mengalami pembendungan eritrosit ENDRI dkk., – Pengaruh ekstrak buah Phaleria macrocarpa pada hepar Rattus norvegicus 95 100 2 Rata-rata (%) Kerusakan 80 3 60 40 20 4 0 5 K1 K2 K3 K4 K5 Kelompok Perlakuan A : Kerusakan 0% B : Kerusakan 20-40% C : Kerusakan >40% Gambar 6. Diagram batang jumlah persentase (%) tingkat kerusakan sel hepar. 1 Gambar 5.. Penampang melintang hepar setelah pemberian 1,3 ml ekstrak buah mahkota dewa selama 15 hari dilanjutkan 0,1 ml CCl4 selama 15 hari. Perbesaran: 200x. Pewarnaan: HE. Keterangan: 1. degenerasi perlemakan makrovesikuler, 2. sel hepar normal, 3. kariolisis, 4. sinusoid, 5. vena sentralis. Hepar Kelompok V Preparat histologis memperlihatkan suatu keadaan sel hepar yang mengalami perlemakan. Hepar KV mengalami kerusakan yang jelas. Perlemakan/steatosis dijumpai di seluruh bidang pengamatan serta beberapa sel mengalami kariolisis. Dalam vena sentralis dijumpai sekumpulan eritrosit yang ikut terfiksasi saat pembuatan preparat. Sel hepar mengalami kerusakan dan perlemakan sampai memenuhi seluruh ruangan sel sehingga mendesak inti ke pinggir. Disamping sel yang mengalami steatosis, preparat ini juga memperlihatkan pula sel hepar yang normal. Sel normal memiliki batas sel jelas, sitoplasma terpulas merah muda dengan inti lebih gelap. Keberadaan sel hepar normal lebih sedikit dibandingkan pada KIV. Sinusoid nampak mengalami penyempitan karena terdesak oleh perlemakan sel hepar pada lobulus (Gambar 5.). Penelitian ini bertujuan mengetahui pengaruh pemberian ekstrak buah mahkota dewa terhadap hepar hewan uji yang dirusak dengan senyawa hepatotoksikan. Mahkota dewa diduga memiliki kemampuan atau bioaktivitas sebagai antihepatotoksik. Efek terapi ini karena senyawa kimia seperti flavonoid, saponin dan tannin dalam buah dan daunnya (Gotama dkk, 1999). Kerusakan yang disebabkan oleh hepatotoksikan CCl4 menjadi model dalam penelitian ini karena mekanisme toksiknya telah dipelajari secara luas. Hepar merupakan organ tempat nutrien yang diserap dari saluran pencernaan, diolah dan disimpan untuk dipakai oleh bagian tubuh lain. Organ yang merupakan kelenjar berukuran besar dalam tubuh ini memiliki peran penting dalam proses metabolisme. Darah yang berasal dari rongga perut dan usus mengalir masuk untuk pertama ke vena porta, darahnya mengandung banyak zat penting seperti karbohidrat, lemak dan vitamin yang dapat diserap dan disimpan dalam hepar selama dibutuhkan (Stine dan Brown, 1996). Sel hepar mampu melakukan metabolisme karbohidrat, lemak dan protein. Posisi hepar dalam sistem sirkulasi adalah optimal untuk menampung, mengubah, dan mengumpulkan metabolit serta untuk menetralisasi dan mengeluarkan substansi toksik. Biotransformasi senyawa karbon tetraklorida Menurut Stine dan Brown (1996) di dalam hepar terkandung sistem enzim yang secara kimia mampu mengubah senyawa toksik menjadi bentuk yang kurang toksik. Hal ini berkaitan dengan biotransformasi suatu zat kimia yang dibagi ke dalam dua jenis utama, reaksi fase I dan fase II. Biotranformasi pada fase I melibatkan proses oksidatif. Sistem enzim terpenting yang mengkatalisis proses itu adalah sistem P-450 dan NADPH sitokrom P450 reduktase. Sistem sitokrom P-450 berada dalam retikulum endoplasma (RE) dan memiliki enzim monooksigenase. Enzim ini terikat pada mikrosom. Mikrosom adalah bagian pecahan dari RE yang terjadi pada sentrifugasi terfraksi dari homogenat sel hepar. Jadi monooksigenase merupakan enzim mikrosom yang menjadi sistem sitokrom P-450. Istilah sitokrom P –450 dipakai karena terjadi absorbsi kuat dari cahaya pada panjang gelombang 450 nm. Biotransformasi oleh enzim mikrosom hepar digambarkan dalam reaksi sebagai berikut: P-H + NADPH + O2 + H+ Æ P-OH + NADP + H2O. Substrat (P-H) mula-mula terikat pada sitokrom P-450 kemudian bereaksi dengan NADPH melalui transport elektron serta mengaktivasi 02 dan memindahkan kepada subtrat sehingga terbentuk subtrat terhidrosilasi (P-OH) dan air (Ganiswara, 1995). Dalam botransformasi fase II akan terjadi suatu proses yang mengubah senyawa asal menjadi metabolit kemudian membentuk konjugasi. Metabolit dan 96 B i o S M A R T Vol. 6, No. 2, Oktober 2004, hal. 91-98 konjugasi bersifat lebih larut dalam air dan lebih polar sehingga mudah diekskresikan melalui ginjal. Akan tetapi dalam kasus tertentu seperti hepatotoksisitas oleh CCl4, zat kimia atau metabolit ini menjadi lebih toksik daripada senyawa asalnya. Reaksi semacam ini dikenal sebagai biotransformasi CCl4. Lestariana (1997) menyatakan bahwa sifat karbon tetraklorida dalam tubuh organisme mengalami biotrasformasi menjadi reaktif yang dikatalisis oleh enzim sitokrom P450. Metabolit reaktif tersebut adalah radikal bebas triklorometil (CCl3) yang terbentuk dari pembelahan homolitik CCl4. Radikal triklorometil secara kovalen mengikat protein dan lipid tidak jenuh dan menyebabkan peroksidasi lipid. Keadaan ini memicu kerentanan membran mitokondria dan retikulum endoplasma. Kajian tentang mekanisme toksik CCl4 menyatakan bahwa efek terhadap retikulum endoplasma sebagian bersifat tidak langsung dan merupakan akibat gangguan di dalam proses fosforilasi oksidatif di dalam membran mitokondria. Radikal bebas seperti triklorometil menyebabkan mitokondria mengalami gangguan dalam respirasi sel. Proses respirasi sel tersebut melibatkan fase-fase yang menghasilkan energi. Pemasukan energi yang berasal dari respirasi sel diperlukan untuk pemeliharaan fungsi dan struktur retikulum endoplasma. Retikulum endoplasma granular dengan ribosom bertugas untuk mensintesis protein yang hasilnya penting bagi mitokondria. Energi yang berkurang juga menyebabkan sel kehilangan daya untuk mengeluarkan trigliserida hepar ke plasma (Koeman, 1987). Perlemakan hepar Perlemakan hepar dapat dipicu oleh berbagai toksikan dalam mekanisme yang beragam. Menurut Pla dalam Lu (1995) senyawa karbon tetraklorida menyebabkan perlemakan melalui penghambatan sintesis satuan protein dari lipoprotein dan penekanan konjugasi trigliserida dengan lipoprotein. Trigliserida hepar hanya disekresikan bila dalam keadaan tergabung dengan lipoprotein dan membentuk lipoprotein berdensitas sangat rendah atau very low density lipoprotein (VLDL). Perlemakan ditunjukkan pada KII, KIV, dan KV. Dalam keadaan normal, lemak di hepar hanya merupakan 5% dari berat keseluruhan sehingga apabila ditemukan lebih dari 5% dipastikan terjadi gangguan dalam metabolismenya. Trigliserida di hepar akan tergabung bersama lipoprotein sebelum disekresikan ke sirkulasi/plasma dalam bentuk VLDL. Perlemakan terjadi bila terdapat gangguan keseimbangan antara sintesis trigliserida (peningkatan atau penurunan) dengan sekresi VLDL (Djanas, 1996). Moslen (2001) menyatakan bahwa senyawa toksik seperti CCl4 menyebabkan kerusakan pada sel hepar seperti ditimbulkan senyawa toksik lain yakni etanol, asam valproic dan fialuridine. Degenerasi lemak yang paling parah ditunjukan oleh kelompok II. Timbunan lemak dalam sel hepar membentuk vakuola kecil-kecil tetapi tidak sampai mendesak inti. Keadaan seperti ini disebut degenerasi perlemakan mikrovesikuler. Apabila vakuolavakuola bergabung membentuk vakuola yang lebih besar dan hampir semua hepatosit terisi butiran lemak berukuran besar maka akan mendorong inti sel ke daerah perifer. Perlemakan dengan vakuola berukuran besar disebut sebagai perlemakan makrovesikuler. Menurut Moslen (2001) secara histologis dalam teknik embeding parafin standar hepatosit yang mengandung lemak akan tampak sebagai vakuola kosong yang mendesak inti sel ke arah perifer. Jika desakan valuola semakin kuat, membran inti akan pecah diikuti inti yang mengalami fragmentasi. Pecahnya inti menjadi beberapa bagian disebut dengan karioreksis. Rangsangan yang terus berlanjut akan mengakibatkan inti terfragmentasi mengalami pelarutan kromatin inti dan secara bertingkat berangsur menghilang. Pada tahap ini inti mengalami kariolisis (Cheville, 1976). Kelompok II memperlihatkan perlemakan parah sampai menyerang daerah sentrolobuler. Levi (2000) menambahkan, bagian disekitar sentrolobular mempunyai kadar enzim sitokrom P450 terbanyak. Aktivitas enzim ini penting dalam metabolisme xenobiotik dalam sel hepar. Senyawa CCl4 diaktifkan menjadi bentuk radikal bebas reaktif oleh sitokrom P450 yang berada disekitar sentrolobular. Hal ini menyebabkan sel-sel hepar di sekitar vena sentralis mendapatkan pengaruh yang paling kuat terhadap CCl4. Pada saat hepar terkena zat toksik bagian perifer lobus hepar mendapat pengaruh pertama kali karena berhubungan langsung dengan sirkulasi darah yang menuju ke vena sentralis. Ini mengakibatkan kerusakan sel di daerah yang berbatasan dengan duktus biliaris, vena porta dan arteri hepatika. Kerusakan bahkan kematian sel berakibat pada terganggunya sirkulasi darah yang membawa oksigen untuk sampai ke vena sentralis. Sel menjadi kekurangan oksigen dan berakibat kematian sel di sekitar vena sentralis. Preparat histologis KII, memperlihatkan sel yang mengalami kariolisis dan perlemakan parah. Nilai persentase derajat kerusakan tertinggi terdapat pada kerusakan lebih dari 40 yakni sebesar 70. Pada KIII, nilai persentase degenerasi tertinggi terdapat pada degenerasi 20-40% yaitu 16,25. Hepar tikus uji yang diperlakukan dengan ekstrak buah mahkota dewa memperlihatkan keadaan normal. Setiap lobulus memiliki lempeng hepatosit dengan batas sel yang jelas, inti bulat dengan kromatin tersebar dan menyerap zat warna sempurna. Pada salah satu preparat hitologis juga dijumpai bagian dari inti sel yang terpulas sangat gelap dan kompak serta menutupi seluruh bagian inti sel. Bintik hitam adalah sel piknotik. Sel yang mengalami piknosis akan terlihat memiliki kromatin yang tampak mengumpul sebagai globulus tunggal dan inti terpulas gelap. Perlakuan dengan ekstrak buah mahkota dewa selama 30 hari secara keseluruhan tidak menyebabkan bintik hitam pada sebagian besar lobulus hepar. Bintik tersebut mungkin merupakan sel yang mengalami proses degenerasi. Ekstrak buah mahkota dewa mengandung senyawa yang beragam dengan efek terapi yang berlainan. Pemanfaatan dalam jangka waktu lama kemungkinan berakibat pada kerusakan sel normal. Buah mahkota dewa mentah sebenarnya bersifat racun apabila dikonsumsi langsung tanpa pengolahan terlebih dahulu. Dari penampang melintang kelompok ini memperlihatkan lumen vena sentralis yang mengalami pelebaran. Ekstrak buah mahkota dewa tidak menyebabkan pelebaran vena sentralis, kondisi seperti ini dinilai bukan merupakan pengaruh buruk dari ekstrak karena ulangan ENDRI dkk., – Pengaruh ekstrak buah Phaleria macrocarpa pada hepar Rattus norvegicus lain dalam kelompok ini tidak memperlihatkan vena sentralis yang melebar (ulangan 3 dan 4). Pelebaran vena sentralis diduga disebabkan oleh curahan darah yang mengosongkan isinya ke dalam vena sentralis untuk kemudian mengalir ke vena kava inferior. Pada preparat KIV, sel hepar jelas mengalami kerusakan akibat pemberian senyawa CCl4 selama 15 hari. Perlemakan ditunjukkan dengan vakuola-vakuola yang tidak banyak jumlahnya. Selain itu terdapat sel normal dengan batas sel yang jelas dan inti kompak. Sel hepar normal keberadaannya mendominasi di lobulus hepar dibandingkan sel dengan degenerasi lemak. Pemberian karbon tetraklorida tidak menyebabkan kerusakan yang sangat fatal seperti KII. Nilai persentase derajat kerusakan pada degenerasi lebih dari 40% hanya sebesar 28,75. Sementara nilai persentase untuk derajat kerusakan 0% berada pada angka 31,25. Pemberian ekstrak buah mahkota dewa dengan dosis sebesar 1,5 ml/200gr BB tikus berpengaruh terhadap sel hepar yang telah dirusak CCl4. Preparat histologis memperlihatkan sel hepar normal dalam jumlah relatif banyak. Senyawa CCl4 tidak menyebabkan kerusakan yang berakibat pada terhentinya proses fisiologis dalam sel hepar. Senyawa flavonoid dalam buah mahkota dewa diduga memiliki kemampuan dalam perbaikan sel hepar yang rusak. Menurut Gotama dkk (1999) dalam kulit buah terdapat senyawa flavonoid yang berfungsi sebagai anti hepatotoksik. Senyawa ini paling berperan dalam memulihkan kerusakan sel hepar dibandingkan alkaloid dan saponin. Anti hepatotoksik yaitu senyawa atau zat yang dapat melindungi sel-sel hepar terhadap pengaruh zat toksik yang menyerang sel hepar. Senyawa anti hepatotoksik bahkan mampu memperbaiki jaringan hepar yang fungsinya sedang terganggu. Dalimarta (2001) menyatakan, mekanisme kerja hepatoprotektor antara lain dengan cara detoksifikasi senyawa racun, meningkatkan regenerasi sel hepar, anti inflamasi dan sebagai imunomodulator. Kelompok perlakuan V memiliki nilai persentase derajat kerusakan hepar tertinggi pada degenerasi lebih dari 40% yaitu 45. Perlemakan makrovesikuler maupun mikrovesikuler terjadi di lobulus hepar tikus. Pada KV, dua ulangan memperlihatkan pengaruh toksik CCl4 yang parah (lebih dari 40%) sementara dua ulangan lainnya merupakan preparat dengan derajat kerusakan 0% yang relatif tinggi terutama ulangan 4. Hepar tikus yang diperlakukan dengan ekstrak selama 15 hari pertama diharapkan menunjukkan penghambatan terhadap senyawa CCl4 yang diberikan 15 hari kedua. Senyawa CCl4 menyerang cukup kuat sehingga terjadi perlemakan makrovesikuler di hampir seluruh bidang pandang. Pemberian ekstrak buah mahkota dewa berpengaruh pada sel hepar KV. Senyawa hepatotoksik seperti CCl4 bersifat sangat toksik terhadap hepar namun kerusakannya dapat dicegah dengan pemberian ekstrak buah mahkota dewa. Hal ini dikuatkan berdasarkan pengamatan histologis yang memperlihatkan sel-sel hepar normal di lobulus hepar. Sel-sel hepar memiliki batas sel jelas, inti terpulas hitam atau biru tua dan kuat menyerap zat warna. Sel hepar normal tampak disekeliling sel-sel yang mengalami kerusakan. Pemberian ekstrak dengan dosis terapi dinilai menghambat kerusakan hepar yang lebih fatal. Hal ini ditunjukkan pada ulangan 2 dan 4 97 kelompok V. Sel hepar normal kedua ulangan lebih dominan dibandingkan kedua ulangan lainnya (1 dan 3). Ulangan 1 dan 3 cenderung memperlihatkan kerusakan hepar yang menyebar merata. Kondisi ini kemungkinan disebabkan oleh dosis terapi yang kurang tepat karena fluktuasi berat badan tikus. Disamping oleh ketahanan fisik masing-masing tikus yang berbeda dalam menerima pengaruh toksik CCl4. Penampakan sel hepar yang masih normal tidak cukup kuat untuk menunjukkan bioaktivitas senyawa flavonoid buah mahkota dewa. Nilai derajat kerusakan pada degenerasi 0% berada diangka 26,25 atau lebih rendah daripada KIV yaitu 31,25. Pengamatan mikroskopis dari kelompok perlakuan ekstrak mahkota dewa tunggal dan kombinasi ekstrak mahkota dewa dengan hepatotoksikan, CCl4 memperlihatkan sebagian vena sentralis yang dipenuhi eritrosit. Vena sentralis merupakan tujuan akhir darah yang mengalir melewati sinusoid untuk kemudian melanjutkan ke vena kava inferior. Pembentukan fragmen eritrosit diduga karena bertumpuknya eritrosit yang mengalir menuju vena sentralis sesaat sebelum hewan uji dikorbankan. Dengan demikian darah yang mengalir melalui sinusoid terbendung pada saat jaringan hepar terfiksasi. Regenerasi sel hepar Hepar merupakan organ yang rentan mengalami kerusakan oleh zat-zat toksik. Fungsi hepar sendiri antara lain menampung, mengubah dan menetralisasi serta mengeluarkan substansi toksik. Peranan hepar dalam metabolisme zat toksi dijelaskan sebagai biotransformasi disamping kemampuan tersebut, hepar dikenal sebagai organ yang memiliki daya regenerasi yang cepat. Kelompok IV dan V mendapatkan dua fase perlakuan. Hepar akan mengalami kerusakan bahkan kematian sel selama paparan 15 hari. Penghentian waktu pencekokan CCl4 seperti pada KIV diduga memicu suatu efek pemulihan. Price dan Wilson (1984) menambahkan gangguan suatu sel karena rangsang tertentu akan memunculkan mekanisme adaptasi apabila rangsang dihentikan ataupun terjadi reaksi pemulihan. Reaksi pemulihan atau regenerasi sel memungkinkan sel dapat kembali seperti keadaan sebelumnya. Gambaran histologis sel hepar kelompok V menunjukkan sel yang tidak mencapai tahap adaptasi terhadap zat toksik. Hal ini karena CCl4 telah berubah menjadi bentuk reaktif yaitu CCl3* dan membentuk peroksidasi lipid setelah terikat dengan lemak tak jenuh ganda. Peristiwa ini mengakibatkan membran sel rusak dan inaktivasi beberapa enzim (Lu, 1995). Rusaknya membran sel menyebabkan sel kehilangan kemampuan untuk mengendalikan pertukaran zat sehingga mengancam kehidupan sel tersebut. Senyawa CCl4 merupakan zat hepatotoksikan yang bereaksi sangat kuat menyerang hepar sehingga tidak memungkinkan hepar mengalami regenerasi secara optimal. Regenerasi pada KIV diduga berlangsung selama perlakuan dengan ekstrak buah mahkota dewa pada 15 hari ke-2 atau setelah penghentian CCl4. Waktu penelitian yang pendek menghambat hepar untuk pulih setelah dirusak CCl4 sehingga dalam penelitian ini peneliti mengabaikan pemulihan jaringan hepar sebagai pengaruh perbaikan sel hepar oleh ekstrak buah mahkota dewa. 98 B i o S M A R T Vol. 6, No. 2, Oktober 2004, hal. 91-98 KESIMPULAN Pemberian karbon tetraklorida (CCl4) sebesar 0,2 ml/ 200 g BB pada tikus putih selama 15 hari dan 30 hari menyebabkan kerusakan berupa perlemakan hepar, kariolisis, karioreksis. Kerusakan tersebut mampu dipulihkan dengan pemberian ekstrak buah mahkota dewa sebesar 1,5 ml/200 g BB tikus putih selama 15 hari. Pemberian ekstrak buah mahkota dewa dengan dosis 1,3 ml/ 200 g BB tikus putih selama 15 hari sebelum perlakuan dengan CCl4 sebesar 0,2 ml/200 g BB pada tikus putih memberikan perlindungan yang belum optimal DAFTAR PUSTAKA Achmad, S.A., Hakim, E.H., dan Makmur, L. 1990. Flavonoid dan phyto medica, kegunaan dan prospek. Majalah Ilmu-ilmu Penopang Obat Bahan Alam 1 (2): 120-126. Ariyani, A. 2002. Pengaruh Pemberian Sari Bawang Merah (Allium ascalonicum L) terhadap Hepatotoksisitas Karbon Tetraklorida pada Tikus Putih. [Skripsi]. Surakarta: Fakultas Kedokteran Universitas Sebelas Maret. Cheville, N.F. 1976. Cell Pathology. 1st edition. Iowa: The Iowa State University Press. Dalimarta, S.. 2001. Ramuan Tradisional untuk Pengobatan Hepatitis. Jakarta: Penerbit Swadaya. Darmansjah, I. 1995. Dasar Toksikologi. Edisis keempat. Jakarta: Gaya Baru. Djanas, W.S. 1996. Perlemakan hati. Dalam: Buku Ajar ilmu Penyakit Dalam I. Jakarta: Penerbit FK UI. Ganiswara. 1995. Farmakologi dan Terapi. Edisi IV. Jakarta: Badan Penelitian dan Pengembangan Kesehatan, Departemen Kesehatan RI. Gotama, I.B.I., S. Sugiarto, dan Nurhadi. 1999. Inventarisasi Tanaman Obat Indonesia Jilid V. Jakarta: Badan Penelitian dan Pengembangan Kesehatan, Departemen Kesehatan. Harmanto, N.. 2002. Mahkota Dewa Obat Pusaka Para Dewa. Jakarta: Agromedia Pustaka. Koeman, J.H. 1987. Pengantar Umum Toksikologi. Penerjemah: Yudono. Yogyakarta: UGM Press. Lestariana, W. 1997. Pengaruh ekstrak heksan herba meniran (Phyllantus niruri) terhadap efek toksik alfatoksin B1 pada hati tikus. Berkala Ilmu Kedokteran 29 (2): 61-67. Levi, P. 2000. Target organ toxicity. In Hodgson, E. And P.E. Levi. Text Book of Modern Toxicology. Singapore: McGraw Hill Companies. Loomis, T.A. 1978 Toksikologi Dasar. Penerjemah: Donatus, I.A.. Semarang: IKIP Press. Lu, F.C. 1995. Toksikologi Dasar: Asas, Organ Sasaran dan Penilaian Resiko. Edisi II. . Penerjemah: Nugroho, E. Jakarta: UI Press. Moslen, M.T. 2001. Toxic Responses of the Liver. New York: McGrawHill Book Co. Price, S.A. 1984. Patofisiologi: Konsep Klinik Proses-Proses Penyakit. Jakarta: Penerbit Kedokteran EGC. Stine, K.E dan T.M Brown. 1996. Principles of Toxicology. USA: CRC Press Inc. Lewiss Publishers. Sunityoso, S., D. Kusnama,., Luthfiralda, dan D. Furqonita. 1998. Perubahan struktur histologik organ hati mencit (Mus musculus L) yang dicekok minyak kelapa bekas gorengan. Jurnal Kedokteran Indonesia 48 (3): 115-120. Suntoro, H. 1983. Metode Pewarnaan (Histologis & Histokimia). Jakarta: Penerbit Bhratara Karya Aksara.