Optimasi Proses Hidrolisis Kimiawi dan Enzimatis
advertisement

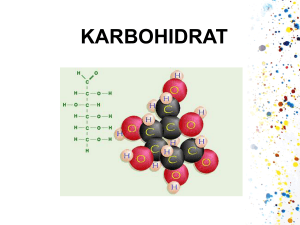
TINJAUAN PUSTAKA Tandan Kosong Kelapa Sawit Kelapa sawit adalah tanaman perkebunan berupa pohon berbatang lurus dari famili palmae. Tanaman tropis ini dikenal sebagai penghasil minyak goreng. Menurut Loebis 1992, tanaman kelapa sawit diperkirakan berasal dari Guinea, pantai barat Afrika yang kemudian menyebar sampai ke Indonesia. Tanaman ini memiliki nama latin Elaeis guineensis JACQ dengan taksonomi sebagai berikut : Dunia : Plantae Divisi : Tracheophyta Kelas : Angiospermae Ordo : Cocoideae Famili : Palmae Genus : Elaeis Species : Elaeis guineensis JACQ Gambar 1 TKKS Tandan kosong kelapa sawit merupakan limbah utama dari industri pengolahan kelapa sawit menjadi minyak sawit. Persentase limbah TKKS adalah 23% dari tandan buah segar, sedangkan persentase serat dan cangkang biji masing masing adalah 13% dan 5,5% dari tandan buah segar (Peni, 1995). Komponen utama dari limbah padat kelapa sawit adalah selulosa dan lignin sehingga limbah ini disebut juga limbah lignoselulosa (Darnoko, 1992). Komposisi kimiawi tandan kosong kelapa sawit dapat dilihat pada Tabel 1 6 Tabel 1 Komposisi kimiawi tandan kosong kelapa sawit Komponen % bobot kering Selulosa 45,95 Hemiselulosa 22,84 Lignin 16,49 Kadar abu 1,23 Kadar air 3,74 Darnoko (1992) Tandan kosong kelapa sawit mempunyai tiga komponen utama yaitu selulosa, hemiselulosa dan lignin. Limbah TKKS memiliki kandungan holoselulosa (selulosa dan hemiselulosa) yaitu sekitar 70% dan kandungan lignin sekitar 17% ( Peni, 1995). Hasil penelitian Darnoko (1992) juga menunjukkan hasil yang serupa, TKKS mengandung selulosa 45,95%, hemiselulosa 22,84% dan lignin 16,49%. Selulosa adalah rantai lurus homopolisakarida yang tersusun atas unit-unit D-glukosa. Hemiselulosa merupakan polisakarida yang berikatan dengan selulosa pada bagian tanaman yang telah mengalami delignifikasi. Lignin merupakan polimer fenolik (Artiningsih et al. 2000). Lignin akan menghalangi pemanfaatan selulosa dari bahan lignoselulosa secara optimal. Oleh karena itu pada penelitian ini perlu dilakukan proses delignifikasi terlebih dahulu pada limbah TKKS dengan jamur pelapuk putih (JPP) Omphalina sp Tandan kosong kelapa sawit mempunyai potensi untuk digunakan sebagai sumber glukosa melalui proses hidrolisis dengan asam atau enzim. Larutan gula yang dihasilkan selanjutnya dapat dikonversikan menjadi berbagai produk seperti asam-asam organik, pelarut etanol, butanol, aseton, xanthan, protein sel tunggal, zat antibiotik dan berbagai produk lainnya. Pemanfaatan limbah kelapa sawit dengan teknologi biokonversi diharapkan dapat memberikan nilai tambah yang cukup besar. (Darnoko, 1992) 7 Komponen Kimia Bahan Lignoselulosa Bahan berselulosa yang terdapat di alam umumnya mengandung selulosa, hemiselulosa, dan lignin. Selulosa Selulosa merupakan konstituen utama kayu sekitar 40-45% bahan kering kayu baik pada kayu berdaun jarum maupun lebar. Di dalam dinding sel kayu, selulosa berfungsi untuk memberikan kekuatan. Selulosa merupakan bahan kimia organik yang memiliki berat molekul tinggi dan merupakan homopolimer rantai panjang dengan monomer glukosa yang saling berikatan dengan ikatan β-1,4 glikosida (Janes, 1969). Struktur selulosa dapat dilihat pada Gambar 2. Gambar 2 Struktur selulosa (Janes, 1969) Serat selulosa terdapat di dalam dinding sel tanaman dan material vegetatif lainnya. Susunan dinding sel terdiri dari lamela tengah (M), dinding primer (P), serta dinding sekunder yang terbentuk selama pertumbuhan dan pendewasaan sel dan terdiri dari lamela transisi (S1), dinding sekunder utama (S2), dan dinding sekunder bagian dalam (S3) (Gambar 3). Dibandingkan dengan dinding primer, dinding sekunder lebih tebal dan mengandung mayoritas selulosa (Judoamidjojo et al. 1989). 8 Gambar 3 Susunan dinding sel (Tsao et al didalam Judoamidjojo et al. 1989) Menurut Judoamidjojo et al. (1989), secara alamiah molekul selulosa tersusun dari fibril yang terdiri dari beberapa molekul selulosa paralel yang dihubungkan dengan ikatan hidrogen. Pada kayu, fibril-fibril membentuk struktur kristal yang dibungkus oleh lignin. Lignin berperan sebagai pelindung selulosa dari serangan enzim pemecah selulosa. Kumpulan fibril disebut mikrofibril, sedangkan kumpulan mikrofibril membentuk makrofibril. Bagian mikrofibril yang mengandung banyak ikatan hidrogen bersifat sangat kuat, tidak dapat ditembus oleh air dan disebut bagian kristalin. Bagian mikrofibril yang sedikit atau sama sekali tidak mengandung ikatan hidrogen disebut bagian amorf (Tsao et al. 1978). Berdasarkan kelarutannya, selulosa dapat dibedakan menjadi selulosa α, β, dan γ. Selulosa α tidak larut dalam larutan natrium hidroksida pekat, selulosa β larut dalam medium alkali tetapi tahan terhadap larutan netral, sedangkan selulosa γ mudah larut walaupun dalam larutan netral (Fengel dan Wegener, 1989). Hemiselulosa Hemiselulosa adalah polisakarida yang berikatan dengan selulosa pada bagian tanaman yang telah mengalami delignifikasi. Hemiselulosa terutama terdapat pada bagian lamela tengah dari dinding sel tanaman (Gong dan Tsao, 1981). Hemiselulosa merupakan heteropolimer bercabang dari glukosa, xylosa, galaktosa, dan arabinosa (Cowling didalam Gaden et al. 1976). Rantai urutan hemiselulosa hanya terdiri dari satu macam monomer (homopolimer), misalnya 9 xylan dan dapat juga dua atau lebih monomer, misalnya glukomanan (Fengel dan Wegener, 1989). Struktur hemiselulosa dapat dilihat pada Gambar 4. Gambar 4 Struktur hemiselulosa (Zabel dan Morrell, 1992) Lignin Lignin merupakan fraksi non karbohidrat yang bersifat kompleks dan sulit dikarakterisasi. Pada dasarnya lignin merupakan polimer aromatik heterogen dengan sistem jaringan yang bercabang serta tidak memiliki bentuk yang tetap (Mc Donald dan Franklin, 1969). Lignin tersusun dari molekul-molekul yang memiliki bobot molekul yang tinggi dengan unit dasar fenilpropana yang dihubungkan dengan ikatan-ikatan karbon (C-C) dan eter (C-O-C) yang relatif stabil (Casey, 1980). Polimer lignin tidak dapat dikonversi ke monomernya tanpa mengalami perubahan pada bentuk dasarnya (Casey, 1980). Lignin yang melindungi selulosa, bersifat tahan terhadap hidrolisa disebabkan oleh adanya ikatan arilalkil dan ikatan eter. Pada suhu tinggi, lignin dapat mengalami perubahan struktur dengan membentuk asam format, metanol, asam asetat, aseton, vormil dan lain-lain. Sedangkan bagian lainnya mengalami kondensasi (Judoamidjojo, 1989). 10 Gambar 5 Struktur lignin (Dellweg, 1983 di dalam Judoamidjojo, 1989) Jamur Pelapuk Putih Jamur pelapuk putih (white-rot fungi) adalah jamur yang beperan dalam menguraikan bahan yang mengandung lignoselulosa. JPP secara cepat dan ekstensif dapat menguraikan lignin dibandingkan dengan jamur pelapuk lunak (soft-rot fungi), jamur pelapuk coklat (brown-rot fungi) (Bratasida, 1992; Singh & Roymoulik, 1992). JPP termasuk dalam kelas basidiomycetes dan kelas ini memiliki keragaman spesifik terbesar. Jamur ini umumnya mempunyai miselium bersepta dan dikenal sebagai jamur yang membentuk tubuh buah yang besar dan tinggi yang disebut basidiokarp. Pada basidiokarp ini terdapat kumpulan basidiospora yang berbentuk gada (basidium). Miselium primer dihasilkan apabila basidiospora berkecambah. Peleburan hifa primer akan menghasilkan miselium sekunder. Miselium sekunder akan berkembang menjadi miselium tersier dan membentuk basidiokarp (Suwanto et al. 1987). JPP merupakan satu-satunya organisme yang mampu mendegradasi lignin secara sempurna menjadi CO2 dan H2O (Buckley dan Dobson, 1998). Keunikannya dalam kemampuan mendegradasi lignin sangat selektif sehingga relatif tidak merusak serat selulosa (Srebotnik dan Messner, 1994). Walaupun 11 demikian beberapa jenis JPP ada juga yang dapat menguraikan selulosa dalam jumlah banyak (Blanchette dan Burnes, 1988). Degradasi lignin dapat terjadi pada daerah yang terbatas atau pada daerah yang luas. Degradasi lignin pada daerah terbatas akan membentuk rongga, sedangkan pada daerah yang luas akan terjadi perubahan warna putih dan kerapuhan (Fengel dan Wegener, 1989). JPP dapat menyebabkan dekomposisi lignin, selulosa dan hemiselulosa dengan memanfaatkannya sebagai sumber karbon kompleks atau sumber energi (Setliff dan Eudy, 1980). Untuk memanfaatkan komponen tersebut, JPP harus mengekresikan enzim-enzim yang dapat merombak hemiselulosa, selulosa dan lignin menjadi unsur-unsur yang dapat diserap oleh dinding selnya. Kemampuan JPP mendegradasi lignin dikarenakan produksi enzim ligninolitik. Enzim tersebut antara lain lignin peroksidase, mangan peroksidase dan lakase (Buckley dan Dobson, 1998; Hatakka, 1994; Kirk dan Chang, 1990). Mekanisme degradasi oleh JPP dapat dibagi menjadi dua tahap yaitu tahap awal dan tahap lanjutan. Pada tahap awal akan terjadi degradasi lignin oleh enzim yang dihasilkan JPP. Aktivitas enzim ini akan menyebabkan kayu melunak dan pecah. Pada tahap lanjutan, JPP menembus dan berkoloni di dalam sel-sel kayu, kemudian mengeluarkan enzim yang berdifusi melalui lumen sel dan menyerang dinding sel (Sachs et al. 1990). Penurunan berat dapat dijadikan parameter infeksi JPP pada suatu bahan. Hal ini disebabkan lignin dan hemiselulosa terdegradasi oleh JPP menjadi suatu polimer sederhana atau monomer. Degradasi akan menyebabkan penurunan kadar lignin dan selulosa sehingga terjadi penurunan berat bahan secara langsung. Semakin tinggi tingkat kerusakan oleh JPP maka penurunan berat akan semakin besar. Selain penurunan dapat terjadi perubahan warna akibat degradasi pigmen (zat ekstraktif) oleh jamur JPP mengakibatkan perubahan warna menjadi putih (Warlinda, 2006). Kemampuan ligninolitik beberapa jenis jamur terutama JPP digunakan untuk mendegradasi lignin tanpa mengurangi kadar karbohidrat seperti pada proses bio-pulping, bio-bleaching, dan pemanfaatan residu hutan serta komponen lignoselulolitik lain sebagai pakan ternak. Di alam, JPP berperan sebagai organisme saprofit yang berperan penting dalam siklus karbon (Boddy dan Rayner, 1988). 12 Hidrolisis Lignoselulosa Hidrolisis Kimiawi Asam yang biasa digunakan untuk menghidrolisis selulosa adalah asam sulfat, asam klorida, atau asam fosfat. Kelemahannya, asam menghidrolisis selulosa secara acak, tanpa pola tertentu dalam pemutusan ikatan glikosidik (Juanbaro dan Puigjaner, 1986). Oleh karena itu, menurut Grethlein didalam Cowling (1975) hidrolisis asam harus dilakukan dalam kondisi yang tepat agar tidak dihasilkan produk terdekomposisi yang tidak diinginkan. Pada umumnya hidrolisis asam dilakukan dengan asam kuat encer pada suhu tinggi (Cowling, 1975). Menurut Juanbaro dan Puigjaner (1986) laju hidrolisis dengan asam dipengaruhi oleh suhu dan konsentrasi asam. Berdasarkan hasil penelitian di atas dengan menggunakan asam sulfat 1 M suhu 80-96 OC meningkatkan rendemen gula. Abasseed dan Lee (1991) mempelajari kinetika hidrolisis asam dari potongan-potongan kecil kayu oak. Pada studi tersebut keterkaitan suhu reaksi (198-215OC), konsentrasi asam sulfat (1-3%), ukuran kayu (0,1-2,5 cm) dan lamanya proses dipelajari. Dari penelitian tersebut diperoleh hasil bahwa peningkatan ukuran kayu akan meningkatkan waktu reaksi yang dibutuhkan dan menurunkan rendemen maksimal glukosa yang diperoleh. Hidrolisis Enzimatik Hidrolisis secara enzimatik dari selulosa adalah salah satu diantara prosesproses biokonversi limbah yang sangat potensial. Akan tetapi, proses hidrolisis tersebut dihambat oleh struktur kimianya sendiri dan adanya ikatan alami selulosa dengan hemiselulosa dan lignin, sehingga rendemen gula yang diperoleh umumnya rendah. Perlakuan pendahuluan untuk melemahkan ikatan ini diperlukan dalam pemecahan masalah ini. Berbagai metode telah dicoba untuk meningkatkan laju hidrolisis lignoselulosa (Enari, 1983). Caminal et al. (1985) mempelajari hidrolisis enzimatik selulosa oleh enzim selulase dengan perlakuan pendahuluan perendaman dalam asam sulfat 70% (w/v) dilanjutkan represipitasi dengan metanol. Bahan yang digunakan untuk 13 percobaan tersebut adalah karboksi metil selulosa (CMC) dengan konsentrasi 14,29 g/L, sedangkan konsentrasi enzim selulase adalah 5,71 g/L. Hasil percobaan tersebut memberikan informasi bahwa hidrolisis selulosa dipengaruhi oleh pH dan suhu. Pada kisaran pH percobaan 4,0-5,5 didapatkan pH optimum aktifitas enzim adalah 4,8. Enzim selulase mengalami deaktifitasi termal yang nyata pada suhu diatas 45 OC pada saat penelitian dilakukan pada kisaran suhu 50 OC (Caminal et al. 1985). Torget et al. (1991) mempelajari pengaruh penambahan asam sulfat encer sebagai perlakuan pendahuluan untuk hidrolisis enzimatik berbagai kayu keras. Percobaan dengan asam pada konsentrasi 0,50-0,65% v/v, 95-250OC dan hidrolisis enzimatik dengan cellulast pada pH 4,8 suhu 50 OC, setelah empat hari menunjukkan bahwa tidak semua kayu keras dan dua jenis residu jagung tahan terhadap hidrolisis enzimatik. Hasil terbaik diperoleh dari contoh NE-388 dengan suhu perlakuan pendahuluan 160 OC selama 20 menit dengan rendemen selulosa tercerna (glukosa total/total anhidroglukosa contoh) 82%. Kontrol untuk kayu tipe tersebut memiliki rendemen 32%. Penelitian yang sama dilakukan oleh Torget et al. (1991) terhadap tiga jenis kayu keras dan dua jenis residu jagung. Hidrolisis pendahuluan dengan asam sulfat encer pada suhu 140 dan 160 OC dengan waktu reaksi 5-60 menit terhadap kelima contoh berhasil menghidrolisa seluruh hemiselulosa yang ada. Hidrolisis pada suhu 160 OC lebih dianjurkan karena dihasilkan rendemen total yang lebih tinggi. Lebih dari 90% selulosa dari kelima contoh dapat dihidrolisa secara enzimatik bila digunakan suhu tersebut pada perlakuan pendahuluan. Sinitsyn et al. (1991) mempelajari pengaruh struktur dan sifat fisikokimiawi bahan berselulosa pada efisiensi hidrolisis enzimatik. Diperoleh hasil bahwa ukuran partikel selulosa, derajat polimerisasi hanya sedikit pengaruhnya terhadap efisiensi hidrolisis enzimatik. Percobaan hidrolisis bagase dengan berbagai perlakuan pendahuluan menunjukkan bahwa hasil terbaik (rendemen glukosa 9,1 g/L setelah 24 jam) diperoleh bila diberikan perlakuan pendahuluan delignifikasi dengan 1% NaOH, dilanjutkan dengan 79% H3PO4. Proses enzimatik pada penelitian ini menggunakan Trichorderma sp dan bakteri selulolitik asal rayap. 14 Trichoderma sp. Trichoderma sp. merupakan fungi kelas Deuteromycotina dari ordo Monaliales dan famili Monaliaceae yang dikenal sejak tahun 1974. Trichoderma dapat tumbuh hampir disemua tanah dan habitat lainnya. Trichoderma merupakan fungi saprofit yang hidup dalam tanah, serasah dan kayu mati. Fungi ini tumbuh diberbagai tempat, mudah ditemukan, berkembang biak dengan cepat dan diantaranya mampu membunuh fungi lain. Fungi ini tumbuh dengan baik di kondisi tanah yang asam dan termasuk peka terhadap pengaruh sinar dan pencahayaan langsung (Papaviizas, 1985). Trichoderma mudah dikenali karena pertumbuhanya yang cepat dan kondisinya yang hijau. Trichoderma sp. merupakan salah satu fungi penghasil enzim kitinase dan selulase. Produksi kedua enzim ini erat kaitannya dengan aktivitas Trichoderma sebagai fungi antagonis dan untuk menekan penyakit tular tanah yang disebabkan oleh fungi patogen, sebagai fungi pendegradasi bahan organik dan sebagai penghasil beberapa jenis enzim (Hoitink dan Keener, 1993). Sebagai fungi pendegradasi bahan organik, Trichoderma sp, menghasilkan enzim selulase yaitu endo-β-1-4 glukonase, ekso-β-1- 4-glukan glukohidrolase dan ekso-β-1,4glukanase, ekso-β-1-4 glukan selobiohidrolase yang mampu mendegradasi bahan yang mengandung lignoselulosa (Gong dan Tsao, 1981) Bakteri selulolitik asal rayap Rayap dikenal sebagai serangga kayu (lignoselulosa). Saluran pencernaannya dapat dibandingkan dengan bioreaktor mini, karena mengandung berbagai mikroorganisme yang dapat menguraikan lignoselulosa termasuk kompleks xilan (Schafer et al. 1996; Bruce 1998). Ekstrak rayap Glytotermes montanus mengandung aktivitas endo-1,4-β-xilanase yang aktivitasnya lebih rendah daripada endo-1,4-β-glukanase (EC. 3.2 1.4) (Purwadaria et al. 2003). Xilanase berbeda dengan CMCase yang telah diketahui, selain diproduksi oleh mikrob saluran pencernaannya, juga dapat diproduksi oleh tubuh rayap sendiri (Watanabe et al. 1998). Hemiselulosa instrinsik rayap belum ditemukan sehingga 15 produksi hemiselulosa termasuk endo-1,4-β-xilanase akan lebih efisien bila dikembangkan dari mikrob xilanolitik, sedangkan saluran pencernaan rayap merupakan sumber isolat. Umumnya mikroorganisme seperti bakteri dan protozoa saluran pencernaan rayap bersifat anaerob baik fakultatif maupun absolut, walaupun demikian telah berhasil diisolasi bakteri aerob (Schafer et al. 1996). Enzim xilanase Bacillus sp hasil isolasi dari saluran pencernaan rayap (Captotermes formosanus) telah dimurnikan dan dikarakterisasi di Jepang (Shimizu et al. 1998). Aktivitas spesifik enzimnya setelah pemurnian cukup tinggi, yaitu 339,5 U/mg. kemampuannya untuk memproduksi enzim sangat bergantung pada sumbernya. Fermentasi Alkohol Fermentasi alkohol terutama dilakukan oleh khamir, khususnya jenis – jenis Saccharomyces yang bersifat anaerob fakultatif. Berbagai minuman yang mengandung alkohol dihasilkan dengan bantuan khamir ini. Misalnya : anggur, bir, dan tuak. Penguraian glukosa menjadi asam piruvat mengikuti jalur HDP. Reaksi totalnya adalah sebagai berikut: C6H12O6 2 C2H5OH + 2 CO2 (Standbury dan Whitaker, 1984) Fermentasi ini berlangsung dalam keadaan anaerob, oleh karena itu asam piruvat tidak berubah menjadi asetil koenzim A sebagaimana jika keadan aerob. Asam piruvat akan didekarboksilase menjadi asetaldehida dengan dikatalisis enzim piruvat dehidrogenase. Enzim ini mengandung tiamin pirofofat (TPP). Asetaldehid tersebut kemudian direduksi menjadi alkohol oleh enzim alkohol dehidrogenase (Timotius, 1982). 16 Jalur HDP Glukosa 2 piruvat 2 NAD etanol 2 NADH Piruvat dekarboksilase CO2 2 asetaldehida Alkohol dehidrogenase Gambar 6 Skema jalur fermentasi alkohol oleh khamir (Timotius, 1982) Berbeda dengan pertumbuhan khamir, bakteri yang mampu melakukan fermentasi alkohol dapat tumbuh lebih baik dalam keadan anaerob. Walaupun demikian ada juga bakteri yang melalui HDP seperti halnya khamir, misalnya: Sarcina ventriculi dan Erwina amylovora. Kecuali itu ada juga bakteri dari macam fermentasi lain yang juga mampu menghasilkan etanol, misalnya: bakteri asam laktat tertentu, jenis-jenis tertentu dari Enterobacteraceae dan Clostridium. Tetapi dalam proses pembentukan etanol tidak menggunakan enzim piruvat dehidrogenase. Bakteri tersebut mengubah asetil ko-A menjadi asetaldehide dengan pertolongan asetaldehid dehidrogenase (Timotius, 1982). CH3-CO-KoA + NADH2 CH3CO COO H asetaldehid dehidrogenase Piruvat dekarboksilase Asam pivurat CH3CHO + NADH2 CH3CHO + KoA + NAD CH3CHO + CO2 asetaldehida Alkohol dehidrogenase CH3CH2OH + NAD+ ATP yang dihasilkan selama fermentasi alkohol adalah dua ATP/molekul glukosa. Hasil ini lebih rendah daripada jika dalam keadaan anaerob. Perubahaan dari anaerob menjadi aerob akan mengurangi atau bahkan menghentikan pembentukan alkohol, jumlah sel yang terbentuk akan bertambah, dan penguraiannya atau penyerapan glukosa akan berkurang. Demikian sebaliknya jika dalam keadaan aerob berubah menjadi anaerob. Fenomena ini dinamakan 17 efek Pasteur. Fenomena ini disebabkan dalam keadaan anaerob khamir melakukan fermentasi, dan jika dalam keadaan aerob khamir melakukan respirasi (Timotius, 1982). Sakarifikasi Fermentasi -Simultan Proses sakarifikasi fermentasi-simultan adalah proses kombinasi antara hidrolisis selulosa secara enzimatik dengan fermentasi gula yang berkelanjutan sehingga menghasilkan produk akhir berupa etanol. Tahapan-tahapan dalam proses sakarifikasi fermentasi-simultan adalah sama dengan tahapan pada hidrolisis dan fermentasi secara terpisah, hanya pada proses sakarifikasi fermentasi simultan ini kedua proses tersebut berlangsung dalam satu reaktor yang sama. Yeast secara langsung menfermentasi produk gula yang dihasilkan dari proses hidrolisis oleh komplek enzim selullase, sehingga laju sakarifikasi dan rendemen etanol yang dihasilkan akan lebih tinggi jika dibanding hasil proses sakarifikasi dan fermentasi yang terpisah. Keunggulan lain dari proses sakarifikasi fermentasi simultan adalah penggunaan reaktor tunggal untuk seluruh proses, sehingga dapat menekan biaya investasi alat. Selain itu adanya etanol (hasil fermentasi) didalam media menyebabkan media tidak mudah terkontaminasi oleh organisme lain yang tidak diinginkan (Ballesteros et al. 2004). Proses sakarifikasi selulosa dan hemiselulosa dalam TKKS menjadi gula dapat dilakukan dengan hidrolisis enzimatik atau dengan menggunakan asam. Jenis enzim yang berperan dalam hidrolisis tersebut adalah komplek selulase dan hemiselulase (xilanase, galaktanase dan mananase). Secara biokimia fermentasi diartikan sebagai pembentukan energi melalui senyawa organik, sedangkan pengertian dalam bidang industri fermentasi adalah suatu proses untuk mengubah bahan dasar menjadi suatu produk oleh massa sel mikrobia. Aplikasi proses fermentasi selalu terdiri dari 6 bagian utama proses, yaitu : formulasi medium, sterilisasi, produksi starter, pemeliharaan pertumbuhan mikroorganisme, pemanenan dan pemurnian produk, serta pembuangan limbah (Wibowo, 1990). Monomer gula dapat diubah secara anaerobik menjadi alkohol oleh bermacam-macam mikroorganisme. Fermentasi gula sederhana (sukrosa dan glukosa) menjadi etanol memiliki persamaan stoikiometri, yaitu : 18 C12H22O11 + H2O C6H12O6 4 C2H5OH + 4 CO2 2 C2H5OH + 2 CO2 (Standbury dan Whitaker, 1984) Yeast Saccharomyces cerevisiae Saccharomyces cerevisiae adalah khamir yang dapat menghasilkan alkohol. Bentuk selnya oval dan bulat, ukuran selnya pada malt agar dapat dilihat setelah 3 hari pada 25 OC. Dalam proses fermentasi, Saccharomyces cerevisiae bereaksi positif terhadap glukosa, galaktosa, sukrosa, maltosa dan raffinosa. Dengan Suhu minuman untuk S. cerevisiae adalah 9 OC dan maksimumnya O 37 C. Pada awal fermentasi udara tidak diperlukan jadi prosesnya an aerob. Dengan adanya udara dapat menyebabkan tumbuhnya bakteri yang tidak diinginkan, sehingga mengakibatkan berkurangnya alkohol hasil fermentasi. Yeast atau khamir S. cerevisiae biasa digunakan untuk membuat roti, anggur dan bir. S. cerevisiae termasuk kedalam kelas Ascomycetes yang dicirikan dengan pembentukan askus yang merupakan tempat dihasilkannya askospora. S. cerevisiae memperbanyak diri secara aseksual dengan bertunas (Pelczar dan Chan, 1986). Dinding sel S. cerevisiae terdiri dari komponen-komponen glukan, mannan, protein, khitin dan lemak (Waluyo, 2004). Boyless (1984) menyatakan bahwa untuk setiap mol glukosa yang dikonsumsi, S. cerevisiae menghasilkan entalpi katabolisme sebesar -31 Kkal, energi bebas dari hidrolisis ATP (2 mol) sebesar -14,6 Kkal dan entalpi untuk sintesis selnya hanya 0,23 Kkal. Entalpi dari metabolisme sebagian besar dihabiskan pada aliran keluar entropy dan hanya sedikit yang digunakan untuk sintesis materi sel. Saccharomyces cerevisiae sangat tahan dan toleran terhadap kadar etanol yang tinggi. Akan tetapi adanya kandungan fulradehid, asam organik dan komponen fenolik (hasil samping hidrolisis asam selulosa) dapat menghambat pertumbuhan S. cerevisiae, bahkan kandungan yang tinggi dan furaldehid, furfural dan 5-hidroksimetil-fulfural dapat bersifat meracuni (Brandberg et al. 2004). Hasil penelitian Samsuri et al. (2005) pada fermentasi bagase yang diberi perlakukan awal steam dan penjamuran dengan menggunakan S. cerevisiae dapat menghasilkan etanol sebanyak 15,4 g/L. 19 Rendemen alkohol dari hexosa dalam fermentasi menggunakan yeast dari genus Saccharomyces (pada kondisi yang optimal) dapat mencapai 90% (Boyles, 1984). Efisiensi pengubahan energi tersebut dapat mencapai 97% (Campbell, 1983). Selain yeast S. cerevisiae, bakteri Zymomonas mobilis juga merupakan salah satu bakteri yang efektif dalam fermentasi etanol, akan tetapi rendemen etanol yang dihasilkan masih lebih sedikit dibanding yeast karena bakteri tersebut juga menghasilkan sejumlah produk lain seperti asetat, laktat dan gliserol.