AGRIPLUS, Volume 23 Nomor : 02 Mei 2013, ISSN 0854
advertisement

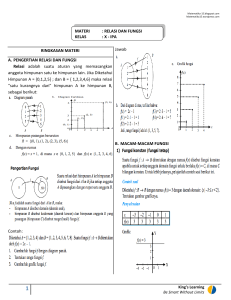
PENGARUH INOKULAN BAKTERI Azospirillum sp ASAL RUMPUT RAJA TERHADAP SIFAT KIMIA TANAH Oleh: Rahman1) dan Arsy Aysyah Anas2), Panca Dewi Manuhara Karti3), Erika B. Lacon3) ABSTRACT Azospirillum sp is bacteria that have potencies to increase king grass nutrition, because it has the ability in nitrogen fixation and able to produce phytohormone and enhancing in nutrition uptake by roots. The main of this experiment is to find get one isolate which have the highest nitrogenase activity and best supporting the king grass growth. Azospirillum sp was isolated from rhizosfer and roots of king grass. There are 5 isolates that have been isolate, consists of 2 (two) from rhizosfer and 3 (three) from roots. From gram staining, the morfologi characteristic all of isolate was same. To get one isolate that have higest nitrogenase activity and best supporting the king grass growth, the experiment was arranged according to completely randomized with all of five isolate as the treatment and four replicate conducted. The estimates of nitrogenase activity from each isolate based on the available N in soil and absorpsion by plant. The growth parameter consist of plant high, number of leaves, number of stolon, root dry weight, and biomassa dry weight. Soil analisis consists of pH, C-organic, total N, available N, available P and K-dd, and plant tissue analize were C, P, N and K was obseved. The results from three times observatin (10, 20, and 30 day after panting) showed that each isolate had fluktuated effect to the growth parameter according the observation time. There was no significant different influence from each isolate to the all growth parameters, so we have to investigate the ability each isolate to increasing available N in soil and in plant tissue. And that we can get one isolate that had a best influences to the king grass growth. Keywords : Azospirillum sp bacteria, isolation, isolates, nitrogenase, growth, king grass PENDAHULUAN Rumput raja (Pennisetum purpureophoides) atau king grass adalah jenis rumput baru yang merupakan hasil persilangan antara rumput gajah (Pennisetum purpereum) dengan pennisetum typhoides. Rumput raja merupakan jenis rumput unggul sebab mudah dibudidayakan dan memiliki potensi produksi yang tinggi. Dibandingkan rumput gajah, produksi hijauan rumput raja dua kali lipat dari produksi rumput gajah, yaitu dapat mencapai 40 ton rumput segar per hektar sekali panen atau setara dengan 200-250 ton rumput segar per hektar per tahun (Wibisono, 2008). Tingginya produktivitas rumput raja tersebut menjadikan rumput raja ini banyak digunakan sebagai pakan dalam usaha penggemukan ruminansia (sapi, kambing, domba, dan kerbau). Penyediaan rumput raja sebagai pakan ternak melalui budidaya yang digunakan baik pada ternak sapi masyarakat 1 di daerah perdesaan baik maupun secara komersil dalam industri peternakan. Meskipun demikain, pemanfaatan rumput raja sebagai pakan ternak ruminansia terbatasi oleh kandungan nutrisi yang masih tergolong rendah. Hasil analisis Laboratorium Ilmu Pertanian dan Peternakan Universitas Tadulako menunjukkan bahwa kadar serat kasar rumput raja mencapai 34.15% dari bahan kering, sedangkan protein kasar hanya berkisar 10,19 % bahan kering (Rahman, 2006). Kadar serat kasar yang tinggi tersebut diakibatkan oleh lignin, selulosa dan hemiselulosa yang merupakan komponen sulit dicerna dalam proporsi yang tinggi. Salah satu cara yang dapat dilakukan untuk menurunkan kadar serat kasar sekaligus meningkatkan kadar protein kasar pada rumput raja melalui peningkatan serapan unsur hara N. Jika kadar nitrogen dapat ditingkatkan maka perbandingan antara karbon dan nitrogen (C/N ratio) menjadi ) Staf Pengajar Jurusan PeternakanVolume Fakultas Peternakan Oleo, Kendari AGRIPLUS, 23 NomorUniversitas : 02 MeiHalu 2013, ISSN 0854-0128 2) 3) Staf Pengajar Jurusan Agroteknologi Fakultas Pertanian Universitas Halu Oleo, Kendari Staff Pengajar pada Departemen Ilmu Nutrisi dan Teknologi Pakan, IPB, Bogor 145 146 lebih rendah yang selanjutnya akan memudahkan mikroba rumen untuk menghancurkan hijauan sehingga proses pencernaan nutrisi dari pakan menjadi lebih cepat. Peningkatan serapan N oleh rumput raja dapat dilakukan melalui pemberian pupuk kimia. Namun cara ini dihadapkan pada beberapa kendala diantaranya teknik pemupukan yang kurang sesuai, pemberian dosis tinggi menjadi tidak ekonomis, dan curah hujan yang tinggi mengakibatkan banyak nitrogen yang hilang akibat tercuci dari lapisan tanah atau hilang melalui penguapan ketika suhu tinggi. Di samping itu, penggunaan pupuk kimia secara intensif juga akan berdampak pada penurunan kualitas tanah dan semakin bertambahnya biaya produksi yang harus dikeluarkan dalam pembudidayaan ternak. Unsur nitrogen secara alami berada dalam jumlah yang melimpah. Menurut Djohana dan Setyamidjaja (1986), nitrogen yang terkandung dalam udara yaitu sekitar 78% dari volume udara. Namun, nitrogen ini tidak dapat langsung digunakan oleh tanaman karena berada dalam bentuk yang tidak tersedia. Untuk dapat diserap tanaman, Nitrogen tersebut harus dikonversi ke bentuk N tersedia melalui bantuan mikroorganisme pemfiksasi N, yang salah satunya adalah bakteri Azospirillum sp. Menurut Garner dkk., (1995), Azospirillum sp. merupakan salah satu mikroorganisme yang dapat menfiksasi N dari udara yang bersifat mikroaerobik dan mampu berasosiasi dengan tanaman tingkat tinggi. Nitrogen yang terfiksasi oleh Azospirillum sp. akan diubah menjadi sebuah jaringan yang kemudian melalui proses dekomposisi, amonifikasi dan nitrifikasi, nitrogen yang terfiksasi tersebut akan berubah menjadi bentuk N-tersedia sehingga dapat diserap oleh tanaman. Selain mampu memfiksasi N bebas, Azospirillum sp. juga dapat menghasilkan hormone pertumbuhan berupa auksin, sitokinin dan giberelin. Apabila keunggulan sifat bakteri ini dapat dimanfaatkan dengan efisien, maka kebutuhan tanaman akan unsure hara N dapat terpenuhi dan harapan untuk mengurangi penggunaan pupuk nitrogen kimia dapat terwujud. Pemanfaatan bakteri Azospirillum sp dalam meningkatkan serapan unsur hara N oleh rumput raja yang selanjutnya dapat menurunkan kadar serat kasar sekaligus meningkatkan kadar protein kasar menjadi mungkin untuk dilakukan. Sebab menurut Rocha dkk (1981) dalam Nurmayulis (2005) bahwa bakteri Azospirillum sp. membentuk koloni dan berasosiasi dengan akar tanaman baik golongan C4 (seperti jagung, sorgum, dan rumuput-rumputan) dan golongan C3 (seperti gandum, padi dan oats). Dan Gamo (1991) dalam Rusmana dan Hadijaya (2005) menyatakan bahwa bakteri Azospirillum sp pertama kali diisolasi dari permukaan akar tanaman rumput-rumputan makanan ternak. Hal ini menunjukkan bahwa tanaman rumput-rumputan termasuk rumput raja merupakan inang dari bakteri ini. Beberapa penelitian tentang inokulasi Azospirillum pada tanaman budidaya menunjukkan bahwa 90 % bakteri Azospirillum ditemukan pada lahan beriklim tropis dan hampir 60 % pada tanah beriklim sedang dengan suhu berkisar 29 oC (D. Swędrzyńska, A. Sawicka, 2000). Dengan kondisi demikian penelitian yang ditujukkan untuk mengetahui jenis bakteri Azospirillum sp yang berasosiasi dengan tanaman rumput raja serta pengaruhnya terhadap peningkatan kandungan nutrisi pada rumput raja sebagai pakan ternak menjadi penting untuk dilakukan. Mengingat bahwa kelima jenis bakteri Azospirillum sp. tersebut memiliki kemampuan memfiksasi N bebas yang berbeda-beda meskipun berasal dari tanaman inang yang sama (Rusmana dan Hadijaya (1994). Perbedaan kemampuan dari masingmasing spesies Azospirillum sp secara langsung akan mempengaruhi besarnya nitrogen yang dapat disumbangkan ke tanaman inangnya. METODE PENELITIAN Penelitian ini dilaksanakan di laboratorium Mikrobiologi Departemen Biologi Fakultas Matematika dan IPA Institut Pertanian Bogor untuk isolasi dan identifikasi bakteri azospirillum sp yang berasal dari tanah rhizosfer dan akar tanaman rumput raja. Tahapan aplikasi inokulum bakteri Azospirillum sp dilakukan di AGRIPLUS, Volume 23 Nomor : 02 Mei 2013, ISSN 0854-0128 147 Laboratorium Lapangan Jurusan Peternakan Universitas Haluoleo. Untuk analisis tanah dan jaringan tanaman dilakukan di Laboratorium Kimia Analitik Universitas Haluoleo. Penelitian di laksanakan dari bulan Juli sampai November 2011 Bahan yang digunakan dalam penelitian ini meliputi sampel tanah rhizosfer dan akar rumput raja sebagai sumber isolat, asam malat, KOH, K2HPO4, MgSO4.7H2O, MnSO4. 7H2O, FeSO4. 7H2O, NaCl, CaCl2, Na2Mo.O4,NH4Cl, congo red, bromtimol blue, ethanol, agar, yeast ekstrak, aquades, spiritus, kapas, aluminium foil, polybag, tanah strelir, pupuk kandang (kotoran sapi), pupuk NPK dan bibit rumput raja . Sedangkan alat-alat yang digunakan meliputi petri dish, tabung reaksi, gelas reaksi, botol kultur hitam, pH meter, jarum ose, tips yellow dan blue, pinset, pipet, spatula, timbangan analitik, autoclave, laminar flow, shaker bath, inkubator, lemari es, pacul, sekop, parang, oven, amplop sampel, meteran, dan kertas label. Penelitian ini terdiri dari bebrapa tahapan yaitu (1) pengambilan sampel tanah rhizosfer dan akar tanaman rumput raja, (2) isolasi bakteri, (3) identifikasi bakteri, (4) pembuatan inokulum Azospirillum sp, (5) pengambilan tanah dan kotoran sapi sebagai bahan media tanam, (6) aplikasi inokulum, dan (7) percobaan polybag. a. Pengambilan sampel tanah rhizosfer dan akar tanaman rumput raja. Tanah rhizosfer dan akar tanaman diambil secara acak dengan memilih empat rumpun tanaman yang berada di tengah. Selanjutnya rumpun rumput gajah tersebut di cabut dengan cara dipacul selanjutnya tanah yang melekat pada akar dibongkar kemudian dikompositkan. Akar rumput raja dari keempat rumpun tersebut di potong dan dikompositkan selanjutnya baik tanah dan akar diambil sekitar 1 kg sebagai sampel untuk keperluan isolasi. b. Isolasi bakteri Azospirilum sp. Sepuluh gram tanah rhizosfer dan akar tanaman rumput gajah yang akan diisolasi bakteri Azospirillumnya dilarutkan dalam 90 ml larutan fisiologis (larutan NaCl 0,85%), selanjutnya diencerkan secara serial c. d. e. sampai tingkat pengenceran 10-5. Satu ml suspensi dari pengenceran 10-2,203 ,10-4 dan 10-5 tanah rhizosfer dan akar dibiakkan ke dalam tabung reaksi yang mengandung 9 ml media NFB semi padat. Masing-masing pengenceran diulang sebanyak 5 kali kemudian biaakn diinkubasi selama 4-7 hari dalam suhu kamar. Biakan yang menunjukkan adanya pelikel putih di goreskan pada media NFB padat yang mengandung 5 ml NH4Cl, 20 mg/l ekstrat agar dan congo red. Koloni yang menyerap warna merah kemudian dibiakan kembali ke media NFB semi padat. Kultur yang menunjukkan adanya pelikel dimurnikan pada media NFB padat tanpa bromtimoblue. Selanjutnya koloni kecil berwarnah merah mudah disimpan dalam agar miring untuk selanjutnya didentifikasi. Identifikasi bakteri Azospirillum sp. Identifikasi terbatas dilakukan dengan cara mengamati bentuk koloni bakteri Azospirillum sp yang tumbuh pada agar miring. Identifikasi dilakukan dengan menggunakan mikroskop. Pembuatan inokulum Azospirillum sp. Media yang diguanakan sebagai biakkan bakteri Azospirillum sp adalah campuran tanah dan kotoran sapi yang telah disterilkan. Masing-masing isolat selanjutnya dicampur dalam media biakkan dan diinkubasi selama 3 hari. Selanjutnya inokulum siap digunakan. Pengambilan tanah dan kotoran sapi sebagai bahan media tanam. Tanah yang digunakan sebagai media tanam adalah tanah lapisan atas (topsoil) dan belum pernah diperlakukan seperti pemupukan dan pengapuran. Tanah kemudian dibersihkan dari kotoran dan akar tanaman kemudian di ayak untuk menghomogenkan ukuran partikel tanah, selanjutnya dimasukkan ke karung. Kotoran sapi diambil di laboratorium lapangan jurusan peternakan Unhalu. Kotoran sapi tersebut sebelum di masukkan ke dalam karung di ayak untuk menghomogenkan ukuran dan menghilangkan kotoran atau sisa-sisa tanaman yang melekat. Selanjutnya tanah dan kotoran sapi AGRIPLUS, Volume 23 Nomor : 02 Mei 2013, ISSN 0854-0128 148 f. g. dicampur dengan perbandingan 20 g kotoran sapi/kg tanah. Campuran tanah dan kotoran sapi selanjutnya disterilisasi untuk mematikan mikroba dan organisme tanah lainnya. Aplikasi inokulum. Penambahan inokulum pada media tanam dilakukan dengan cara menugal di bagian tengah polybag (tempat bibit rumput raja akan di tanam) yang telah beriisi media tanam sebanyak 20 kg. Selanjutnya diinkubasi selama 4 hari agar bakteri dapat beradaptasi dengan lingkungan hidupnya. Percobaan polybag. Bibit rumput raja yang digunakan berasal dari potongan batang (stek) dengan panjang stek 20 – 25 cm (dengan jumlah ruas 2 – 3 atau memiliki 2 buku/mata). Stek rumput raja ditanam dengan cara memasukkan 2/3 bagian dari panjang stek dalam lubang tanam dengan kemiringan 30 derajat pada masing-masing polybag yang sebelumnya telah diberi inokulum Azospirillum sp dan diinkubasi selama 4 hari. Selama tahap aplikasi, dilakukan pembersihan yang meliputi penyulaman jika terdapat bibit yang tidak tumbuh, penyiraman dan pengendalian gulma secara manual. Tindakan ini ditujukkan agar pengaruh aplikasi perlakuan inokulum bakteri Azospirillum sp terhadap tanaman rumput raja optimal. Tahapan percobaan dilakukan dengan menggunakan Rancangan Acak Lengkap dengan 5 perlakuan isolat yaitu King 1, King 2, King 3, King 4, dan King 5, masing-masing perlakuan diulang sebanyak 4 kali sehingga diperoleh 20 unit percobaan dengan 1 kontrol (tanpa pemberian inokulum). Untuk mengetahui adanya pengaruh perlakuan diuji dengan analisis ragam (Anova). Jika perlakuan menunjukkan pengaruh nyata maka akan dilanjutkan dengan uji Beda nyata terkecil (BNT). HASIL DAN PEMBAHASAN 1. Isolasi dan Identifikasi Bakteri Azospirillum sp pada Tanah Rhizosfer dan Akar Tanaman Rumput Raja Medium isolasi yang digunakan untuk bakteri Azospirillum dalam penelitian ini adalah medium semi padat NFb dengan sumber karbon asam malat. Keadaan medium yang semi padat ini dapat membuat kondisi medium mikroaerofil (rendah O2) sehingga dalam kondisi lingkungan yang demikian, Azospirillum mampu menambat N2. Pertumbuhan bakteri Azospirillum ditunjukkan dengan terbentuknya pellikel di permukaan medium (Okon , et al., 1977). Pemilihan sumber karbon berupa asam malat untuk medium isolasi bakteri Azospirillum, didasarkan dari beberapa hasil penelitian yang menunjukkan bahwa pertumbuhan bakteri Azospirillum sangat baik pada medium yang mengandung asam malat, asam suksinat, atau asam piruvat, sedangkan pada medium yang mengandung glukosa, pertumbuhan bakteri Azospirillum cukup baik, dan pada medium yang mengandung asam sitrat pertumbuhannya kurang baik (Okon et al., 1976; Konde dan Mohendale, 1984). Hasil isolasi bakteri Azospirillum sp dari tanah rhizosper dan akar tanaman rumput raja ditandai dengan terbentuknya pelikel berwarna putih di permukaan atas media NFB semi padat (Gambar 1). Gambar 1. Terbentuknya pelikel pada permukaan media dan terjadinya perubahan warna pada media. Berdasarkan hasil pengamatan, pelikel yang terbentuk berwarna putih, tebal dan berombak. Jumlah media yang menunjukkan pembentukan pelikel putih yaitu 20 (dua puluh) pada sampel akar dengan empat tingkat pengenceran yaitu 10-2, 10-3, 10-4 dan 10-5 dan 5 (lima) pada sampel tanah rhizosfer dengan tingkat pengenceran (Tabel 1). AGRIPLUS, Volume 23 Nomor : 02 Mei 2013, ISSN 0854-0128 149 Terbentuknya pelikel putih pada permukaan media merupakan indikasi keberadaan bakteri Azospirillum sp. Okon, dkk. (1997) menjelaskan bahwa pertumbuhan bakteri Azospirillum ditunjukkan dengan terbentuknya pellikel di permukaan medium. Setelah terbentuk pelikel, selaput putih tersebut digoreskan secara kuadran ke dalam media padat NFB yang mengandung ekstrat khamir dan kongo red dan diinkubasi selama 5-6 hari. Hasil pengamatan menunjukkan bahwa pembentukan koloni bakteri Azospirillum sp yang menyerap warna merah berjumlah 3 pada sampel tanah Rhizosfer dan 4 pada sampel akar (Tabel 2). Tabel 1. Pembentukan pelikel Putih pada masing-masing pengenceran Pengenceran Sumber Isolat 10-2 10-3 10-4 10-5 + + + Tanah + Rhizosper + + + + + + + + + + + + + + Akar + + + + + + + + Keterangan : tanda positif (+) menunjukkan terbentuknya pelikel putih. Koloni Azospirillum sp yang terbentuk pada media padat NFB memiliki ciri berwarna merah tua, padat, kecil, berbentuk bundar dengan bagian tengah koloni meninggi dan tepian berombak (Gambar 2.). Koloni yang berwarna merah dan tumbuh terpisah selanjutnya diisolasi dalam media miring yaitu media NFB semi padat tanpa bromotymolblue. Tabel 2. Pembentukan koloni Azospirillum sp pada berbagai tingkat pengenceran Pengenceran Sumber Isolat 10-2 10-3 10-4 10-5 + + + Tanah Rhizosper + + + + Akar Keterangan : Tanda positif (+) menunjukkan terbentuknya koloni berwarna merah pada medium NFb padat yang merupakan penciri bakteri azospirillum sp; tanda negatif (-) yang berarti bahwa tidak terbentuknya koloni azospirillum sp. Gambar 2. Penampilan koloni Azospirillum sp berumur 6 hari pada media padat NFB. Gambar 2 memperlihatkan bahwa koloni bakteri Azospirillum sp yang berwarna merah dikelilingi oleh koloni berwarna putih/pucat yang mengindikasikan adanya kontaminasi. Sehingga dilakukan pemurnian dengan mengambil koloni berwarna merah dengan menggunakan jarum ose dan di masukkan ke dalam tabung reaksi berisi media NFB tanpa bromotymol yang disebut media agar miring. Hasil identifikasi bakteri Azospirillum sp setelah 5 kali pemurnian dalam media agar miring disajikan pada Tabel 3 berikut. AGRIPLUS, Volume 23 Nomor : 02 Mei 2013, ISSN 0854-0128 150 Tabel 3. Hasil Pengamatan Mikroskopis Bakteri Azospirillum sp. No. Isolat Pewarnaan Gram Morfologi Mortilitas Uji NFB semi solid 1. KING 1 Gram Batang Mortil Biru berpelikel 2. KING 2 Gram Batang Mortil Biru berpelikel 3. KING 3 Gram Batang Mortil Biru berpelikel 4. KING 4 Gram Batang Mortil Biru berpelikel 5. KING 5 Gram Batang Mortil Biru berpelikel Keterangan : KING 1 dan KING 2 adalah isolat yang berasal dari tanah rhizosfer; KING 3, 4 dan 5 adalah isolat yang berasal dari akar. Berdasarkan hasil identifikasi sebagaimana ditunjukkan pada Tabel 3, diketahui bahwa kelima isolat yang dihasilkan memiliki ciri yang sama yaitu berbentuk matang, mortil, dan biru berpelikel. Hal ini diduga bahwa jenis bakteri yang berasosiasi dengan tanaman rumput raja baik pada akar maupun tanah rhizosfer adalah sama. Namun demikian dibutuhkan pengujian lanjutan untuk mengetahui kemampuan memfiksasi nitrogen dan pengaruhnya terhadap pertumbuhan rumput raja dari masingmasing isolat. Rusmana dan Hadijaya (1994) menerangkan bahwa setiap jenis Azospirillum sp. memiliki bakteri kemampuan memfiksasi N bebas yang berbeda-beda meskipun berasal dari tanaman inang yang sama. Tabel 4. Rekapitulasi hasil analisis ragam pengaruh pertumbuhan tanaman rumput raja Parameter pertumbuhan yang No. diamati 1. Tinggi tanaman (cm) 2. Jumlah daun (helai) 3. Jumlah tunas (tunas) 2. Pengaruh Inokulasi Bakteri Azospirillum sp Terhadap 3. Pertumbuhan Tanaman Rumput Raja (Pennisetum purpureophoides) Proses pertumbuhan tanaman dapat diketahui melalui perubahan morfologi dari tanaman tersebut dan perubahan tersebut dapat terukur secara kuantitatif. Analisis pertumbuhan pada dasarnya merupakan suatu cara untuk mengikuti dinamika fotosintesis. Berdasarkan hasil pengamatan dan analisis ragam yang dilakukan terhadap pengaruh inokulasi bakteri Azospirillum sp terhadap pertumbuhan rumput raja dalam 3 (tiga) pengamatan yaitu 10, 20 dan 30 HST (hari setelah tanam) diketahui adanya perbedaan tingkat pertumbuhan rumput raja akibat pemberian isolat yang berbeda. Rekapitulasi hasil analisis ragam pertumbuhan rumput raja yang terdiri atas tinggi tanaman, jumlah daun, dan jumlah tunas secara lengkap disajikan pada Tabel 4. inokulasi Bakteri Azospirillum sp terhadap 10 tn tn tn Waktu Pengamatan (HST 20 tn tn tn 30 tn tn tn Keterangan : **= perlakuan berpengaruh sangat nyata; * = perlakuan berpengaruh nyata; tn = perlakuan tidak berpengaruh nyata. (Analisis data Primer 2011). Hasil analisis ragam sebagaimana disajikan pada Tabel 4 menunjukkan bahwa perbedaan isolat tidak berpengaruh nyata terhadap keseluruhan parameter pertumbuhan yang diamati yaitu tinggi tanaman, jumlah daun, dan jumlah tunas rumput raja baik pada umur 10, 20 dan 30 HST (lampiran 1a-9b). a. Pengaruh mandiri bakteri Azospirillum sp terhadap tinggi tanaman rumput raja Penampilan ukuran tinggi tanaman merupakan salah satu aspek yang dapat diamati dan mudah dinilai kualitas pertumbuhannya (Sitompul dan Guritno, 1995). Lakitan (1996) menyatakan tinggi AGRIPLUS, Volume 23 Nomor : 02 Mei 2013, ISSN 0854-0128 151 tanaman merupakan pertumbuhan yang paling mudah untuk diukur. Pertumbuhan tinggi tanaman ditentukan oleh perkembangan dan pertumbuhan sel, semakin cepat sel membelah dan memanjang (membesar) semakin cepat tanaman meninggi. Hasil analisis sidik ragam yang ditunjukkan pada Tabel 4 yang menunjukkan bahwa perbedaan isolat tidak berpengaruh nyata terhadap tinggi tanaman dapat diasumsikan bahwa laju pertambahan tinggi tanaman rumput raja pada masingmasing perlakuan relatif sama. Hal ini diduga karena sifat bakteri Azospirillum sp di masing-masing perlakuan memiliki ciri morfologi yang sama. Artinya kemungkinan jenis bakteri yang ada pada masing-masing isolat adalah sama. Namun demikian, secara kulitatif pertambahan tinggi tanaman dari tiap-tiap perlakuan berbeda. Tabel 5. Tinggi Tanaman (cm) Rumput Raja yang diinokulasi bakteri Azospirillum sp pada umur 10, 20 dan 30 HST Waktu Pengamatan (HST) Perlakuan 10 20 30 76,90 102,15 132,07 KING 1 83,27 115,47 136,25 KING 2 65,77 105,88 121,00 KING 3 64,82 101,82 126,50 KING 4 81,97 109,56 140,25 KING 5 Sumber : Hasil Pengolahan Data Primer, 2011 Tabel 5 memperlihatkan bahwa pada umur 10 dan 20 HST tinggi tanaman tertinggi yaitu 83,27 cm dan 115,47 cm ditunjukkan oleh perlakuan isolat King 2. Isolat king 2 merupakan isolat yang dihasilkan dari tanah rhizosfer rumput raja. Sedangkan pada umur 30 HST, tinggi tanaman tertinggi ditunjukkan oleh perlakuan King 5 dengan rata-rata tinggi tanaman adalah 140,25 cm. King 5 adalah isolat yg berasal dari akar tanaman rumput raja. b. Pengaruh mandiri bakteri Azospirillum sp terhadap jumlah daun rumput raja Daun merupakan organ fotosintetik utama dalam tubuh tanaman, di mana terjadi proses perubahan energi cahaya menjadi energi kimia dan mengakumulasikan dalam bentuk bahan kering. Dalam analisis pertumbuhan, perkembangan daun menjadi perhatian utama. Berbagai ukuran dapat digunakan, diantaranya adalah jumlah daun. Jumlah daun tanaman merupakan komponen yang dapat menunjukkan pertumbuhan tanaman. Pembentukan daun sendiri sebetulnya dipengaruhi oleh sifat genetik tanaman, namun lingkungan yang baik dapat mempercepat pembentukkan tersebut. Menurut Leopold dan Kriedman (1975), pembentukan daun ditentukan oleh faktor lingkungan antara lain iklim dan tanah. Saat masuk pada fase pembentukan daun, tanaman lebih banyak menyerap unsur hara dari dalam tanah dan banyak membutuhkan cahaya matahari. Hasil analisis ragam pengaruh isolat Azospirillum sp terrhadap jumlah daun menunjukkan bahwa perbedaan jenis isolat tidak berpengaruh nyata. Namun, hasil pengamatan yang ditampilkan pada Tabel 6 memperlihatkan bahwa jumlah daun yang terbentuk berbeda-beda pada tiap-tiap perlakuan. Tabel 6. Jumlah daun (helai) Rumput Raja yang diinokulasi bakteri Azospirillum sp pada umur 10, 20 dan 30 HST Waktu Pengamatan (HST) Perlakuan 10 20 30 63,50 91,50 71,75 KING 1 60,25 95,00 84,25 KING 2 60,50 80,75 81,50 KING 3 50,75 63,50 71,25 KING 4 60,00 92,25 81,75 KING 5 Sumber : Hasil Pengolahan Data Primer, 2011 bahwa Data pada Tabel 6 menunjukkan rata-rata jumlah daun tertinggi AGRIPLUS, Volume 23 Nomor : 02 Mei 2013, ISSN 0854-0128 152 diperoleh pada perlakuan King 1 yaitu 63,50 helai pada umur 10 HST dan King 2 dengan jumlah daun rata-rata 95,00 helai pada umur 20 dan 30 HST. King 1 dan king 2 merupakan dua isolat yang dihasilkan dari tanah rhizosfer. Ini menggambarkan bahwa dalam dua waktu pengamatan, isolat yang berasal dari tanah rhizosfer memberikan pengaruh yang lebih baik terhadap pertambahan jumlah daun rumput raja. Berdasarkan data pada Tabel 6 juga terlihat bahwa terjadi penurunan rata-rata jumlah daun pada umur 30 HST di semua perlakuan kecuali King 3 dan King 4. Penurunan ini diduga karena pengaruh musim kemarau, kemarau menyebabkan suhu udara tinggi sehingga terjadi penguapan yang cukup besar ditandai dengan lebih cepatnya media tanam menjadi kering sehingga daun menjadi cepat layu dan mati. Kondisi lingkungan yang demikian selanjutnya mempengaruhi aktivitas dari bakteri Azospirillum sp. Menurut Davies and Whithread (1989), faktor abiotik utama yang mempengaruhi ketahanan bakteri bila diintroduksi ke dalam tanah adalah kelembaban tanah, temperatur, pH, tekstur, kadar oksigen dan kadar unsur hara. c. Pengaruh mandiri bakteri Azospirillum sp terhadap jumlah tunas rumput raja Hasil analisis ragam jumlah rumput raja yang terbentuk pada dua pengamatan yaitu 10 dan 20 menunjukkan bahwa perlakuan berpengaruh nyata. tunas waktu HST tidak Tabel 7. Jumlah anakan (anakkan)Rumput Raja yang diinokulasi bakteri Azospirillum sp pada umur 10 dan 20 HST Perlakuan KING 1 KING 2 KING 3 KING 4 KING 5 Waktu Pengamatan (HST) 10 20 30 8,25 10,25 10,25 8,25 11,00 11,25 7,25 10,75 13,25 6,25 9,00 9,75 8,25 10,25 11,00 Sumber : Hasil Pengolahan Data Primer, 2011 Data pada Tabel 7 memperlihatkan bahwa jumlah tunas tertinggi pada umur 10 HST diperoleh pada perlakuan King 1, King 2, dan King 3 dengan rata-rata jumlah tunas yang terbentuk 8,25 tunas. Sedangkan jumlah tunas terendah ditunjukkan oleh perlakuan King 4 dengan jumlah tunas 6,25 tunas. Pada umur 20 HST, jumlah tunas tertinggi ditunjukkan oleh King 2 dengan jumlah rata-rata 11 tunas, sedangkan perlakuan King 4 menjadi perlakuan dengan jumlah tunas terendah yaitu 9 tunas. Pada umur 30 HST rata-rata jumlah tunas tertinggi di peroleh pada perlakuan King 3 yaitu 13,25 tunas, dan terendah yaitu 9,75 tunas diperoleh pada perlakuan King 4. KESIMPULAN DAN SARAN Kesimpulan Berdasarkan tiga kali pengamatan (10, 20 dan 30 hari setelah tanam) terhadap pengaruh kelima isolat yang diperoleh masing-masing dua dari hasil isolasi tanah rhizosfer (King 1 dan King 2) dan tiga dari hasil isolasi akar tanaman rumput gajah (King 3, King 4, dan King 5), diketahui bahwa pengaruh masing-masing isolat berbeda – beda dan mengalami fluktuasi seiiring dengan bertambahnya waktu pengamatan terhadap keseluruhan parameter pertumbuhan rumput raja yang diamati yaitu tinggi tanaman, jumlah daun, dan jumlah tunas. Dan analisis ragam menunjukkan bahwa perbedaan jenis isolat tidak berpengaruh nyata terhadap masing-masing parameter. Sehingga untuk menentukan satu jenis isolat yang memberikan pengaruh terbaik, maka perlu diketahui besarnya pertambahan nitrogen dalam tanah dan tingkat serapan N tanaman sebagai indikator aktivitas nitrogenase dari tiap-tiap isolat. Saran Waktu pengamatan perlu diperpanjang hingga 60 hari setelah tanam (panen pertama rumput raja) dengan melanjutkan pengamatan terhadap tinggi tanaman, jumlah daun, dan jumlah tunas, serta berat kering brangkasan dan berat kering akar. Selanjutnya dilakukan analisis tanah untuk mendapatkan besaran perubahan sifat tanah dan perubahan nutrisi pada rumput raja dari masing-masing perlakuan. Sehingga dapat ditentukan satu isolat yang memberikan AGRIPLUS, Volume 23 Nomor : 02 Mei 2013, ISSN 0854-0128 153 pangaruh lebih baik untuk digunakan pada penelitian tahap kedua. DAFTAR PUSTAKA Davies, K.G., and R. Whitbread. 1989. Factor affecting the colonization of a root system by fluorescent Pseudomonas; the effect of water, temperature and soil microflora. Palnt and Soil 116 ; 247-256. Djohana dan Setyamidjaja. 1986. Pupuk dan Pemupukan. CV. Simpleks. Jakarta. El-Khawas, H Adachi K. 1999. Identification and Quantification of Auxin in Cultur Media of Azospirillum and Klebsiella and Their effect on Rice Root. Biol Fertil Soils 28 : 377-384 Gandanegara S, Slamet, Idawati dan Lina M,. 2005. Pengaruh Inokulasi Sejumlah Isolate Azospirillum Sp Terhadap Pertumbuhan dan Serapan Pupuk N pada Jagung. Jurnal berita Biologi, Vol. 6. Pusat Penelitian Biologi-LIPI. Bogor. Garner, F.P, R.B. Pearce dan R.I. Mirchell. 1995. Phyciology of Crop Plants. The Iowa States University Press, Ames. Iowa. Gunarto L. 1999. Capability of Azospirillum to Produce Indole-Acetic Acid, to fix N2 in Assotiation with Rice Plant and using RAPD to Fingerprint Indigenous Azospirillum. Final report ICRS, JIRCAS. 24p Gunarto L. Adachi K, and Senboku. 1999. Isolation and Selection of Indegenous Azospirillum sp. from a subtropical island, and effect of inoculation on growth of lowland rice under several level of N application. Boil fertile soils 28 : 129-135. Okon, Y., S.L. Albrecht, and R.H. Burris. 1977. Methods for Growing Azospirillum lipoferum and For Counting It In Pure Culture and In Association With Plants. Appl. Environ. Microbiol. 33(1) : 85-88 Okon, Y. 1985. Azospirillum as a potential inoculants for agriculture. Trends in Biotechnology 3 : 223 – 228. Okon, Y., and Kapulnik. 1986. Development an Function of Azospirillum inoculated roots. Plant and Soil 90 : 3-16 Okon, Y., and C.A Labandera-Gonzales. 1994. Agronomic application of Azospirillum ; an evaluation of 20 years wordwide field inoculation. Plant and Soil 26 ; 1591-1601 Sitompul, S. M dan B. Guritno.1995. Analisis Pertumbuhan Tanaman. Gajah Mada University Press, Yogyakarta Nurmayulis, 2005. Pertumbuhan dan Hasil Tanaman Kentang (Solanum tuberosum L.) yang diberi pupuk organic Difermentasi, Azospirillum sp., dan Pupuk Nitrogen di Pangalengan dan Cisarua. Universitas Padjajaran. Bandung Rahman, Koddang, M.Y., dan Damry, 2006. Pengaruh Penambahan tepung Ikan dan Bungkil Kelapa dengan rumput gajah ad-libitum terhadap Daya Cerna Protein Kasar, Serat Kasar dan Bahan Kering Ransum Sapi Bali Jantan. Jurnal Ilmiah Impasja: ISSN: 1829-9997,Volume III No.1 Maret 2006, Bogor. Rusmana, I. dan Hadijaya, DD. 1994. Aktivitas Nitrogenase Azospirillum sp. dan Efektivitas Simbiotiknya dengan Jagung. Jurnal hayati Vol, 1. Fakultas Matematika dan Ilmu Pengetahuan Alam. IPB. Bogor. AGRIPLUS, Volume 23 Nomor : 02 Mei 2013, ISSN 0854-0128