evaluasi status fisiologi pengaruh anestesi per injeksi dan per
advertisement

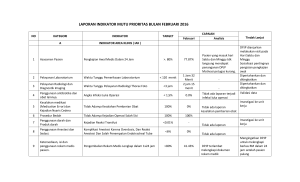
1 EVALUASI STATUS FISIOLOGI PENGARUH ANESTESI PER INJEKSI DAN PER INHALASI DALAM RANGKA OPERASI PENANAMAN IMPLAN TULANG SINTETIS PADA DOMBA (Ovies aries) RADITYA PRADANA PUTRA FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR BOGOR 2010 2 PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI Dengan ini saya menyatakan bahwa skripsi dengan judul “Evaluasi Status Fisiologi Pengaruh Anestesi Per Injeksi Dan Per Inhalasi Dalam Rangka Operasi Penanaman Implan Tulang Sintetis Pada Domba (Ovies aries)” adalah benar merupakan hasil karya saya dan belum diajukan dalam bentuk apapun ke Perguruan Tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang telah diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini. Bogor, Desember 2010 Raditya Pradana Putra NIM.B04061715 3 ABSTRACT Raditya Pradana Putra. B04061715. Physiological Status Evaluation of Injection and Inhalation Routes Anaesthetical Effects In Synthetical Bone Implant Surgery Period on Sheep (Ovies aries). Under direction of Gunanti and Dudung Abdullah S.M. This study aimed to observe the effect of injection and inhalation anasthetical method, such as, the value of oxygen saturation, heart frequency, respiratory frequency and body temperature in sheeps model during the synthetical bone implant surgery. Injection and inhalation anaesthetical methods were used in this experiment. The local sheep (Ovies aries), as an animal model, was used and prepared indoor for experiment adaptation. The method of this research was divided into two methods: 1) The first treatment group P1 was consisted of two sheeps and they were anaesthetical (per injection) using xylazine hydrochloride 2% with a dose of sheep 0.1 – 0.2 mg/kg by intramuscular (IM) and 0.1 mg/kg by intravena (IV), 2) The second treatment group P2 was consisted of two sheeps and they were anaesthetical (per inhalation) using isoflurane 1.5% 3% with a fresh-gas flow rate 25 ml/kg. The results showed that there are some differential values, especially the injection anaesthetical route and inhalation anaesthetical route oxygen saturation, heart frequency, respiratory frequency and body temperature. It can be concluded that isoflurane as an inhalation anaesthetical route is better than xylazine as an injection anaesthetical route. Keywords: Anaesthetical, injection, inhalation, xylazine, isoflurane. 4 RINGKASAN Raditya Pradana Putra. B04061715. Evaluasi Status Fisiologi Pengaruh Anestesi Per Injeksi Dan Per Inhalasi Dalam Rangka Operasi Penanaman Implan Tulang Sintetis Pada Domba (Ovies aries). Dibimbing oleh Gunanti dan Dudung Abdullah S.M. Penelitian ini bertujuan untuk melihat pengaruh anestesi per-injeksi dan anestesi per-inhalasi dari nilai saturasi oksigen, frekuensi jantung, frekuensi nafas dan suhu tubuh pada domba model selama operasi penanaman implan tulang. Pada penelitian ini menggunakan teknik anestesi per-injeksi dan anestesi perinhalasi. Hewan model yang digunakan adalah domba lokal (Ovies aries) yang diberi tempat tinggal di dalam ruangan dengan akses makanan dan air yang mudah untuk menyesuaikan diri dengan kondisi lingkungan. Penelitian ini dibagi menjadi dua metode: 1) Perlakuan pertama pada kelompok P1 (anestesi perinjeksi sebanyak dua domba) dengan menggunakan xylazine hydrochloride 2% dengan dosis domba sebanyak 0.1 – 0.22 mg/kg melalui intramuskular (IM), 2) Perlakuan kedua pada kelompok P2 (anestesi per-inhalasi sebanyak dua domba) dengan menggunakan isofluran 1.5% - 3% dengan dosis aliran gas (oksigen) 25 ml/kg. Hasil penelitian menunjukkan bahwa anestesi per-injeksi dan anestesi perinhalasi memberikan perbedaan nilai saturasi oksigen, frekuensi jantung, frekuensi nafas dan suhu tubuh. Hal ini dapat disimpulkan bahwa isofluran sebagai anestesi per-inhalasi memberikan efek anestesi yang lebih baik daripada xylazin sebagai anestesi per-injeksi. Kata kunci: Anestesi, injeksi, inhalasi, xylazin, isofluran, 5 ©Hak Cipta milik IPB, tahun 2010 Hak Cipta dilindungi Undang-Undang Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB. 6 EVALUASI STATUS FISIOLOGI PENGARUH ANESTESI PER INJEKSI DAN PER INHALASI DALAM RANGKA OPERASI PENANAMAN IMPLAN TULANG SINTETIS PADA DOMBA (Ovies aries) RADITYA PRADANA PUTRA SKRIPSI Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan DEPARTEMEN KLINIK REPRODUKSI DAN PATOLOGI FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR 2010 7 Judul : Evaluasi Status Fisiologi Pengaruh Anestesi Per Injeksi Dan Per Inhalasi Dalam Rangka Operasi Penanaman Implan Tulang Sintetis Pada Domba (Ovies aries) Nama : Raditya Pradana Putra NIM : B04061715 Program Studi : Kedokteran Hewan Menyetujui, Pembimbing I Pembimbing II Dr. Drh. Hj. Gunanti, MS Drh. Dudung Abdullah S.M. NIP. 19620102 198703 2 002 NIP. 19500523 197701 1 001 Mengesahkan, Wakil Dekan Fakultas Kedokteran Hewan Institut Pertanian Bogor Dr. Nastiti Kusumorini NIP. 19621205 198703 2 001 Tanggal Lulus : 8 RIWAYAT HIDUP Penulis dilahirkan di Pati pada tanggal 1 Januari 1989 dari ayah yang bernama Abdul Djamal dan ibu yang bernama Eny Murdiwati. Penulis merupakan anak sulung dari dua bersaudara. Tahun 1994 penulis lulus dari TK Aisyiah Pati, tahun 2000 penulis lulus dari SD Negeri 1 Pati, tahun 2003 penulis lulus dari SLTP Negeri 3 Pati, tahun 2006 penulis lulus dari SMA Negeri 1 Pati, dan pada tahun yang sama kuliah di Institut Pertanian Bogor (IPB) melalui jalur USMI (Ujian Seleksi Mahasiswa IPB) serta memilih Fakultas Kedokteran Hewan (FKH) IPB. Selama mengikuti perkuliahan, penulis mengikuti berbagai organisasi internal kampus seperti IMAKAHI (Ikatan Mahasiswa Kedokteran Hewan Indonesia) (2008-2009), Himpunan Minat Profesi SATLI (Satwaliar) (20082009), Komunitas Seni Steril (2008-2009), serta menjadi panitia dalam First Congress of South East Asia Veterinary School Association (SEAVSA) yang diadakan oleh FKH IPB (2010). i PRAKATA Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya sehingga skripsi ini dapat diselesaikan. Penelitian ini dimulai bulan April hingga Juli 2009 dengan judul Evaluasi Status Fisiologi Pengaruh Anestesi Per Injeksi Dan Per Inhalasi Dalam Rangka Operasi Penanaman Implan Tulang Sintetis Pada Domba (Ovies aries). Penyelesaian skripsi ini tidak lepas dari bantuan berbagai pihak. Penulis mengucapkan terimakasih kepada: 1. Keluarga tercinta (Bapakku Abdul Djamal, Ibuku Eny Murdiwati dan adikku Tifani Malinda Putri) atas dukungan, semangat, doa dan kasih sayang yang telah diberikan. 2. Dr. drh. Hj. Gunanti, MS dan drh. Dudung Abdullah S.M. selaku pembimbing skripsi atas ilmu, keterampilan, nasihat, saran, kritik, perhatian dan kesabaranya dalam membimbing penulis. 3. Drh. Titiek Sunartatie. MSi, selaku dosen pembimbing akademik. 4. Drh. Riki Siswandi, Drh. Fakhrul Ulum, Pak Katim, Pak Kosasih dan Pak Dahlan atas bantuan yang telah diberikan selama berjalannya penelitian. 5. Rekan-rekan sepenelitian (Shakerz) Kokol, Kobe, Gendis, Mato, Abe, Asme atas kerjasama, dukungan, semangat dan kebersamaanya selama penelitian berlangsung. 6. Ayu Puji Lestari atas bantuan, dukungan, semangat, perhatian, pengertian, cinta dan kasih sayangnya. 7. Sahabat-sahabat terbaik seperjuangan di IPB (Jihan, Anang, Bakhtiar, Gilang, Ika, Ilmi, Anggi) atas semangat, dukunganya dan bantuanya dalam penelitian dan penyelesaian skripsi ini. 8. Teman-teman Wisma Biru (Aero, Agus, Aguy, Hadi, Iin, Ijal, Nube, Reza, Riza, Rofi, Soni, Zamzam) atas motivasi, bantuan, dan rasa kekeluargaan yang telah diberikan. 9. Teman-teman Aesculapius FKH IPB (Ardi, Binol, Cipo, Ipin, Nina, Nobo, dan semuanya yang tidak bisa disebutkan satu per satu) serta Mas Wawan atas bantuan dan motivasinya. ii 10. Kepada semua pihak yang tidak dapat penulis sebutkan satu per satu yang telah membantu dalam penelitian dan penulisan skripsi ini. Semoga karya ilmiah ini dapat bermanfaat. Bogor, Desember 2010 Raditya Pradana Putra iii DAFTAR ISI Halaman PRAKATA .......................................................................................................... i DAFTAR ISI ..................................................................................................... iii DAFTAR TABEL .............................................................................................. v DAFTAR GAMBAR ......................................................................................... vi DAFTAR LAMPIRAN .................................................................................... vii 1. PENDAHULUAN 1.1 Latar Belakang .............................................................................................. 1 1.2 Tujuan Penelitian .......................................................................................... 1 1.3 Manfaat Penelitian ........................................................................................ 1 2. TINJAUAN PUSTAKA 2.1 Klasifikasi Domba Lokal............................................................................... 2 2.2 Saturasi Oksigen, Frekuensi Jantung, Frekuensi Nafas dan Suhu Tubuh ......... 3 2.2.1 Saturasi Oksigen ................................................................................... 3 2.2.2 Frekuensi Jantung ................................................................................. 4 2.2.3 Frekuensi Nafas .................................................................................... 5 2.2.4 Suhu Tubuh .......................................................................................... 6 2.3 Preanestesi .................................................................................................... 8 2.3.1 Atropin Sulfat ....................................................................................... 8 2.4 Anestesi ......................................................................................................... 9 2.4.1 Anestesi per-Inhalasi .......................................................................... 10 2.4.2 Isofluran ............................................................................................. 13 2.4.3 Anestesi per-Injeksi ............................................................................ 14 2.4.4 Tranquilizer dan Sedatif ..................................................................... 14 2.4.5 Xylazin ............................................................................................... 14 2.5 Implan Tulang Sintetis ................................................................................. 16 3. KERANGKA METODE PENELITIAN 3.1 Kerangka Metode ......................................................................................... 17 4. METODE PENELITIAN 4.1 Waktu dan Tempat Penelitian....................................................................... 18 iv 4.2 Bahan dan Alat Penelitian ............................................................................ 18 4.3 Metode Penelitian ........................................................................................ 18 4.3.1 Tahapan Persiapan Hewan Percobaan.............................................. 18 4.3.1.1 Hewan Percobaan ................................................................ 18 4.3.1.2 Adaptasi Lingkungan Baru .................................................. 19 4.3.2 Pengelompokan Hewan ................................................................... 19 4.3.2.1 Kelompok P1 ....................................................................... 19 4.3.2.2 Kelompok P2 ....................................................................... 20 4.3.3 Pre-Operasi, Operasi dan Post Operasi ............................................ 21 4.3.3.1 Pre Operasi .......................................................................... 21 4.3.3.2 Operasi ................................................................................ 22 4.3.3.3 Post-Operasi ........................................................................ 24 4.3.4 Parameter Penelitian ........................................................................ 24 4.3.5 Analisis Data ................................................................................... 24 5. HASIL DAN PEMBAHASAN 5.1 Perbandingan Rata-rata Saturasi Oksigen pada Anestesi Per-Injeksi (P1) dan Anestesi Per-Inhalasi (P2) .................................................................................. 25 5.2 Perbandingan Rata-rata Frekuensi Nafas pada Anestesi Per-Injeksi (P1) dan Anestesi Per-Inhalasi (P2) .................................................................................. 26 5.3 Perbandingan Rata-rata Denyut Jantung pada Anestesi Per-Injeksi (P1) dan Anestesi Per-Inhalasi (P2) .................................................................................. 28 5.4 Perbandingan Rata-rata Suhu Tubuh pada Anestesi Per-Injeksi (P1) dan Anestesi Per-Inhalasi (P2) .................................................................................. 29 6. SIMPULAN DAN SARAN 6.1 Simpulan .................................................................................................. 32 6.2 Saran ........................................................................................................ 32 DAFTAR PUSTAKA ....................................................................................... 33 LAMPIRAN ..................................................................................................... 37 v DAFTAR TABEL No. Halaman Teks 1. Protokol Pelaksanaan Operasi dan Pengambilan Data P1 ............................... 19 2. Protokol Pelaksanaan Operasi dan Pengambilan Data P2 ............................... 21 3. Perbandingan Nilai Rata-Rata Saturasi Oksigen Pada Anestesi Per Injeksi (P1) dan Anestesi Per Inhlasi (P2)…………………………………………………..25 4. Perbandingan Nilai Rata-Rata Frekuensi Jantung Pada Anestesi Per Injeksi (P1) dan Anestesi Per Inhlasi (P2)…………………………………………………..26 5. Perbandingan Nilai Rata-Rata Frekuensi Nafas Pada Anestesi Per Injeksi (P1) dan Anestesi Per Inhlasi (P2)…………………………………………………..28 6. Perbandingan Nilai Rata-Rata Suhu Tubuh Pada Anestesi Per Injeksi (P1) dan Anestesi Per Inhlasi (P2)……………………………………………………….29 vi DAFTAR GAMBAR No. Halaman Teks 1. Rumus Bangun Isofluran (Booth 1995) .......................................................... 13 2. Rumus Bangun Xylazin (Booth 1995) ............................................................ 16 3. Penimbangan Bobot Badan ............................................................................ 22 4. Pemeriksaan Fisik .......................................................................................... 22 5. Pencukuran Rambut ....................................................................................... 22 6. Penyayatan ..................................................................................................... 23 7. Pengeboran Tulang ........................................................................................ 23 8. Implan Tulang Sintetis ................................................................................... 23 9. Penanaman Implan Tulang Sintetis ................................................................ 23 10. Penjahitan .................................................................................................... 23 11. Pemerbanan ................................................................................................. 23 vii DAFTAR LAMPIRAN No. Halaman Teks 1. Tabel Data Operasi 1...................................................................................... 38 2. Tabel Data Operasi 2...................................................................................... 39 3. Tabel Data Operasi 3...................................................................................... 40 4. Tabel Data Operasi 4...................................................................................... 41 1 1. PENDAHULUAN 1.1 Latar Belakang Setiap tahun jutaan orang menderita berbagai penyakit tulang yang diakibatkan oleh trauma, tumor, ataupun patah tulang, kondisi ini diperparah dengan kurangnya pengganti tulang yang ideal (Murugan dan Ramakrishna 2004). Pengganti tulang (bahan sintetis) yang ideal yang dapat digunakan sebagai bahan implan tulang pada saat ini sangat dibutuhkan dengan tujuan untuk membatasi jumlah jaringan yang digunakan. Salah satu bahan sintetis yang sering digunakan adalah campuran hidroksiapatit (HAp). Salah satu tujuan penelitian ini adalah untuk mendapatkan metode anestesi yang aman dalam rangka operasi penanaman implan tulang sintetis. Dalam penelitian ortopedi ini dipilih domba dewasa karena berat tubuhnya dan dimensi tulang panjang pada domba mirip dengan manusia (Newman et al. 1995). Sebelum dilakukan tindakan operasi, hewan harus dalam keadaan teranestesi. Anestesi dilakukan dengan suntikan (per-injeksi) dan melalui paru-paru (per-inhalasi). Pada penelitian kali ini akan dicoba untuk membandingkan antara anestesi per-injeksi dengan anestesi per-inhalasi selama operasi penanaman implan tulang sintetis dengan melihat gambaran nilai fisiologisnya. 1.2 Tujuan Melihat pengaruh anestesi per-injeksi dan per-inhalasi terhadap beberapa nilai fisiologis yaitu nilai saturasi oksigen, frekuensi jantung, frekuensi nafas dan suhu tubuh pada domba lokal (Ovis aries) selama operasi penanaman implan tulang sintetis. 1.3 Manfaat Penelitian ini diharapkan dapat memberikan informasi tentang pemilihan anestesi yang aman pada saat melakukan anestesi selama operasi penanaman implan tulang sintetis terhadap keadaan fisiologis hewan. 2 2. TINJAUAN PUSTAKA 2.1 Klasifikasi Domba Lokal Domba merupakan hewan ruminansia yang berkuku belah dan termasuk dalam subfamili Caprinae dari famili Bovidae. Semua domba termasuk dalam genus Ovis dan yang terdomestifikasi adalah Ovis aries (Blakely dan Bade 1991). Mulyono (1998) mengatakan domba yang saat ini dikenal adalah domba lokal atau peliharaan (Ovis aries) yang diduga keturunan moufflon liar dari Asia Tengah Selatan dan Barat Daya. Bangsa domba di Indonesia ada beberapa macam, diantaranya domba ekor tipis, domba priangan, domba ekor gemuk, domba merino, domba suffolk dan domba dorset. Menurut Mulyono (1998), klasifikasi ilmiah domba lokal sebagai berikut: Kingdom : Animalia Phylum : Chordata Class : Mammalia Ordo : Artiodactyla Famili : Bovidae Subfamili : Caprinae Genus : Ovis Spesies : aries Domba merupakan salah satu spesies yang cocok untuk pengujian bahan implantasi tulang (Ravaglioli et al. 1996). Pada periode 1990-2001, pemakaian domba dalam penelitian ortopedik yang meliputi patah tulang (fraktur), osteoporosis, bone-lengthening dan osteoarthritis sebanyak 9-12%. Jumlah ini meningkat dibandingkan pada periode 1980-1989 yang hanya sebanyak 5% (Martini et al. 2001, diacu dalam Pearce et al. 2007). Peningkatan penggunaan ini berkaitan dengan isu-isu etis dan persepsi negatif publik terhadap penggunaan hewan kesayangan untuk penelitian medis. Domba menawarkan keuntungan untuk digunakan sebagai hewan model implantasi tulang karena domba memiliki dimensi tulang panjang yang sesuai untuk implantasi pada pengimplanan manusia dan prostesis (Newman et al. 1995, diacu dalam Pearce et al. 2007). Domba merupakan model yang berharga untuk regenerasi tulang manusia dan aktivitas remodelling (Chavassieux et al. 1987; den Boer et al. 1999; Pastoureau et al. 3 1989, diacu dalam Pearce et al. 2007). Komposisi mineral tulang pada manusia dan domba tidak memperlihatkan perbedaan yang signifikan dilihat dari fisiologi pergantian Mg2+ untuk Ca2+ pada tricalcium magnesium phosphate (TCMP) (Ravaglioli et al. 1996, diacu dalam Pearce et al. 2007). 2.2 Saturasi Oksigen, Frekuensi Jantung, Frekuensi Nafas dan Suhu Tubuh 2.2.1 Saturasi Oksigen Saturasi oksigen adalah indikator untuk mengetahui persentase Hb yang tersaturasi dengan oksigen saat pemeriksaan (Schutz 2001). Menurut Cunningham (1992), saturasi adalah perbandingan volume oksigen yang terikat dengan hemoglobin dalam darah dari keseluruhan volume oksigen dalam tubuh. Ikatan antara hemoglobin dengan oksigen dalam keadaan normal mencapai 95%. Ikatan ini terjadi ketika darah melewati paru-paru, maka oksigen akan berdifusi dari alveolus ke dalam darah dan berikatan dengan hemoglobin berupa tekanan oksigen (PO2). Menurut Guyton dan Hall (1997), pengikatan oksigen oleh Hb ditentukan oleh tekanan oksigen (PO2). Bila PO2 tinggi, seperti dalam kapiler paru-paru maka oksigen yang berikatan dengan Hb semakin banyak tapi bila PO2 rendah misal dalam kapiler jaringan maka sejumlah besar oksigen akan dilepas dari hemoglobin (Hb). Pulse oxymetri merupakan suatu teknik non invasive untuk mengukur dan memastikan secara cepat saturasi oksigen pada arteri dengan memancarkan cahaya melalui kulit (Kirk dan Warren 1995). Cara penggunannya dengan menempelkan probe pada lidah, bibir, telinga, ekor dan jari kaki (Nelson dan Counto 1998). Pembacaan melalui pulse oxymetri ini menggunakan sensor cahaya yang berisi dua sumber cahaya (inframerah) yang akan diabsorbsi oleh hemoglobin dan ditransmisikan melalui jaringan ke photodetector kemudian dikonversikan ke dalam bilangan digital yang menunjukkan persen saturasi (Schutz 2001). Beberapa faktor yang mempengaruhi ketepatan pengukuran pulse oxymetri adalah perbedaan warna kulit, penurunan perfusi, hipotermia dan peningkatan konsentrasi serum bilirubin dan anemia (Kirk dan Warren 1995). Nilai saturasi oksigen dapat bervariasi dengan sejumlah penggunaan oksigen oleh jaringan seperti terdapatnya perbedaan dalam nilai saturasi oksigen pada pasien saat istirahat dibandingkan saat beraktifitas. Satu molekul hemoglobin 4 maksimal dapat membawa empat molekul oksigen, jika molekul hemoglobin hanya membawa tiga molekul oksigen maka hanya 75% dari jumlah maksimum molekul oksigen yang dapat dibawa oleh molekul hemoglobin. Seratus molekul hemoglobin dapat membawa maksimal 400 molekul oksigen, jika 100 molekul hemoglobin hanya membawa 380 molekul oksigen maka nilai persen saturasi oksigen adalah 95% (Anonim 2007). 2.2.2 Frekuensi Jantung Frekuensi jantung domba berkisar antara 80-150 kali/menit (Riebold et al. 1995). Menurut Kelly (1974), frekuensi jantung adalah laju jantung berdetak per menit. Peningkatan frekuensi jantung disebut takikardia sedangkan frekuensi jantung menurun disebut bradikardia. Frekuensi jantung domba didapat dengan menggunakan bantuan stetoskop. Menurut Adisuwirdjo (2001), faktor-faktor yang mempengaruhi frekuensi jantung yaitu: 1. Aktivitas, aktivitas yang tinggi dapat meningkatkan frekuensi kerja jantung. 2. Ion kalsium, ion kalsium memicu sistol yaitu kontraksi salah satu ruangan jantung pada proses pengosongan ruangan tersebut. Diastol adalah reaksi dari satu ruang jantung sesaat sebelum dan selama pengisian ruangan tersebut. 3. Kadar CO2, dapat menaikkan frekuensi maupun kekuatan kontraksi jantung. 4. Asetilkolin, mengurangi frekuensi jantung. 5. Adrenalin, dapat menaikkan frekuensi jantung. 6. Atropin dan nikotin, dapat mempercepat frekuensi jantung. 7. Morfin, dapat memperlambat frekuensi jantung. 8. Suhu tubuh, semakin tinggi suhu maka frekuensi jantung juga semakin besar. 9. Berat badan, semakin berat badan seseorang atau hewan maka frekuensi jantung juga semakin besar. 10. Umur, umur muda memiliki frekuensi jantung yang lebih cepat. 5 Kelly (1974) menambahkan faktor lain yang mempengaruhi frekuensi jantung yaitu ukuran hewan, kondisi fisik, jenis kelamin, kebuntingan, parturasi, laktasi, excitement, olahraga, postur, proses pencernaan makanan, ruminasi dan suhu lingkungan. Menurut Ville et al. (1988), laju pompa jantung dipengaruhi oleh aktivitas mamalia atau manusia itu sendiri. Jantung pada berbagai hewan dapat berkontraksi dengan sendirinya tanpa ada rangsangan dari luar (Kay 1998). Kontrol syaraf kardiovaskular dipengaruhi oleh kontrol syaraf terhadap jantung dan pembuluh darah. Kontrol syaraf terhadap jantung ini dilakukan oleh nodusatrial dan syaraf otonom. Nodus sino-atrial ini yang berfungsi untuk mempertahankan agar jantung tetap berdenyut secara teratur tanpa kontrol syaraf (Guyton dan Hall 1997). 2.2.3 Frekuensi Nafas Bernafas atau ventilasi adalah tindakan membawa udara ke dalam dan kemudian mengeluarkan udara dari paru-paru. Paru-paru adalah struktur kompleks yang dirancang untuk memberikan pertukaran gas yang mudah, terutama oksigen dan karbondioksida antara udara dan darah (Kelly 1974). Menurut Guyton dan Hall (1997), tujuan utama dari pernafasan adalah menyediakan oksigen bagi jaringan dan membuang karbondioksida. Salah satu proses respirasi adalah ventilasi paru-paru yang berarti masuk dan keluarnya udara antara atmosfer dan alveoli. Hal ini dapat dilakukan dengan dua cara yaitu gerakan naik dan turun dari diafragma untuk memperbesar dan memperkecil rongga dada dan depresi tulang iga untuk memperbesar dan memperkecil diameter antroposterior rongga dada. Pada hewan, frekuensi dan ritme pernafasan dapat diketahui dengan menempatkan satu tangan di daerah flank bawah. Frekuensi nafas juga dapat diketahui dengan melihat pergerakan nostril atau lebih efisien dengan auskultasi pada thoraks atau trakea. Kisaran pernafasan normal pada domba adalah 20-40 kali/menit (Riebold et al. 1995). Tindakan bernafas diatur secara sengaja dan refleks dengan memonitor fungsi pusat pernafasan di medulla oblongata (Kelly 1974). Dua mekanisme syaraf yang mengatur pernafasan yaitu pengatur volunteer dan pengatur otomatis. Pengatur volunteer terletak di dalam cortex cerebri yang mengatur impuls ke neuron motorik pernafasan melalui traktus kortikospinal. 6 Sedangkan pengatur otomatis terdapat di pons dan medulla oblongata yang terbagi menjadi tiga kelompok neuron utama yaitu (1) kelompok pernafasan dorsal, terletak pada bagian dorsal medula yang menyebabkan terjadinya inspirasi, (2) kelompok pernafasan ventral, terletak di ventrolateral medula yang menyebabkan ekspirasi atau inspirasi pada kelompok neuron yang dirangsangnya, (3) pusat pneumotaksik, terletak pada bagian superior belakang pons yang membantu kecepatan dan pola pernafasan (Guyton dan Hall 1997). Faktor-faktor yang dapat meningkatkan frekuensi nafas antara lain excitement, ketakutan, suhu lingkungan yang tinggi, kelembaban, setelah olahraga dan obesitas (Kelly 1974). 2.2.4 Suhu Tubuh Ditinjau dari pengaruh suhu pada lingkungan, hewan dibagi menjadi dua golongan, yaitu poikiloterm dan homoiterm. Pada poikiloterm suhu tubuhnya dipengaruhi oleh lingkungan. Suhu tubuh bagian dalam lebih tinggi dibandingkan dengan suhu tubuh luar. Hewan seperti ini juga disebut hewan berdarah dingin. Hewan homoiterm sering disebut hewan berdarah panas (Duke 1995). Pada hewan berdarah panas suhunya lebih stabil, hal ini dikarenakan adanya reseptor dalam otaknya sehingga dapat mengatur suhu tubuh. Hewan berdarah panas dapat melakukan aktifitas pada suhu lingkungan yang berbeda akibat dari kemampuan mengatur suhu tubuh. Hewan dalam kelompok ini mempunyai variasi suhu normal yang dipengaruhi oleh faktor umur, faktor kelamin, faktor lingkungan, faktor panjang waktu siang dan malam, faktor makanan yang dikonsumsi dan faktor jenuh pencernaan air (Swenson 1997). Contoh hewan berdarah panas adalah bangsa burung dan mamalia (Guyton & Hall 1993). Domba termasuk hewan berdarah panas atau homoiterm. Suhu tubuh normal pada domba adalah 38,9-40,5°C (Kelly 1974). Suhu tubuh hampir seluruhnya diatur oleh mekanisme persyarafan umpan balik. Mekanisme ini terjadi melalui pusat pengaturan suhu yang terletak di hipotalamus yang disebut thermostat perifer yaitu reseptor panas dan dingin. Termoreseptor pusat yaitu neuron yang peka terhadap panas dan dingin yaitu nucleus preoptik dan nucleus hipotalamik anterior area preoptik. Dalam mekanisme kerja kedua neuron ini mengadakan integrasi untuk menghasilkan 7 signal eferen yang berguna untuk mengatur pembentukan dan pengeluaran panas. Pusat pengaturan suhu di hipotalamus mempunyai suhu kritis tertentu (suhu set point), jika suhu berada diatas suhu tersebut maka mekanisme pengeluaran panas diaktivasi dan jika dibawah suhu tersebut maka mekanisme pembentukan panas mulai bekerja. Pemberian agen sedasi dapat menekan reaktifitas pengaturan suhu di hipotalamus dan menyebabkan penurunan suhu (hipotermia). Penurunan suhu akan memperlambat denyut jantung dan menekan metabolism sel otot jantung. (Guyton dan Hall 1997). Suhu tubuh yang dihitung dengan termometer tidak menunjukkan jumlah total dari panas yang diproduksi, namun hanya merefleksikan keseimbangan (keadaan tetap) yang ada antara produksi panas dan kehilangan panas. Suhu pada permukaan kulit biasanya lebih rendah daripada bagian dalam tubuh. Tingginya suhu tubuh merupakan hubungan yang penting terhadap kehilangan panas. Walaupun suhu rektal tidak selalu menunjukan suhu tubuh pada hewan, namun tetap tempat yang paling tepat untuk memperoleh ukuran (Kelly 1974). Faktor-faktor yang mempengaruhi suhu antara lain: 1. Ukuran hewan, semakin kecil hewan semakin tinggi suhu normal tubuhnya. 2. Jenis kelamin, betina memiliki suhu normal tubuh lebih tinggi daripada jantan. 3. Hewan bunting memiliki suhu normal tubuh lebih tinggi. 4. Umur, hewan muda memiliki suhu normal tubuh lebih tinggi daripada hewan tua. 5. Aktifitas makan, suhu tubuh hewan meningkat setelah makan, terutama apabila makan terlalu banyak. 6. Olahraga (exercise). 7. Parturasi. 8. Terkena suhu atmosfer yang tinggi. 9. Excited, ketika hewan excited suhu tubuhnya meningkat. 10. Prosedur dalam pemeriksaan fisik dapat menyebabkan peningkatan suhu tubuh. 8 Semua hewan yang sehat memiliki suhu tubuh yang bervariasi sepanjang hari. Suhu rendah pada pagi hari, sedikit meninggi pada tengah hari dan mencapai puncak sekitar pukul 6 sore. Pada hewan dibawah pengamatan klinis, suhu tubuh biasanya diukur dua kali sehari (pagi hari dan malam hari). Perbedaan antara kedua pembacaan tersebut merupakan variasi harian (Kelly 1974). 2.3 Preanestesi Obat-obatan preanastesi digunakan untuk mempersiapkan pasien sebelum pemberian agen anestesi baik itu anastesi lokal, regional ataupun umum. Pemberian agen preanestesi bertujuan untuk mengurangi sekresi kelenjar ludah, meningkatkan keamanan pada saat pemberian agen anestesi, memperlancar induksi anestesi, mencegah efek bradikardi dan muntah setelah ataupun selama anestesi, mendepres reflek vagovagal, mengurangi rasa sakit dan gerakan yang tidak terkendali selama recovery (Kumar 1996). Agen preanastesi digolongkan menjadi 4 yaitu; antikolinergik, morfin serta derivatnya, transquilizer dan neuroleptanalgesik (Kumar 1996). Sementara menurut Sardjana dan Kusumawati (2004), obat-obat yang digunakan untuk anastesi premedikasi meliputi antikolinergik, analgesik, neuroleptanalgik, tranquilizer, obat dissosiatif dan barbiturate. Pada umumnya obat-obat preanastesi bersifat sinergis terhadap anastetik namun penggunaanya harus disesuaikan dengan umur, kondisi dan temperamen hewan, ada atau tidaknya rasa nyeri, teknik anestesi yang dipakai, adanya antisipasi komplikasi dan lainnya. 2.3.1 Atropin Sulfat Atropin merupakan agen preanestesi yang digolongkan sebagai antikolinergik atau parasimpatolitik. Atropin sebagai prototip antimuskarinik mempunyai kerja menghambat efek asetilkolin pada syaraf postganglionik kolinergik dan otot polos. Hambatan ini bersifat reversible dan dapat diatasi dengan pemberian asetilkolin dalam jumlah berlebih atau pemberian antikolinesterase (Ganiswarna et al. 2001). Atropin sulfat berbentuk kristal putih, tidak berwarna dan tidak berbau. Atropin dalam bentuk bubuk atau tablet harus disimpan dalam kontainer tertutup 9 dengan suhu 15º-30ºC, sedangkan dalam bentuk injeksi harus disimpan pada suhu kamar. Atropin sebagai premedikasi diberikan pada kisaran dosis 0,02-0,04 mg/kg, yang diberikan baik secara subkutan, intravena maupun intramuskular (Plumb 2005), sedangkan menurut Rossoff (1994), atropin sebagai premedikasi diberikan dengan dosis 0,03-0,06 mg/kg. Atropin dapat menimbulkan beberapa efek, misalnya pada susunan syaraf pusat, merangsang medulla oblongata dan pusat lain di otak, menghilangkan tremor, perangsang respirasi akibat dilatasi bronkus, pada dosis yang besar menyebabkan depresi nafas, eksitasi, halusinasi dan lebih lanjut dapat menimbulkan depresi dan paralisa medulla oblongata. Efek atropin pada mata menyebabkan midriasis. Pada saluran nafas, atropin dapat mengurangi sekresi hidung, mulut dan bronkus. Efek atropin pada sistem kardiovaskuler (jantung) bersifat bifasik yaitu atropin tidak mempengaruhi pembuluh darah maupun tekanan darah secara langsung tetapi dapat menghambat vasodilatasi oleh asetilkolin. Pada saluran pencernaan, atropin sebagai antispasmodik yaitu menghambat peristaltik usus dan lambung, sedangkan pada otot polos atropin mendilatasi pada saluran perkencingan sehingga menyebabkan retensi urin (Ganiswarna et al. 2001). 2.4 Anestesi Anestesi menurut arti kata adalah hilangnya kesadaran rasa sakit, namun agen anestesi umum tidak hanya menghilangkan rasa sakit akan tetapi juga menghilangkan kesadaran. Pada operasi-operasi daerah tertentu seperti perut, maka selain hilangnya rasa sakit dan kesadaran, dibutuhkan juga relaksasi otot yang optimal agar operasi dapat berjalan dengan lancar. Anestesi umum diperlukan untuk pembedahan karena dapat menyebabkan penderita mengalami analgesia, amnesia dan tidak sadarkan diri sedangkan otot-otot mengalami relaksasi dan penekanan reflek yang tidak dikehendaki. Pertimbangan utama agar anestesi umum dapat berjalan dengan sebaik mungkin adalah memilih agen anestesi yang ideal. Pemilihan ini didasarkan pada beberapa pertimbangan yaitu keadaan penderita, sifat anestesi, jenis operasi yang dilakukan dan peralatan serta obat yang tersedia. Sifat anestesi yang ideal antara lain mudah didapat, murah, 10 tidak menimbulkan efek samping terhadap organ vital seperti saluran pernafasan atau jantung, tidak mudah terbakar, stabil, cepat dieliminasi, menghasilkan relaksasi otot yang cukup baik, kesadaran cepat kembali, tanpa efek yang tidak diinginkan. Agen anestesi umum yang ideal mempunyai sifat-sifat antara lain: pada dosis yang aman mempunyai daya analgesik relaksasi otot yang cukup, cara pemberian mudah, mulai kerja obat yang cepat dan tidak mempunyai efek samping yang merugikan. Selain itu obat tersebut harus tidak toksik, mudah dinetralkan, mempunyai batas keamanan yang luas, tidak dipengaruhi oleh variasi umur dan kondisi hewan (Anonim 2008). Setelah hewan berada dalam kondisi anestesi harus dilakukan monitoring anastesi terhadap: (1) Tingkat kedalaman anastesi melalui tekanan darah, respirasi, reflek pupil, pergerakan bola mata dan kesadaran, (2) suhu tubuh, umumnya tubuh tidak mampu mempertahankan suhu tubuhnya, (3) kardiovaskular melalui monitoring pulsus dan detak jantung dan (4) respirasi, melalui pemeriksaan tipe respirasi dan komplikasi sistem respirasi (Sardjana dan Kusumawati 2004). Anestetikum dibagi dalam dua kelompok besar yaitu anestetikum umum dan anestetikum lokal (Siswandono dan Soekardjo 1995). Anestesi umum adalah suatu keadaan yang bersifat reversible yang dapat mengubah status fisiologis tubuh, ditandai dengan hilangnya kesadaran, hilangnya persepsi nyeri (analgesi), hilangnya memori (amnesi) dan relaksasi. Beberapa substansi yang dapat menghasilkan keadaan anestesi umum antara lain bersifat inert (xenon), anorganik (nitrous oxide), halogen hidrokarbon (halotan) dan struktur organik komplek (barbiturat) (Morgan et al. 2002). Menurut McCurnin (2006), anestesi lokal adalah kehilangan sensasi rangsang pada bagian tertentu dari tubuh sedangkan anestesi umum adalah pemberian obat anestetik tertentu yang dapat menimbulkan ketidaksadaran yang dikendalikan dan bersifat reversible. Anestesi injeksi maupun inhalasi dapat menghasilkan anestesi umum. 2.4.1 Anestesi per-Inhalasi Menurut Siswandono dan Soekardjo (1995), anestesi per-inhalasi adalah senyawa yang dapat menimbulkan efek anestesi dan diberikan secara inhalasi 11 dengan oksigen sebagai pelarut. Anestesi per-inhalasi ini memiliki dua kelebihan dibandingkan dengan anestesi intravena. Kedalaman anestesi dapat diubah dengan cepat yaitu dengan cara mengubah kadar senyawanya. Senyawa dapat dieleminasikan dengan cepat sehingga depresi pernafasan dapat dihindari. Contoh anestesi per-inhalasi adalah siklopropan, etilen, nitrogen oksida, halotan, enfluran, isofluran, kloroform, dietil eter dan metoksifluran. Anestesi per-inhalasi ini memiliki tiga sifat dasar yaitu berbentuk cairan pada suhu kamar, mempunyai sifat anestetik pada kadar rendah dan relatif mudah larut dalam lemak, darah dan jaringan (Handoko 1998). Berkaitan dengan efek pada sistem sayaraf pusat (SSP), maka anestesi umum baik parenteral maupun inhalasi dibagi atas 4 tahap atau stadium (Handoko 2003): 1. Stadium I (analgesia): Melibatkan korteks otak, dimulai dari saat pemberian anestesi sampai hilangnya kesadaran. Peredaran fungsinya menimbulkan analgesia dengan membatasi kesadaran secara berangsur-angsur tetapi masih mampu untuk mengikuti perintah. 2. Stadium II (eksitasi/delirium): Melalui penghambatan pusat-pusat yang lebih tinggi terjadi aktivitas yang meningkat pada otak tengah. Menyebabkan hiperrefleksia (muntah), peningkatan sekresi kelenjar, penambahan tonus otot, hilangnya kesadaran, midriasis, takikardi. Stadium ini harus cepat dilewati karena dapat menyebabkan kematian. 3. Stadium III (toleransi/pembedahan): Pusat-pusat yang lebih dalam dari SSP dilumpuhkan (batang otak dan sumsum tulang belakang). Kepekaan refleks dan sekresi kelenjar akan berkurang, tonus otot menurun, pupil sangat lebar, dan refleks cahaya hilang. Stadium ini dibagi menjadi 4 berdasarkan gejala klinisnya, yaitu : Tingkat 1: pernafasan teratur, miosis, pernafasan dada dan pernafasan perut seimbang, belum tercapai relaksasi otot lurik yang sempurna. Tingkat 2: pernafasan teratur tapi kurang dalam, pupil mulai melebar, refleks laring hilang sehingga bisa dikerjakan intubasi. 12 Tingkat 3: pernafasan perut lebih dominan, relaksasi otot lurik sempurna, pupil lebar tapi belum maksimal. Tingkat 4: pernafasan perut sempurna karena paralisis otot intercostae sempurna, tekanan darah mulai turun, pupil sangat lebar dan refleks cahaya hilang. 4. Stadium IV (asfiksia): Pemblokan pusat-pusat vegetatif yang vital pada medulla oblongata sehingga pernafasan dan jantung berhenti, tekanan darah tidak dapat diukur karena pembuluh darah kolap. Pada stadium ini kelumpuhan pernafasan tidak dapat diatasi dengan pernafasan buatan. Anestesi per-inhalasi dapat diberikan dengan empat cara yaitu: 1. Metode terbuka (Open drop method): Metode ini jarang digunakan tetapi biasanya digunakan pada keadaan darurat jika peralatan tidak ada. Cara ini biasanya digunakan untuk anestetikum pada kapas yang diletakkan di depan hidung pasien. Cara seperti ini tidak ekonomis karena terlalu banyak gas yang dibuang ke udara sehingga kadar anestetikum yang masuk tidak diketahui. 2. Metode setengah terbuka (Semiopen drop method): metode ini menggunakan masker untuk meminimalisir terbuangnya zat anestetikum. CO2 yang dikeluarkan sering dihisap kembali. Oleh karena itu O2 dialirkan melalui pipa yang terdapat di bawah masker supaya kejadian hipoksia (kekurangan O2) dapat dihindari. 3. Metode setengah tertutup (Semiclosed method): metode ini membutuhkan penggunaan mesin penganestesi. Udara yang dihisap diberikan bersamaan dengan O2 murni yang dapat ditentukan kadarnya, kemudian dilewatkan pada vaporizer sehingga kadar zat anestetik dapat ditentukan. Setelah pasien menghisap udara maka nafas yang dikeluarkan akan dibuang ke udara luar. Pada metode ini hipoksia dapat dicegah dengan pemberian O2 serta pemberian zat anestetikum kadarnya dapat diatur. 4. Metode tertutup (Closed method): pada metode ini udara dialirkan melalui NaOH yang dapat mengikat CO2, sehingga udara yang 13 mengandung anestetikum dapat digunakan lagi. Metode ini lebih hemat, aman dan lebih mudah akan tetapi harga alatnya cukup mahal. (Handoko 1998). 2.4.2 Isofluran Isofluran merupakan cairan yang mudah menguap tidak dapat terbakar, tidak berwarna dan tekanan uap yang relatif tinggi. Senyawa ini mengalir masuk dan dieliminasi dengan cepat, relaksasi otot lebih kuat dibandingkan dengan halotan dan menimbulkan efek depresi pernafasan. Laju biotransformasi dari isofluran sangat sedikit yaitu kurang dari 3% sehingga sangat kecil kemungkinan terjadinya kerusakan hati dan ginjal. Penggunaan isofluran dapat menyebabkan depresi dari CNS, peningkatan aliran darah ke otak, depresi pernafasan, hipotensi, vasodilatasi dan depresi dari miokardium sehingga frekuensi jantung menurun (Plumb 2005). Dalam aplikasinya isofluran diberikan bersamaan dengan gas sebagai pelarut, berupa oksigen atau N2O (Lumb and Jones 1996). Pemberian isofluran pada hewan betina sebagai anestesi tidak akan menimbulkan gangguan fertilitas ataupun kehamilan sehingga tidak menimbulkan gangguan teratogenik pada keturunannya. Isofluran yang diberikan dengan alat penguap tertutup (in-circuit vaporize closed system) lebih efektif dibandingkan dengan pemberian secara semi tertutup (out-circuit vaporizer semi closed system) karena durasi akan lebih panjang dan perubahan gejala klinisnya tidak terlalu signifikan (Bednarski dan Muir 1991). Gambar 1 Rumus Bangun Isofluran Sumber Booth (1995) 14 Mendepres system saraf pusat Menurunkan frekuensi jantung ISOFLURAN (Anonim 1999) Mendepres pernafasan Meningkatkan aliran darah otak (konsentrasi 1.5%) Meningkatkan tekanan intrakranial Merelaksasikan otot Menurunkan tekanan darah 2.4.3 Anestesi per-Injeksi Anastesi umum yang diberikan secara parenteral baik intravena maupun intramuskular biasanya digunakan untuk tindakan yang singkat. Keuntungan pemberian anestetik intravena adalah cepat dicapai induksi dan pemulihan, sedikit komplikasi pasca anestetik jarang terjadi, akan tetapi efek analgesik dan relaksasi otot rangka sangat lemah. Agen anestesi yang umum dipakai adalah thiopental, barbiturat, ketamin, droperidol dan fentanil. Pada tindakan yang lama biasanya dikombinasikan dengan agen anestesi yang lain (Anonim1 2010). 2.4.4 Tranquilizer dan Sedatif Tranquilizer dan sedatif adalah senyawa yang dapat menekan sistem syaraf pusat sehingga menimbulkan efek sedasi (penurunan kepekaan) lemah sampai tidur pulas atau hipnotik (Siswandono dan Soekardjo 1995). Agen ini biasa digunakan untuk restrain dan mengurangi perlawanan serta rasa takut. Senyawa ini juga membantu untuk mengurangi stress sebelum induksi dan saat sadar serta membantu meningkatkan kemampuan menginduksi dari anestesi (Cornick 1994). 2.4.5 Xylazin Xylazin merupakan cairan bening yang tidak berwarna yang tersedia dalam sediaan 2% dan 10% atau dalam bentuk bubuk kering dengan cairan yang telah disiapkan sehingga bisa diencerkan sesuai kebutuhan (Hall 1978). Menurut Plumb (2005), xylazin sering digunakan untuk sedatif dan analgesik pada berbagai spesies hewan dan terkadang digunakan sebagai obat emetikum pada kucing sedangkan pada kuda dan ruminansia tidak meyebabkan muntah. 15 Xylazin menimbulkan efek relaksasi muskulus sentralis juga analgesi. Kondisi tidur yang ringan sampai kondisi narkosis yang dalam dapat tercapai tergantung pada dosis untuk masing-masing spesies hewan (Sardjana dan Kusumawati 2004). Menurut Plumb (2005), perbedaan dapat terlihat sehubungan dengan sensitivitas spesies terhadap xylazin. Hewan ruminansia (domba) sangat sensitif terhadap xylazin bila dibandingkan dengan kuda, anjing atau kucing. Ruminansia secara umum membutuhkan dosis xylazin kira-kira 1/10 dari dosis yang dibutuhkan untuk kuda dalam memperlihatkan efek yang sama. Polyuria pada ruminansia sering terlihat setelah pemberian xylazin, kemungkinan disebabkan menurunnya produksi vasopressin (hormon ADH). Bradikardia dan hipersalivasi juga terlihat dan dapat diatasi dengan pemberian atropin. Daya kerja xylazine bila diberikan dosis maksimal (0.1 mg/kg IV atau 0.2-0.3 mg/kg IM) dapat memberikan efek anestesi umum mendekati sekitar satu jam (Taylor 1991). Xylazin termasuk ke dalam golongan turunan α2-adrenoreseptor agonis yang dapat menimbulkan efek sedasi, analgesia dan muscle relaxan (Luna et al. 2000). Menurut Lumb and Jones (1996), xylazin menghasilkan sedasi dengan cara mengaktifkan central α2 -adrenoreceptors yang menghasilkan hipoksemia tanpa menyebabkan hipoventilasi sedangkan anestesi inhalasi dalam jumlah yang besar dapat dihilangkan dari tubuh melalui kerja paru-paru. Alpha-2 adrenoreseptor ini telah diidentifikasi berada di system saraf pusat, kardiovaskular, respiratory, renal, endokrin, gastrointestinal dan system hematologi (Aanta et al. 1995). Menurut Maze dan Tranquilli (1991), α2-adrenoreseptor dijelaskan terletak di presinap neuron noradrenergik, α2-adrenoreseptor agonis mengerahkan efek penghambatan pada fungsi system saraf pusat melalui penghambatan pelepasan norepinephrin (NE) dari saraf simpatis. Hal ini menyebabkan aktivitas saraf simpatis menurun sehingga menurunkan tingkat kewaspadaan, menurunkan frekuensi jantung dan tekananan darah. Alpha-2 adrenoreseptor juga ditemukan di otot polos pembuluh darah (non-presynaptic site) dan ketika diaktifkan akan menyebabkan vasokonstriksi. Xylazine hydrochloride (rompun) dengan rumus kimia 2-(2,6xylidino)-5,6-dihydro-4H-1,3-thiazine hydrochloride (Booth 1995). 16 Gambar 2 Rumus Bangun Xylazin Sumber Booth (1995) Mendepres system saraf pusat Mendepres pernafasan Merelaksasikan otot XYLAZIN Hipersalivasi (Plumb 2005) Menghambat motilitas gastrointestinal Menurunkan frekuensi jantung Hipotermia 2.5 Implan Tulang Sintetis Bahan yang dapat mengganti tulang disebut sebagai material implan. Implan tulang atau bone graft adalah prosedur medis penggantian tulang yang rusak atau hilang dengan implan. Jika implan tulang berhasil, ada kesempatan baik bahwa area tersebut akan sembuh dengan baik sehingga memungkinkan pasien untuk menggunakan tulang seperti biasa (Anonim2 2010). Implan tulang dimungkinkan karena jaringan tulang memiliki kemampuan untuk regenerasi sepenuhnya jika tersedia ruang untuk tumbuh. Ketika tulang asli tumbuh, umumnya akan menggantikan material implan sepenuhnya yang menghasilkan daerah terintegrasi sepenuhnya oleh tulang baru. Mekanisme biologi menyediakan dasar rasional untuk pengimplanan tulang yaitu osteokonduktif, osteoinduktif dan osteogenesis (Klokkevold & Jovanovic 2002). 17 3. KERANGKA METODE PENELITIAN 3.1 Kerangka Metode Induksi Anestesi Umum Umur Berat Badan Jenis dan Dosis Operasi Penanaman Agen Anestesi Implan Tulang Sintetis Xylazin Isofluran Status Present Saturasi Oksigen Frekuensi Jantung Frekuensi Pernafasan Suhu Tubuh 18 4. METODOLOGI PENELITIAN 4.1 Waktu dan Tempat Penelitian Penelitian ini dilakukan pada bulan April sampai dengan Juli 2009 bertempat di Laboratorium Bagian Bedah dan Radiologi, Departemen Klinik, Reproduksi dan Patologi serta kandang Hewan Percobaan yang dikelola oleh Unit Pelayanan Teknis Hewan Laboratorium (UPT Helab), Fakultas Kedokteran Hewan, Institut Pertanian Bogor. 4.2 Bahan dan Alat Penelitian Hewan percobaan yang digunakan domba lokal (Ovis aries) yang berjumlah 4 ekor dengan kisaran umur 1,5-2 tahun dan berat badan rata-rata 19 kg. Domba dalam keadaan klinis sehat dan tidak bunting. Bahan yang digunakan pada penelitian ini obat bius per-injeksi berupa xylazin 2% sedangkan obat bius per-inhalasi berupa isofluran, antibiotik Cefotaxime 250 mg, NaCl fisiologis, larutan ringer laktat, benang jahit (silk 3/0, cat gut chromic 3/0 dan 4/0, cut gut plain 3/0), Rivanol, Levertrans, Peru Balsem, Gusanex, Iodine tincture 3%, preparat sulfa, kapas, tampon, perban dan plester. Alat yang digunakan adalah alat pulse oxymetri, peralatan anestesi perinhalasi, tabung oksigen, alat bedah minor, meja bedah, lampu bedah, baju operasi, masker, dan tutup kepala operator, masker untuk inhalasi, sarung tangan, tali, dysposible syiringe 1ml, termometer, pencukur rambut dan jarum berdiameter segitiga dan bulat serta implan tulang hidroksiapatit (HA), trikalsium fosfat (TKF) dan kitosan dengan diameter 4 mm dan tebal 7 mm yang diperoleh dari Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. 4.3 Metode Penelitian 4.3.1 Tahapan Persiapan Hewan Percobaan 4.3.1.1 Hewan Percobaan Penelitian ini menggunakan 4 ekor domba lokal dengan rata-rata berumur 1,5-2 tahun dan berat badan rata-rata 19 kg. Domba dibagi menjadi dua kelompok yaitu kelompok anestesi per injeksi (kelompok P1) dan kelompok anestesi per 19 inhalasi (kelompok P2). Kelompok 1 dan 2 masing-masing terdiri dari 2 ekor domba. 4.3.1.2 Adaptasi Lingkungan Baru Adaptasi domba dilakukan selama seminggu dengan akses makanan dan air yang mudah untuk menyesuaikan diri dengan kondisi lingkungan yang baru. Domba ditempatkan di kandang domba dan setiap domba ditempatkan di kandang yang berbeda. Hewan diberi pakan konsentrat dan rumput pada pagi dan sore hari dan air diberikan ad libitum. 4.3.2 Pengelompokan Hewan 4.3.2.1 Kelompok P1 Kelompok P1 dilakukan pada kelompok domba yang dibius secara per injeksi (xylazin 2%) sebanyak 2 ekor domba. Domba terlebih dahulu diberikan premedikasi dengan atropin sulfat 0.2 mg/kg (SC) sampai interval waktu 10 menit sebelum dilakukan aplikasi anestesi dengan menggunakan xylazin 2% 0,2 mg/kg (IM) dan maintenance 0,10 mg/kg (IV) setiap 15 menit. Protokol pelaksanaan operasi dan pengambilan data P1 dapat dilihat pada tabel 1. Tabel 1. Protokol pelaksanaan operasi dan pengambilan data P1 Kelompok P1 - Penimbangan bobot badan - Pemeriksaan fisik - Pencukuran rambut - Penghitungan dosis anestesi - aplikasi atropine sulfat Aplikasi xylazin Operasi Pengamatan parameter fisiologis Penjahitan Pre-operasi Waktu 0 15 30 45 60 75 20 Perhitungan dosis atropin sulfat: Sediaan : Atropine Sulfat 0,25 mg/ml Dosis untuk domba: 0,15-0,3 mg/kg (SC) → 0,2 mg/kg (Plumbs, 5th edition) Perhitungan: Dosis atropin = dosis untuk domba x berat badan domba dosis sediaan Perhitungan dosis xylazine: Sediaan : Xylazine HCl 2 % (20 mg/ml) Dosis untuk domba: 0,10-0,22 mg/kg (IM) → 0,2 mg/kg 0,10 mg/kg (IV) (Plumbs, 5th edition) Perhitungan: Dosis Xylazine = dosis untuk domba x berat badan domba Dosis sediaan 4.3.2.2 Kelompok P2 Kelompok P2 dilakukan pada kelompok domba yang dibius secara perinhalasi sebanyak 2 ekor domba (P2). Domba terlebih dahulu diinduksi dengan menggunakan xylazin 2% secara injeksi intramuskular agar tidak mengalami kesulitan dalam memasang masker inhalasi. Setelah domba tersedasi lalu diberi isofluran yang bercampur dengan oksigen secara per inhalasi dengan menggunakan metode mempertahankan setengah keadaan anestesi. tertutup (semiclosed Protokol pengambilan data P2 dapat dilihat pada tabel 2. method) pelaksanaan operasi untuk dan 21 Tabel 2. Protokol pelaksanaan operasi dan pengambilan data P2 kelompok P2 Pre-operasi Waktu 0 15 30 45 60 75 - Penimbangan bobot badan - Pemeriksaan fisik - Pencukuran rambut - Penghitungan dosis anestesi Induksi xylazin Aplikasi isofluran Aplikasi oksigen Operasi Pengamatan parameter fisiologis Penjahitan Perhitungan dosis isofluran : Oksigen murni dengan dosis 25 ml/kg BB = BB x dosis oksigen = BB x 10 ml/kg BB Dosis isofluran 1.5%-3% 4.3.3 Pre Operasi, Operasi dan Post Operasi 4.3.3.1 Pre Operasi Domba terlebih dahulu ditimbang bobot badannya untuk mengetahui dosis anestesi yang akan diberikan (gambar 4). Kemudian dilakukan pemeriksaan fisik (physical examination) untuk mengetahui keadaan umum domba tersebut sehingga dapat diketahui domba tersebut sehat dan telah siap untuk dioperasi (gambar 5). Pencukuran rambut dilakukan pada daerah kaki belakang tepatnya pada setengah medial dari os tibia pada sekitar 1/3 proksimal (gambar 6). Pada kelompok P1, domba terlebih dahulu diberikan premedikasi dengan atropin sulfat 0.2 mg/kg (SC) sampai interval waktu 10 menit sebelum dilakukan aplikasi anestesi dengan menggunakan xylazin 2% 0,2 mg/kg (IM) dan maintenance 0,10 mg/kg (IV) setiap 15 menit. Pada kelompok P2, domba diinduksi terlebih dahulu 22 dengan xylazin 2% dengan dosis yang sama baru kemudian dilakukan maintenance dengan menggunakan Isofluran secara inhalasi dengan dosis 1.5%3% dan dosis oksigen 25 ml/kg BB setiap 15 menit. Setelah domba teranestesi dilakukan pembersihan pada daerah target operasi dengan desinfektan Iodine tincture 3%. Gambar 4 Gambar 5 Gambar 6 Keterangan: Gambar 4 Penimbangan Bobot Badan, Gambar 5 Pemeriksaan Fisik, Gambar 6 Pencukuran Rambut 4.3.3.2 Operasi Penanaman implan tulang sintetis dilakukan dengan operasi secara aseptis pada domba dibawah pengaruh anestesi dengan agen sedasi. Operasi dilakukan dengan melakukan penyayatan selebar 3-4 cm pada kulit lalu subkutan kemudian penyayatan otot (musculus peroneus tertius dan musculus flexor digitalis pedis longus) dan jaringan periosteum. Otot (musculus peroneus tertius dan musculus flexor digitalis pedis longus) disayat sejajar sumbu tulang pada bagian proximomedial tulang tibia kiri hingga mencapai tulang (gambar 7). Penyayatan dilakukan secara hati-hati agar tidak mengenai vena saphena dan nervus saphenus. Musculus peroneus tertius akan tampak di bagian proximokranial sedangkan musculus flexor digitalis pedis longus akan tampak di bagian proximokaudal. Penanaman implan tulang sintetis dilakukan pada bagian tulang tibia sekitar 1/3 proksimal dengan menggunakan bor untuk membuat lubang yang sesuai dengan diameter dan kedalaman yang disesuaikan dengan ukuran material implan tulang (gambar 8). Material implan tulang yang berbentuk silinder dengan diameter 4 mm dan tebal 7 mm (gambar 9) ditanam pada lubang yang telah dibuat. Penanaman implan dilakukan pada tulang tibia kaki kiri bagian medial 23 (gambar 10) sementara itu tulang tibia kaki kanan bagian medial sebagai kontrol positif (hanya dilubangi tanpa diberi implan). Setelah itu penutupan jaringan dilakukan dengan menjahit lepas periosteum, otot (musculus peroneus tertius dan musculus flexor digitalis pedis longus), jaringan subkutan dan kulit menggunakan jahitan sederhana (gambar 11) kemudian dilakukan pemerbanan (gambar 12). Prosedur yang sama dilakukan pada tulang tibia kaki kanan bagian medial tetapi lubang tidak diberi implan. Operasi dilakukan oleh orang yang sama untuk mencegah terjadinya variasi dalam operasi. Pengukuran selama operasi dilakukan setiap 15 menit sekali dengan parameter yang sama. Pengukuran dilakukan sampai domba tersadarkan kembali atau maksimal 75 menit setelah domba teranestesi. Gambar 7 Gambar 8 Gambar 9 Gambar 10 24 Gambar 11 Gambar 12 Keterangan: Gambar 7 Penyayatan, Gambar 8 Pengeboran Tulang, Gambar 9 Implan Tulang Sintetis, Gambar 10 Penanaman Implan Tulang Sintetis, Gambar 11 Penjahitan, Gambar 12 Pemerbanan 4.3.3.3 Post Operasi Semua domba kemudian menerima antibiotik yang diberikan dengan penyuntikan intramuskular yaitu Cefotaxime sodium 250 mg sebanyak dua kali sehari selama 5 hari post operasi. Penggantian verban juga dilakukan setiap hari sampai luka sembuh. Bagian bekas operasi dibersihkan dengan Rivanol lalu diolesi campuran Levertrans dan peru balsam untuk mempercepat persembuhan jaringan dan diberi iodium tingture sebagai desinfektan. Setelah itu disekitar luka disemprot dengan Gusanex sebagai anti serangga, kemudian luka diverban kembali. Penanganan post penanaman implan dilakukan pada hewan setiap hari secara rutin sampai luka sembuh. 4.3.4 Parameter Penelitian Parameter yang diukur selama penelitian ini adalah saturasi oksigen, frekuensi jantung, frekuensi nafas dan suhu tubuh. 4.3.5 Analisis Data Data yang diperoleh diolah dengan menggunakan analisa secara deskriptif dengan melihat nilai parameter fisiologis (saturasi oksigen, frekuensi jantung, frekuensi nafas dan suhu tubuh). 25 5. HASIL DAN PEMBAHASAN Domba lokal yang digunakan pada penelitian ini mempunyai rata-rata umur 1.5 – 2 th dengan berat badan rata-rata 19 kg. Pemeriksaan keadaan fisiologis awal menunjukkan hewan tersebut dalam keadaan yang sehat. Rata – rata rentang nilai saturasi oksigen normal adalah 72%-90%, rata – rata rentang nilai normal frekuensi jantung adalah 80-150 kali/menit, rata – rata rentang nilai normal frekuensi nafas adalah 20-40 kali/menit (Riebold et al. 1995) dan rata – rata rentang nilai normal suhu tubuh adalah 38.90C-40.50C (Kelly 1974). Pengamatan terhadap nilai parameter fisiologis diatas dilakukan pada 4 ekor domba yang diamati setiap 15 menit sekali selama 75 menit waktu operasi. 5.1 Perbandingan Nilai Rata-rata Saturasi Oksigen pada Anestesi Per-Injeksi (P1) dan Anestesi Per-Inhalasi (P2) Tabel 3. Perbandingan Nilai Rata-rata Saturasi Oksigen pada Anestesi Per-Injeksi (P1) dan Anestesi Per-Inhalasi (P2). P1 P2 Waktu Saturasi O2 Waktu Saturasi O2 (menit) (%) (menit) (%) 15' 86 ± 1.4 15' 97 ± 1.4 30' 83 ± 2.8 30' 97 ± 0.7 45' 84 ± 3.5 45' 96 ± 2.8 60' 85 ± 2.1 60' 97 ± 1.4 75' 86 ± 1.4 75' 96 ± 0 100 Saturasi Oksigen (%) 95 90 P1 P2 85 80 Normal 75 70 65 15' 30' 45' 60' 75' Waktu (menit) Gambar 1. Perbandingan Nilai Rata-rata Saturasi Oksigen P1 dan P2. 26 Hasil nilai rata-rata saturasi oksigen, menunjukkan bahwa anestesi per inhalasi memberikan nilai rata-rata saturasi oksigen yang lebih tinggi (95%) daripada anestesi per injeksi (84%). Pada grafik anestesi per injeksi (P1), gambaran nilai rata-rata saturasi oksigen menunjukkan perubahan setiap 15 menit dan relatif meningkat. Pada menit ke-15 terjadi penurunan nilai rata-rata saturasi oksigen sampai menit ke-30 yang merupakan akibat dari pengaruh xylazin yang mendepres pernafasan sehingga penerimaan oksigen menurun (Luna et al. 2000). Penurunan ini mencapai dibawah titik kritis saturasi oksigen yaitu 85%. Bila penurunan nilai saturasi oksigen dibawah titik kritis ini berlangsung dalam waktu yang lama dapat menyebabkan terjadinya hipoksia yang berakhir pada kematian jaringan (Carol 1997). Namun nilai rata-rata saturasi oksigen kembali meningkat pada menit ke-30, hal ini dikarenakan kompensasi jantung untuk meningkatkan penerimaan oksigen. Sedangkan gambaran nilai rata-rata saturasi oksigen pada anestesi per inhalasi (P2) menunjukkan perubahan yang tidak terlalu signifikan (penurunan dan peningkatannya tidak terlalu tajam) bahkan cenderung tinggi di atas nilai normal batas atas saturasi oksigen. Hal ini dikarenakan adanya suplai oksigen dengan isofluran yang terlarut di dalamnya maka proses oksigenasi mengalami peningkatan dan cenderung stabil (Soma 1997). 5.2 Perbandingan Nilai Rata-rata Frekuensi Jantung pada Anestesi Per-Injeksi (P1) dan Anestesi Per-Inhalasi (P2) Tabel 4. Perbandingan Nilai Rata-rata Frekuensi Jantung pada Anestesi Per-Injeksi (P1) dan Anestesi Per-Inhalasi (P2). P1 P2 Waktu Frek Jantung Waktu Frek Jantung (menit) (/menit) (menit) (/menit) 15' 80±5.6 15' 68±11.3 30' 74±8.4 30' 75±4.9 45' 80±10.6 45' 73±1.4 60' 79±9.1 60' 65±7.0 75' 66±8.4 75' 70±2.8 Frekuensi Jantung (x/mnt) 27 150 130 110 P1 90 P2 Normal 70 50 15' 30' 45' 60' 75' Waktu (menit) Gambar 2. Perbandingan Nilai Rata-rata Frekuensi Jantung P1 dan P2. Pada parameter frekuensi jantung, menunjukkan bahwa pada grafik anestesi per injeksi (P1) menit ke-30 terjadi penurunan frekuensi jantung akibat dari pengaruh xylaxin yang mendepres kardiovaskuler (Muir 2000). Xylazin menyebabkan relaksasi otot sehingga menghambat tranmisi intraneural pada impuls pusat dari sistem syaraf pusat, mendepres miokardial dan hipotensi sehingga frekuensi jantung melemah (Booth 1995). Pada menit ke-45 mengalami kenaikan sebagai akibat dari kompensasi jantung untuk memompa darah setelah efek xylazin menurun. Pada menit ke-75 kembali menurun (bradikardia) akibat pemberian maintenance. Hal ini dikarenakan xylazin menyebabkan rangsangan pada nervus vagus sehingga mempengaruhi refleks sirkulasi yang mengakibatkan frekuensi jantung menurun (bradikardia) akibat efek penghambatan rangsangan parasimpatis oleh asetilkolin pada fungsi jantung (Guyton dan Hall 1997). Pada grafik anestesi inhalasi (P2) menunjukkan perubahan yang tidak terlalu signifikan yang ditunjukkan adanya penurunan dan peningkatan yang tidak terlalu tajam. Menurut Eger (1994), semua anestesi per inhalasi termasuk isofluran menurunkan frekuensi jantung (bradikardi). Penurunan frekuensi jantung sebagian besar disebabkan oleh penurunan stroke volume sebagai hasil dari dosis yang terkait depresi dalam kontraktilitas miokard. Pengaruh anestesi per inhalasi pada frekuensi jantung adalah bervariasi dan tergantung pada agen dan spesies. Hal ini dapat dijelaskan bahwa kedua anestesi per injeksi maupun anestesi per inhalasi 28 dapat menurunkan frekuensi jantung sampai batas ambang bawah dari normal frekuensi jantung. 5.3 Perbandingan Nilai Rata-rata Frekuensi Nafas pada Anestesi Per-Injeksi (P1) dan Anestesi Per-Inhalasi (P2) Tabel 5. Perbandingan Nilai Rata-rata Frekuensi Nafas pada Anestesi Per-Injeksi (P1) dan Anestesi Per-Inhalasi (P2). P1 P2 Waktu Frek Nafas Waktu Frek Nafas (menit) (/menit) (menit) (/menit) 15' 28±6.3 15' 22±2.8 30' 18±3.5 30' 32 ± 0 45' 24±8.5 45' 26±2.8 60' 22±3.5 60' 32 ± 0 75' 25±8.5 75' 22±2.8 Frekuensi Nafas (x/mnt) 50 45 40 35 P1 30 P2 25 Normal 20 15 15' 30' 45' 60' 75' Waktu (menit) Gambar 3. Perbandingan Nilai Rata-rata Frekuensi Nafas P1 dan P2. Hasil rata-rata frekuensi nafas, menunjukkan bahwa antara grafik anestesi per injeksi dan per inhalasi mengalami fluktuasi berbeda pada menit tertentu. Pada grafik anestesi injeksi (P1) mulai mengalami penurunan sampai menit ke-30. Hal ini dikarenakan pemberian xylazin secara intramuskular dilakukan pada menit ke0 dan dibutuhkan waktu ±15 menit sehingga efek mendepres nafas mulai terlihat maksimal pada menit ke-30. Hal ini sama halnya dengan yang terjadi pada menit ke-60 yang mengalami penurunan karena pemberian maintenance dilakukan pada menit ke-45 melalui intravena sehingga efek terdepresnya nafas lebih cepat 29 terlihat. Hasil grafik anestesi per inhalasi (P2) juga mengalami kenaikan dan penurunan namun pada menit yang berbeda. Pada menit ke-15 nampak menurun karena pengaruh induksi dari xylazin yang dapat mendepres pernafasan (McCurnin 2006). Terdepresnya pernafasan ini menyebabkan terjadinya penurunan volume tidal dan penurunan kerja pernafasan secara berlebihan (Plumb 2005). Setelah efek induksi xylazin mulai berkurang, frekuensi nafas kembali naik pada menit ke-30 dan saat itu juga diberikan maintenance anestesi per inhalasi dengan menggunakan isofluran. Anestesi per inhalasi juga dapat mendepres fungsi sistem pernafasan (Muir 2000). Hal ini dapat terlihat setelah pemberian maintenance isofluran terjadi penurunan nafas pada menit ke-45 dan mengalami kenaikan setelah dilakukan penambahan dosis oksigen 500 ml pada menit ke-60. Namun setelah pemberian isofluran dan oksigen dihentikan, frekuensi nafas mengalami penurunan pada menit ke-75. Hal ini mungkin dikarenakan masih adanya efek dari isofluran yang terdapat dalam tubuh domba. Kenaikan dan penurunan frekuensi nafas keduanya masih dalam kisaran normal. Frekuensi pernafasan pada P1 lebih rendah daripada normal dan P2 namun baik P1 dan P2 masih berada dalam kisaran nilai normal. 5.4 Perbandingan Nilai Rata-rata Suhu Tubuh pada Anestesi Per-Injeksi (P1) dan Anestesi Per-Inhalasi (P2) Tabel 6. Perbandingan Nilai Rata-rata Suhu Tubuh pada Anestesi Per-Injeksi (P1) dan Anestesi Per-Inhalasi (P2). P1 P2 Temperatur Temperatur Waktu Waktu Tubuh (0C) Tubuh (0C) (menit) (menit) 15' 30' 45' 60' 75' 38.5±0.4 38±0.4 37.9±0.1 37±0.7 37.4±0.1 15' 30' 45' 60' 75' 38.6±0.7 38±1.2 38±1.0 37.8±1.0 37.3±0.3 30 41 Suhu Tubuh (0C) 40 39 38 P1 37 P2 Normal 36 35 15' 30' 45' 60' 75' Waktu (menit) Gambar 4. Perbandingan Nilai Rata-rata Suhu Tubuh P1 dan P2. Suhu tubuh inti dikontrol oleh hipotalamus sehingga untuk mendapatkan nilai refleksi suhu inti tubuh diperlukan pengukuran sensor suhu pada arteri carotis interna yang mensuplai hipotalamus (West et al.2007). Dalam operasi ini dilakukan pengukuran suhu secara per rektal sehingga hanya mendapatkan perubahan suhu secara lokal saja. Menurut West et al (2007), pengukuran secara per-rektal dapat mendapatkan hasil yang berbeda dari suhu inti, namun dapat berguna untuk memantau perubahan relatif pada suhu tubuh. Pada parameter suhu tubuh menunjukkan bahwa grafik anestesi per injeksi (P1) maupun anestesi per inhalasi (P2) memiliki pola grafik menurun yang hampir sama. Grafik P2 menunjukkan pola yang cukup stabil dalam kisaran suhu normal. Namun grafik P1 pada menit ke-60 mengalami penurunan 10C dibawah suhu normal sehingga dapat dikatakan domba tersebut mengalami hipotermia ringan. Menurut Lumb dan Jones (1996), hipotermia adalah menurunnya suhu tubuh dari hewan berdarah panas, menurunnya metabolisme tubuh, serta berkurangnya kebutuhan oksigen. Gejala hipotermia dihasilkan dari agen anestesi yang diberikan secara intravena. Pada grafik anestesi per inhalasi (P2) menunjukkan bahwa domba tersebut mengalami hipotermi. Hal ini tidak sesuai dengan McCurnin (2006), ketika α2agonist (xylazin) dipakai sebagai premedikasi, menurunnya suhu dapat dikurangi sampai 50% atau lebih jika digunakan anestesi per inhalasi sebagai maintenance. Menurut Oncken et al (2001), hipotermia dapat diklasifikasikan menjadi hipotermia primer dan sekunder. Hipotermia primer disebabkan dari pasien yang 31 terpapar lingkungan yang dingin. Dalam hal ini mungkin dikarenakan hewan sudah mengalami hipotermi sebelumnya akibat suhu lingkungan ruangan operasi yang dingin karena memakai air conditioner. Hipotermia sekunder sendiri disebabkan efek dari pemberian agen anestesi yang dapat mempengaruhi produksi panas tubuh dan efek dari termoregulasi (Oncken et al. 2001). 32 6. SIMPULAN DAN SARAN 6.2 Simpulan Berdasarkan hasil penelitian dapat disimpulkan bahwa isofluran sebagai anestesi per inhalasi memberikan efek anestesi yang lebih baik daripada xylazin sebagai anestesi per injeksi. Anestesi per inhalasi memiliki nilai rata-rata parameter saturasi oksigen, frekuensi nafas dan suhu tubuh yang lebih tinggi dan stabil daripada anestesi per injeksi dan untuk parameter frekuensi jantung keduanya berada dalam nilai batas ambang bawah kisaran normal. Kedua anestesi tersebut dapat digunakan dalam operasi penanaman implan tulang sintetis karena tidak menyebabkan efek yang merugikan selama operasi berlangsung. 6.3 Saran Perlu dilakukan penelitian lebih lanjut dengan menambahkan jumlah sampel domba pada operasi penanaman implan sehingga dapat ditambahkan pengujian statistik berupa analisa dengan menggunakan T-test. 33 DAFTAR PUSTAKA Anonim. 1999. Isofluran. Manuklau City Auckland: Rhodia New Zealand Limited [8 Septermber 2010] Anonim. 2008. http://heriblog.web.id/veterinary/preanastesi dan anastesi sebelum operasi/ [10 Agustus 2010] Anonim. 2007. http://www.pulseox.info/index.htm [09 Maret 2010] [Anonim]1. 2010. http://titianputri.blogspot.com/2010/03/anastesi-umum-generalanasthetic.html [09 Maret 2010] [Anonim]2. 2010. Bone Grafting. [terhubung http://en.wikipedia.org/wiki/Bone_grafting [9 Agustus 2010]. berkala]. Aantaa R, Marjamaki A, Scheinin M. Molecular Pharmacology of α2adrenoreseptor subtypes. Ann Med 1995; 27:439-449 Adisuwirdjo D. 2001. Buku Ajar Dasar Peternakan.Unsoed, Purwokerto. Fisiologi Ternak. Fakultas Bednarski RM dan Muir WW. 1991. Closed System of Halothane and Isoflurane With Vaporizer in The Anesthetic Circle. Veterinary Surgery 20 (5): 353356. ISSN:0161-3499 Booth NH. 1995. Drugs Acting on The Central Nervous System. Di dalam: Booth NH, Keith RB. Editor. Veterinary Farmacology and Therapeutics. Ed ke2. Philadelphia: WB Saunders Company. Blakely J dan Bade DH. 1991. Ilmu Peternakan Edisi ke-4. Terjemahan. Gadjah Mada University Press, Yogyakarta. Caroll P. 1997. Pulse Oximetry at Your Fingertips. R N 60.2 : 22-27 Cornick. 1994. Veterinary Anesthesia. Di dalam: Dennis MM, editor. Clinical Textbook for Veterinary Technicians. Ed ke-3. Philadelphia: WB Saunders Company. Cunningham JG. 1992. Veterinary Physiology. Philadelphia: WB Saunders Company. Duke NH. 1995. The Physiology of Domestic Animal. Comstock Publishing: New York. Eger EI. 1994. New Inhaled Anesthetic. Anesthesiology 80: 906-922. 34 Ganiswarna SG, Setiabudy R, Suyatna FD, Purwantyastuti, Nafrialdi. 2001. Farmakologi dan Terapi. Edisi 4. Jakarta: Gaya Baru. Guyton AC & Hall. 1997. Fisiologi Kedokteran. Edisi ke-9. Diterjemahkan oleh dr. Irawati Setiawan, dr. LMA. Ken Ariata Tengadi, dr. Alex Santoso. Jakarta : EGC. Guyton DC & Hall. 1993. Fisiologi Hewan. Edisi 2. EGC. Jakarta. Hall LW. 1978. Veterinary Anesthesia and Analgesia. Revised 7th edition. London: Bailiere Tindall. Handoko T. 1998. Anestesi Umum. Dalam Ganiswara, Farmakologi dan Terapi. Edisi ke-5. Jakarta : Bagian Farmakologi Kedokteran Universitas Indonesia. Handoko T. 2003. Obat Susunan Syaraf Pusat. Di dalam: Sulistia GG, editor. Farmakologi dan Terapi. Ed ke-4. Jakarta: Gaya Baru. Hlm 109-102. Kay I. 1998. Introduction to Animal Physiology. Bioscientific Publisher Springer Verlag, New York. Kelly WR, 1974. Veterinary Clinical Diagnosis. Second Edition. Bailliera Tindall London. Kirk I dan Warren R. 1995. Kirk’s Current Veterinary Theraphy XII Small Animal Practice. Michigan : W.B. Saunders Company. Klokkevold PR, Jovanovic SA. 2002. Advanced Implant Surgery and Bone Grafting Techniques. In Newman, Takei, Carranza, editors: Carranza's Clinical Periodontology, 9th Edition. Philadelphia: W.B. Saunders Co. page 907-8. Kumar A. 1996. Veterinary Surgical Techniques. New Delhi: Vikas Publishing House. Lumb WV, Jones EW. 1996. Lumb and Jones’ Veterinary Anesthesia. Ed ke-3. USA: Williams and Wilkins. Luna SPL, CS Noguiera, ML Cruz, F Massone, GB Castro. 2000. Romifidine or Xylazine. Brazillian Journal of Veterinary Research and Animal Science. Vol. 37 n2 Sao Paulo 2000. http://www.scielo.br/scielo.php?pid. [Accessed on 6 June 2010] Maze M, Tranqulli W. 1991. Alpha-2 adrenoreceptor agonist: Defining The Role in Clinical Anesthesia. Anesthesiology ;74:581-605 35 McCurnin DM. 2006. Clinical Textbook for Veterinary Technicians. Edisi ke-6. USA : W.B. Saunders Company. Morgan GE, Mikhail MS, Murray MJ, Larson CP. 2002. Nonvolatile Anesthetic Agent. In: Clinical Anesthesiology. 3rd ed. New York: Lange Medical Books/McGraw-Hill Medical Publishing Edition. Mulyono S. 1998. Teknik Pembibitan Kambing dan Domba. Penebar Swadaya. Jakarta. Muir WW. 2000. Handbook of Veterinary Anesthesia. Third Edition. Ohio: All of the Department of Clinic Sciences. Murugan R, Ramakrishna S. 2004. Bioresorbable composite bone paste using polysaccharide based nano hydroxiapatite. Biomaterials 25:3829-3835 Nelson RW, Counto CG. 1998. Small Animal Internal Medicine. Missouri: Mosby. Newman E, Turner AS, Wark JD. 1995. The Potential of Sheep for The Study of Osteopenia: current status and comparison with other animal models. Bone 16: 277S- 284S. Oncken A, Kirby R, Rudolff E. 2001. Hypothermia in Critically Ill Dogs and Cats. Compend Contin Educ Pract Vet; 23: 506-520 Pearce AI, RG Richards, S Milz, E Schneider, SG Pearce. 2007. Animal models for implant biomaterial research in bone: A review. European Cells and Materials Vol. 13. 2007 (pages 1-10). Plumb DC. 2005. Plumb’s Veterinary Drug Handbook. Ed ke-5. Wisconsin: Pharma Vet. Ravaglioli A, Krajewski A, Celotti GC, Piancastelli A, Bacchini B, Montanari L, Zama G, Piombi L. 1996. Mineral evolution of bone. Biomaterials 17: 617-622. Riebold TW, Geiser DR, Goble DO: Clinical Techniques for Food Animal Anesthesia. In Riebold TW, Geiser DR, Goble DO, editors: Large Animal Anestheisa: Principles and Techniques, ed 2, Ames, IA, 1995, Iowa State University Press: Alon E et al: Effects of Propofol and Thiopental on Maternal and Fetal Cardiovacular and Acid-base variables in the pregnant ewe, Anesthesiology 78:562, 1993. Rossoff IS. 1994. Handbook of Veterinary Druges and Chemical,. Edisi kedua, Pharmatox Publishing Company, Illinois, USA. 36 Sardjana IKW dan Kusumawati D. 2004. Anestesi Veteriner Jilid I. Gadjah Mada University Press. Schutz SL. 2001. Oxygen Saturation Monitoring by Pulse Oxymetry. Di dalam: Debra JLM, Karen KC, editor. Procedur Manual for Critical Care. Ed ke-4. Philadelphia: WB Saunders. Siswandono dan Soekardjo B. 1995. Kimia Medisinal. Surabaya: Airlangga University Press. Soma LR. 1997. Textbook Of Veterinary Anesthesia. Edisi ke-3. Baltimore : The Williams : Wilkins Company. Swenson GM. 1997. Dules Physiology or Domestic Animals. Publishing Co. Inc : USA. Taylor PM. 1991. Anaesthesia in Sheep and Goat. Practice 13:31-36 Ville CA, Walker, Barnes WF. 1988. Zoologi Umum. Erlangga, Jakarta. West G, Heard D, Caulkett N. 2007. Zoo Animal And Wildlife Immobilization And Anesthesia. Blackwell Publishing: Australia 0 LAMPIRAN 38 0 OPERASI 1 No. Domba:10 Berat badan : 20.2kg INDUKSI Tanggal: Dosis: KONTROL ANAESTHESIA CATATAN KHUSUS Aplikasi 09.20 Pemberian atropine 09.10 Terbius 09.35 Onset= 15 menit WAKTU Suhu Nafas Jantung Reflex Menit ke- (oC) /mnt 0' 15' 30' 45' 60' 75' 39,5 38.2 37.7 37,8 37,5 37,4 9 April 09 1x dosis IM 20 23 21 20 19 20 /mnt 96 84 68 72 72 60 SPO2 maintenance Perlakuan/ Cubit Reflex pupil (cm) (%) (ml) Induksi 1xdosis IM gejala2 lain + - + + + 2 1,1 1,5 85 81 81 83 87 OPERASI MULAI 1x dosis IV OPERASI SELESAI 39 1 OPERASI 2 No. Domba:8 Berat Badan:21 Kg Tanggal: Dosis: 21 April 09 2x dosis IM KONTROL ANAESTHESIA CATATAN KHUSUS INDUKSI Aplikasi 15.20 Pemberian atropine 15.09 Terbius 15.34 Onset= 14 menit WAKTU Suhu Nafas Jantung Reflex Cubit + - Reflex pupil (cm) 1,5 1,7 1,5 Menit ke0' 15' 30' (oC) 39,1 38,8 38,3 /mnt 36 32 16 /mnt 72 76 80 45' 60' 37,9 36,4 32 24 75' 90' 105' 120' 135' 37,3 37,3 37,0 37,0 36,6 32 32 20 20 16 SPO2 87 85 87 85 - 1,5 1,7 86 86 72 72 76 72 66 + + 1,5 1,5 1,5 1,3 1,2 85 81 70 - (%) maintenance (ml) 15.20=Induksi 2x dosis IM Perlakuan/ gejala2 lain 15.34=DOMBA TERBIUS 15.45= OPERASI MULAI 16.07= 1x dosis IV 16.38= Ix dosis IV SADAR OPERASI SELESAI 17.20=DOMBA SADAR Ada tympani 40 2 OPERASI 3 No. Domba: 9 BB: 22,6 kg Tanggal: Dosis: Xylazin 21 Mei 09 2xdosis IM Isofluran 1,5-3% KONTROL ANAESTHESIA CATATAN KHUSUS INDUKSI Aplikasi 08. 54 Pemberian Atropine= 08.45 Terbius 09.14 Onset 1= 3 menit, Onset 2= 2 menit WAKTU Suhu Nafas Jantung Reflex SPO2 maintenance Perlakuan/ Cubit Reflex pupil (cm) Menit ke- (oC) /mnt /mnt (%) (ml) 80 + 1,5 - 20 32 28 60 71 72 + - 1,5 1,6 1,7 98 97 98 37,0 32 60 - 1,5 96 37,0 20 68 - 1,6 96 gejala2 lain 08.57= onset pertama 09.03=hipersalivasi 09.08=1x dosis IV 09.10= onset kedua 09. 14= TERBIUS, OPERASI MULAI 09.23=Iso 2,5% 25’ Pemberian Oksigen 500ml 55’ 09.53=Iso 1,5 % 65’ 10.00=Iso 0% OFF dan Pemberian oksigen 500 ml 70’ Pemberian oksigen I L 80’ 10.14= DOMBA SADAR, Ada gerak bola mata, ada reflex 0' 38,7 28 15' 30' 45' 38,0 37,1 37,2 60' 75' 08.54=Induksi 2x dosis IM - - 41 3 OPERASI SELESAI OPERASI 4 No. Domba: 2 Berat Badan: 17kg Tanggal: Dosis: 21 Mei 09 1x dosis IV Isofluran 1,5-3% KONTROL ANAESTHESIA CATATAN KHUSUS INDUKSI Aplikasi 10.14 Pemberian atropine= 10.04 Terbius 10.16 Onset= 2 menit WAKTU Suhu Nafas Jantung Reflex SPO2 maintenance Cubit Reflex pupil (cm) Menit ke- (oC) /mnt /mnt (%) (ml) 0' 39,5 20 80 + 1,5 - 15' 39,1 24 76 - 1,5 96 30' 45' 60' 75' 38,9 38,7 38,5 37,5 32 24 32 24 78 74 70 72 + 1,5 1,5 1,5 1,5 96 94 98 96 10.14=Induksi 1x dosis IV 10.35=Iso 1,5% 11.01=Iso 2,5% 11.19=Iso 0% OFF - Perlakuan/ gejala2 lain 10.16= TERBIUS, OPERASI MULAI 5’ 10.24=Iso 2,5% dan Pemberian oksigen 500 ml Pemberian oksigen 550 ml 25’ 10.43=Iso 1% dan Pemberian oksigen 550 ml Pemberian penicillin 40’ 10.56=Iso 2% 65’ 11.23= DOMBA SADAR 11.26= OPERASI SELESAI