9. alkana, alkena dan alkuna
advertisement

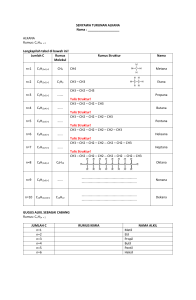
Senyawa yang hanya tersusun oleh karbon dan hidrogen Banyak terdapat di alam (Contoh : gas alam, minyak bumi) Dibagi menjadi 3 yaitu : 1. Jenuh : alkana, mempunyai ikatan tunggal dibagi menjadi 2 yaitu : o Asiklik (rantai terbuka) o Siklik (rantai tertutup) 2. Tak jenuh: mempunyai 2 ikatan yaitu : o Ikatan rangkap dua : alkena o Ikatan rangkap tiga : alkuna 3. Aromatik: benzene dan derivatnya. Siklik (rantai tertutup) 1. Karbosiklik 2. Heterosiklik Asiklik (rantai terbuka) Contoh : CH3-CH2-CH2-CH3 Butana CH2=CH-CH3 siklik ; jenuh : asiklik ; jenuh : asiklik ; tak jenuh Siklik ; tak jenuh senyawa hidrokarbon jenuh dengan rumus umum CnH2n + 2 n = jumlah atom C Contoh: CH4 (metana) CH3-CH3(etana) CH3-CH2-CH3 (propana) CH3-CH2-CH2-CH3 (butana) dst. 1. Nama trivial ◦ Pemberian nama didasarkan pada sumber senyawa itu diperoleh. ◦ Contoh: HCOOH : asam formiat CH3COOH : asam asetat 2. Nama menurut aturan IUPAC (International Union of Pure and Applied Chemistry) ◦ Digunakan aturan tertentu ◦ Contoh: HCOOH = asam metanoat CH3COOH = Asam Etanoat 1. Nama umum hidrokarbon jenuh asiklik adalah Alkana 2. Alkana tanpa cabang dinamakan menurut jumlah atom C-nya. Akar kata bahasa latin (pent;heks-,dst) menunjukan panjang rantai. 3. Alkana dengan rantai cabang, penamaanya didasarkan pada penamaan rantai atom C yang terpanjang Contoh : CH3 CH3 CH3 CH CH CH2 CH3 1 2 3 4 5 struktur pentana bersubtitusi nama: 2,3-dimetil pentana 4. Substituen: gugus yang menempel pada rantai utama Gugus Alkil: subtituen jenuh yang hanya mengandung C dan H contoh : gugus metil yang diturunkan dari hidrokarbon metana H H HCH H C atau CH3- atau Me H H Metana gugus metil 5. Lokasi gugus ditunjukkan dengan nama dan nomor ◦ ◦ ◦ Rantai utama diberi nomor sedemikian rupa, sehingga subtituen yang pertama terletak pada nomor karbon yang terendah. Bila ada dua atau lebih gugus identik yang menempel pada rantai utama digunakan awalan di,tri,tetraSetiap subtituen harus diberi nama dan nomor, sekalipun dua subtituen yang identik menempel pada karbon yang sama. 6. Tanda baca penting artinya dalam penulisan IUPAC ◦ ◦ ◦ ◦ ◦ Nama ditulis dalam satu baris Nomor-nomor dipisahkan satu sama lain dengan koma Nomor dan nama dipisahkan dengan tanda garis Jika terdapat dua atau lebih jenis subtituen, maka subtituen disusun menurut abjad Subtituen terakhir merupakan awalan bagi alkana induk untuk membentuk satu kata. 1. CH3 CH2 CH2 CHCH3 CH3 2- metil pentana (bukan 4- metil pentana) Akhiran ana menyatakan semua C berikatan tunggal Pentana : 5 karbon pada rantai terpanjang. Penamaan dimulai dari kanan agar substituen metil mendapat nomor terendah 2. CH3 CH CH2 CH2 CH3 CH3 - CH3 3-metil heksana (bukan 2-etil pentana) Rantai jenuh dengan C=6, gugus metil pada C3 struktur ini biasa ditulis sbg : CH3 CH2 CH CH2 CH2 CH3 3. CH3 CH3 C CH2 CH3 CH3 2,2-dimetilbutana (bukan 2,2-metilbutana, bukan 2dimetilbutana) Setiap substituen harus diberi nomor dan digunakan awalan (di-)yang dalam contoh ini menyatakan dua substituen gugus metil CH3 CH2 CH2 CH CH3 Cl 1-kloro-3-metilbutana(bukan 4-kloro-2-metilbutana) Penamaan rantai butana harus memberikan nomor terendah untuk klor. Semakin panjang rantai C, semakin tinggi titik didih dan titik lebur Sukar larut dan sukar bereaksi dengan zat lain Dapat terbakar menjadi CO2 + H2O Terjadi substitusi dengan halogen apabila ada sinar matahari (ultraviolet) SINTESIS WURTZ 2RX + 2Na R-R + 2 NaX Contoh: 2 CH3Cl + 2 Na CH3-CH3 + 2 NaCl SINTESIS GRIGNARD eter RX + Mg Contoh: RMgX eter C2H5Cl + Mg + H2O RH + Mg(OH)X + H2O C2H5MgCl C2H6 + Mg(OH)Cl Hidrokabron tak jenuh (H<2n+2) Alkena : hidrokarbon yang mengandung ikatan C-C ganda dua (-C=C-) = alkenes Rumus: CnH2n Alkuna : hidrokarbon yang mengandung ikatan C-C ganda tiga ( C C )= alkynes Rumus: CnH2n-2 Jumlah ikatan ganda dua 2: alkadiena = diena 3: triena 4 : tertrana > 4: poliena Letak ikatan rangkap : -C=C=C-C=C-C=C-C=C-C-C-C=C- Ketentuan IUPAC serupa dengan alkana dengan ketentuan-ketentuan tambahan sebagai berikut : Ikatan ganda dua diberi akhiran –ena bila terdapat lebih dari satu ikatan ganda dua diena,triena,dst Ikatan ganda harus masuk dalam rantai yang diberi nomor dan penomoran adalah sedemikian rupa sehingga C dengan ikatan ganda mendapat nomor terendah Kedudukan ikatan ganda dinyatakan menurut nomor atom C yang paling rendah dari setiap ikatan ganda, nomornomor ini diletakkan dimuka senyawa. o CH2=CHCH2CH3 1-butena o CH2=C CH3 CH3 Metilpropena o CH3 CH=CH CH CH3 CH3 4-metil-2-pentana Siklopentena CH3C=CCH3 2-butuna CH3 C=CHCH3 CH3 2-metil -2-butena CH2=CH CH=CH2 1,3-butadiena 3- metilsiklopentena Setiap atom C yang mempunyai ikatan ganda dua selalu berikatan dengan tiga atom lain (trigonal) Dua atom C yang dihubungkan dengan ikatan ganda dua beserta atom-atom H yang melekat padanya terletak dalam bidang datar Ikatan ganda C-C biasanya lebih pendek daripada ikatan tunggalnya. Sifat C-C C=C 1. Jumlah yang melekat pada C 4 (tetrahedral) 3(trigonal) 2. Rotasi/putaran bebas Terbatas 3. geometri Banyak kemungkinan konformasi Planer 4. sudut ikatan (umum) 109,5 120 5. panjang ikatan (umum) 1,54 1,34 Karena tidak ada putaran pada ikatan C-C ganda dua menjadi isomer, sis –trans terjadi pada beberapa alkena yang bersibtitusi Contoh : Cis-1,2-dikloroetana Titik didih 60C Titik didih -80C trans-1,2-dikloroetena titik didih 47C titik didih -50C Berat jenis lebih besar daripada 1 Sedikit larut dalam air C lebih kecil daripada 4: gas tak berwarna C lebih besar daripada 5 : cairan mudah menguap Hukum Markounikov Jika pereaksi tak simetris beradisi pada alkena tak simetris, bagian elektropositif dari pereaksi berada pada karbon dari ikatan ganda dua yang mempunyai hidrogen terbanyak. Reaksi-reaksi adisi dan subtitusi Reaksi subtitusi : umum terjadi pada alkana R-H + A-B RA + H-B Reaksi Adisi : umum terjadi pada alkena + A-B Subtitusi : CH3-CH3 + Br2 Cahaya Adisi : CH2=CH2 + Br2 CH3CH2Br + HBr brometana CH2-CH2 1,2-dibrometana simetris pereaksi Alkena Tak simetris Karbon yang memilki ikatan ganda tiga berhubungan dengan dua atom lain Sudut ikatan 180 linear Geometri linear tidak punya isomer cis-trans a. Adisi halogen Trans 1,2-dibromoetana 1,1,2,2-tetrabrometana b. Adisi Hidrogen 2-butuna cis-2-butena Apabila hibridisasi karbon lebih banyak bersifat s dan lebih sedikit p, keasaman hidrogenya meningkat = sp3 25%s 75%p sp2 331/3%s 662/3%p sp 50%s 50%p Alkena dapat dibuat dengan eliminasi alkohol dengan bantuan asam sulfat pada suhu 170oC Contoh: CH3-CH-CH3 OH H2SO4 170oC CH3-CH=CH2 + H2O Alkuna dapat dibuat dengan dehidrohalogenasi alkil halida Cl Cl Contoh: CH3-C-C-CH3 H H CH3-C C-CH3 + 2 HCl