Uploaded by
devyrida
ACFrOgCEkUbSx7m2rSxKMtiH8gAEsRHyut6W5-vexncmGh5Q7 ebw0t9A21NqdCLbeN-RP36pAEkGp 9nucySLX0nB4GXeP59XhyExTobQ4f93qfYu9fUC4BEx PmMIMBiMktowD-76Ey1QT4dTr
advertisement

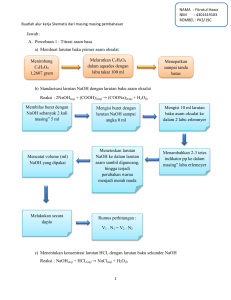
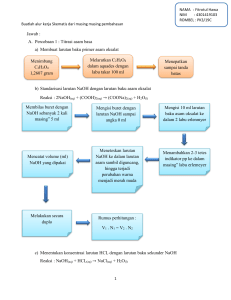
P1. PENENTUAN TETAPAN DISSOSIASI ASAM LEMAH (Ka) DENGAN pH-METER DATA PENGAMATAN Metode I CH3COOH (M) pH 0,1 5,7 0,05 6,1 0,01 6,9 0,005 7,2 0,001 7,6 [ H+] Perhitungan Ka Ka rata-rata Metode II Volume NaOH yang diperlukan untuk menetralisir 25 mL asam asetat adalah 24,55 mL. [A-]/[HA] NaOH volume 1/5 dari 2/5 dari 3/5 dari 4/5 dari 5/5 dari pH [H+] Ka 4,5 5,0 6,0 6,4 8,6 Ka rata-rata Metode III : pH campuran dari dua bagian larutan asam asetat 5,2 [H+] = ……………………………………… Ka = ………………………………………. Metode IV : Sejumlah 25 mL asam asetat 0,1 M dititrasi dengan NaOH 0,1 M No. 1. 2. 3. 4. 5. 6. 7. 8. V 0 0,5 1 1,5 2 2,5 3 3,5 pH 2,29 2,30 2,61 2,80 3,94 4,06 4,15 4,24 Volum terkoreksi (mL) pH/V 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 4 4,32 4,5 4,39 5 4,45 5,5 4,52 6 4,58 6,5 4,64 7 4,70 7,5 4,75 8 4,81 8,5 4,87 9 4,93 9,5 4,99 10 5,06 10,5 5,12 11 5,19 11,5 5,27 12 5,36 12,5 5,45 13 5,57 13,5 5,71 14 5,90 14,5 6,22 32. 33. 34. 35. 36. 37. 38. 39. 40. 41. 15 9,47 15,5 11,21 16 11,51 16,5 11,68 17 11,80 17,5 11,89 18 11,96 18,5 12,02 19 12,07 19,5 12,12 20 12,15 Titik ekivalen tercapai pada pH ……..dan volum titran……….ml pH pada setengah volum titik ekivalen …………………. pKa = …………………………. Ka = …………………………