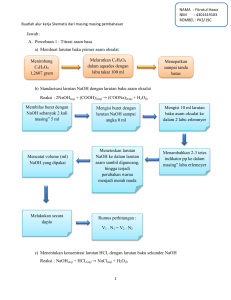
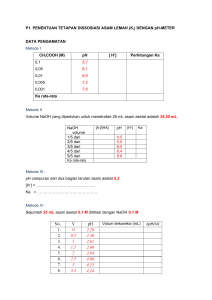
NAMA : Fitrotul Hawa NIM : 4301419103 ROMBEL : PK3/19C Buatlah alur kerja Skematis dari masing masing pembahasan Jawab : A. Percobaan 1 : Titrasi asam basa a) Membuat larutan baku primer asam oksalat Menimbang C2H2O4 1,2607 gram Melarutkan C2H2O4 dalam aquades dengan labu takar 100 ml Menepatkan sampai tanda batas b) Standarisasi larutan NaOH dengan larutan baku asam oksalat Reaksi : 2NaOH(aq) + (COOH)2(aq) → (COONa)2(aq) + H2O(l) Membilas buret dengan NaOH sebanyak 2 kali masing” 5 ml Mencatat volume (ml) NaOH yang dipakai Melakukan secara duplo Mengisi buret dengan larutan NaOH sampai angka 0 ml Mengisi 10 ml larutan baku asam oksalat ke dalam 2 labu erlenmyer Meneteskan larutan NaOH ke dalam larutan asam sambil diguncang, hingga terjadi perubahan warna menjadi merah muda Menambahkan 2-3 tetes indikator pp ke dalam masing” labu erlemeyer Rumus perhitungan : V1 . N1 = V2 . N2 c) Menentukan konsentrasi larutan HCL dengan larutan baku sekunder NaOH Reaksi : NaOH(aq) + HCL(aq) → NaCl(aq) + H2O(l) 1 Mengisi buret dengan larutan NaOH yang telah ditentukan konsentrasinya.ditentukan konsentrsinya Mengisi 10 ml larutan HCL ke dalam 2 labu erlenmeyer. Dan tambahkan 2-3 tetes larutan PP Meneteskan larutan NaOH ke dalam larutan asam sambil diguncang, hingga terjadi perubahan warna menjadi merah muda Mencatat volume (ml) NaOH yang dipakai Dan dilakukan secara duplo Rumus perhitungan : V1 . N1 = V2 . N2 d) Membuat kurva titrasi Memasukkan 10 ml larutan HCl 0,1 M ke dalam erlenmeyer Mengukur pH setiap penambahan NaOH. Mengukur dan mencatat pH larutan HCl Menambahkan 1 ml larutan NaOH dari buret pada larutan HCl kemudian guncangkan 2 Menyiapkan buret dan mengisi dengan larutan NaOH sampai tepat angka 0 ml Menyiapkan buret dan mengisi dengan larutan NaOH sampai tepat angka 0 ml Memasukkan 10 ml larutan CH3COOH 0,1 M ke dalam erlenmeyer Menyiapkan buret dan mengisi dengan larutan NaOH sampai tepat angka 0 ml Mengukur dan mencatat pH larutan CH3COOH Menambahkan 1 ml larutan NaOH dari buret pada larutan CH3COOH kemudian guncangkan Mengukur pH setiap penambahan NaOH Menyiapkan buret dan mengisi dengan larutan NaOH sampai tepat angka 0 ml. B. Percobaan 2 : Koloid a. Pembuatan koloid dengan cara kondensasi Pembuatan sol Fe(OH)3 Menyediakan dua gelas kimia 250 ml yang bersih Gelas kimia I di isi dengan 100 ml air suling dan menambahkan tetes demi tetes larutan FeCl3 jenuh 5 ml Menambahkan tetes demi tetes larutan FeCl3 jenuh 5 ml kedalam larutan yang sedang mendidih sambil diaduk Gelas kimia II diisi air suling 100 ml dan dipanaskan sampai mendidih Mengamati dan mencatat warna kedua larutan 3 Pembuatan sol As2S3 b. Memasukkan serbuk As2O3 5 𝑔𝑟𝑎𝑚 𝑘𝑒 𝑑𝑎𝑙𝑎𝑚 𝑙𝑎𝑏𝑢 𝑒𝑟𝑙𝑒𝑛𝑚𝑒𝑦𝑒𝑟 250 𝑚𝑙 Mengamati dan mencatat warna yang terbentuk Menambahkan sedikit demi sedikit air suling sebanyak 100 ml Ke dalam larutan tadi alirkan gas H2S sampai jenuh Memanaskan campuran sampai mendidih sambil terus diaduk Setelah larut, dinginkan hingga mencapai temperatur kamar Pembuatan koloid dengan cara dispersi Memasukan satu sendok teh amilum dan 10 ml air suling ke dalam gelas kimia I 50 ml Aduk campuran tadi dan saring Menambahkan kedua filtrat masing" 3 tetes larutan Iodium. bandingkan warna kedua filtrat tersebut Menampung kedua filtrat dalam tabung reaksi kecil dan amati warna pada filtrat 4 Memasukkan satu sendok teh amilum yang telah digerus dan 10 ml air suling ke dalam gelas kimia II Aduk campuran tadi dan saring c. Pembuatan emulsi Memasukkan 2 ml kerosin dan 4 ml air suling ke dalam tabung reaksi besar Mengocok dengan kuat dan letakkan tabung dalam rak Menambahkan 2 ml larutan sabun, kocok dengan kuat Meletakkan tabung di rak dan amati perubahan selama 510 menit Mengamati waktu yang diperlukan untuk pemisahan kedua komponen d. Pembuatan Gel Memasukkan 1,5 ml larutan kalsium asetat jenuh ke dalam tabung reaksi besar Menambahkan 8,5 ml alkohol 95% dan mengamati perubahan yang terjadi Memasukkan sedikit hasil pencampuran ke dalam cawan porselin Membakar campuran tadi kemudian mengamati perubahan yang terjadi 5 e. Efek tyndall Menyediakan 4 gelas kimia 250 ml Menempatkan keempat gelas kimia di ruang gelap Memasukkan 100 ml hasil percobaan a.1 (lar FeCl3) ke dalam gelas kimia I Memasukkan 100 ml air suling ke dalam gelas kimia IV Memasukkan 100 ml hasil percobaan a.2 (Fe(OH)3) ke dalam gelas kimia II Memasukkan 100 ml hasil percobaan b ke dalam gelas kimia III Melewatkan cahaya dari lampu senter melalui lubang kecil dengan arah tegak lurus pada gelas kimia Mengamati berkas cahaya dengan arah tegak lurus Mencatat hasil pengamatan f. Koagulasi Pengaruh elektrolit Menyiapkan 3 tabung reaksi Memasukkan 2 ml sol Fe(OH)3 hasil percobaan a.2 ke dalam 3 tabung Memasukkan 1 ml larutan BaCl2 1 M ke dalam tabung reaksi kedua Memasukkan 1 ml larutan AlCl3 1 M ke dalam tabung reaksi ketiga Mengamati urutan kecepatan koagulasi dan mencatat waktu sampai terjadinya penggumpalan Membandingkan hasil percobaan tersebut 6 Memasukkan 1 ml larutan NaCl 1 M ke dalam tabung reaksi pertama Di masukkan secara bersama Pengaruh sol lain 1. • Mencampurkan 5 ml Fe(OH)3 dengan 5 ml sol As2S3 2. • Mengamati apakah terjadi koagulasi 3. • Mencatat waktu yang diperlukan untuk menggumpal g. Adsorpsi Menyediakan 2 buah tabung reaksi kecil Memasukkan 5 ml air suling dan 1/2 sendok teh gula aren ke dalam masing" tabung Mengocok hingga larut Meletakkan tabung kedua dalam gelas kimia yang berisi air panas sambil di aduk Menambahkan 1/4 sendok teh norit atau karbon aktif ke dalam tabung kedua Tabung pertama disimpan sebagai pembanding Setelah 10 menit saring campuran tsb dan filtratnya di tampung ke dalam tabung reaksi lain Membandingkan warna filtrat hasil ssaringan dengan larutan gula pada tabung pertama 7 2. Persiapan teoritik A. Percobaan 1: titrasi asam basa 1. Tujuan titrasi adalah Jawab : Menentukan konsentrasi atau kadar suatu zat yang tidak diketahui dengan menggunakan zat yang telah diketahui kadarnya. 2. Apa yang dimaksud dengan larutan baku primer dan larutan baku sekunder? Jawab : Larutan baku primer adalah larutan yang mengandung zat padat murni yang konsentrasi larutannya diketahui secara tepat melalui metode gravimetri (perhitungan massa), dapat digunakan untuk menetapkan konsentrasi larutan lain yang belum diketahui, sedangkan Larutan baku sekunder merupakan larutan yang mengandung suatu zat yang konsentrasinya tidak dapat diketahui dengan tepat karena berasal dari zat yang tidak pernah murni. Konsentrasi larutan ini ditentukan dengan pembakuan menggunakan larutan baku primer, biasanya melalui metode titrimetri. 3. Kesalahan titrasi terjadi bila? Jawab : Titik akhir titrasi dan titik ekivalen tidak berimpit sehingga didapatkan selisih antara titik akhir titrasi dan titik ekivalen . 4. Larutan 1 M artinya? Jawab : didalam 1 liter larutan terdapat 1 mol zat terlarut. 5. Hitung molaritas 250 ml larutan yang mengandung 6,3 gram kristal asam oksalat? Jawab : Di ket : massa kristal asam oksalat Volume M= = 𝑚𝑎𝑠𝑠𝑎 𝑚𝑟 X 6,3 𝑔𝑟𝑎𝑚 126,070 : 6,3 gram : 250 ml 1000 𝑉 X 1000 250 = 0,199 M ≈ 0,2 M 6. Berapa pH air murni? Jawab : Air murni bersifat netral dengan pH = 7 pada suhu 25℃. 7. Berapa pH larutan garam yang berasal dari basa kuat-asam kuat yang ekivalen? Jawab : Larutan garam dari asam kuat dan basa kuat umumnya tidak mengubah perbandingan konsentrasi 𝐻 + atau 𝑂𝐻 − dalam air. Oleh karena itu, larutannya bersifat netral dengan pH = 7. 8 8. Berapa pH larutan garam yang berasal dari basa kuat-asam lemah? Jawab : Larutan garam dari asam lemah dan basa kuat akan meningkatkan konsentrasi 𝑂𝐻 − dalam air. Sehingga larutannya bersifat basa dengan pH > 7. 9. Tulis reaksi ion dari hidrolisis garam dari basa kuat-asam lemah! Jawab : contoh garam : CH3COONa Raksi Ion : CH3COONa(aq) → CH3COO-(aq) + 𝑁𝑎 + (aq) Ion 𝑁𝑎 + bereaksi dengan air membentuk kesetimbangan sebagai berikut : Reaksi Hidrolisis : CH3COO-(aq) + H2O(l) → CH3COOH(aq) + 𝑂𝐻 − (aq) (bersifat basa) 10. Tuliskan rumus pH hidrolisis garam tersebut diatas? 𝑘𝑤 𝑂𝐻 − = √ 𝑘𝑎 [CH3COONa] 𝑝𝑂𝐻 = - log [𝑂𝐻 − ] 𝑝𝐻 = 14 – pOH B. Percobaan 2 : Koloid 1. Jelaskan apakah perbedaan dari larutan sejati, koloid, dan suspensi! Jawab : Larutan sejati adalah campuran antara fase terdispersi yang berwujut zat padat atau zat cair dengan medium pendispersi yang berupa zat cair. Koloid adalah suatu bentuk campuran yang keadaannya antara larutan dan suspensi. Suspensi adalah sediaan cair yang mengandung partikel padat tidak larut yang terdispersi dalam fase cair. NO 1. CIRI Ukuran BENTUK CAMPURAN LARUTAN SEJATI KOLOID SUSPENSI Kurang dari 1 nm Antara 1-100 nm Lebih besar dari 100 partikel 2. Sifat alami 3. Penampakan nm Homogen heterogen heterogen Tidak tampak Tampah dibawah Tampak dengan mata mikroskop telanjang Stabil Tidak stabil parikel 4. Kestabilan Stabil 9 5. Kemampuan Mudah melewati Mudah menembus Tidak bisa menembus menyaring kertas saring dan kertas saring tapi tidak kertas saring dan membran sel bisa menembus membran sel membran sel 6. Pengaruh Partikel tidak diam Partikel tidak Partikel dalam kondisi gravitasi dipengaruhi oleh diam pada partikel gravitasi, tetapi bisa diendapkan dengan sentrifuge 7. Difusi Berdifusi dengan Berdifusi dengan Tidak berdifusi partikel cepat perlahan 8. Fasa Satu fasa Dua fasa Dua fasa 9. contoh Larutan gula, spirtus, Sabun, susu, santan, Air sungai keruh, garam, cuka, udara, jelli, selai, mentega, campuran air dan pasir, air laut dan mayonais air kopi, minyak dengan air. 2. Tuliskan reaksi hidrolisis pada pembuatan sol besi! Jawab : FeCl3(aq)+ 3H2O(l) → Fe(OH)3(s) +3HCl(aq) 3. Apa yang dimaksud dengan : a. Efek tyndall : peristiwa penghamburan cahaya oleh partikel koloid. Contoh : sorot lampu mobil di udara yang berkabut. b. Gerak brown : gerak acak partikel koloid dalam medium pendispersi. Terjadi karena adanya tumbukan antara partikel” pendispersi dan partikel” terdispersi. c. Adsorpsi : proses penyerapan suatu zat yang bermuatan dipermukaan partikel koloid. Contoh : penjernihan air dengan tawas. d. Koagulasi atau penggumpalan : peristiwa pengendapan partikel-partikel koloid sehingga fase terdispersi terpisah dari medium pendispersinya. Contoh : pembentukan delta pada muara sungai. 10 Jawaban pertanyaan A. Percobaan 1 : titrasi asam basa A. Pertanyaan 1. Tentukan molaritas dan normalitas larutan baku asam oksalat ? Jawab D1. Ms asam oksalat (COOH)2.2H2O = 1,2607 gram Mr = 126,070 V = 100 mL D2. M = …..? N = …..? D3. Molaritas larutan asam oksalat = 𝑚𝑠 × 1000 𝑀𝑟 𝑉 1,2866 1000 = 126,070 × 100 = 0,01 × 10 = 0,1 M Normalitas larutan asam oksalat = M × valensi asam = 0,1 × 2 = 0,2 N 2. Tentukan normalitas dan molaritas larutan NaOH ? Jawab D1. Volume larutan asam oksalat Normalitas larutan baku asam oksalat Volume larutan NaOH rata-rata D2. N NaOH = …..? M NaOH = …..? D3. NaOH = (COOH)2.2H2O N1 × V1 = N2 × V2 N × 19,5 = 0,2 × 10 N= 0,2 × 10 19,5 2 = 19,5 = 0,1025 N 11 = 10 mL = 0,2 N = 19,5 mL N NaOH = M × valensi 0,1025 = M × 1 M = 0,1025 M 3. Tentukan normalitas dan molaritas larutan HCl ? Jawab D1. Volume larutan HCl Normalitas larutan NaOH Volume larutan NaOH rata-rata = 10 mL = 0,1025 M = 10,75 mL D2. N HCl = …..? M HCl = …..? D3. HCl = NaOH N1 × V1 = N2 × V2 N × 10 = 0,1025 × 10,75 N= = 0,1025 × 10,75 10 1,102 10 = 0,1102 N N = M × valensi 0,1102 = M × 1 M = 0,1102 M 4. Berdasarkan data yang diperoleh, buatlah kurva titrasi dengan mengalurkan pH terhadap volume NaOH yang ditambahkan (volume NaOH sebagai absis). Jawab 12 Kurva Titrasi HCl-NaOH berdasarkan percobaan 12 10 pH 8 6 4 2 10,6 10,8 11 12 10,6 10,8 11 12 10,4 10,2 10,1 10 9,9 9,8 9,7 9,6 9,4 9,2 9 8 7 5 3 1 0 Volume NaOH yang ditambahkan Kurva Titrasi CH3COOH-NaOH berdasarkan percobaan 12 10 6 4 2 10,4 10,2 10,1 10 9,9 9,8 9,7 9,6 9,4 9,2 9 8 7 5 3 0 1 pH 8 Volume NaOH yang ditambahkan 13 5. Buatlah grafik kurva titrasi HCl-NaOH dan CH3COOH–NaOH secara teoritis/ perhitungan! Jawab Kurva Titrasi HCl-NaOH berdasarkan perhitungan 14 12 pH 10 8 6 4 2 10,6 10,8 11 12 10,6 10,8 11 12 10,4 10,2 10,1 10 9,9 9,8 9,7 9,6 9,4 9,2 9 8 7 5 3 1 0 Volume NaOH yang ditambahkan Kurva Titrasi CH3COOH-NaOH berdasarkan perhitungan 14 12 8 6 4 2 10,4 10,2 10,1 10 9,9 9,8 9,7 9,6 9,4 9,2 9 8 7 5 3 0 1 pH 10 Volume NaOH yang ditambahkan 14 6. Dari kurva titrasi HCl-NaOH, berapa pH campuran pada saat titik ekivalen secara empiris/ grafis ? Jawab 7 7. Dari kurva titrasi CH3COOH-NaOH , tentukan harga Ka asam asetat? Jawab D1. pH = 9 D2. Ka = …..? D3. pH = 14 – pOH 9 = 14 – pOH pOH = 14 – 9 =5 pOH = - log [OH-] 5 = - log [OH-] 5 = [OH-] − 𝑙𝑜𝑔 10-5 = [OH-] 𝐾𝑤 [OH-] = √ 𝐾𝑎 × 𝑀 1014 10-5 = √ 𝐾𝑎 × 10−1 10-5 = √ 10-10 = 10−15 𝐾𝑎 10−15 𝐾𝑎 10−15 Ka = 10−10 = 10-5 8. Berapa perkiraan pH campuran ekivalen CH3COOH-NaOH secara grafis/ empiris? Jawab 9 (lebih dari 7) 15 9. Berapa pH campuran ekivalen CH3COOH-NaOH secara teoritis, jika Ka CH3COOH = 1,8.10-5 Jawab D1. Ka CH3COOH = 1,8 × 10-5 D2. pH = …..? 𝐾𝑤 D3. [OH-] = √ 𝐾𝑎 × 𝑀 10−14 = √1,8 ×10−5 × 0,1 = √0,5 × 10−10 = 0,7 × 10-5 pOH = - log [OH-] = - log 0,7 × 10-5 = 5 – log 0,7 = 5 – (-0,15) = 5 + 0,15 = 5,15 pH = 14 – pOH = 14 – 5,15 = 8,85 B. Percobaan 2 : koloid 1. Mengapa warna larutan FeCl3 berubah ? Jawab : Karena adanya reaksi kimia yang terjadi pada H2O saat pencampuran FeCl3 reaksi kimia tersebut adalah reaksi hidrolisis yang merupakan salah satu bagian dari pembuatan koloid dengan cara kondensasi. Perubahan warna yang terjadi menjadi warna yang gelap tersebut menandakan bahwa sol sudah terbentuk. 2. Mengapa warna larutan As2O3 berubah ? (Percobaan tidak dilakukan) 3. Apakah perbedaan amilum yang tidak digerus dengan amilum yang digerus? Jawab : Amilum tanpa digerus : ukuran partikelnya besar sehingga pada saat disaring partikelpartikel yang ukurannya lebih besar dari koloid tidak dapat melewati kertas saring Amilum yang digerus : amilum yang gumpalan materinya diubah menjadi lebih kecil sehingga tersebar dan berukuran koloid dan koloid merupakan partikel diskrit yang terdapat dalam suspensi air baku, dimana partikel inilah yang menjadi penyebab utama kekeruhan. 16 4. Mengapa Kalsium asetat sampai membentuk gel ? Apa yang terjadi pada pembakaran gel itu? Jawab : Karena saat Kalsium asetat jenuh ditambah dengan pelarut alkohol akibatnya terjadi pergantian pelarut antara pelarut air dan alkohol, karena kalsium asetat sukar larut dalam alkohol terbentuklah koloid yang berupa gel. Apabila gel kemudian dibakar maka terbentuk api yang berwarna biru tapi tidak terlalu nampak dan sisa pembakaran berupa kalsium asetat padat. 5. Apakah pengaruh larutan elektrolit terhadap kestabilan koloid ? Jawab : Semakin banyak elektrolit yang ditambahkan maka semakin stabil koloid tersebut. 6. Apa kesimpulan dari hasil pengamatan 5 dihubungkan dengan efek Tyndall ? Jawab : Efek Tyndall adalah peristiwa terhamburnya cahaya oleh partikel koloid. Partikel koloid dan suspensi cukup besar untuk dapat menghamburkan sinar, sedangkan partikelpartikel larutan berukuran sangat kecil sehingga tidak dapat menghamburkan cahaya. 7. Dari hasil pengamatan anda, anion atau kationkah yang berpengaruh terhadap terjadinya koagulasi sol Fe(OH)3 dan sol As2O3 ? Bagaimana pendapat anda tentang muatan dari sol Fe(OH)3 dan sol As2O3 ? Jelaskan. (Percobaan tidak dilakukan) 8. Kesimpulan apa yang dapat saudara ambil dari pencampuran Fe(OH)3 dan As2S3 ? (Percobaan tidak dilakukan) 9. Apakah kesimpulan anda tentang sifat molekul sabun ? manakah gugus yang bersifat hidrofil dan mana yang hidrofob ? Jawab : Sabun memiliki rumus umum RCOONa. Dalam air, ion-ion Na+ terlepas dari ionion RCOO-. Rantai R bersifat nonpolar sehingga tidak dapat menarik air, tetapi mampu menarik minyak. Sedangkan -COO bersifat hidrofil mampu menarik air. 17