percobaan i - Laboratorium Kimia Dasar ITB
advertisement

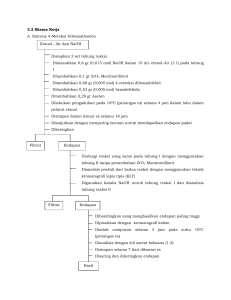
STOIKIOMETRI REAKSI KIMIA 29 September 2014 – 07 Oktober 2014 Laboratorium Kimia Dasar, BSC B Program Studi Kimia, FMIPA Institut Teknologi Bandung proses yang mengakibatkan perubahan satu atau lebih zat menjadi zat lain yang berbeda sifatnya dengan melibatkan penataulangan elektron Reaksi kimia dapat ditandai dengan: • perubahan warna • perubahan suhu • pembentukan endapan • pembentukan gas • perubahan pH Stoikiometri berasal dari bahasa Yunani, stoikheion (elemen) dan metria (ukuran) Stoikiometri adalah bagian dari ilmu kimia yang mempelajari tentang hubungan kuantitatif dalam suatu reaksi kimia Hukum-hukum dasar kimia: • Hukum Kekekalan Massa • Hukum Perbandingan Tetap • Hukum Perbandingan Berganda • dll • Ditemukan oleh P. Job (1928) • Metoda ini dilakukan dengan menyiapkan komposisi pereaksi yang bervariasi, tapi dengan jumlah mol total yang sama (mol A + mol B = konstan) • Metoda ini didasarkan pada pengamatan perubahan yang terjadi, seperti perubahan suhu, pertambahan atau pengurangan massa, dll Contoh: Perhitungan mol (× 103) Kondisi Vol. AgNO3 0,24 M (mL) Vol. K2CrO4 0,24 M (mL) 1 5 45 50 1,20 10,80 12,0 2 10 40 50 2,40 9,60 12,0 3 15 35 50 3,60 8,40 12,0 4 20 30 50 4,80 7,20 12,0 5 25 25 50 6,00 6,00 12,0 6 30 20 50 7,20 4,80 12,0 7 35 15 50 8,40 3,60 12,0 8 40 10 50 9,60 2,40 12,0 9 45 5 50 10,80 1,20 12,0 Vol. Total larutan (mL) AgNO3 K2CrO4 Total Kondisi 1 mol. AgNO3 mol. K2CrO4 (× 103) (× 103) 1,20 10,80 Massa produk (g) 0,225 2 2,40 9,60 0,396 3 3,60 8,40 0,564 4 4,80 7,20 0,696 5 6,00 6,00 0,885 6 7,20 4,80 1.030 7 8,40 3,60 1,194 8 9,60 2,40 0,892 9 10,80 1,20 0,598 1.2 massa endapan, g 1.0 0.8 0.6 0.4 0.2 0 2 4 6 8 10 12 3 mol AgNO3( x 10 ) • Kondisi 7 memberikan hasil maksimum (mol AgNO3 : mol K2Cr2O4 = 8,4: 3,6 ~ 2: 1) • perbandingan stoikiometri reaksi AgNO3 dengan K2CrO4 adalah 2:1 • rumus molekul endapan yang dihasilkan adalah Ag2CrO4 6 5 4 3 2 1 0 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 2.5 3 5 4.5 4 3.5 3 2.5 2 1.5 1 0.5 0 0 0.5 1 1.5 2 3.5 4 4.5 5 1. Penentuan persentase hasil (% yield) untuk reaksi timbal(II) asetat dan kalium iodida 2. Penentuan titik maksimum dan perbandingan mol reaksi a. Tembaga(II) sulfat dan natrium hidroksida b. Asam klorida dan natrium hidroksida c. Asam sulfat dan natrium hidroksida Percobaan Larutan Komposisi Pengukuran I Pb(OAc)2 dan KI 2 mL dan 2 mL 2 NaOH dan CuSO4 40 mL dan 10 mL 2 NaOH dan CuSO4 30 mL dan 20 mL 2 NaOH dan CuSO4 20 mL dan 30 mL 2 NaOH dan CuSO4 10 mL dan 20 mL 2 NaOH dan HCl 5 mL dan 25 mL 2 NaOH dan HCl 10 mL dan 20 mL 2 NaOH dan HCl 15 mL dan 15 mL 2 NaOH dan HCl 20 mL dan 10 mL 2 NaOH dan HCl 25 mL dan 5 mL 2 NaOH dan H2SO4 5 mL dan 25 mL 2 NaOH dan H2SO4 10 mL dan 20 mL 2 NaOH dan H2SO4 15 mL dan 15 mL 2 NaOH dan H2SO4 20 mL dan 10 mL 2 NaOH dan H2SO4 25 mL dan 5 mL 2 II III IV 1. Bagian I • • catat massa dengan tepat sebelum menimbang campuran, pisahkan antara cairan dan endapan yang terbentuk dengan cara dekantasi 2. Bagian II, III, dan IV • • • pastikan suhu awal tiap larutan sama, rendam gelas kimia yang berisi larutan di dalam wadah (baki peralatan) yang telah diisi oleh air gunakan termometer yang sama untuk pekerjaan yang sama pegang termometer di bagian atas dan termometer jangan mengenai alat gelas 3. Gunakan bahan yang tersedia dengan bijaksana 4. Utamakan keselamatan kerja Ada pertanyaan? • Silahkan bawa laptop (1 laptop untuk 2 orang) • Silahkan unduh aplikasi Avogadro (avogadro.cc/Wiki/Get_Avogadro) • Alternatif: aplikasi akan kami unggah di grup Facebook Praktikum Kimia Dasar 2014 • Setelah diunduh, silahkan install dan pelajari aplikasi tersebut