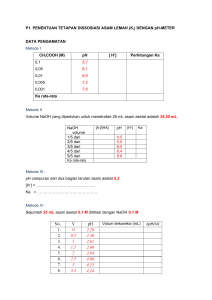
LAPORAN PRAKTIKUM SINTESIS DAN KARAKTERISASI ETIL ASETAT DARI ETHANOL DAN ASAM ASETAT MELALUI REAKSI ESTERIFIKASI diajukan untuk memenuhi salah satu Tugas Mata Kuliah Praktikum Kimia Pemisahan dan Pengukuran Dosen Pengampu : Dr. Ratnaningsih Eko Sardjono, M.Si Dra. Gebi Dwiyanti, M.S Tanggal Percobaan : Awal : 16 Februari 2021 Akhir : 22 februari 2021 Disusun oleh : Asep Royani (1805838) DEPARTEMEN PENDIDIKAN KIMIA FAKULTAS PENDIDIKAN MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS PENDIDIKAN INDONESIA BANDUNG 2021 SINTESIS DAN KARAKTERISASI ETIL ASETAT DARI ETHANOL DAN ASAM ASETAT MELALUI REAKSI ESTERIFIKASI Tanggal percbaan : -Awal : 16 Februari 2021 -Akhr : 22 februari 2021 A. Tujuan Percobaan ini bertujuan untuk : 1. memahami proses sintesis etil asetat dari etil alkohol dan asam asetat melalui reaksi esterifikasi 2. Memahami rangkaian proses sintesis etil asetat 3. Mampu menghitung rendemen etil asetat hasil reaksi 4. Mengkarakterisasi etil asetat dengan metode kromatografi GC B. Dasar Teori Ester diturunkan dari asam karboksilat. Sebuah asam karboksilat mengandung gugus -COOH, dan pada sebuah ester hidrogen di gugus ini digantikan oleh sebuah gugus hidrokarbon dari beberapa jenis. Disini kita hanya akan melihat kasus-kasus dimana hidrogen pada gugus -COOH digantikan oleh sebuah gugus alkil, meskipun tidak jauh beda jika diganti dengan sebuah gugus aril yang berdasarkan pada sebuah cincin benzena. (Clark,2007) Suatu ester asam karboksilat ialah suatu senyawa yang menggandung gugus –CO2R dengan -R dapat berbentuk alkil maupun aril. Suatu ester dapat dibentuk dengan reaksi langsung antara suatu asam karboksilat dan suatu alkohol, yang disebut reaksi esterifikasi. Esterifikasi berkataliskan asam dan merupakan reaksi yang reversibel (Fessenden, dan Joan, 1982) Alkil ester yang tidak dihalangi dapat dibuat melalui reaksi esterifikasi sederhana dengan memanaskan suatu asam karboksilat dengan suatu alkohol dan sedikit asam kuat. Hidrolisis dalam suasana asam dari suatu ester menghasilkan asam karboksilat dan alkohol. Reaksi ini adalah reaksi kebalikan dari esterifikasi langsung suatu asam karboksolat dengan alkohol (Fessenden, 1997) Reaksi asam karboksilat dengan alkohol menghasilkan senyawa ester melalui reaksi yang dikenal dengan nama esterifikasi, dan biasanya menggunakan katalis asam. Reaksi akan berlangsung dengan baik jika direfluks bersama sedikit asam sulfat atau asam klorida. Di indusri dan di laboratorium etil asetat dibuat dengan memanaskan etanol dengan asam asetat glasial dengan penambahan asam sulfat. Reaksi antara asam asetat dan etanol dengan katalis asam sulfat akan menghasilkan etil ester dan air (Azura dkk., 2015) Reaksi esterifikasi bersifat reversible. Jika pemanasannya melebihi suhu yang semestinya maka reaksi yang dihasilkan akan kembali menjadi reaktan sehingga Reaksi berlangsung perlahan-lahan, biasanya membutuhkan banyak waktu untuk mencapai keseimbangan. Menurut prinsip Le Chatelier, hasil dari ester dapat ditingkatkan dengan meningkatkan konsentrasi reaktan. reaksi lebih cepat pada suhu yang lebih tinggi, esterifikasi dilakukan pada titik didih campuran reaksi. Penmanasan dilakukan dengan refluks, yaitu dengan cara memanaskan campuran atau larutan tanpa mengurangi volume larutannya dengan adanya kondensasi dapat mengubah uap menjadi cair. Agar reaksinya berlangsung cepat dan sempurna dilakukan penambahan katalis berupa katalis asam (Suryawanshi et all., 2014) Jika asam karboksilat dengan alkohol dan katalis asam (biasanya HCl dengan H2SO4) dipanaskan, terdapat kesetimbangan dengan ester dan air. Proses ini dinamakan esterifikasi Fischer, yaitu berdasarkan nama Emil Fischer, kimiawan organik abad 19 yang mengembangkan metode ini. Walaupun reaksi ini adalah reaksi kesetimbangan, dapat juga digunakan untuk membuat ester dengan hasil yang tinggi dengan menggeser kesetimbangan ke kanan. Hal ini dapat dicapai dengan beberapa teknik, jika alkohol atau asam murah, dapat digunakan dalam jumlah yang berlebihan, cara lain adalah dengan memisahkan ester dan/atau air yang terbentuk (dengan penyulingan), sehingga menggeser reaksi ke kanan (Hart, 1983) Pembuatan turunan ester dilakukan dengan membuat turunan asam karboksilat dan alkoholnya. Ester mula-mula dilakukan reaksi hidrolisis dari asam karboksilat serta alkohol yang dihasilkan dipisahkan. Data-data asam karboksilat dan alkohol yang diperoleh dengan mereaksikan NaOH dengan pelarut etilen glikol air yang dipanaskan. Hasil safonifikasi ini kemudian diasamkan untuk mendapatkan karboksilat. Jika diperoleh endapan asam karboksilat berupa cairan yang tidak larut dalam air dapat diekstraksi dengan ester. Hasil ekstrak dengan ester dikeringkan dengan MgSO4 anhidrat. Pelarut eter diuapkan sehingga diperoleh asam karboksilat penyusun ester (Anwar, 1994) Etil asetat juga dikenal dengan nama acetc ether adalah pelarut yang banyak digunakan pada industry cat, tinta, plastic, farmasi dan industri kimia organik. Etil asetat adalah cairan bening yang tidak berwarna dan berbau khas. Pada skala industry, etil asetat diproduksi dari reaksi esterifikasi antara asam asetat (CH3COOH) dan etanol (C2H5OH), dengan bantuan katalis dalam suasana asam (H2SO4). Selain melalui reaksi di atas, etil asetat juga diprduksi secara komersil melalui reaski antara eilen dan asam asetat. Namun dari sisikeekonomian, etil asetat dari etanol dan asam asetat lebih kompetitif. (Fuad, 2012) Etil asetat sifatnya polar menengah atau semipolar yang volatil dan dapat melarutkan senyawa semipolar pada dinding sel seperti aglikon flavonoid. Etil asetat tidak beracun dan tidak higroskopis. Di samping itu, etil asetat digunakan sebagai pelarut karena etil asetat dapat menyari senyawa-senyawa yang memberikan aktivitas antibakteri, diantaranya flavonoid polihidroksi dan fenol lain (Wardhani dan Nanik, 2012) Esterifikasi asam organik dan alkohol merupakan salah satu reaksi yang paling mendasar dan penting dalam industri kimia. Produk-produk esternya secara luas dimanfaatkan sebagai pelarut dan pengemulsi dalam industri makanan (tepung), farmasi serta kosmetik ataupun pelumas dalam pengolahan logam, industri tekstil dan plastik. Saat ini perhatian atas rekayasa pada reaksi esterifikasi dan produk esternya telah semakin meningkat, terutama setelah alkil ester (metil ester, etil ester dan profil ester) memiliki karakteristik sebagai solar bio, sehingga dapat menggantikan bahan bakar fosil (Susanto, et al., 2008) Ekstraksi adalah penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak larut dengan pelarut cair. senyawa aktif yang terdapat dalam berbagai senyawa dapat digolongkan kedalam golongan minyak atsiri, alkaloid, flavanoid dan lainlain. dengan diketahui senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat (Ditjen POM, 2000) Pembagian metode ekstraksi menurut Ditjen POM (2000)yaitu: a) Ekstraksi secara dingin yaitu maserasi, perkolasi b) Ekstraksi secara panas yaitu refluks, sokletasi, digestasi, infundasi dan dekok Prinsip kerja pada metode refluks yaitu penarikan komponen kimia yang dilakukan dengan cara sampel dimasukkan ke dalam labu alas bulat bersama-sama dengan cairan penyari lalu dipanaskan, uap-uap cairan penyari terkondensasi pada kondensor bola menjadi molekul-molekul cairan penyari yang akan turun kembali menuju labu alas bulat, akan menyari kembali sampel yang berada pada labu alas bulat, demikian seterusnya berlangsung secara berkesinambungan sampai penyarian sempurna, penggantian pelarut dilakukan sebanyak 3 kali setiap 3-4 jam. Filtrat yang diperoleh dikumpulkan dan dipekatkan (Akhyar,2010) C. Alat dan Bahan a) Alat 1. Labu erlenmeyer 2. Magnetic stirrer 3. Pipet tetes 4. Reflux dan kondensor 5. Labu dasar bulat 6. Corong pisah 7. Klem dan statif 8. Gelas kimia b) Bahan 1. Asam asetat glasial : 60 g 4. Natrium karbonat 2. Etanol 95% 5. Magnesium Sulfat Anhidrat : 100 mL 3. Asam sulfat 98% : 2 mL 6. Aquades : secukupnya D. Spesifikasi Bahan No 1. Nama bahan Aquades (H2O) Sifat fisika - 0 0 Berwujud cairan berwarna dan Sifat kimia tidak tiddak - berbau 0 Bersifat polar Merupakan universal - Titik didih : 100 ˚C - Titik leleh : 0 ˚C antar - Densitas : 1 g/cm3 kuat - Bahaya - Dapat pelarut menimbulkan - Memiliki gaya tarik molekul yang Penanggulangan Jauhkan kontak ledakkan ketika bereaksi langsunng dengan dengan logam reaktif logam reaktif 2 Asam asetat glasial (CH3COOH/C2H4O2) Sifat Fisika - 2 3 0 - Sifat Kimia Berwujud cairan berwarna dan tidak berbau Produk secara ini stabil kimiawi di pedih bawah kondisi Titik didih awal/rentang ruangan standar (suhu didih : 117,9 °C pada kamar) 1.013,25 hPa - Dapat larut dalam air - Titik lebur : 16,64 °C - Mudah menyala - Densitas uap : 2,07 Bahaya - - Penanggulangan Dapat mengakibatkan - Segera bilas dengan iritasi pada mata dan kulit air Campuran lepaskan bersifat pada uap/udara mudah-meledak pemanasan yang menyengat mengalir dan semua pakaian yang terkontaminasi oleh zat - Jauhkan dari sumber api/panas 3 Etanol 95% Sifat fisika 3 2 0 Sifat kimia Berwujud cairan berwarna dan tidak sedikit - Dapat larut dalam air Produk ini stabil berbau secara kimiawi di - Titik didih : 78,3 oC bawah - Titik lebur -114,5 °C ruangan standar (suhu - Densitas : 0,790 - 0,793 kamar) kondisi g/cm3 Bahaya - - - Cairan Penanggulangan dan uap amat - Jauhkan dari sumber mudah menyala. api/panas Menyebabkan iritasi mata - Bilas dengan seksama yang serius dengan air untuk Bahaya jika terhirup - beberapa menit. Lepaskan lensa kontak jika memakainya dan - mudah melakukannya.Lanjutk an membilas. - Jika terhirup segera menuju udara segar 4 Asam sulfat (H2SO4) 0 3 0 Sifat fisika Sifat kimia - Berwujud cair tidak berwarna - pH 0,3 pada 49 g/L 25◦C - Tidak berbau - Korosif - Massa molar 98,08 g/mol - Higroskopis - Titik lebur -20◦C - Stabil - Titik didih 335◦C pada 1.013 hPa - Densitas 1,84 g/cm3 pada 20◦C - Larut dalam air pada 20◦C Bahaya - Korosif terhadap logam - Menyebabkan kulit terbakar dan kerusakan mata - Iritasi Penanggulangan - Jika tertelan: basuh mulut, minum gelas, 2 jangan merangsang muntah - Jika terkena mata: bilas dengan air beberapa menit. - Jika terhirup : hirup udara segar - Jika kontak dengan kulit: pakaian, tanggalkan bilas dengan air mengalir 5. Natrium Karbonat (Na2CO3) Sifat fisika - Berwujud padat, serbuk, 0 2 atau kristal serbuk dan 1 Sifat kimia - Stabil - Higroskopis granaul - Berwarna putih - Tidak berbau - Berat molekul 105,99 g/mol - Titik lebur 851°C - Larut dalam air panas dan gliserol - Larut sebagian dalam air dingin - Tidak larut dalam aseton dan alkohol Bahaya - Menyebabkan iritasi Penanggulangan - Jika terkena mata: mata, sistem pernapasan, bilas dengan dan kulit beberapa menit. air - Jika terhirup : hirup udara segar - Jika kontak dengan kulit: bilas dengan air mengalir selama 15 menit 6. Magnesium Sulfat Anhidrat (MgSO4) 0 1 Sifat fisika - Berwujud padatan berwarna putih tidak 0 Sifat kimia - Kelarutan dalam air 710 g/l pada 20 °C berbau - Titik lebur : 1,124 °C - Densitas 1,68 g/cm3 pada 20 °C - Produk ini stabil secara kimiawi di bawah kondisi ruangan standar (suhu kamar) Bahaya Penanggulangan - Irittasi pada mata dan kulit - Gangguan pernafasan jika terhirup - Basuh dengan air mengalir kurang lebih 5-10 menit - Segera menuju udara segar jika terhirup dalam durasai yang cukup lama Labchem Fisher Scientific (2012). Material Safety Data Sheet. [Online]. Diakses dari www.fishersci.com [14 Februari 2021]. MerckMillipore. (2020). Material Safety data Sheet. [Online]. Diakses dari www.merckmillipore.com [14 Februari 2021]. Smartlab. (2017). Material Safety data Sheet. [Online]. Diakses dari www.smartlab.co.id [14 Februari 2021] E. Prosedur Percobaaan dan pengamatan No 1. Langkah Kerja Pengamatan - Asam asetat glasial berwujud cairan berwarna Proses Esterifikasi keruh seulas Etanol (100 mL) + Asam asetat glasial - dimasukkan ke - Etanol berwujud cairan tidak berwarna dalam labu - Asama sulfat berwujud cairan berwarna erlenmeyer yang berada diatas coklat seulas hotplate dan berisi stirring bar - Volume ethanol = 100 mL - ditambahkan 2 mL asam sulfat - Massa asam asetat = 60 g pekat secara perlahan melalui - Volume asam sulfat = 2 mL dinding labu erlenmeyer - Ketika etanol dicampurkan dengan asam - dihomogenkan dengan pengadukan asetat glasial ke dalam labu erlenmayer, maka konstan teramatai kedua larutan dapat saling - diset alat refluks melarutka dengan warna campuran berwarna - dipasangkan selang ditiap aliran air keruh seulas, begitu pun ketika asam sulfat pada kondensor dengan bagian dicampurkan ke dalam labu erlenmayer berisi bawah aliran masuk air campuran etanol dan asam asetat - dialirkan kondensor air dingin pada - direfluks selama 1 jam - didinginkan hingga mencapai suhu kamar - diambil sedikit untuk dikarakterisasi Campuran dalam labu erlenmeyer 2. Destilasi - dilakukan destilasi disekitar titik didih etil asetat (82o C) dengan mengganti kondensor refluks dengan set alat destilasi - ditampung destilat pertama hasil - hasil destilasi diperkirakan mengandung etil asetat, ethanol, dan sisa destilasi - destilat asam dihentikan destilasi setelah 20 mL campuran telah berkurang - diambil sedikit untuk karakterisasi Destilat 3. Ekstraksi Cair-Cair - pada saat natrium karbonat ditambahkan pada destilat dalam corong pisah, maka Destilat dapat teramati adanya 2 buah lapisan yaitu - dimasukan menggunakan corong lapisan atas (fasa organik) yang kaca kedalam corong pisah yang merukapakam larutan etil asetat dengan telah diset warna larutan tidak berwarna dan lapisan bawah - dicuci sebanyak 2 kali dengan yang merupakan Na2CO3 dan pengotor berwarna putih keruh larutan natrium karbonat jenuh untuk memastikan seluruh destilat masuk kedalam corong pisah - dikocok dan didiamkan hingga terbentuk 2 lapisan Lapisan bawah (lapisan aqueous) - Sebelum ditambahkan MgSO4 anhidrat teramati larutan keruh yang menandakan masih adanya air - dialirkan kedalam gelas kimia kering dan bersih Setelah teramati berwarna) Lapisan atas (lapisan organik) ditambahkan larutan MgSO4 menjadi anhidrat jernih yang menandakan air (tak telah berhasil dihilangkan - ditambahkan natrium larutan karbonat menghilangkan jenuh garam untuk garam dan senyawa polar seperti etanol dari campuran Hasil : Fasa organik yang sisa asam, fasa air, sisa garam, ethanol telah dihilangkan di dalam campuran organik tersebut - dialirkan kedalam gelas kimia bersih dan kering lainnya berisi stirring bar - diaduk dengan menyalakan magnetic stirrer - ditambahkan magnesium sulfat anhidrat untuk menghilangkan air hingga larutan menjadi bersih - disaring untuk menghilangkan magnesium sulfat - diambil sedikit untuk dikarakterisasi Hasil 4. Karakterisasi - Berdasarkan percobaan diperoleh massa total etil asetat 97 g Hasil Sintesis sebelum destilasi - dilakukan karakterisasi dengan asetat karena dianggap lartuan etil asetat spektroskopi raman yang diperoleh sebelumnya berada pada tingkat kemurnian yang rendah. Pemurnian Hasil Sintesis setelah destilasi - dilakukan karakterisasi menggunakan metode destilasi fraksional dengan karena spektroskopi raman - Hasil Sintesis setelah ekstraksi - dilakukan karakterisasi spektroskopi raman Dilakukan kembali pemurnian larutan etil dengan Diperoleh hasil karakterisasi menggunakan spektroskopi GC : 3 puncak yang menandakan masih adanya pengotor dan larutan etil asetat tidak berada dalam Hasil kemurnian yang tinggi Pemurnian ulang dengan destilasi - 5. - fraksional Tekanan eksternal (atm) = 985 atm Dalam destilasi ini memisahkan zat volatil yang mempunyai perbedaan titik didih yang Hasil sintesis etil asetat kecil : - dipindahkan etil asetat kedalam labu erlenmeyer kering Titik Didih Asetat/ethanol (69:31) = 71,8 ℃ berisi Titik Didih Etil Asetat = 77℃ stirring bar yang telah diset untuk Titik Didih Ethanol = 78 ℃ destilasi fraksional Titik Didih Asetat/air (93:7) = 70,4 ℃ - diset seluruh bagian untuk destilasi Titik Didih Asetat/ethanol/air (83:9:8) = fraksional 70,3 ℃ Hasil sintesis etil asetat - dalam labu erlenmeyer - dipanaskan dengan pengadukan hasil dalam keadaan murni karena titik didih etil asetat yang berdekatan dengan titik didih secara konstan - ditampung Selanjutnya, etil asetat sulit didapatkan destilat pada dari etanol (zat terlarut) wadah pada berbagai fraksi - ditutup wadah tiap destilat yang diperoleh - dihentikan setelah larutan dalam labu erlenmeyer tersisa sekitar 1020 mL Hasil 6. - Karakterisasi Diperoleh hasil puncak : 1 puncak yang menandakan hasil sintesis etil asetat Destilat 1-6 - dikarakterisasi dengan yang diperoleh telah murni menggunakan spektroskopi GC Hasil F. rencana pengolahan data Menentukan presentase rendemen % Rendemen = 𝑚𝑎𝑠𝑠𝑎 𝑒𝑡𝑖𝑙 𝑎𝑠𝑒𝑡𝑎𝑡 𝑝𝑒𝑟𝑐𝑜𝑏𝑎𝑎𝑛 𝑚𝑎𝑠𝑠𝑎 𝑒𝑡𝑖𝑙 𝑎𝑠𝑒𝑡𝑎𝑡 𝑡𝑒𝑜𝑟𝑖𝑡𝑖𝑠 x 100% G. Persamaan Reaksi H2SO4 1. CH3COOH + CH3CH2OH CH3COOH2CH3 + H2O 2. Mekanisme reaksi Gambar 1. Mekanisme reaksi sintesis etil asetat H. Data Pengamatan Kromatogram GC Gambar 2. Kromatogram Hasil Analisis Produk sintesis etil asetat sebelum destilasi bertingkat Gambar 3. Kromatogram Hasil GC Produk sintesis etil asetat sebelum destilasi bertingkat I. Pembahasan Praktikum yang berjudul “Sintesis Dan Karakterisasi Etil Asetat Dari Ethanol Dan Asam Asetat Melalui Reaksi Esterifikasi” bertujuan untuk memahami proses sintesis etil asetat dari etil alkohol dan asam asetat melalui reaksi esterifikasi, memahami rangkaian proses sintesis etil asetat, mampu menghitung rendemen etil asetat hasil reaksi dan mengkarakterisasi etil asetat dengan metode kromatografi GC. Etil asetat dapat disintesis melalui reaksi esterifikasi antara asam asetat (CH3COOH) dan etanol (C2H5OH) dengan bantuan katalis asam sulfat (H2SO4) dengan komposisi ketiga bahan tersebut yaitu etanol 95% (100 mL), asam asetat glasial (60 g), dan asam sulfat 98% (2 mL). Esterifikasi pada dasarnya adalah reaksi yang bersifat reversibel (dapat balik) karena ketika asam karboksilat (asam asetat) dan ethanol dipanaskan untuk bereaksi maka akan terjadi reaksi kesetimbangan antara ester dan air, artinya bahwa ester dan air yang terbentuk dapat kembali menghasilkan reaktan-reaktannya yaitu asam asetat dan ethanol. Oleh karena itu, untuk memperoleh hasil reaksi yang banyak maka diusahakan agar reaksi cenderung bergeser ke arah produk yaitu dengan cara reaktan dibuat berlebih yang dalam percobaan ini ethanol dibuat berlebih ketika direaksikan dengan asam asetat. Asam asetat glasial digunakan sebagai pereaksi pembatas Etil asetat yang akan disintesis merupakan senyawa yang berwujud cairan tidak berwarna dan sedikit berbau. Dalam prosesnya, sintesis etil asetat dapat terjadi melalui tahap reaksi esterifikasi senyawa asam asetat dengan alkohol pada suasana asam yang dipanaskan. Pada percobaan kali ini digunakan pula H2SO4 yang berfungsi sebagai katalis pada saat gugus karbonil diprotonasi oleh gugus H+ Karena digunakan katalis asam dari reaksi akan terbentuk kembali H+. Hal ini memberikan peluang untuk terjadinya protonasi. Protonasi ini sangat di butuhkan karena melihat bahwa OH pada gugus asam asetat merupakan gugus pergi yang jelek karna OH memiliki keelektonegatifan sehingga kemampuan untuk terikat pada C yang parsial (+) sangat besar (karena adanya perbedaan momen dipol menyebabkan OH enggan pergi) Pada percobaan ini, digunakan larutan H2SO4 sebagai katalis asam yang dapat mempercepat terjadinya reaksi, khususnya mempercepat dalam terbentuknya senyawa ester. Pada saat penambahan asam sulfat pekat, dilakukan pula pendinginan dikarenakan reaksi yang terjadi merupakan reaksi eksoterm. Pada percobaan ini juga dilakukan metode refluks yang bertujuan untuk memutuskan ikatan rangkap C dan O sehingga memudahkan gugus OH yang bertindak sebagai nukleofilik untuk menyerang karbon karbonil atau agar asetat yang dihasilkan lebih banyak Pada percobaan ini labu Erlenmeyer digunakan sebagai reactor atau tempat terjadinya reaksi yang dilengkapi dengan pendingin lurus atau pendingin liebig, hal ini karena dalam proses pemanasan tidak digunakan penangas melainkan menggunakan hotplate yang memungkinkan adanya kontak panas yang terjadi antar permukaan hotlplate dengan bagian dasar pada labu erlenmeyer. Metode pemanansan menggunakan hotplate ini dianggap kurang efektif karena penas tidak dapat menyebar secara merata pada seluruh bagian rekator, sehingga disarankan untuk menggunakan penangas air agar proses pemanasan dapat berjalan lebih efektif. Setelah proses refluks selesai dilakukan maka tahap selanjutnya yaitu dilaukan proses destilasi , yang bertujuan untuk memurnikan sampel etil asetat dari air atau pun zat pengotor lainnya. Destilat hasil destilasi kemudian ditambahkan dengan natrium karbonat sehingga terbentuk 2 buah fasa, yaitu fasa lapisan atas yang merupakan fasa organik dengan larutan tak berwarna/jernih (etil asetat) dan lapisan bawah berwarna putih keruh (sisa asam dalam air, Na2CO3 dan pengotor). Tujuan ditambahkannya natrium karbonat adalah untuk mengesktarksi asam-asam sisa dalam larutan etil asetat. Tahapan selanjutnya yaitu menambahkan MgSO4 ke dalam larutan yang diperoleh dengan tujuan untuk menghilangkan air yang masih terkandung di dalam larutan yang kemudian membentuk endapan yang berada di dasar wadah karena memiliki massa jenis yang lebih besar dari produk yang diinginkan. Lalu dilakukan penyaringan untuk menghilangkan magnesium sulfat dan diperoleh etil asetat. Setelah itu, dilakukan karakterisasi menggunakan kromatografi GC Dari hasil karakterisasi mengunakan kromatografi GC diperoleh hasil 3 puncak yang menandakan etil asetat yang diperoleh masih belum murni, kemungkinan masih terdapat sisa etanol dan zat pengotor laiinya sehingga dilakukan destilasi fraksional untuk memperoleh destilat (etil asetat murni). Setelah dilakukannya destilasi fraksional diperoleh etil asetat yang kemudian dikarakterisasi lagi menggunakan kromatografi GC dan diperoleh kromatogram hasil karakterisasi kedua dengan jumlah puncak satu yang menandakan senyawa etil asetat berada dalam keadaan murni. Berdasarkan percobaan, diperoleh massa dari etil asetat yaitu sebesar 73 g dengan hasil rendemen sebesar 82,95% J. Kesimpulan Praktikum yang berjudul “Sintesis Dan Karakterisasi Etil Asetat Dari Ethanol Dan Asam Asetat Melalui Reaksi Esterifikasi” bertujuan untuk memahami proses sintesis etil asetat dari etil alkohol dan asam asetat melalui reaksi esterifikasi, memahami rangkaian proses sintesis etil asetat, mampu menghitung rendemen etil asetat hasil reaksi dan mengkarakterisasi etil asetat dengan metode kromatografi GC. Berdasarkan percobaan yang telah dilakukan dapat disimpulkan bahwa etil asetat dapat dibuat dengan reaksi esterifikasi antara asam asetat (CH3COOH) dan etanol (C2H5OH) dengan bantuan katalis asam sulfat (H2SO4). Dalam percobaan ini, etil asetat yang diperoleh adalah 73 gram, dengan rendemen sebesar 82,95 % K. Daftar Pustaka Akhyar, (2010). Uji Daya Hambat Dan Analisis KLT Bioautografi Ekstrak Akar Dan Buah Terhadap Vibrio Harvey YI . Skripsi. Fakultas farmasi universitas hasanuddin Makassar. Anwar, C. dkk., 1994, Pengantar Praktikum kimia Organik, Universitas Gadjah Mada Press, Yogyakarta. Azura, S. L., Reni S. dan Iriany. 2015. Pembuatan Etil Asetat dari Hasil Hidrolisis, Fermentasi dan Esterifikasi Kulit Pisang Raja (Musa paradisiaca L.). Jurnal Teknik Kimia USU. Clark, J. 2007. Pembuatan Ester. Penerbit USU. Medan. Dirjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan pertama Jakarta : depkes RI. Fessenden, 1997, Dasar-Dasar Kimia Organik, Bina Pura Bangsa, Jakarta. Fessenden, R. J. dan Joan S. F. 1982. Kimia Organik. Erlangga. Jakarta. Fuad. (2012). Etil Asetat. http:/Fuadshifu/Etilasetat.org (Diakses tanggal 14 Februari 2021). Hart, H. 1987, Kimia Organik Suatu Kuliah Singkat, Erlangga, Jakarta. Labchem Fisher Scientific (2012). Material Safety Data Sheet. [Online]. Diakses dari www.fishersci.com [14 Februari 2021]. MerckMillipore. (2020). Material Safety data Sheet. [Online]. Diakses dari www.merckmillipore.com [14 Februari 2021]. Smartlab. (2017). Material Safety data Sheet. [Online]. Diakses dari www.smartlab.co.id [14 Februari 2021] Suryawanshi, M.A., Shinde N.H. dan Nagotkar R.V. 2014. Kinetic Study of Esterification Reaction for the Synthesis of Butyl Acetate. International Journal of Advanced Research in Science, Engineering and Technology. Susanto, H.B., M. Nasikin, dan Sukirno, 2008. Sintesis Pelumas Dasar Bio Melalui Esterifikasi Asam Oleat Menggunakan Katalis Asam Heteropoli/Zeolit. Prosiding Seminar Nasional Rekayasa Kimia Dan Proses. Wardhani, L. K. dan Nanik S. 2012. Uji Aktivitas Antibakteri Ekstrak Etil Asetat Daun Binahong (Anredera Scandens L.) terhadap Shigella flexneri beserta Profil Kromatografi Lapis Tipis. Jurnal Ilmiah Kefarmasian. Lampiran Perhitungan 1. Menghitung rendemen etil asetat hasil reaksi - Massa etil asetat percobaan : 73 g - Masa asam asetat : 60 g - Massa ethanol 𝜌= 𝑚 𝑉 𝑚=𝜌𝑥𝑉 m = 0,79 g/mL x 100 mL m = 79 g - Mol ethanol mol = - 𝑚𝑎𝑠𝑠𝑎 𝑒𝑡𝑎𝑛𝑜𝑙 𝑀𝑟 𝑒𝑡ℎ𝑎𝑛𝑜𝑙 79 𝑔 = 46 𝑔/𝑚𝑜𝑙 = 1,71 mol Mol asam asetat mol = 𝑚𝑎𝑠𝑠𝑎 𝑎𝑠𝑎𝑚 𝑎𝑠𝑒𝑡𝑎𝑡 𝑀𝑟 𝑎𝑠𝑎𝑚 𝑎𝑠𝑒𝑡𝑎𝑡 60 𝑔 = 60 𝑔/𝑚𝑜𝑙 = 1 mol H2SO4 C2H5OH + CH3COOH Mula-mula : 1,71 mol 1 mol - : 1 mol 1 mol 1 mol 1 mol Setimbang : 0,71 mol 0 1 mol 1 mol Bereaksi - CH3COOC2H5 + H2O Massa etil asetat teoritis = mol etil asetat x Mr etil asetat = 1 mol x 88 g/mol = 88 g - % Rendemen sintesis etil asetat % rendemen etil asetat = 𝑚𝑎𝑠𝑠𝑎 𝑒𝑡𝑖𝑙 𝑎𝑠𝑒𝑡𝑎𝑡 𝑝𝑒𝑟𝑐𝑜𝑏𝑎𝑎𝑛 𝑚𝑎𝑠𝑠𝑎 𝑒𝑡𝑖𝑙 𝑎𝑠𝑒𝑡𝑎𝑡 𝑡𝑒𝑜𝑟𝑖𝑡𝑖𝑠 73 𝑔 = 88 𝑔 x 100 % = 82,95 % x 100 % -