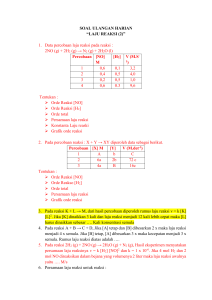
SOAL ULANGAN HARIAN “LAJU REAKSI (2)” 1. Data percobaan laju reaksi pada reaksi : 2NO (g) + 2H2 (g) → N2 (g) + 2H2O (l) Percobaan [NO] [H2] M 1 0,6 0,1 2 0,4 0,5 3 0,2 0,5 4 0,6 0.3 V (M.S1) 3,2 4,0 1,0 9,6 Tentukan : Orde Reaksi [NO] Orde Reaksi [H2] Orde total Persamaan laju reaksi Konstanta Laju reaski Grafik orde reaksi 2. Pada percobaan reaksi : X + Y → XY diperoleh data sebagai berikut. Percobaan [X] M [Y] V (M.det-1) 1 A b C 2 6a 2b 72 c 3 4a B 16c Tentukan : Orde Reaksi [NO] Orde Reakso [H2] Orde total Persamaan laju reaksi Grafik orde reaksi 3. Pada reaksi K + L → M, dari hasil percobaan diperoleh rumus laju reaksi v = k [K] [L]2. Jika [K] dinaikkan 3 kali dan laju reaksi menjadi 12 kali lebih cepat maka [L] harus dinaikkan sebesar …. Kali konsentrasi semula 4. Pada reaksi A + B → C + D, Jika [A] tetap dan [B] dibesarkan 2 x maka laju reaksi menjadi 4 x semula. Jika [B] tetap, [A] dibesarkan 3 x maka kecepatan menjadi 3 x semula. Rumus laju reaksi diatas adalah …. 5. Pada reaksi 2H2 (g) + 2NO (g) → 2H2O (g) + N2 (g), Hasil eksperimen menyatakan persamaan laju reaksinya v = k [H2] [NO]2 dan k = 1 x 10-6. Jika 4 mol H2 dan 2 mol NO direaksikan dalam bejana yang volumenya 2 liter maka laju reaksi awalnya yaitu …. M/s 6. Persamaan laju reaksi untuk reaksi : A + B + C → D adalah v = k [A]2 [C]. Jika konsentrasi A, B, dan C masing-masing diperbesar menjadi 4 kali semula, laju reaksi menjadi … kali. 7. Pada reaksi : P + Q → hasil, v = k [P] [Q]2. Apabila konsentrasi Q diperbesar 3 kali semula besarnya perubahan laju reaksi menjadi …. 8. Laju reaksi awal dari suatu reaksi orde dua yaitu 5,0 x 10-7 mol L-1 det-1. Konsentrasi awal dari pereaksinya 0,2 mol L-1. Tetapan konsentrasi laju reaksinya adalah …. 9. Grafik yang mencerminkan reaksi 2A + B → dengan rumus laju reaksi v = k[A]2 adalah …. 10. Diketahui reaksi A + B → AB. Jika konsentrasi A dinaikkan dua dan konsentrasi B tetap maka laju reaksi menjadi dua kali lebih besar. Jika konsentrasi A dan B masing-masing dinaikkan dua kali maka laju reaksi menjadi delapan kali lebih besar. Persamaan laju reaksinya adalah …. 11. Diketahui persamaan reaksi kimia : A → B. Dalam waktu 330 detik, konsetrasi zat A Berkurang dari 1,00 M menjadi 0,75 M. Tentukan laju reaksi pembentukan zat B ! 12. Dalam ruang 10 L dimasukkan gas NO2 sebanyak 3 mol hingga terurai menjadi NO dan O2. Setelah 8 detik dalam ruangan terdapat 1,25 mol gas NO. Tentukan : a. Laju reaksi pembentukan NO, b. Laju reaksi pembentukan O2, DAN c. Laju reaksi penguraian NO2. 13. Dalam ruang 10 L berlangsung penguraian N2O4 menurut reaksi : N2O4 → 2NO2. Jika di awal reaksi terdapat 6 mol N2O4 , dalam waktu 5 detik tersisa 3 mol N2O4 maka laju reaksi terbentuknya NO2 adalah …. M/s 14. Untuk reaksi X (g) + 3Y (g) → XY3 (g) diperoleh data sebagai berikut . 1. Jika konsentrasi Y ditingkatkan dua kali lipat pada konsentrasi X tetap, laju reaksi meningkat empat kali lipat 2. Jika konsentrasi X dan Y masing-masing ditingkatkan dua kali, laju reaksi meningkat enam belas kali. Rumus laju reaksi untuk reaksi tersebut adalah …. 15. Pembesaran dan pengecilan konsentrasi suatu pereaksi tidak mempengaruhi laju reaksi. Orde reaksi terhadap pereaksi tersebut adalah ….