Hukum dasar dan Stoikiometri
advertisement

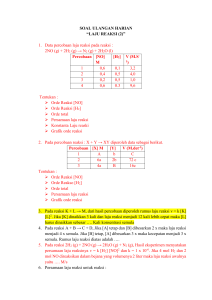
HUKUM HUKUM DASAR DAN STOIKIOMETRI Hukum-hukum dasar kimia 1. Hukum Lavoisier (Hukum kekekalan massa) : “Dalam sistem tertutup, massa zat sebelum dan sesudah reaksi adalah sama”. 2. Hukum Proust (Hukum perbandingan tetap) : “Perbandingan massa unsur-unsur dalam suatu senyawa adalah tertentu dan tetap”. No 1. 2. 3. 4. 5. 6. Massa hidrogen yang direaksikan 1 gr 2 gr 1 gr 2 gr 5 gr 10 gr Massa oksigen yang direaksikan 8 gr 16 gr 9 gr 8 gr 45 gr 10 gr Massa air yang terbentuk 9 gr 18 gr 9 gr 9 gr 45 gr 11,25 gr Massa pereaksi yang sisa 1 gr oksigen 1 gr hidrogen 5 gr oksigen 8,75 gr hidrogen 3. Hukum Dalton (Hukum kelipatan berganda) : “Jika massa dari salah satu unsur dalam kedua senyawa itu sama, maka perbandingan massa unsur yang satu lagi dalam kedua senyawa itu merupakan bilangan bulat dan sederhana”. Contoh: Kadar belerang dalam senyawa I dan II berturut-turut adalah 50% dan 40%. Apakah hukum Dalton berlaku untuk senyawa tersebut? Massa S : Massa O dalam senyawa I = 50 : 50 =1:1 Massa S : Massa O dalam senyawa II = 40 : 60 = 1 : 1,5 Jika Massa S dalam senyawa I = senyawa II, misalnya sama-sama 1 gram, maka massa O senyawa I : senyawa II = 2 : 3. Perbandingan tersebut merupakan bilangan bulat dan sederhana. Maka kedua senyawa itu memenuhi hukum Dalton. 4. Hukum Gay lussac (Hukum perbandingan volume) : “Volume gas-gas yang bereaksi dan hasil reaksi berbanding sebagai bilangan-bilangan bulat dan sederhana, apabila diukur pada tekanan dan temperatur yang sama. Contoh: Berapa ml gas N2 harus direaksikan dengan 12 ml gas H2 untuk menghasilkan gas NH3? N2(g) + 3H2(g) → 2NH3(g) 2 Gas NH3 yang terjadi = 3 x 12 ml = 8 ml 5. Hukum Avogadro “Gas-gas yang mempunyai volume yang sama pada suhu dan tekanan yang sama mengandung sejumlah molekul yang sama pula”. Yohanesprivate.com Page 1 Konsep mol Mol (n) = 𝑔𝑟𝑎𝑚 𝐴𝑟 Volume : atau 𝑔𝑟𝑎𝑚 𝑀𝑟 Dalam keadaan STP : V = n x 22,4 liter/mol Dalam keadaan RTP : V = n x 24,4 liter/mol Dalam suhu dan tekanan yang diketahui : V = Dalam suhu dan tekanan yang sama 𝑉 𝑛𝑅𝑇 𝑃 : 𝑉1 = 2 𝑛1 𝑛2 Jumlah partikel/atom/molekul = n x 6,02 x 1023 Kemolaran larutan Molaritas (M) = 𝑛 𝑣 Rumus empiris adalah rumus perbandingan yang paling sederhana dari atom-atom unsur penyusun senyawa itu. Rumus molekul adalah rumus perbandingan empiris dikalikan dengan faktor pengali. Contoh: RE : CH3 , CO2 RM : C2H6 , C3O6 Menentukan kadar unsur dalam senyawa Kadar = 𝑥 .𝐴𝑟 𝑀𝑟 𝑥 100% Menentukan massa unsur dalam senyawa Massa unsur = 𝑥 .𝐴𝑟 𝑢𝑛𝑠𝑢𝑟 𝑀𝑟 𝑠𝑒𝑛𝑦𝑎𝑤𝑎 Yohanesprivate.com 𝑥 𝑀𝑎𝑠𝑠𝑎 𝑠𝑒𝑛𝑦𝑎𝑤𝑎 Page 2