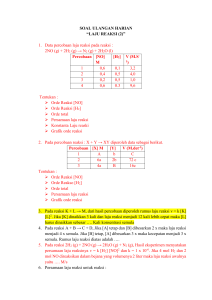
PERSAMAAN REAKSI
advertisement
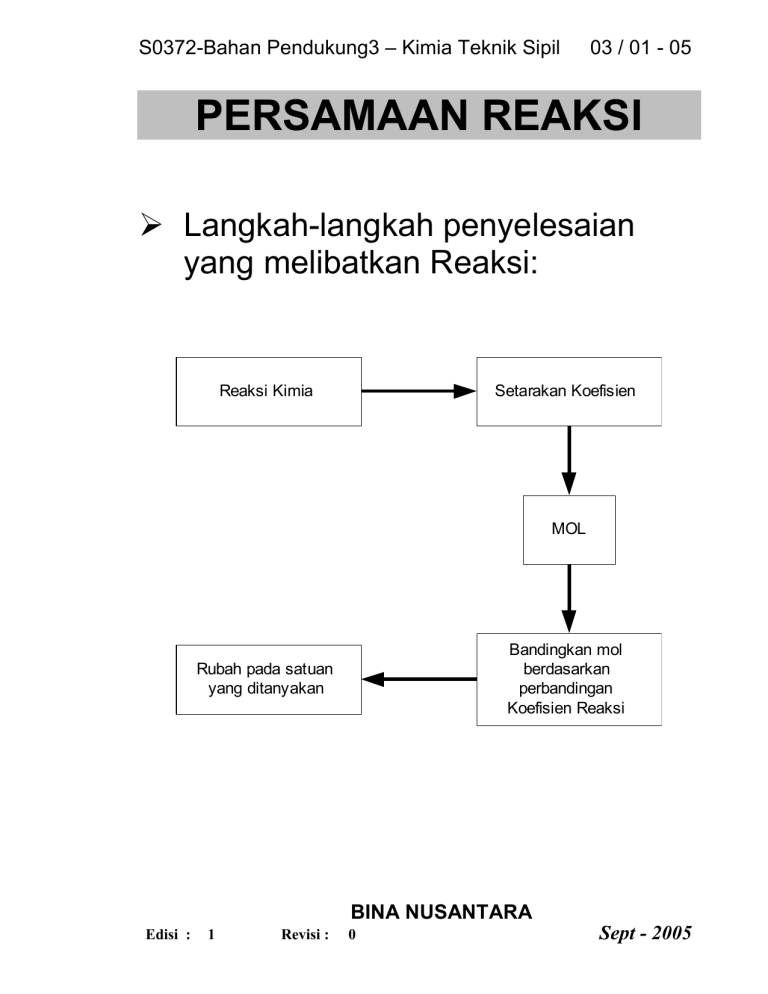
S0372-Bahan Pendukung3 – Kimia Teknik Sipil 03 / 01 - 05 PERSAMAAN REAKSI Langkah-langkah penyelesaian yang melibatkan Reaksi: Reaksi Kimia Setarakan Koefisien MOL Bandingkan mol berdasarkan perbandingan Koefisien Reaksi Rubah pada satuan yang ditanyakan BINA NUSANTARA Edisi : 1 Revisi : 0 Sept - 2005 S0372-Bahan Pendukung3 – Kimia Teknik Sipil 03 / 02 - 05 Hukum Dasar Perhitungan (Stoikiometri) 1. Hukum Proust: Perbandingan massa unsur dalam senyawa selalu tetap. Contoh: massa C = 12 CO2 massa O = 32 Dalam CO2 perbandingan massa C:O selalu 12:32 atau 3:8 2. Hukum Avogadro: Sejumlah mol yang sama dari suatu zat akan mengandung jumlah partikel yang sama pula (walaupun zatnya berbedabeda). Untuk gas pada P & T sama akan memiliki volume yang sama pula. BINA NUSANTARA Edisi : 1 Revisi : 0 Sept - 2005 S0372-Bahan Pendukung3 – Kimia Teknik Sipil 03 / 03 - 05 mol 1 Volume Gas 1 mol 2 Volume Gas 2 mol 1 mol 2 partikel 1 partikel 2 3. Hukum Gay Lussac: Pada suhu/tekanan yang diketahui, Volume Gas dihitung dengan rumusan: P.V = n.R.T dimana : P = tekanan Gas (atm) V = Volume Gas (l) n = mol Gas R = konstanta Gas ideal = 0,082 l. atm / mol.ºK T = suhu (ºK) BINA NUSANTARA Edisi : 1 Revisi : 0 Sept - 2005 S0372-Bahan Pendukung3 – Kimia Teknik Sipil 03 / 04 - 05 4. Bila pada Gas dilakukan perubahan suhu/tekanan, volume Gas dapat ditentukan dengan rumusan: P1V1 P2V2 T1 T2 5. Hukum Dalton: Unsur-unsur yang dapat membentuk lebih dari satu macam rumus senyawa, untuk massa yang sama dari salah satu unsurnya, massa unsur yang lain akan merupakan perbandingan yang bulat (sederhana). BINA NUSANTARA Edisi : 1 Revisi : 0 Sept - 2005 S0372-Bahan Pendukung3 – Kimia Teknik Sipil Contoh: 03 / 05 - 05 Karbon dan Oksigen dapat membentuk senyawa CO dan CO2 Senyawa CO CO2 Massa C 12 12 Massa O 16 32 Untuk massa C sama, perbandingan massa O pada CO dan CO2 adalah = 16:32 = 1:2 BINA NUSANTARA Edisi : 1 Revisi : 0 Sept - 2005