Gas Ideal
advertisement
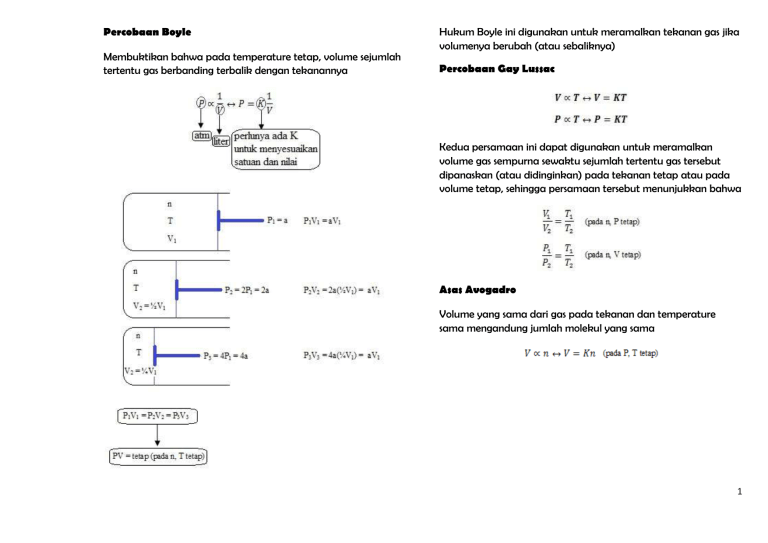
Percobaan Boyle Membuktikan bahwa pada temperature tetap, volume sejumlah tertentu gas berbanding terbalik dengan tekanannya Hukum Boyle ini digunakan untuk meramalkan tekanan gas jika volumenya berubah (atau sebaliknya) Percobaan Gay Lussac Kedua persamaan ini dapat digunakan untuk meramalkan volume gas sempurna sewaktu sejumlah tertentu gas tersebut dipanaskan (atau didinginkan) pada tekanan tetap atau pada volume tetap, sehingga persamaan tersebut menunjukkan bahwa Asas Avogadro Volume yang sama dari gas pada tekanan dan temperature sama mengandung jumlah molekul yang sama 1 diperoleh Asas Avogadro menunjukkan bahwa volume molar Vm suatu gas yaitu volume yang ditempatinya per mol molekul Perlu ada K untuk menyesuaikan satuan dan nilai, sehingga harus sama untuk semua gas selama temperature dan tekanan bertingkah laku sempurna Dari empat hubungan yang didapat 2 Komposisi campuran dinyatakan dalam fraksi mol. Untuk Hukum Dalton Tekanan yang dilakukan oleh campuran gas sempurna adalah jumlah tekanan yang dilakukan oleh masing-masing gas tersebut yang secara sendiri menempati volume yang sama 3 Perubahan pada volume tetap (dV = 0) Perubahan Parsial Perubahan pada suhu tetap (dT = 0) Interaksi Molekuler Perubahan pada tekanan tetap (dP = 0) Gas nyata memperlihatkan penyimpangan dari hukum gas sempurna karena molekul-molekulnya berinteraksi satu sama lain. Gaya tolak antar molekul membantu pemuaian dan gaya tarik membantu pemampatan. 4 Faktor pemampatan Untuk gas sempurna Z = 1 pada semua kondisi, penyimpangan Z dari 1 adalah ukuran ketidaksempurnaan Dengan memperhitungkan gaya tarik menarik antar molekul Pada tekanan tinggi, semua gas mempunyai Z > 1, menunjukkan bahwa gas-gas lebih sulit dimampatkan ketimbang gas sempurna (hasil kali PVm lebih besar dari pada RT). Sekarang gaya tolak yang menang. Pada tekanan menengah, beberapa gas mempunyai Z < 1 artinya gaya tarik menang dan lebih mudah dimampatkan Koefisien Virial Kondisi kritis gas: kondisi dimana gas berubah menjadi zat cair. Pada kondisi kritis volumenya tetap, diketahui sebagai volume kritis. Pada kondisi kritis dicapai pada tekanan kritis dan suhu kritis Kondisi kritis berdasarkan persamaan Van Der Waals Persamaan Keadaan Gas Nyata (Persamaan Van Der Waals) Molekul gas dianggap sebagai bola berongga (memiliki volume molekul). Jika volume molekul mol gas b maka volume molekul n mol gas (volume tetap) nb. Karena volume molekul gas tersebut nb maka volume gas sesungguhnya lebih kecil dibandingkan volume yang dinyatakan persamaan gas ideal, maka volume sesungguhnya adalah V – nb Pada kondisi kritis, Tm, Vm, Pm menjadi Tc, Vc, Pc 5 Faktor pemampatan Substitusi persamaan (5) ke persamaan (1) 4 persamaan pada kondisi kritis Persamaan Van Der Waals 6