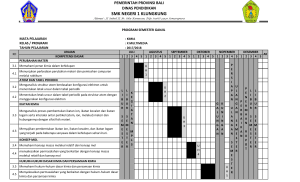
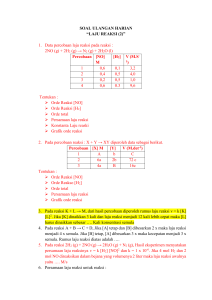
PLEASE, BRING US WHEREVER YOU GO!! DON’T LEAVE US!! KONSEP MOL Mol merupakan satuan yang menunjukkan ukuran jumlah partikel yang ada dalam suatu zat apapun. 1 mol suatu zat didefinisikan sebagai banyaknya zat tesebut sama dengan banyaknya atom karbon yang terdapat pada 12 gram atom 12C Massa satu mol suatu zat adalah massa zat tersebut yang sesuai dengan Ar-nya atau Mr-nya dinyatakan dalam gram satu mol suatu zat adalah banyaknya zat tersebut yang mengandung 6,022 x 1023 partikel, molekul, ion, atau gabungan partikel-partikel. KONSEP MOL 𝑎 𝑎 𝑔𝑟𝑎𝑚 𝑠𝑢𝑎𝑡𝑢 𝑢𝑛𝑠𝑢𝑟 𝑋 = 𝑚𝑜𝑙 𝐴𝑟 𝑋 𝑛 𝑚𝑜𝑙 𝑠𝑢𝑎𝑡𝑢 𝑢𝑛𝑠𝑢𝑟 𝑋, 𝑚𝑎𝑠𝑠𝑎𝑛𝑦𝑎 = 𝑛 × 𝐴𝑟 𝑋 𝑔𝑟𝑎𝑚 𝑛 𝑚𝑜𝑙 𝑠𝑢𝑎𝑡𝑢 𝑢𝑛𝑠𝑢𝑟 𝑋, 𝑚𝑒𝑛𝑔𝑎𝑛𝑑𝑢𝑛𝑔 = 𝑛 × 6,022 × 1023 𝑎𝑡𝑜𝑚 𝑢𝑛𝑠𝑢𝑟 𝑋 𝑏 𝑏 𝑎𝑡𝑜𝑚 𝑠𝑢𝑎𝑡𝑢 𝑢𝑛𝑠𝑢𝑟 𝑋 = 𝑚𝑜𝑙 𝑢𝑛𝑠𝑢𝑟 𝑋 23 6,022 × 10 KONSEP MOL CONTOH : Jika diketahui Ar Ca = 40 a. Berapa gram massa 2 mol Ca? b. Berapa mol 10 gram Ca? Jawab : a. 1 mol Ca = 40 gram 2 mol Ca = 2 x 40 = 80 gram 1 𝑚𝑜𝑙 b. 10 𝑔𝑟𝑎𝑚 𝐶𝑎 × = 0,25 𝑚𝑜𝑙 𝐶𝑎 40 𝑔𝑟𝑎𝑚 KONSEP MOL AIR KRISTAL Air Kristal (hidrat) adalah air yang terikat pada suatu kristal senyawa tertentu dengan perbandingan molekul yang tertentu pula. Air ini dapat dibebaskan melalui pemanasan. Contoh air kristal : CuSO4.5H2O ; FeSO4.7H2O Perbandingan jumlah molekul = Perbandingan Mol KONSENTRASI LARUTAN PERSENTASE MASSA UNSUR Persentase massa unsur X dalam senyawa XY adalah : 𝑗𝑢𝑚𝑙𝑎ℎ 𝑎𝑡𝑜𝑚 𝑋 × 𝐴𝑟 𝑋 𝑃𝑒𝑟𝑠𝑒𝑛𝑡𝑎𝑠𝑒 𝑚𝑎𝑠𝑠𝑎 𝑋 = × 100% 𝑀𝑟 𝑋 Massa unsur X dalam a gram senyawa XY adalah : 𝑗𝑢𝑚𝑙𝑎ℎ 𝑎𝑡𝑜𝑚 𝑋 × 𝐴𝑟 𝑋 𝑀𝑎𝑠𝑠𝑎 𝑋 = × 𝑎 𝑔𝑟𝑎𝑚 𝑀𝑟 𝑋 KEMURNIAN (KADAR) Kemurnian suatu zat dapat ditentukan dengan persamaan sebagai berikut : % 𝑧𝑎𝑡 ℎ𝑎𝑠𝑖𝑙 𝑒𝑘𝑠𝑝𝑒𝑟𝑖𝑚𝑒𝑛 𝐾𝑒𝑚𝑢𝑟𝑛𝑖𝑎𝑛 𝑠𝑢𝑎𝑡𝑢 𝑧𝑎𝑡 = × 100% % 𝑧𝑎𝑡 𝑠𝑒𝑐𝑎𝑟𝑎 𝑡𝑒𝑜𝑟𝑖𝑡𝑖𝑠 Atau 𝑚𝑎𝑠𝑠𝑎 𝑧𝑎𝑡 ℎ𝑎𝑠𝑖𝑙 𝑒𝑘𝑠𝑝𝑒𝑟𝑖𝑚𝑒𝑛 𝐾𝑒𝑚𝑢𝑟𝑛𝑖𝑎𝑛 𝑠𝑢𝑎𝑡𝑢 𝑧𝑎𝑡 = × 100% 𝑚𝑎𝑠𝑠𝑎 𝑠𝑎𝑚𝑝𝑒𝑙 PEREAKSI PEMBATAS Jika dalam suatu reaksi, salah satu zat dibuat berlebihan maka zat yang lain suatu saat akan habis bereaksi. Zat yang habis bereaksi itulah yang disebut Pereaksi pembatas. 𝑀𝑜𝑙 𝑍𝑎𝑡 𝑦𝑎𝑛𝑔 ℎ𝑎𝑏𝑖𝑠 𝑏𝑒𝑟𝑒𝑎𝑘𝑠𝑖 = 𝐾𝑜𝑒𝑓𝑖𝑠𝑖𝑒𝑛 Yang memiliki mol terkecil, maka zat tersebut merupakan zat yang habis bereaksi (Pereaksi pembatas) PEREAKSI PEMBATAS HUBUNGAN MOL DENGAN PERSAMAAN KIMIA Dalam persamaan kimia, ada angka koefisien reaksi. Angka koefisien reaksi ini menyatakan : 1. Perbandingan atom atau molekul zat pereaksi dan zat hasil reaksi. 2. Perbandingan mol zat dan zat hasil reaksi 3. Untuk reaksi yang berwujud gas, koefisien reaksi juga menyatakan perbandingan volume zat pereaksi dan zat hasil reaksi (jika diukur pada temperature dan tekanan yang sama) 𝑘𝑜𝑒𝑓𝑖𝑠𝑖𝑒𝑛 𝑦𝑎𝑛𝑔 𝑑𝑖𝑡𝑎𝑛𝑦𝑎𝑘𝑎𝑛 𝑚𝑜𝑙 𝑧𝑎𝑡 𝑦𝑎𝑛𝑔 𝑑𝑖𝑡𝑎𝑛𝑦𝑎𝑘𝑎𝑛 = × 𝑚𝑜𝑙 𝑦𝑎𝑛𝑔 𝑑𝑖𝑘𝑒𝑡𝑎ℎ𝑢𝑖 𝑘𝑜𝑒𝑓𝑖𝑠𝑖𝑒𝑛 𝑦𝑎𝑛𝑔 𝑑𝑖𝑘𝑒𝑡𝑎ℎ𝑢𝑖