Modul 04_Syahid
advertisement

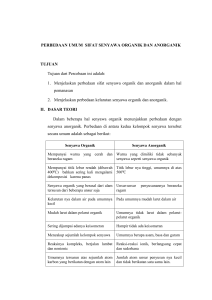
Laporan Praktikum Struktur dan Keraktifan Anorganik KI3231 Sintesis Padatan Oksida Cr2O3 dengan Metode Hidrotermal Syahid Mujahid NIM 10509091 Shift Rabu Pagi, Kelompok B-5[16-S] ,Asisten Arifin Abstrak Dalam percobaan ini telah dilakukan sintesis padatan oksida Cr2O3 dengan metode hidrotermal. Metode hidrotermal merupakan metode kristalisasi pada suhu dan tekanan uap tinggi. Sintesis padatan Cr2O3 ini dilakukan dengan menggunakan metode hidrotermal dengan senyawa prekursor K2Cr2O7 beserta glukosa dan air dalam autoclave yang dioven pada suhu 200oC. Analisis hasil menggunakan alat XRD. Didapatkan kristal Cr2O3 sebesar 0,0568 g dengan massa rendemen 36,11%. Dari data XRD terlihat ada beberapa puncak yang sama dengan data standar pada nilai 2θ sekitar 40 dan 65. Dari data ini didapatkan kristal Cr2O3 yang masih mengandung pengotor. metoda sol gel, metoda solvotermal, metoda hidrolisis, presipitasi-gel, kondensasi gas, sonochemical reaction, microwave plasma , dekomposisi larutan nitrat , deposisi induksilaser. Tetapi dari semua metode itu, tidak semua dapat diaplikasikan dalam skala industri. [2] I. Pendahuluan Padatan Cr2O3 yang berwarna hijau merupakan salah satu senyawa yang banyak digunakan sebagai pigmen warna untuk pembuatan campuran berwarna hijau seperti at, tinta, ataupun bahan celup tekstil. Selain itu, Cr2O3 digunakan juga dalam industri gelas. Cr2O3 mempunyai sifat fisik yang menarik antara lain sifat magnetik, katalitik dan berukuran nano. Dalam percobaan ini, Cr2O3 akan disintesis melalui reaksi reduksi K2Cr2O7 dengan glukosa dalam autoclave pada suhu 200oC. Ion dikromat akan tereduksi menjadi kromium(III) oksida hidrat yang kemudian digunakan sebagai prekursor pembentukan Cr2O3. Metode ini disebut dengan metode hidrotermal. Senyawa nanopartikel adalah senyawa yang mempunyai ukuran partikel nano yakni diabwah 100 nm. Nanopartikel dari Cr2O3 banyak diterapkan dalam bidang Magnetic Resonance Imaging (MRI) sebagai bahan penginderaan magnetik, solar cells, katalis heterogen, pewarnaan dan digunakan dalam material tahanan (resistance materials). Metode hidrotemal meliputi berbagai teknik kristalisasi zat dari suhu tinggi pada tekanan uap tinggi. Metode sintesis kristal tunggal ini bergantung pada kelarutan mineral dalam pelarutnya(air panas) dibawah tekanan tinggi. Struktur Cr2O 3 diadaptasikan dari struktur corundum yang berupa hcp(hexagonal closed packed) dekat anion oksida dimana 2/3 lubang oktahedral diisi oleh kromium. Cr2O3 ditemukan di alam dalam bentuk chromite (FeCr2O4). Diatas suhu 370K, Cr2O 3 akan bersifat antiferromagnetik. Dalam mensintesis nanopartikel Cr2O3 terdapat banyak cara seperti metoda keramik, 1 Percobaan dilakukan tanggal 29 Februari 2012, Laporan dikumpulkan tanggal 02 Mei 2012 Laporan Praktikum Struktur dan Keraktifan Anorganik KI3231 II. Percobaan 1. Prosedur Percobaan a. Sintesis Cr2O 3 standar Cr2O3. Nilai intesitas setengah dari nilain maksimum dan ukuran butir partikel ditentukan untuk mengetahui keberhasilan percobaan ini. Kalium dikromat sebanyak 0,3029 gram dengan 0,1025 gram glukosa dilarutkan dalam gelas kimia 50 mL. Kemudian larutan dipanaskan di oven (T=200oC) dalam Teflon autoclave selama 60 menit. Setelah dingin, endapan yang didapat disaring dengan kertas saring. Endapan tersebut kemudian ditambahkan larutan HCl 5M sedikit demi sedikit sampai pH larutan menjadi 5. Kemudian larutan tersebut didiamkan selama 2 jam (pH 5, T ruang) sampai diperoleh endapan. 2. Data Pengamatan dan Perhitungan m K2Cr2O7 = 0,3029 g m glukosa = 0,1025 g Endapan hidrat Cr(III) oksida dengan kertas saring kemudian dicuci dengan 20-30 mL aquabidest sambil diaduk. Endapan tersebut kemudian didekantasi dalam wadah berbeda. Pencucian endapan ini dilakukan sebanyak 7 kali. Setelah itu, endapan dipanaskan kembali di oven pada suhu 100oC dalam krus keramik selama 24 jam. Sebelum dipanaskan (m teflon autoklaf isi = 179,2875 g Setelah pemanasan (m teflon autoklaf isi) = 194,0551 g m Kristal Cr2O3 = 0,0568 g (setelah pemanasan oven 24 jam) Kristal Cr2O3 yang dihasilkan berwarna hijau Perhitungan : 0,3029 𝑔 Mol K2Cr2O7 = 294 𝑔/𝑚𝑜𝑙 = 1,0303 × 10−3 0,1025 𝑔 Mol C6H12O6 = 188,06 𝑔/𝑚𝑜𝑙 = 0,54504 × 10−3 b. Analisis Analisis dilakukan dengan pengukuran difraksi sinar X dari sampel yang diperoleh. Hasil difraksi ini dibandingkan dengan data 10 K2Cr2O7 + 5C6H12O6 10 Cr2O3 + 3H2O + 10 K2O + 30 CO2 m = 1,0303 × 10−3 0,5450 × 10−3 r = 1,0303 × 10−3 0,5151 × 10−3 1,0303 × 10−3 s = 0,0299 × 10−3 1,0303 × 10−3 - - % rendemen - - 𝑚 𝑘𝑟𝑖𝑠𝑡𝑎𝑙 = 𝑚 𝑡𝑒𝑜𝑟𝑖𝑡𝑖𝑠 × 100% Jadi, massa teoritis Cr2O3 yang diperoleh adalah sebesar 0,1573 g = 0,1573 × 100% Sehingga, = 36,11% m Cr2O3 0,0568 = n Cr2O3 × Mr Cr2O3 = 1,0303 × 10−3mol x 152 g/mol = 0,1566 g 2 - Laporan Praktikum Struktur dan Keraktifan Anorganik KI3231 III. Hasil dan Diskusi a. Sintesis Setelah itu dilakukan pemanasan kembali pada suhu 110oC selama 2 jam. Pada suhu 110oC,air dengan titik didih 100oC akan menguap dan diharapkan semua air yang terikat kepada Cr2O3 akan menguap. Setelah dipanaskan maka dilakukan kalsinasi pada oven(T=300oC) selama 5 jam untuk menghilangkan pelarut organik dan CO2 agar diperoleh kristal yang murni. Dalam hal ini tidak dilakukan kalsinasi dikarenakan khawatir jika dilakukan kalsinasi Cr2O3 akan terurai (melihat dari hasil kelompok lain). Sintesis Cr2O3 ini dilakukan dengan metode hidrothermal dimana pada prinsipnya adalah pengkristalan suatu senyawa pada suhu tinggi dengan kondisi tekanan uap yang tinggi. Dari metode hidrotermal ini digunakan metode perbedaan suhu. Dimana penjenuhan dilakukan dengan mengurangi suhu di zona pertumbuhan kristal. Dalam autoklaf terjadi dua zona suhu dimana nutrien (Cr2O3 ) dalam hal ini akan larut di larutan panas, dan larutan yang telah jenuh akan terbawa ke bagian atas oleh gerakan konvektif dari larutan. Larutan dengan solusi yang lebih padat dengan suhu yang lebih dingin akan turun berkebalikan dengan larutan jenuh tersebut. Larutan menjadi sangat jenuh dibagian atas (akibat pengurangan suhu) dan kristalisasi terjadi. b. Data XRD Berikut cara kerja XRD secara sederhana Dalam sintesis ini digunakan kalium dikromat (sumber logam Krom) dan glukosa yang dilarutkan dalam aquabidest. Glukosa berfungsi sebagai reduktor krom dari biloks +6 menjadi +3. Hal ini akibat dari gugus aldehid dari glukosa yang akan teroksidasi menjadi gugus karboksilat. Larutan ini kemudian dioven dalam autoklaf selama 1 jam pada suhu 200oC. Berikut adalah reaksi kesetimbangan ion Cr3+ dalam suasana asam : Data hasil XRD merupakan spektrum antara intensitas cahaya dengan 2θ (dua theta). Dari data spektrum XRD (lampiran 1) terlihat bahwa beberapa puncak dari data standar Cr2O3 terlihat pula dari data sampel di nilai 2θ sekitar 40 dan 65. Tetapi puncak lain pada standar tidak terlihat pada puncak dari data spektrum sampel. Hal ini diakibatkan adanya noise pada sampel akibat kristal yang digunakan bukan kristal tunggal (masih ada pengotor) dan belum dilakukannya baseline dari data spektrum sampel. Cr2O72- + 14 H+ 2 Cr3+ + 7 H2O Setelah dioven terlihat bahwa terjadi perubahan warna dari kalium dikromat yang berwarna orange menjadi hijau dimana hal ini menandakan bahwa telah terjadi reduksi dari krom biloks +6 menjadi +3. Ion dikromat tadi tereduksi membentuk kromium (III) oksida hidrat yang selanjutnya akan digunakan sebagai prekursor untuk pembentukan Cr2O3. Dari data ini tidak dapat ditentukan lebar puncak pada nilai intensitas setengah dari nilai maksimum (Full Width at Half Maximum) dan ukuran butir partikel dikarenakan data spektrum belum dilakukan baseline. Dalam hal ini larutan pun ditambahkan larutan HCl pekat sebagai pensuasana asam agar ion dikromat dapat tereduksi dan penstabil krom biloks +3 agar tidak teroksidasi. Sehingga diharapkan produk yang terbentuk akan lebih banyak. 3 Laporan Praktikum Struktur dan Keraktifan Anorganik KI3231 IV. Kesimpulan Dari percobaan ini telah berhasil didapatkan kristal Cr2O3 dari metoda hidrotermal sebanyak 0,0568 gram dengan massa rendemen sebesar 36,11%. Dari data spektrum XRD didapatkan kristal sampel yang cukup sama dilihat dari adanya puncak yang sama pada 2θ disekitar 40 dan 65. dengan data spektrum Cr2O3 standar walaupun terlihat masih tedapat pengotor. V. Daftar Pustaka 1. Zhi-mao Yao, Zuo-hu Li, and Zhang, Journal of Colloid and Interface Science, 266 (2003) , p-382-387 2. Zhenzhao Pei, Hongbin Xua, and Yi Zhang, Journal of Alloys and Compounds, 468 (2009), L5-L8. 3. http://chemwiki.ucdavis.edu/Analytic al_Chemistry/Instrumental_Analysis/ Diffraction/Powder_X-ray_Diffraction diunduh pada tanggal 02 Mei 2012 4. http://en.wikipedia.org/wiki/Hydroth ermal_synthesis diunduh pada tanggal 02 Mei 2012. 4