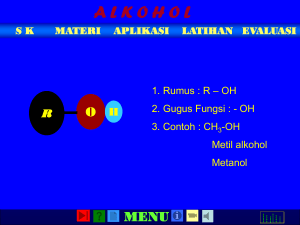
Benzena dan Turunannya
advertisement

Senyawa Aromatis : Subtitusi elektrofilik Struktur Benzen Struktur Benzen • heksagonal planar, sudut 120º • panjang ikatan C-C = 140 pm • hibridisasi sp2 Seluruh elektron dalam orbital bonding Stabilitas Benzen Ikatan rangkap pada benzen tidak bereaksi seperti pada alkena: Br Br2 Br Br Br " + Br Br " but Tetapi Br2 FeBr3 Tidak bereaksi no reaction! Br Stabilitas Benzen Benzen lebih stabil dibanding “sikloheksatriena”: ~ 30 kkal lebih stabil dibanding “sikloheksatriena” ~ -25.0 -26.8 = stabilisasi aromatik -49.8 -28.6 kcal Subtitusi Elektrofilik Pada Benzen Subtitusi Elektrofilik (SE) Aromatis Subtitusi elektrofilik: mengganti hidrogen pada cincin benzen Sigma kompleks Benzen telah tersubtitusi Mekanisme SE Tahap 1 : Serangan E+ membentuk sigma kompleks Sigma kompleks (ion arenium) Tahap 2 : lepasnya proton pada sigma kompleks membentuk produk subtitusi Brominasi benzen Mekanisme reaksi • • Membutuhkan E+ yang lebih kuat dibandingkan Br2. Gunakan katalis asam lewis kuat, FeBr3. Br Br + + Br FeBr 3 Br FeBr 3 H Proceeds through a -complex Br Br H Br H + Br 2 + CH FeBr 3 H HC + CH -complex with the positive charge, distributed only between ortho- and para-positions Br Br Br Br Addition - + -H Br Substitution (aromaticity is restored) Brominasi benzen Diagram energi Keadaan transisi Energi Pereaksi Intermediet Produk => Koordinat reaksi Klorinasi dan Iodinasi • Klorinasi serupa dengan brominasi. Katalis yang digunakan AlCl3. • Iodinasi membutuhkan agen pengoksidasi asam, seperti asam nitat, yang akan mengoksidasi iodin menjadi ion I+. + H + HNO3 + 1/2 I2 + I + NO2 + H2O Nitrasi Benzen Elektrofil Untuk membentuk elektrofil ion NO2+digunakan H2SO4 dengan HNO3. O H O S O H O H O H O N H O N + O O O H O H O N + O _ + HSO4 O H2O + N+ O E+ Nitrasi Benzen Mekanisme Nitronium-cation HNO3 + H2SO4 H NO2 + + HSO4- + H2O Proceeds through a -complex O2N + -H O2 N O2N H H + O2N + CH HC + CH H Sulfonasi Mekanisme Gunakan SO3 dan asam sulfat berasap untuk menghasilkan ion HSO3+ SO3 + H2SO4 H HSO 3 + + HSO4- Proceeds through a -complex HO 3S + -H HO 3S HO 3S H H + HO 3S + CH HC + CH H Alkilasi Friedel-Crafts Elektrofil : • Sintesis alkil benzen menggunakan alkil halida dan asam lewis, biasanya AlCl3. • Reaksi alkil halida dengan asam lewis akan menghasilkan karbokation yang berperan sebagai elektrofil. Cl CH3 CH CH3 + AlCl3 _ CH3 + C Cl AlCl3 H3C H • Sumber karbokation lain : alkena + HF atau alkohol+ BF3. _ H2C CH CH3 OH H3C CH CH3 BF3 HF F + H3C CH CH3 + BF3 H O H3C CH CH3 H3C _ + + CH CH3 HOBF3 Alkilasi Friedel-Crafts Mekanisme : CH3 +C H H + CH3 CH(CH3)2 H F H CH(CH3)2 + H F B F OH - CH3 CH + CH3 HF F F B OH Alkilasi Friedel-Crafts Alkilasi Friedel-Crafts memiliki beberapa keterbatasan diantaranya adalah : • Karbokation yang terbentuk mengalami penaatan ulang. Cl AlCl3 • Produk alkil benzena lebih reakstif dibandingkan benzen sehingga dapat menyebabkan terjadinya polialkilasi. Asilasi Friedel-Crafts Mekanisme : • Asil klorida digunakan untuk menggantikan alkil klorida. • O R C Cl AlCl3 + _ R C Cl AlCl3 Ion intermediet asilium distabilisasi oleh resonansi dan tidak mengalami penataan ulang seperti karbokation. O + _ R C Cl AlCl3 • O _ AlCl4 + + R C O + R C O Produk fenil keton bersifat kurang reaktif dibandingkan benzen, sehingga akan menghindari poliasilasi. O O C C+ R + H H R Cl _ AlCl3 O C HCl R + AlCl3 Asilasi Friedel-Crafts Reduksi Clemmensen : Asilbenzen yang terbentuk dapat dikonversi menjadi alkil benzen melalui reaksi dengan HCl (aq) dan amalgam Zn. O O + CH3CH2C Cl 1) AlCl3 2) H2O C CH2CH3 Zn(Hg) aq. HCl CH2CH2CH3 Formilasi Gatterman-Koch • Untuk menghasilkan benzaldehida digunakan reaksi yang lain. • Untuk menghasilkan formil klorida (merupakan senyawa yang tidak stabil) gunakan campuran dalam tekanan tinggi dari CO, HCl, dan katalis. O H C Cl CO + HCl + _ + H C O AlCl4 AlCl3/CuCl O O C+ C H H + HCl Subtitusi Elektrofilik Pada Benzen tersubtitusi (Subtitusi Elektrofilik Kedua) Pengaruh subtituen X Mempengaruhi kereaktifan terhadap subtitusi berikutnya Mengarahkan posisi subtituen pada subtitusi berikutnya Efek Elektronik Subtituen pada Cincin Benzen X induksi resonansi hiperkonjugasi Efek Elektronik Subtituen pada Cincin Benzen a. Akseptor Induksi. Efek ini diperlihatkan oleh subtituen yang mengandung atom yang memiliki keelektronegatifan lebih besar dari atom H yang terhubung pada cincin benzen. Contoh: -OCH3, -NH2, -Cl, -NO2 b. Aseptor resonansi. Konjugasi antara orbital p digambarkan melalui struktur resonansi dengan muatan positif pada cincin benzen. Contoh: -COR, -NO2, -SO3H O OR OR OR R Efek Elektronik Subtituen pada Cincin Benzen c. Donor Resonansi. Konjugasi antara orbital-p digambarkan melalui struktur resonansi dengan muatan negatif pada cincin benzen. Contoh: -OCH3, -NH2, -Cl, -phenyl NH2 NH2+ NH2+ NH2+ d. Donor Hiperkonjugasi. Konjugasi yang melibatkan orbital-s digambarkan melalui struktur resonansi non klasik (mengijinkan pemutusan ikatan-s) dengan muatan negatif pada cincin benzen . Contoh: -CH3, -Alkyl Efek Elektronik Subtituen pada Cincin Benzen e. Akseptor Hiperkonjugasi. Konjugasi yang melibatkan orbital sigma, digambarkan melalui struktur resonasni non kalsik (mengijinkan pemutusan ikatan-s) dengan muatan positif pada cincin benzen. Examples: -CF3 Efek Subtituen pada Reaktifitas 1. Donor elektron meningkatkan reaktivitas (pengaktifasi) SE Aromatis Contoh: -CH3, -NR2, -OR, -CH=CH2 2. Akseptor elektron menurunkan reaktivitas (pendeaktivasi) SE Aromatis Contoh: -NO2, -NH3+, -COR, -Cl 3. Untuk subtituen dengan efek yang berlawanan, efek resonansi lebih mempengaruhi dibanding efek lainnya, kecuali pada Cl dan Br efek induksi lebih kuat. + Br FeBr 3 Br 2 OH OH Br Br + Br 2 Diluted solution in water Br Subtituen Pengaktivasi Gugus Fungsi : Tidak punya PEB Senyawa : fenoksida anilina fenol fenil eter anilida alkil benzen Subtituen Pendeaktivasi Gugus Bentuk resonansi Contoh Subtituen Pendeaktivasi Gugus Bentuk resonansi Contoh Efek Subtituen pada Pengarahan Subtituen yang telah terikat pada cincin benzen akan mengarahkan posisi masuknya subtituen berikutnya: 1. Seluruh donor elektron akan mengarahkan subtituen yang datang pada posisi orto dan para (dengan terdapat beberapa pengecualian). Contoh: -CH3, -NR2, -OR, -Cl, -Br, -CH=CH2 E H + Donor H E H E + C HC + C stabilisasi Stabilization Donor stabilisasi Stabilization Donor kurang Lack ofterstabilkan stabilization Efek Subtituen pada Pengarahan 2. Akseptor elektron akan mengarahkan subtituen pada posisi meta. Contoh: -NO2, -NH3+, -COR, -CF3 E H + Acceptor H E H E + C HC + C terdestabilisasi Destabilization Acceptor terdestabilisasi Destabilization Acceptor kurang terdestabilisasi Lack of destabilization Efek Subtituen pada Pengarahan Contoh reaksi SE pada Benzen tersubtitusi Nitrasi Toluena • Toluena bereaksi 25 kali lebih cepat dibanding benzen. • Gugus metil berperan sebagai pengaktivasi. • Campuran produk mengandung molekul disubtitusi dengan posisi orto dan para lebih banyak Nitrasi Toluena Mekanisme dan Sigma kompleks serangan pada posisi orto 3o lebih disukasi serangan pada posisi para 3o lebih disukasi serangan pada posisi meta Intermediat lebih stabil jika nitrasi terjadi pada posisi orto atau para Nitrasi Toluena Diagram Energi Subtitusi Pada Nitrobenzen • Nitrobenzen bereaksi 100.000 kali lebih lambat dibanding benzen. • Gugus metil berperan sebagai pendeaktivasi. • Campuran produk mengandung molekul disubtitusi dengan posisi meta lebih banyak. • Subtituen pendeaktivasi mendeaktivasi pada semua posisi, tetapi posisi meta kurang dideaktivasi. Subtitusi Pada Nitrobenzen Mekanisme dan Sigma kompleks serangan pada posisi orto sangat tidak stabil serangan pada posisi para sangat tidak stabil serangan pada posisi meta Subtitusi Pada Nitrobenzen Diagram Energi Halobenzen • Halogen mendeaktivasi pada SE tetapi akan mengarahkan subtituen pada posisi orto, para. • Karena halogen sangat elektronegatif, mereka akan menarik kerapatan elektron dari cincin secara induktif melalui ikatan sigma (mendeaktivasi). • Tetapi halogen memiliki PEB yang dapat menstabilkan sigma kompleks melalui efek resonansi (mengarahkan pada orto-para). Para attack Ortho attack Br Br + (+) E E (+) + H (+) + Br Br (+) (+) + E Meta attack Br Br H (+) + + H E (+) E (+) H E Energy Diagram Diagram Energi Subtitusi Nukleofilik Pada Benzen Substitusi Nukleofilik Aromatis • Nukleofilik mengganti gugus pergi pada cincin aromatis. • Subtituen penarik elektron akan mengaktivasi cincin terhadap subtitusi nukleofilik. Contoh : Mekanisme Subtitusi Nukleofilik Tahap 1. Serangan Nu- (OH-) memberikan sigma yang distabilkan resonansi Tahap 2. Lepasnya Nu- (Cl-) memberikan produk Mekanisme Benzuna • Pereaksinya adalah halobenzena yang tidak memiliki gugus penarik elektron pada cincin benzen. • Gunakan basa yang sangat kuat seperti NaNH2. Contoh : Intermediet Benzuna Mekanisme reaksi : NH2 H NH2 NH2 _ NH2 H H H _ or H H CH3 H H CH3 meta-toluidine H H CH3 H H CH3 para-toluidine