respon kemoterapi penderita kanker ovarium di
advertisement

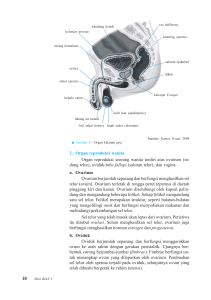
RESPON KEMOTERAPI PENDERITA KANKER OVARIUM DI RUMAH SAKIT KANKER DHARMAIS JAKARTA (TAHUN 1997 – 2002) Amaylia Oehadian Sub Bagian Hematologi-Onkologi Medik SMF Penyakit Dalam FK UNPAD / RS Perjan Hasan Sadikin I. LATAR BELAKANG 1 Di Amerika Serikat, kanker ovarium merupakan urutan ke tujuh kanker terbanyak. Kanker epitelial ovarium merupakan penyebab utama kematian kanker ginekologis di Amerika Serikat dan merupakan urutan ke lima penyebab kematian karena kanker pada wanita. Pada tahun 2001 diperkirakan terdapat 23,400 kasus baru kanker ovarium dan diperkirakan menyebabkan 13,900 kematian .1,2 Insiden kanker ovarium meningkat dengan bertambahnya umur. Insidensi tertinggi didapatkan pada decade ke 8 yaitu sebesar 57/100,000 wanita. Ratarata usia pada waktu diagnosis ditegakkan adalah 63 tahun dan 70 % di antaranya datang 2 dengan stadium lanjut. Pengobatan primer terhadap kanker ovarium terdiri dari staging operasi dan sitoreduksi, sebagian besar diikuti dengan kemoterapi sistemik. Operasi inisial harus merupakan staging lapatoromi yang menyeluruh, termasuk TAH (total abdominal hysterectomy) dan BSO (bilateral salphingo-oophorectomy). Pada penderita usia muda yang ingin mempertahankan fertilitas, USO (unilateral salphingo-oophorectomy) merupakan pilihan pada tumor stadium I, grade I, diikuti observasi saja karena kelangsungan hidup pada stadium ini di atas 90 %. (NCCN). Pada penderita dengan stadium III atau IV, pada umumnya direkomendasikan operasi sitoreduksi. Kemoterapi neoajuvan dapat dipertimbangkan pada penderita stadium III atau IV dengan bulky disease yang tidak memungkinkan tindakan operasi. Pada keadaan ini diagnosis patologis dapat ditegakkan dengan aspirasi jarum halus atau parasentesis. 2 Penelitian GOG (Gynecologic Oncology Group) menunjukkan pada kanker ovarium stadium lanjut (stadium III dan IV) , kombinasi regimen CAP (cyclophosphamide, adriamycin, cisplatin) memberikan respon yang lebih baik daripada regimen cyclophosphamide dan adriamycin (respon keseluruhan sebesar 51% vs 26%) dan memberikan kelangsungan hidup yang lebih baik (15.7 bulan vs 9.7 bulan).3 Penelitian paclitaxel pada kanker ovarium dimulai pada pengobatan penderita yang mengalami progresivitas dengan terapi cisplatin atau dengan remisi kurang dari 6 bulan dengan respon antara 30 – 40%. Penelitian – penelitian selanjutnya membandingkan respon kemoterapi regimen paclitaxel-platinum dengan regimen tanpa paclitaxel. Regimen paclitaxel menunjukkan keunggulan dalam tingkat respon, remisi komplit, kelangsungan hidup bebas penyakit dan kelangsungan hidup keseluruhan. Pada penelitian GOG, pemberian regimen paclitaxel-cisplatin pada penderita kanker ovarium stadium lanjut dan dengan prognosis buruk memberikan perbaikan kelangsungan hidup selama 14 bulan dibandingkan regimen cyclophosphamide-cisplatin (38 bulan vs 24 bulan). Sejak pertengahan tahun 1990, kombinasi kemoterapi dengan paclitaxel dan platinum telah 3 diterima sebagai standard kemoterapi pada kanker ovarium di Amerika Serikat. Perkembangan selanjutnya adalah penelitian-penelitian yang membandingkan regimen carboplatin-paclitaxel dan cisplatin-paclitaxel. Penelitian GOG 158, AGO (Arbeitsgemeinschaft Gynaekologische Onkologie) dan Netherland-Danish membandingkan kedua regimen tersebut. Hasil penelitian-penelitian tersebut menunjukkan tidak ada perbedaan pada median time to pregression kedua regimen. Penelitian AGO menunjukkan keunggulan regimen carboplatin-paclitaxel dalam hal kualitas hidup dibandingkan cisplatinpaclitaxel. Berdasarkan penelitian-penelitian tersebut, saat ini regimen carboplatin-paclitaxel merupakan regimen terpilih pada kanker ovarium stadium lanjut. 3 Selama tahun 1997 – 2002, kanker ovarium menempati urutan ke 4 sampai ke 7 dari 10 kanker terbanyak di Rumah Sakit Kanker Dharmais .Kanker ovarium merupakan urutan ke 2 terbanyak kanker ginekologi setelah kanker serviks (data dari Bagian Rekam Medis Rumah Sakit Kanker Dharmais).Kanker ovarium merupakan urutan ke 2 terbanyak kanker ginekologis setelah kanker serviks. Pada umumnya penderita datang dalam stadium yang lanjut sehingga memerlukan kemoterapi sistemik setelah terapi primer. II. RUMUSAN MASALAH 1. Bagaimana karakteristik penderita kanker ovarium yang mendapat kemoterapi di RS Kanker Dharmais pada tahun 1997-2002? 2. Bagaimana respon kemoterapi pada penderita-penderita tersebut? III. TUJUAN PENELITIAN 1. Mempelajari karakteristik penderita kanker ovarium yang mendapat kemoterapi di RS Kanker Dharmais pada tahun 1997-2002 2. Mempelajari respon kemoterapi pada penderita-penderita tersebut. IV. KEGUNAAN PENELITIAN Kegunaan ilmiah : Penelitian ini diharapkan dapat menambah bukti ilmiah dan khasanah kepustakaan mengenai respon kemoterapi pada pada penderita kanker ovarium . Kegunaan praktis : Hasil penelitian ini diharapkan dapat menjadi bahan pertimbangan dalam pemberian kemoterapi pada penderita kanker ovarium. V. KERANGKA PEMIKIRAN 1. Patogenesis : Faktor genetiK, hormonal, lingkungan dan diet telah diketahui berperan penting dalam terjadinya kanker ovarium. 3,4 Genetik Kurang dari 10% kasus merupakan kanker ovarium herediter dengan pola klasik dominan autosomal. HBOC (hereditary – breast – ovarian cancer) merupakan kelainan herediter yang paling banyak ditemukan dan merupakan 85-90% kanker ovarium herediter. Sebagian besar tumor berhubungan dengan mutasi lokus BRCA 1. Gen lain yang berperan dalam kerentanan tehadap kanker ovarium dan payudara adalah BRCA 2 pada kromosom 13q12. Wanita dengan mutasi gen BRCA 1 dan riwayat keluarga dengan kanker mempunyai risiko sebesar 90% untuk mendapat kanker payudara dan 65% untuk mendapat kanker ovarium. Hormonal Terdapat hubungan antara hormon dengan terjadinya kanker ovarium.Hormon mempunyai pengaruh tidak langsung yaitu merangsang ovulasi yang selanjutnya akan menimbulkan proliferasi sel epitel ovarium. Wanita dengan paritas rendah atau infertilitas , pemberian obat-obat perangsang ovulasi mempunyai peningkatan risiko terhadap terjadinya kanker ovarium. Lingkungan Paparan terhadap talk (hydrous magnesium trisilicate), radiasi diduga berperan dalam menimgkatkan risiko kanker ovarium, meskipun data yang menunjang hal-hal tersebut masih bertentangan. Diet Diet tinggi lemak hewani dan laktosa (pada penderita dengan defisiensi enzim galactose-L-phospate uridyltransferase) diduga berhubungan dengan risiko kanker ovarium 2. Histopatologi : Kanker ovarium epithelial merupakan 60% neoplasma ovarium dan merupakan 80-90% keganasan ovarium. Neoplasma ovarium yang lain berasal dari germ cell atau stromal cell.3 Klasifikasi histopatologi tumor ovarium ganas menurut WHO 3 : Epithelial tumors Malignant serous tumor Adenocarcinoma, papillary adenocarcinoma, papillary cystadenocarcinoma Surface paplillary carcinoma Malignant adenofibroma, cystadenofibroma Malignant mucinous tumor Adenocarcinoma, cystadenocarcinoma Malignant adenofibroma, cystadenofibroma Malignant endometrioid tumor Carcinoma : Adenocarcinoma, adenoacanthoma, malignant adenofibroma Cystadenofibroma Endometrioid stromal sarcoma Mesodermal (Mullerian) mixed tumor: homologous and heterologous Clear cell (mesonephroid) tumor, malignant Brenner tumor, malignant Mixed epithelial tumor, malignant Undifferentiated carcinoma Unclassified Sex cord-stromal tumors Granulosa - stromal cell tumor Granulosa cell tumor Tumor in the thecoma-fibroma group Fibroma Unclassified Androblastoma : Sertoli- Leydig cell tumor Well differentiated Tubular androblastoma, Sertoli cell tumor (tubular adenoma of Pick) Tubular androblastoma with lipid storage, Sertolli cell tumor sith lipid storage Sertoli-Leydig cell tumor (tubular adenoma with Leydig cells) Leydig cell tumor, hillus cell tumor of intermediate differentiation Poorly differentiated ( sarcomatoid) With heterologous selements Gyandroblastoma Unclassified Germ cell tumor : Dysgerminoma Endodermal sinus tumor Embryonal carcinoma Polyembryoma Lipid (lipoid) cell tumors Choriocarcinoma Teratoma : Immature Mature dermoid cyst with malignant transformation Monodermal and highly specialized : Struma ovarii, carcinoid Struma ovarii and carcinoid Others Mixed forms Gonadoblastoma Pure Mixed with dysgerminoma or other form of germ cell tumor 3. Stadium : Stadium karsinoma ovarium menurut International Federation of Obstetricians Stage Grouping (1988) dapat dilihat pada tabel V.1.3 Gynecologists and Tabel V.1. Stadium karsinoma ovarium (FIGO 1988) Stadium I IA IB IC II Pada 1 ovarium, tidak ada asites, tidak ada tumor pada permukaan luar, kapsul intak Pada kedua ovarium, tidak ada asites, tidak ada tumor pada permukaan luar, kapsul intak Tumor sesuai stadium IA atau IB tetapi dengan tumor pada permukaan luar pada 1 atau kedua ovarium, atau dengan ruptur kapsul atau dengan asites yang mengandung sel- sel ganas atau dengan peritonel washing positip Tumor pada satu/kedua ovarium dengan ekstensi pelvis IIA IIB IIC III Ekstensi dan/atau metastase pada uterus dan/atau tuba Pada satu/kedua ovarium dengan ekstensi pelvis Tumor sesuai stadium IIA atau IIB dengan tumor pada permukaan luar 1 atau kedua ovarium, atau dengan ruptur kapsul atau dengan asites yang mengandung sel-sel ganas atau dengan peritonel washing positip Tumor pada satu atau kedua ovarium dengan penyebaran pada peritoneum di luar pelvis dan/atau kelenjar retroperitoneal atau inguinal positip. Metastase ke hati yang superficial termasuk stadium III. Tumor terbatas pada rongga pelvis, tetapi disertai ekstensi ke usus halus dan omentum IIIA IIIB IIIC IV Deskripsi Tumor terbatas pada ovarium Tumor terbatas pada rongga pelvis , kelenjar getah bening negatip, tetapi adanya penyebaran mikroskopis (terbukti secara histopatologi) pada permukaan peritoneum abdominal Tumor pada satu /kedua ovarium dengan implan pada permukaan peritoneum abdominal (terbukti secara histopatologis), tidak ada yang melebihi diameter 2 cm, tidak ada kelenjar getah bening Implan abdominal dengan diameter > 2 cm dan/atau kelenjar getah bening retroperitoneal/ inguinal positip Tumor pada satu/kedua ovarium dengan metastase jauh. Bila didapatkan efusi pleura, harus disertai pemeriksaan sitologis positip. Metastase pada parenkhim hati termasuk stadium IV 4. Pengelolaan Pengobatan primer pada kecurigaan adanya kanker ovarium.2 : Laparotomi/TAH/BSO dengan staging lengkap atau USO bila penderita menginkan fertilitas. Operasi sitoreduktif pada stadium klinis II, III atau IV Pertimbangkan kemoterapi neoajuvan atau interval cytoreduction pada penderita dengan bulky stadium III/ IV di mana operasi bukan pilihan utama ( diagnosis dengan aspirasi jarum halus atau parasintesis) Setelah dilakukan tindakan operasi, pengelolaan selanjutnya tergantung pathologic staging. Sebagian besar penderita kanker ovarium epithelial akan menerima kemoterapi sistemik postoperatif. Observasi direkomendasikan pada stadium Ia, grade 1 karena tingginya angka kesembuhan. Beberapa kontroversi didapatkan pada stadium I, grade 2, beberapa ahli merekomendasikan untuk observasi saja atau kemoterapi. Pada penderita dengan grade/stadium yang lebih tinggi, direkomendasikan pemberiam kemoterapi sistemik. 2 NCCN (National Comprehensive Cancer Network) tahun 2002 merekomendasikan pengelolaan lanjutan kanker ovarium sebagai berikut : Tabel V. 2. Pengelolaan lanjutan kanker ovarium Pathologic staging Stadium IA atau IB Grade Grade 1 Grade 2 Grade 3 Terapi Observasi Observasi atau paclitaxel/carboplatin 3-6 siklus Paclitaxel/carboplatin 3-6 siklus Stadium IC Grade 1,2, 3 Paclitaxel/carboplatin 3-6 siklus Stadium II Paclitaxel/carboplatin 3-6 siklus Stadium III, IV Paclitaxel/carboplatin atau paclitaxel/cisplatin 6 siklus atau Whole abdominal RT untuk kelainan mikroskopis pada penderita tertentu stadium III atau Kemoterapi intraperitoneal dapat dipertimbangkan pada penderita stadium III dengan low-volume optimally debulked Regimen kemoterapi yang dianjurkan adalah.2 : Carboplatin AUC 5.0-7.5 + paclitaxel 175 mg/m2 selama 3 jam sebanyak 6 siklus untuk stadium III atau IV dan 3-6 siklus untuk stadium I dan II Regimen alternatif : - Cisplatin 75 mg/m3 + paclitaxel 135 mg/m2 selama 24 jam - Docetaxel/carboplatin, AUC 5-6 5. Rekurensi Sebagian besar penderita kanker ovarium akan mengalami rekurensi setelah pengobatan. Dari seluruh penderita yang mendapat pengobatan platinum–based, 50% akan mengalami remisi komplit secara klinis. Lima puluh persen dari penderita tersebut mengalami remisi komplit secara patologik pada second look laparotomi. Pada pemantauan selanjutnya, 50 % dari penderita dengan remisi komplit patologik akan mengalami rekurensi, sehingga kesembuhan hanya didapatkan kira-kira 12% dari seluruh penderita yang diobati . 1,5 Penderita kanker ovarium yang mengalami rekurensi dibagi menjadi 2 golongan , yaitu.1,6 : Platinum-sensitive : penderita dengan rekurensi yang terjadi lebih dari 6 bulan setelah menyelesaikan pengobatan Platinum refractory atau platinum resistant : penderita yang mengalami progresifitas selama pengobatan atau dengan interval bebas penyakit kurang dari 6 bulan. Pilihan kemoterapi lini kedua pada kanker ovarium rekuren menurut NCCN 2 tahun 2002 (National Comprehensive Cancer Network) adalah. : Penderita platinum sensitive : Paclitaxel atau Platinum atau Paclitaxel + Platinum atau regimen rekuren Penderita platinum refractory/resistant : rekuren regimen : Topotecan, Gemcitabine, Etoposide oral, Altretamine, alkylating agent , Vinorelbine, Liposomal doxorubicin, Taxane, Platinum , Tamoxifen, Radiasi. Regimen –regimen yang dapat diberikan pada kanker ovarium rekuren dapat dilihat pada tabel V.3. Tabel V.3. Regimen kemoterapi pada kanker ovarium rekuren . Regimen Paclitaxel Carboplatin Docetaxel Liposomal doxorubicin Oral etoposide Dosis/interval 40-75 mg/m2/minggu IV AUC 5-7.5 setiap 3 minggu 60-75 mg/m2 IV setiap 21 hari 40-50 mg/m2 IV setiap 28 hari 50-100 mg/hari PO, selama 21 hari, tiap 4 minggu Topotecan 1,25-1,5 mg/m2/hari IV (1-5),tiap 21 hari 1,8 mg/m2/hari IV (1-3), tiap 4 minggu 1200-1250 mg/m2 IV (1,8,15) setiap 4 minggu 260 mg/m2 PO (1-14) tiap 28 hari 25-30 mg/m2/minggu IV 2 x 20 mg PO tiap minggu Ifosfamide Gemcitabine Altretamine Vinorelbine Tamoxifen 1,5,7 Respon (%) 21-48 % 21-77 % 19,7 % 26 % 27 % (platinum resistan) 35 % (platinum sensitive) 20 % 12 % 19 % 14 % 20 % 18 % 6. Faktor prognostik Faktor progostik yang menentukan kelangsungan hidup kanker ovarium adalah.3, 8,9 : Faktor tumor :stadium (tumor burden),tipe histologi,grade, ploidi,massa tumor, residual disease, petanda molekular (masih dalam penelitian : petanda proliferasi tumor, growth factor receptor , signal transduction pathway, gen yang berhubungan dengan metastase (nm23-HI), ekspresi onkogen: HER-2/neu, p53, bcl-3, k-ras, Ki67) Faktor host : umur, status performans, residual disease, volume asites Faktor lingkungan : kualitas tenaga kesehatan (gynecologic oncolo-gist), regimen kemoterapi Kelangsungan hidup 5 tahun pada penderita kanker ovarium stadium I (diferensiasi baik dan sedang) lebih dari 90%, 80% pada stadium II, 15-20% pada stadium III dan kurang dari 5% pada stadium IV. 3 Penderita kanker ovarium stadium 3 dengan microscopic residual disease pada awal kemoterapi mempunyai kelangsungan hidup 5 tahun sekitar 40 –75 % dibandingkan 30-40% pada penderita dengan optimal residual disease dan hanya 5 % pada penderita non optimal 9 residual disease. Pada kanker ovarium stadium lanjut, kelangsungan hidup berhubungan dengan derajat operasi sitoreduksi. Pada penelitian retrospektif, penderita tanpa residual disease mempunyai rata-rata kelangsungan hidup 39 bulan dibandingkan dengan 29 bulan (pendeirta dengan residual disease < 0,5 cm), 18 bulan (penderita dengan residual diasease 0,6-1,5 cm) dan 11 bulan (penderita dengan residual disease > 1,5 cm).3 Respon kanker ovarium terhadap kemoterapi ditentukan oleh.8 : Faktor tumor : Pada kanker ovarium stadium lanjut, substage (FIGO III A dan III B vs IIIC dan IV) dan besarnya residual disease (FIGO IIIC dan IV) merupakan faktor yang menentukan respon terhadap kemoterapi lini pertama. Faktor host : Usia dan status performans penderita akan mempengaruhi pilihan dan intensitas regimen kemoterapi. 3,8 Respon kanker ovarium terhadap salvage therapy ditentukan oleh. : Respon terhadap kemoterapi lini pertama : Terdapat 3 kelompok yang berbeda yaitu : Penderita yang tidak berespon terhadap terapi lini pertama Penderita dengan respon partial dan kemudian mengalami progresifitas Penderita dengan remisi lengkap yang mengalami rekuren. Kemoterapi salvage hanya memberikan efektivitas rendah pada dua kelompok pertama. Pada kelompok ketiga, kemoterapi akan lebih efektif sesuai panjangnya interval bebas penyakit. Tipe histology serous, number of disease site (<2) dan ukuran maksimum lesi ( < 5 cm) Platinum –free interval (waktu terjadinya rekuren setelah kemoterapi platinum-based): < 6 bulan vs > 6 bulan VI. BAHAN DAN METODA 1. Rancangan penelitian Penelitian ini merupakan penelitian deskriptif yang bersifat retrospektif 2. Waktu dan tempat penelitian Penelitian dilakukan di Rumah Sakit Kanker Dharmais sejak Mei 2003 – Agustus 2003 3. Sampel Sampel diambil dari data catatan medik penderita kanker ovarium yang berobat ke Rumah Sakit Kanker Dharmais dari tahun 1997- 2002 4. Bahan dan cara kerja Dari catatan medik penderita dicatat: umur, stadium penyakit, tindakan operasi yang dilakukan, histopatologis, jenis , respon dan efek samping hematologis kemoterapi, terjadinya rekuren. Pada kasus yang tidak menjalani kemoterapi, dicatat alasannya. 5. Definisi operasional Kanker ovarium : adalah keganasan yang berasal dari ovarium, dibuktikan dengan pemeriksaan histopatologis Stadium : stadium kanker ovarium ditentukan berdasarkan FIGO 1988 Respon kemoterapi Respon kemoterapi ditentukan berdasarkan definisi WHO.3,10 : CCR (Clinical Complete Remission) : tidak didapatkan adanya kanker secara klinis atau pemeriksaan radiologis (no evidence of disease) disertai kadar CA 125 normal. PR (partial remission) : berkurangnya massa tumor sebesar 50 % setelah pengobatan, tidak adanya pertumbuhan tumor baru, tidak adanya daerah tumor yang mengalami progresifitas. PD (progressive disease) : peningkatan massa tumor > 25 %, adanya lesi baru atau penderita meninggal sebagai akibat tumornya. NA (not available) : respon kemoterapi tidak dapat dinilai karena penderita tidak menyelesaikan kemoterapi 6. Analisis data Data dibuat dalam bentuk persentase dan disajikan dalam bentuk table VII. HASIL PENELITIAN DAN PEMBAHASAN 1. Karakteristik penderita Selama tahun 1997-2002 didapatkan 162 kasus kanker ovarium. Dari 162 kasus tersebut, 60 kasus (37%) menjalani kemoterapi di RSKD dan 102 kasus (63%) tidak menjalani kemoterapi di RSKD . Tiga puluh delapan penderita (23,5%) menjalani operasi di RSKD, sedangkan 124 penderita (76,5%) telah menjalani operasi di luar RSKD. Dari 38 penderita yang di operasi di RSKD, 24 penderita (63,2%) menjalani kemoterapi di RSKD dan 14 penderita (36,8%) tidak menjalani kemoterapi di RSKD. Dari 102 penderita yang di operasi di luar RSKD, 36 penderita ( 29 %) menjalani kemoterapi di RSKD dan 88 penderita ( 71 %) tidak menjalani kemoterapi di RSKD. Alasan penderita yang tidak menjalani kemoterapi di RSKD dapat dilihat pada tabel VII.1. Tabel VII.1. Alasan tidak menjalani kemoterapi di RSKD Alasan Jumlah Tidak ada keterangan Keadaan umum buruk Sudah kemoterapi di luar RSKD Tidak bersedia relaparotomi Tidak bersedia kemoterapi Ingin kemoterapi di luar RSKD Tidak memerlukan kemoterapi Menunggu review PA ( PA dari luar RSKD) Ingin berobat tradisionil Masih berunding Radioterapi n 42 20 10 9 7 6 4 2 2 1 1 % 41,2 19,6 9,8 8,8 6,9 5,9 4,0 1,9 1,9 0,9 0,9 Dari 42 kasus yang tidak ada keterangan mengenai alasan tidak menjalani kemoterapi di RSKD, 14 kasus (33,3%) adalah penderita yang menjalani operasi di RSKD dan 28 kasus (66,7%) telah menjalani operasi di luar RSKD. Data tempat dilakukannya kemoterapi dan operasi dapat dilihat pada tabel VII. 2, dan VII. 3. Tabel VII. 2. Operasi pada penderita yang tidak menjalani kemoterapi di RSKD Operasi RSKD DI luar RSKD Jumlah n 14 88 % 13,7 86,3 Penderita yang tidak menjalani kemoterapi di RSKD. 86,3% telah menjalani operasi di luar RSKD, sedangkan 13,7 % penderita menjalani operasi di RSKD. Tabel VII. 3. Operasi pada penderita yang menjalani kemoterapi di RSKD Operasi RSKD DI luar RSKD Jumlah n 24 36 % 40 60 Penderita yang menjalani kemoterapi di RSKD 60% telah menjalani operasi di luar RSKD, sedangkan 40 % penderita menjalani operasi di RSKD. Dari data–data tersebut, tampak : Dari seluruh penderita kanker ovarium yang berobat ke RSKD, 37% menjalani kemoterapi di RSKD Sebagian besar kasus (76,5%) telah menjalani operasi di luar RSKD Sebagian besar kasus ( 63,2%) yang menjalani operasi di RSKD juga menjalani kemoterapi di RSKD Sebagian besar kasus (71%) yang telah menjalani operasi di luar RSKD, tidak menjalani kemoterapi di RSKD Enam puluh persen penderita yang menjalani kemoterapi di RSKD telah menjalani operasi di luar RSKD 2. Penderita yang menjalani kemoterapi di RSKD Penderita yang menjalani kemoterapi di RSKD berusia rata-rata 42,7 tahun (22 – 75 tahun), hal ini lebih muda dibandingkan kepustakaan yang menyatakan rata-rata penderita kanker ovarium berusia 63 tahun.3 Distribusi jumlah penderita setiap tahun dapat dilihat pada tabel VII.4. Tabel VII.4. Distribusi penderita kanker ovarium yang menjalani kemoterapi tahun 1997- 2002 Tahun Jumlah penderita (n) 11 7 7 14 12 9 60 1997 1998 1999 2000 2001 2002 Jumlah (%) 18,3 16,6 16,6 23,2 20 15,3 100 Dari tabel VII.4 terlihat distribusi penderita yang hampir merata pada setiap tahun. Stadium penyakit pada waktu penderita datang dapat dilihat pada tabel VII.5. Tabel VII.5 Stadium penyakit kanker ovarium Stadium penyakit Jumlah penderita (n) (%) I 15 25,0 II 2 3,3 III 16 26,7 IV 13 21,7 rekuren 14 23,3 60 100 Penderita kanker ovarium stadium dini (I dan II) merupakan 28,3% dan stadium lanjut (III dan IV) dan rekuren merupakan 71,7% penderita . Hal ini tampaknya hampir sama dengan kepustakaan yang menyatakan penderita kanker ovarium stadium dini merupakan 20% penderita.11 dan 75-80% penderita kanker ovarium datang pada stadium lanjut.12 3. Jenis histopatologi tumor ganas ovarium Jenis histopatologi tumor ganas ovarium yang didapatkan adalah sebagai berikut : Epithelial tumors ( 83,3% penderita ), terdiri dari : - Malignant serous tumor : 57,2 % - Malignant mucinous tumor : 22,4 % - Malignant endometrioid tumor : 20,4 % Germ cell tumors (6,7 % penderita), terdiri dari : - Malignant teratoma (25 %) - Mixed germ cell (nephroid) (25 %) - Dysgerminoma (50%) Tidak ada data PA (10% penderita) Tipe epithelial merupakan jenis histopatologis yang paling sering ditemukan (83,3%) .Data di atas sesuai dengan kepustakaan yang menyatakan bahwa sebagian besar kanker ovarium (80 - 90%) adalah tipe epithelial. 3 4. Regimen kemoterapi Kemoterapi yang diberikan terdiri dari : kemoterapi yang diberikan pertama kali : 46 penderita (76,7%) kemoterapi lini kedua : 14 penderita (23,3%) Regimen kemoterapi yang diberikan pertama kali dapat dilihat pada tabel VII.6 Tabel VII.6. Regimen kemoterapi pertama kali Regimen CAP (Cyclophosphamide-Adriamycin-Cisplatin Cyclophosphamide- Cisplatin Paclitaxel –Carboplatin Taxotere - Carboplatin Bleomycin BEP ( Bleomycin-Etoposide-Cisplatin) VAC ( Vincristine-Dactinomycin-Cyclophosphamide) Jumlah penderita n % 24 52,2 9 19,6 8 17,3 1 2,2 1 2,2 2 4,3 1 2,2 Regimen kemoterapi lini kedua yang diberikan dapat dilihat pada tabel VII.7 Tabel VII.7. Regimen kemoterapi lini kedua Regimen CAP (Cyclophosphamide-Adriamycin-Cisplatin Paclitaxel –Carboplatin Cisplatin intraperitoneal -Taxotere Taxotere weekly Jumlah penderita n % 3 21,4 9 64,4 1 7,1 1 7,1 5. Respon kemoterapi Respon kemoterapi yang diberikan dapat dilihat pada tabel VII.8 Tabel VII.8. Respon kemoterapi Stadium I II III IV Rekuren CCR 80 50 75 53,8 50 Respon kemoterapi (%) PR PD 18,7 23,1 23,1 42,8 Ket : CCR : clinical complete response (no evidence of disease) PR : partial respon PD : progressive disease NA : respon tidak dapat dinilai ( tidak menyelesaikan kemoterapi) NA 20 50 6,3 7,2 Respon kemoterapi berdasarkan regimen yang diberikan dapat dilihat pada tabel VII.9, VII.10, VII.11 Tabel VII.9. Respon kemoterapi regimen CAP Stadium n I II III IV Rekuren 4 2 7 11 3 CCR 75 50 85,7 18,2 66,7 Respon kemoterapi (%) PR PD 14,3 27,3 54,5 33,3 NA 25 50 - Tabel VII.10. Respon kemoterapi regimen Cyclophosphamide-Cisplatin Stadium n I II III IV Rekuren 6 2 1 - CCR 100 50 100 - Respon kemoterapi (%) PR PD 50 - NA - Tabel VII. 11. Respon kemoterapi regimen Paclitaxel-Carboplatin Stadium I II III IV Rekuren n 2 3 2 9 CCR 100 66,7 50 55,5 Respon kemoterapi (%) PR PD 33,3 50 44,5 NA - 6. Perbandingan respon kemoterapi pada setiap stadium berdasarkan regimen Perbandingan respon kemoterapi pada setiap stadium berdasarkan regimen dapat dilihat pada tabel VII.12, VII.13, VII.14, VII.15 Tabel VII.12 Respon kemoterapi pada penderita Stadium I Respon CCR PR PD NA CAP (n=4) (%) 75 25 CC (n=6) (%) 100 - Pacli-Carbo (n=2) (%) 100 - Tabel VII.13. Respon kemoterapi pada penderita Stadium II Respon CCR PR PD NA CAP (n=2) (%) 50 50 CC (n=0) (%) - Pacli-Carbo (n=0) (%) - Tabel VII.14. Respon kemoterapi pada penderita Stadium III Respon CAP (n=7) (%) 85,7 14,3 - CCR PR PD NA CC (n=2) (%) 50 50 - Pacli-Carbo (n=3) (%) 66,7 33,3 - Tabel VII.15. Respon kemoterapi pada penderita Stadium IV Respon CAP (n=11) (%) 18,2 27,3 54,5 - CCR PR PD NA CC (n=1) (%) 100 - Pacli-Carbo (n=2) (%) 50 50 - Pada penelitian ini pemberian regimen CAP pada kanker ovarium stadium lanjut memberikan CCR 85,7% (stadium III ) dan CCR 18,2 % , PR 27,3%(stadium IV). Pada penelitian ini, regimen kemoterapi CAP pada kanker ovarium stadium lanjut (stadium III dan IV) memberikan OR sebesar 61,1%. Pada kepustakan, kemoterapi regimen CAP pada kanker ovarium stadium lanjut memberikan OR 51 %. 3 Pada pemelitian ini pemberian regimen CC pada kanker ovarium stadium lanjut memberikan CCR 50 % (stadium III) dan CCR 100 % (stadium IV), dengan OR 75 %. Pada kepustakaan, kemoterapi regimen CC pada kanker ovarium stadium lanjut memberikan CCR 32%. 3 7. Respon kemoterapi pada penderita kanker ovarium rekuren Perbandingan respon kemoterapi pada penderita kanker ovarium rekuren dapat dilihat pada tabel VII. 16 dan VII.17. Tabel VII. 16 Respon kemoterapi pada penderita rekuren Respon CAP (n=3) (%) Pacli-Carbo (n=9) (%) 66,7 33,3 - 55,5 44,5 - CCR PR PD NA Taxotere weekly (n=1) (%) 100 Taxotere weekly/cisp IP(n=1) (%) 100 - Tabel VII.17 Respon kemoterapi pada penderita rekuren berdasarkan waktu terjadinya rekuren Waktu sejak terapi pertama < 6 bulan > 6 bulan Jumlah penderita 7 7 CCR (%) PR (%) PD (%) NA (%) 14,3 85,7 - 71,4 14,3 14,3 - Regimen-regimen kemoterapi yang diberikan pada kasus rekuren berdasarkan waktu terjadinya rekuren adalah : Rekuren < 6 bulan : Pacli-carbo (5 kasus) : 1 CCR, 4 PD Cisplatin IP (1 kasus) : PD Taxotere weekly (1 kasus) : NA Rekuren > 6 bulan : Pacli-carbo (4 kasus) : 4 CR CAP (3 kasus) : 2 CR, 1 PD Pada penderita rekuren ,waktu terjadinya rekurensi setelah kemoterapi pertama menjadi bahan pertimbangan dalam pemilihan regimen kemoterapi yang akan diberikan. Bila rekuren terjadi < 6 bulan setelah pemberian kemoterapi cisplatin base ( cisplatin resisten) maka direkomendasikan pemberian kemoterapi lini kedua antara lain : Topotecan, Gemcitabine, Etoposide oral, Altretamine, Alkylating agent, Vinorelbine, Liposomal doxorubicin, Taxane atau platinum compound.2 Pada penderita yang mengalami rekuren > 6 bulan setelah kemoterapi cisplatin base (cisplatin sensitive) , dapat diberikan kembali regimen cisplatin base. Secara keseluruhan, pada penelitian ini respon kemoterapi pada penderita rekuren cukup baik, CCR 50% (tabel VII.8). Regimen CAP masih memberikan hasil yang baik pada kasus rekuren (CCR 66,7% dari 3 penderita), demikian juga regimen Pacli-Carbo ( 55,5 % dari 9 penderita). Pemberian regimen Pacli-Carboplatin pada 4 penderita rekuren dengan platinum sensitive memberikan CCR 100% .Pada kepustakaan, didapatkan pemberian kemoterapi regimen Paclitaxel-carboplatin pada penderita platinum sensitive memberikan CCR 70% dan PR 20%.3 Pada evaluasi respon kemoterapi berdasarkan waktu terjadinya rekuren, maka tampak perbedaan respon, yaitu CCR 14,3% dari penderita yang mengalami rekuren dalam waktu < 6 bulan (platinum resistant) dan CCR 85,7% penderita yang mengalami rekuren dalam waktu > 6 bulan (platinum sensitive). Berdasarkan kepustakaan, respon kemoterapi lini kedua berdasarkan interval sejak selesai nya kemoterapi pertama dapat dilihat pada tabel VII.18. 13 Tabel VII.18 Respon kemoterapi lini kedua berdasarkan interval sejak selesainya terapi pertama.11 Interval (bulan) Respon (%) 6 10 7-12 29 13 63 > 18 94 Bila dibandingkan dengan data pada tabel tersebut, pada penelitian ini tidak banyak perbedaan hasil antara respon kemoterapi pada penderita dengan rekuren < 6 bulan (10% vs 14,3%) dan respon kemoterapi pada pendeirta dengan rekuren > 6 bulan ( 29-94% vs 85,7%). Pada kasus rekuren, respon terhadap salvage therapy juga ditentukan oleh number of 8 disease site dan ukuran lesi terbesar. Hal tersebut dapat dilihat pada tabel VII.19 dan VII.20 Tabel VII. 19. Respon kemoterapi berdasarkan number of disease site Respon kemoterapi CCR PR PD NA n 6 5 1 Number of disease site < 2 (n=12) > 2 (n=2) % n % 50 1 50 41,7 8,3 1 50 Pada penelitian ini, tidak terdapat perbedaan CCR pada penderita dengan disease site < 2 dan penderita dengan disease site > 2 . Tabel VII.20 Respon kemoterapi berdasarkan ukuran lesi terbesar Respon kemoterapi < 5 cm(n=3) n % 2 66,7 1 33,3 - CCR PR PD NA Ukuran lesi terbesar > 5 cm (n=3) n % 1 33,3 2 66,7 - Tidak ada data (n=8) n % 4 50 1 25 1 25 2 50 Pada penelitan ini, penderita dengan ukuran lesi terbesar < 5 cm, mempunyai CCR yang lebih tinggi (66,7%) dibandingkan penderita dengan ukuran lesi terbesar > 5 cm (CCR 33,3%). 8. Relaps Pada pemantauan selama 6 bulan setelah menjalani kemoterapi lini pertama, 7 penderita (15,2 % ) mengalami relaps, terdiri dari : Stadium III : 3 penderita (18,8 % penderita stadium III), relaps dalam waktu ratarata 5,5 bulan Stadium IV : 4 penderita (30,8 % penderita stadium IV), relaps dalam waktu rata-rata 4,2 bulan Data ke tujuh penderita tersebut dapat dilihat pada tabel VII.21. Tabel VII .21 Penderita yang mengalami relaps setelah kemoterapi Penderita Stadium 1 2 3 4 5 6 7 III III III IV IV IV IV Residu Jenis PA < 0,5 cm > 0,5 cm ? < 0,5 cm < 0,5 cm > 0,5 cm ? Malignant serous Malignant serous Malignant serous Malignant serous Malignant serous Malignant serous Endometrioid Regimen kemoterapi CAP CAP TC CAP CAP Taxotere-C CAP Waktu relaps ( bulan) 6 6 3 5 6 1 4 Pada penderita no 1 dan 2, tidak ada perbedaan ukuran residu , regimen yang diberikan dengan waktu terjadinya relaps. Pada penderita no 7 (stadium IV, residu > 0,5 cm, kemoterapi Taxotere –carbo), terlihat waktu terjadinya relaps yang sangat singkat (1 bulan) dibandingkan penderita pada stadium yang sama dengan residu < 0,5 cm (penderita no 4 dan 5) 9. Data operasi : Data residu berdasarkan tempat dilakukannya operasi dapat dilihat pada tabel VII.22 Tabel VII.22. Data residu berdasarkan tempat menjalani operasi Besarnya residu Residu < 0,5 cm Residu > 0,5 cm Tidak ada data residu RSKD( n=24) n % 15 62,5 9 37,5 - RS di luar RSKD (n=36) n % 2 5,6 4 11,2 30 83,2 Respon kemoterapi berdasarkan besarnya residu dapat dilihat pada tabel VII.23 Tabel VII. 23 Respon kemoterapi berdasarkan besarnya residu Respon kemoterapi CCR PR PD NA < 0,5 cm(n=19) n % 13 68,4 1 5,30 3 15,8 2 10,5 Besarnya residu > 0,5 cm (n=13) Tidak ada data (n=28) n % n % 4 30,8 12 60,6 1 3,60 8 61,5 3 17,9 1 7,70 2 17,9 Optimal debulking didefinisikan sebagai residu tumor < 0,5 cm setelah tindakan operasi.14 Terdapat perbedaan respon kemoterapi pada penderita dengan optimal debulking (CCR 68,4 % ) dan penderita dengan residu > 0,5 cm ( CCR 30,8 %). 10. Efek samping hematologi pemberian kemoterapi Efek samping hematologi obat-obat kemoterapi yang diberikan dapat dilihat pada tabel VII 24, 25 dan 26. Regimen (n) CAP (27) CC (9) TC (17) Taxotere-carbo (1) Taxotere (2) VAC (1) BEP (2) Tabel VII .24. Efek samping anemia Grade 0 (%) 1 (%) 2 (%) 3 (%) 40,8 3,7 18,5 18,5 22,2 11,2 44,4 22,2 23,5 23,5 23,5 23,5 100 0 0 0 100 0 0 0 0 100 0 0 50 50 0 0 4 (%) 18,5 0 6 0 0 0 0 Dari tabel VII.24 terlihat, toksisitas anemia grade 3 dan 4 terbanyak ditemukan pada pemberian regimen CAP (37 %), diikuti regimen TC (24,1%) dan regimen CC (22,2%). Regimen (n) CAP (27) CC (9) TC (17) Taxotere-carbo (1) Taxotere (2) VAC (1) BEP (2) Tabel VII.25 Efek samping lekopeni Grade 0 (%) 1 (%) 2 (%) 3 (%) 44,5 3,7 11,1 22,2 44,2 11,2 11,2 22,2 35,3 5,9 52,9 0 100 0 0 0 100 0 0 0 0 100 0 0 100 0 0 0 4 (%) 18,5 11,2 5,9 0 0 0 0 Dari tabel VII.25 terlihat, toksisitas lekopeni grade 3 dan 4 terbanyak ditemukan pada pemberian regimen CAP (40,7 %), diikuti regimen CC (33,4%) dan regimen TC (5,9%). Regimen (n) CAP (27) CC (9) TC (17) Taxotere-carbo (1) Taxotere (2) VAC (1) BEP (2) Tabel VII. 26 Efek samping trombositopeni Grade 0 (%) 1 (%) 2 (%) 3 (%) 70,4 7,4 0 14,8 78,4 5,9 5,9 5,9 71,5 11,2 11,2 0 100 0 0 0 50 0 0 0 100 0 0 0 100 0 0 0 4 (%) 7,4 11,8 0 0 50 0 0 Dari tabel VII.26 terlihat, toksisitas lekopeni grade 3 dan 4 terbanyak ditemukan pada pemberian regimen Taxotere (50 %), diikuti regimen CAP (22,2%) dan regimen TC (17,7%). Berdasarkan kepustakaan, toksisitas hematologi obat-obat kemoterapi pada kanker ovarium dapat dilihat pada tabel VII.27. 15 : Tabel VII.27. Toksisitas hematologi obat-obat kemoterapi Obat kemoterapi Derajat toksisitas Frekwensi Cisplatin Berat Sering Carboplatin Berat Sering Paclitaxel Berat Kadang-kadang Cyclophosphamide Berat Sering Doxorubicin Berat Sering Doxetacel Sedang Kadang-kadang Gemcitabine Berat Kadang-kadang VIII. KESIMPULAN 1. Selama tahun 1997 – 2002 di RS Kanker Dharmais didapatkan 162 kasus kanker ovarium , 37 % di antaranya menjalani kemoterapi di RS Kanker Dharmais. 2. Penderita kanker ovarium yang menjalani kemoterapi di RS Kanker Dharmais rata-rata berusia 42,7 tahun (22 – 75 tahun) , terdiri dari 28,3 % stadium dini (I dan II), 71,7% stadium lanjut (III dan IV) dan rekuren. Kanker ovarium jenis epithelial merupakan 83,3% kasus. 3. Regimen kemoterapi yang diberikan pertama kali (76,7 % penderita) adalah : CAP, CC, Paclicarbo, Taxotere-carbo, Bleomycin, BEP, VAC 4. Regimen kemoterapi yang diberikan sebagai lini kedua (23,3 % penderita) adalah : CAP, Pacli-carbo, Cisplatin IP-Taxotere, Taxotere. 5. Respon kemoterapi pada penderita stadium I : 80 % CCR, 20 % NA 6. Respon kemoterapi pada penderita stadium II : 50 % CCR, 50 % NA 7. Respon kemoterapi pada penderita stadium III : 75 % CCR, 18,7 % PD 8. Respon kemoterapi pada penderita stadium IV : 53,8 % CCR, 23,1 % PR, 23,1 % PD 9. Respon kemoterapi pada penderita rekuren : 50 % CCR (14,2 % pada penderita platinum resistant dan 85,7% pada penderita platinum sensitive), 42,8 % PD, 7,2 % NA. 10. Pada pemantauan selama 6 bulan setelah menjalani kemoterapi lini pertama, 15,2% penderita mengalami relaps. 11. Penderita dengan residu tumor < 0,5 cm memberikan CCR lebih baik dbandingkan dengan penderita dengan residu tumor > 0,5 cm (68,4% vs 30,8 %) IX. DAFTAR PUSTAKA 1. Salom E, Almeida Z, Mirhashemi R. Management of Recurrent ovarian Cancer : Evidence – based Decisions. Current Opinion in Oncology 2002 ; 14: 519-527. 2. NCCN (National Comprehensive Cancer Network). Ovarian Cancer, Practice Guidelines in Oncology-v.1.2002 3. Ozols RF, Schwarts PE, Eifel PJ. Ovarian Cancer, Fallopian Tube Carcinoma, and Peritoneal Carcinoma. In : In : DeVita,JR.VT, Hellman S, Rosenberg SA.eds. Cancer: Principles and Practice of Oncology, 6th ed.Philadelphia : Lippincott-Raven. 2001: p 15971632. 4. Rubin SC, Sabbatini P, Randall ME. Ovarian Cancer. In : Pazdur R, Coia AR, Hoskins WJ, Wagman LD. Eds .Cancer Management : A Multidisciplinary Approach Medical, Surgical and Radiation Oncology . Melville NY : PRR. 2001 : p 409 – 428. 5. Armstrong DK. Relapsed Ovarian Cancer : Challenges and Management Strategies for a Chronic Disease. The Oncologist 2002 ;7, Suppl 5 : 20-28. 6. Markman M, Bookman MA. Second-Line Treatment of Ovarian Cancer. The Oncologist 2002 ; 5: 26-35. 7. Medscape 2003. Second –line Therapy for Ovarian Cancer. 8. Pecorelli S, Zigliani L, Odicino FE. Cancer of the Ovary and Fallopian Tube. In : Gospodarowicz MK, Henson DE, Hutter RVP, O’Sullivan B, Sobin LH, Wittekind Ch. Eds. UICC Prognostic Factors in Cancer. 2nd Ed. New York : Wiley-Liss, 2001 : 531-550. 9. Berek JS. Epithelial Ovarian Cancer. In : Berek JS, Hacker NF. Eds. Practical Gynecologic Oncology. 3rd Ed. Philadelphia : Lippincott Williams and Wilkins. 2000 : 457-507. 10. Lowitz BB, Casciato DA. Principles of Medical Oncology and Cancer Biology. In : Casciato DA, Lowitz BB. Eds. Manual of Clinical Oncology, 4 th Ed. Philadelphia : Lippincott Williams and Wilkins.2000 :9. 11. Mc Guire III WP. Epithelial Ovarian Cancer. ASCO 2000 Educational Book .p : 541-545. 12. Schink JC. Current Initial Therapy of Stage III and IV Ovarian Cancer : Challenges for Managed Care. Semin Oncol 1999 ;26 (suppl 1 ) : 2-7. 13. Alberts DS. Treatment of Refractory and Recurrent Ovarian Cancer. Semin Oncol 1999 ;26 (suppl 1 ) : 8-14. 14. Vergote I. The Role of Surgery in the primary Management of Advanced Ovarian Cancer. ASCO 2003 Educational Book, p : 390-396. 15. Fish LS, Lewis BE. Quality of Life Issues in the Management of Ovarian Cancer. Semin Oncol 1999 ;26 (suppl 1 ) :32-29.